-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prenylované fenoly s cytotoxickou a antiproliferativní aktivitou izolované z Morus alba
Prenylated phenols with cytotoxic and antiproliferative activity isolated from Morus alba
This review deals with cytotoxic and antiproliferative activity of fifty seven prenylated phenols isolated from Morus alba. Prenyl side chain, which can be variously modified, increases lipophilicity of the substances, thereby improving their penetration through biological membranes and thus results in an increased bioavailability. The objective was to describe the relationship between structure of the prenylated phenols and their cytotoxic effect and to clarify various mechanisms by which cytotoxic prenylated phenols induce apoptosis. The conclusions showed that the cytotoxicity of the substances increases with increasing number of the prenyl side chains and ketal groups. Conversely, modification of the prenyl side chain, such as hydroxylation, reduces cytotoxicity. The cytotoxic activity is also influenced by the presence of prenyl and hydroxyl groups at specific positions.
Keywords:
<i>Morus alba</i> – prenylated phenols – antiproliferative activity – cytotoxicity
Autori: Nikol Prausová; Peter Kollár
Vyšlo v časopise: Čes. slov. Farm., 2019; 68, 48-68
Kategória: Přehledy a odborná sdělení
Súhrn
Tento přehledový příspěvek se zabývá cytotoxickou a antiproliferativní aktivitou 57 prenylovaných fenolů izolovaných z Morus alba. Prenylovaný postranní řetězec, který může být různě modifikován, zvyšuje lipofilitu látek, čímž zlepšuje jejich prostupnost biologickými membránami a vede tak ke zvýšení biologické dostupnosti. Cílem byla snaha popsat vztah mezi strukturou prenylovaných fenolů a jejich cytotoxickým účinkem a objasnit různé mechanismy, kterými cytotoxické prenylované fenoly indukují apoptosu. Závěry ukázaly, že se cytotoxicita látek zvyšuje s rostoucím počtem prenylovaných postranních řetězců a ketalových skupin. Modifikace prenylovaného postranního řetězce, jako je například hydroxylace, cytotoxicitu naopak snižuje. Cytotoxickou aktivitu ovlivňuje také přítomnost prenylových a hydroxylových skupin ve specifických polohách.
Klíčová slova:
<i>Morus alba</i> – prenylované fenoly – antiproliferativní aktivita – cytotoxicita
Úvod
Nádorová onemocnění jsou po kardiovaskulárních chorobách druhou nejčastější příčinou úmrtnosti v České republice a jejich incidence celosvětově stále roste. Naopak míra úmrtnosti klesá, za což je zodpovědná zvyšující se kvalita lékařské péče, časná diagnostika nádorových onemocnění a dostupnost nových diagnostických a terapeutických prostředků.
Nevýhodu chemoterapie představuje nedostatek její selektivity a toxicita. Poměrně často také dochází ke snížení účinnosti chemoterapie vznikem rezistence, což má za následek selhání léčby. Tyto zmiňované důvody jsou tedy podnětem pro hledání nových látek, které by účinkovaly selektivně a vykazovaly tak minimální cytotoxicitu vůči nenádorovým buňkám.
V léčbě nádorových onemocnění hrají nezastupitelnou roli látky přírodního původu, jako jsou například Vinca alkaloidy, taxany či deriváty podofylotoxinu a kamptotecinu. V současné době roste zájem o prenylované fenolické sloučeniny, který je zapříčiněný silnou nehydrolyzovatelnou substitucí fenolického systému prenylovými skupinami. Prenylovaný postranní řetězec zvyšuje lipofilitu látky, zlepšuje tak její prostupnost skrze buněčné stěny a navíc přispívá k cytotoxické aktivitě. Moraceae je jednou z nejbohatších čeledí na prenylované flavonoidy, a proto byl ke studiu prenylovaných fenolů s cytotoxickou a antiproliferativní aktivitou vybrán právě morušovník bílý.
Cílem práce je vyhledat v dostupné literatuře prenylované fenoly s cytotoxickou a antiproliferativní aktivitou izolované z Morus alba a následně popsat a vyhodnotit souvislosti mezi strukturou těchto látek a jejich účinkem.
Morus alba L.
Morus alba původem pochází z Číny a také je hojně pěstována v Koreji a Japonsku. Listí moruše představuje primární stravu pro bource morušového (Bombyx mori L.), který podporuje hedvábnický průmysl již celá staletí1). Antické Řecko moruším připisovalo narkotické a antitoxické účinky. Ve střední Asii plody moruší sušili a mleli na sladkou mouku. Dobře usušené jsou totiž trvanlivé a mohou nahrazovat cukr2). Vejčitě válcovitá plodenství jsou vhodná zejména k výrobě marmelád, zmrzlin, octů, šťáv nebo vín3). Z bílých plodů se rovněž připravuje mošt medové chuti2).
Plody jsou bohaté na vitamin C a obsahují celou řadu minerálů – železo, vápník, fosfor, draslík nebo hořčík4). Uplatňují se v léčbě slabosti, závrati, tinnitu, únavy, anemie, flatulence a inkontinence5). Listům moruše se připisuje antioxidační, antimikrobiální, cytotoxický, antidiabetický, antihyperlipidemický, antiaterosklerotický, antiobezitní a kardioprotektivní účinek. Kořenová kůra vykazuje antimikrobiální, cytotoxické, protizánětlivé a antihyperlipidemické vlastnosti1). Mezi další účinky kořenové kůry se řadí účinek antibakteriální, antioxidační, hypoglykemický, neuroprotektivní, antiulcerózní a analgetický6).
Tradiční čínská medicína používá listy, plody a kůru moruše k léčbě horečky, ochraně poškození jater, zlepšení zraku, posílení kloubů nebo ke snížení krevního tlaku1). Dále využívá i kořenové kůry k terapii kašle a astmatu7).
Obsahové látky
Různé rostlinné části obsahují různé látky v rozlišném množství, a proto se liší i svými farmakologickými účinky. V listech jsou obsaženy flavonoidy (rutin, kvercetin, isokvercetin, moracetin, astragalin), triterpeny (lupeol), steroly (β-sitosterol), kumariny, alkaloidy, organické kyseliny a aminokyseliny. Ve větvích moruše byly objeveny flavonoidy (mulberrin, cyklomulberrin, morusin, kempferol) a fenolické látky (resveratrol). Plody zase disponují anthokyany (cyanidin), flavonoidy (kvercetin, kempferol) a tokoferoly. V kořenech byly nalezeny též flavonoidy (morusin, morusinol), alkaloidy (kalystegin) a stilbeny (oxyresveratrol)4).
Prenylované fenoly
Prenylované fenolické látky se objevují v čeledích Paulowniaceae (Paulownia spp.), Leguminosae (Sophora spp.), Guttiferae (Garcinia spp.), Rutaceae (Neoreaputia spp.), Cannabaceae (Cannabis a Humulus spp.) a Moraceae (Morus, Maclura, Artocarpus spp.). Prenylované fenoly zahrnují několik kategorií, přičemž je vždy nutná přítomnost společného fenolického hydroxylu na skeletu rozdílného biosyntetického původu substituovaného prenylovou skupinou. Jedná se o flavonoidy, chalkony, xanthony, stilbeny, kumariny, chinony, ftalidy, aromatické organické kyseliny a acylfloroglucinoly. Široká biologická aktivita je modifikována charakterem skeletu látky i substitucí prenylu8).
Prenyl (3-methyl-2-buten-1-yl) nebo isoprenyl je terpenoidní postranní řetězec, jenž se často vyskytuje v jedné nebo více specifických polohách fenolického skeletu přes atom uhlíku (C-) nebo kyslíku (O-) či přes oba9). Jinou možnost připojení tvoří cyklizace se sousedním hydroxylem za vzniku 2,2-dimethyl-pyranu nebo furanu8).
Největší zájem o tento typ sloučenin zapříčiňuje silná, nehydrolyzovatelná C-substituce fenolického systému prenylovými skupinami, které obecně zvyšují lipofilitu a udělují molekule silnou afinitu k biologickým membránám. Jinými slovy, prenylová část působí jako transportér fenolické látky skrze buněčné stěny a dokonce přispívá k biologické aktivitě vykazované celou molekulou, což se ukázalo v nedávných studiích vztahů mezi strukturou a účinkem. Kombinace prenylové skupiny s fenolickým skeletem může tedy poskytovat sérii nových zajímavých biologických aktivit, jak je již prokázáno u mnoha izolovaných bioaktivních terpenoidů a fenolů9).
Tab. 4. Diels-Alderovy adukty chalkonu a dehydroprenyl-2-arylbenzofuranu 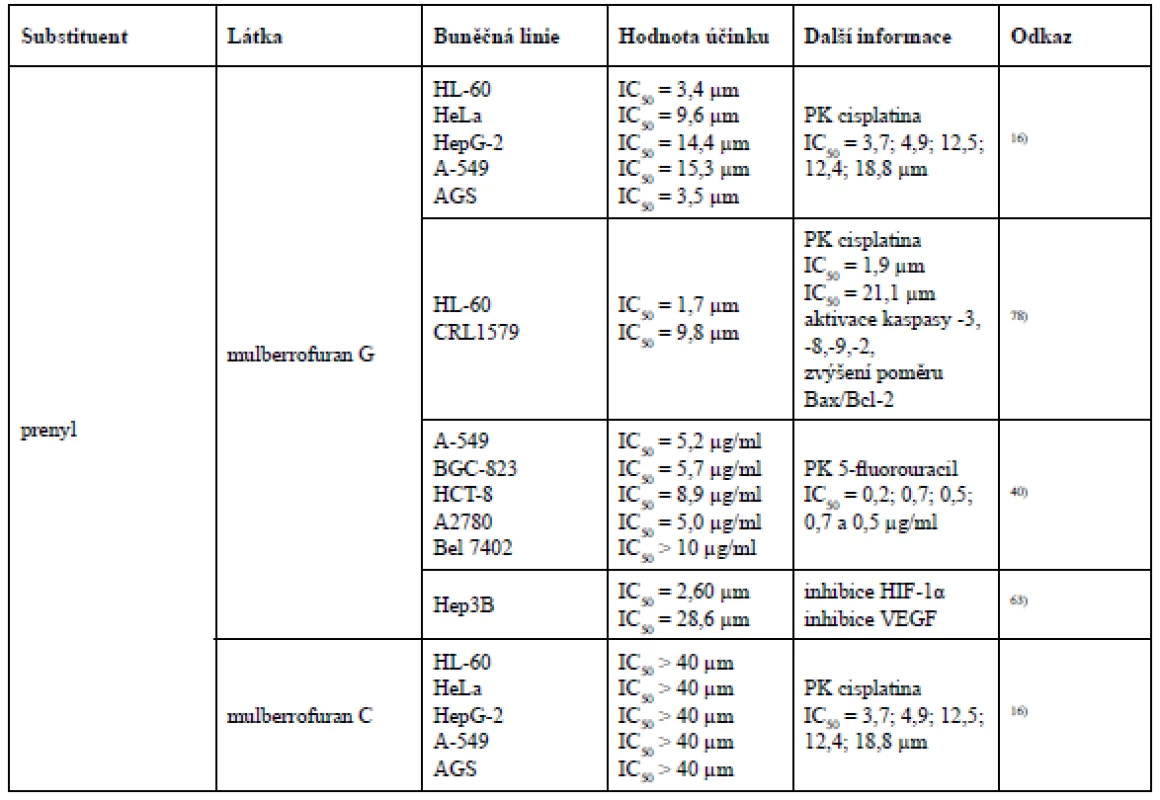
Tab. 5. Diels-Alderovy adukty chalkonu a dehydroprenylstilbenu 
Prenylované flavonoidy
Podskupinu flavonoidů tvoří prenylované flavonoidy, které slučují flavonoidní skelet s lipofilním prenylovaným postranním řetězcem. Do roku 2005 bylo objeveno 37 rodů obsahujících prenylované flavonoidy. Dle současné literatury se nejvíce těchto látek nachází v čeledi Moraceae. V rostlinné říši jsou tyto látky pokládány za fytoalexiny, které hrají důležitou úlohu ve fyziologických procesech obrany proti patogenním mikroorganismům10).
Obecně je C-prenylace více známá než O-prenylace. C-prenylace se objevuje v poloze C-6 nebo C-8 A-kruhu nebo v poloze C-3´a C-5´ B-kruhu, což se obvykle nachází v ortho poloze hydroxylové skupiny. C-prenylace na C-kruhu nastává vzácně. Prenylovaných postranních řetězců existuje celá řada, nejčastěji se však jedná o vzorec 3,3-dimethylallyl. Flavonoidy s geranylovou nebo farnesylovou skupinou se též objevují mezi přírodními prenylovanými flavonoidy. Oxidace, cyklizace, dehydratace či redukce prenylovaného postranního řetězce vedou ke vzniku různých modifikací terpenoidního řetězce10).
Diels-Alderový typ flavonoidů vzniká enzymatickou reakcí dehydroprenylu (dien) s α,β-dvojnou vazbou chalkonu (dienofil)11). Konkrétně se jedná o intermolekulární [4+2] cykloadici12). Tyto sekundární metabolity se nalézají hlavně v čeledích Moraceae a Zingiberaceae a vykazují slibnou biologickou aktivitu využitelnou při hypertenzi, HIV, tuberkulóze, zánětu a nádorech13). Doposud bylo z čeledi Moraceae izolováno okolo 80 Diels-Alderových aduktů12).
Diskuze
V práci jsou popsány a hodnoceny cytotoxické a antiproliferativní účinky prenylovaných fenolů izolovaných z moruše bílé. Z celkového souboru 113 prenylovaných fenolů tvořily největší část hodnocených látek prenylované flavony, dále v sestupném pořadí prenylované flavanony, Diels-Alderovy adukty chalkonu a dehydroprenyl-2-arylbenzofuranu, prenylované chalkony a nakonec prenylované stilbeny. Cytotoxickou aktivitu vykázalo 57 látek, přičemž kořenová kůra moruše bílé představuje hlavní zdroj prenylovaných fenolů a také je poměrně velké množství těchto látek zastoupeno v listech stromu Morus alba.
Moraceae je jednou z nejbohatších čeledí na prenylované flavonoidy10). Prenylovaný postranní řetězec, který může být různě modifikován, zvyšuje lipofilitu látek, čímž zlepšuje jejich prostupnost biologickými membránami a vede tak ke zvýšení biologické dostupnosti9).
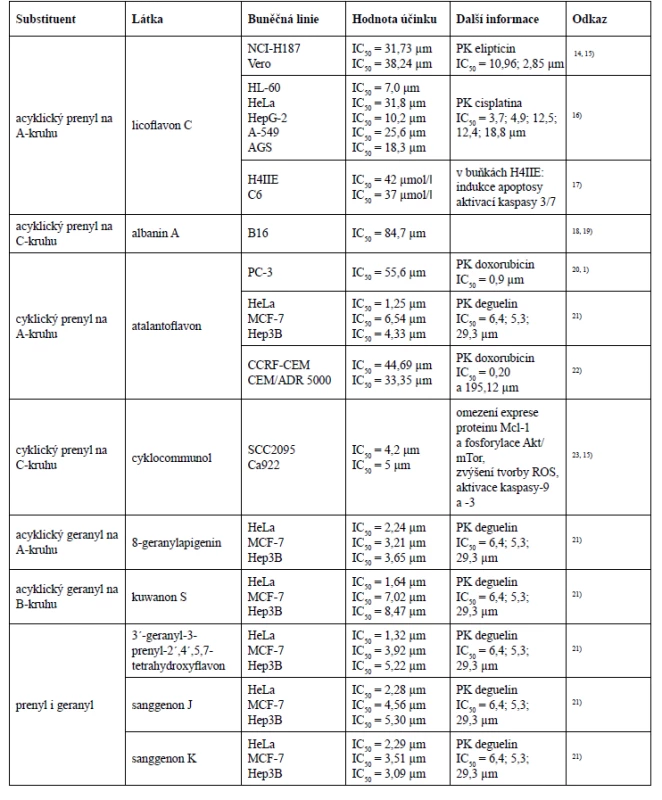
Prenylovaný postranní řetězec v mnohých případech zlepšuje i biologickou aktivitu, což bylo prokázáno studií na buněčné linii melanomu B16, kde cytotoxická aktivita rostla se vzrůstajícím počtem prenylových skupin18). Nejsilnější cytotoxický účinek vykázaly látky obsahující ve své struktuře dva prenylované postranní řetězce, ke kterým patřily cudraflavon C, cudraflavon B a kuwanon C.
Podíváme-li se detailněji na struktury těchto tří látek, můžeme konstatovat, že cytotoxickou aktivitu ovlivňují i hydroxylové skupiny ve specifických polohách. Cudraflavon C s nejnižší hodnotou inhibiční koncentrace (IC50 = 9,2 µm) má acyklické prenylové skupiny navázány v polohách C-3 a C-6. Cudraflavon B také obsahuje prenylové skupiny v polohách C-3 a C-6, avšak v poloze C-6 došlo k cyklizaci prenylu se sousední hydroxylovou skupinou, což je pravděpodobně důvodem nižší cytotoxické aktivity cudraflavonu B (IC50 = 12,5 µm) v porovnání s cytotoxickou aktivitou cudraflavonu C. Kuwanon C vykázal z těchto tří látek nejvyšší hodnotu inhibiční koncentrace (IC50 = 14,2 µm), což bude s největší pravděpodobností způsobeno substitucí acyklickými prenylovými skupinami v polohách C-3 a C-8.
V této studii byl také testován albanin A, který obsahuje jeden acyklický prenylovaný řetězec v poloze C-3. Hodnota inhibiční koncentrace albaninu A (IC50 = 84,7 µm) se již velmi výrazně lišila od hodnot inhibičních koncentrací diprenylovaných flavonů. Tato studie také naznačuje, že látka obsahující acyklickou prenylovou skupinu v poloze C-6 vykazuje mnohem silnější cytotoxicitu než látka s acyklickou prenylovou skupinou v poloze C-3.
Lze tedy říci, že v případě diprenylovaných flavonů byla nejefektivnější substituce acyklických prenylových skupin v polohách C-3 a C-6, dále efektivita klesala cyklizací jednoho z prenylu se sousedním hydroxylem a nejméně efektivní se zdála být substituce acyklických prenylových skupin v polohách C-3 a C-818).
Další studie, která podporuje tvrzení, že prenylovaný postranní řetězec zvyšuje cytotoxický účinek, porovnává cytotoxickou aktivitu 8-prenylapigeninu a apigeninu u nádorové buněčné linie myšího hepatomu H4IIE a myšího gliomu C6, kde hodnota inhibiční koncentrace apigeninu nebyla na rozdíl od 8-prenylapigeninu vůbec stanovena17). Ke stejnému závěru došel Ferlinahayati et al., kdy C-8 prenylovaný euchrenon a7 vykázal na buňkách myší lymfocytické leukemie P388 vyšší cytotoxicitu než norartocarpanon, který přítomnost prenylovaného postranního řetězce postrádá53).
Vliv geranylovaného postranního řetězce na cytotoxickou aktivitu uvádí ve své studii i Šmejkal et al. Ukázalo se, že flavanony s geranylovou skupinou v poloze C-6 vykazovaly vyšší cytotoxicitu než flavanony obsahující geranyl v poloze C-3´, mezi které patří například kuwanon E nebo kuwanon U. Kromě toho hydroxylace geranylovaného postranního řetězce cytotoxicitu snižuje, stejně jako přítomnost hydroxylové skupiny v poloze C-384).
Nejširší paletu cytotoxických aktivit vykázal jednoznačně morusin, jehož struktura obsahuje prenylovou skupinu v poloze C-8, která podlehla cyklizaci s hydroxylovou skupinou v poloze C-7, a další acyklickou prenylovou skupinu v poloze C-3. U morusinu byly rovněž provedeny tři studie in vivo, v nichž tato látka dokázala snížit plicní kolonizaci buněk hepatocelulárního karcinomu SK-Hep1 u imunodeficietního kmenu myší druhu Nude mice a potlačit růst epiteliálního ovariálního karcinomu a glioblastomu24, 27, 33). Studie in vivo byla provedena i u sanggenonu C ze skupiny prenylovaných flavanonů, kde na myším xenograftovém modelu potlačil růst karcinomu tlustého střeva a zvýšil apoptosu buněk tohoto nádoru59). Chalkomoracin je jediným zástupcem Diels-Alderových aduktů chalkonu a dehydroprenyl-2-arylbenzofuranu, který byl prozatím testován in vivo. Na myším xenograftovém modelu prokázal inhibiční účinek na růst karcinomu prsu buněčné linie MDA-MB-23180).
O selektivitě lze v případě prenylovaných flavonů hovořit u cudraflavonu B a cudraflavonu C. Cudraflavon B účinně zastavoval buněčný cyklus lidské monocytární buněčné linie THP-1 ve fázi G1, avšak distribuce nenádorové buněčné linie BPH-1 izolované z benigní hyperplazie prostaty zůstala ve všech fázích buněčného cyklu nezměněna, a to i po vystavení vysokým koncentracím cudraflavonu B37). Silný cytotoxický účinek vykázal cudraflavon B u dvou nádorových buněčných linií skvamózního orálního karcinomu HN4 a HN12, avšak vůči nenádorovým lidským orálním keratinocytům cytotoxicitu ve stejné koncentraci neprojevil38). Cudraflavon C by mohl představovat vhodnou molekulu pro studium léčby maligního melanomu A375.S2, protože indukuje apoptosu jeho buněk a zároveň není cytotoxický vůči lidským fibroblastům a keratinocytům44). Soo et al. zaznamenal selektivní inhibiční účinek cudraflavonu C na proliferaci buněk kolorektálního karcinomu KM12, Caco-2, HT-29, HCC2998, SW48 a HCT116, nicméně proliferaci epiteliálních kolorektálních buněk CCD CoN 841 cudraflavon C neinhiboval46).
Určitá selektivní aktivita byla zjištěna u pěti prenylovaných flavanonů sanggenonu A, B, C, D a O, které prokázaly vyšší cytotoxicitu vůči lidským orálním nádorovým buněčným liniím (HSC-2 a HSG) než vůči nenádorovým lidským gingiválním fibroblastům (HGF)62).
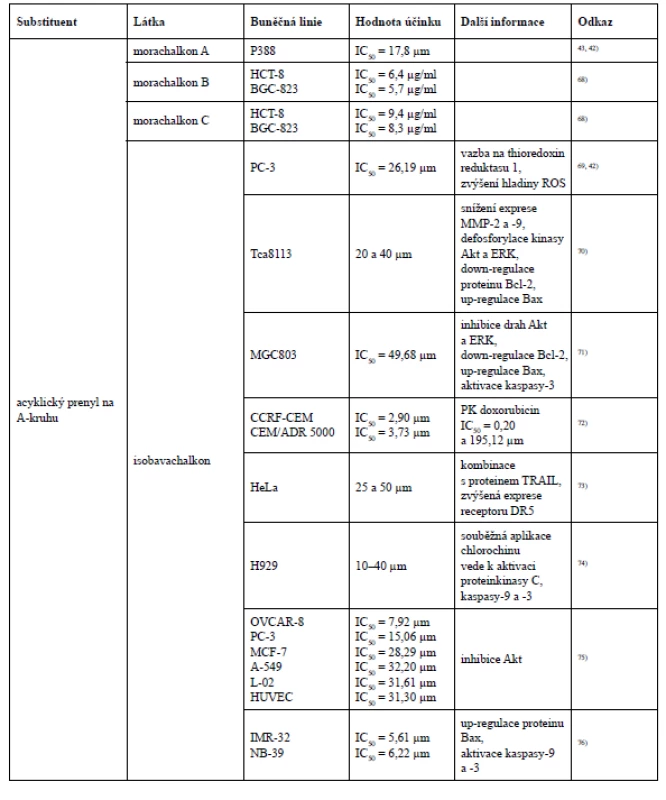
Isobavachalkon projevil selektivní účinek hned ve dvou studiích. Nejprve byl potvrzen jeho antiproliferativní účinek u čtyř nádorových buněčných linií OVCAR-8, PC-3, MCF-7 a A-549 (ovariální karcinom, karcinom prostaty, karcinom prsu a karcinom plic) a u dvou nenádorových buněčných linií L-02, HUVEC (jaterní buňky a lidské endoteliální buňky pupečníkové vény). Nicméně silnější antiproliferativní aktivita byla prokázána u nádorových buněčných linií OVCAR-8 a PC-3 (IC50 = 7,92 a 15,06 µm), a to z toho důvodu, že tyto dvě nádorové buněčné linie vykazují nadměrnou aktivaci endogenní proteinkinasy B (Akt), kterou isobavachalkon účinně inhibuje75). Velmi silný cytotoxický účinek isobavachalkonu byl pozorován u dvou nádorových buněčných linií lidského neuroblastomu IMR-32 a NB-39 (IC50 = 5,61 a 6,22 µm), avšak vůči nenádorovým cerebelárním granulárním buňkám cytotoxicky nepůsobil (IC50 > 100 µm)76).
Ze studie zkoumající cytotoxicitu desíti prenylovaných flavonů vůči třem nádorovým buněčným liniím HeLa, MCF-7 a Hep3B lze vyhodnotit jako nejefektivnější 3´-geranyl-3-prenyl-2´,4´,5,7-tetrahydroxyflavon, 8-geranylapigenin a sanggenon K. Všechny tyto tři látky obsahují geranylovaný postranní řetězec, přičemž
3´-geranyl-3-prenyl-2´,4´,5,7-tetrahydroxyflavon a sanggenon K mají ve své struktuře navázanou i prenylovou skupinu v poloze C-3. Znovu se zde potvrzuje teorie, že substituce geranylovou skupinou v poloze C-8 (8-geranylapigenin) vykazuje vyšší cytotoxicitu vůči nádorovým buněčným liniím MCF-7 a Hep3B, než substituce geranylem v poloze C-3´ (kuwanon S). Rozdíl mezi 3´-geranyl-3-prenyl-2´,4´,5,7-tetrahydroxyflavonem a sanggenonem K je v modifikaci geranylové skupiny v poloze C-3´. V případě 3´-geranyl-3-prenyl-2´,4´,5,7-tetrahydroxyflavonu je tento geranyl acyklický, avšak sanggenon K má ve své struktuře geranyl cyklický. I zde může být cyklický geranyl příčinou nižší cytotoxické aktivity vůči nádorové buněčné linii HeLa, nicméně vůči nádorovým buněčným liniím MCF-7 a Hep3B vykázal lepší cytotoxicitu právě sanggenon K obsahující geranyl cyklický. Sanggenon K i sanggenon J obsahují geranylovou skupinu v poloze C-3´, přesto vyšší cytotoxicitu vykazuje sanggenon K, u kterého dochází k cyklizaci geranylu s hydroxylovou skupinou v poloze C-2´ na rozdíl od sanggenonu J, který podléhá cyklizaci s hydroxylem v poloze C-4´. U morusinu, cyklomorusinu a cyklomulberrinu lze konstatovat, že nižší cytotoxická aktivita morusinu a cyklomorusinu vůči MCF-7 a Hep3B může být způsobena cyklizací prenylové skupiny v poloze C-8 se sousedním hydroxylem v poloze C-7, kdežto u cyklomulberrinu k této cyklizaci nedochází21).Qin et al. se zabýval cytotoxickou aktivitou Diels-Alderových aduktů chalkonu a dehydroprenyl-2-arylbenzofuranu, prenylovaných flavanonů a prenylovaných flavonů u nádorových buněčných linií HL-60 (lidská myeloidní leukemie), HeLa (lidský cervikální adenokarcinom), HepG-2 (lidský hepatocelulární karcinom), A-549 (lidský nemalobuněčný karcinom plic) a AGS (lidský adenokarcinom žaludku). Z Diels-Alderových aduktů chalkonu a dehydroprenyl-2-arylbenzofuranu byla určena cytotoxická aktivita pouze u mulberrofuranu G a mongolicinu C. Mulberrofuran G však vykázal vyšší cytotoxický účinek vůči všem pěti nádorovým buněčným liniím, což může být způsobeno přítomností ketalových skupin, kterých mulberrofuran G obsahuje více než mongolicin C. Geranylovaný flavanon sanggenol L vykázal ze všech testovaných látek nejnižší hodnotu inhibiční koncentrace u buněčné linie nemalobuněčného karcinomu plic. Z chemických struktur 3´-geranyl-3-prenyl-2´,4´,5,7-tetrahydroxyflavonu, morusinu a morusinolu vyplývá již výše uváděný fakt, že cyklizací prenylovaného postranního řetězce klesá cytotoxická aktivita. Morusin a morusinol jsou diprenylované flavony lišící se modifikací prenylu v poloze C-3. Morusin má ve své struktuře navázaný acyklický prenyl v poloze C-3, ale morusinol obsahuje v poloze C-3 prenyl cyklický, a právě proto morusin vykazuje vyšší cytotoxickou aktivitu. Naopak 3´-geranyl-3-prenyl-2´,4´,5,7-tetrahydroxyflavon vykazuje vyšší cytotoxicitu než morusin, protože je jeho prenylovaný i geranylovaný řetězec acyklický. Pozoruhodné je, že licoflavon C prokázal nejvyšší cytotoxicitu ze všech testovaných prenylovaných flavonů u nádorových buněčných linií HL-60 (IC50 = 7,0 ± 1,3 µm) a HepG-2 (IC50 = 10,2 ± 0,9 µm), a to i přesto, že ve své struktuře obsahuje pouze jeden acyklický prenylovaný postranní řetězec v poloze C-816).
Licoflavon C a cudraflavon B byly testovány vůči nádorovým buněčným liniím KB (lidský orální karcinom), MCF-7 (karcinom prsu) a NCI-H187 (karcinom plic) a vůči nenádorové buněčné linii Vero (ledvinné fibroblasty získané z afrického kočkodana zeleného). Diprenylovaný cudraflavon B vykázal cytotoxicitu u všech testovaných buněčných linií, zatímco licoflavon C obsahující jednu prenylovou skupinu vykázal cytotoxicitu pouze u buněk karcinomu plic a Vero. To na první pohled působí, že dva prenylované postranní řetězce cudraflavonu B zlepšují jeho cytotoxickou aktivitu. Když však porovnáme jejich jednotlivé hodnoty inhibičních koncentrací, zjistíme, že u licoflavonu C byla naměřena nižší hodnota inhibiční koncentrace vůči buňkám karcinomu plic než u cudraflavonu B a zároveň licoflavon C prokázal žádoucí nižší cytotoxicitu vůči nenádorovým buňkám Vero14).
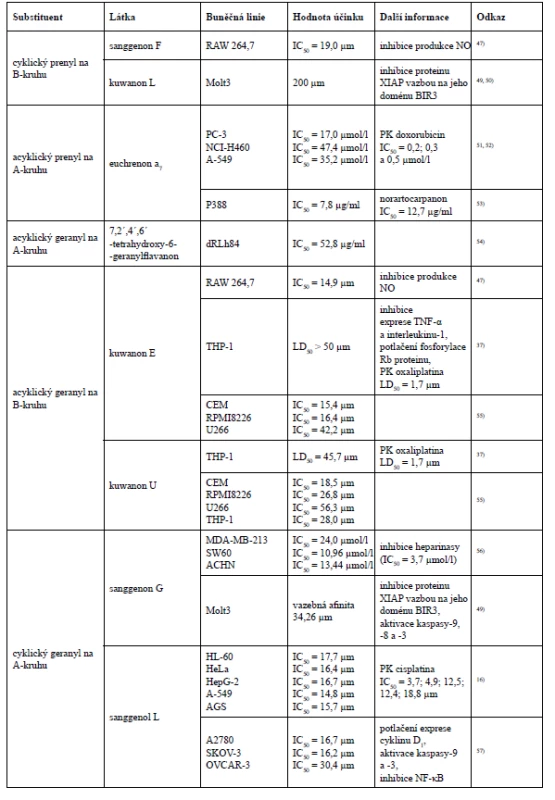
Existují však i další studie, ve kterých neplatí tvrzení, že cyklizace prenylové skupiny se sousední hydroxylovou skupinou snižuje cytotoxickou aktivitu, například při testování morusinu a kuwanonu C na buňkách myší lymfocytické leukemie P388. Přestože morusin ve své struktuře obsahuje jeden acyklický a jeden cyklický prenylovaný řetězec, vykázal vyšší cytotoxickou aktivitu než kuwanon C, který má ve své struktuře navázány dva acyklické prenyly ve stejných polohách jako morusin. Dále byl testům cytotoxicity podroben i prenylovaný chalkon morachalkon A, který ze všech tří testovaných látek vykázal nejnižší cytotoxicitu43).
Studie testující cytotoxickou aktivitu devíti Diels-Alderových aduktů chalkonu a dehydroprenyl-2-arylbenzofuranu vůči nádorovým buněčným liniím A-549 (lidský nemalobuněčný karcinom plic), Bel 7402 (lidský hepatocelulární karcinom), BGC-823 (karcinom žaludku), HCT-8 (lidský kolorektální karcinom) a A2780 (lidský ovariální karcinom) došla k závěru, že nejvyšší cytotoxicity dosáhl yunanensin A, v jehož struktuře jsou přítomné ketalové skupiny, a dva prenylované postranní řetězce, z nichž jeden podléhá cyklizaci se sousedním hydroxylem a druhý se podílí na 4+2 cykloadici, ze které však nevzniká cyklohexen, nýbrž benzen. O něco menší cytotoxicitu vykázal mulberrofuran F, který ve své struktuře také obsahuje ketalové skupiny i dva prenylované postranní řetězce, z nichž je jeden acyklický a druhý se účastní 4+2 cykloadice. Jak již bylo řečeno, cyklizace prenylovaného postranního řetězce by měla cytotoxicitu snižovat, což však v tomto případě neplatí. Ve struktuře yunanensinu A může cytotoxicitu ovlivňovat benzenový kruh místo cyklohexenového. Dále téměř stejnou cytotoxickou aktivitu vykázaly chalkomoracin a mulberrofuran E. Tyto dvě látky jsou strukturálně velmi podobné, obě obsahují dva prenylované postranní řetězce, avšak chalkomoracin disponuje jednou hydroxylovou skupinou navíc, což bude pravděpodobně důvodem jeho vyšší cytotoxicity. Velmi podobnou míru cytotoxicity s těmito dvěma látkami prokázal mulberrofuran G, jehož strukturu tvoří ketalové skupiny. Na rozdíl od předchozích dvou látek nevykázal cytotoxicitu u všech nádorových buněčných linií. U mongolicinu C byla zjištěna nižší cytotoxicita než u mulberrofuranu G, protože mulberrofuran G obsahuje více ketalových skupin. Australisin C prokázal nejslabší cytotoxický efekt u nádorové buněčné linie A2780, zatímco mulberrofuran J a Q spolu s prenylovaným flavonem kuwanonem G byly inaktivní. Vzhledem k výsledkům této studie lze konstatovat, že vzrůstající počet prenylovaných postranních řetězců, ketalových skupin a hydroxylových skupin zvyšuje cytotoxický účinek40, 81).
Kikuchi et al. testoval albanol A a mulberrofuran Q u nádorové buněčné linie myeloidní leukemie HL-60 a melanomu CRL1579. Zde albanol A vykázal dokonce vyšší cytotoxickou aktivitu než kontrolní cisplatina. Mulberrofuran Q vykázal naopak jen velmi slabou cytotoxickou aktivitu. Výsledek této studie tedy dokládá fakt, že intenzita cytotoxické aktivity může korelovat s množstvím ketalových skupin78).
V některých případech může o cytotoxicitě rozhodovat i konečná konfigurace látek. Například sanggenon C a sanggenon O jsou vzájemnými diastereoizomery, kterým se ve své studii věnoval Dat et al. Zkoumal potlačení životaschopnosti buněk Hep3B a inhibici akumulace HIF-1α (hypoxií indukovaný transkripční faktor) a sekrece vaskulárního endoteliálního růstového faktoru v buňkách této linie. Sanggenon O sice efektivněji inhiboval akumulaci HIF-1α a sekreci vaskulárního endoteliálního růstového faktoru, avšak sanggenon C vykázal silnější cytotoxicitu u buněk Hep3B. Z prenylovaných chalkonů byly těmto testům podrobeny kuwanon J, Q, R a V, přičemž kuwanony J, Q a R vykázaly podobné hodnoty inhibičních koncentrací. Hodnoty inhibičních koncentrací kuwanonu V byly ve všech případech nejvyšší, z čehož vyplývá jeho nejslabší cytotoxický efekt, který může být dán nižším počtem hydroxylových skupin v jeho struktuře63).
K zajímavému závěru došla studie hodnotící kuwanon L a sanggenon B, C, D a G jako inhibitory proteinu XIAP. Sanggenony B, C a D neprokázaly žádnou aktivitu, na rozdíl od sanggenonu G a kuwanonu L. Kuwanon L však v porovnání se sanggenonem G projevil jen velmi malou inhibiční aktivitu, protože sanggenon G vzhledem k vyšší lipofilitě postranního prenylovaného řetězce daleko lépe překonává biologické membrány, čímž efektivně vstupuje do buněk. Aby látka mohla působit jako ligand domény proteinu XIAP, vyžaduje určitou flexibilitu fenylové skupiny (B-kruh) flavonoidního skeletu, což v případě sanggenonu B, C, a D není dodrženo, protože hydroxylová skupina navázaná na B-kruhu flavonoidního skeletu podlehla cyklizaci s C-kruhem49).
Závěr
Cílem práce bylo vyhledat v dostupné literatuře prenylované fenoly s cytotoxickou a antiproliferativní aktivitou izolované z Morus alba a následně popsat a vyhodnotit souvislosti mezi strukturou těchto látek a jejich účinkem.
Z celkového souboru 113 prenylovaných fenolů byla cytotoxická aktivita zjištěna u 57 látek, které byly nejčastěji izolovány z kořenové kůry moruše bílé. Většina látek s cytotoxickou aktivitou byla odvozena od prenylovaných flavonoidů. Substituce fenolického skeletu prenylovanými postranními řetězci zvyšuje lipofilitu látky a uděluje jí silnou afinitu k biologickým membránám, díky čemuž je látka schopna interagovat s cílovými proteiny v buňce. Prenylované fenoly indukovaly v buňkách apoptosu ovlivňováním exprese proteinů z rodiny Bcl-2 nebo aktivováním klíčových apoptotických enzymů – kaspas.
Výsledky studií potvrdily, že se vzrůstajícím počtem prenylovaných postranních řetězců rostla cytotoxická aktivita, na kterou měly dále vliv i hydroxylové skupiny ve specifických polohách. Ketalové skupiny v kombinaci s prenylovanými postranními řetězci rovněž zvyšovaly cytotoxickou aktivitu. Také se ukázalo, že látky s prenylovou skupinou navázanou na A-kruhu vykazovaly vyšší cytotoxicitu než látky obsahující prenylovou skupinu na B-kruhu nebo C-kruhu. Modifikace prenylovaného postranního řetězce, jako je například hydroxylace, cytotoxicitu naopak snižovala. Jakým způsobem ovlivňuje cyklizace prenylovaného postranního řetězce se sousedním hydroxylem cytotoxickou aktivitu, zůstává nejasné. V některých případech cyklizací prenylové skupiny se sousedním hydroxylem cytotoxicita rostla, v jiných naopak klesala. Geranylované fenoly vykázaly ve studiích vyšší cytotoxicitu než prenylované fenoly, protože geranylová skupina je více lipofilní a umožňuje tak efektivnější vstup do buněk.
Osm prenylovaných fenolů prokázalo selektivní cytotoxický účinek vůči nádorovým buňkám, přičemž vůči nenádorovým buňkám nebyly cytotoxické vůbec, nebo byly méně cytotoxické než k buňkám nádorovým.
Seznam použitých zkratek
Akt serin-threoninová kinasa
ATP adenosintrifosfát
BAD Bcl-2-associated death promoter
BAX Bcl-2-associated X protein
Bcl-2 B-cell lymphoma
CDK cyklin-dependentní kinasa
DR5 receptor smrti 5
EGFR epidermální růstový faktor
ER endoplazmatické retikulum
ERK extracelulárně regulovaná kinasa
HIF-1 hypoxií indukovaný transkripční faktor
IC50 střední inhibiční koncentrace
LD50 střední smrtelná dávka
MAPK mitogenem aktivovaná proteinkinasa
MMP matrixové metaloproteinasy
NF-κB jaderný faktor kappa B
NO oxid dusnatý
PINK1 PTEN-indukované kinasy 1
PI3K fosfatidylinositol-3-kinasa
PK pozitivní kontrola
PUMA p53 upregulated modulator of apoptosis
Rb protein retinoblastomový protein
ROS reaktivní formy kyslíku
STAT-3 signální transduktor a aktivátor transkripce 3
TNF tumor nekrotizující faktor
TRAIL tumor necrosis factor-related apoptosis-inducing ligand
XIAP X-chromosome-linked inhibitor of apoptosis protein
VEGF vaskulární endoteliální růstový faktor
Seznam zkratek buněčných linií
AGS buněčná linie lidského adenokarcinomu žaludku
ACHN buněčná linie lidského renálního adenokarcinomu
AsPC-1 buněčná linie lidského adenokarcinomu pankreatu
A-549 buněčná linie lidského nemalobuněčného karcinomu plic
A2780 buněčná linie lidského ovariálního karcinomu
A375.S2 buněčná linie lidského maligního melanomu
BGC-823 buněčná linie lidského karcinomu žaludku
BPH-1 buněčná linie benigní hyperplazie prostaty
BxPc-3 buněčná linie lidského adenokarcinomu pankreatu
B16 buněčná linie myšího melanomu
Bel 7402 buněčná linie lidského hepatocelulárního karcinomu
Caco-2 buněčná linie lidského kolorektálního adenokarcinomu
Ca922 buněčná linie lidského orálního skvamózního karcinomu
CEM buněčná linie lidské T-lymfoblastické leukemie
CEM/ADR 5000 buněčná linie lidské akutní T-lymfoblastické leukemie
CCRF-CEM buněčná linie lidské T-lymfoblastické leukemie
CRL1579 buněčná linie lidského melanomu
C6 buněčná linie myšího gliomu
DU-145 buněčná linie lidského karcinomu prostaty
dRLh84 buněčná linie hepatocelulárního karcinomu potkana
HCC2998 buněčná linie lidského kolorektálního adenokarcinomu
HCT-8 buněčná linie lidského kolorektálního adenokarcinomu
HCT116 buněčná linie lidského kolorektálního adenokarcinomu
HeLa buněčná linie lidského cervikálního adenokarcinomu
HepG-2 buněčná linie lidského hepatocelulárního karcinomu
Hep3B buněčná linie lidského hepatocelulárního karcinomu
HGF buněčná linie lidských gingiválních fibroblastů
HL-60 buněčná linie lidské myeloidní leukemie
HN4 buněčná linie lidského orálního skvamózního karcinomu
HN12 buněčná linie lidského metastatického orálního skvamózního karcinomu
HO-8910 buněčná linie lidského ovariálního karcinomu
HSC-2 buněčná linie lidského orálního skvamózního karcinomu
HSG buněčná linie lidského karcinomu slinné žlázy
HT-29 buněčná linie lidského kolorektálního karcinomu
HUVEC buněčná linie lidských jaterních buněk
H1299 buněčná linie lidského nemalobuněčného karcinomu plic
H1975 buněčná linie lidského nemalobuněčného karcinomu plic obsahující dvojitou mutaci L858R/T790M
H22 buněčná linie myšího hepatocelulárního karcinomu
H292 buněčná linie lidského nemalobuněčného karcinomu plic
H4IIE buněčná linie hepatocelulárního karcinomu potkana
H460 buněčná linie lidského nemalobuněčného karcinomu plic
H929 buněčná linie lidského mnohočetného myelomu
IMR-32 buněčná linie lidského neuroblastomu
KB buněčná linie lidského orálního karcinomu
KM12 buněčná linie lidského kolorektálního adenokarcinomu
K562 buněčná linie lidské erytro-megakaryoblastické leukemie
LAPC-4 buněčná linie lidského pokročilého karcinomu prostaty
LNCaP buněčná linie lidského androgen-senzitivního adenokarcinomu prostaty
LoVo buněčná linie lidského kolorektálního karcinomu
L-02 buněčná linie lidských endoteliálních buněk pupečníkové vény
MCF-7 buněčná linie lidského prsního karcinomu
MCF10A buněčná linie lidského prsního epitelu
MDA-MB-157 buněčná linie lidského prsního karcinomu
MDA-MB-231 buněčná linie lidského prsního karcinomu
MDA-MB-453 buněčná linie lidského prsního karcinomu
MGC803 buněčná linie lidského karcinomu žaludku
MIA Paca 2 buněčná linie lidského adenokarcinomu pankreatu
MKN45 buněčná linie lidského adenokarcinomu žaludku
M2182 buněčná linie lidského karcinomu prostaty
Molt3 buněčná linie lidské akutní T-lymfoblastické leukemie
NB-39 buněčná linie lidského neuroblastomu
NCI-H187 buněčná linie lidského malobuněčného karcinomu plic
NCI-H460 buněčná linie lidského karcinomu plic
OVCAR-3 buněčná linie lidského ovariálního adenokarcinomu
OVCAR-8 buněčná linie lidského ovariálního adenokarcinomu
PANC-1 buněčná linie lidského adenokarcinomu pankreatu
PC-3 buněčná linie lidského adenokarcinomu prostaty
P388 buněčná linie myší lymfocytické leukemie
RPMI8226 buněčná linie lidského mnohočetného myelomu
RAW 264,7 buněčná linie myší leukemie
SCC2095 buněčná linie lidského orálního skvamózního karcinomu
SCLC buněčná linie lidského malobuněčného karcinomu plic
SGC-7901 buněčná linie lidského karcinomu žaludku
SKOV-3 buněčná linie lidského ovariálního karcinomu
SK-Hep1 buněčná linie lidského hepatocelulárního karcinomu
SMMC-7721 buněčná linie lidského hepatocelulárního karcinomu
SW48 buněčná linie lidského kolorektálního adenokarcinomu
SW480 buněčná linie lidského kolorektálního karcinomu
Tca8113 buněčná linie lidského skvamózního karcinomu jazyku
THP-1 buněčná linie lidské monocytické leukemie
U266 buněčná linie lidského mnohočetného myelomu
Vero buněčná linie ledvinných fibroblastů získaných z afrického kočkodana zeleného
Střet zájmů: žádný.
N. Prausová
doc. PharmDr. Peter Kollár, Ph.D.
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta
Ústav humánní farmakologie a toxikologie
Palackého 1/3, 612 42 Brno
e-mail: F14103@vfu.cz; KOLLARP@vfu.cz
Zdroje
1. Chan E., Lye P., Wong S. Review: Phytochemistry, pharmacology, and clinical trials of Morus alba. CJNM 2016; 14(1), 17–30. https://www-sciencedirect-com.katalog.vfu.cz:444/science/article/pii/S187553641630005X
2. Kresánek J. Atlas liečivých rastlín a lesných plodov. 3. vyd. Bratislava: Osveta 1988; 400 s.
3. Natić M., Dabić D., Papetti A., Fotirić Akšić M., Ognjanov V., Ljubojević M., Tešić Ž. Analysis and characterisation of phytochemicals in mulberry (Morus alba L.) fruits grown in Vojvodina, North Serbia. Food Chem. 2015; 171, 128–136. http://linkinghub.elsevier.com/retrieve/pii/S0308814614013260
4. Lim T. Edible Medicinal and Non Medicinal Plants: Volume 3, Fruits. Dordrecht Heidelberg London New York: Springer 2012; 399–429. https://epdf.tips/volume-3-fruits.html
5. Krishna H., Singh D., Singh R., Kumar L., Sharma B., Saroj P. Morphological and antioxidant characteristics of mulberry (Morus spp.) genotypes. Journal of the Saudi Society of Agricultural Sciences 2018. https://linkinghub.elsevier.com/retrieve/pii/S1658077X18302169
6. Yimam M., Jiao P., Hong M., Brownell L., Hyun-Jin Kim, Lee Y., Jia Q. Repeated dose 28-day oral toxicity study of a botanical composition composed of Morus alba and Acacia catechu in rats. Regul. Toxicol. Pharmacol. 2018; 94, 115–123. https://linkinghub.elsevier.com/retrieve/pii/S0273230018300400
7. Kumar V., Chauhan S. Mulberry: Life enhancer. J. Med. Plants Res. 2008; 2(10), 271–278. https://academicjournals.org/article/article1380526584_Kumar %20and %20Chauhan.pdf
8. Šmejkal K. Medicínské využití prenylovaných fenolů. https://docplayer.cz/71015046-Medicinske-vyuziti-prenylovanych-fenolu-karel-smejkal.html (2013)
9. Talhi O. Organic Synthesis of C-Prenylated Phenolic Compounds. Curr. Org. Chem. 2013; 17(10), 1067–1102. https://www.researchgate.net/publication/236854139_Organic_Synthesis_of_C-Prenylated_Phenolic_Compounds
10. Yang X., Jiang Y., Yang J., He J., Sun J., Chen F., Zhang M., Yang B. Prenylated flavonoids, promising nutraceuticals with impressive biological activities. Trends Food Sci. Technol. 2015; 44(1), 93–104. https://linkinghub.elsevier.com/retrieve/pii/S0924224415000710
11. Nomura T., Hano Y., Fukai T. Chemistry and biosynthesis of isoprenylated flavonoids from Japanese mulberry tree. Proc. Jpn. Acad., Ser. B, Phys. Biol. Sci. 2009; 85(9), 391–408. http://joi.jlc.jst.go.jp/JST.JSTAGE/pjab/85.391?from=CrossRef
12. Xia C., Tang G., Guo Y., Xu Y., Huang Z., Yin S. Mulberry Diels-Alder-type adducts from Morus alba as multi-targeted agents for Alzheimer’s disease. Phytochemistry. 2019; 157, 82–91. https://linkinghub.elsevier.com/retrieve/pii/S0031942218306988
13. Nasir S., Tee J., Rahman N., Chee Ch. Flavonoids – from biosynthesis to human health. InTech. 2017; 167–188. http://www.intechopen.com/books/flavonoids-from-biosynthesis-to-human-health/biosynthesis-and-biomimetic-synthesis-of-flavonoid-diels-alder-natural-products
14. Boonyaketgoson S., Rukachaisirikul V., Phongpaichit S., Trisuwan K. Cytotoxic arylbenzofuran and stilbene derivatives from the twigs of Artocarpus heterophyllus. Tetrahedron Lett. 2017; 58(16), 1585–1589. https://linkinghub.elsevier.com/retrieve/pii/S0040403917303167
15. Guo Y., Tang G., Lou L., Li W., Zhang B., Liu B., Yin S. Prenylated flavonoids as potent phosphodiesterase-4 inhibitors from Morus alba: Isolation, modification, and structure-activity relationship study. Eur. J. Med. Chem. 2018; 144, 758–766. https://linkinghub.elsevier.com/retrieve/pii/S0223523417310887
16. Qin J., Fan M., He J., Wu X., Peng L., Su J., Cheng X., Li Y., Kong L., Li R., Zhao Q. New cytotoxic and anti-inflammatory compounds isolated from Morus alba L. Nat. Prod. Res. 2015; 29(18), 1711–1718. http://www.tandfonline.com/doi/full/10.1080/14786419.2014.999333
17. Wätjen W., Weber N., Lou Y., Wang Z., Chovolou Y., Kampkötter A., Kahl R., Proksch P. Prenylation enhances cytotoxicity of apigenin and liquiritigenin in rat H4IIE hepatoma and C6 glioma cells. Food Chem. Toxicol. 2007; 45(1), 119–124. https://linkinghub.elsevier.com/retrieve/pii/S0278691506002213
18. Arung E., Yoshikawa K., Shimizu K., Kondo R. Isoprenoid-substituted flavonoids from wood of Artocarpus heterophyllus on B16 melanoma cells: Cytotoxicity and structural criteria. Fitoterapia. 2010; 81(2), 120–123. https://linkinghub.elsevier.com/retrieve/pii/S0367326X09001749
19. Zhang Y., Luo J., Wan C., Zhou Z., Kong L. Four New Flavonoids with α-Glucosidase Inhibitory Activities from Morus alba var. tatarica. Chem. Biodivers. 2015; 12(11), 1768–1776. https://onlinelibrary-wiley-com.katalog.vfu.cz:444/doi/epdf/10.1002/cbdv.201500005
20. Fomani M., Ngeufa Happi E., Nouga Bisoue A., Ndom J., Kamdem Waffo A., Sewald N., Wansi J. Oxidative burst inhibition, cytotoxicity and antibacterial acriquinoline alkaloids from Citrus reticulate (Blanco). Bioorg. Med. Chem. Lett. 2016; 26(2), 306–309. https://linkinghub.elsevier.com/retrieve/pii/S0960894X15303413
21. Dat N., Binh P., Quynh L., Van Minh C., Huong H., Lee J. Cytotoxic prenylated flavonoids from Morus alba. Fitoterapia. 2010; 81(8), 1224–1227. https://linkinghub.elsevier.com/retrieve/pii/S0367326X10002078
22. Kuete V., Sandjo L., Djeussi D., Zeino M., Kwamou G., Ngadjui B., Efferth T. Cytotoxic flavonoids and isoflavonoids from Erythrina sigmoidea towards multi-factorial drug resistant cancer cells. Invest. New Drugs 2014; 32(6), 1053–1062. http://link.springer.com/10.1007/s10637-014-0137-y
23. Weng J., Bai L., Ko H., Tsai Y. Cyclocommunol induces apoptosis in human oral squamous cell carcinoma partially through a Mcl-1-dependent mechanism. Phytomedicine. 2018; 39, 25–32. https://linkinghub.elsevier.com/retrieve/pii/S0944711317301770
24. Lin W., Lai D., Lee Y., Chen N., Tseng T. Antitumor progression potential of morusin suppressing STAT3 and NFκB in human hepatoma SK-Hep1 cells. Toxicol. Lett. 2015; 232(2), 490–498. http://linkinghub.elsevier.com/retrieve/pii/S0378427414015069
25. Lee J., Won S., Chao C., Wu F., Liu H., Ling P., Lin C., Su C. Morusin induces apoptosis and suppresses NF-κB activity in human colorectal cancer HT-29 cells. Biochem. Biophys. Res. Commun. 2008; 372(1), 236–242. http://linkinghub.elsevier.com/retrieve/pii/S0006291X08009285
26. Kang S., Kim E., Kim S., Lee J., Ahn K., Yun M., Lee S. Morusin induces apoptosis by regulating expression of Bax and Survivin in human breast cancer cells. Oncol. Lett. 2017; 13(6), 4558–4562. https://www.spandidos-publications.com/10.3892/ol.2017.6006
27. Xue J., Li R., Zhao X., Ma C., Lv X., Liu L., Liu P. Morusin induces paraptosis-like cell death through mitochondrial calcium overload and dysfunction in epithelial ovarian cancer. Chem.-Biol. Interact. 2018; 283, 59–74. https://linkinghub.elsevier.com/retrieve/pii/S0009279717311924
28. Park H., Min T., Chi G., Choi Y., Park S. Induction of apoptosis by morusin in human non-small cell lung cancer cells by suppression of EGFR/STAT3 activation. Biochem. Biophys. Res. Commun. 2018; 505(1), 194–200. https://linkinghub.elsevier.com/retrieve/pii/S0006291X18320102
29. Wang L., Guo H., Yang L., Dong L., Lin C., Zhang J., Lin P., Wang X. Morusin inhibits human cervical cancer stem cell growth and migration through attenuation of NF-κB activity and apoptosis induction. Mol. Cell. Biochem. 2013; 379(1–2), 7–18. http://link.springer.com/10.1007/s11010-013-1621-y
30. Lim S., Park S., Kang S., Park D., Kim S., Um J., Jang H., Lee J., Jeong C., Jang J., Ahn K., Lee S. Morusin induces cell death through inactivating STAT3 signaling in prostate cancer cells. Am. J. Cancer Res. 2015; 5(1), 289–300. http://www.ajcr.us/files/ajcr0003469.pdf
31. Kim C., Kim J., Oh E., Nam D., Lee S., Lee J., Kim S., Shim B., Ahn K. Blockage of STAT3 Signaling Pathway by Morusin Induces Apoptosis and Inhibits Invasion in Human Pancreatic Tumor Cells. Pancreas. 2016; 45(3), 409–419. http://Insights.ovid.com/crossref?an=00006676-201603000-00015
32. Park D., Ha I., Park S., Choi M., Lim S., Kim S., Lee J., Ahn K., Yun M., Lee S. Morusin Induces TRAIL Sensitization by Regulating EGFR and DR5 in Human Glioblastoma Cells. J. Nat. Prod. 2016; 79(2), 317–323. http://pubs.acs.org/doi/10.1021/acs.jnatprod.5b00919
33. Guo H., Liu C., Yang L., Dong L., Wang L., Wang Q., Li H., Zhang J., Lin P., Wang X. Morusin inhibits glioblastoma stem cell growth in vitro and in vivo through stemness attenuation, adipocyte transdifferentiation, and apoptosis induction. Mol. Carcinog. 2016; 55(1), 77–89. http://doi.wiley.com/10.1002/mc.22260
34. Wang F., Zhang D., Mao J., Ke X., Zhang R., Yin C., Gao N., Cui H. Morusin inhibits cell proliferation and tumor growth by down-regulating c-Myc in human gastric cancer. Oncotarget. 2017; 8(34), 57187–57200. https://www.researchgate.net/publication/318437337_Morusin_inhibits_cell_proliferation_and_tumor_growth_by_downregulating_c-Myc_in_human_gastric_cancer
35. Wan L., Ma B., Zhang Y. Preparation of morusin from Ramulus mori and its effects on mice with transplanted H 22 hepatocarcinoma. BioFactors 2014; 40(6), 636–645. http://doi.wiley.com/10.1002/biof.1191
36. Ma J., Qiao X., Pan S., Shen H., Zhu G., Hou A. New isoprenylated flavonoids and cytotoxic constituents from Artocarpus tonkinensis. J. Asian Nat. Prod. Res. 2010; 12(7), 586–592. http://www.tandfonline.com/doi/abs/10.1080/10286020.2010.485932
37. Kollár P., Bárta T., Hošek J., Souček K., Závalová V., Artinian S., Talhouk R., Šmejkal K., Suchý P., Hampl A. Prenylated Flavonoids from Morus alba L. Cause Inhibition of G1/S Transition in THP-1 Human Leukemia Cells and Prevent the Lipopolysaccharide-Induced Inflammatory Response. Evid. Based Complementary Alternat. Med. 2013; 2013, 1–13. http://www.hindawi.com/journals/ecam/2013/350519/
38. Lee H., Auh Q., Lee Y., Kang S., Chang S., Lee D., Kim Y., Kim E. Growth inhibition and apoptosis-inducing effects of cudraflavone B in human oral cancer cells via MAPK,
NF-κB, and SIRT1 Signaling Pathway. Planta Medica. 2013; 79(14), 1298–1306. http://www.thieme-connect.de/DOI/DOI?
10.1055/s-0033-135061939. Zou Y., Hou A., Zhu G., Chen Y., Sun H., Zhao Q. Cytotoxic isoprenylated xanthones from Cudrania tricuspidata. Bioorg. Med. Chem. 2004; 12(8), 1947–1953. http://linkinghub.elsevier.com/retrieve/pii/S0968089604000641
40. Zhang Q., Tang Y., Chen R., Yu D. Three new cytotoxic Diels-Alder-type adducts from Morus australis. Chemistry 2007; 4(7), 1533–1540. https://onlinelibrary-wiley-com.katalog.vfu.cz:444/doi/epdf/10.1002/cbdv.200790133
41. Oke-Altuntas F., Kapche G., Nantchouang Ouete J., Demirtas I., Koc M., Ngadjui B. Bioactivity evaluation of cudraxanthone I, neocyclomorusin and (9βh)-3β-acetoxylanosta-7,24-diene isolated from Milicia excelsa Welw. C. C. Berg (Moraceae). Med. Chem. Res. 2016; 25(10), 2250–2257. http://link.springer.com/10.1007/s00044-016-1670-3
42. Gryn-Rynko A., Bazylak G., Olszewska-Slonina D. New potential phytotherapeutics obtained from white mulberry (Morus alba L.) leaves. Biomed. Pharmacother. 2016; 84, 628–636. https://linkinghub.elsevier.com/retrieve/pii/S075333221631188
43. Ferlinahayati F., Syah Y., Juliawaty L., Achmad S., Hakim E., Takayama H., Said I., Latip J. Phenolic constituents from the wood of Morus australis with cytotoxic activity. Z. Naturforsch. C. 2008; 63(1–2), 35–39. https://www.degruyter.com/downloadpdf/j/znc.2008.63.issue-1-2/znc-2008-1-207/znc-2008-1-207.pdf
44. Lee C., Yen F., Ko H., Li S., Chiang Y., Lee M., Tsai M., Hsu L. Cudraflavone C induces apoptosis of A375.S2 melanoma cells through mitochondrial ROS production and MAPK activation. Int. J. Mol. Sci. 2017; 18(7), 1508–1520. https://content-ebscohost-com.katalog.vfu.cz:444/ContentServer.asp?T=P&P=AN&K=124367473&S=R&D=a9h&EbscoContent=dGJyMNLr40Sep7A4xNvgOLCmr1GeprFSr6a4S7SWxWXS&ContentCustomer=dGJyMPGut0ivrLZPuePfgeyx43zx
45. Syah Y., Juliawaty L., Achmad S., Hakim E., Ghisalberti E. Cytotoxic prenylated flavones from Artocarpus champeden. J. Nat. Med. 2006; 60(4), 308–312. http://link.springer.com/10.1007/s11418-006-0012-z
46. Soo H., Chung F., Lim K., Yap V., Bradshaw T., Hii L., Tan S., See S., Tan Y., Leong C., Mai C., Castresana J. Cudraflavone C Induces tumor-specific apoptosis in colorectal cancer cells through inhibition of the phosphoinositide 3-kinase (PI3K)-AKT pathway. PLoS One 2017; 12(1), 1–20. https://dx.plos.org/10.1371/journal.pone.0170551
47. Yang Z., Matsuzaki K., Takamatsu S., Kitanaka S. Inhibitory effects of constituents from morus alba var. multicaulis on differentiation of 3T3-L1 cells and nitric oxide production in RAW264.7 cells. Molecules 2011; 16(7), 6010–6022. http://www.mdpi.com/1420-3049/16/7/6010
48. Mihara S., Hara M., Nakamura M., Sakurawi K., Tokura K., Fujimoto M., Fukai T., Nomura T. Non-peptide bombesin receptor antagonists, kuwanon G and H, isolated from mulberry. Biochem. Biophys. Res. Commun. 1995; 213(2), 594–599. http://linkinghub.elsevier.com/retrieve/pii/S0006291X85721730
49. Seiter M., Salcher S., Rupp M., Hagenbuchner J., Kiechl-Kohlendorfer U., Mortier J., Wolber G., Rollinger J., Obexer P., Ausserlechner M. Discovery of Sanggenon G as a natural cell-permeable small-molecular weight inhibitor of X-linked inhibitor of apoptosis protein (XIAP). FEBS Open Bio. 2014; 4(1), 659–671. http://doi.wiley.com/10.1016/j.fob.2014.07.001
50. Wang Z., Li X., Chen M., Liu F., Han C., Kong L., Luo J. A strategy for screening of α-glucosidase inhibitors from Morus alba root bark based on the ligand fishing combined with high-performance liquid chromatography mass spectrometer and molecular docking. Talanta. 2018; 180, 337–345. https://linkinghub.elsevier.com/retrieve/pii/S0039914017312730
51. Wang X., Di X., Shen T., Wang S., Wang X. New phenolic compounds from the leaves of Artocarpus heterophyllus. Chin. Chem. Lett. 2017; 28(1), 37–40. https://linkinghub.elsevier.com/retrieve/pii/S1001841716301838
52. Jung J., Park J., Lee Y., Seo K., Oh E., Lee D., Lim D., Han D., Baek N. Three new isoprenylated flavonoids from the root bark of Morus alba. Molecules 2016; 21(9), 1–10. http://www.mdpi.com/1420-3049/21/9/1112
53. Ferlinahayati F., Syah Y., Juliawaty L., Hakim E. Flavanones from the wood of Morus nigra with cytotoxic activity. Indones. J. Chem. 2013; 13, 205–208. https://www.researchgate.net/publication/286348915_Flavanones_from_the_wood_of_Morus_nigra_with_cytotoxic_activity
54. Kofujita H., Yaguchi M., Doi N., Suzuki K. A novel cytotoxic prenylated flavonoid from the root of Morus alba. J. Insect Biotechnol. Sericology 2004; 73(3), 113–116. https://www.jstage.jst.go.jp/article/jibs/73/3/73_3_113/_pdf/-char/en
55. Šmejkal K. Cytotoxic potential of C-prenylated flavonoids. Phytochem. Rev. 2014; 13(1), 245–275. http://link.springer.com/10.1007/s11101-013-9308-2
56. Cui L., Lee H., Oh W., Ahn J. Inhibition of sanggenon G isolated from Morus alba on the metastasis of cancer cell. Chm. 2011; 3(1), 23–26. http://www.tiprpress.com/chmen/ch/reader/create_pdf.aspx?file_no=CHM20100722001&year_id=2011&quarter_id=1&fal
57. Nam M., Jung D., Seo K., Kim B., Kim J., Kim J., Kim B., Baek N., Kim S. Apoptotic effect of sanggenol L via caspase activation and inhibition of NF-κB signaling in ovarian cancer cells. Phytother. Res. 2016; 30(1), 90–96. http://doi.wiley.com/10.1002/ptr.5505
58. Zhou P., Dong X., Tang P. Sanggenon C induces apoptosis of prostate cancer PC3 cells by activating caspase 3 and caspase 9 pathways. Nan Fang Yi Ke Da Xue Xue Bao 2017; 37(9), 1206–1210. http://www.j-smu.com/Upload/html/2017091206.html
59. Chen L., Liu Z., Zhang L., Yao J., Wang C. Sanggenon C induces apoptosis of colon cancer cells via inhibition of NO production, iNOS expression and ROS activation of the mitochondrial pathway. Oncol. Rep. 2017; 38(4), 2123–2131. https://www.spandidos-publications.com/10.3892/or.2017.5912
60. Dat N., Xuan Binh P., Phuong Quynh L., Huóng H., Van Minh C. Sanggenon C and O inhibit NO production, iNOS expression and NF-κB activation in LPS-induced RAW264.7 cells. Immunopharmacol. Immunotoxicol. 2012; 34(1), 84–88. https://eds-a-ebscohost-com.katalog.vfu.cz:444/eds/pdfviewer/pdfviewer?vid=5&sid=caf51610-430c-4581-952f-c80d8366c0d6 %40sdc-v-sessmgr04
61. Huang H., Liu N., Zhao K., Zhu C., Lu X., Li S., Lian W., Zhou P., Dong X., Zhao C., Guo H., Zhang C., Yang C., Wen G., Lu L., Li X., Guan L., Liu C., Wang X., Dou Q., Liu J. Sanggenon C decreases tumor cell viability associated with proteasome inhibition. Front. Biosci. 2011; 3(4), 1315–1325. https://www.researchgate.net/publication/51174312_Sanggenon_C_decreases_tumor_cell_viability_associated_with_proteasome_inhibition
62. Shi Y., Fukai T., Sakagami H., Chang W., Yang P., Wang F., Nomura T. Cytotoxic Flavonoids with Isoprenoid Groups from Morus mongolica. J. Nat. Prod. 2001; 64(2), 181–188. http://pubs.acs.org/doi/abs/10.1021/np000317c
63. Dat N., Jin X., Lee K., Hong Y., Kim Y., Lee J. Hypoxia-inducible factor-1 inhibitory benzofurans and chalcone-derived Diels-alder adducts from Morus species. J. Nat. Prod. 2009; 72(1), 39–43. http://pubs.acs.org/doi/abs/10.1021/np800491u
64. Wu Y., Kim Y., Kwon T., Tan C., Son K., Kim T. Anti-inflammatory effects of mulberry (Morus alba L.) root bark and its active compounds. Nat. Prod. Res. 2019; 1–4. https://www.tandfonline.com/doi/full/10.1080/14786419.2018.1527832
65. Jing W., Yan R., Wang Y. A practical strategy for chemical profiling of herbal medicines using ultra-high performance liquid chromatography coupled with hybrid triple quadrupole-linear ion trap mass spectrometry: a case study of Mori Cortex. Anal. Methods. 2015; 7(2), 443–457. https://pubs.rsc.org/en/content/getauthorversionpdf/C4AY02196G
66. Liu Y., Li S., Hou J., Liu Y., Wang D., Jiang Y., Ge G., Liang X., Yang L. Identification and characterization of naturally occurring inhibitors against human carboxylesterase 2 in White Mulberry Root-bark. Fitoterapia 2016; 115, 57–63. https://linkinghub.elsevier.com/retrieve/pii/S0367326X16304981
67. Kim S., Son E., Yoon S. Pharmaceutical composition including sanggenol Q for preventing or treating lung cancer. 2017. Republic of Korea. KR101771364B1. Uděleno 19. 7. 2016. Zapsáno 24. 8. 2017. https://patents.google.com/patent/KR101771364B1/en
68. Yang Y., Zhang T., Xiao L., Yang L., Chen R. Two new chalcones from leaves of Morus alba L. Fitoterapia. 2010; 81(6), 614–616. https://linkinghub.elsevier.com/retrieve/pii/S0367326X1000064X
69. Li K., Zheng Q., Chen X., Wang Y., Wang D., Wang J. Isobavachalcone Induces ROS-Mediated Apoptosis via Targeting Thioredoxin Reductase 1 in Human Prostate Cancer PC-3 Cells. Oxid. Med. Cell. Longev. 2018; 2018, 1–13. https://www.hindawi.com/journals/omcl/2018/1915828/
70. Shi Y., Wu W., Huo A., Zhou W., Jin X. Isobavachalcone inhibits the proliferation and invasion of tongue squamous cell carcinoma cells. Oncol. Lett. 2017; 14(3), 2852–2858. https://www.spandidos-publications.com/10.3892/ol.2017.6517
71. Jin X., Shi Y. Isobavachalcone induces the apoptosis of gastric cancer cells via inhibition of the Akt and Erk pathways. Exp. Ther. Med. 2016; 11(2), 403–408. https://www.spandidos-publications.com/10.3892/etm.2015.2904
72. Kuete V., Mbaveng A., Zeino M., Fozing C., Ngameni B., Kapche G., Ngadjui B., Efferth T. Cytotoxicity of three naturally occurring flavonoid derived compounds (artocarpesin, cycloartocarpesin and isobavachalcone) towards multi-factorial drug-resistant cancer cells. Phytomedicine 2015; 22(12), 1096–1102. https://linkinghub.elsevier.com/retrieve/pii/S0944711315002330
73. Szliszka E., Jaworska D., Ksek M., Czuba Z., Król W. Targeting death receptor TRAIL-R2 by chalcones for TRAIL-induced apoptosis in cancer cells. Int. J. Mol. Sci. 2012; 13(12), 15343–15359. http://www.mdpi.com/1422-0067/13/11/15343
74. Zhao S., Ma C., Liu C., Wei W., Sun Y., Yan H., Wu Y. Autophagy inhibition enhances isobavachalcone-induced cell death in multiple myeloma cells. Int. J. Mol. Sci. 2012; 30(4), 939–944. https://www.spandidos-publications.com/10.3892/ijmm.2012.1066
75. Jing H., Zhou X., Dong X., Cao J., Zhu H., Lou J., Hu Y., He Q., Yang B. Abrogation of Akt signaling by Isobavachalcone contributes to its anti-proliferative effects towards human cancer cells. Cancer Lett. 2010; 294(2), 167–177. https://linkinghub.elsevier.com/retrieve/pii/S0304383510000704
76. Nishimura R., Tabata K., Arakawa M., Ito Y., Kimura Y., Akihisa T., Nagai H., Sakuma A., Kohno H., Suzuki T. Isobavachalcone, a chalcone constituent of Angelica keiskei, induces apoptosis in neuroblastoma. Biological. 2007; 30(10), 1878–1883. https://www.jstage.jst.go.jp/article/bpb/30/10/30_10_1878/_pdf
77. Phung T., Tran T., Dan T., Chau V., Hoang T., Nguyen T. Chalcone-derived Diels–Alder adducts as NF-κB inhibitors from Morus alba. J. Asian Nat. Prod. Res. 2012; 14(6), 596–600. https://www.tandfonline.com/doi/abs/10.1080/10286020.2012.670221
78. Kikuchi T., Nihei M., Nagai H., Fukushi H., Tabata K., Suzuki t., Akihisa T. Albanol A from the Root Bark of Morus alba L. Induces Apoptotic Cell Death in HL60 Human Leukemia Cell Line. Chemical 2010; 58(4), 568–571. https://www.jstage.jst.go.jp/article/cpb/58/4/58_4_568/_pdf/-char/en
79. Lee Y., Seo K., Hong E., Kim D., Kim Y., Baek N. Diels-alder type adducts from the fruits of Morus alba L. Appl. Biol. Chem. 2016; 59(2), 91–94. https://www.researchgate.net/publication/304583358_Diels-Alder_type_adducts_from_the_fruits_of_Morus_alba_L
80. Han H., Chou C., Li R., Liu J., Zhang L., Zhu W., Hu J., Yang B., Tian J. Chalcomoracin is a potent anticancer agent acting through triggering Oxidative stress via a mitophagy - and paraptosis-dependent mechanism. Sci. Rep. 2018; 8(1), 1–14. https://www.nature.com/articles/s41598-018-27724-3.pdf
81. Cui X., Wang L., Yan R., Tan Y., Chen R., Yu D. A new Diels-Alder type adduct and two new flavones from the stem bark of Morus yunanensis Koidz. J. Asian Nat. Prod. Res. 2008; 10(4), 315–318. http://www.tandfonline.com/doi/abs/10.1080/10286020701833537
82. Ha M., Seong S., Nguyen T., Cho W., Ah K., Ma J., Woo M., Choi J., Min B. Chalcone derivatives from the root bark of Morus alba L. act as inhibitors of PTP1B and α-glucosidase. Phytochemistry 2018; 155, 114–125. https://linkinghub.elsevier.com/retrieve/pii/S0031942218304254
83. Hu C., Chen Z., Yao R., Xu G. Inhibition of protein kinase C by stilbene derivatives from Morus alba L. Tianran Chanwu Yanjiu Yu Kaifa 1996; 8(2), 13–16. http://en.cnki.com.cn/Article_en/CJFDTOTAL-TRCW199602002.htm
84. Šmejkal K., Svačinová J., Šlapetová T., Schneiderová K., Dall’Acqua S., Innocenti G., Závalová V., Kollár P., Chudík S., Marek R., Julínek O., Urbanová M., Kartal M., Csöllei M., Doležal K. Cytotoxic activities of several geranyl-substituted flavanones. J. Nat. Prod. 2010; 73(4), 568–572. http://pubs.acs.org/doi/abs/10.1021/np900681y
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2019 Číslo 2-
Všetky články tohto čísla
- Ekonomický pohled na léčbu bevacizumabem u metastatického kolorektálního karcinomu
- Prenylované fenoly s cytotoxickou a antiproliferativní aktivitou izolované z Morus alba
- Vliv formulačních a procesních parametrů na vlastnosti Cu2+/alginátových částic připravených vnější iontovou gelací hodnocený analýzou hlavních komponent Miroslava Pavelková
- Trh s volně prodejnými léčivy – porovnání Česká republika a Řecko
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Trh s volně prodejnými léčivy – porovnání Česká republika a Řecko
- Ekonomický pohled na léčbu bevacizumabem u metastatického kolorektálního karcinomu
- Prenylované fenoly s cytotoxickou a antiproliferativní aktivitou izolované z Morus alba
- Vliv formulačních a procesních parametrů na vlastnosti Cu2+/alginátových částic připravených vnější iontovou gelací hodnocený analýzou hlavních komponent Miroslava Pavelková
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy