-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Teorie a praxe lékopisné kontroly jakosti léčiv a pomocných látek IX. Problematika tolerančních mezí na obsah léčivých a pomocných látek v Evropském lékopisu (Ph. Eur.)*
Theory and practice of pharmacopoeial control of quality of drugs and excipients IX. The problem of tolerance limits for the content of active substances and excipients in the European Pharmacopoeia (Ph. Eur.)
Content tolerance limits should respect the acceptable variation in the content of the active substance or excipient from its production and the variability of the results of the analytical procedure prescribed to determine the content by the appropriate pharmacopoeia. This usually prevails in the active substances and excipients. They should be derived statistically based on the precision of the prescribed analytical method determined by the interlaboratory test. Calculations from published precision characteristics show that some tolerance intervals for the active substance content are probably too narrow in Ph. Eur. This can lead to erroneous decisions about their quality.
Keywords:
Ph. Eur. – determination of active substance content – interlaboratory study – statistical tolerance limits
Autoři: Jan Šubert; Jozef Kolář
Vyšlo v časopise: Čes. slov. Farm., 2019; 68, 91-94
Kategorie: Přehledy a odborná sdělení
Souhrn
Toleranční meze na obsah by měly respektovat akceptovatelné kolísání obsahu léčivé či pomocné látky z její produkce a variabilitu výsledků analytického postupu předepsaného ke stanovení obsahu příslušným lékopisným článkem. Ta u léčivých a pomocných látek obvykle převládá. Měly by být odvozovány statisticky na základě přesnosti předepsané analytické metody zjištěné mezilaboratorním testem. Výpočty z publikovaných charakteristik přesnosti ukazují, že některé toleranční intervaly na obsah léčivých látek v Ph. Eur. jsou pravděpodobně příliš úzké. To může vést až k chybnému rozhodování o jejich kvalitě.
Klíčová slova:
Ph. Eur. – stanovení obsahu léčivých látek – mezilaboratorní studie – statistické toleranční meze
olerance na obsah a jejich nastavení jsou důležitou částí lékopisné kontroly jakosti léčiv. Měly by respektovat akceptovatelné kolísání obsahu léčivé či pomocné látky z její produkce a mimoto variabilitu výsledků analytického postupu předepsaného ke stanovení obsahu příslušným lékopisným článkem. Při stanovení obsahu samotných léčivých a pomocných látek od kvalitních dodavatelů variabilita z analytiky zpravidla převládá. Přes publikovaná upozornění na význam přesnosti výsledků metod používaných ke stanovení obsahu v lékopisné kontrole jakosti léčiv (např. 1–3)), byly toleranční intervaly v minulosti a dosud jsou vzhledem k nedostatečné znalosti statistických charakteristik přesnosti jednotlivých analytických metod a postupů v lékopisech stanovovány spíše než s využitím statistických metod odborným odhadem a v některých případech příliš úzké. Možné důsledky takového přístupu lze ukázat na stanovení obsahu krystalického dusičnanu stříbrného podle třetího vydání Československého lékopisu (ČsL 3)4).
Analýza rozptylu5–7) výsledků mezilaboratorního testu za účasti 15 laboratoří zabývajících se lékopisnou kontrolou jakosti léčiv v České republice a ve Slovenské republice ukázala, že postup ČsL 3 (titrace odměrným roztokem thiokyanatanu amonného za vizuální indikace) dává výsledky s nízkou vnitrolaboratorní variabilitou (relativní směrodatná odchylka byla < 0,1 %),problémem však byla mezilaboratorní variabilita. Relativní směrodatná odchylka výsledků zahrnující i tuto složku byla 0,58 % a jejím důsledkem byl fakt, že pouze u šesti laboratoří z 15 (40 %) byl aritmetický průměr výsledků dvou paralelních stanovení v rozmezí, které odpovídá šířce tolerančního intervalu ČsL 3 (tolerance 99,7–100,5 %4)), přičemž statistickým testováním nebyly mezi 30 jednotlivými výsledky ani 15 aritmetickými průměry výsledků jednotlivých laboratoří nalezeny odlehlé hodnoty8). Proto byla v dalším vydání Československého lékopisu9) tolerance na obsah krystalického dusičnanu stříbrného rozšířena na 99,2–100,5 % a současně byla vizuální indikace nahrazena potenciometrickou. Je-li však jako přiměřená tolerance uvažován v prvním přiblížení nejméně čtyřnásobek hodnoty směrodatné odchylky výsledků předepsaného analytického postupu2), nebyly tyto změny dostatečné a jako pravděpodobně příliš úzkou lze z tohoto pohledu hodnotit i toleranci v článku Silver nitrate Ph. Eur.10), kde je uveden požadavek na obsah 99,0–100,5 %, přičemž předepsaný analytický postup se v zásadě shoduje s postupem podle ČsL 3 (titrace za vizuální indikace síranem amonno-železitým).
Statistické přístupy byly použity i v návrzích k řešení problematiky tolerančních mezí v Ph. Eur. Je to patrné např. z údajů v publikaci11), ve které jsou výsledky stanovení obsahu racemického efedrin-hydrochloridu acidimetrickou titrací v nevodném prostředí za potenciometrické indikace ve 40 laboratořích. Po vyloučení laboratoří s odlehlými či neúplnými výsledky byla vyčíslena ze zbylých výsledků hodnota směrodatné odchylky 0,54 a z ní jejím vynásobením ± 1,69 (hodnota odvozená autory11) ze vzorce předpokládajícího provedení tří paralelních stanovení) tolerance vyplývající z variability výsledků použité analytické metody 99,1–100,9 %. Není však zřejmé, nakolik byl tento přístup uplatněn v článcích na obsah léčivých a pomocných látek Ph. Eur. Není příliš pravděpodobné, že by se zkušený analytik při kontrole obsahu léčivých a pomocných látek spokojil s provedením jen jednoho stanovení, nelze to však zcela vyloučit; autorům příspěvku se nepodařilo v textu Ph. Eur. najít požadavek na provedení alespoň dvou paralelních stanovení obsahu. Pokud jde o analytické metody předepsané v článcích, lze v předmluvě k Ph. Eur. nalézt zmínku o mezilaboratorním testování, ale jinde v textu je uvedeno, že předepsané limity jsou založeny na údajích získaných v běžné analytické praxi a berou v úvahu běžné analytické chyby, přijatelné odchylky při výrobě, přípravě a znehodnocení v rozsahu považovaném ještě za přijatelný.
Výsledky dalších devíti mezilaboratorních testů postupů předepsaných ke stanovení obsahu léčivých látek Ph. Eur. jsou uvedeny v12). Z nich autoři odvozují, že tolerance vyplývající z analytické variability stanovení obsahu acidobazickou titrací může být ± 1 %, spektrofotometrií v ultrafialové oblasti a kapalinovou chromatografií ± 2 %. Tyto závěry se jeví v kontextu výsledků analýz13, 14) jako příliš optimistické, např. u odměrných stanovení na úrovni 100% obsahu účinné látky uvádí studie13) jako možnou predikci směrodatné odchylky zahrnující mezilaboratorní variabilitu, která je jednou ze součástí konstrukce tolerančních mezí, hodnotu 0,96. Ani některé výsledky uvedené v12) výše uvedené představě autorů neodpovídají, např. při spektrofotometrickém stanovení obsahu cinarizinu byla směrodatná odchylka charakterizující reprodukovatelnost výsledků včetně mezilaboratorní variability po vyloučení laboratoří s odlehlými výsledky rovna 1,91. Počítáme-li za předpokladu normálního rozdělení výsledků analýz oboustranné statistické toleranční meze5, 15–17) s respektováním skutečnosti, že máme pro výpočet k dispozici jen konečný a zpravidla ne příliš velký počet výsledků, je třeba brát v úvahu konfidenční pravděpodobnost γ a počítat ze směrodatné odchylky (s) toleranční meze jako interval, ve kterém bude s dostatečně velkou pravděpodobností γ ležet nejméně P % všech budoucích normálně rozdělených výsledků stanovení. S respektováním hodnoty tolerančního faktoru pro normální rozdělení se známou střední hodnotou k(p,γ,f)5, 12, 15, 16) tabelovaného pro různé hodnoty p, γ a počet stupňů volnosti, z nichž byla určena směrodatná odchylka podle vzorce ± k(p,γ,f)s pro obvyklé hodnoty p = 0,95 a γ = 0,95 při směrodatné odchylce s = 1,91 a odpovídajícím počtu stupňů volnosti, docházíme k hodnotě až dvojnásobné a ani výsledek výpočtu za předpokladu provedení tří paralelních stanovení (což není Ph. Eur. předepsáno) disproporci v plném rozsahu neřeší. Nejde o situaci typickou, nýbrž o jeden z příkladů ukazujících, že výsledky mezilaboratorních studií mohou ve vztahu k lékopisným tolerancím přinést nečekaná překvapení; viz také3, 8), nebo18). Pokud by postup stanovení obsahu cinarizinu spektrofotometrií v ultrafialové oblasti nebyl předmětem mezilaboratorní studie a byl zařazen do článku Ph. Eur. s rámcovou tolerancí na analytickou variabilitu ± 2 %, mohlo by docházet k chybnému posuzování dodávek. Proto by mezilaboratorní studie měly být považovány za standardní metodu práce při přípravě nových a revizi dosavadních článků Ph. Eur. a měla by být pro ně stanovena pravidla, která by zajistila, že se jich zúčastní laboratoře zabývající se lékopisnou kontrolou jakosti léčiv z co největšího počtu zemí, které Ph. Eur. používají. Výsledky těchto studií by měly být soustavně využívány při statistickém odvozování tolerancí na obsah léčivých a pomocných látek. Že tomu tak v Ph. Eur. dosud ve všech případech není, dokládají toleranční meze na obsah v některých jeho článcích (tab. 1). Jsou-li např. toleranční meze jen 99,5–100,5 %, byl by toleranční faktor při p = 0,95, γ = 0,95 a 100 stupních volnosti k = 2,2216). Vydělením šířky tolerančního pole jeho dvojnásobkem vychází za předpokladu nulové variability obsahu léčivé či pomocné látky z výroby (která ale nulová není) nejvyšší přípustná hodnota pro směrodatnou odchylku charakterizující reprodukovatelnost výsledků včetně jejich mezilaboratorní variability 0,23. To je hodnota obtížně dosažitelná a vyvolává obavu, že tolerance Ph. Eur. mohou být v těchto případech příliš úzké. Mimoto je třeba počítat i s variabilitou z výroby, která ale nebývá u léčivých a pomocných látek příliš velká. Analogická úvaha pro 200 stupňů volnosti vede k hodnotě k = 2,1416) a ke stejné hodnotě s = 0,23, jako při f = 100. Problémy tohoto typu lze očekávat i při tolerancích na obsah 99,0–100,5 %, které lze nalézt v Ph. Eur.10) ve větším počtu článků. Naznačuje to příklad kyseliny benzoové. Pomineme-li toleranci z výroby, pro úvahu 100 stupňů volnosti by neměla směrodatná odchylka charakterizující i mezilaboratorní reprodukovatelnost překročit hodnotu 0,34, z výsledků mezilaboratorní studie přesnosti analytického postupu (alkalimetrie za vizuální indikace konečného bodu titrace), který se liší od postupu předepsaného Ph. Eur. prakticky jen použitým barevným indikátorem, za účasti 17 laboratoří zabývajících se kontrolou jakosti léčiv v České republice a ve Slovenské republice byla ale směrodatná odchylka 0,5119). Že může nastat problém i při šířce tolerančního intervalu 2 %, která je v Ph. Eur. běžná, ukazují výsledky mezilaboratorní studie stanovení obsahu racemického efedrin-hydrochloridu alkalimetrickou titrací za potenciometrické indikace konečného bodu titrace za účasti 39 laboratoří, které vedly po vyloučení laboratoří s odlehlými výsledky k hodnotě směrodatné odchylky zahrnující mezilaboratorní reprodukovatelnost rovné 0,6412). Tedy zřetelně větší, než 0,45 získaná analogickým výpočtem za předpokladu 100 stupňů volnosti a větší než směrodatná odchylka výsledků mezilaboratorní studie původního postupu Ph. Eur. (0,54)11). Zmíněné problémy se zvětšují, uvažujeme-li větší pravděpodobnostní pokrytí vzhledem k tomu, že např. při p = 0,99, γ = 0,99 a 100 stupních volnosti je hodnota tolerančního faktoru rovna 3,0816). Jinou možností by mohla být konstrukce neparametrických tolerančních mezí5, 15), které by byly robustnější.
Tab. 1. Příklady léčiv, pro která je v článcích Ph. Eur.10) potenciálně příliš úzká tolerance na obsah 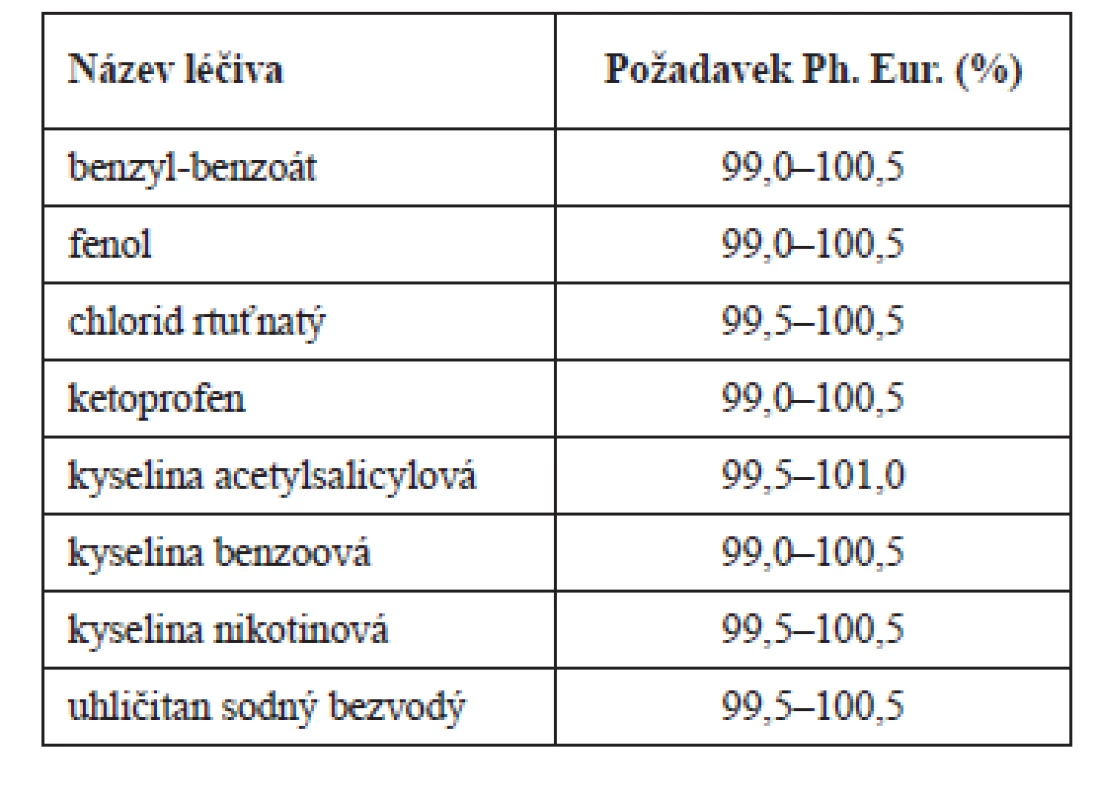
Naznačené problémy lze snížit opakováním analýz, přičemž je užitečné porovnávat s tolerančními mezemi místo jednotlivých výsledků až aritmetický průměr z nich vzhledem k tomu, že je lepším odhadem neznámé skutečnosti. Informační obsažnost stoupá s počtem provedených stanovení nejvýrazněji do 56). Požadavek na opakování stanovení obsahu při kontrole jakosti léčivých a pomocných látek se autorům příspěvku nepodařilo v Ph. Eur. dohledat, některé návrhy a studie (11, 12) počínaje) s opakováním analýz ve výpočtech přesto počítají. S provedením tří stanovení obsahu a se statistickým přístupem počítá20), přičemž s tolerancemi porovnává až průměr z nich, až čtyři stanovení navrhuje21) (s tolerancemi rovněž porovnává až průměr z nich), pro začátek dvě stanovení uvažuje22). Bylo by proto žádoucí a potřebné věnovat v textu Ph. Eur. pozornost i této problematice a s ní souvisejícím otázkám.
Střet zájmů: žádný.
prof. RNDr. Jan Šubert, CSc.
Dušínova 1512/42, 664 34 Kuřim
doc. RNDr. Jozef Kolář, CSc. ()
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta
Ústav aplikované farmacie
Palackého tř. 1946/1, 612 42 Brno
e-mail: kolarj@vfu.cz
Zdroje
1. Reimers F. The Basic Principles for Pharmacopoeial Tests. Copenhagen, London: Ejnar Munksgaard, Heinemann Medical Books 1956; 76.
2. Fürst W. Zur Bedeutung der Standardabweichung für die Aufstellung von Arzneibuchmonografien. Zbl. Pharm. 1973; 112, 701–710.
3. Diding N., Johansson S., Ohlson B., Öhrner B. Anforderungen an Präzision, Genauigkeit und Spezifität von Gehaltsbestimmungen unter Verwendung von Standards. Zbl. Pharm. 1981; 120, 779–788.
4. Československý lékopis, 3. vydání, svazek II. Praha: Avicenum 1970; 463–464.
5. Sachs L. Angewandte Statistik. 4. Aufl. Berlin, Heidelberg, New York: Springer-Verlag 1974.
6. Eckschlager K., Horsák I., Kodejš Z. Vyhodnocování analytických výsledků a metod. Praha: SNTL 1980.
7. Youden W. J., Steiner E. H. Statistical Manual of the AOAC. Washington: Association of Official Analytical Chemists 1975.
8. Šubert J., Grolichová L. Ke kvantitativnímu hodnocení léčiv v ČsL 3. XVI. Stanovení obsahu krystalického dusičnanu stříbrného – kruhový test. Farm. Obzor 1986; 55, 25–28.
9. Československý lékopis, 4. vydání, svazek II. Praha: Avicenum 1987; 101.
10. European Pharmacopoeia Online 9.5 (http://online6.edqm.eu/ep905/ Accessed 05-02-2019).
11. Daas A. G. J., Miller J. H. McB. Content limits in the European Pharmacopoeia (Part 1). Pharmeuropa 1997; 9, 148–156.
12. Daas A. G. J., Miller J. H. McB. Content limits in the European Pharmacopoeia (Part 2). Pharmeuropa 1998; 10, 137–146.
13. Margosis M., Horwitz W., Albert R. Performance characteristics of methods of analysis used for regulatory purposes. I. Drug dosage forms. F. Gravimetric and titrimetric methods. J. Assoc. Off. Anal. Chem. 1988; 71, 619–635.
14. Horwitz W., Albert R. H. Performance characteristics of methods of analysis used for regulatory purposes. I. Drug dosage forms. D. High pressure liquid chromatographic methods. J. Assoc. Off. Anal. Chem. 1985; 68, 191–198.
15. Jílek M. Statistické toleranční meze. Praha: SNTL 1988.
16. Jílek M. Počet měření a odhad přesnosti chemických analýz. Chem. Listy 1981; 75, 937–946.
17. Dong X., Tsong Y., Shen M., Zhong J. Using tolerance intervals for assessment of pharmaceutical quality. J. Biopharm. Stat. 2015; 25, 317–327. doi:10.1080/10543406.2014.972512.
18. De Beer J. O., De Spiegeleer B. M. J., Hoogmartens J., Samson I., Massart D. L., Moors M. Relationship between content limits and assay methods: an interlaboratory statistical evaluation. Analyst 1992; 117, 933–940.
19. Šubert J., Grolichová L. Ke kvantitativnímu hodnocení léčiv v ČsL 3/ČsL 4. XX. Stanovení obsahu trometamolu a benzoové kyseliny – kruhový test. Českoslov. Farm. 1988; 37, 133–137.
20. Ebel S. Assay content limits in the pharmacopoeia. Pharmeuropa 1997; 9, 143–147.
21. van Rompay J. How to construct and use the specifications of chemical substances. Pharmeuropa 1997; 9, 135–139.
22. van de Vaart F. J. Content limits – setting and use. Pharmeuropa 1997; 9, 140–143.
Štítky
Farmácia Farmakológia
Článok vyšiel v časopiseČeská a slovenská farmacie

2019 Číslo 3-
Všetky články tohto čísla
- Výběr technologických parametrů pro přípravu kombinovaného perorálního roztoku Maglycimet™
- XLI. pracovní dny Radiofarmaceutické sekce České společnosti nukleární medicíny ČLS JEP
- Zemřel pan docent RNDr. Pavel Komárek, PhD. † 8. července 2019
- Teorie a praxe lékopisné kontroly jakosti léčiv a pomocných látek IX. Problematika tolerančních mezí na obsah léčivých a pomocných látek v Evropském lékopisu (Ph. Eur.)*
- Schisandra chinensis and its phytotherapeutical applications
- Česká a slovenská farmacie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Schisandra chinensis and its phytotherapeutical applications
- Teorie a praxe lékopisné kontroly jakosti léčiv a pomocných látek IX. Problematika tolerančních mezí na obsah léčivých a pomocných látek v Evropském lékopisu (Ph. Eur.)*
- XLI. pracovní dny Radiofarmaceutické sekce České společnosti nukleární medicíny ČLS JEP
- Výběr technologických parametrů pro přípravu kombinovaného perorálního roztoku Maglycimet™
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



