-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Celiakie, která není celiakií?
When is celiac disease not celiac disease?
Despite the high the prevalence of celiac disease in the European population (around 1%), this disease is often not diagnosed and in some cases the diagnosis takes place when the disease is in the advance stages. Diagnosing celiac disease is not always unequivocal and because it requires a lifelong gluten-free diet, it should be done in a sensible way. Diagnosing celiac disease is based on the conclusiveness of different serological markers and on the presence of a typical coeliac histology that responds to a gluten-free diet. In cases of typical disease progress, the diagnosis is usually clear. Doubts may arise when other diseases mimic the symptoms of celiac disease or when a non-standard or missing serological response occurs. Our case study describes a 30-year-old patient whose diagnosis of celiac disease could not be confirmed or refuted, even after several years of considerable effort. At the beginning of monitoring, the patient was diagnosed with celiac disease based on the presence of characteristic histological findings in a membrane biopsy of the duodenum (Marsh 3). Despite the patient maintaining a variable diet, the histological changes regressed but without loss of isolated positivity to endomysial antibodies. We therefore considered diseases other than celiac disease that might be responsible for the patient’s symptoms. Subsequently, lamblioza was confirmed in a secretion from the duodenum. Even after treatment, the patient was kept on gastroenterological dispenzarization and on a normal diet with working diagnosis of potential sprue.
Key words:
celiac disease – differential diagnosis – duodenitis – Giardia lamblia
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
25. 2. 2016Accepted:
2. 4. 2016
Autori: Petra Koňaříková; V. Kojecký
Pôsobisko autorov: Gastroenterologie, Interní klinika Krajská nemocnice T. Bati, a. s., Zlín
Vyšlo v časopise: Gastroent Hepatol 2017; 71(1): 58-61
Kategória: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.14735/amgh2016csgh.info18Súhrn
Přes vysokou prevalenci celiakie v evropské populaci (okolo 1 %) není toto onemocnění dostatečně často diagnostikováno a k diagnóze se někdy dospěje až v pozdní fázi nemoci. Stanovení diagnózy je však ne vždy zcela jednoznačné, a jelikož člověka odsoudí k doživotní bezlepkové dietě, mělo by být uvážlivé. Diagnóza celiakie je založena na průkazu různých sérologických markerů a na typickém histologickém obraze s následnou reakcí na bezlepkovou dietu. Při typickém obraze je diagnóza snadná. Pochyby však mohou nastat při chorobách, které celiakii imitují a při netypické či chybějící sérologické odpovědi. Naše kazuistika představuje 30letou pacientku, u níž ani po více letech nejsme schopni přes maximální úsilí diagnózu celiakie s jistotou potvrdit ani vyloučit. Na počátku sledování jsme u ní, na základě typického histologického nálezu z biopsie sliznice duodena Marsh 3, stanovili diagnózu celiakie. Pacientka dietu držela variabilně, přesto došlo k regresi histologických změn, současně přetrvávala izolovaná pozitivita protilátek proti endomysiu. Proto jsme začali uvažovat o jiných onemocněních napodobující celiakii. V duodenálním sekretu jsme následně prokázali lambliózu. Nicméně ji i po přeléčení ponecháváme v gastroenterologické dispenzarizaci při běžné dietě s pracovní diagnózou potenciální sprue.
Klíčová slova:
celiakie – diferenciální diagnostika – duodenitida – Giardia lambliaÚvod
Celiakie (celiakální sprue, glutenová enteropatie) je typickým autoimunitním onemocněním dětí i dospělých. V poslední době prevalence tohoto onemocnění, zejména v rozvinutých zemích, stoupá. V ČR se odhaduje na 1 : 200 – 250, což odpovídá přibližně 40 000–50 000 nemocných. Nárůst počtu nemocných je dán jednak samotným zlepšením diagnostiky, ale také zavedením cíleného screeningu celiakie. I přesto je v současné době diagnostikováno z celkového počtu pouze 10 – 15 % nemocných [1].
Celiakie má různé formy příznaků. Klasická forma s hubnutím, bolestmi břicha a steatoreou se vyskytuje zřídka a především v dětském věku. U dospělých se častěji manifestuje formou atypickou s mimostřevními příznaky, sideropenií, osteoporózou, zvýšenými hodnotami transamináz, infertilitou, depresemi a polyneuropatií. Formy silentní, latentní a potenciální jsou vesměs již bezpříznakové (tab. 1).
Tab. 1. Formy celiakie dle [2]. Tab. 1. Forms of celiac disease according to [2]. ![Formy celiakie dle [2].
Tab. 1. Forms of celiac disease according to [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f713547f7b9d84445847eea7d1ea17c5.png)
Existuje řada onemocnění, která mohou celiakii ve svých příznacích, patologiích a průběhu napodobovat, případně se s celiakií kombinovat, což může diagnózu značně zkomplikovat.
Revidovaná diagnostická kritéria celiakie zahrnují jednak klinické příznaky, sérologický průkaz protilátek, histologický nález a zřetelnou klinickou a sérologickou odpověď na bezlepkovou dietu [2]. Před provedením sérologických vyšetření a enterobiopsie musí být pacient minimálně 3 měsíce exponován stravě s obsahem lepku [1]. U pacienta s typickou konfigurací patologií je diagnóza snadná. Senzitivita a specificita testů však není 100%. Proto se doporučuje, s cílem maximalizovat senzitivitu a specificitu, jednotlivá vyšetření kombinovat. Problém vzniká v situaci, kdy získáme protichůdné výsledky.
Vlastní kazuistika
Žena, 30 let, bez jiných chorob, byla vyšetřována hematologem pro mikrocytózu (objem erytrocytů 78 fl, hemoglobin 134 g/ l, železo i ostatní laboratorní parametry v normě). Do medikace byl hematologem doplněn preparát železa a pro dyspepsie a intermitentní průjmy byla pacientka odeslána do gastroenterologické ambulance k vyloučení celiakie. Při prvním vyšetření byly protilátky proti tkáňové transglutamináze (AtTG) ve třídě imunoglobulinů (Ig) A i G negativní, hladina IgA u pacientky byla v normě. Endomysiální protilátky (EMA – endomysial antibodies) však byly pozitivní. Histologický nález duodena (hyperplastické krypty s mírnou atrofií klků) patolog hodnotil jako celiakii Marsh 3a (obr. 1). I přes netypickou sérologii byla pacientce doporučena bezlepková dieta.
Obr. 1. Částečná atrofie klků – typizace Marsh 3a, barvení hematoxilin-eozinem dle [17]. Fig. 1. Partial atrophy of the villi – Marsh 3a typing, haematoxylin-eosin staining according to [17]. ![Částečná atrofie klků – typizace Marsh 3a, barvení hematoxilin-eozinem dle [17].
Fig. 1. Partial atrophy of the villi – Marsh 3a typing, haematoxylin-eosin staining according to [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/96cbda0ba52d19c6d1338c550e63f537.jpg)
Pacientka se dostavila na kontrolu za rok. Veškeré potíže vymizely, cítila se dobře, bezlepkovou dietu se snažila dodržovat, ne však dokonale. Sérologie protilátek i krevní obraz byly identické jako při prvním kontaktu, trvala izolovaná pozitivita EMA. Histologický nález z biopsie duodena odpovídal nespecifické duodenitidě. Došlo tedy ke zlepšení histologického nálezu i při nedokonalém dodržování bezlepkové diety (v době odběru bezlepkovou dietu cca 2 – 3 týdny nedodržovala).
Při kontrolách v dalším roce se cítila dobře, laboratorní nálezy byly stacionární, s pozitivitou EMA a negativitou AtTG, i přesto, že pacientka dietu nedodržovala.
K verifikaci diagnózy bylo proto pacientce doporučeno bezlepkovou dietu nedodržovat, za půl roku byla pozvána na kontrolu. Subjektivně byla bez potíží, laboratorně trvala pozitivita EMA při negativních AtTG.
Při kontrolní biopsii z duodena obraz odpovídal celiakii stupně 1 dle Marshe(zvýšený počet intraepiteliálních CD3T lymfocytů). Tato dynamika nálezů a histologického obrazu za bezlepkové diety je pro celiakii netypická, proto jsme v diferenciální diagnostice začali uvažovat o jiných onemocněních napodobujících celiakii. Nebyl potvrzen protilátkový deficit, negativní byla anamnéze léková, k vyloučení Crohnovy choroby byla provedena koloskopie (s negativním nálezem vč. intubace terminálního ilea).
Vyšetření tenkého střeva již pacientka neakceptovala. V duodenálním sekretu byla prokázána lamblie, což je jedna z možných příčin duodenitidy. Nemocná byla tedy přeléčena entizolem. Při kontrole s odstupem času byla bez potíží a bezlepkovou dietu nedodržovala. Stále trvala pozitivita EMA při negativitě AtTG a negativní byly i protilátky proti deaminovaným gliadinovým peptidům (DGP). Zato byl prokázán genotyp DQ8 s pozitivitou alel (DQA1, DQB1). Kontrolní biopsii z duodena pacientka odmítla.
Má tedy naše pacientka celiakii, či nikoli? Diagnózu celiakie podporuje genetická predispozice, histologický obraz Marsh 3 a pozitivita EMA protilátek. Zpochybňuje ji regrese histologických změn na sliznici duodena i při nedodržování bezlepkové diety, stacionární a velmi netypická sérologie protilátek. Histologické změny v duodenu jsou vysvětlitelné lambliovou infekcí.
Diskuze
Stanovení diagnózy celiakie vychází z kriterií ESPGHAN [3]:
- anamnéza a klinické příznaky kompatibilní s celiakií,
- sérologická vyšetření kompatibilní s celiakií,
- histologické nálezy kompatibilní s celiakií,
- zřetelná klinická a sérologická odpověď na bezlepkovou dietu,
- nemocný je starší 2 let,
- vyloučení jiných onemocnění napodobujících celiakii.
Ve screeningu celiakie je stěžejní vyšetření protilátek (tab. 2):
- Antigliadinové protilátky (AGA – antigliadin antibodies) jsou obsoletní.
- Základní metodou jsou protilátky proti tkáňové transglutamináze ve třídě IgA, IgG (AtTGA, AtTGG). Hodnota hladiny protilátek je v přímé úměře s mírou poškození tenkého střeva, po nasazení bezlepkové diety jejich titry klesají během několika měsíců. Za pozitivní se považují hladiny nad 20 IU/ l, přičemž hodnota > 100 IU/ l ve většině případů konfirmuje onemocnění [4]. Celkem 3 % celiaků mají izolovaný deficit IgA, v tomto případě je nutné stanovit protilátky ve třídě IgG. Falešná pozitivita AtTGA se vyskytuje u pacientů s chronickým onemocněním jater a ledvin, u pacientů s nespecifickými střevními záněty, při tumorech či monoklonálních gamapatiích a řady autoimunitních chorob (tab. 3) [5]. Falešně negativní hodnoty mohou mít osoby v imunosupresi, s vrozeným či získaným imunodeficitem.
- EMA jsou považovány za nejspecifičtější (98 – 100 %) [6] a za referenční standard [7]. Pozitivní EMA je glutenem aktivovaný autoimunitní proces, který značí poškození sliznice, pozitivita může být i u latentního onemocnění. Falešná pozitivita je dle literatury raritní, falešná negativita může nastat při selektivním IgA deficitu, nebo naopak při pokročilejší formě onemocnění [8].
- Protilátky proti DGP – DGP testy jsou přesnější než tTG a jsou nejspolehlivějšími testy u lidí s IgA deficiencií, jsou vysoce senzitivní i specifické u obou izotypů – IgG i IgA (IgG dokonce u dětí lepší než tTG) [9,10].
Tab. 2. Protilátky v diagnostice celiakie dle [18 ]. Tab. 2. Antibodies in the diagnosis of celiac disease according to [18]. ![Protilátky v diagnostice celiakie dle [18 ].
Tab. 2. Antibodies in the diagnosis of celiac disease according to [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e48ef53fb1de174611a2f4072dce20ce.png)
Ig – imunoglobulin, AGA – antigliadinové protilátky, EMA – endomysiální protilátky, tTG – tkáňová transglutamináza, DGP – deaminovaný gliadinový peptid Tab. 3. Modifikovaná Marshova klasifikace. Tab. 3. Modified Marsh classification. 
IEL – intraepiteliální lymfocyty V současnosti se doporučuje k upřesnění diagnostiky celiakie využít kombinaci více sérologických metod a specificita se poté blíží 100 %. Pozitivita předpokládá víceměsíční expozici lepkem. K normalizaci hladiny dochází postupně během 1 roku po ukončení kontaktu s lepkem.
Jedinou sérologickou patologií u naší pacientky byly trvale pozitivní EMA, a to i přes variabilní expozici lepkem, kdy bychom předpokládali jednak objevení se nových protilátek či postupnou normalizaci EMA. Protilátkový imunodeficit prokázán nebyl.
Následujícím krokem ke stanovení diagnózy je histologické vyšetření sliznice tenkého střeva. Již při endoskopickém vyšetření mohou být makroskopicky patrné změny sliznice v duodenu – vroubkování řas, redukce jejich počtu a výšky, mozaikovitá struktura sliznice, nodularity, zvýraznění cévní kresby. Slizniční změny mohou být přítomny disperzně, proto se doporučuje biopsie z D2/ D3 části duodena v počtu min. čtyř vzorků a jednoho vzorku z bulbu duodena [1]. Tíže změn kolísá od lymfocytární infiltrace (počet intraepiteliálních lymfocytů) až po těžkou atrofii (tab. 3).
V případě lehkých změn (Marsh 1) je specificita pro diagnózu nízká a není pro celiakii patognomická. Může se nacházet u řady dalších onemocnění jako např. hypersenzitivita na kravské mléko, imunodeficity, lamblióza, bakteriální přerůstání aj. (tab. 4). U naší nemocné byl úvodní obraz Marsh 3 s diagnózou celiakie plně slučitelný. Podivné postupné zlepšení na Marsh 1 bez bezlepkové diety již diagnózu zpochybňuje.
Tab. 4. Differenciální diagnostika duodenitidy a atrofie střevní sliznice. Tab. 4. Differential diagnosis of duodenitis and atrophy of the intestinal mucosa. 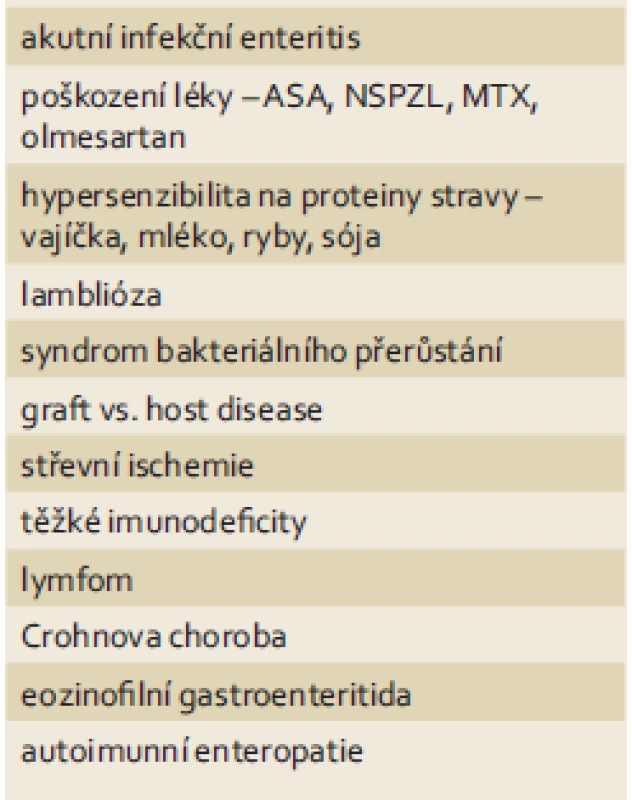
ASA – kyselina acetylsalicylová, NSPZL – nesteroidní protizánětlivé léky, MTX – metotrexát Genetika
Genetická susceptibilita je dána polygeny – jednak MHC (major histocompatibility complex) HLA DQ2 a DQ8 a dalšími non-HLA geny (CTLA4, ICOS, CD28). DQ2 má cca 91 % celiaků, pro kombinaci HLA DQ2 a DQ8 je senzitivita kolem 96 % [11 – 13]. Přítomnost specifických genů nutně rozvoj celiakie neznamená. Např. HLA DQ2 je přítomen u 30 % europoidní populace, přičemž k rozvoji celiakie dojde jen u 1 % z nich [14]. Individuální senzitivita závisí také na vlastní genetické konfiguraci (zvláště genů DQB1*02 a DQA1*05). Nosičství DQ2.5 je pro vznik celiakie nutné, ale samo o sobě nestačí. Pro vznik celiakie je nutná koincidence dispozice s nepříznivými vlivy okolí (kojení, bariérové funkce, infekce) [15]. Naše pacientka je nosičkou rizikového genotypu DQ8.
Expozice a vysazení lepku
Tolerance vůči lepku je i u osob s celiakií variabilní. Předpokládá se, že bezpečný příjem lepku u celiaka se pohybuje mezi 10 – 20 mg lepku/ den. U dětí se expoziční test nedoporučuje do 5 let a v období puberty. V případě, že nedoje k sérologické odpovědi do 2 let od zahájení expozice lepkem, se další pokračování nedoporučuje [7]. Po ukončení expozice titr protilátek klesá, normalizace může trvat až 1 rok.
Pokud máme pacienta, u kterého chybí pozitivní sérologie, histologicky je však přítomna sliznice duodena ohodnocena Marsh 3, a pokud jsme vyloučili jiné celiakii imitující onemocnění, lze pacienta zařadit mezi vzácnou skupinu s tzv. séronegativní celiakií, která je definována dle [16]:
- atrofií klků střevní sliznice, která nemá jinou prokazatelnou příčinu;
- negativitou sérologických testů (EMA, DGP, AtTGG, AtTGA);
- průkazem genetické predispozice.
Závěr
U naší pacientky nejsme schopni stanovisko diagnózy celiakie ani po 3 letech zaujmout. Histologický obraz modifikovala lamblióza a pro nedostatečnou compliance nelze efekt expozice či vysazení lepku či jiného koincidujícího onemocnění spolehlivě hodnotit. Jde o geneticky disponovanou osobu, u které jsou přítomny vysoce specifické EMA. Stav proto stále pracovně hodnotíme jako potenciální sprue a pacientka je dále sledována při běžné dietě.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 25. 2. 2016
Přijato: 2. 4. 2016
MU Dr. Petra Koňaříková
Gastroenterologie
Interní klinika
Krajská nemocnice T. Bati, a. s.
Havlíčkovo nábřeží 600
762 75 Zlín
petra.konarikova@bnzlin.cz
Zdroje
1. Frič P, Keil R. Celiakie pro praxi. Med Praxi 2011; 8(9): 354 – 359.
2. Kohout P. Celiakie v ambulantní praxi. Med Praxi 2007; 6 : 250 – 252
3. Walker-Smith JA, Guandalini S, Schmitz Jet al. Revised criteria for diagnosis of coeliac disease. Report of Working Group of European Society of Paediatric Gastroenterology and Nutrition. Arch Dis Child 1990; 65(8): 909 – 911.
4. Kotalová R, Nevoral J, Šmídová J. Tkáňové protilátky v diagnostice celiakální sprue. Čs Pediatr 1996; 51(11): 680 – 687.
5. Clemente MG, Musu MP, Frau F et al. Antitissue transglutaminase antibodies outside celiac disease. J Pediatr Gastroenterol Nutr 2002; 34(1): 31 – 34.
6. Collin P, Kaukinen K, Vogelsang H et al. Antiendomysial and antihuman recombinant tissue transglutaminase antibodies in the diagnosis of coeliac disease: a biopsy--proven European multicentre study. Eur J Gastroenterol Hepatol 2005; 17(1): 85 – 91.
7. Husby S, Koletzko S, Korponay-Szabó IR et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition Guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012; 54(1): 136 – 160. doi: 10.1097/ MPG.0b013 e31821a23d0.
8. Salmi TT, Collin P, Korponay-Szabó IR. Endomysial antibody‐negative coeliac disease: clinical characteristics and intestinal autoantibody deposits. Gut 2006; 55(12): 1746 – 1753. doi: 10.1136/ gut.2005.071514.
9. Volta U, Granito A, Parisi C et al. Deamidated gliadin peptide antibodies as a routine test for celiac disease: a prospective analysis. J Clin Gastroenterol 2010; 44(3): 186 – 190. doi: 10.1097/ MCG.0b013e3181c378f6.
10. Agardh D. Antibodies against synthetic deamidated gliadin peptides and tissue transglutaminase for the identification of childhood celiac disease. Clin Gastroenterol Hepatol 2007; 5(11): 1276 – 1281.
11. Karell K, Louka AS, Moodie SJ et al. HLA types in celiac dinase patients not carrying the DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European genetics cluster on celiac disease. Hum Immunol 2003; 64(4): 469 – 477.
12. Polvi A, Eland C, Koskimies S et al. HLA DQ and DP in Finnish families with celiac disease. Eur J Immunogenet 1996; 23(3): 221 – 234.
13. Margaritte-Jeannin P, Babron MC, Bourgey M et al. HLA-DQ relative risks for coeliac disease in European populations: a study of the European genetics cluster on coeliac disease. Tissue Antigens 2004; 63(6): 562 – 567.
14. Heap GA, van Heel DA. Genetics and pathogenesis of coeliac disease. Semin Immunol 2009; 21(6): 346 – 354. doi: 10.1016/ j.smim.2009.04.001.
15. Gujral N, Freeman H, Thomson AB et al. Celiac disease: prevalence, diagnosis, pathogenesis and treatment. World J Gastroenterol 2012; 18(42): 6036 – 6059.
16. Degaetani M, Tennyson CA, Lebwohl Bet al. Villous atrophy and negative celiac serology: a diagnostic and therapeutic dilemma. Am J Gastroenterol 2013; 108(5): 647 – 653. doi: 10.1038/ ajg.2013.45.
17. Pathological Society, Understanding Disease [online]. Available from: www.pathsoc.org.
18. Bai JC, Fried M, Corazza GR. World Gastroenterology Organisation global guidelines on celiac disease. J Clin Gastroenterol 2013; 47(2): 121 – 126. doi: 10.1097/ MCG.0b013e31827a6f83.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Novinky v roce 2017Článek Gastrointestinální infekceČlánek RealistaČlánek Jaká je Vaše diagnóza?Článek Recenze knihyČlánek Správná odpověď na kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2017 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Czech Working Group for Paediatric Gastroenterology and Nutrition guidelines for diagnostics and treatment of inflammatory bowel diseases in children – 1stedition update
- Léčba vedolizumabem u pacientů s idiopatickými střevními záněty v České republice
- Intraoperačná enteroskopia je bezpečná a je prínosom v určení rozsahu resekčného výkonu pri Crohnovej chorobe
- Možnosti miniinvazivní chirurgie u pacientů s Crohnovou nemocí a ulcerózní kolitidou
- Ustekinumab – nové biologikum v terapii Crohnovy nemoci
- Imunoglobulin G4 asociovaná sklerozující cholangitida u pacienta s Crohnovou nemocí
- Receptorové mechanizmy aktivácie pažerákových nervov kyselinou
- Celiakie, která není celiakií?
- Novinky v roce 2017
- Mění se chirurgická léčba stenotického karcinomu rekta?
- Recenze knihy
- Looking back at the XVth intensive IBD course for doctors and nurses
- 14th Training and Discussion Gastroenterology Days
-
Gastrointestinal infections
Herbert Tilg Lecture – Gastro Update Europe 2016, Prague - Výběr z mezinárodních časopisů
- Realista
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test
- Ginkor Fort® s obsahem extraktu z jinanu dvoulaločnatého
- Jaká je Vaše diagnóza?
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Celiakie, která není celiakií?
- Ginkor Fort® s obsahem extraktu z jinanu dvoulaločnatého
- Mění se chirurgická léčba stenotického karcinomu rekta?
- Možnosti miniinvazivní chirurgie u pacientů s Crohnovou nemocí a ulcerózní kolitidou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



