-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
Outcome of treatment of Helicobacter pylori infection based on microbiological susceptibility testing following the unsuccessful second-line eradication treatment
Introduction:
Helicobacter pylori is the etiological factor of several illnesses and its eradication is a key factor in treatment. Due to increasing resistance to antibiotics, it is necessary to monitor the development of the H. pylori infection and adjust the course of treatment depending on the antibiotic sensitivity of the H. pylori in a given population. The goal of this paper was to evaluate the effects of third-line eradication treatment, based on microbiological examinations and assessments of H. pylori antibiotic sensitivity.Patients and Methods:
The data were collected on a retrospective and non-selective basis from all patients who had been treated at our department using third-line eradication treatment between 2011 and 2015. Antibiotics were selected based on the results of in vitro antibiotic susceptibility tests on biopsy samples of the stomach mucous lining. The effect of the treatment was assessed by performing a biopsy or determining the H. pylori antigen in stool samples.Results:
Third-line eradication was carried out on 38 patients. H. pylori cultivation and assessment of H. pylori antibiotic susceptibility were successful in 31 cases; 23 patients were treated and examined. Eradication was achieved only in three patients, i.e. 7.9% of all cases examined (38).Conclusion:
Third-line eradication treatment has so far been unsatisfactory, despite the use of targeted antibiotic treatment, indicating that efforts should be made to increase the effectiveness of the first or second line of eradication treatment.Key words:
Helicobacter pylori – microbial sensitivity tests – treatment outcome – antibiotics
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
19. 9. 2016Accepted:
29. 9. 2016
Autori: L. Králíček 1; R. Kroupa 2
; A. Ševčíková 3; M. Otrubová 1; V. Kulhánek 1
Pôsobisko autorov: Endoskopické centrum, Nemocnice Milosrdných bratří, p. o., Brno 1; Interní gastroenterologická klinika LF MU a FN Brno 2; Oddělení klinické mikrobiologie, LF MU a FN Brno 3
Vyšlo v časopise: Gastroent Hepatol 2017; 71(4): 304-309
Kategória: Klinická a experimentální gastroenterologie: původní práce
doi: https://doi.org/10.14735/amgh2017csgh.info02Súhrn
Úvod:
Helicobacter pylori je etiologickým faktorem řady onemocnění a jeho eradikace je v indikovaných případech důležitým krokem v jejich terapii. Vzhledem k vyvíjející se rezistenci H. pylori vůči antibiotikům je třeba její průběžná kontrola a úprava terapie na základě výsledků citlivosti H. pylori vůči antibiotikům v dané populaci. Cílem práce je zhodnotit efekt 3. linie eradikační léčby na základě mikrobiologického vyšetření se stanovením citlivosti H. pylori vůči antibiotikům.
Soubor pacientů a metodika: Data byla sbírána retrospektivně a neselektovaně od všech pacientů našeho pracoviště, u kterých byla indikována 3. linie eradikační léčby H. pylori v letech 2011–2015. Antibiotika byla vybírána na podkladě výsledku in vitro citlivosti při mikrobiologickém vyšetření z bioptických vzorků sliznice žaludku. Efekt léčby byl hodnocen buď biopticky, či na základě stanovení antigenu H. pylori ze stolice.Výsledky:
Třetí linie eradikace byla provedena u 38 pacientů. Kultivace a stanovení citlivosti H. pylori bylo úspěšné u 31 z nich a léčeno a zkontrolováno bylo 23 pacientů. Doložitelné eradikace bylo dosaženo pouze u 3 pacientů, tj. 7,9 % z původního počtu 38 testovaných.Závěr:
Výsledky 3. linie eradikační léčby, a to i přes prokazatelně cílenou léčbu antibiotiky, jsou zatím nedostačující. Tento fakt by měl být podnětem pro snahu o využití všech dostupných možností pro zvýšení efektivity, a to již v 1., resp. 2. linii eradikační léčby.Klíčová slova:
Helicobacter pylori – mikrobiální testy citlivosti – efektivita léčby – antibiotikaÚvod
Helicobacter pylori (H. pylori) je spirální, mikroaerofilní, gramnegativní bakterie. Je 2,5–5 μm dlouhá a 0,5–1,0 μm široká. Bakterie má 4–6 bičíků (zhruba 30 μm dlouhých), které jsou nezbytné pro pohyblivost mikroba [1].
Dlouhodobé přežívání mikroba v prostředí žaludku je umožněno produkcí velkého množství ureázy, která štěpí močovinu na oxid uhličitý a amoniak, jenž neutralizuje žaludeční kyseliny [2].
Infekce H. pylori je jedna z celosvětově nejrozšířenějších infekcí vůbec. Odhaduje se, že touto bakterií je infikováno 50–80 % světové populace, přičemž je zde výrazný kontrast mezi ekonomicky vyspělými zeměmi západní Evropy a Severní Ameriky, kde je prevalence asi 10–30 %, a zeměmi rozvojovými, kde je infikováno až 95 % dospělé populace [1,3].
Prevalence infekce H. pylori v ČR, podobně jako v ostatních vyspělých zemích, postupně klesá. V roce 2001 činila v ČR 42 %, zatímco v roce 2011 to bylo 24 % [1,3,4].
Přenos infekce je možný fekálně-orální, orálně-orální a gastro-orální cestou (v souvislosti s gastroezofageálním refluxem), z matky na dítě či mezi sourozenci [2]. Způsob přenosu infekce souvisí s vyšší prevalencí v nižších socioekonomických vrstvách obyvatel.
Indikace k terapii infekce H. pylori
V souladu s doporučením České gastroenterologické společnosti jsou uváděny tyto jednoznačné indikace [5]:
- Vředová choroba žaludku a dvanáctníku – eradikace je indikována ve všech stadiích onemocnění (aktivní, neaktivní, s komplikacemi či bez nich, stavy po operaci pro vředovou chorobu).
- MALT lymfom žaludku – eradikace přispěje k navození dlouhodobé remise onemocnění.
- Rakovina žaludku – nejen u stavů po operaci karcinomu žaludku, ale i u příbuzných 1. řádu pacientů s karcinomem žaludku. H. pylori je dle WHO kancerogen 1. třídy.
- Refluxní choroba jícnu – zejména u pacientů, kteří mají současně vředovou chorobu (aktuální či v anamnéze). Maastrichtský konsenzus IV doporučuje eradikaci H. pylori u osob s refluxní chorobou jícnu při dlouhodobé léčbě inhibitory protonové pumpy (IPP) (k zabránění vzniku atrofické gastritidy). Přičemž dle nových poznatků eradikace H. pylori nezhorší již existující refluxní chorobu jícnu nebo efekt léčby [6].
- Dlouhodobá léčba nesteroidními antiflogistiky – zejména u osob s vředovou chorobou gastroduodena v anamnéze či u osob s vyšším rizikem (ženy starší 60 let, současná léčba glukokortikosteroidy nebo warfarinem, kuřáci). Tato léčba může snížit riziko vzniku peptických ulcerací.
- Chronická atrofická gastritida H. pylori pozitivní – již vzhledem k vyššímu riziku výskytu rakoviny žaludku.
- Gastrická intestinální metaplazie, kde se v souvislosti s eradikací předpokládá zpomalení její progrese do dysplazie a karcinomu [7].
- Jaterní cirhóza – eradikace H. pylori je indikována (po individuálním posouzení pacienta). Riziko peptického vředu je u H. pylori pozitivních nemocných s jaterní cirhózou 40× vyšší ve srovnání s negativními. Komplikace peptického vředu, zejména krvácení, by mohlo mít pro pacienta fatální následky [5].
- Ménétrierova choroba – udává se, že prevalence infekce H. pylori u pacientů s Ménétrierovou chorobou je až 90 %, a že eradikace může vést k regresi endoskopického nálezu a vymizení příznaků [8].
- Funkční dyspepsie – eradikace H. pylori není zcela jednoznačně indikována. Je nutné individuální posouzení každého pacienta po předchozím pečlivém gastroenterologickém vyšetření a vyloučení dalších možných příčin dyspeptických potíží. Jedná se o důležité téma již vzhledem k faktu, že prevalence dyspepsie horního typu se pohybuje v západních zemích kolem 25 % (7–41 %) [9]. Údaje v literatuře jsou rozporuplné. Dle některých autorů infekce H. pylori u nemocných s funkční dyspepsií neovlivňuje kvalitu jejich života [10]. Toto potvrzuje i zjištění, že zatímco prevalence infekce H. pylori ve vyspělých zemích klesá, prevalence funkční dyspepsie horního typu je stacionární, nebo dokonce mírně narůstá. Na druhou stranu se uvádí, že část pacientů (cca 10 %) může z této léčby profitovat [11].
- Eradikace z důvodu extraintestinálních chorob (sideropenická anémie, deficit vitaminu B12, idiopatická trombocytopenická purpura, kopřivka aj.) je možná [6] a záleží na individuálních okolnostech (zejména s ohledem na nález při gastroskopii) a na zvážení lékaře. Je nutno také respektovat volbu poučeného pacienta.
Terapie
Prakticky žádná navržená eradikační léčba nevykazuje 100% úspěšnost, nicméně je třeba volit takové režimy, které dosahují v klinických studiích alespoň 80% účinnost [5]. Pokud pacient není alergický na penicilin, měl by být základem terapie amoxicilin. Rezistence H. pylori na toto antibiotikum (ATB) je totiž výjimečná. Důležitým faktorem ve volbě léčebného režimu je také míra rezistence H. pylori vůči klaritromycinu v dané populaci – v našich podmínkách se rezistence vůči klaritromycinu pohybuje kolem 30 % [1]. Navíc, zejména v dnešní době, je nutné také zohlednit zemi původu pacienta a míru výskytu rezistence na ATB v jeho domovině.
1. linie
Léčebným schématem první volby je podávání IPP v kombinaci s amoxicilinem (2 × 1 000 mg) a klaritromycinem (2 × 500 mg) nebo metronidazolem (2 × 500 mg) po dobu 7 dní. V případě alergie na penicilinová ATB je obvykle s IPP podáván klaritromycin a metronidazol [1,5]. Jako výhodná alternativa se v poslední době ukazuje tzv. sekvenční terapie, která dle dosavadních poznatků vykazuje ve srovnání se standardní léčbou asi o 10–20 % lepší účinnost, a to hlavě proto, že překonává problémy narůstající ATB rezistence (zejména vůči klaritromycinu) a vykazuje méně nežádoucích účinků. V první fázi se podává IPP spolu s amoxicilinem (ve standardních dávkách) po dobu 5 dní. Na tuto fázi bezprostředně navazuje podávání IPP spolu s dalšími dvěma ATB – klaritromycinem a metronidazolem po dobu dalších 5 dní (opět ve standardních dávkách) [1,12].
2. linie
Po prvním selhání je vhodné a po druhém již nezbytné využití mikrobiologického vyšetření ke stanovení citlivosti na ATB [6]. V případě testování citlivosti na ATB se již po prvním selhání doporučuje podání IPP s amoxicilinem a druhé ATB doplnit na základě výsledků citlivosti [5]. Alternativou 2. linie je též využití dvojkombinace IPP + amoxicilin po dobu 2 týdnů [1]. Pouze v zahraničí, resp. formou mimořádného dovozu, je dostupná terapie čtyřkombinací s koloidním bizmutem či bizmut-citrátem [5]. V ČR má registraci preparát Pylera (kombinace bizmut-citrátu, tetracyklinu a metronidazolu), který však nemá úhradu. Na mimořádný dovoz a přímou úhradu pacientem je dostupný levofloxacin.
Cíl
Cílem naší práce bylo retrospektivně analyzovat úspěšnost eradikace H. pylori založené na provedení kultivace a testu citlivosti u pacientů po neúspěšné 2. linii léčby a zhodnotit výsledky a faktory, které efektivitu této eradikační terapie ovlivňují.
Soubor pacientů a metodika
Data byla sbírána retrospektivně od pacientů endoskopovaných na Endoskopickém centru Nemocnice Milosrdných bratří v Brně, jejichž vzorek byl odeslán k mikrobiologickému vyšetření na mikrobiologické oddělení FN Brno, a to neselektovaně, u všech pacientů indikovaných k eradikační léčbě po 2. neúspěšné linii v rozmezí let 2011–2015. Všechna data byla dále anonymně zpracována v souhrnné podobě. Pacienti podepsali informovaný souhlas s vyšetřením a odběrem vzorku v rámci běžné klinické praxe. Provedená studie nijak neovlivňovala standardní diagnostický a léčebný postup.
Ze sledovaných faktorů byly zaznamenávány údaje o pohlaví, věku pacientů, indikaci k eradikační léčbě, alergiích na ATB, spotřebě nesteroidních antirevmatik a o kouření.
Pacienti byli zváni na přesný čas tak, aby byl odběr vzorků bezprostředně následován transportem na mikrobiologické oddělení. Odebírány byly vždy alespoň dva vzorky sliznice z antra a z těla žaludku, které byly ihned po odběru aplikovány do lahviček s thioglykolátovým bujónem, aby bylo zabráněno vyschnutí a zajištěno mikroaerofilní prostředí. Transport vzorků byl prováděn při pokojové teplotě. Materiál v laboratoři byl ihned zpracován, nejlépe do 4 hod po odběru. Odebrané vzorky sliznice byly sterilně rozdrceny, byl připraven mikroskopický preparát, proveden ureázový test – URE-HPtest (Lachema) a současně byly vzorky vyočkovány na dvě kultivační půdy – Columbia agar s 10 % koňských krvinek (Merck). Jedna půda bez ATB, druhá s přidáním H. pylori Selective Supplement (Oxoid) obsahující ATB (vankomycin, trimetoprim, cefsulodin) a antimykotikum (amphotericin). Vzorky byly kultivovány v mikroaerofilním prostředí v anaerostatu s generátorem plynů CampyGen (Oxoid) při teplotě 35–37 °C celkem 7 dnů. Misky byly odečítány po 3 a 7 dnech. U vykultivovaného kmene H. pylori byla stanovena citlivost na ATB kvantitativně pomocí E-testu. Z ATB byl testován amoxicilin, klaritromycin, tetracyklin, metronidazol a ciprofloxacin. Petriho misky s E-testy byly odečítány po 3 dnech.
Na základě citlivosti a s ohledem na alergie těchto pacientů jsme poté podávali léčbu dvojkombinací ATB spolu s IPP v dávce ekvivalentní 2 × 20 mg omeprazolu, a to po dobu 10–14 dní. Úspěch eradikace byl poté kontrolován s odstupem 5 týdnů, a to dle potřeby buď biopticky, či vyšetřením antigenu H. pylori ve stolici.
K souhrnné prezentaci výsledků byla použita popisná statistika.
Výsledky
Celkem bylo do našeho pozorování zahrnuto 38 pacientů po 2. neúspěšné eradikační léčbě. Z toho 31 žen a 7 mužů, průměrného věku 47,7 let v době vyšetření. Nejstaršímu pacientovi bylo v době vyšetření 74 let, nejmladšímu 20 let. (tab. 1). Z celkového počtu 38 pacientů se H. pylori podařilo vykultivovat a následně stanovit citlivost na ATB u 31 pacientů (81,6 %). U části z těchto pacientů se však pro polyvalentní alergie nepodařilo nalézt vhodnou kombinaci k eradikační léčbě. Léčeno proto bylo celkem 27 pacientů (71,1 %). Z tohoto počtu se 4 pacienti nedostavili ke kontrole eradikace. Léčeno a zkontrolováno tedy bylo 23 pacientů (60,5 %), jejichž výsledky mohly být zahrnuty do pozorování (tab. 2).
Tab. 1. Charakteristika souboru pacientů. Tab. 1. Characteristics of patients included in the study. 
Tab. 2. Souhrnné výsledky eradikační léčby <i>H. pylori</i> 3. linie. Tab. 2. Summary of the results of third-line eradication treatment for <i>H. pylori</i>. 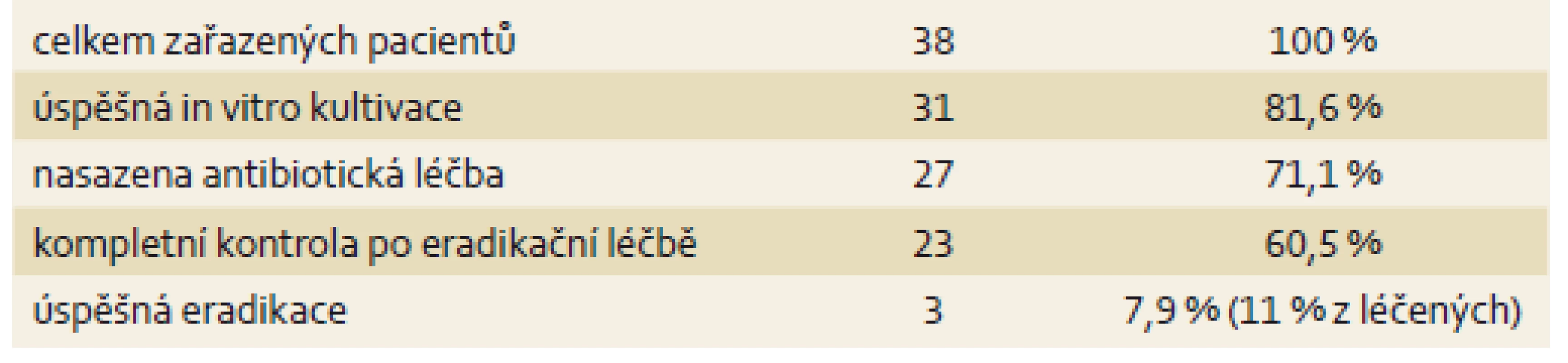
K dokreslení představy o tom, jak malého zlomku pacientů se tato problematika týká, lze uvést, že ve sledovaném období v letech 2011–2015 bylo na našem pracovišti provedeno celkem 13 588 gastroskopií.
Nejčastější indikací k eradikační léčbě byla vředová choroba gastroduodena (44,7 %), dále dyspepsie (39,5 %). Ostatní indikace, tj. refluxní nemoc jícnu, atrofická gastritida a intestinální metaplazie, byly v menšině (15,8 %) (tab. 3).
Tab. 3. Indikace k eradikační léčbě. Tab. 3. Indications for eradication treatment. 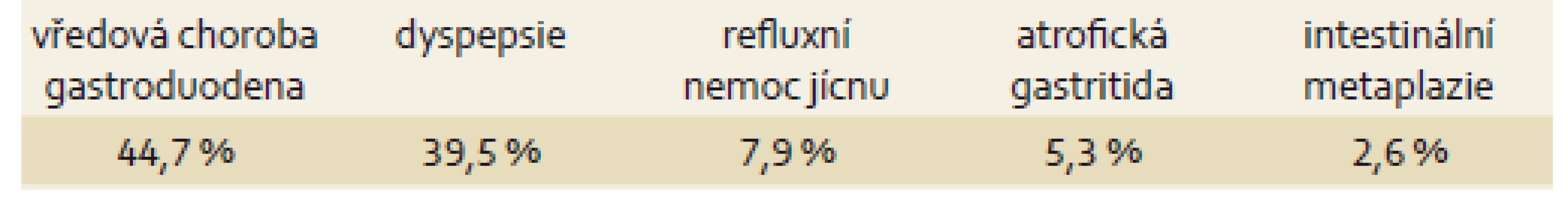
Eradikační léčba zahrnovala IPP (omeprazol nebo pantoprazol) podávaný 2× denně ve standardní dávce a dvě ATB, vše po dobu 10–14 dní. Při terapii byl nejčastěji používaným ATB amoxicilin (2 × 1 000 mg), a to celkem 18×, dále byl použit 16× ciprofloxacin (2 × 500 mg), 14× doxycyklin (2 × 100 mg), 5× metronidazol (3 × 250 mg) a 1× klaritromycin (2 × 500 mg) (tab. 4).
Tab. 4. Použitá antibiotika u eradikace. Tab. 4. Antibiotics used in the course of eradication therapy. 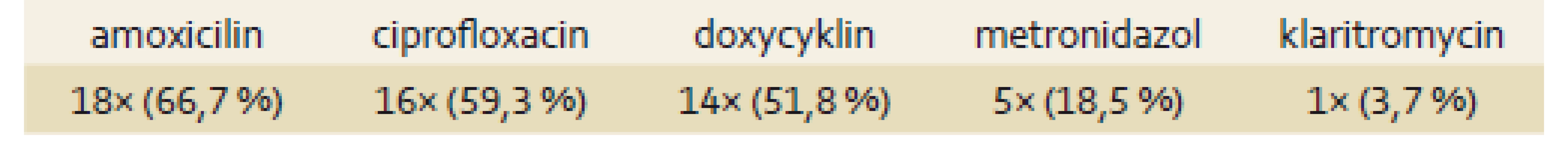
Kultivace H. pylori a testování in vitro citlivosti na ATB bylo úspěšné u 31 pacientů, kteří již předtím podstoupili neúspěšně 2. linii eradikační léčby. U všech testovaných osob byl H. pylori citlivý na amoxicilin a tetracyklin (100 %). Důležité je též poměrně vysoké procento citlivosti na ciprofloxacin (79,2 %) a naopak nízké procento citlivosti na klaritromycin (10,5 %) (tab. 5).
Tab. 5. Procentuálně vyjádřená míra citlivosti <i>H. pylori</i> na antibiotika u testovaných pacientů po neúspěšné 2. linii eradikační léčby. Tab. 5. Antimicrobial susceptibility of <i>H. pylori</i> in tested subjects following the unsuccessful second-line eradication treatment. 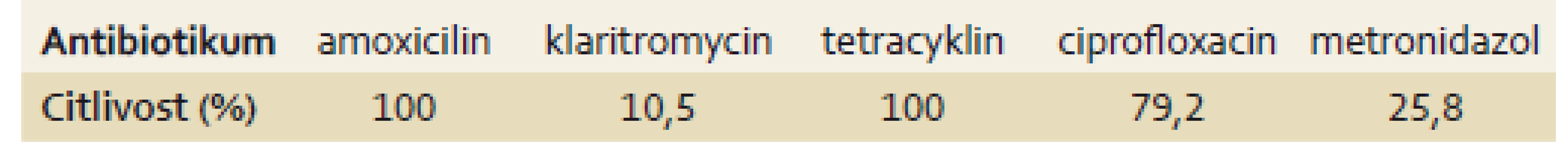
Konečným výstupem je míra úspěšně eradikovaných pacientů na základě cílené eradikační léčby. I když byla podávána ATB na základě citlivosti, doložitelné eradikace bylo dosaženo pouze u 13 % z léčených a zkontrolovaných pacientů, což odpovídá 7,9 % z původního počtu 38 testovaných.
Diskuze
Naše práce popisuje efektivitu eradikační léčby H. pylori založené na stanovení in vitro citlivosti bakterie u pacientů, kteří byli k eradikaci indikováni i přes dva předchozí neúspěšné pokusy o eradikaci.
Vzhledem k obtížnější dostupnosti mikrobiologického vyšetření na našem pracovišti vyplývající především z nutnosti zajištění rychlého transportu bioptovaného vzorku na mikrobiologické pracoviště (kterým naše nemocnice nedisponuje) jsme se rozhodli standardně provádět mikrobiologické vyšetření až po neúspěšné 2. linii eradikační léčby (v souladu s Maastrichtským konsenzem IV) [6].
Výsledky eradikační léčby v našem souboru mohou být významně ovlivněny selekcí pacientů k odběru vzorku k mikrobiologickému testování se záměrem následné cílené eradikační léčby. U významné části nemocných s teoretickou indikací k eradikaci bylo na základě předchozí neúspěšné terapie a možných nežádoucích a nepříjemných účinků ATB léčby od dalšího pokusu o eradikaci H. pylori upuštěno. Na druhou strany byli v souboru zahrnuti pacienti, u nichž lze o indikaci a efektu eradikační terapie pochybovat, nicméně po společné domluvě pacienta a lékaře byli k této terapii indikováni. V našem souboru převažovaly ženy, stejně jako u ostatních autorů [13,14]. U žen je popisován vyšší výskyt rezistentních kmenů H. pylori, což vede častěji k opakované neúspěšné terapii. V naší skupině bylo 34,2 % pravidelných kuřáků, což je znatelně více než procento kuřáků v neselektované populaci (podle výzkumu z roku 2011 lze v ČR za pravidelné kuřáky označit 24,2 % občanů [15]), což je v souladu s údaji o významném vlivu kouření na infekci H. pylori a jeho eradikaci [1].
Dalším zajímavým, ale nikoli neočekávaným faktem je, že ve skupině pacientů po 2. neúspěšné eradikační léčbě je 30 % pacientů s anamnézou alergie na penicilinové ATB, což je opět významně vyšší hodnota než u neselektované populace (alergie na penicilinová ATB se bez ohledu na typ alergické reakce vyskytuje u 0,7−10 % populace [16]). Tento fakt poukazuje na velký význam amoxicilinu v eradikační léčbě H. pylori a zhoršené možnosti úspěšné léčby, pokud toto ATB nelze použít [17].
Z pohledu indikací k eradikační léčbě je na první pohled nápadné vysoké procento pacientů indikovaných pro dyspeptické potíže, konkrétně 39,5 %. Zde je důležité si uvědomit, o jak malý zlomek z celkově vyšetřených pacientů na našem pracovišti jde, a také to, že se v těchto případech většinou jedná o pacienty již prošetřené celou řadou diagnostických metod, u kterých byly zkoušeny různé způsoby terapie bez efektu. Často jsou to také pacienti s obavami z možného karcinogenního potenciálu H. pylori.
Nízká úspěšnost eradikační terapie vedené dle citlivosti je v našem souboru překvapivá. Zahraniční pracoviště uvádějí úspěšnost až v 70 % [17]. Příčiny lze zřejmě hledat v limitované velikosti souboru, který mohou tvořit právě vyselektovaní pacienti, kteří měli potíže již s předchozí léčbou. Nejčastější příčinou selhání léčby je nedostatečná compliance pacienta [1,5]. Pokud vynechá více než třetinu předepsané medikace, úspěšnost eradikace výrazně klesá [1]. Proto by ke zlepšení výsledků měla vést snaha o co nejlepší informovanost a s tím ruku v ruce jdoucí motivaci pacienta. Dobrá informovanost pacienta zahrnující i podrobnější odpověď na otázku, proč je pacient léčen, vyžaduje samozřejmě čas navíc, který se ale ve výsledku vyplatí. Dále je důležitá volba co nejjednodušších léčebných schémat se snahou o minimalizaci nežádoucích účinků.
Při podrobnějším zkoumání získaných dat se ukázalo, že mezi pacienty, u kterých byla 3. linie eradikační léčby úspěšná, nebyl žádný z pacientů indikovaných pro dyspepsii, naopak všichni tito pacienti byli indikováni pro vředovou chorobu gastroduodena. Tuto informaci je však třeba brát s velkou rezervou vzhledem k malému souboru pacientů.
Jak vyplývá z literatury i z našeho pozorování, důležitým faktorem je též míra rezistence na ATB v dané populaci.
Dalším a mnohdy obtížně ovlivnitelným faktorem je kouření, které může účinek léčby též významně snížit. I o tom je důležité pacienty informovat.
Příčinou selhání eradikační léčby může být také skutečnost, že někteří pacienti v důsledku polymorfizmu genů kódujících enzymatickou transformaci zvýšeně metabolizují některé IPP, proto je při opakované léčbě vhodné zvolit jiný IPP ve vysoké dávce [8].
Bohužel retrospektivně nelze zjistit, jaká byla reálná compliance v průběhu předepsané ATB terapie u našich pacientů, zda bylo dodrženo doporučené dávkování a doba léčby. Je možné, že pacient, který měl potíže se správným užíváním předchozí léčby, a tato proto selhala, bude mít potíže i s terapií cílenou. Též individuální vlastnosti ovlivňující vstřebávání a metabolizmus léků zůstaly stejné.
U námi popisovaných případů hraje také důležitou roli fakt, že se jedná o skupinu pacientů s vyselektovanou populací H. pylori významně rezistentní na užívaná ATB. Naše možnosti vybrat terapii srovnatelnou s publikovanými zahraničními daty jsou velmi omezené. Prakticky většina léků používaných v dalších liniích léčby je obtížně dostupná až nedostupná v podmínkách běžného gastroenterologického pracoviště. Proto jsme v souladu s domácími doporučeními používali dostupné alternativy jako ciprofloxacin a doxycyklin. Výsledky dosažené s těmito preparáty nemusí být tedy srovnatelné.
Doporučení
S ohledem na výše uvedené indikace je třeba zdůraznit, že vyšetření na H. pylori bychom měli provádět pouze u těch pacientů, u kterých je případná eradikační léčba indikována. V ostatních případech je již samo prvotní vyšetření na H. pylori zbytečné a vede k terapeutickým rozpakům.
V tomto ohledu by bylo u některých pacientů po první neúspěšné eradikační léčbě také vhodné opětovné zhodnocení indikace k eradikační léčbě a v případě sporných indikací, jako je tomu v případě dyspeptických potíží, již od dalších eradikačních pokusů upustit.
U pacientů indikovaných ze závažných a jednoznačných důvodů naopak stojí za to se pokusit o eradikační léčbu i některými nestandardními postupy. V zahraniční literatuře je zmiňována možnost využití rifabutinu, která je však v našich podmínkách nepřípustná [1] vzhledem k potřebě vyhradit rifabutin k léčbě tuberkulózy. Obhájit tuto léčbu by snad bylo možné ve zvlášť závažných případech, po vyčerpání ostatních možností, po otestování citlivosti, vyloučení infekce tuberkulózy a po konzultaci s mikrobiologem. Alternativou je také terapie čtyřkombinací s koloidním bizmutem či bizmut-citrátem, který může být dovezen ze zahraničí. V literatuře je též popisována terapie s furazolidonem [18].
Jako vhodná se jeví již výše popsaná sekvenční terapie, která by, pokud je to možné, měla být doporučována jako léčba první volby. To zejména vzhledem k rostoucí rezistenci vůči klaritromycinu. Ke zvážení bychom také doporučili testování citlivosti na ATB již po selhání 1. linie eradikační léčby, které by mohlo významně zvýšit účinnost 2. linie.
U vybraných pacientů by bylo jistě možné doporučit jako doplňkovou léčbu ke standardní terapii též některý z přírodních přípravků, což by u některých mohlo mít příznivý vliv jak na samotnou eradikační terapii, tak i na compliance pacienta. V zahraniční literatuře je popisován zejména efekt propolisu, dále pak olivového oleje, černuchy seté (černý kmín), brusinek, meruňky japonské, skořice a kurkumy [19]. V literatuře je popisován také účinek česneku, zatím však prokázaný pouze in vitro [20]. Důležitým faktorem jsou také probiotika, která krom redukce nežádoucích účinků kombinované ATB terapie mohou mít dle některých autorů příznivý vliv i na efektivitu samotné eradikace. V tomto smyslu jsou však literární údaje nejednotné [21–25].
Při snaze o srovnání našich dat s dostupnou literaturou se nám nepodařilo nalézt žádnou podobně koncipovanou studii z českého prostředí, většinou byla porovnávána účinnost v závislosti na složení ATB v eradikačních režimech. Bylo by zajímavé v budoucnu podobně koncipovanou studii zrealizovat v rámci širšího výzkumu za spolupráce více pracovišť. Na takovém podkladě by bylo možné doporučit efektivní používání mikrobiologického vyšetření H. pylori v gastroenterologické praxi a zhodnotit reálné možnosti 3. a další linie eradikační terapie v národních podmínkách.
Závěr
Výsledky 3. linie eradikační léčby, a to i přes mikrobiologické vyšetření s testováním citlivosti na jednotlivá ATB, jsou nedostačující.
Cílem by tedy měla být spíše snaha o vyšší účinnost již 1., resp. 2. linie s ohledem na aktuální výskyt rezistence H. pylori vůči ATB v dané populaci, a také snaha o dostatečnou informovanost pacientů, a tedy i dobrou compliance, a pečlivá volba pacientů, které indikujeme k eradikační léčbě, resp. k vyšetření na přítomnost infekce H. pylori.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 19. 9. 2016
Přijato: 29. 9. 2016
MUDr. Lukáš Králíček
Endoskopické centrum
Nemocnice Milosrdných bratří
Polní 3
639 00 Brno
lukas.kralicek@centrum.cz
Zdroje
1. Kopáčová M, Seifert B. Co je nového v léčbě infekce Helicobacter pylori? – komentář. Medicína po promoci 2015; 16 (4): 280–283.
2. Sýkora J. Helicobacter pylori a gastrointestinální projevy u dětí. Pediatr pro Praxi 2006; 7 (2): 74–79.
3. Bureš J, Kopáčová M, Koupil I et al. Significant decrease in prevalence of Helicobacter pylori in the Czech Republic. World J Gastroenterol 2012; 18 (32): 4412–4418. doi: 10.3748/wjg.v18.i32.4412.
4. Bureš J, Kopáčová M, Koupil I et al. Epidemiology of Helicobacter pylori infection in the Czech Republic. Helicobacter 2006; 11 (1): 56–65.
5. Bureš J, Dítě P, Fixa B et al. Infekce Helicobacter pylori. Doporučený postup České gastroenterologické společnosti ČLS JEP pro dospělé. [online]. Dostupné z: www.cgs-cls.cz/wp-content/uploads/2015/04/guidelines-infekce-helicobacter-pylori.pdf.
6. Malfertheiner P, Megraud F, O’Morain CA et al. Management of Helicobacter pylori infection: the Maastricht IV/Florence Consensus report. Gut 2012; 61 (5): 646–664. doi: 10.1136/gutjnl-2012-302084.
7. Falt P, Hanousek M, Kundrátová E et al. Prekancerózy žaludku. Klin Onkol 2013; 26 (Suppl): S22–S28.
8. Pročke M. Současný pohled na eradikaci Helicobacter pylori. Lékařské listy 2010; 59 (5): 5–7.
9. Rejchrt S. Prevalence a sociodemografická charakteristika dyspepsie v České republice. 1. vyd. Hradec Králové: Nucleus HK 2005 : 96.
10. Fixa B, Komárková O, Nožička Z. Dlouhodobé sledování nemocných s funkční žaludeční dyspepsií. Závislost obtíží na infekci Helicobacter pylori? Čes a slov Gastroent a Hepatol 2002; 56 (5): 171–176.
11. Rejchrt S, Koupil I, Kopáčová M et al. Epidemiologie dyspepsie. Vnitř Lék 2014; 60 (7–8): 649–656.
12. Kopáčová M, Bureš J. Sekvenční léčba Helicobacter pylori. Folia Gastroenterol Hepatol 2009; 7 (2): 82–84.
13. Draeger S, Wüppenhorst N, Kist M et al.Outcome of second-and third-line Helicobacter pylori eradication therapies based on antimicrobial susceptibility testing. J Antimicrob Chemother 2015; 70 (11): 3141–3145. doi: 10.1093/jac/dkv223.
14. Wüppenhorst N, Draeger S, Stüger HP et al. Prospective multicentre study on antimicrobial resistence of Helicobacter pylori in Germany. J Antimicrob Chemother 2014; 69 (11): 3127–3133. doi: 10.1093/jac/dku243.
15. Sovinová H, Sadílek P, Csémy L. Vývoj prevalence kuřáctví v dospělé populaci ČR názory a postoje občanů ČR k problematice kouření (období 1997–2010). Výzkumná zpráva. Praha: Státní zdravotní ústav 2012. Dostupné z: http: //www.szu.cz/uploads/documents/czzp/zavislosti/koureni/zprava-kuractvi-2011.pdf.
16. Hlinka I, Hlinková B. Riziko skríženej alergie cefalosporíny u pacientov alergických na penicilíny. Alergie 2014; 16 (2): 22–23.
17. Gisbert JP, Barrio J, Modolell I et al. Helicobacter pylori first-line and rescue treatments in the presence of penilillin allergy. Dig Dis Sci 2015; 60 (2): 458–464. doi: 10.1007/s10620-014-3365-2.
18. Graham DY, Lee YC a Wu MS. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicine-based evidence. Clin Gastroenterol Hepatol 2014; 12 (2): 177–186. doi: 10.1016/j.cgh.2013.05.028.
19. Murali MR, Naveen SV, Son CG. Current knowledge on alleviating Helicobacter pylori infections through the use of some commonly known natural products: bench to bedside. Integr Med Res 2014; 3 (3): 111–118.
20. Sovová M, Sova P. Farmaceutický význam Alliumsativum L. 2. Antibakteriální účinek. Ceska Slov Farm 2002; 51 (1): 11–16.
21. Boltin D. Probiotics in Helicobacter pylori-induced peptic ulcer disease. Best Pract Res Clin Gastroenterol 2016; 30 (1): 99–109. doi: 10.1016/j.bpg.2015.12.003.
22. Lu C, Sang J, He H et al. Probiotic supplementation does not improve eradication rate of Helicobacter pylori infection compared to placebo based on standard therapy: a meta-analysis. Sci Rep 2016; 6 : 23522. doi: 10.1038/srep23522.
23. Danq Y, Reinhardt JD, Zhou X et al. The effect of probiotics supplementation on Helicobacter pylori eradication rates and side effects during eradication therapy: a meta-analysis. PLoS One 2014; 9 (11): e111030. doi: 10.1371/journal.pone.0111030.
24. Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment. Aliment Pharmacol Ther 2010; 32 (9): 1069–1079. doi: 10.1111/j.1365-2036.2010.04457.x.
25. Zhang MM, Qian W, Qin YY. Probiotics in Helicobacter pylori eradication therapy: a systematic review and meta-analysis. World J Gastroenterol 2015; 21 (14): 4345–4357. doi: 10.3748/wjg.v21.i14.4345.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Recenze knihyČlánek Správná odpověď na kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2017 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Klinická a experimentální gastroenterologie
- Malé příznaky kontrastující s velkým a progredujícím endoskopickým nálezem
- Vplyv nitroglycerínu na manometrické parametre u pacientov s achaláziou
- Sérové koncentrace S100P proteinu u pacientů s kolorektálním karcinomem
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Protézoduodenální píštěl – příčina masivního krvácení do gastrointestinálního traktu
- Současné postavení telemedicíny v péči o pacienty s idiopatickými střevními záněty
-
Komentář k článku
Biosimilární infliximab v terapii anti-TNF naivních pacientů s IBD – jednoleté klinické sledování - Možnosti použitia neinvazívnych metód pri nealkoholovej tukovej chorobe pečene
- Adenokarcinom tenkého střeva jako neobvyklý zdroj hypochromní anémie
- Akutní apendicitida – vzácná komplikace koloskopie
- Epidemiologická studie obezity v populaci rozdílného rasového, kulturního, ekonomického a dietního prostředí
- Recenze knihy
- 35th Slovak and Czech Gastroenterological Congress and 39th Slovak and Czech Endoscopic Days
-
Endoscopic achievements in the upper gastrointestinal tract and small bowel
Christian Ell Lecture – Gastro Update Europe 2017, Vienna -
Komentář k lékovému profilu
Rifaximin – terapeutické vlastnosti - Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Remsima® – první biosimilární infliximab CT-P13
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výsledky terapie infekce Helicobacter pylori na základě mikrobiologického vyšetření po selhání 2. linie eradikační léčby
- Samoexpandibilní potahovaný metalický stent Daniš jako bridging k transplantaci jater
- Malé příznaky kontrastující s velkým a progredujícím endoskopickým nálezem
- Akutní apendicitida – vzácná komplikace koloskopie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



