-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Covid-19 a hepatogastroenterologie
Covid-19 and hepato-gastroenterology
The new coronavirus disease (covid-19) pandemic has become a global health and social issue with specific context in gastroenterology and hepatology. The organisational and restrictive measures are similar to those in other instrumental specialties and include the protection of patients and staff in reaction to the current epidemiological situation and presumed infection route. In addition to this specific protection, the effects of covid-19 on other aspects of the field leading to potential limitation of health care and adversely affecting other diseases must be minimised. In endoscopy, this protection is predominantly oral in focus due to the respiratory route of the infection; transmission through excrement and instruments is possible but insignificant. Gastrointestinal and liver manifestations of the infection represent a significant part of the overall symptomatology and may correlate with the severity of the disease. Covid-19 does not deteriorate the course of inflammatory bowel disease (IBD) and likewise, the immunosuppressive and biological treatment of IBD patients does not worsen in the course of the infection. Higher mortality was reported with corticosteroid therapy. The combination of liver disease and covid-19 is under investigation. Viral hepatitis does not represent a significant risk; however, non-alcoholic steatohepatitis and advanced liver cirrhosis are risk factors. The available data on the effects of transplantation are sporadic; its insignificance is further supported by our own experience at IKEM as well as documented data on renal insufficiency and kidney transplant, which show a higher risk. Furthermore, interactions of antiviral and immunosuppressive drugs are being investigated. Atazanavir, lopinavir and to a lesser extent chloroquine and hydrochloroquine are not considered to be suitable. On the other hand, there are no considerable interactions with remdesivir.
Keywords:
covid-19 – digestive endoscopy – nonspecific intestinal inflammation – immunosuppression – biological treatment – viral hepatitis – non alcoholic fatty liver disease (NAFLD) – liver cirrhosis – liver transplantation
Autori: Julius Špičák
Pôsobisko autorov: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha
Vyšlo v časopise: Gastroent Hepatol 2020; 74(5): 415-423
Kategória:
Súhrn
Nová pandemie koronavirem covid-19 se stala globálním zdravotním a sociálním problémem s konkrétními souvislostmi v oblasti gastroenterologie a hepatologie. Organizační a restriktivní opatření se neliší od ostatních instrumentálních oborů a zahrnují ochranu nemocných i personálu v bezprostřední reakci na momentální epidemiologickou situaci a předpokládaný způsob šíření infekce. Vedle této konkrétní ochrany je třeba minimalizovat vliv na ostatní oblasti oboru vedoucí potenciálně k omezení péče a tedy k negativnímu ovlivnění jiných chorob. V provozu endoskopie je ochrana specificky zaměřena na dominantně orálně-respirační šíření infekce, přenos exkrementy a instrumenty je možný nicméně reálně nevýznamný. Gastrointestinální a hepatologická manifestace infekce je významnou součástí symptomatologie a její hodnota může korelovat s tíží onemocnění. Covidová infekce nezhoršuje průběh nespecifických střevních zánětů a jejich imunosupresivní a biologická léčba naopak nezhoršuje průběh infekce. Vyšší mortalita byla zaznamenána v případě léčby kortikoidy. Podrobně se zkoumá souběh covid-19 a jaterních chorob. Vliv na virové hepatitidy je marginální, rizikovým faktorem je nealkoholická steatohepatitida a pokročilá jaterní cirhóza. Údaje o vlivu na transplantace jsou sporadické a nevýznamnost podporují i autentické zkušenosti IKEM, stejně jako dokumentovanou realitu, že větším rizikem jsou renální insuficience a transplantace ledvin. Zvažují se interakce potenciálních antivirotik a imunosupresiv a jako nevhodná antivirotika se považují atazanavir, lopinavir, v menší míře chlorochin a hydrochlorochin, zatímco remdesivir výraznější interakce nevykazuje
Klíčová slova:
covid-19 – digestivní endoskopie – nespecifické střevní záněty (NSZ) – imunosuprese – biologická léčba – virová hepatitida – non alcoholic fatty liver disease (NAFLD) – jaterní cirhóza – transplantace jater
Koronaviry až do roku 2002 v zásadě nepoutaly větší pozornost, byť běžně postihovaly jak zvířata, tak lidskou populaci, tu ovšem pouze pod obrazem banálního nachlazení. První závažná epidemie SARS (severe acute respiratory syndrome, SARS-CoV) infikovala více než 8 000 lidí ve 32 zemích a vyžádala si 919 obětí. V roce 2013 byla u muže zemřelého v Saúdské Arábii na pneumonii identifikována infekce Middle East respiratory coronavirus (MERS-CoV). Infekce zasáhla 27 zemí a postihla 2 494 nemocných, z nichž 854 (34,4 %) zemřelo. Současná infekce vypukla v prosinci předchozího roku v provincii Wuhan v Číně opět primárně jako ložiskový výskyt pneumonie těžkého průběhu. Virus byl charakterizován jako SARS-CoV-2 patřící do subgenu Sarbecovirus v rámci genu Batacoronavirus. Následovaly známé drastické sanační a politické důsledky, čímž došlo k lokální kontrole infekce, která se již nicméně rozšířila do celého světa. Záměrným sekundárním cílem byla likvidace wuhanského politického konkurenčního centra, přičemž epidemie posloužila jako záminka. Stejný virus byl izolován u několika zvířat včetně netopýrů, z čehož vyplynuly teorie o zvířecích vektorech, přičemž méně věrohodné spekulace odkazují na možný únik z laboratoře, případně umělou genezi viru. Původ viru dal jméno pandemii: COrona Virus Disease 2019 (covid-19). Pandemie covid-19 změnila způsob existence lidské společnosti jako žádná jiná událost od druhé světové války ani ne tak bezprostředními zdravotními důsledky jako následnými hygienickými a dalšími sekundárními opatřeními. Podobně zaměřená úvaha bývá vždy doprovázena aktuálními číselnými údaji. V tomto případě je třeba brát veškeré informace s rezervou, protože vývoj je natolik dynamický, že v době vydání může být epidemiologická situace značně jiná. V době psaní zahrnul počet infikovaných osob, který se stále urychluje, na 24 milionů, z nichž 840 000 zemřelo. Světové písemnictví aktuálně obsahuje na 50 000 vědeckých prací, přičemž počet českých příspěvků se blíží jedné stovce. Nezodpovězen zůstává zásadní rozpor v tíži onemocnění a v mortalitě v geograficky odlišných, ale často nepříliš vzdálených lokalitách. Vysoká mortalita v USA, Brazílii, Belgii, Anglii, Francii, Iránu a v některých oblastech zejména severní Itálie a Španělska je objektivním strašákem diktujícím reakci v důsledku globalizace i vzdálených a nemocí prakticky (dosud) nedotčených teritorií. Tyto rozdíly může ovlivnit řada faktorů, jako jsou genetická dispozice [1], věková distribuce, kvalita a dostupnost zdravotnického systému, životní prostředí, stereotypy sociálních kontaktů, případně vakcinace proti jiným patogenům (např. hepatitidě A, tuberkulóze či chřipce) či metodika sběru dat, nicméně žádný z nich nebyl jednoznačně doložen a nelze jej aplikovat univerzálně. Reprodukční číslo SARS-CoV-2 infekce se pohybuje mezi 2 a 5,5, a je tak podstatně vyšší než reprodukční číslo předchozích geograficky omezených epidemií, nicméně jejich letalita byla podstatně vyšší. Prvotní šíření se uskutečňuje horizontálně i vertikálně v rámci místní komunity, druhotně dochází k šíření cestovateli. Ke koncentrovanému vzplanutí dochází v rámci uzavřených komunit na malém prostoru, jako jsou kluby, koncerty, náboženská shromáždění a zdravotnická a pečovatelská zařízení doslova během několika hodin, nicméně jiná zůstávají zcela intaktní. Spekuluje se o superpřenašečích a virové náloži, aniž bychom je dokázali definovat. K interpersonálnímu přenosu dochází kapénkami, méně průkazný je přenos aerosolem, kontaktem přímo či přes nástroje a povrchy a cestou orofekální. Z toho vyplývají základní restrikční opatření – roušky, respirátory, omezený kontakt, distance a hygiena osobní i povrchů a prostředí. Populace reaguje vysoce nejednotně, přičemž se rozlišuje riziko infekce jako takové, těžkého průběhu a smrti. Riziko infekce vyplývá z intenzity kontaktů a je nejvyšší v uzavřených a koncentrovaných komunách, ze zaměstnanců u zdravotníků a sociálních pracovníků, riziko těžkého průběhu je dáno věkem a komorbiditami. Riziko těžkého průběhu u dětí, které jsou jinak infikovány běžně, prakticky neexistuje. Hepatogastrointestinální souvislosti jsou předmětem dalších řádek, nejvýznamnějšími rizikovými komorbiditami jsou hypertenze, diabetes, ischemická choroba srdeční, některá nádorová onemocnění, dialýza (stav po transplantaci ledvin) a obezita (metabolický syndrom). Řada studií popsala reakci viru s hostitelem. K primárnímu kontaktu s buňkou dochází hrotovým glykoproteinem viru (S protein), který se váže na receptor angiotenzin konvertujícího enzymu 2 (ACE2), monokarboxypeptidázu kontrolující štěpení některých peptidů spojených se systémem renin-angiotenzin. Tento receptor se vyskytuje na buňkách respiračního traktu s výrazným distálním gradientem, ale též na buňkách epitelu jícnu, tenkého i tlustého střeva, jater i žlučových cest, buňkách myokardu, endotelu proximálních tubulů ledvin a močového měchýře, nikoli však imunitního systému. Následuje univerzální zánětlivá reakce s akumulací lymfocytů a neutrofilů v místě postižení a s vyplavením cytokinů, jejímž důsledkem je variabilní klinický obraz. Specifickým patologickým rysem je bilaterální pneumonie s difuzním alveolárním postižením, deskvamací pneumocytů, formací hyalinních membrán a intersticiálním infiltrátem s dominujícími lymfocyty a multinukleárními syncitiálními buňkami. Až u 22 % dochází k fibrotizaci. Objem jater bývá zvětšen, podobně žlučníku, histologický nález zahrnuje buněčné nekrózy, mitózy, zánětlivý infiltrát, tukovou degeneraci a detekovatelný SARS-CoV-2 u 41 % tkáně jater s maximální náloží 1,6 × 10 na 6 kopií/g tkáně. Sliznice žaludku bývá tmavěji zbarvená s petechiemi. Histologické abnormality trávicí trubice zahrnují edém a plazmocytární a lymfocytární infiltrát a v epiteliích je prokazatelná SARS-CoV-2 RNA. Podobně nespecifický a relativně chudý je patologický korelát jiných orgánů s expresí ACE2 receptorů. Při občasném infarktu myokardu či trombech není jasné, zda se jedná primárně o důsledek přímého postižení endotelu, či sekundaritu v širších souvislostech [2].
Symptomatologie covid-19
Četné studie se, pokud jde o symptomatologie, více méně shodují. Po infekci následuje několik bezpříznakových dní a pak nespecifické prodromy, následovat může vyléčení i prudká akcelerace klinického průběhu. Při něm dochází k přijetí k hospitalizaci kolem 7. dne, rozvoj pneumonie (ARDS – acute respiratory distress syndrome) kolem 9. dne a nastolení intenzivní péče kolem 10. dne. Nejčastějším příznakem je horečka (> 90 %), slabost (kolem 70 %), suchý kašel (cca 60 %), myalgie (do 40 %) a dušnost (podobně). Gastrointestinální příznaky zahrnují průjem (přibližně 10 %), abdominální bolesti a zvracení (do 5 %). Podle jedné z původních studií dosáhl počet stolic až 9 s průměrem 3,3 ± 1,6 denně. Stolice bývá nejčastěji vodnatá a průjem může potencovat léčba virózy (oseltamivir). Vysoce variabilní je ztráta chuti k jídlu, vedle anorexie může být samostatným příznakem dysgeuzie spojená se ztrátou čichu (1–79 % nemocných podle jednotlivých studií). Podle studie Lin et al se u většiny nemocných rozvinula ztráta chuti k jídlu během hospitalizace a nebyla spojena s podáváním antibiotik a antivirotik. Tím se dyspepsie u covid-19 liší od jiných virových gastroenteritid [3]. Přibližně u 10 % postižených předchází gastrointestinální symptomy respirační a celkové příznaky. U nemocných s těžkým průběhem jsou gastrointestinální příznaky častější, a dokonce i výlučné. Podle relativně recentní metaanalýzy dosáhla celková prevalence gastrointestinálních příznaků 15 % (tab. 1) [4,5].
Tab. 1. Gastroenterologická a hepatologická symptomatologie u covidové infekce [5].
Tab. 1. Gastroenterological and hepatological symptomatology in covide infection [5].![Gastroenterologická a hepatologická symptomatologie u covidové
infekce [5].<br>
Tab. 1. Gastroenterological and hepatological symptomatology in covide
infection [5].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/aa5eb159da08b8294c3fd843f3293001.png)
Covid-19 a digestivní endoskopie
Provádění endoskopie v době pandemie je ovlivněno v mnoha rovinách. Při gastroskopii je kontakt s potenciálním nosičem infekce vzhledem k instrumentaci a oronazálnímu šíření bezprostřední, infekce se může šířit exkrementy i potenciálně kontaminací ploch, přístroje a instrumentária, přestože instrumentální přenos dosud nebyl zaznamenán. Zprávy o přítomnosti virové RNA i aktivního viru ve stolici jsou nečetné, ale relevantní. Podle jedné studie byla virová RNA detekována u 39 ze 73 nemocných (53,42 %), u dalších to bylo méně (tab. 2), zdá se však, že stolice nemocných obsahuje viry bez závislosti na symptomech a může přetrvávat i několik dní po vyléčení – tj. po negativním výtěru nazofaryngu. Replikace virů byla prokázána opakovaně v epiteloidních buňkách histologických odběrů při koloskopii opět i s několikadenním odstupem od definovaného vyléčení [6–8]. Virus se může přenášet z pacientů na personál i naopak a samozřejmě uvnitř obou komunit. Organizační opatření proto musí být komplexní a v závislosti na aktuální místní epidemiologické situaci. Režim je v podstatě univerzální u všech podobných diagnosticko-intervenčních instrumentálních ambulatorií. Zahrnuje dezinfekci celého prostoru, interpersonální odstupy a časové intervaly, stratifikaci plánovaných výkonů podle rizik, indikací a epidemiologické situace a personálu na vzájemně se nepotkávající týmy. Ochranné pomůcky by v místě zasažené epidemií měly být kategorie biosafety 2, v případě podezřelého nemocného biosafety 3. Přísně by se měly dodržovat dezinfekční (sterilizační) procesy s jednoznačnou preferencí instrumentária na jedno použití zohledňující doporučené postupy European Society of Digestive Endoscopy (ESGE). Dezinfekční činidla musí být účinná proti všem třem hlavním mikrobiálním agens. Jako součást eliminace infekce se zvažuje negativní tlak, UV iradiace a ozon, v našich podmínkách patrně nedostupné. Po každém výkonu by měla následovat dezinfekce využívaných povrchů [9].
Tab. 2. Fekální pozitivita PCR SARS-CoV-2 [8].
Tab. 2. Fecal positivity PCR SARS-CoV-2 [8].![Fekální pozitivita PCR SARS-CoV-2 [8].<br>
Tab. 2. Fecal positivity PCR SARS-CoV-2 [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/8be6f870e4f2f322186406945ed47028.png)
Covid-19 a trávicí trubice
Trávicí trubice je přímo postižena virovou infekcí v důsledku exprese ACE2 receptorů zejména v epiteloidních buňkách ilea a tlustého střeva, ale také v dlaždicovém epitelu jícnu a v žaludku. Histologický obraz je ovšem nespecifický a nevýrazný a k dalšímu šíření infekce nedochází. Četnost záchytu infekce ve stolici je větší u nemocných bez respiračních symptomů a při léčbě kortikoidy. Nespecifické střevní záněty (NSZ) Crohnova nemoc a ulcerózní kolitida jsou chronická autoimunní zánětlivá onemocnění, jejichž vznik i průběh jsou ovlivněny individuální genetickou dispozicí a environmentálními faktory. Průběh je variabilní a v důsledku onemocnění samého i imunosupresivní medikace jsou náchylnější k oportunním infekcím a hypoteticky lze očekávat zvýšené riziko covid-19 infekce, případně její těžší průběh. Naopak infekce covid-19 by mohla vést ke zvýšení aktivity střevního zánětu tím spíš, že exprese receptorů ACE2 je v zánětem postižených buňkách zvýšena. Ve vzájemné souvislosti NSZ a covid-19 se nastoluje řada otázek:
Jaké je riziko infekce u nemocných s NSZ?
Zvyšují NSZ riziko těžkého průběhu infekce?Jaká je souvislost s aktivitou NSZ?
Jaký je vliv medikace NSZ na průběh covid-19?
Měla by se měnit léčba NSZ v průběhu epidemie?
Způsobuje infekce covid-19 relaps NSZ či jejich vznik de novo?Obecně platí, že systematických pozorování větších souborů pacientů bylo dosud publikováno velmi málo. Recentní studie pochází z jednoho mimořádně zasaženého ohniska – Madridu. Z celkem 1 918 nemocných byla infekce covid-19 prokázána u 12 osob o průměrném věku 52 let. Přibližně 75 % byly ženy, u 58,3 % se jednalo o Crohnovu nemoc, u 7 se podávala imunosuprese či biologická léčba. Osm z nich bylo hospitalizováno, dva zemřeli. Nejčastějším příznakem byl průjem (42 %). Ve srovnání s regionální situací nebyli nemocní s NSZ zatíženi zvýšeným rizikem [10]. Jiná práce z Arabského poloostrova zahrnuje 59 nemocných s NSZ (40 z nich s Crohnovou nemocí) s průměrným trváním 3,5 roku. 78 % dostávalo biologickou léčbu, 36 % imunosupresiva, 17 % mesalamin a 3,4 % kortikoidy. Zkoumala subjektivní obtíže a kvalitu života a souhrn těchto parametrů se v průběhu infekce covid-19 nezměnil [11]. Nesmírně zajímavé je sledovat mezinárodní registr SECURE-IBD: V den psaní textu zahrnoval 2 035 nemocných prakticky z celého světa, potěšitelně i z ČR (7 nemocných). Hospitalizováno bylo 26 % pacientů, další hlavní údaje zahrnuje tab. 3 [12].
Tab. 3. Registr infekce covid-19 u NSZ.
Tab. 3. Infection registry of covid-19 in NSZ.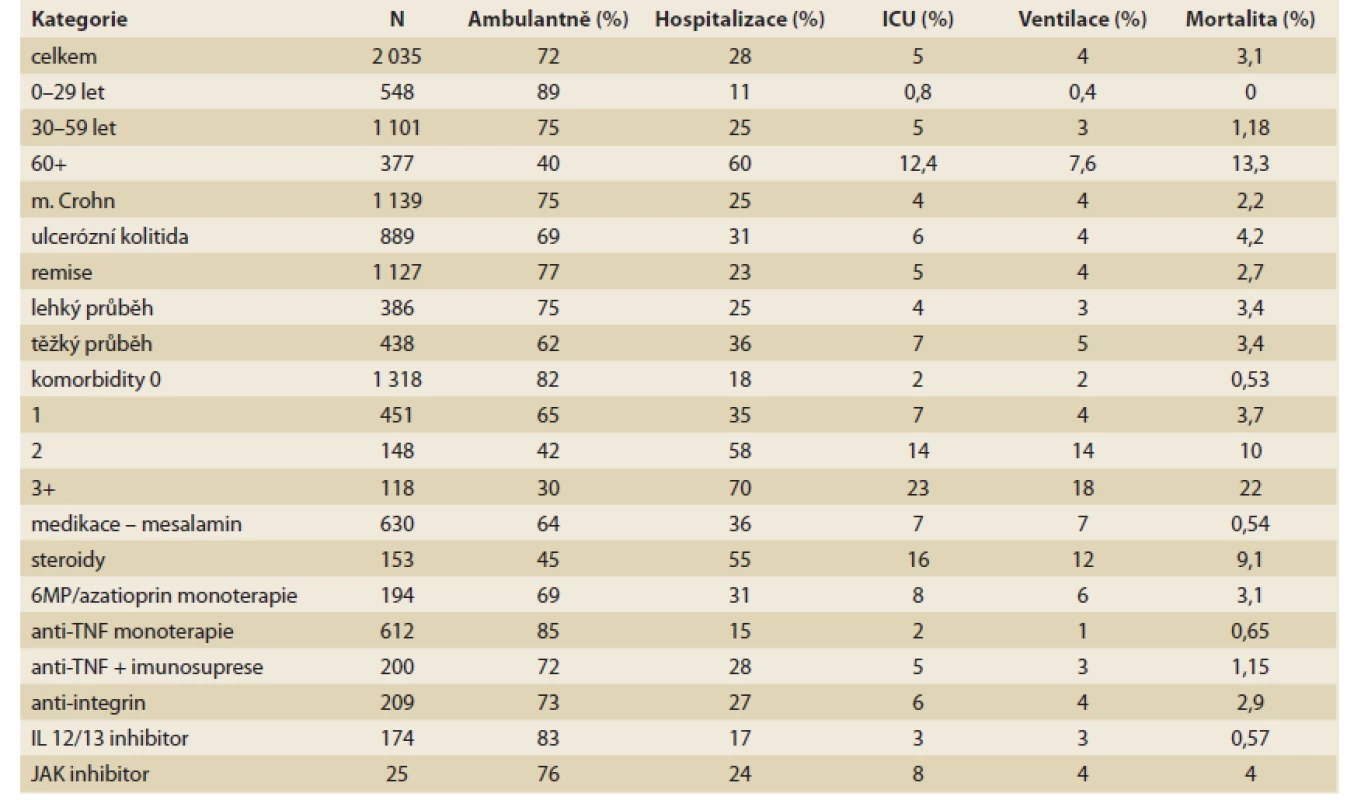
Výsledky je nutné hodnotit s velkou opatrností, protože je není možné ověřit a není jasné, nakolik je soubor v celém profilu reprezentativní. Nicméně základní výsledky lze považovat za relevantní. Celkově NSZ nezvyšují riziko infekce covid-19 a naopak, infekce průběh NSZ nezhoršuje. Těžký průběh je prakticky výjimečný u věkové kategorie mladí / střední věk a nesouvisí s tíží onemocnění. Mortalita narůstá s věkem a komorbiditami. Zvýšené riziko přináší léčba kortikoidy, naopak pozoruhodně vyznívá příznivý průběh při léčbě biologickou léčbou, zejména preparáty anti-TNF. Mezinárodní (International Organization for the Study od Inflammatory Bowel Diseases – IOBD, Crohn’s and Colitis UK) i národní organizace stanovily řadu pravidel pro fungování této subspecializace spíše na základě předpokladů než jednoznačných důkazů. Péče musí zůstat zachována, pacienti by měli pokračovat v systému léčby a kontrol za dodržování hygienických opatření v souladu s místní epidemiologickou situací. U nemocných s potvrzenou infekcí bez symptomů se má za vhodné prodloužit interval k následující aplikaci biologické léčby k vyhodnocení klinického vývoje (což poněkud odporuje výsledkům mezinárodního registru), biologická léčba by v případě symptomů covid-19 měla pokračovat po jejich vymizení, případně negativním testu. Thiopuriny se přes zvýšenou afinitu virových infekcí dále podávají, protože případné vysazení má až velmi protrahovaný a nejednoznačný efekt. Pokračuje se v léčbě steroidy a mesalazinem. Kontinuálně se vyhodnocuje poměr přínos/riziko a veškeré případy by se měly registrovat (www.covidibd.org) [13].
Postižení jater
U hepatopatií lze očekávat vyšší riziko infekce covid-19 i průběhu vzhledem k imunitní dysfunkci a komorbiditám. Receptor SARS-CoV-2, ACE2, je vysoce exprimován jak na hepatocytech, tak i cholangiocytech, což zavdává předpoklad přímého poškození jater i žlučových cest. Objem jater i žlučníku u zemřelých může být zvětšen, histologie vykazuje mírnou sinusoidální dilataci, drobné nekrózy a lymfocytární infiltraci, obecně nespecifické změny. Vztah covid-19 a hepatopatie navozuje řadu otázek:
Jsou nemocní s hepatopatií zatíženi větším rizikem infekce a její tíží?
Jaký je rozdíl mezi jednotlivými hepatopatiemi v závislosti na etiologii, stadiu a jaterní dysfunkci?
Jaký vliv na jaterní dysfunkci má ARDS a užívání širokého spektra léků s hepatotoxickým potenciálem, jako jsou antipyretika, antibiotika, antivirotika a další?
Jaký je vztah infekce k nemocným po transplantaci jater?Podle studie Wanga et al bylo ze 132 nemocných s jaterní dysfunkcí 54,45 % mužů, průměrný věk 62 let [7]. Většina vykazovala jen mírné zvýšení transamináz mezi 40 a 80 U/l. Zvýšení přímého bilirubinu bylo zaznamenáno u 18 a nepřímého u 8 postižených. U 12 byla prokázána prodělaná hepatitida C, u 2 hepatitida B [14]. Podobně ve studii Guana et al byla preexistující hepatitida B zaznamenána u 23 z 1 099 nemocných [15]. Podle recentní metaanalýzy zahrnující 128 studií byla u covidové infekce nejčastější hepatální abnormalitou hypoalbuminemie (61,27 %), elevace gama-glutamyltransferázy (GMT; 27,94 %), alaninaminotransferázy (ALT; 23,28 %) a aspartátaminotransferázy (AST; 23,41 %) a tyto hodnoty byly častěji zvýšené u těžkého průběhu infekce [16]. Ve společné práci američtí a egyptští autoři retrospektivně zpracovali na 20 studií a zjistili, že těžký průběh infekce covid-19 je spojen s vyšší elevací ALT, AST a bilirubinu. Doporučují monitoraci jaterních enzymů jako predikci těžkého průběhu [17]. K podobným závěrům dospěli íránští autoři [18]. Další oblastí je souvislost infekce covid-19 s tukovým onemocněním jater (NAFLD – non alcoholic fatty liver disease). Rozsáhlá studie pocházející z New Yorku identifikovala jako rizikové faktory hypertenzi, diabetes a obezitu, přičemž relativně „jen“ 23 % nemocných byli Hispánci s předpokládaným vyšším výskytem NAFLD. U časné studie pocházející z Číny se u 21,6 % nemocných s covid-19 prokázala NAFLD, což je více než v běžné populaci. Jiná metodicky přesnější studie prokázala zvýšené riziko těžkého průběhu covid-19 u NAFLD (OR 6,4), přičemž diabetes nehrál roli. Podobně vyzněla jiná čínská studie zahrnující 214 nemocných: zvýšené riziko (odds ratio [OR] 6) nebylo ovlivněno dalšími faktory jako věk, pohlaví, dyslipidemie, hypertenze a diabetes. Vysvětlením může být větší exprese receptorů ACE2 ve steatotických játrech [19,20]. Hlubší analýzu souvislosti covid-19 a NAFLD obsahuje úvaha italských a polských autorů. Zdůrazňují jednak komorbidity vyplývající z metabolického syndromu, jednak speciální prozánětlivý stav a inzulinovou rezistenci v důsledku akumulované tukové tkáně [21]. Další čínská multicentrická studie se specificky zabývá vlivem covid-19 na chronickou virovou hepatopatii B. Ze sedmi pacientů bylo šest mužů, věku od 33 do 49 let, dva byli cirhotici. Během hospitalizace došlo k signifikantnímu zvýšení ALT u tří a AST u dvou nemocných, nicméně u žádného nebyl nutná pobyt na jednotce intenzivní péče a nikdo nezemřel [22].
Informace o průběhu infekce u autoimunní hepatitidy jsou nedostatečné. V Itálii ze 148 nemocných vykázalo dle dotazníku 25 % symptomy slučitelné s covid-19, infekce však byla prokázána jen u čtyř, z nichž jeden zemřel typicky se známými rizikovými faktory. U ostatních byl průběh lehký [23]. Cirhóza jater je jedno z běžných onemocnění s variabilním průběhem, se sníženou kvalitou života, poměrně vysokou mortalitou a řadou specifických rysů potenciálně zvyšujících riziko infekce. To potvrdila i vysoká mortalita nemocných s cirhózou v době epidemie virózy N1H1. Jeden z registrů cirhotiků zahrnuje 151 nemocných s covid-19. Nejčastější etiologií byl ethyl následován NASH a virovou hepatitidou. Až 24 % nemocných si vyžádalo intenzivní péči, 16 % ventilaci a 40 % zemřelo [24]. Recentní studie zahrnuje 50 nemocných cirhotiků z Lombardie, o průměrném věku 67 let. U 52 % se jednalo o původně kompenzovanou cirhózu, 70 % byli muži, u 38 % se jednalo o cirhózu virového původu. Nejčastějším symptomem byla zvýšená teplota (64 %) následovaná dyspnoí a encefalopatií. Přibližně 96 % vyžadovalo hospitalizaci, 52 % dostávalo antivirotika, 80 % heparin, 71 % oxygenoterapii. U 24 pacientů došlo k výraznému zhoršení (acute on chronic liver failure) a 17 (34 %) pacientů zemřelo 4–13 dní od počátku obtíží. Mortalitu predikovaly tíže respiračního a jaterního postižení (CLIF-C, CLIF-OF a MELD skóre) [25]. Metodicky ambiciózní multicentrická studie pocházející z USA srovnávala průběh nemocných s cirhózou a covid-19 vs. srovnatelný soubor hospitalizovaných pro samotnou infekci a další se samotnou cirhózou. Jednotlivé skupiny zahrnovaly 37, 108 a 127 nemocných. Mortalita u pacientů se společným výskytem obou chorob byla vyšší než u pacientů s infekcí samotnou, nikoli však ve srovnání se samotnou cirhózou (30 vs. 13 vs. 20 %). U obou skupin nemocných s infekcí byly stejné respirační příznaky, rentgenové nálezy, pobyt na jednotce intenzivní péče a ventilace. Pacienti s výskytem obou chorob měli vyšší výskyt komorbidit, nižší výskyt gastrointestinálních symptomů a vyšší hodnotu laktátu. U pacientů se samotnou cirhózou byl vyšší výskyt komplikací základního onemocnění, MELD skóre a nižší potřeba ventilace. Jediným průkazným rizikovým faktorem mortality byl výskyt komorbidit (tab. 4) [26]. Dalším specifickým problémem je transplantační program. Jedna studie u nemocných po transplantaci zaznamenala vyšší výskyt těžkého průběhu, potřeby intenzivní péče a ventilace a mortalitu, zatímco studie z Itálie u dětí tuto tendenci nepotvrdila a podobně další zprávy – kazuistiky o nepříznivém vlivu covid-19 na potransplantační průběh jsou ojedinělé [27,28]. Nedávná přehledná studie zahrnující 6 transplantačních center a 16 nemocných vykázala různorodé výsledky; nicméně celkově vyšší úmrtnost 37,5 %. Nejmladšímu pacientovi bylo 59 let, průměrný odstup od transplantace byl 5 let, nezemřelo žádné dítě [29]. Zajímavé výsledky nabízí srovnání vlivu hepatopatií s nefropatiemi na infekci covid-19. Metaanalýza obsahuje 22 studií o 5 595 covid-19 nemocných. Celková mortalita byla 16 %, prevalence chronické hepatopatie byla 3 %, nefropatie 1 %. U hepatopatií bylo 57,33 % průběhů těžkých s mortalitou 17,65 %, odpovídající parametry u nefropatií byly 83,96 % a 53,33 % [30]. Pokud jde o interakce potenciálních antivirotik a imunosupresiv, jako nevhodná antivirotika se považují atazanavir, lopinavir, v menší míře chlorochin a hydrochlorochin, zatímco remdesivir výraznější interakce nevykazuje (tab. 5) [31].
Tab. 4. Mortalita u covid-19 a jaterní cirhózy.
Tab.4. Mortality in covid-19 and liver cirrhosis.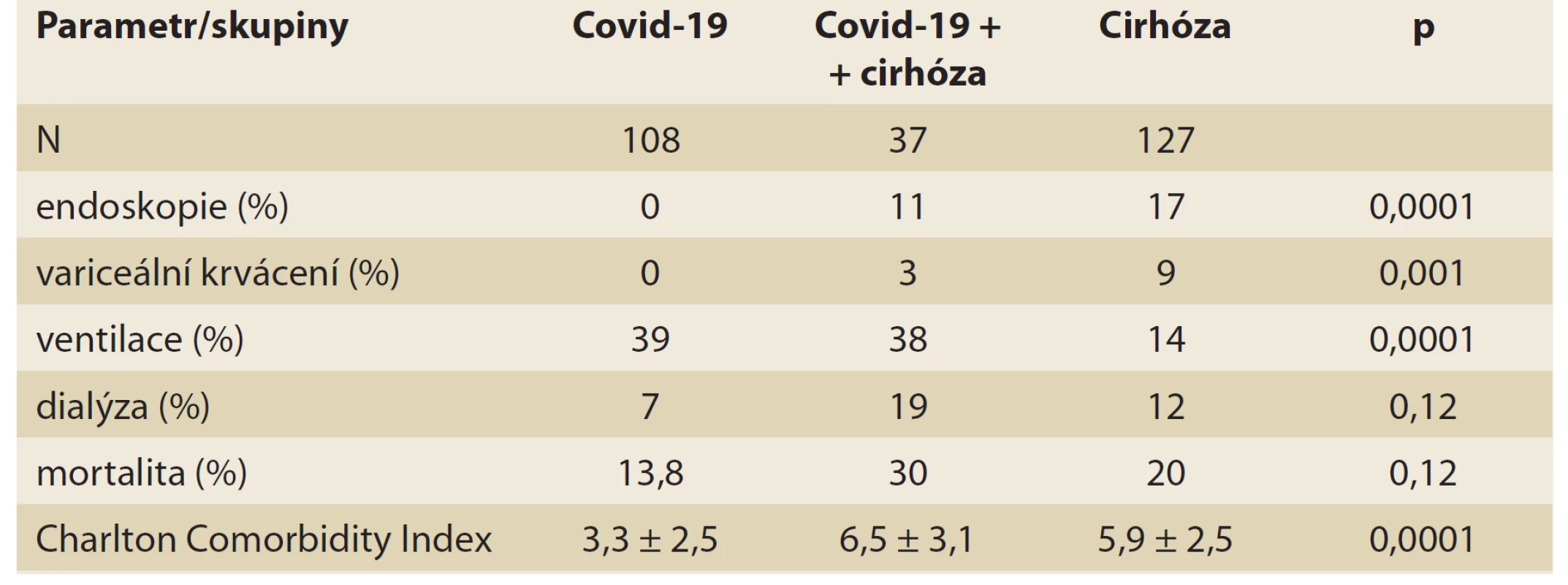
Tab. 5. Potenciální interakce covidových virostatik a imunosupresiv.
Tab. 5. Potential interactions of covide antivirals and immunosuppressants.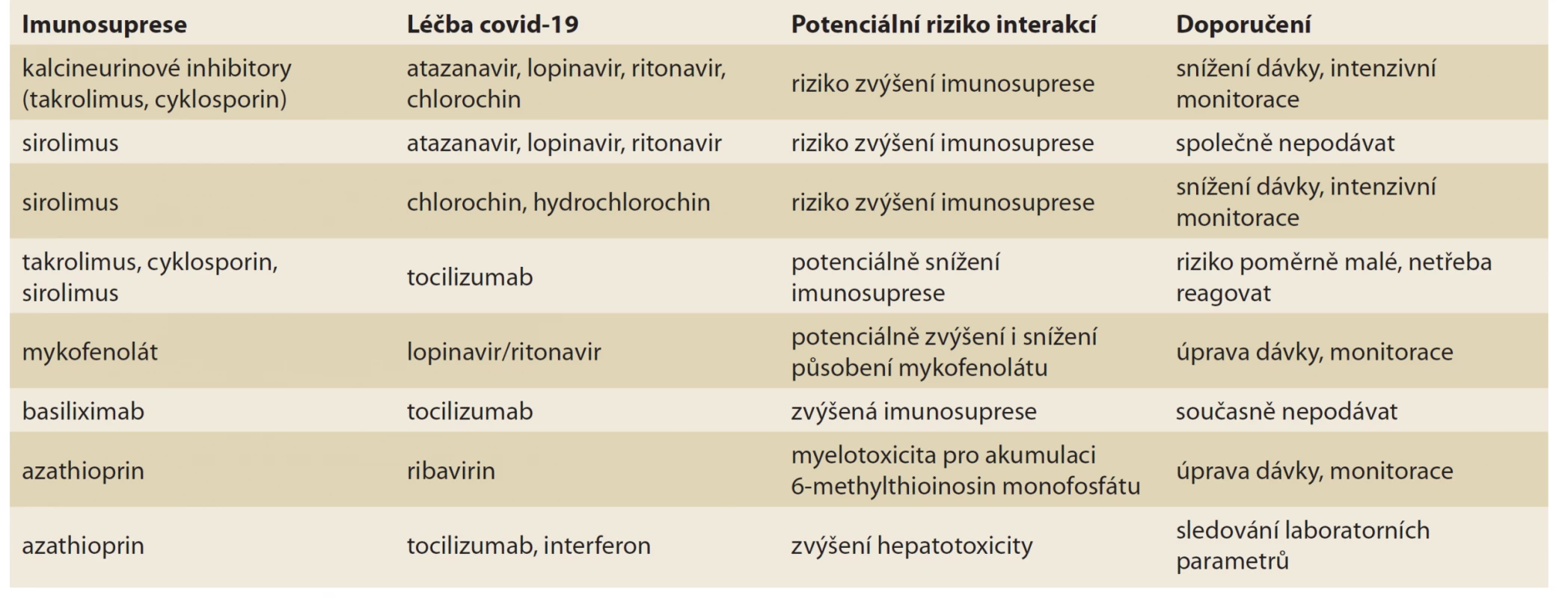
Speciální diskuze se vede o možnosti použití orgánů zemřelých na infekci covid-19. V úvahu připadá potřeba urgentní transplantace, rizikem je přenos infekce a její těžký průběh u transplantovaného. Samozřejmostí by byla plná informace a souhlas čekajícího. Dosud nebyl tento případ popsán [32,33]. V poslední době bylo publikováno několik metaanalýz. Práce tureckých autorů analyzuje výskyt jaterní dysfunkce u covidové infekce a její průběh všeobecně a zvlášť u cirhotiků a po transplantaci jater (tab. 6, 7). Těžší průběh infekce je zřejmý, nicméně se jedná o retrospektivní studie s variabilním počtem nemocných a metodikou, což odůvodňuje velké rozdíly mezi jednotlivými soubory [34]. Patrně nejkomplexnější metaanalýza analyzující 29 studií (6 064 nemocných) byla recentně publikována v časopise Lancet. Celková prevalence hepatogastrointestinálních komorbidit u covidové infekce byla 4 %, prevalence symptomatologie 15 % a prevalence jaterní dysfunkce 19 %. U pacientů s těžkým průběhem infekce byla častější abdominální bolest (OR 7,10), zvýšená hodnota ALT (OR 1,89) a AST (OR 3,08). V prevalenci jsou patrné geografické rozdíly, naopak prevalence symptomatologie u dětí nebyla zásadně odlišná (10 %). U pacientů s gastrointestinálním postižením byl častější ARDS (OR 2,96; p = 0,02) [35]. I u hepatopatií existuje mezinárodní registr infikovaných covid-19 při EASL. Zahrnuje 957 nemocných a naznačuje těžký průběh infekce. Je ovšem obtížné až nemožné zpětně hodnotit, za jakých okolností byla infekce diagnostikována u velmi heterogenního souboru nemocných, a takto jednoznačně specifikovat riziko (https: //covidcirrhosis.web.unc.edu – SECURE-Cirrhosis) (tab. 8–10). K dané problematice zaujaly stanovisko dvě největší mezinárodní specializační organizace Americal Association for the Study of Liver Disease (AASLD) a European Association for the Study of the Liver (EASL). Vzájemná souvislost hepatitid i dalších preexistujících hepatopatií a infekce covid-19 si vyžádá další šetření, nicméně k jaternímu selhání nedochází a význam hepatopatií pro průběh infekce covid-19 není jednoznačný. Specifickým problémem jsou nemocní s pokročilým chronickým jaterním onemocněním, zejména s metabolickým syndromem, dalšími komorbiditami a po transplantaci jater, kde se předpokládá snížená imunita a zvýšená náchylnost k infekcím (tab. 11) [36,37].
Tab. 6. Jaterní dysfunkce u covidové infekce a její průběh – přehled studií [34].
Tab. 6. Hepatic dysfunction in covide infection and its course – an overview of studies [34].![Jaterní dysfunkce u covidové infekce a její průběh – přehled studií [34].<br>
Tab. 6. Hepatic dysfunction in covide infection and its course – an overview of
studies [34].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/403c30c33786bbfbe4f4956abcb6f81d.png)
Tab. 7. Covid-19 u preexistujícího jaterního onemocnění a cirhózy – přehled studií [34].
Tab. 7. Covid-19 in pre-existing liver disease and cirrhosis – an overview of studies [34].![Covid-19 u preexistujícího jaterního onemocnění a cirhózy – přehled
studií [34].<br>
Tab. 7. Covid-19 in pre-existing liver disease and cirrhosis – an overview
of studies [34].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/d1623bdaaa7aa108f39d55f9918d391a.png)
Tab. 8. Registr hepatopatií a infekce covid-19 (obecně, necirhotici a cirhotici).
Tab. 8. Registry of hepatopathies and covid-19 infections (in general, non-cirrhotic and cirrhotic patients).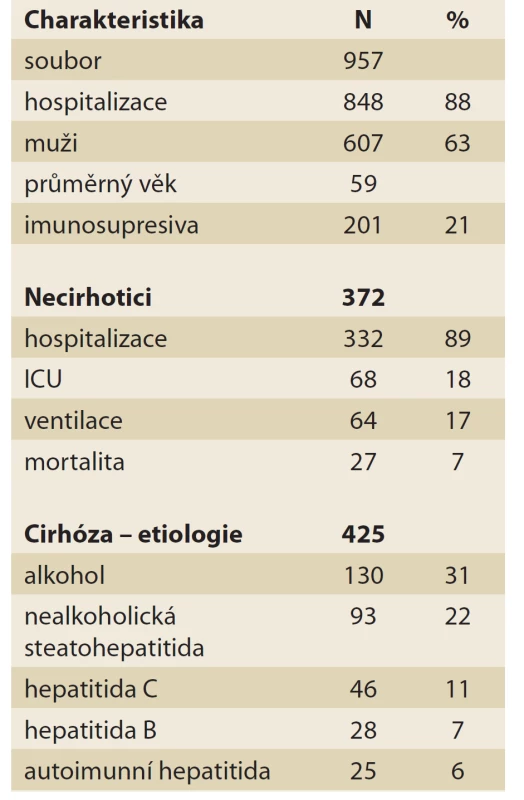
Tab. 9. Vliv covid-19 na průběh jaterního onemocnění.
Tab. 9. The eff ect of covid-19 on the course of liver disease.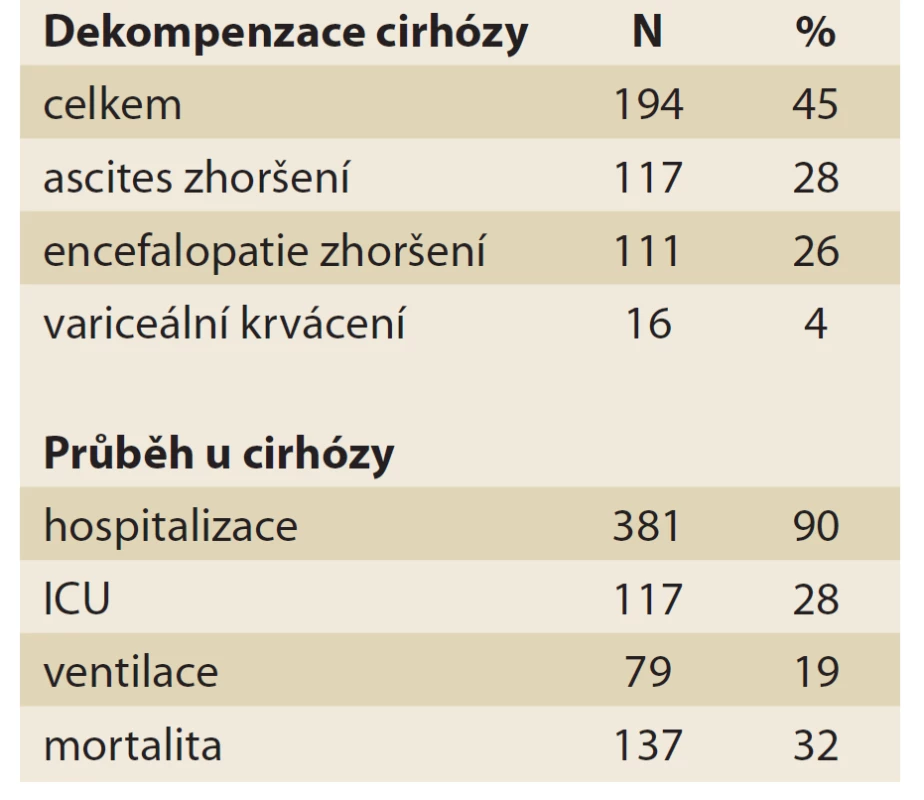
Tab. 10. Vliv covid-19 na potransplantační průběh.
Tab. 10. Infl uence of covid-19 on the post-transplant course.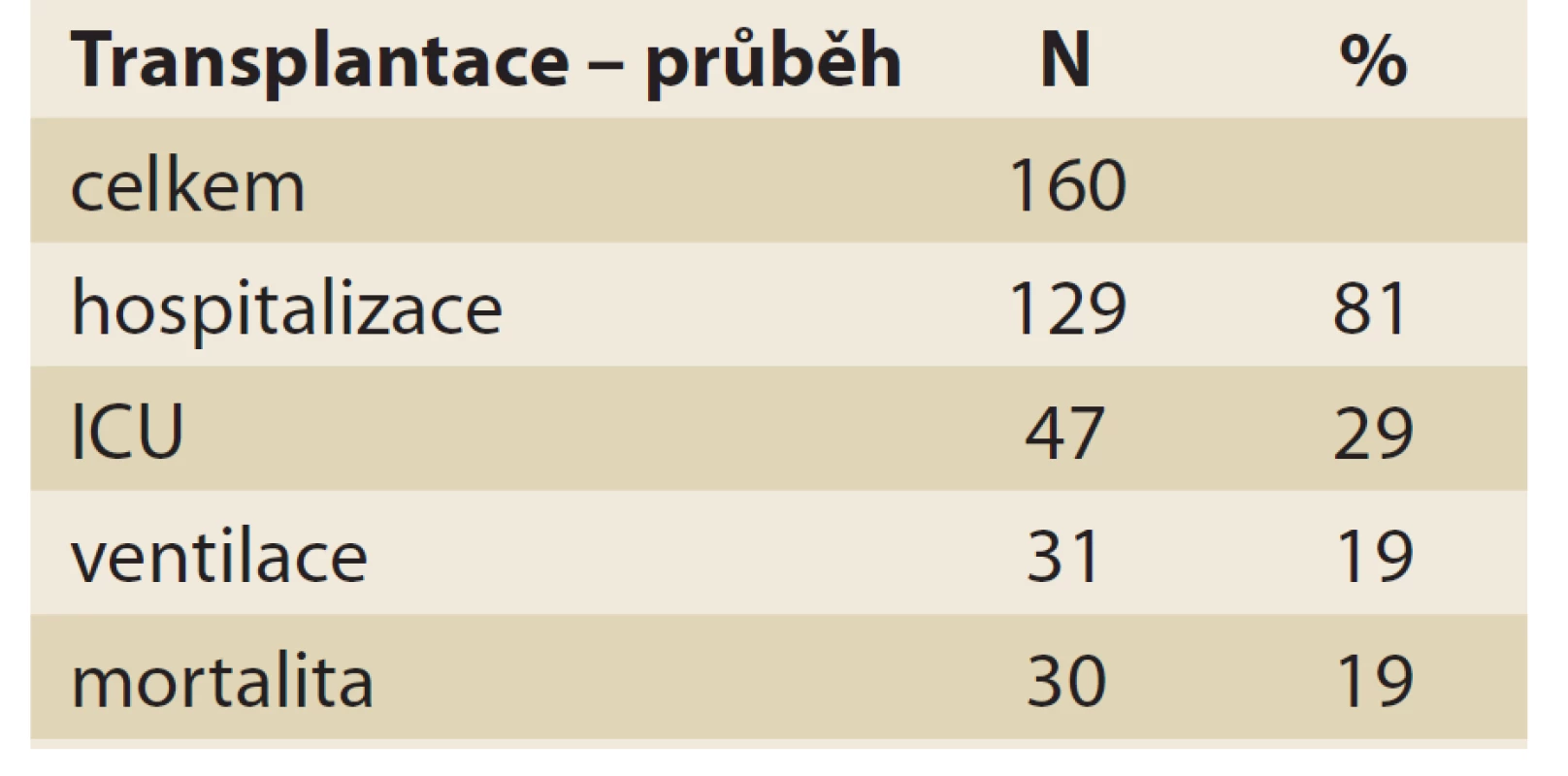
Tab. 11. Doporučení AASLD a EASL k imunosupresi.
Tab. 11. Recommendations of AASLD and EASL for immunosuppression.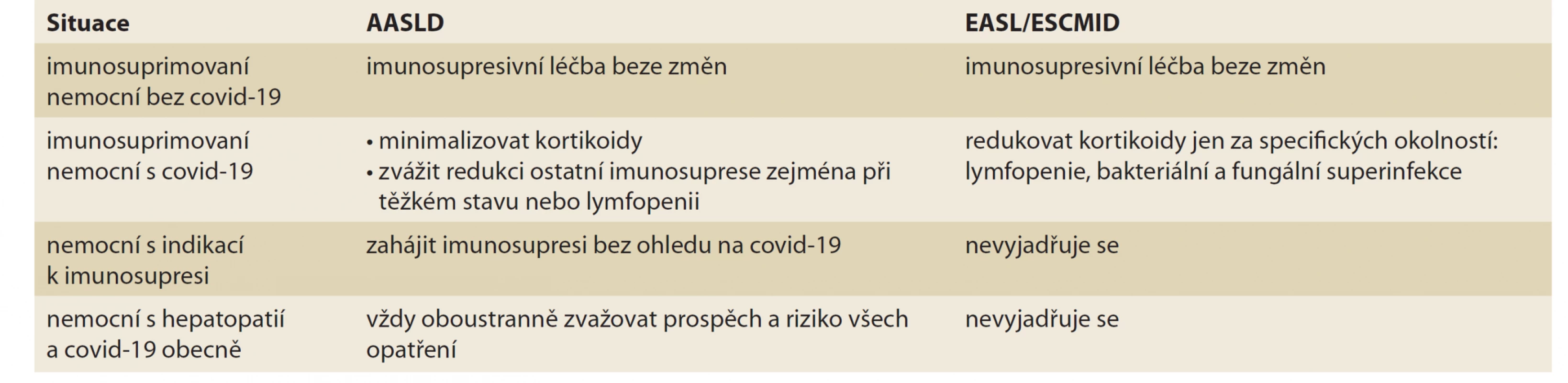
Covid-19 a mikrobiot
Lidský mikrobiot obsahuje 1 014 mikroorganizmů a zahrnuje bakterie, archae, viry i houby. Denzita osídlení tlustého střeva je extrémní s dominantním zastoupením rodů Basbacteroidacae, Perevotelacae, Rikenellacae, Lachnospiracaeae a Ruminococcaecaeae. Role spočívá v podílu na ochranných, trofických a metabolických procesech regulací řady fyziologických funkcí včetně imunity proti patogenům. Střevní dysbióza hraje roli v řadě zásadních civilizačních chorob, jako jsou kardiovaskulární onemocnění, deprese, diabetes 2. typu a také NSZ. Podobně bakteriální flóra příznačně kolonizuje plíce a oba systémy spolu komunikují. Zatímco ve střevě dominují Bacteroidetes a Firmicutes, v plicích se přidávají Proteobacteria. Komunikace obou systémů, která se nazývá „gut-lung axis“, se uskutečňuje zánětlivými mediátory krevního oběhu. Řada prací dokazuje, že respirační infekce jsou doprovázeny střevní dysbiózou a naopak změny mikrobiotu hrají roli ve vzniku sepse a ARDS. Střevní mikrobiota jsou ve všech aspektech předmětem intenzivního výzkumu, jehož výsledky se v klinické praxi dosud adekvátně neuplatňují. Lákavou perspektivou je ovlivnění covid-19 modulací mikrobiotu preventivním podáváním probiotik, nicméně koncept je zatím zatížen simplifikující univerzalitou [38].
Závěr
Vztah hepatopatií a gastrointestinálních chorob a infekce covid-19 není zcela jednoznačný. Infekce je běžně provázena gastrointestinální symptomatologií včetně parametrů jaterní dysfunkce, nicméně k orgánovému selhání, chronickým změnám a vzplanutí chronických chorob trávicí trubice ani jater a pankreatu nedochází. Laboratorní nálezy jaterní dysfunkce jsou výraznější u těžšího průběhu infekce a mohou sloužit jako predikce jejího průběhu. V některých nejednoznačně definovaných případech mohou být chronické hepatopatie a střevní záněty rizikovým faktorem průběhu infekce, významnou roli ovšem hrají další faktory, například komorbidity a rizikovost je celkově menší než u diabetu, kardiovaskulárních onemocnění a nefropatií. Zdá se, že medikamentózní imunosuprese není sama o sobě významným rizikovým faktorem infekce, jak naznačují výsledky u mladých. Kvalitních studií je dosud málo a je třeba mít na paměti časový faktor – sběr dat v případě retrospektivy, sepsání článku a proces od přijetí ke zveřejnění trvá nevyhnutelně spíše tři než dva měsíce, během nichž se patrně průběh infekce změnil. Výsledky i závěr šetření se tedy vztahují k období do května 2020 a další informace mohou informativní obsah změnit. Doporučení odborných společností jsou odrazem velké obezřetnosti na vrcholu pandemie v Itálii a Španělsku. Proces organizace gastroenterologické a hepatologické péče podléhá hygienickým normám a momentální epidemiologické situaci a neliší se zásadně od jiných odborností.
Doručeno/Submitted: 1. 8. 2020
Přijato/Accepted: 5. 9. 2020
prof. MUDr. Julius Špičák, CSc.
Klinika hepatogastroenterologie
Transplantcentrum
IKEM
Vídeňská 9
140 21 Praha 4
Konflikt zájmů: Autor deklaruje, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašuje, že v souvislosti s předmětem článku nemá
finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autor souhlasí s uveřejněním svého jména a e-mailového
kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The author declares that the article/manuscript complies with ethical standards, patient anonymity has been respected, and he states that he has no
fi nancial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/manuscript has not been published or is currently being submitted for another review. The author agrees to publish his name and e-mail in the
published article/manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Zdroje
1. Ellinghaus D, Degenhardt F, Bujanda L et al. Genomwide association study of severe COVID-19 with respiratory failure. N Engl j Med 2020. [online]. Available from: https: //www.nejm.org/doi/pdf/10.1056/NEJMoa2020283. doi: 10.1056/NEJMoa2020283.
2. Magro F, Abreu C, Rahier JF. The daily impact of COVID-19 in gastroenterology. United European Gastroenterol J 2020; 8 (5): 520–527. doi: 10.1177/2050640620920157.
3. Lin L, Jiang X, Zhang Z et al. Gastrointestinal symptoms of 95 causes with SARS-CoV-2 infection. Gut 2020; 69 (6): 997–1001. doi: 10.1136/gutjnl-2020-321013.
4. Su S, Shen J, Zhu L et al. Involvement of digestive system in Covid.19: manifestations, pathology, management and challenges. Ther Adv Gastroenterol 2020; 13. [online]. Available from: https: //covid19.elsevierpure.com/zh/publications/involvement-of-digestive-system-in-covid-19-manifestations-patholdoi: 10.1177/ 1756284820934626.
5. Mao R, Qiu Y, He JS et al. Manifestations and prognosis of gastrointestinal and liver involvement in patients with COVID-19: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2020; 5 (7): P667–P678. doi: https: //doi.org/10.1016/S2468-1253 (20) 30126-6.
6. Xiao F, Tang M, Zheng S et al. Evidence for gastrointestinal infection of SARS-CoV-2. Gastroenterology 2020; 158 (6): 1831–1833. doi: 10.1053/j.gastro.2020.02.055.
7. Wang W, Xu Y, Gao R et al. Detection of SARS-CoV-2 in different types of clinical specimen. JAMA 2020; 323 (18): 1843–1844. doi: 10.1001/jama.2020.3786.
8. Tian Y, Rong L, Nian W et al. Review article: Gastrointestinal features in COVID-19 and the possibility of faecal transmission. Aliment Pharmacol Therap 2020; 51 (9): 843–851. doi: 10.1111/apt.15731.
9. Gralnek IM, Hassan C, Beilenhoff U et al. ESGE and ESGENA position statement on gastrointestinal endoscopy and the COVID-19 pandemic. Endoscopy 2020; 52 (6): 483–490. doi: 10.1055/a-1155-6229.
10. Taxonera C, Sagastagoitika I, Alba C et al. 2019 novel coronavirus disease in patients with inflammatory bowel syndrome. [online]. Available from: https: //onlinelibrary.wiley.com/doi/10.1111/apt.15804. doi: 10.1111/apt.15 804
11. Azzam NA, Aljdbreen A, Almuhareb A et al. Disability and quality of life before and during the COVID-19 outbreak: A cross-sectional study in inflammatory bowel disease patients. Saudi J Gastroenterol 2020; 26 (5): 256–262. doi: 10.4103/sjg.SJG_175_20.
12. Brenner EJ, Ungaro RC, Colombel JF et al. SECURE-IBD database public data update [online]. Available from: https: //covidibd.org/current-data/.
13. Rubin DT, Feuerstein JD, Wang AY et al. AGA Clinical Practice Update on Management of Inflammatory Bowel Disease During the COVID-19 Pandemic: Expert Commentary. Gastroenterology 2020; 159 (1): 350–357. doi: 10.1053/j.gastro.2020.04.012.
14. Wang SH, Han P, Xiao F et al. Manifestations of liver injury in 333 hospitalized patients withcoronavirus disease 2019. Chin J Dig 2020; 40 : 157–161
15. Guan GW, Gao L, Wang JW et al. Exploring the mechanism of liver enzymes abnormalities in patients with novel coronavirus-infected pneumonia. Zhonghua Gan Zang Bing Za Zhi 2020; 28 : 100–106.
16. Kumar MP, Mishra S, Jha DK et al. Coronavirus disease (COVID-19) and the liver. A comprehensive review and metaanalysis. Hepatol Int 2020; 1–12. doi: 10.1007/s12072-020-10071-9.
17. Youssef M, Hussein M, Attia AS et al. COVID-19 and liver dysfunction: a systematic review and meta-analysis of retrospective studies. doi: 10.1002/jmv.26055.
18. Parohan M, Yaghoubi S, Seraji A. Liver injury is associated with severe coronavirus disease 2019 (COVID-19) infection. A systematic review and meta-analysis of retrospective studies. Hepatol Res 2020; 50 (8): 924–935. doi: 10.1111/hepr.13510.
19. Ji D, Quin E, Xu J et al. Non-alcoholic fatty liver disease in patients with COVID-19: a retrospective study. J Hepatol 2020; 73 (2): 451–453. doi: 10.1016/j.jhep.2020.03.044.
20. Zheng KI, Gao F, Wang XB et al. Letter to the Editor: Obesity as a risk factor for greater severity of COVID-19 in patients with metabolic associated fatty liver disease. Metabolism 2020; 108 : 154244. doi: 10.1016/j.metabol.2020.154244.
21. Portincasa P, Krawczyk M, Smyk W et al. COVID-19 and non-alcoholic fatty liver disease: two intersecting pandemics. Eur J Clin Invest 2020; 50 (10): e13338. doi: 10.1111/eci.13338.
22. Yang L, Li Ch, Wang J et al. A case series of COVID‐19 patients with chronic hepatitis B virus infection. J Med Virol 2020. doi: 10.1002/jmv.26201
23. Di Giorgio A, Nicastro E, Speziani C et al. Health status of patients with autoimmune liver disease during SARS-CoV-2 outbreak in northern Italy. J Hepatol 2020; 73 (3): 702–705. doi: 10.1016/j.jhep.2020.05.008.
24. Kushner T, Cafardi J. Chronic liver disease and COVID-19: Alcohol use disorder/alcohol-associated liver disease,/non-alcoholic fatty liver disease/non-Alcoholic steatohepatitis, autoimmune liver disease, and compensated cirrhosis. Clinical Liver Disease 2020; 15 : 195–199. doi: 10.1002/cld.974.
25. Iavarone M, D’Ambrosio R, Soria A et al. High rates of 30-d mortality in patients with cirrhosis and COVID-19. J Hepatol 2020; S0168-8278 (20) 30365-2. doi: 10.1016/j.jhep.2020.06. 001.
26. Bajaj JS, Garcia-Tsao G, Biggins SW et al. Comparison of mortality risk in patients with cirrhosis and COVID-19 compared with patients with cirrhosis alone and COVID-19 alone: multicentre matched cohort. Gut. doi: 10.1136/gutjnl-2020-322118.
27. Nicastro E, Di Giorgio A, Zambelli M et al. Impact of the Severe Acute Respiratory Syndrome Coronavirus 2 Outbreak on Pediatric Liver Transplant Recipients in Lombardy, Northern Italy. Liver Transpl 2020; 26 (10): 1359–1362. doi: 10.1002/lt.25840.
28. Bhoori S, Rossi RE, Citterio D et al. Coronaviruses and immunosuppressed patients: the facts during the third epidemic. Lancet Gastroenterol Hepatol 2020; 5 (6): 532–533. doi: 10.1016/S2468-1253 (20) 30116-3.
29. Nacif LS, Zanini LY, Waisberg DR et al. COVID-19 n solid organ transplantation patients: a systematic review. Clinics (Sao Paulo) 2020; 75: e1983. doi: 10.6061/clinics/2020/e1983. eCollection 2020.
30. Oyelade T, Alqahtani J, Canciani G. Prognosis of COVID-19 in patients with Liver and Kidney diseases.: an early systematic review and metaanalysis. Trop Mesed Infect Dis 2020; 5 (2): 80. doi: 10.3390/tropicalmed5020080.
31. Elens L, Langman LJ, Hesselink DA et al. Pharmacologic Treatment of Transplant Recipients Infected With SARS-CoV-2: Considerations Regarding Therapeutic Drug Monitoring and Drug-Drug Interactions. Ther Drug Monit 2020; 42 (3): 360–368. doi: 10.1097/FTD.0000000000000761.
32. El Kassas M, Alborale M, Balakosy AA et al. Liver transplantation in the era of COVID-19. Arab J Gastroenterol 2020; 21 (2): 69–75. doi: 10.10168j.ajg.2020.04.019.
33. Boyarsky BJ, Po-Yu Chiang T, Werbel WA et al. Early impact of COVID-19 on transplant center practices and policies in the United States. Am J Transplant 2020; 20 (7): 1809–1818. doi: 10.1111/ajt.15915.
34. Sahin TT, Akbulut S, Yimaz S. COVID-19 pandemic: its impact on liver disease and liver transplantation. World J Gastroenterol 2020; 26 (22): 2987–2999. doi: 10.3748/wjg.v26.i22.2987.
35. Mao R, Qiu Y, He JS et all. Manifestations and prognosis of gastrointestinal and liver involvement in patients with COVID-19: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2020; 5 (7): 667–678. doi: 10.1016/S2468-1253 (20) 30126-6.
36. Fix OK, Hameed B, Fontana RJ et al. Clinical Best Practice Advice for Hepatology and Liver Transplant Providers During the COVID-19 Pandemic: AASLD Expert Panel Consensus Statement. Hepatology 2020; 72 (1): 287–304. doi: 10.1002/hep.31281.
37. Boettler T, Newsome PN, Mondelli MU et al. Care of patients with liver disease during the COVID-19 pandemic: EASL-ESCMID position paper. JHEP Rep 2020; 2 (3): 100113. doi: 10.1016/j.jhepr.2020.100113.
38. Dhar D, Mohanty A. Gut microbiota a COVID-19 – possible link and implications. Virus Res 2020; 285 : 198018. doi: 10.1016/ j.virusres.2020.198018.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastroenterologie v době pandemie covid-19
- Gastrointestinální onkologie
- Kvíz z klinické praxe
- Surveillance of hepatocellular carcinoma in Slovakia
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
- Současné možnosti predikce léčebné odpovědi na neoadjuvantní chemoradioterapii u karcinomu konečníku
- Fenotyp akútneho hepatálneho zlyhania pri inaparentnom malobunkovom karcinóme pľúc
- Prevalencia hypovitaminózy D a poruchy glukózovej tolerancie u pacientov s neuroendokrinnými tumormi podstupujúcich liečbu somatostatínovými analógmi
- Covid-19 a hepatogastroenterologie
- Srdeční selhání u pacientky s cirhotickou kardiomyopatií jako neobvyklá indikace k transplantaci jater
- První použití single-use duodenoskopu v České republice
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Prof. MUDr. Jiří Ehrmann, CSc., osmdesátiletý
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Výběr z mezinárodních časopisů
- Budesonid v léčbě idiopatických střevních zánětů
- Primární biliární cholangitida – zacíleno na farnesoidní X receptor
- Správná odpověď na kvíz Endometrióza postihující serózní povrch (okruží) terminálního ilea
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 1
- Budesonid v léčbě idiopatických střevních zánětů
- Nová členka redakční rady MUDr. Kristýna Zárubová
- Prediktory pokročilé kolorektální neoplazie ve screeningu kolorektálního karcinomu – průběžné výsledky multicentrické prospektivní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



