-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Idiopatický hypereozinofilní syndrom s postižením zažívacího traktu
Idiopathic hypereosinophilic syndrome with gastrointestinal involvement
Idiopathic hypereosinophilic syndrome (iHES) is a rare disorder with an unclear cause that is characterized by a persistent increase in the number of eosinophilic granulocytes in the peripheral blood and organ damage. The differential diagnosis of hypereosinophilia is broad – the cause may be primary (clonal), secondary (reactive – most often in the context of allergic, parasitic, autoimmune or malignant diseases), genetic (familial) or idiopathic (determined per exclusionem). This case report describes a patient with recurrent episodes of abdominal pain, ascites, and leukocytosis with hypereosinophilia, who underwent extensive examinations over the years, including two diagnostic laparoscopies. CT scans revealed abnormalities in the small bowel and stomach region, and histological and cytological examinations confirmed an increased number of eosinophils in the duodenal villi and eosinophilic ascites. Gastroscopy raised suspicion of eosinophilic esophagitis and stomach involvement, but this was not confirmed histologically. The ethiology of mild hepatopathy with elevated transaminases remains unclear, as the patient refused liver biopsy, repeatedly. After ruling out primary and secondary causes of hypereosinophilia, the idiopathic hypereosinophilic syndrome was diagnosed and corticotherapy was initiated with good clinical and laboratory outcome and normalization of eosinophil count.
Keywords:
ascites – eosinophilia – hypereosinophilia – hypereosinophilic syndrome
Autori: D. Husáková 1
; Š. Konečný 2
Pôsobisko autorov: Endoskopické oddělení, Nemocnice Milosrdných bratří, příspěvková organizace, Brno 1; Interní gastroenterologická klinika LF MU a FN Brno 2
Vyšlo v časopise: Gastroent Hepatol 2024; 78(1): 47-52
Kategória: Digestivní endoskopie: kazuistika
doi: https://doi.org/10.48096/ccgh202447Súhrn
Idiopatický hypereozinofilní syndrom (iHES) je vzácným onemocněním s nejasnou příčinou, které je charakterizováno perzistujícím zvýšením počtu eozinofilních granulocytů v periferní krvi a orgánovým postižením. Diferenciální diagnostika hypereozinofilie je přitom široká – příčina může být primární (klonální), sekundární (reaktivní – nejčastěji v rámci alergických, parazitárních, autoimunitních či maligních onemocnění), genetická (familiární) či idiopatická (stanovená per exclusionem). Kazuistika popisuje případ pacientky s opakovanými atakami bolestí břicha, ascitem a leukocytózou s hypereozinofilií, která byla v průběhu let opakovaně obšírně vyšetřována včetně dvou diagnostických laparoskopií. Na CT byla popisována patologie v oblasti tenkých kliček a žaludku, histologické a cytologické vyšetření pak prokázalo zvýšený počet eozinofilů v klcích duodena a eozinofilní ascites. Gastroskopicky bylo také vysloveno podezření na eozinofilní ezofagitidu a postižení žaludku, jež se ale histologicky neprokázalo. Nejasnou zůstává etiologie mírné hepatopatie s elevací transamináz, biopsii jater pacientka opakovaně odmítla. Po vyloučení primární a sekundární příčiny hypereozinofilie byl diagnostikován idiopatický hypereozinofilní syndrom a byla zahájena kortikoterapie s dobrým klinickým i laboratorním efektem a normalizací počtu eozinofilů.
Klíčová slova:
ascites – eozinofilie – hypereozinofilie – hypereozinofilní syndrom
Úvod
Eozinofilie provází řadu interních i hematologických onemocnění [1] a je definována absolutním počtem eozinofilů > 0,5 × 109/ l [2,3]. O hypereozinofilii (HE) se pak jedná při hodnotách > 1,5 × 109/ l [1–3].
Hypereozinofilní syndrom (HES) diagnostikujeme v případě, že je prokázána hypereozinofilie a s ní související orgánové postižení [1–4], které nelze vysvětlit jiným onemocněním [3]. Podle kritérií Chusida et al. z roku 1975 bylo ke stanovení diagnózy HES nutno prokázat trvání HE v délce alespoň 6 měsíců [1,2,5]. Vzhledem ke zlepšení diagnostických možností a nutnosti rychlé terapie k zamezení progrese orgánového poškození není již tato podmínka vyžadována zcela konzistentně [5]. Multidisciplinární mezinárodní pracovní skupina pro eozinofilní onemocnění (ICOG-EO – International Cooperative Working Group on Eosinophil Disorders) označuje za perzistentní HE prokázanou opakovaně s odstupem alespoň 2 týdnů [3].
Podle aktualizované klasifikace navržené ICOG-EO pak rozlišujeme čtyři typy HES [3]:
- primární (neoplastický);
- sekundární (reaktivní);
- familiární;
- idiopatický.
Sekundární HES je nejčastější variantou [3]. Mezi primární (klonální) příčiny HES patří myeloidní/ lymfoidní neoplazie s eozinofilií a přestavbou genů PDGFRA, PDGFRB, FGFR1 či PCM-JAK2, dále klasické myeloidní neoplazie definované Světovou zdravotnickou organizací (akutní myeloidní leukemie, akutní lymfoblastová leukemie, myelodysplatický syndrom, myeloproliferativní onemocnění, systémová mastocytóza) a chronická eozinofilní leukemie [3,5].
Sekundární (reaktivní) HES je způsoben nadprodukcí cytokinů (interleukinů – IL-3, IL-5 a granulocyty a makrofágy stimulujícího faktoru – GM-CSF), které stimulují proliferaci a aktivaci eozinofilů [1–3]. Celosvětově jsou nejčastější příčinou reaktivního HES parazitární infekce [1]. Mezi další vyvolávající onemocnění patří např. alergie, polékové reakce, infekční a autoimunitní nemoci či malignity [1–3].
Zvláštní podskupinou sekundárního HES je lymfocytární varianta (L-HES), u níž jsou eozinofily stimulovány cytokiny produkovanými aberantními T lymfocyty (nejčastěji CD3–/ CD4+) [3,5].
Familiární hypereozinofilie je vzácně se vyskytující autozomálně dominantní onemocnění s převážně benigním průběhem [1]. Postižení bývají asymptomatičtí, ale vzácně může dojít k rozvoji orgánového postižení [4].
Idiopatický HES (iHES) je pak diagnózou per exclusionem, pokud není zjištěna jiná příčina [1–3].
Postižen může být jakýkoli orgán či tkáň – nejčastěji se jedná o kůži, plíce, srdce, centrální nervový systém, periferní nervy či zažívací trakt [1]. Zejména kardiální poškození může být pro pacienty život ohrožující [1].
První linií léčby iHES jsou kortikosteroidy [1,2,4,5]. V případě rezistence na kortikosteroidy nebo při snaze o snížení jejich dávky se uplatňují také hydroxyurea, interferon-alfa a nově i monoklonální protilátky proti IL-5 (např. mepolizumab) [2,4,5].
Obr. 1. CT břicha – zesílená stěna aborální části žaludku dorzálně (šipka), volná tekutina v dutině břišní. 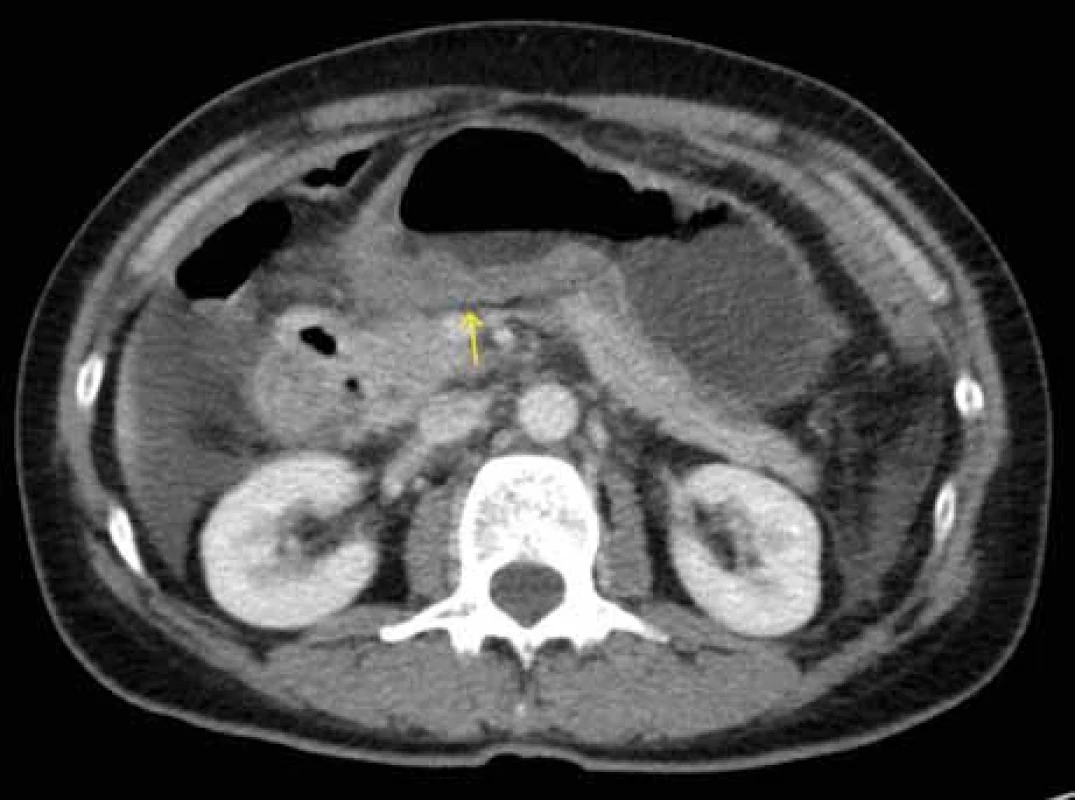
Zdroj: Klinika radiologie a nukleární medicíny FN Brno.
Fig. 1. Abdominal CT scan – thickened wall of the aboral part of the stomach dorsally (arrow), free fl uid in the abdominal cavity.
Source: Department of Radiology and Nuclear Medicine, University Hospital Brno.Obr. 2. CT břicha – zesílená stěna zachycených kliček jejuna s edémem řas (žluté šipky), dilatace kličky orálního jejuna (červená šipka), zachycena volná tekutina především vlevo. 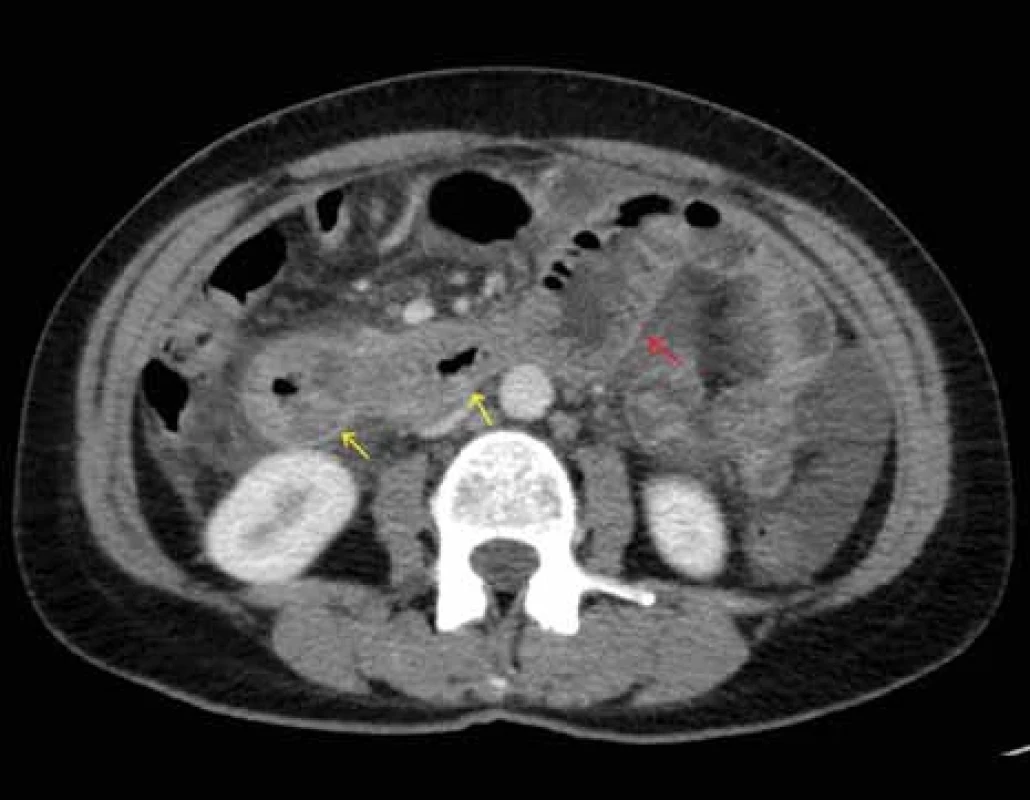
Zdroj: Klinika radiologie a nukleární medicíny FN Brno.
Fig. 2. Abdominal CT scan – thickened wall of depicted jejunal loops with edema of folds (yellow arrows), dilatation of the oral jejunal loop (red arrow), free fl uid mainly on the left.
Source: Department of Radiology and Nuclear Medicine, University HospitalObr. 3. CT břicha – zesílená stěna orálního jejuna. 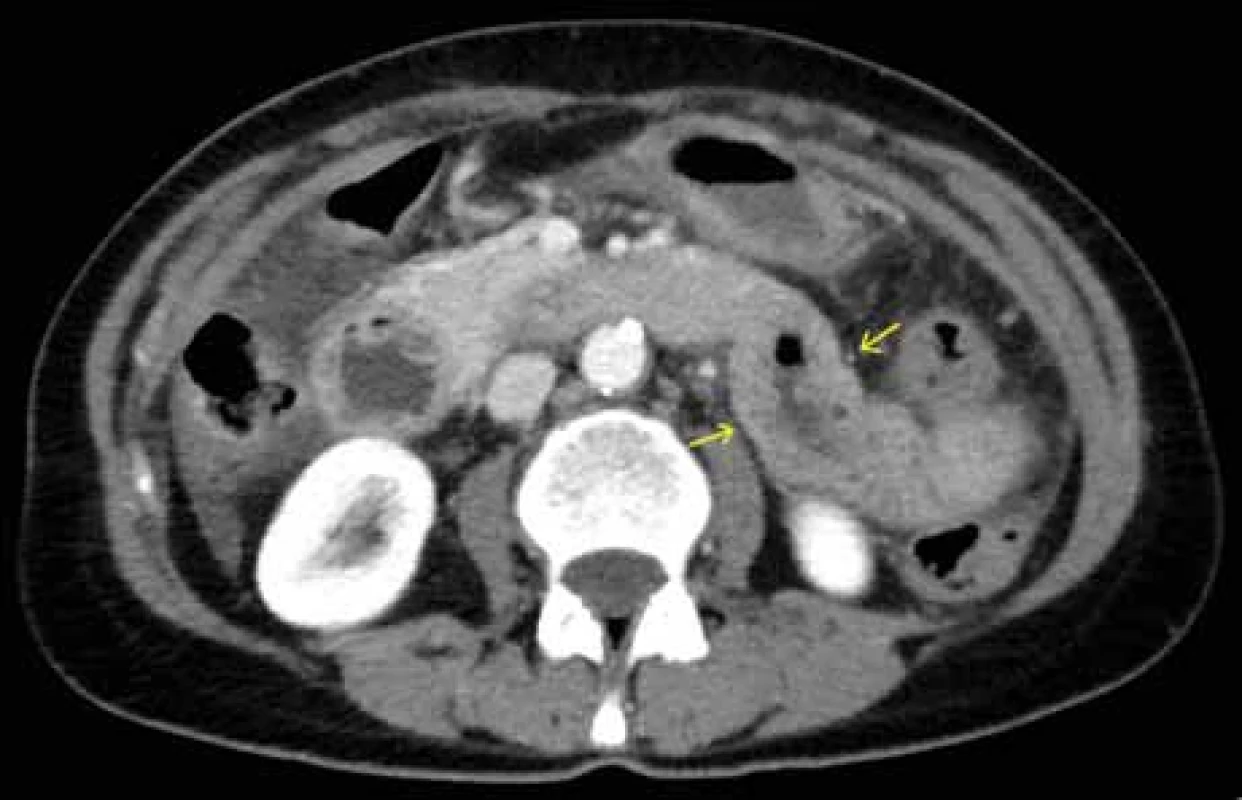
Zdroj: Klinika radiologie a nukleární medicíny FN Brno.
Fig. 3. Abdominal CT scan – thickened wall of the oral jejunum.
Source: Department of Radiology and Nuclear Medicine, University Hospital Brno.Obr. 4. CT břicha – zesílená stěna kliček jejuna v levém mezogastriu (šipky), volná tekutina především při konvexitě jater a v okolí dělohy v malé pánvi. 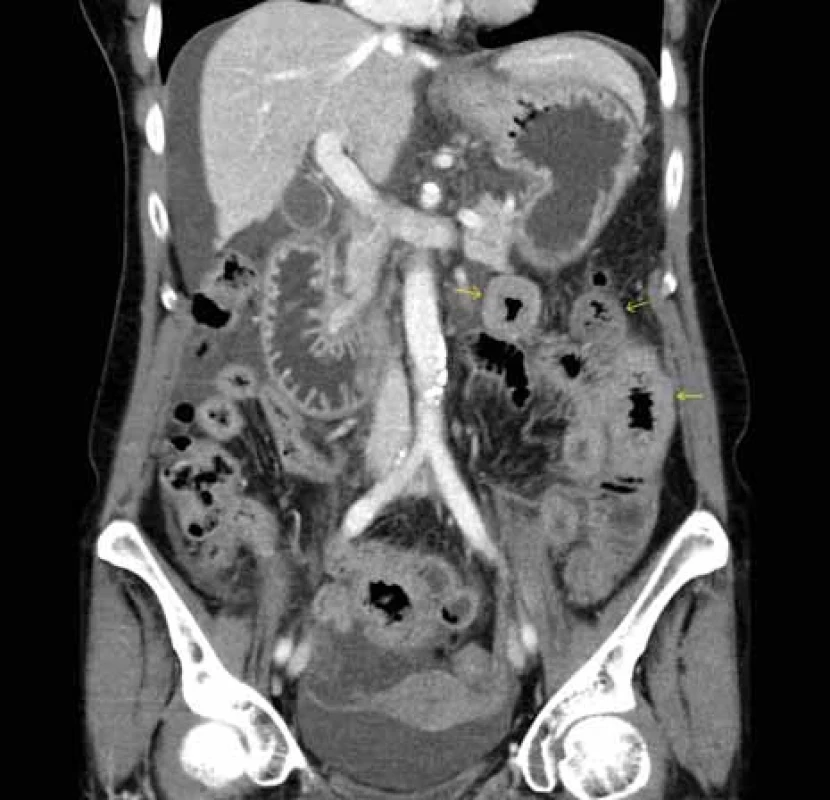
Zdroj: Klinika radiologie a nukleární medicíny FN Brno.
Fig. . Abdominal CT scan – thickened wall of jejunal loops in left mesogastrium (arrows),
free fl uid predominantly at the convexity of the liver and around the uterus in the small pelvis.
Source: Department of Radiology and Nuclear Medicine, University Hospital Brno.a) Mapovitá hyperemická slizniční léze žaludku. b) Hyperemická sliznice duodena. 
Fig. 5 a) Map-like hyperemic mucosal lesion of stomach.
5b) Hyperemic duodenal mucosa.Obr. 6, 7. Zvýšený počet eozinofi lních granulocytů v lamina propria mucosae s tvorbou clusterů (více než 30 eozinofi lů/HPF). Barvení hematoxyl-eozin, zvětšení 400×. 
Zdroj: Ústav patologie FN Brno.
Fig. 6, 7. Increased number of eosinophilic granulocytes in lamina propria mucosae with cluster formation (more than 30 eosinophils/HPF).
Hematoxylin-eosin staining, magnifi cation 400×.
Source: Department of Pathology, University Hospital Brno.Obr. 8, 9. Pouze reaktivní změny sliznice duodena s nespecifi ckým ložiskovým nakupením eozinofi lů. Barvení hematoxyl-eozin, zvětšení 400×. 
Zdroj: Ústav patologie FN Brno.
Fig. 8, 9. Only reactive changes of the duodenal mucosa with non-specifi c localized eosinophil accumulation. Hematoxylin-eosin staining, magnifi cation 400×.
Source: Department of Pathology, University Hospital Brno.Popis případu
Šedesátiletá pacientka byla přijata v květnu 2023 na Interní gastroenterologickou kliniku FN Brno k došetření opakovaných bolestí břicha, průjmu, ascitu a hypereozinofilie. Pacientka v době přijetí neužívala pravidelně žádnou medikaci a měla negativní alergologickou anamnézu. V minulosti prodělala borreliózu, akutní pankreatitidu a appendektomii. Abúzus alkoholu neguje, v cestovatelské anamnéze má pouze Chorvatsko.
První epizoda nejasných bolestí břicha s nálezem ascitu proběhla v roce 2015. Laboratorní testy ukázaly leukocytózu (14,6 × 109/ l) s hypereozinofilií (2,83 × 109/ l) a elevaci CA 125 (150 kU/ l). Jaterní testy i ostatní onkomarkery byly v normálním rozmezí. Na CT břicha byla popsána zesílená stěna aborální části žaludku (obr. 1), edém řas a dilatace kliček orální poloviny jejuna (obr. 2), gastroskopicky pak bulbitida a gastritida (Helicobacter pylori negativní). Diagnostická laparoskopie neprokázala malignitu ani jinou vysvětlující příčinu obtíží. Cytologicky byl ascites vyhodnocen jako reaktivní zánětlivý výpotek. Pacientka byla zaléčena inhibitory protonové pumpy, infuzemi, analgetiky a bolesti břicha postupně odezněly. S odstupem bylo provedeno kontrolní CT vyšetření s regresí ascitu i patologických změn stěny žaludku a tenkého střeva.
Následujících 7 let byla pacientka bez obtíží, až v říjnu 2022 došlo k opětovnému rozvoji bolestí břicha a ascitu. Týden před počátkem symptomů doužívala Augmentin pro protrahovaný infekt horních cest dýchacích. Laboratorně dominovala leukocytóza (19,4 × 109/ l) s hypereozinofilií (5 × 109/ l), dále mírná, ale progredující elevace alaninaminotransferázy (ALT) a následně i aspartátaminotransferázy (AST); ALT 0,97 μkat/ l, AST 0,64 μkat/ l se vzestupem na maximum 10, resp. 6 μkat/ l. Ultrazvuk (UZ) ukázal zesílenou stěna duodena, ascites a steatózu jater. Další provedená vyšetření (CT břicha, gastroskopie, koloskopie, gynekologie a diagnostická laparoskopie) byla však bez další patologie. Stran hepatopatie byly vyloučeny infekční hepatitidy, z autoprotilátek pouze pozitivita ASMA (protilátky proti hladkým svalům), elastografický nález byl v normě. Biopsii jater však pacientka odmítla. Následně při dispenzarizaci došlo k postupnému poklesu transamináz na 1,13 μkat/ l; resp. 0,85 μkat/ l.
Další relaps nastal v květnu 2023 – výrazné postprandiální bolesti břicha omezující příjem stravy a tekutin, průjmy, hmotnostní úbytek 5 kg. Na CT břicha byl popsán opět ascites a zesílení stěny tenkého střeva v oblasti jejuna a D4 duodena (obr. 3, 4), laboratorně leukocytóza s výraznou hypereozinofilií až 16 × 109/ l a jen s mírnou elevací ALT a AST (maximálně do 2 μkat/ l).
Diagnostická laparoskopie potvrdila segmentární zesílení a překrvení stěny kličky jejuna, v biopsii tukové částečky peritonea eozinofilní zánětlivý infiltrát. Cytologie ascitu prokazuje eozinofilní výpotek. Při gastroskopii byl popsán obraz suspektního eozinofilního zánětu jícnu s rýhami (furrows), v žaludku mapovitá hyperemická slizniční léze velikosti 2 × 2,5 cm v oblasti antrokorporálního přechodu (obr. 5a) a hyperemická sliznice v D2 duodena (obr. 5b). Byly odebrány vzorky na histologii jumbo kleštěmi a byl prokázán fokálně zvýšený počet eozinofilů v klcích duodena včetně tvorby klastrů (obr. 6, 7), z biopsie žaludku vyšla pouze reaktivní gastropatie.
V rámci diferenciální diagnostiky hypereozinofilie byla doplněna řada vyšetření k vyloučení její primární (morfologické vyšetření krve a kostní dřeně, průtoková cytometrie, cytogenetika vč. fluorescenční in situ hybridizace, vyloučení mutací vč. fúze FIP1L1/ PDGFRA, klonality T lymfocytů, stanovení tryptázy, sekvenování nové generace) či sekundární etiologie (vyloučení infekce vč. vyšetření stolice a sérologie parazitárních onemocnění, alergologické vyšetření, stanovení hladiny kortizolu, volného tyroxinu, tyreotropního hormonu, hladin imunoglobulinů, autoprotilátek vč. ENA, ANA, ANCA, RF, antiGBM, onkomarkerů aj.). V myelogramu je patrná výrazná eozinofilie (34,2 %) bez dysplastických změn, bez zmnožení blastů. Z onkomarkerů přetrvává pozitivita CA 125 (od roku 2015). Ostatní vyšetření byla negativní. Biopsii jater pacientka opět odmítla. Dále bylo vyloučeno oční, plicní, kardiální i neurologické postižení.
Pacientka splnila kritéria pro diagnózu iHES a byla zahájena terapie prednisonem v úvodní dávce 40 mg s dobrým klinickým i laboratorním efektem a normalizací počtu eozinofilů. Endoskopický obraz je při kontrole po 5 měsících normalizován, histologický nález již neprokazuje eozinofilní duodenitidu, pouze reaktivní změny sliznice duodena s nespecifickým fokusem nakupených eozinofilů (obr. 8, 9). Dle sonografického vyšetření došlo k regresi změn na jejunu a vymizení ascitu.
Diskuze
V kazuistice je popsán případ pacientky s recidivujícími epizodami bolestí břicha, nálezem ascitu a hypereozinofilie. Na zobrazovacích vyšetřeních byla opakovaně popsána patologie v oblasti tenkých kliček a žaludku. Histologické a cytologické vyšetření pak prokazují eozinofilní ascites a zvýšený počet eozinofilů v klcích duodena. Gastroskopicky je také podezření na eozinofilní ezofagitidu a event. postižení žaludku, jež se ale histologicky nepodařilo prokázat. Nejasnou zůstává etiologie hepatopatie – nelze vyloučit polékové poškození (v návaznosti na užívání antibiotik v roce 2022), autoimunitní etiologii či postižení v rámci HES.
Pacientka splnila kritéria pro hypereozinofilní syndrom. V rámci diferenciální diagnostiky bylo vyloučeno hematoonkologické onemocnění a byla provedena řada vyšetření k vyloučení sekundární příčiny hypereozinofilie. HES byl tedy uzavřen jako idiopatický a byla zahájena kortikoterapie s dobrým klinickým i laboratorním efektem. Došlo k normalizací počtu eozinofilů a endoskopického nálezu, sonograficky bylo potvrzeno vymizení ascitu a změn na jejunu.
Pacientka bude nadále sledována stran vývoje krevního obrazu, hepatopatie, postižení zažívacího traktu a event. rozvoje dalšího orgánového postižení v rámci HES. Dávka kortikosteroidů bude postupně redukována.
Nelze vyloučit, že v budoucnu dojde v rámci dispenzarizace k odhalení sekundární příčiny HES – např. alergenu, léku, event. k rozvoji systémového onemocnění, které v současné době není jednoznačně prokazatelné.
Závěr
Cílem této kazuistiky je upozornit na vzácnou diagnózu hypereozinofilního syndromu s možností postižení zažívacího traktu, které se může vyskytnout izolovaně nebo jako součást multiorgánového onemocnění.
Další použité zkratky
ANA
antinukleární protilátkyANCA
protilátky proti cytoplazmě neutrofilůantiGBM
protilátky proti bazální membráně glomerulůENA
autoprotilátky proti extrahovatelným jaderným antigenůmFIP1L1/ PDGFRA
Fip1-like-1-platelet-derived growth factor receptor alphaFGFR1
fibroblast growth factor receptorPCM-JAK2
pericentriolar material 1-Janus kinase 2PDGFRA
platelet derived growth factor receptor alfaPDGRFB
platelet derived growth factor receptor betaRF
revmatoidní faktor
Zdroje
1. Novotný J. Hypereozinofilie. Transfuze Hematol Dnes 2021; 27(4): 278–282. doi: 10.48095/ ccta hd2021278.
2. Doubek M, Brychtová Y, Kissová J et al. Diferenciální diagnostika eosinofilie. Vnitř Lék 2014; 60(2): 21–27.
3. Valent P, Klion AD, Roufosse F et al. Proposed refined diagnostic criteria and classification of eosinophil disorders and related syndromes. Allergy 2023; 78(1): 47–59. doi: 10.1111/ all.15544.
4. Dispenza MC, Bochner BS. Diagnosis and Novel Approaches to the Treatment of Hypereosinophilic Syndromes. Curr Hematol Malig Rep 2018; 13(3): 191–201. doi: 10.1007/ s118 99-018-0448-8.
5. Shomali W, Gotlib J. World Health Organization – defined eosinophilic disorders: 2022 update od diagnosis, risk stratification, and management. Am J Hematol 2022; 97(1): 569–148. doi: 10.1002/ ajh.26352.
ORCID autorů
D. Husáková 0009-0001-7347-2880,
Š. Konečný 0000-0002-7709-3079.
Doručeno/ Submitted: 9. 10. 2023
Přijato/ Accepted: 26. 11. 2023MU Dr. Dagmar Husáková
Endoskopické oddělení
Nemocnice Milosrdných bratří, příspěvková organizace
Polní 3 639 00 Brno
dagmar.husakova@nmbbrno.czŠtítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2024 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Heuréka!
- Jaké bude vaše doporučení pro terapii těžké ulcerózní kolitidy?
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
- Snížená hladina magnezia v moči po ileokolické resekci u pacientů s Crohnovou chorobou
- Mirikizumab – první protilátka anti-IL12 p19 v terapii ulcerózní kolitidy
- Efficacy and safety of switching from intravenous to subcutaneous CTP-13 treatment in IBD patients – a one-year retrospective study from large Slovak IBD centre
- Metotrexát – znovuobjevený lék u Crohnovy nemoci
- Hidradenitis suppurativa, intestinal microbiome and SIBO – a comprehensive overview of the issue
- Idiopatický hypereozinofilní syndrom s postižením zažívacího traktu
- Simultánní robotická resekce kolorektálního karcinomu a jaterní metastázy – naše první zkušenosti
- Výběry z mezinárodních časopisů
- Hoffmanová I. Abdominální sonografie žlučníku a žlučových cest
- Kreditovaný autodidaktický test: IBD
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metotrexát – znovuobjevený lék u Crohnovy nemoci
- Idiopatický hypereozinofilní syndrom s postižením zažívacího traktu
- Mirikizumab – první protilátka anti-IL12 p19 v terapii ulcerózní kolitidy
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku Crohnovy choroby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



