-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Analýza pulzové vlny v objektivizaci bolesti – předběžné sdělení
Pulse Wave Analysis in Objective Evaluation of Pain – a Preliminary Communication
The authors present the results of a peripheral pulse wave analysis obtained by screening the volume pulse of the radial artery with respect to the perception of pain. Time records of peripheral pulsation were used for the analysis in 26 patients (with an average age of 23.3 years) examined in rest and when feeling pain caused by routine surgical procedures (group l, n = 14, 53.8 % of patients) or present in a post-op period (group II, n = 12, 46.2 % of patients). An eleven-grade visual numeric scale or a universal pain assessment tool (UPAT) was used for subjective assessment of pain. The average value of the intensity of pain was 3.12 in group l and 2.33 in group II. The obtained curves were analysed visually and the results were processed statistically. Changes in the time course of the pulse wave were recorded in 25 cases (i.e. 96.15 %) during a pain experience. Two types of changes were observed – a split in the initial vibration with a loss of the characteristic dicrotism, and an expanding and levelling of the first vibration. In both the cases, relative delay in the onset of the second vibration was recorded on a non-constant basis. Both the types of changes occurred simultaneously on a single curve in 76.9 %, only the split occurred in 19.2 %, while isolated levelling was not recorded at all. In one case, changes were evaluated as non-characteristic. Subsequent statistical correlation and regression analysis did not confirm the dependence between the frequency of splits or levelling and the intensity of pain.
Key words:
peripheral pulse wave – radial artery – volume pulsation – pain measurement – visual analogue scale
Autori: K. Navrátil 1; J. Hálek 2; P. Havránek 3; S. Binder 2
Pôsobisko autorov: Klinika transplantační chirurgie IKEM Praha 1; Ústav lékařské biofyziky LF UP v Olomouci 2; Klinika dětské chirurgie a traumatologie 3. LF UK a FTNsP, Praha 3
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(3): 303-308
Kategória: Přehledný článek
Súhrn
Autoři prezentují dosavadní výsledky analýzy periferní pulzové vlny získané snímáním objemové pulzace arteria radialis ve vztahu k vnímání bolesti. K analýze byly použity časové záznamy periferní pulzace u 26 pacientů (průměrný věk 23,3 roku) vyšetřených v klidu a za bolestivého prožitku, který byl způsoben rutinní chirurgickou instrumentací (skupina I, n = 14, 53,8 % pacientů) nebo byl součástí pooperačního období (skupina II, n = 12, 46,2 % pacientů). K subjektivnímu hodnocení bolesti byla použita standardní 11stupňová vizuální numerická škála nebo univerzální dotazník bolesti (UPAT). Průměrná hodnota intenzity bolesti byla v I. skupině 3,12 a ve II. skupině 2,33. Získané křivky byly vizuálně analyzovány a výsledky statisticky zpracovány. Za bolestivého prožitku byly v 25 případech (96,15 %) zaznamenány změny na časovém průběhu pulzové vlny. Popsány byly 2 typy změn – rozštěp iniciálního kmitu se ztrátou charakteristické dikrocie a rozšíření a oploštění prvního kmitu. V obou případech se nekonstantně vyskytovalo relativní zpoždění nástupu druhého kmitu. Oba dva typy změn zároveň se na jedné křivce vyskytovaly v 76,9 %, pouhý rozštěp v 19,2 %, izolovaná přítomnost oploštění zaznamenána nebyla. V jednom případě byly změny hodnoceny jako necharakteristické. Následná statistická korelační a regresní analýza nepotvrdila závislost četnosti výskytu rozštěpů nebo oploštění na intenzitě bolesti.
Klíčová slova:
periferní pulzová vlna – arteria radialis – objemová pulzace – měření bolesti – vizuální analogová škálaÚvod
Bolest je dle Mezinárodní společnosti pro studium bolesti definována jako „nepříjemný smyslový a emoční prožitek (zážitek) spojený se skutečným nebo potenciálním poškozením tkáně, nebo popisovaný výrazy pro takové poškození“ [1,2]. Popis a objektivizace bolesti byl a stále je spíše doménou psychologie než somatické medicíny. Z pohledu psychologa se bolest skládá ze 2 základních komponent – senzorické a afektivní. Senzorická komponenta popisuje intenzitu vnímání bolesti, zatímco afektivní její „nepříjemnost“ [3]. K měření intenzity bolesti jako součásti patologického procesu se užívají vizuální analogové škály nebo numerická škála, případně jejich kombinace. Při použití numerické škály bolesti (NS) respondent hodnotí intenzitu vnímané bolesti celým číslem v intervalu od 0 do 10, kde 0 představuje žádnou a 10 maximální možnou bolest [4]. Vizuální analogová škála (VAS) je např. úsečka o 100 dílech, na které pacient graficky vyznačí intenzitu prožívané bolesti [3]. K vyšetřování dětí je vhodná tzv. facial grimace scale [5], což je v zásadě kombinace vizuální a numerické škály. V klinické praxi je nejpoužívanějším nástrojem Universal Pain Assessment Tool (UPAT) [6], dostupný i v české modifikaci pod názvem Univerzální hodnotící škála bolesti, obsahující všechny důležité hodnotící škály v jednom formuláři. K popisu charakteru, typu, tedy afektivní složky bolesti, lze použít např. McGill Pain Questionairre, resp. jeho krátkou formu [7]. Experimentálně se k objektivizaci bolesti užívá rovněž hodnocení aktuální reaktivity subjektu na bolestivé stimuly zpravidla ve spojení s dynamickou zobrazovací metodou [8,9]. Vedle hodnocení přirozeně se vyskytující bolesti lze výše popsanými metodami hodnotit rovněž bolest uměle vyvolanou. V tomto případě je subjekt vystaven bolestivému podnětu působením různých energií. Dostatečně standardizovaný je v tomto směru např. cold pressor test [10], při kterém vyšetřovaný ponoří předloktí do chladné vody a následně je zaznamenávána intenzita narůstající bolesti, tlaková algometrie (cuff-algometry) [11], využívající působení tlaku a ischemie na končetinu. Z dalších metod uvádíme např. termotest užívající kontaktního nebo sálavého tepla [12], von-Freyova vlákna (Pin-prick test) [13] a vibrační algometrie [12,13] s mechanickou ladičkou o frekvenci 64 Hz. Publikováno bylo i pozorování změny kožní vodivosti v závislosti na intenzitě vnímání bolesti [14].
Pulzová vlna vzniká během srdeční revoluce, při které dochází k vypuzení systolického objemu krve z levé komory do velkého oběhu [15]. Arteriální systém se s tímto rychle vypuzeným objemem vyrovnává svou elasticitou, tedy schopností krátkodobého zvětšení průřezu arterie, kterým vyrovnává nepoměr v objemu nacházejícím se v daném okamžiku ve sledovaném segmentu arterie. Tento tzv. objemový pulz bezprostředně po systole prochází celým arteriálním systémem velkou rychlostí, neporovnatelně větší, než je vlastní rychlost toku okysličené krve. Tato rychlost šíření pulzové vlny (PWV) [16] je měřitelná, definována jako poměr vzdálenosti měřeného bodu na periferní arterii od srdce a časového intervalu měřeného od vrcholu kmitu R EKG záznamu, prováděného současně se záznamem pulzové vlny, do paty 1. kmitu pulzové vlny. Patří mezi hemodynamické parametry cévního systému jedince. Pulzová vlna se dále na periferii odráží zpět, takže vytváří stojaté vlnění s maximy a minimy [17]. Na časovém záznamu pulzové vlny periferní arterie (obr. 1) lze tedy vysledovat více, zpravidla 2 amplitudy odpovídající tlumenému kmitu. Tomuto jevu říkáme dikrocie [15]. Mezi další hemodynamické parametry měřitelné na časovém průběhu pulzové vlny patří: vrcholový čas (CT), relativní vrcholový čas (RCT), meziraménková vzdálenost (IWT) – čas prvního kmitu ve 2/3 jeho amplitudy, systolická amplituda (A), čas dikrotické vlny (RDT), amplituda dikrotické vlny (RDA), augmentační index (Aix) a čas druhé postupné vlny (T2) [16]. Tyto parametry jsou u daného jedince za standardních podmínek vysoce konstantní. Korpas [16] uvádí průměrnou variabilitu parametrů odvozených z časového průběhu do 6 %. Nejstabilnějším parametrem je v tomto ohledu RDT s variačním koeficientem 3,47 %.
Obr. 1. Časový průběh periferní pulzové vlny s výčtem měřitelných parametrů. 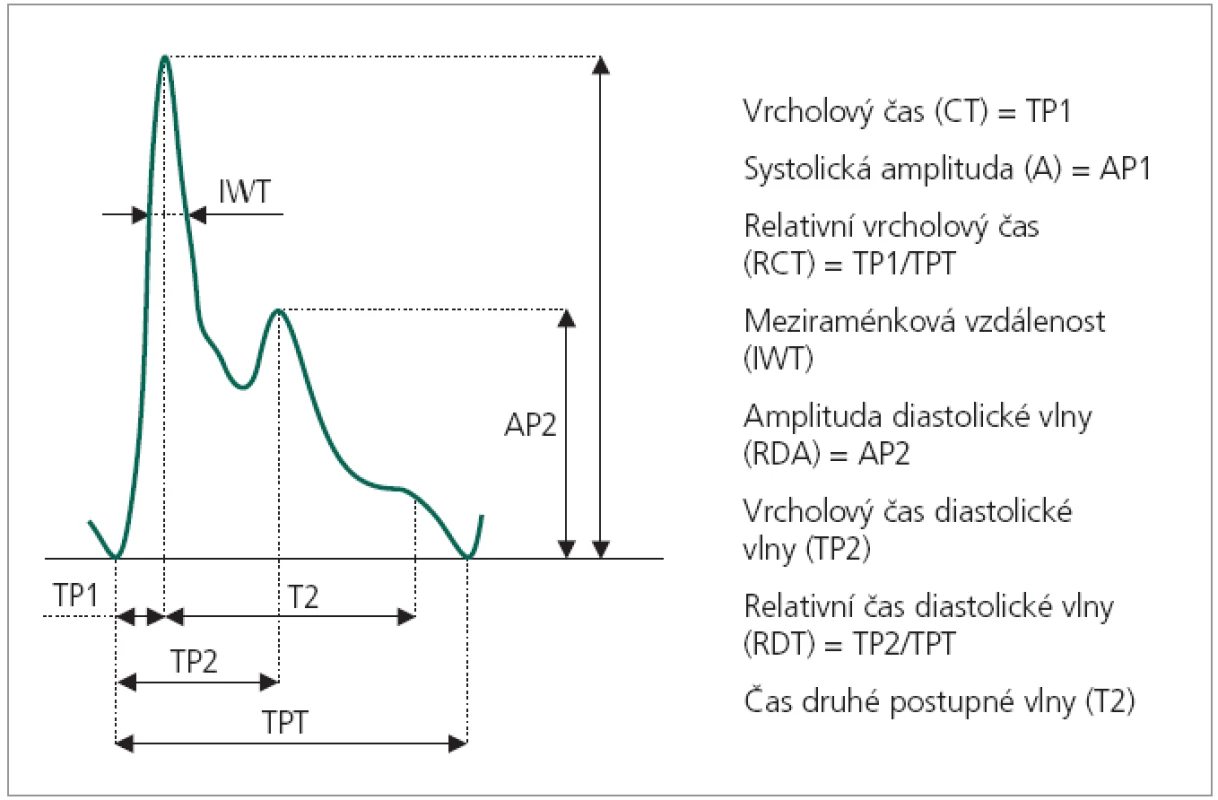
K zachycení průběhu pulzové vlny lze použít různé metody. Historicky nejstarší je pletyzmografie, tedy obecná metoda snímání změn definovaného objemu. K záznamu pulzové vlny ji použil Myers již v roce 1964 [18]. Použil nejjednodušší, tzv. strain-gauge pletyzmografii, což je ve své podstatě dynamický záznam pulzace končetiny, na níž je přiložena tonometrická manžeta s kapalinovou náplní běžně užívaná k měření krevního tlaku. Modernější metody pletyzmografie používají jiné principy, jako měření indukčnosti kompartmentů [19] nebo měření intenzity procházejícího záření [20]. V praxi jsou výrazně použitelnější sonografické metody snímání pulzové vlny. Lze použít jak klasický B-mód zobrazení změn průměru arterie [21], tak dopplerometrické měření změn průtokové rychlosti proudící krve [22].
Cíl práce
Cílem naší práce bylo experimentálně ověřit vliv bolesti na tvar periferní pulzové vlny zaznamenané metodou snímání objemové pulzace a. radialis. Dále jsme chtěli ověřit, zda četnost změn tvaru pulzové vlny závisí na intenzitě bolesti.
Materiál a metody
K měření a záznamu periferní pulzové vlny jsme použili patentovaný přístroj vyvinutý na Ústavu lékařské biofyziky LF UP v Olomouci [23]. Blokové schéma přístroje ukazuje obr. 2. Srdcem přístroje je vysoce citlivý diferenciální tlakový snímač typu BHV 5355 (BHV Sensors Praha), který pracuje jako tlakově-napěťový převodník. Systém pro snímání tlaků má kladnou a zápornou větev. Na kladnou větev snímače je prostřednictvím tekutého media přivedena vlastní přenesená pulzace periferní arterie prostřednictvím vyšetřovací sondy. Zápornou větev tvoří vzduchová náplň regulovatelná balonkovým tonometrem umožňující jednak úpravu rozsahu výstupního napětí, jednak regulující přítlak membrány měřící sondy k arterii. Měřicí sonda je trubice malého průměru opatřená vrchlíkem z elastické, velmi tenké membrány. Tato membrána bezprostředně naléhá na sledovanou tkáň a snímá objemovou pulzaci. Změny výstupního napětí jsou prostřednictvím měřicí karty přenosného počítače digitalizovány a následně vyhodnocovány softwarem LabView v. 6.0 (National Instrumetns, USA) [17]. Vyšetření bylo standardizováno pro záznam pulzace a. radialis na distálním předloktí v místě, kde se běžně provádí palpace k měření pulzu. Snímali jsme vzorkovací frekvencí 500 Hz záznam o délce 30 s.
Obr. 2. Schéma přístroje pro analýzu pulzových vln. 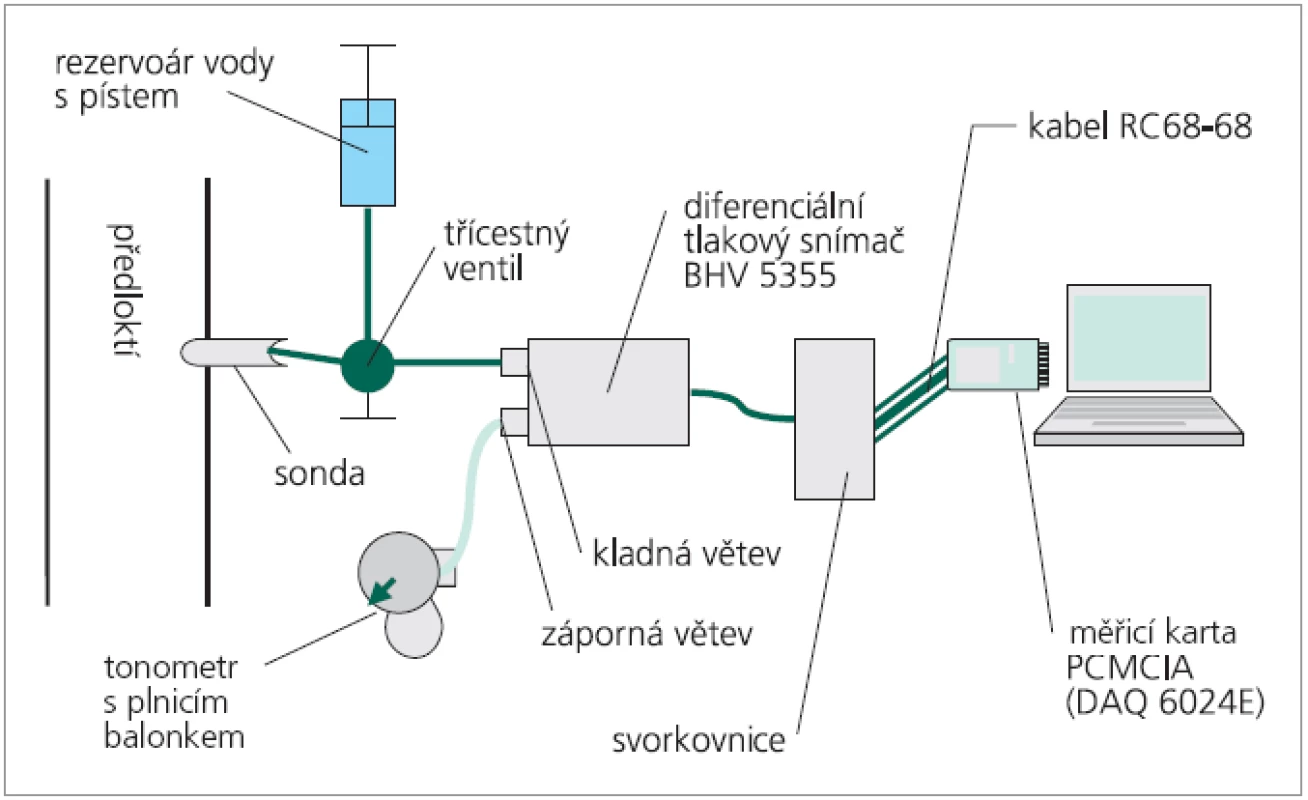
Studie byla projednána a schválena etickou komisí při IKEM a FTNsP v Praze. Respondenty byli pacienti ošetření v ambulantních i hospitalizačních provozech FTNsP v Praze. Vhodnými kandidáty byli v tomto stadiu výzkumu mladí, celkově zdraví lidé, u kterých nedocházelo k rušivým interferencím s bolestivými prožitky v rámci chronických onemocnění. Vyšetřovali jsme 2 skupiny pacientů. 1. skupinu tvořili pacienti podrobující se rutinním invazivním výkonům prováděným v rámci léčebného procesu na chirurgické ambulanci, 2. skupinu tvořili operandi dobře definovaných chirurgických výkonů prováděných standardní technikou v celkové anestezii na operačním sále. Spektrum prováděných výkonů ukazuje tab. 2. Obě skupiny pacientů jsme důkladně seznámili s technikou a účelem vyšetření, opatřili jsme informovaný souhlas s podpisem respondenta, pokud byl zletilý. U nezletilých respondentů jsme získali informovaný souhlas rodiče nebo zákonného zástupce. Z pochopitelných důvodů jsme do první skupiny nezletilé respondenty nezařazovali.
Tab. 1. Provedené výkony u vyšetřovaných ve skupinách I a II. 
Měření jsme prováděli ve 2 sezeních. 1. za klidového stadia, kdy respondent bolest neprožíval, a 2. pokud ano. V 1. skupině bylo provedeno kontrolní měření pulzové vlny před vlastním ambulantním výkonem a následně v průběhu výkonu, resp. v průběhu jeho bolestivé fáze. Záznamy, u kterých vlastní bolestivý vjem trval méně než 30 s, tedy nepokryl celou stanovenou délku měření, byly ze statistické analýzy vyřazeny. Ve 2. skupině vyšetřovaných bylo 1. měření provedeno standardně 1. pooperační den ráno po kompletním odeznění anestezie a peroperační analgezie, v intervalu 12 až 24 h po ukončení operačního výkonu. Pokud byla u pacienta ordinována analgetika v rámci pooperační péče, bylo měření provedeno před jejich podáním. Kontrolní vyšetření bylo provedeno s odstupem za absence bolestivého vjemu, zpravidla před dimisí pacienta, případně při ambulantní kontrole 7.–14. pooperační den. Při každém vyšetření byl nejprve změřen a zaznamenán tlak a pulz v poloze vleže na zádech po adaptaci pacienta trvající 3–5 min. Pokud šlo o 1. vyšetření, bylo doplněno rovněž odebrání anamnézy a záznam antropometrických hodnot pacienta – výšky a váhy. Poté jsme zjišťovali subjektivní hodnotu vnímané bolesti prostřednictvím standardní 11stupňové vizuální numerické škály [4], případně příslušné analogie v univerzálním dotazníku bolesti [6].
Získané křivky jsme vizuálně hodnotili v párech (klid, bolest) pomocí prohlížecího režimu software LabView v. 4.2, který byl rovněž použit k digitalizaci dat. Hodnocené kmity jsme převedli na jednotnou délku kmitu (osa X: čas) a jednotnou amplitudu (osa Y: napětí) tak, že jednotný horizontální rozměr 100 px (obrazovkových bodů) tvořil TPT (Total Pulse Time) parametr hodnocené vlny a jednotný vertikální rozměr 100 px tvořil parametr A (Amplitude), tedy amplituda prvního neboli systolického kmitu (obr. 1). Z křivky klidového záznamu byla použita 1 reprezentativní vlna, se kterou jsme porovnávali postupně všechny vlny křivky záznamu bolesti u stejného pacienta. Vizuálně odchylné kmity jsme zaznamenávali a jejich četnosti podrobili statistické analýze. Použili jsme Pearsonovu korelační a regresní analýzu s pomocí software StatGraphics (StatPoint, Inc., USA) v. 9.0.
Výsledky
Provedli jsme 26 párů měření. Průměrný věk pacientů byl 23,30 (medián 19, modus 17) let. 14 pacientů (53,8 %) patřilo do skupiny I – instrumentální vyšetření, zbylých 12 (46,2 %) do skupiny II – operandi. Průměrná výška respondentů byla 169,16 ± 8,31 a hmotnost 64,12 ± 15,89. Průměrná hodnota intenzity bolesti byla 3,14 ve skupině I a 2,33 ve skupině II.
Vizuálním hodnocením vln jsme pozorovali odchylnosti mezi klidovou křivkou a křivkou bolesti ve 25 případech (96,15 %). Popsali jsme 2 typy odchylnosti tvaru 1. kmitu, vyskytující se s vysokou četností na křivkách záznamu bolesti (obr. 3). 1. typem odchylnosti byl rozštěp 1. kmitu se ztrátou charakteristické dikrocie, přítomné na vlnách křivky konkordantního klidového záznamu: za rozštěp jsme hodnotili přítomnost 2 maxim 1. kmitu. 2. typem bylo oploštění a rozšíření 1. kmitu se zachováním dikrocie. V obou případech bylo nekonstantně na záznamu patrno relativní zpoždění nástupu 2. postupného kmitu. Oba 2 typy změn se vyskytovaly na 1 křivce záznamu bolesti ve 20 případech (76,92 %), pouze rozštěp 1. kmitu byl přítomen v 5 případech (19,23 %). Na 1 křivce (3,84 %) nebylo možno vysledovat ani 1 popsanou změnu, změny byly zcela necharakteristické. Izolovaná přítomnost oploštění 1. kmitu nebyla zaznamenána.
Obr. 3. Srovnání křivek periferní pulzové vlny v klidu a za bolestivého prožitku. Na křivce zaznamenané během bolestivého výkonu (dole) je patrno na první vlně rozštěpení 1. kmitu s rozpadem dikrocie, na 2. vlně oploštění a rozšíření 1. kmitu. Oproti kontrole (horní křivka) u obou vln došlo k opoždění nástupu 2. kmitu. 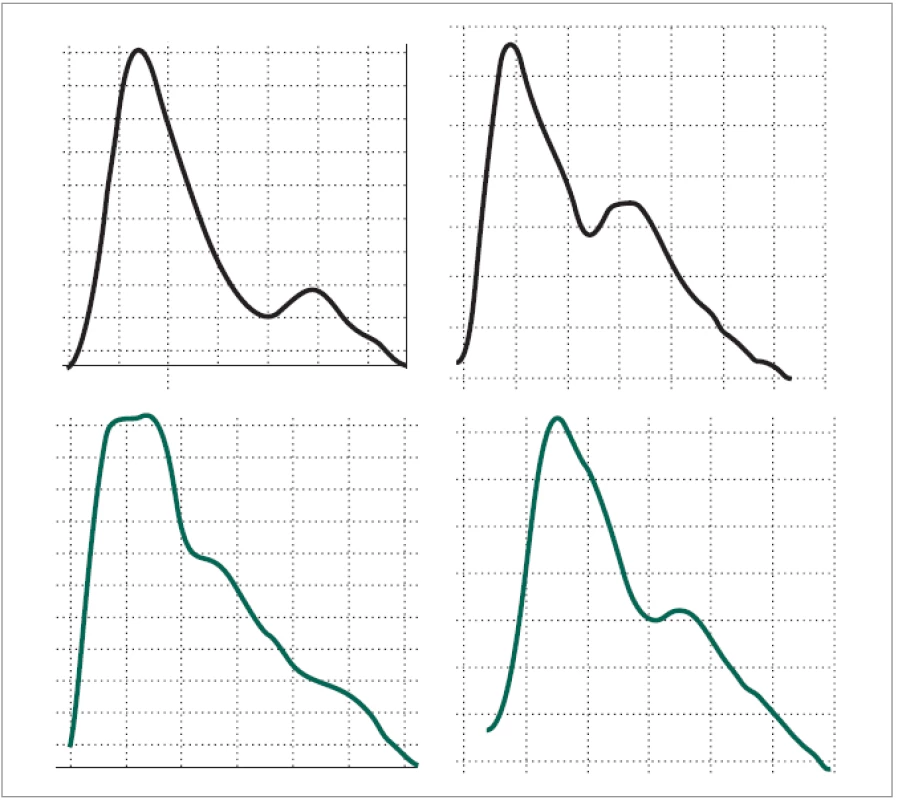
Korelační analýzou četností výskytu obou typů změn prvního kmitu byla prokázána slabá míra pozitivní závislosti procenta výskytu rozštěpů 1. kmitu na intenzitě bolesti. Mezi intenzitou bolesti a procentem výskytu oploštění závislost prokázána nebyla (tab. 1). Následná regresní analýza závislost počtu patologických kmitů na intenzitě bolesti neprokázala (obr. 4, 5).
Tab. 2. Korelační analýza závislosti intenzitou bolesti na procentu výskytu aberantních kmitů. 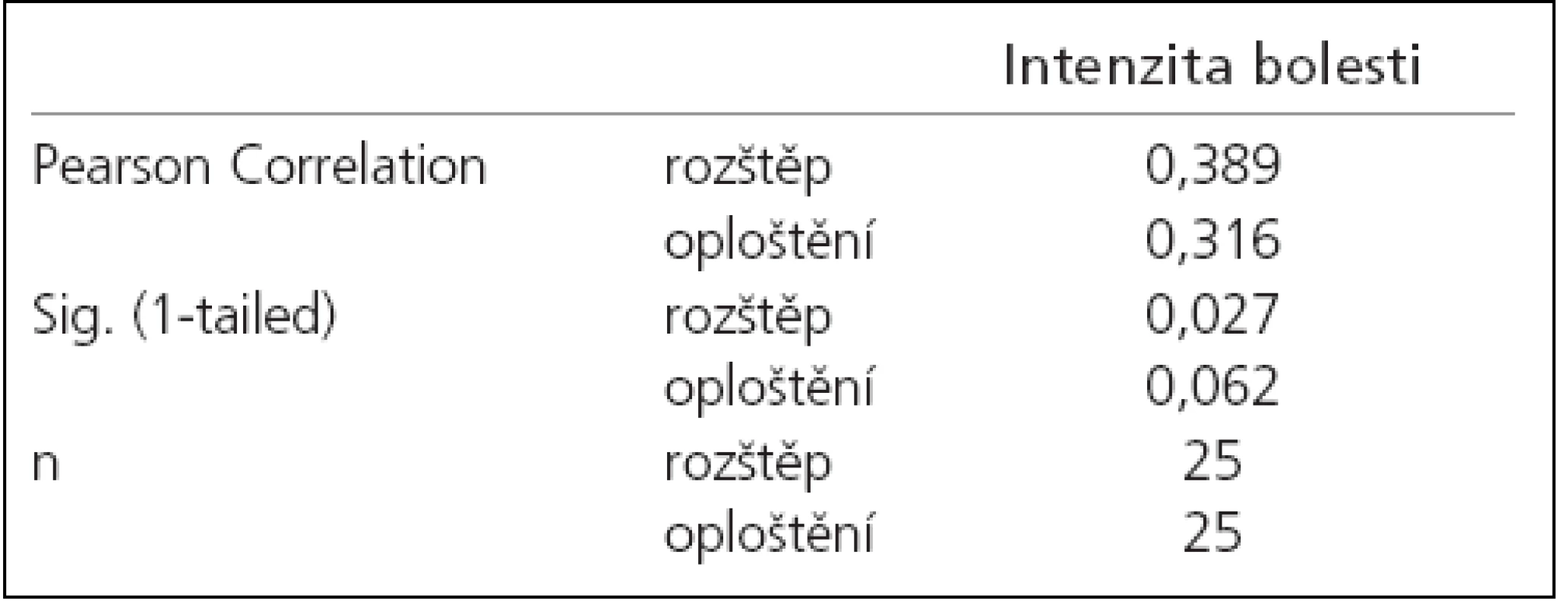
Obr. 4. Regresní analýza: predikce intenzity bolesti, nezávisle proměnná % rozštěpených kmitů. 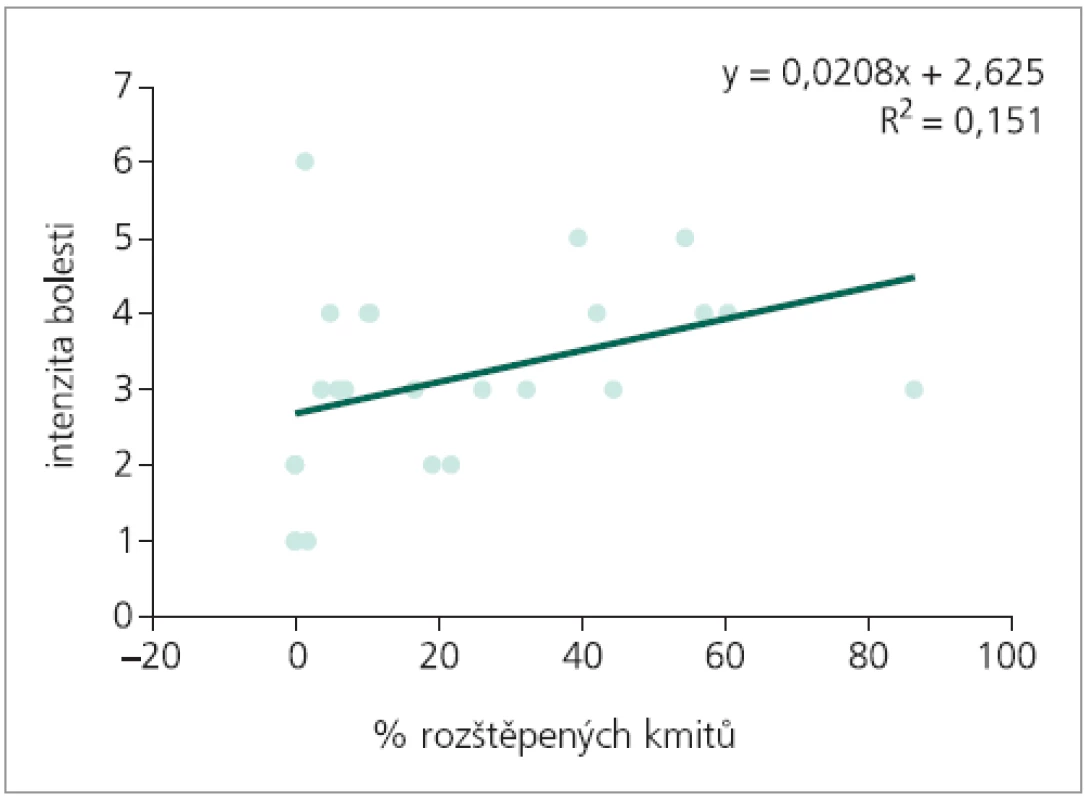
Obr. 5. Regresní analýza: predikce intenzity bolesti, nezávisle proměnná % oploštěných kmitů. 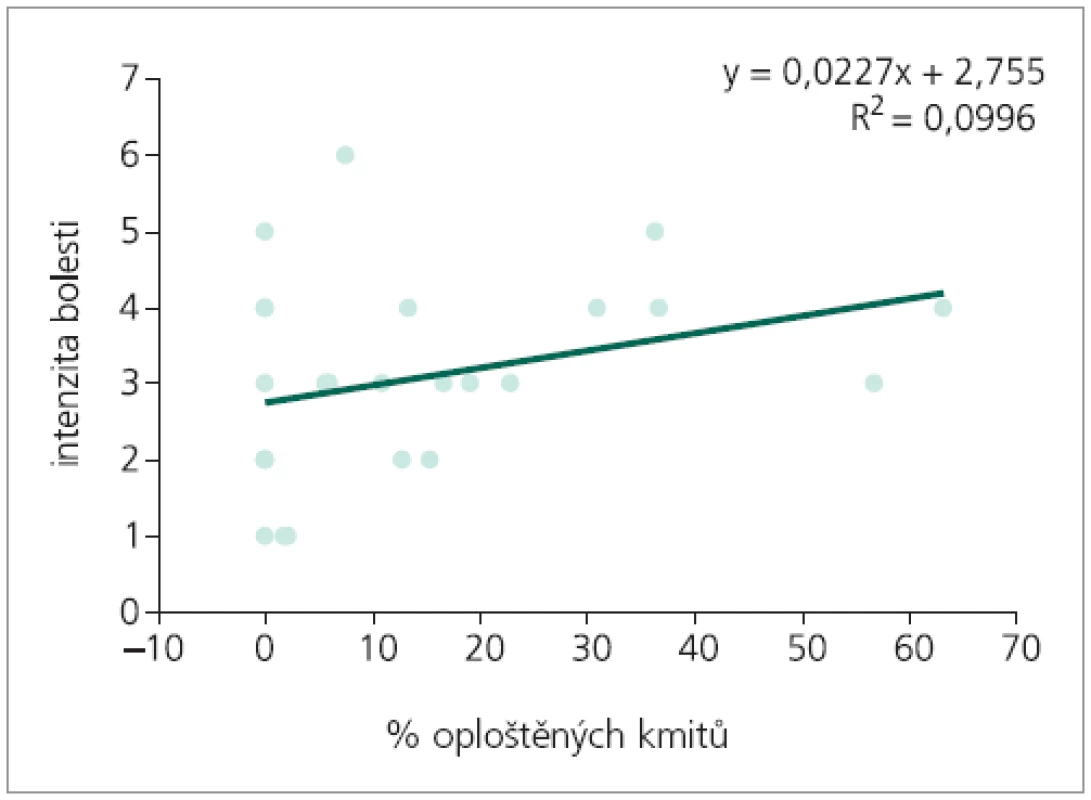
Diskuse
Současné metody měření bolesti jsou ve velké většině založeny na subjektivním hodnocení bolestivého prožitku [3–6]. Při řešení experimentálních úloh jako hodnocení působení analgetik [24] toto nebývá zdrojem chyb, protože vyšetřovaný subjekt nebývá motivován výsledky zkreslovat. Zcela jiná situace nastává, pokud vyšetřujeme pacienta se sníženou schopností komunikace, případně chceme hodnotit bolest z pohledu forenzního a posudkového lékařství, tedy hledáme objektivně měřitelný parametr korelující s přítomností a intenzitou bolesti. Ojedinělá je v tomto ohledu práce Ledowského et al [14] popisující vliv bolesti na kožní vodivost. Autoři pozorovali růst fluktuace hodnot vodivosti kůže v korelaci s intenzitou vnímané bolesti. V naší práci se zatím podařilo ověřit, že bolest může ovlivnit tvar pulzové vlny. Patofyziologický podklad změny tvaru křivky zatím objasněn není. Předpokládali bychom podstatný vliv vegetativního nervstva, dle dosavadních zjištění [16,17] ale vegetativní tonus ovlivňuje spíše jiné parametry periferní cirkulace než tvar iniciálního kmitu. Vzhledem k rychlosti nástupu akutně vzniklého pocitu bolesti lze stěží uvažovat o vlivu změny viskozity proudící krve. Z čistě fyzikálního pohledu se námi popisované změny křivky, tedy oploštění i rozštěp 1. kmitu, jeví jako interference vlnění, ev. výskyt dříve nepozorované odrazové vlny. Tento jev nutně vyžaduje přítomnost překážky v postupu pulzové vlny, která způsobuje odraz vlny a následnou interferencí. Vysvětlení by mohla poskytnout změna některé veličiny určující periferní rezistenci arteriálního řečiště, zejména kontrakce arteriol malého průměru. Hypotéza o četnosti aberantních kmitů v korelaci s intenzitou bolesti ověřena nebyla. Za důvody selhání hypotézy považujeme jednak malý vzorek vyšetření pro statistické zpracování a jednak absenci vyšetření pacientů se subjektivně vyšší intenzitou vnímané bolesti. V našem souboru dosáhla nejvyšší intenzita bolesti vyjádřená standardní numerickou škálou [4] stupně 6, což odpovídá střední intenzitě bolesti. V citované práci Ledowského et al přitom nejvyšší senzitivita i specificita byla prokázána ve skupině s těžkou až nesnesitelnou bolestí (stupeň 7–10 NS). Zde narážíme na zásadní etický problém vyšetřování pacienta trpícího intenzivní bolestí. V další práci tedy zřejmě bude nutné použít některý z experimentálních postupů umělé indukce bolesti [10,11] za spolupráce dobrovolníků k získání záznamu při vyšších intenzitách vnímané bolesti. V námi použité metodice rovněž opomíjíme vliv anticipace, která v prožívání bolesti hraje nezanedbatelnou roli. Přinejmenším ve skupině ambulantně ošetřených pacientů by bylo vhodné doplnit 3. měření, při kterém pacient žádný bolestivý prožitek neočekává. V rámci objektivity bude rovněž nutné vyšetření randomizovat.
Další spornou otázkou je metodologie hodnocení aberantních kmitů. Vizuální hodnocení, v medicíně běžně užívané např. při hodnocení elektrokardiogramů, je napadnutelné z hlediska striktní objektivity. Lákavou představou je použití metod umělé inteligence, zejména techniky tréninku arteficiální neuronové sítě [25] ke simulaci hodnocení klinikem. Další možný přístup je statistické hodnocení definovaných parametrů pulzové vlny. Vhodnými kandidáty mohou být např. parametry IWT, RDT a Aix [16] (obr. 1).
Závěr
Cílem naší práce je nalézt způsob objektivního měření bolesti. Pulzová vlna, dle našeho předběžného zjištění, je ovlivněna subjektivním pocitem bolesti vyjádřeným pomocí standardní numerické škály. Kvantifikace bolesti vizuálním hodnocením křivky zatím zřejmě možná není. V další práci je nutno nalézt způsob optimálního hodnocení časového záznamu pulzové vlny a získat dostatečně velký vzorek vyšetření ke statistické analýze.
Práce nebyla podpořena grantem ani financována z jiných zdrojů.
MUDr. Kamil Navrátil
Klinika transplantační chirurgie IKEM
Vídeňská 1958/9
140 21 Praha 4
e-mail: kamil.navratil@ikem.cz
Přijato k recenzi: 23. 7. 2007
Přijato do tisku: 28. 1. 2008
Zdroje
1. IASP Pain Terminology [online], 1994 [cited: 2007-03-27]. Dostupné z: <http://www.iasp-pain.org/AM/Template.cfm?Section=General_Resource_Links&Template=/CM/HTMLDisplay.cfm&ContentID=3058#Pain>.
2. Merskey H, Bogduk N. Classification of Chronic Pain: Descriptions of pain syndromes and definitions of pain terms. 2nd ed. Seattle: IASP Press 1994 : 209–214.
3. Knotek P, Žalský M. Vizuální analogové škály pro měření bolesti a psychologickou diagnostiku pacientů s chronickou bolestí. Bolest 2001; 4(2): 96–102.
4. Herr KA, Spratt K, Mobily PR, Richardson G. Pain intensity assessment in older adults: use of experimental pain to compare psychometric properties and usability of selected pain scales with younger adults. Clin J Pain 2004; 20(4): 207–219.
5. Wong DL, Baker CM. Smiling faces as anchor for pain intensity scales. Pain 2001; 89(2–3): 295–300.
6. UCLA Pain Assessment Tools [online], [cited: 2007-03-27]. Dostupné z: <http://www.anes.ucla.edu/pain/assessment_tools.htm>.
7. Knotek P, Šolcová I, Žalský M. Česká verze krátké formy dotazníku bolesti McGillovy univerzity: restandardizace. Bolest 2002; 5(3): 30–34.
8. Yarnitsky D, Ochoa JL. Abstract Studies of heat pain sensation in man: perception thresholds, rate of stimulus rise and reaction time. Pain 1990; 40(1): 85–91.
9. Pertovaara A, Morrow TJ, Casey KL. Cutaneous pain and detection thresholds to short CO2 laser pulses in humans:evidence on afferent mechanisms and the influence of varying stimulusconditions. Pain 1988; 34(3): 261–269.
10. Von Baeyer CL, Piira T, Chambers CT, Trapanotto M, Zeltzer LK. Guidelines for the cold pressor task as an experimental pain stimulus for use with children. J Pain 2005; 6(4): 218–227.
11. Polianskis R, Graven-Nielsen T, Arendt-Nielsen L. Computer-controlled pneumatic pressure algometry--a new technique for quantitative sensory testing. Eur J Pain 2001; 5(3): 267–277.
12. Murakawa K, Moriyama K, Yanamoto F, Nakano S, Fukunaga T, Arimura Y. Measurement of clinical pain intensity: quantitative sensory testing. Masui 2006; 55(9): 1080–1086.
13. Rolke R, Magerl W, Campbell KA, Schalber C, Caspari S, Birklein F et al. Quantitative sensory testing: a comprehensive protocol for clinical trials. Eur J Pain 2006; 10(1): 77–88.
14. Lebowski T, Bromilow J, Paech MJ, Storm H, Hacking R, Schug SA. Monitoring of skin conductance to assess postoperative pain intensity. Br J Anaesth 2006; 97(6): 862–865.
15. Oliva I, Roztočil K. Pulsová vlna v diagnostice ischemické choroby dolních končetin. Praha: Avicenum 1982.
16. Korpas D. Hemodynamické parametry a jejich variabilita. Lékař a technika 2004; 35(3): 63–66.
17. Korpas D, Hálek J. Přístroj pro měření a analýzu pulzové vlny. Lékař a technika 2003; 34(5–6): 163–170.
18. Myers K. The investigation of peripheral arterial disease by strain gauge plethysmography. Angiology 1964; 15 : 293–304.
19. Trubel H, Huber E, Daake C, Barnikol WK. Development of a flexible cardiorespiratory monitor based on induction plethysmography. Biomed Tech (Berl) 2002; 47(7–8): 178–185.
20. Allen J. Photoplethysmography and its application in clinical physiological measurement. Physiol Meas 2007; 28(3): R1–R39.
21. Meinders JM, Kornet L, Brands PJ, Hoeks AP. Assessment of local pulse wave velocity in arteries using 2D distension waveforms. Ultrason Imaging 2001; 23(4): 199–215.
22. Breslau PJ, Slot HB, Greep JM. Comparative study of strain gauge plethysmography and Doppler ultrasound in patients with occlusive arterial disease of the lower extremities. Angiology 1981; 32(12): 840–845.
23. Hálek J, Korpas D, inventors; UP v Olomouci, assignee. Způsob neinvazivního měření průběhu pulzové vlny krve a zařízení k provádění tohoto způsobu. Český patent 295119. 2005.
24. Koltzenburg M, Pokorny R, Gasser UE, Richarz U. Differential sensitivity of three experimental pain models in detecting theanalgesic effects of transdermal fentanyl and buprenorphine. Pain 2006 126(1–3): 165–174.
25. Flake QW. The Computational Beauty of Nature: Computer explorations of fractals, chaos, complex systems, and adaptation. Cambridge: MIT Press 2000 : 384–413.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaciČlánek Retrospektivní analýza nálezů zrakových evokovaných potenciálů při akutním zánětu zrakového nervuČlánek Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózyČlánek Migréna v těhotenstvíČlánek Sporadický „guamský parkinsonský komplex“ nebo koincidence více neurodegenerativních onmocnění?Článek Webové okénkoČlánek Gerhard Waberžinek
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2008 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Depersonalizace a derealizace – současné nálezy
- Sexuální dysfunkce u žen s epilepsií a jejich příčiny
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
- Asociace vybraných rizikových faktorů s tíží aterosklerotického postižení v karotické bifurkaci
- Funkce pravé komory srdeční a výskyt plicní hypertenze u pacientů se syndromem obstrukční spánkové apnoe
- Přínos vyšetření čichu v časné diagnostice demencí neurodegenerativní etiologie
- Analýza pulzové vlny v objektivizaci bolesti – předběžné sdělení
- Kvalita života u pacientů po subarchnoidálním krvácení – roční katamnéza
- Retrospektivní analýza nálezů zrakových evokovaných potenciálů při akutním zánětu zrakového nervu
- Laboratorní ukazatele neurodegenerace v likvoru a míra motorického postižení u Parkinsonovy nemoci: korelační studie
- Tau-protein, fosforylovaný tau-protein a beta-amyloid42 v likvoru u demencí a roztroušené sklerózy
- Migréna v těhotenství
- Sporadický „guamský parkinsonský komplex“ nebo koincidence více neurodegenerativních onmocnění?
- Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky
- Webové okénko
-
Analýza dat v neurologii
IX. Poissonovo rozdělení - Gerhard Waberžinek
- Management ischemické cévní mozkové příhody a tranzitorní ischemické ataky – doporučení European Stroke Organisation (ESO) 2008 – zestručněná česká verze
- Doporučený postup sekundární prevence recidivy po akutní cévní mozkové příhodě: mozkovém infarktu/tranzitorní ischemické atace a hemoragické cévní mozkové příhodě
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Depersonalizace a derealizace – současné nálezy
- Degenerace krční meziobratlové ploténky – indikace a možnosti chirurgické léčby
- Migréna v těhotenství
- Pohybové aktivity pacientů trpících dědičnou polyneuropatií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



