-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Detekce mikroembolizací pomocí transkraniální dopplerovské sonografie
Detection of Microembolisation with the Use of Transcranial Doppler Sonography
Cerebrovascular accidents are the second or third most common cause of death in advanced countries. In order to provide effective treatment, including primary and secondary prevention of strokes, a thorough knowledge of their ethiopathogenesis is needed. A frequent cause of a cerebrovascular accident is embolization. One of the advantages of transcranial doppler sonography is the possibility, with long term monitoring, to detect even asymptomatic microemboli in cerebral circulation. The first part of the article gives an overview of the history of microembolization detection using the ultrasound; the second part provides an introduction to the technical background of this investigative method, along with its disadvantages. The sub section on clinical aspects of the detection of microemboli deals with current and future trends of the method and shows its possible clinical application.
Key words:
cerebrovascular accidents – transcranial doppler sonography – embolization – microembolic signal
Autoři: P. Reková; J. Bauer
Působiště autorů: Neurologická klinika, Univerzita Karlova v Praze, 1. lékařská fakulta a Všeobecná fakultní nemocnice
Vyšlo v časopise: Cesk Slov Neurol N 2009; 72/105(1): 30-37
Kategorie: Přehledný referát
Souhrn
Cévní mozkové příhody jsou ve vyspělých zemích druhou až třetí nejčastější příčinou úmrtí. Pro adekvátní terapii, včetně primární a sekundární prevence mozkových příhod, je důležitá znalost jejich etiopatogeneze. Častou příčinou vzniku cévní mozkové příhody je embolizace. Jednou z výhod transkraniální dopplerovské sonografie je možnost detekce i asymptomatických mikroembolů v mozkové cirkulaci pomocí dlouhodobého monitoringu. První část článku nabízí krátký pohled do historie detekce mikroembolizací pomocí ultrazvuku, v další části jsou shrnuty základní technické informace a úskalí této vyšetřovací metody. Oddíl týkající se klinických aspektů detekce mikroembolů se zabývá současnými i budoucími trendy metody a poukazuje na její možné klinické využití.
Klíčová slova:
cévní mozkové příhody – transkraniální dopplerovská sonografie – embolizace – mikroembolický signálÚvod
Cévní mozkové příhody (CMP) jsou ve vyspělých zemích druhou až třetí nejčastější příčinou úmrtí a vedoucí příčinou invalidity dospělých osob [1,2]. Předpokladem adekvátní terapie akutní fáze CMP stejně jako primární či sekundární prevence je znalost její etiopatogeneze. Nejčastějším mechanizmem vzniku CMP je embolizační etiologie [1]. Embolizovat mohou např. srdeční tromby, ateromové hmoty při ateroskleróze vzestupné aorty a supraaortálních tepen (nejčastěji z vnitřní krkavice, arteria carotis interna, ACI). Jinou možností je paradoxní embolizace z venózního systému při pravo-levých zkratech. Embolizace je také významnou příčinou vzniku neurologických komplikací při operačních a intervenčních výkonech [3].
Významnou úlohu v průkazu embolizační etiologie CMP má transkraniální dopplerovská sonografie (TCD). Jednou z jejích výhod je i schopnost detekovat ještě asymptomatické mikroemboly během dlouhodobého monitoringu [4]. Detekovat lze jak plynné, tak korpuskulární mikroemboly [5–7].
Historie
První zmínky o možnosti detekovat mikroemboly v proudící tekutině pomocí ultrazvuku pocházejí z poloviny 60. let minulého století. V roce 1965 Austen a Howry při pokusech in vitro pozorovali přechodná zvýšení intenzity odraženého ultrazvukového signálu související s výskytem bublin vzduchu v detekčním zařízení. Podobné změny signálu popsali při pokusech se zvířaty napojenými na mimotělní krevní oběh. Vyšetřující vyslovili podezření, že vzestupy intenzity signálu mají souvislost s plynnými či pevnými částicemi [5].
U lidí byly obdobné signály poprvé popsány v roce 1968 v souvislosti s dekompresní nemocí a o rok později u pacientů podstupujících kardiochirurgickou operaci [6].
Postupný rozvoj ultrazvukových technik vedl v první polovině 80. let 20. století ke zjištění, že ultrazvuk dokáže překonat kostní bariéru a lze jím tak zaznamenávat průtoky v intrakraniálních cévách [8].
V roce 1990 při TCD monitorování u pacienta podstupujícího karotickou endarterektomii byly zachyceny signály nižší intenzity, než by odpovídalo dříve popisovaným signálům plynným. Navíc se tyto signály objevily ještě před otevřením karotidy. Šlo o pevné mikroemboly [7]. Názory, že podobné signály jsou spíše artefakty či krevní turbulence, byly vyvráceny experimentálními pracemi in vitro a na zvířecích modelech. Tyto pokusy dokazovaly, že tromby, ateromy či shluky krevních destiček mohou být původci popsaných signálů [9,10]. Klinické práce rovněž potvrdily schopnost TCD detekovat korpuskulární mikroemboly [11].
Postupně byl záchyt mikroembolů popsán u pacientů s různými onemocněními, jako jsou stenóza vnitřní karotidy, fibrilace síní, onemocnění srdečních chlopní [12].
Rovněž u intervenčních a operačních výkonů jsou mikroembolické signály (MES) často detekovány. Příkladem mohou být angiografická vyšetření či angioplastika vnitřní karotidy, karotická endarterektomie, výkony kardiochirurgické [12].
Princip
Podle Dopplerova principu se frekvence ultrazvukového vlnění mění při odrazu od pohybujícího se objektu. To platí také pro detekci mikroembolů, které jsou unášeny krevním proudem. Velikost asymptomatických mikroembolů je výrazně menší než vlnová délka ultrazvuku. To je důvodem, proč vzniká na akustickém rozhraní embolu rozptyl (difuze, scattering), nikoliv klasický odraz. Energie vlnění je rozptýlena všemi směry a zpět k sondě se vrací malé procento. Stejný jev nastává při interakci ultrazvuku s mikroskopickými rozhraními krevních elementů. Intenzita odrazů je v případě rozptylu na mikroskopických rozhraních embolů vyšší v porovnání s intenzitou odrazů proudící krve, přechodné shluky erytrocytů nevyjímaje (retrodifuze, backscattering). Ultrazvukové přístroje pracují s parametrem, který udává poměr akustického výkonu k sondě odraženého signálu z embolu k akustickému výkonu z okolní proudící krve. Jedná se o relativní zvýšení intenzity, které se uvádí v dB [4].
Relativní zvýšení intenzity závisí na akustické impedanci (složení) embolu (druhá mocnina), na velikosti částic (šestá mocnina průměru embolu), na insonační frekvenci (čtvrtá mocnina). Je ovlivněno rovněž množstvím krve uvnitř vzorkovacího objemu (závisí na velikosti užívaného vzorkovacího objemu) [4,13].
Mikroemboly se ve spektrálním dopplerovském záznamu zobrazují jako signály vysoké intenzity (High Intensity Transient Signals, HITS, Microembolic Signal – MES, obr. 1, 2).
Obr. 1. Mikroembolus. Žlutá šipka označuje mikroembolický signál (snímek pořízen během vyšetření pravo-levého zkratu pomocí směsi fyziologického roztoku a vzduchu). 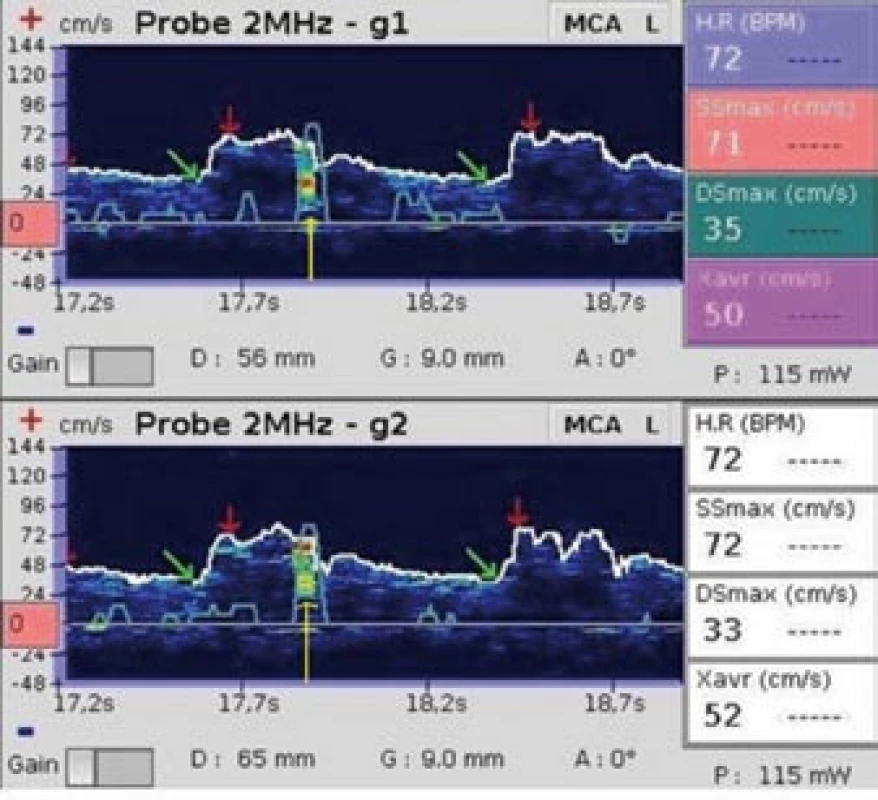
Obr. 2. Dva mikroemboly. Žluté šipky označují dva za sebou se vyskytující mikroembolické signály (snímek pořízen během vyšetření pravo-levého zkratu pomocí směsi fyziologického roztoku a vzduchu). 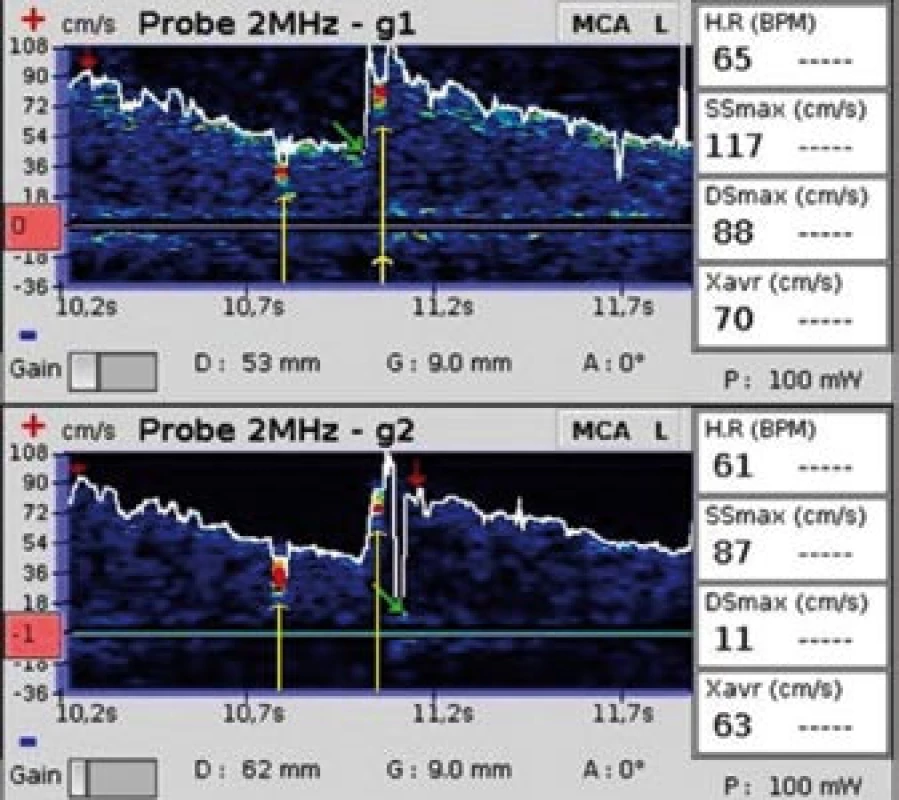
Mikroembolický signál, artefakt
Klíčovým faktorem pro detekci mikroembolů je odlišení artefaktů od mikroembolických signálů. Zlatým standardem je hodnocení nahraného záznamu off line zkušeným sonografistou. Vyšetřující přitom využívá standardní audiovizuální kritéria pro identifikaci MES [14] (tab. 1). Na rozdíl od MES je artefakt častěji bidirekcionální a maximum výskytu je v oblasti nižších frekvencí (obr. 3, 4).
Tab. 1. Základní audiovizuální kritéria pro detekci MES [4,14]. ![Základní audiovizuální kritéria pro detekci MES [4,14].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/1a23a119e0cdd2ffb9bb6209776da607.png)
Obr. 3. Šest za sebou se vyskytujících artefaktů. Žluté šipky označují artefakty, které vznikly poklepem na ultrazvukovou sondu. 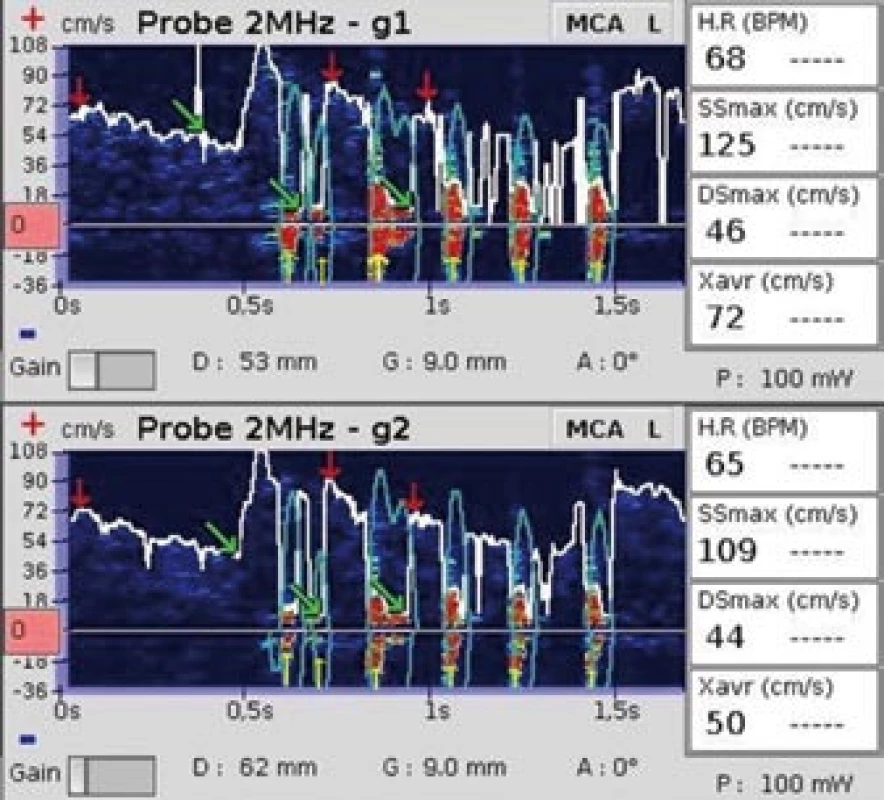
Obr. 4. Jeden artefakt. Žluté šipky ukazují na artefakt, který vznikl odstraněním pramínku vlasů z prostoru mezi sondou a kůží hlavy. 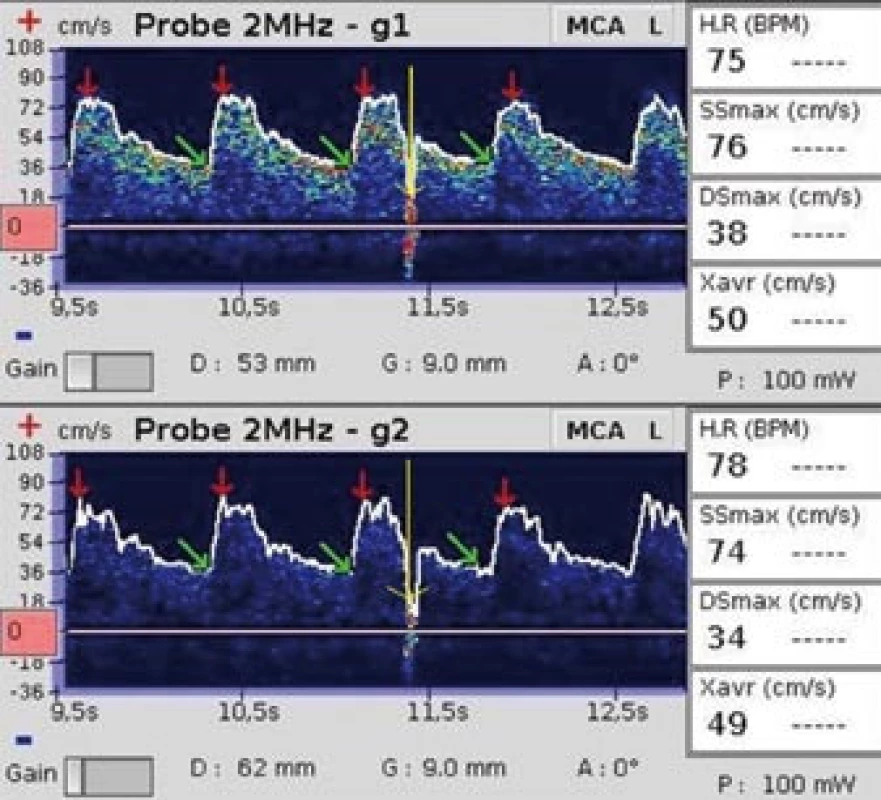
Hodnocení nahraného záznamu je však velmi časově náročné a pracné. Proto jsou vyvíjeny ultrazvukové přístroje umožňující automatické vyhodnocení záznamu. Dle vybavení přístroje lze nejen odlišit artefakty od MES, ale také s různou mírou pravděpodobnosti určit, zda se jedná o embolus korpuskulární či plynný.
Průlomem v automatickém odlišení artefaktů od MES bylo zavedení dvoubránového (dual-gate, event. reference-gate) čí vícebránového (multi gate) snímání do klinické praxe. Jde o techniku, při které je záznam získáván ze dvou (či více) různých hloubek stejné mozkové tepny. Přístroj následně vyhodnotí případné časové zpoždění mikroembolu putujícího cévou. Artefakty časové zpoždění postrádají a objevují se simultánně v záznamech ze všech hloubek [13].
Paralelní vícebránové snímání je rovněž využíváno u přístrojů vybavených režimem power M mode. Na svislé ose v tzv. hloubkovém řezu (mm hloubky) je barevně zobrazena intenzita signálu (power). Horizontální osa obrazovky ukazuje čas. Pohyblivé echo (mikroembolus) za sebou v obraze zanechává tzv. stopu (track), která odpovídá pohybu mikroembolu různými úseky intrakraniální tepny [13].
Jiná slibná technika využívá ultrazvukových sond emitujících dvě rozličné frekvence. Tato metoda slouží nejen k odlišení artefaktů od MES, ale také k rozlišení, zda se jedná o embolus pevný či plynný. Principem je porovnávání charakteristik MES na jednotlivých frekvencích. Bohužel, přes slibné in vitro studie i pilotní klinické studie [15], nenašla tato technika zatím širší uplatnění v klinické praxi, především pro nedostatečnou specificitu a senzitivitu v určení struktury mikroembolů [16].
Délka monitorování
Přestože při používání ultrazvuku pro diagnostické účely nebyly prokázány závažnější nežádoucí účinky, dlouhodobé monitorování může vedlejší biologické efekty mít [17]. Při transkraniálním monitoringu je proto nutné dodržovat základní pravidla a pro vlastní vyšetření použít jen takový výstupní výkon přístroje, který dostačuje ke kvalitnímu provedení monitorování. Ze stejného důvodu nemá být v případě použití klasických ultrazvukových přístrojů zbytečně prodlužována doba, která je potřebná pro klinické hodnocení.
Doba monitorování se nejčastěji pohybuje v rozmezí 15–60 min [13].
U pacientů s onemocněními s nízkou frekvencí mikroembolizací, jako je fibrilace síní či stenóza karotidy, se dává přednost delším záznamům a nemocní jsou monitorováni většinou po dobu 60 min [18–21]. Objeví li se u nemocného se symptomatickou stenózou karotidy první MES dříve, lze vyšetření ukončit před uplynutím této doby. Důvodem je současný pohled na klinický dopad „MES pozitivity“ u těchto nemocných, kdy ke stratifikaci rizika budoucí CMP či tranzitorní ischemické ataky (TIA) postačí nález jediného MES [22]. U téměř 60% pacientů se symptomatickou stenózou karotidy lze zaznamenat MES již během prvních 10 min monitoringu a u 90% nemocných v průběhu prvních 30 min [22].
U nemocných s chlopenními náhradami může být dostatečné monitorování v délce 30 min [21].
Délka perioperačního záznamu závisí na aktuální situaci.
V posledních letech se objevily ambulantní monitorovací systémy, které dovolují pořízení záznamu v délce až 8 hod [23]. Jednou z výhod několikahodinového monitoringu je snížení četnosti falešně negativních záznamů, zejména u nemocných s asymptomatickou stenózou karotidy či u pacientů s fibrilací síní [24].
Počet opakování záznamu u jednotlivých klinických diagnóz rovněž není stanoven a vychází většinou z klinických potřeb.
K monitorování je nutné vybavení ultrazvukového přístroje speciální sondou/sondami s fixačním zařízením (obr. 5) a specifickým softwarem.
Obr. 5. Ultrazvukové sondy s fixačním zařízením. 
Hodnocení výsledku
Monitorování MES by v ideálním případě mohlo dát odpovědi na následující klinické otázky: Co je zdrojem mikroembolizací, popř. který ze dvou suspektních zdrojů je aktivní? Jaká je jeho aktivita? Jak velké jsou detekované mikroemboly? Jaké je jejich složení? Bohužel, přes veškerý technický pokrok je stále obtížné na tyto otázky přesně odpovědět. Proto je stále zlepšováno vybavení ultrazvukových přístrojů, se snahou zdokonalit zpracování signálu stejně jako vyvinout spolehlivý systém pro automatickou detekci embolů.
1. Identifikace zdroje mikroembolů
Kromě nejčastějšího monitoringu z oblasti střední mozkové tepny (arteria cerebri media, ACM), lze mikroemboly monitorovat pomocí 2MHz sondy rovněž z extrakraniálního úseku ACI v oblasti nad úhlem dolní čelisti, dále z proximálního úseku společné karotické tepny (arteria carotis communis, ACC). Emboly kardiálního původu (rovněž také původu ze vzestupné aorty a supraortálních cév až do ACC) detekujeme oboustranně z ACC, ACI a ACM. Emboly z oblasti karotické bifurkace detekujeme z ACI a ACM na stejné straně, jako je léze. Emboly z oblasti karotického sifonu pak detekujeme pouze ze stejnostranné ACM.
2. Aktivita zdroje
Aktivitu zdroje můžeme odhadovat podle počtu zachycených MES za časovou jednotku. V literatuře se setkáme většinou s údajem o počtu MES za hodinu, event. za minutu. Embolizace je však dynamickým procesem vykazujícím v čase určitou variabilitu. Při dlouhodobém monitorování nemocných se stenózou karotidy bylo zjištěno, že mikroemboly jsou často detekovány v clusterech [23]. U onemocnění s nízkou frekvencí mikroembolických signálů (asymptomatická stenóza karotidy, fibrilace síní) stoupá počet MES pozitivních pacientů s prodloužením doby monitorování [23]. Při užití obvyklého způsobu maximálně 60minutového záznamu má tedy stanovení frekvence omezenou prediktivní hodnotu, zejména u onemocnění s nízkou četnostní MES. Jsou však klinické situace (perioperační monitoring u karotické endarterektomie), kde vysoký počet MES za hodinu je prediktorem budoucí tromboembolické příhody [25,26].
3. Velikost mikroembolů
Určení velikosti mikroembolů se při hodnocení výsledku v současné době nepoužívá, přestože by to bylo pro některé situace velkým přínosem (viz odst. Využití). Bohužel současná přístrojová technika nedovolí přesné stanovení velikosti zachycených mikroembolů.
Velikost detekovatelných mikroembolů se pohybuje v rozmezí od 2 do 450 µm. Mikroemboly menší než 2 µm způsobují malý vzestup relativní intenzity a nedosáhnou detekčního prahu. Naopak větší mikroemboly nad 450 µm u většiny ultrazvukových přístrojů již způsobují fenomén přesycení [27,28].
4. Složení mikroembolů
Přestože na trhu jsou k dispozici ultrazvukové přístroje, které s určitou mírou pravděpodobnosti zařadí MES do kategorie plynný či pevný, nedokáží to s takovou spolehlivostí, která je potřebná pro klinickou praxi. Využití parametru relativního vzestupu intenzity dovoluje rozlišení plynných mikroembolů s přibližně 90% specificitou [29]. Komerčně dostupný Embo-Dop Transcranial Doppler systém (event. v současné době uváděná modernější varianta Multi Dop) využívající sondy emitující dvě ultrazvukové frekvence dokáže detekovat klinicky závažnější pevné mikroemboly se specificitou až 96,5% [16]. Chybění spolehlivého systému, který by rozlišil mezi plynnými a pevnými mikroemboly, je limitující zejména pro detekci MES v situacích, ve kterých se vyskytuje velké množství malých (neškodných) plynných mikroembolů a malé množství větších (potenciálně nebezpečných) pevných mikroembolů.
Využití
1. Aterosklerotické postižení vnitřní karotidy
Symptomatická stenóza karotidy
Prevalence MES u pacientů se symptomatickou stenózou krkavice se v dosud publikovaných souborech pohybuje v širokém rozmezí od 18 do 100%, přičemž procento MES pozitivních nemocných stoupá se stupněm stenózy [22,30–33]. Analýza prací z let 1990–2006, zveřejněných v Medline, ukázala, že celkem byly MES detekovány u 43% z 586 nemocných [22].
Je prokázáno, že u symptomatické stenózy vnitřní karotidy větší než 50% je přítomnost asymptomatických MES nezávislým rizikovým faktorem vzniku TIA či CMP [32–35]. MES pozitivní pacienti mají asi sedmkrát větší riziko budoucí ischemické události [22] v porovnání s nemocnými bez přítomnosti MES. Záchyt MES tak identifikuje pacienty s vysokým rizikem opakované CMP či TIA. Zjištění MES u pacientů se stenózou krkavice větší než 50% a s klinickými projevy ischemie v jejím povodí může mít několik klinických dopadů.
U pacientů se symptomatickou stenózou 70% a větší je karotická endarterektomie jedním z nejvýznamnějších opatření v prevenci recidivy CMP [36,37]. Přesto však ne všichni nemocní s prokázanou těžkou stenózou krkavice z endarterektomie profitují. Detekce MES dovoluje identifikovat skupinu vysoce rizikových nemocných, u kterých je provedení preventivní operace zvlášť naléhavé. Navíc u pacientů, kteří z jakéhokoliv důvodu nemohou endarterektomii podstoupit, může pomoci vytipovat ty, kteří by mohli profitovat z agresivnější protidestičkové terapie. K potvrzení jsou nutné randomizované klinické studie. Ve studii Clopidogrel and Aspirin for Reduction of Emboli in Symptomatid Carotid Stenosis (CARESS) vedla duální protidestičková léčba k významnému snížení počtu MES v porovnání s jedinci, kteří dostáváli pouze kyselinu acetylosalicylovou [38].
U pacientů se symptomatickou stenózou 50–69% je přínos chirurgického zákroku menší [39]. Efektivita endarterektomie je nižší u nemocných mladších 75 let [40] a menší prospěch z operace mají rovněž ženy [39,41]. V této skupině pacientů by přítomnost MES mohla indentifikovat rizikovou skupinu nemocných, kteří budou z endarterektomie profitovat.
Asymptomatická stenóza karotidy
Prevalence MES u nemocných s asymptomatickou stenózou krkavice se v dosud publikovaných souborech pohybuje v rozmezí od 2 do 29% [18,22,32]. Celkem byly detekovány MES u 10% z 1 066 nemocných [22].
V 90. letech minulého století byly publikovány výsledky prací, které ukazovaly, že rovněž u asymptomatických stenóz krkavic je přítomnost MES významným rizikovým faktorem vzniku CMP či TIA. Zahrnovaly však malé počty nemocných [42]. Navíc, studie ACED (Asymptomatic Carotid Embolus Detection) jejich závěry nepotvrdila.V této studii byla sice přítomnost MES spojena s častějším vznikem CMP či TIA, ne však statisticky významně [18]. V současné době se očekávají výsledky probíhající studie ACES (Asymptomatic Carotid Emboli Study), která zahrnuje dosud největší počet nemocných s asymptomatickou stenózou krkavice 70% a větší. Tato studie má dát odpověď na otázku, zdali přítomnost MES u asymptomatických nemocných s těžkou stenózou krkavice je stejně jako u pacientů symptomatických spojena s větším rizikem ischemického mozkového inzultu [19].
2. Aterosklerotické postižení vzestupné aorty
Ateroskleróza vzestupné aorty a aortálního oblouku s pláty silnějšími než 4mm či přítomnost mobilních plátů je rovněž častým zdrojem embolizace do centrálního nervového systému (CNS) [43]. Problematikou přítomnosti MES u nemocných s aterosklerózou aorty se zabývá velmi málo prací, které navíc zahrnují jen malé množství pacientů [22]. Význam a prognostický dopad přítomnosti MES u nemocných s aortálním zdrojem embolizace zatím zůstává nejasný.
3. Srdeční onemocnění
U pacientů s potenciálním kardiálním zdrojem embolizace (zejména náhrady chlopní, bakteriální endokarditida, fibrilace síní – FS, infarkt myokardu, dilatační kardiomyopatie, myxom levé síně) pomáhá TCD detekce MES stanovit riziko mozkové ischemie. Prevalence MES u výše vyjmenovaných patologií se pohybuje v rozmezí 15–94% [44–46]. Vyšší frekvence MES je nacházena u nemocí s větším rizikem embolizace, jako je infekční endokarditida či mechanické srdeční chlopně, nižší frekvence MES např. u fibrilace síní.
Náhrady srdečních chlopní
Zajímavou problematiku tvoří nemocní s náhradami srdečních chlopní. U nemocných s mechanickými chlopněmi se MES vyskytují často, naopak biologické chlopenní náhrady jsou s MES asociovány zřídka.
U pacientů s plnou antikoagulací se předpokládá, že většina MES je neškodná, neboť se jedná o plynné mikroemboly malých rozměrů (většina 3–5 µm), které projdou mozkovými kapilárami. Mechanizmem vzniku takovýchto mikroembolů je zřejmě kavitace (kavitace je jev, při kterém v důsledku lokálních změn tlaku v tekutině vznikají bubliny vzduchu). Existují však publikace, které ukazují na pozitivní korelaci přítomnosti MES a CMP [47] či přítomnosti MES a kognitivní deteriorace [48]. Jde pravděpodobně o pacienty s kombinací malých plynných mikroembolů a větších potenciálně nebezpečných pevných mikroembolů. Chybějící technika s dostatečně senzitivním rozlišením plynných a pevných mikroembolů limituje využití fenoménu MES v další léčebné strategii u nemocných s náhradami chlopní. Využití přítomnosti MES by mohlo spočívat v nasazení agresivnější antikoagulační terapie u pacientů s prokázanou přítomností korpuskulárních mikroembolů.
Fibrilace síní
Pacienti s FS mají nízkou frekvenci MES. U antikoagulovaných nemocných se pohybuje kolem 1,5%, u nemocných léčených antiagregací v rozmezí od 6 do 16%. U již symptomatických nemocných je frekvence MES vyšší než u asymptomatických [20,45].
Přítomnost MES u dosud asymptomatických mladších nemocných s nerevmatickou FS bez dalších rizikových faktorů může pomoci stratifikovat riziko systémové embolizace. MES pozitivní pacienti by mohli profitovat z časného nasazení antikoagulační terapie. Vzhledem k malé frekvenci MES u nemocných s FS je příslibem využití ambulantních monitorovacích systémů (několikahodinový monitoring).
4. Intervenční výkony
Karotická endarterektomie
Ischemie CNS, jedna z nejvážnějších komplikací karotické endarterektomie, vzniká obvykle v časném pooperačním období a je nejčastěji tromboembolického původu. Vysoký počet MES během výkonu a v časném pooperačním období u pacientů podstupujících karotickou endarterektomii koreluje s perioperačním rizikem vzniku CMP a TIA [25,26] a také s novými ischemickými lézemi na magnetické rezonanci mozku [49]. MES jsou častější u žen, u pacientů, kteří nedostávají antiagregaci a u pacientů podstupujících levostrannou karotickou endarterektomii [50]. Mikroembolizace mohou tedy vysvětlovat, proč stejné faktory jsou spojeny s vyšším rizikem perioperační CMP.
Kardiochirurgické operace – koronární bypass, náhrada srdečních chlopní
Neurologické komplikace patří mezi nejvážnější komplikace kardiochirurgických výkonů. V souvislosti s kardiochirurgickými operacemi existuje více možných zdrojů mikroembolů, ať už pevných či plynných.
V porovnání s arteriálními zdroji mikroembolů (ateroskleróza oblouku aorty, stenóza krkavice, stenózy intrakraniálních tepem) dosahují počty MES v průběhu monitorování během kardiochirurgických výkonů mnohem vyšších hodnot. Často bývají zachyceny i spršky MES. Existují důkazy, že přítomnost MES během operace je spojena se snížením neuropsychologických funkcí pooperačně [51]. U nemocných s počtem MES menším než 200 během operačního zákroku byl pooperační pokles neuropsychologických funkcí zaznamenán u 8,6% pacientů v porovnání se 43% u nemocných, kteří měli více než 1 000 MES během chirurgického výkonu [52]. Předpokládá se, že nejen pevné mikroemboly, ale rovněž plynné mikrobubliny jsou u kardiochirurgických výkonů odpovědné za postižení CNS. Plynné mikroemboly mají totiž v tomto případě větší rozměry než mikrobubliny vznikající při kavitaci na umělých srdečních chlopních (viz výše). V těchto situacích by byla velkým přínosem schopnost rozlišit strukturu mikroembolů stejně jako určit jejich velikost.
Monitorování MES během kardiochirurgických výkonů může být nástrojem ke zlepšení chirurgických technik či ke stanovení adekvátní perioperační farmakoterapie.
Srdeční katetrizace, perkutánní transluminální koronární angioplastika (PTCA)
Embolizace do CNS je sice vážnou, nicméně málo častou komplikací srdeční katetrizace či PTCA. Asymptomatické MES jsou detekovány u více než 50% nemocných podstupujících srdeční katetrizaci či PTCA. Přestože MES jsou u těchto intervenčních výkonů detekovány často, předpokládá se, že kolerátem většiny MES jsou zřejmě malé plynné mikrobubliny, bez většího klinického významu [53,54].
5. Monitorování úspěšnosti antitrombotické terapie, optimalizace výběru antiagregačního preparátu a jeho dávky, efektivita nových léků
Antitrombotické léky snižují výskyt MES. Efekt antitrombotické terapie na výskyt MES může sloužit jako marker jejich účinnosti v prevenci TIA či CMP [55]. Pomocí detekce MES lze rovněž posuzovat efektivitu léků v nových indikacích [56,57] či účinnosti léků nových [58]. K potvrzení, zda snížení počtu MES v souvislosti s farmakoterapií koreluje se snížením rizika CMP/TIA, jsou však nutné randomizované klinické studie.
Přítomnost MES je užívána jako zástupný ukazatel (náhradní cílový parametr tzv. surrogate marker) ke zhodnocení účinnosti protidestičkové léčby. Efektivita duální antiagregační terapie na snížení MES byla potvrzena v prospektivní multicentrické studii CARESS. Jde o práci zahrnující dosud největší počet nemocných, ve které byla přítomnost MES použita k posouzení účinnosti antiagregační terapie [38].
Závěr
Detekce mikroembolických signálů pomocí transkraniální dopplerovské sonografie poskytuje důležité patofyziologické informace u různých onemocnění s potenciálem embolizace do CNS. Klinický význam a terapeutické dopady jsou však stále předmětem diskuzí. Obecným omezením transkraniální dopplerovské sonografie je nedostatečná kvalita kostních okének. Specifickým úskalím dlouhodobého monitoringu jsou obtíže spojené s udržením signálu při vyšetřování neklidných nemocných. Významným limitem je v současné době také chybění dostatečně senzitivního automatického zpracování nahraného záznamu, absence spolehlivého rozlišení pevných a plynných mikroembolů a rovněž nedostupnost systému pro ambulantní monitoring. V budoucnu však pokrok v technickém vývoji umožní ještě širší klinické využití této často opomíjené vyšetřovací metody.
Vypracováno s podporou výzkumného záměru MSM 0021620807 a MŠM 0021620849.
MUDr. Petra Reková
Neurologická klinika UK v Praze, 1. LF a VFN v Praze
Kateřinská 30
128 08 Praha 2
e-mail: petra.rekova@seznam.cz
Zdroje
1. Kalita Z et al. Akutní cévní mozkové příhody. Diagnostika, patofyziologie, management. Praha: Maxdorf 2006.
2. European Stroke Organisation (ESO) Executive Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25(5): 457–507.
3. Goldemund D, Mikulík R. Neurologické komplikace operací v mimotělním oběhu. Interní Med 2003; 5(3): 22–26.
4. Brucher R, Russell D. Embolus detection with Doppler ultrasonography: background and principles. In: Tegler C, Babikian VL, Gomez CR (eds). Neurosonology. St. Louis: Mosby 1996 : 231–234.
5. Austen W, Howry D. Ultrasound as a method to detect bubbles or particulate matter in the arterial line during cardiopulmonary bypass. J Surg Res 1965; 5 : 283–284.
6. Spencer MP, Lawrence GH, Thomas GI, Sauvage LR. The use of ultrasonics in the determination of arterial aeroembolism during open-heart surgery. Ann Thorac Surg 1969; 8(6): 489–497.
7. Spencer MP, Thomas GI, Nicholls SC, Sauvage LR. Detection of middle cerebral artery emboli during carotid endarterectomy using transcranial Doppler ultrasonography. Stroke 1990; 21(3): 415–423.
8. Aaslid R, Markwalder TM, Nornes H. Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries. J Neurosurg 1982; 57(6): 769–774.
9. Markus HS, Brown MM. Differenctiation between diferent pathological cerebral embolic materials using transcranial Doppler in an in vitro model. Stroke 1993; 24(1): 1–5.
10. Russel D, Madden KP, Clark WM, Sandset PM, Zivin JA. Detection of arterial emboli using Doppler ultrasound in rabbits. Stroke 1991; 22(2): 253–258.
11. Khaffaf N, Karnik R, Winkler WB, Vaentin A, Slany J. Embolic stroke by compression maneuver during transcranial Doppler sonography. Stroke 1994; 25(5): 1056–1057.
12. Dittrich R, Ritter MA, Droste DW. Microembolus detection by transcranial doppler sonography. Eur J Ultrasound 2002; 16(1–2): 21–30.
13. Škoda O. Transkraniální dopplerovská sonografie. In: Školoudík D, Škoda O, Bar M et al (eds). Neurosonologie. 1st ed. Praha: Galén 2003 : 154–155.
14. Consensus Committee of the Ninth International Cerebral Hemodynamic Symposium. Basic identification criteria of Doppler microembolic signals. Stroke 1995; 26(6): 1123.
15. Russel D, Brucher R. Online automatic discrimination between solid and gaseous cerebral microemboli with the first multifrequency transcranial Doppler. Stroke 2002; 33(8): 1975–1980.
16. Markus HS, Punter M. Can transcranial Doppler discriminate between solid and gaseous microemboli? Assessment of a dual-frequency transducer system. Stroke 2005; 36(8): 1731–1734.
17. Skoloudík D, Fadrná T, Bar M, Zapletalová O, Zapletal O, Blatný J et al. Changes in haemocoagulation in healthy volunteers after a 1-hour thrombotripsy using a diagnostic 2–4 MHz transcranial probe. J Tromb Trombolysis 2008; 26(2): 119–124.
18. Abbott AL, Chambers BR, Stork JL, Levi ChR, Bladin ChF, Donnan GA. Embolic signals and prediction of ipsilateral stroke or transient ischemic attack in asymptomatic carotid stenosis: a multicenter prospective cohort study. Stroke 2005; 36(6): 1128–1133.
19. Major ongoing trials. Stroke 2008; 39(10): e154–e162.
20. Cullinane M, Wainwright R, Brown A, Monaghan M, Markus HS. Asymptomatic embolization in subjects with atrial fibrillation not taking anticoagulants: A prospective study. Stroke 1998; 29(9): 1810–1815.
21. Ringelstein EB, Droste EW, Babikian VL, Evans DH, Grosset DG, Kaps M et al. Consensus on microembolus detection by TCD. Stroke 1998; 29(3): 725–729.
22. Ritter MA, Dittrich R, Thoenissen N, Ringelstein EB, Nabavi DG. Prevalence and prognostic impact of microembolic signals in arterial sources of embolism. A systematic review of the literature. J Neurol 2008; 255(7): 953–961.
23. Mackinnon AD, Aaslid R, Markus HS. Ambulatory transcranial Doppler cerebral embolic signal detection in symptomatic and asymptomatic carotid stenosis. Stroke 2005; 36(8): 1726–1730.
24. Mackinnon AD, Aaslid R, Markus HS. Long term ambulatory monitoring for cerebral emboli using transcranial Doppler ultrasound. Stroke 2004; 35(1): 73–78.
25. Levi CR, O‘Malley HM, Fell G, Roberts AK, Hoare MC, Royle JP et al. Transcranial Doppler detected cerebral microembolism following carotid endarterectomy. High microembolic signal loads predict postoperative cerebral ischaemia. Brain 1997; 120(4): 621–629.
26. Müller M, Behnke S, Walter P, Omlor G, Schimrigk K. Microembolic signals and intraoperative stroke in carotid endarterectomy. Acta Neurol Scand 1998; 97(2): 110–117.
27. Moehring MA, Klepper JR. Pulse Doppler ultrasound detection, characterization and size estimation of emboli in flowing blood. IEEE Trans Biomed Eng 1994; 41(1): 35–44.
28. Brucher R, Russell D. Automatic online embolus detection and artifact rejection with the first multifrequency transcranial Doppler. Stroke 2002; 33(8): 1969–1974.
29. Georgiadis D, Mackay TG, Kelman AW, Grosset DG, Wheatley DJ, Lees KR. Differentiation between gaseous and formed embolic materials in vivo: Application in prosthetic heart valve patients. Stroke 1994; 25(8): 1559–1563.
30. Daffertshofer M, Ries S, Schminke U, Hennerici M. High intensity transient signals in patients with cerebral ischemia. Stroke 1996; 27(10): 1844–1849.
31. Grosset DG, Georgiadis D, Kelman AW, Lees KR. Quantification of ultrasound emboli signals in patients with cardiac and carotid disease. Stroke 1993; 24(12): 1922–1924.
32. Molloy J, Markus HS. Asymptomatic embolization predicts stroke and TIA risk in patients with carotid artery stenosis. Stroke 1999; 30(7): 1440–1443.
33. Censori B, Partziguian T, Castro L, Camerlingo M, Mamoli A. Doppler microembolic signals predict ischemic recurrences in symptomatic carotid stenosis. Acta Neurol Scand 2000; 101(5): 327–331.
34. Valton L, Larrue V, le Traon AP, Massabuau P, Géraud G. Microembolic signals and risk of early recurrence in patients with stroke or transient ischemic attack. Stroke 1998; 29(10): 2125–2128.
35. Markus HS, MacKinnon A. Asymptomatic embolization detected by Doppler ultrasound predicts stroke risk in symptomatic carotid artery stenosis. Stroke 2005; 36(5): 971–975.
36. European Carotid Surgery Trialists‘ Collaborative Group. MRC European Carotid Surgery Trial: interim results for symptomatic patients with severe (70–99%) or with mild (0–20%) carotid stenosis. Lancet 1991; 337(8752): 1235–1243.
37. North American Symptomatic Carotid Endarterectomy Trial Collaborators. Benefical effect of carotid endarterectomy in symptomatic patients with high grade stenosis. N Engl J Med 1991; 325(7): 445–453.
38. Markus HS, Droste DW, Kaps M, Larrue V, Lees KR, Siebler M, Ringelstein EB. Dual antiplatelet therapy with clopidogrel and aspirin in symptomatic carotid stenosis evaluated using Doppler embolic signal detection: the clopidogrel and aspirin for reduction of emboli in symptomatic carotid stenosis (CARESS) trial. Circulation 2005; 111(17): 2233–2240.
39. Barnett HJ, Taylor DW, Eliasziw M, Fox AJ, Ferguson GG, Haynes RB et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. N Engl Med 1998; 339(20): 1415–1425.
40. Alamowitch S, Eliasziw M, Algra A, Meldrum H, Barnett HJ. Risk, causes, and prevention of ischaemic stroke in elderly patients with symptomatic internal-carotid artery stenosis. Lancet 2001; 357(9263): 1154–1160.
41. Alamowitch S, Eliasziw M, Barnett HJ. The risk and benefit of endarterectomy in women with symptomatic internal carotid artery disease. Stroke 2005; 36(1): 27–31.
42. Siebler M., Nachtmann A, Sitzer M, Rose G, Kleinschmidt A, Rademacher J et al. Cerebral microembolism and the risk of ischemia in asymptomatic high grade internal carotid artery ischemia. Stroke 1995; 26(11): 2184–2186.
43. Fujimoto A, Yasaka M, Otsubo R, Oe H, Nagatsuka K, Minematsu K. Aortic arch atherosclerotic lesions and the recurrence of ischemic stroke. Stroke 2004; 35(6): 1426–1429.
44. Eicke BM, Barth V, Kukowski B, Werner G, Paulus W. Cardiac microembolism: prevalence and clinical outcome. J Neurol Sci 1996; 136(1–2): 143–147.
45. Kumral E. Balkir K. Uzuner N, Evyapan D, Nalbantgil S. Microembolic signal detection in patients with symptomatic and asymptomatic lone atrial fibrillation. Cerebrovasc Dis 2001; 12(3): 192–196.
46. Knappertz VA, Tegeler CH, Furberg CD, Wesley DJ, Stewart KP, Kitzman DW. Carotid Doppler high intensity transient signals in dilated cardiomyopathy. Am Heart J 2000; 140(2): E1–E4.
47. Braekken SK, Russell D, Brucher R, Svennevig J. Incidence and frequency of cerebral embolic signals in patients with a similar bileaflet mechanical heart valve. Stroke 1995; 26(7): 1225–1230.
48. Deklunder G, Roussel M, Lecroart JL, Prat A, Gautier C. Microemboli in cerebral circulation and alteration of cognitive abilities in patients with mechanical prosthetic heart valves. Stroke 1998; 29(9): 1821–1826.
49. Cantelmo NL, Babikian VL, Samaraweera RN, Gordon JK, Pochay VE, Winter MR. Cerebral microembolism and ischemic changes associated with carotid endarterectomy. J Vasc Surg 1998; 27(6): 1024–1031.
50. Stork JL, Levi CR, Chambers BR, Abbott AL, Donnan GA. Possible determinants of early microembolism after carotid endarterectomy. Stroke 2002; 33(8): 2082–2085.
51. Stygall J, Kong R, Walker JM, Hardman SM, Harrison MJ, Newman SP. Cerebral microembolism detected by transcranial Doppler during cardiac procedures. Stroke 2000; 31(10): 2508–2510.
52. Dittrich R, Ringelstein EB. Occurence and clinical impact of microembolic signals during or after cardiochirurgical procedures. Stroke 2008; 39(2): 503–511.
53. Leclercq F, Kassnarsallah S, Cesari JB, Blard JM, Macia JC, Messner-Pellenc P et al. Transcranial Doppler detection of cerebral microemboli during left heart cathetrization. Cerebrovasc Dis 2001; 12(1): 59–65.
54. Bladin CF, Bingham L, Grigg L, Yapanis AG, Gerraty R, Davis SM. Transcranial Doppler detection of microemboli during percutaneous transluminal coronary angioplasty. Stroke 1998; 29(11): 2367–2370.
55. Junghans U, Siebler M. Cerebral microembolism is blocked by tirofiban, a selective nonopeptide platelet glycoprotein IIb/IIIa receptor antagonist. Circulation 2003; 107(21): 2717–2721.
56. Lennard N, Smith J, Dumville J, Abbott R, Evans DH, London NJ et al. Prevention of postoperative trombotic stroke after endarterectomy: the role of transcranial Doppler ultrasound. J Vasc Surg. 1997; 26(4): 579–584.
57. Payne DA, Jones CI, Hayes PD, Thompson MM, London NJ, Bell PR et al. Beneficial effects of clopidogrel combined with aspirin in reducing cerebral emboli in patients undergoing carotid endarterectomy. Circulation 2004; 109(12): 1476–1481.
58. Molloy J, Martin JF, Baskerville PA, Fraser SCA, Markus HS. S-nitrosoglutathione reduces the rate of embolization in humans. Circulation 1998; 98(14): 1372–1375.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2009 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
-
Intraspinální lumbální synovi ální cysty I.
Přehled problematiky - Diferenciální diagnostika neuroakantocytóz
- Detekce mikroembolizací pomocí transkraniální dopplerovské sonografie
- Použití titanových a PEEKových implantátů při ALIF stand alone u degenerativního onemocnění lumbosakrální páteře – prospektivní studie
- První zkušenosti s použitím intraoperační MR při resekcích adenomů hypofýzy
- Hereditární neuropatie
- Sclerosis multiplex a komorbidita s iným a uto imunitným ochorením
- Ependymální „čerchování“, typický znak u pacientů s roztroušenou sklerózou mozkomíšní
- Intraspinální lumbální synoviální cysty II – chirurgická léčba 13 nemocných
- Dermatomyozitida asociovaná s mnohočetným myelomem a amyloidózou – kazuistika
- Trombotická trombocytopenická purpura (TTP) u pacientky s roztroušenou sklerózou – kazuistika
- Virtuální pitva pomocí magnetické rezonance – kazuistika
- Možnost predikce průběhu herpetické encefalitidy pomocí magnetické rezonance – kazuistika
- Webové okénko
- Analýza dat v neurologii
- Zpráva z 36. kongresu ISPN
-
Intraspinální lumbální synovi ální cysty I.
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hereditární neuropatie
- Trombotická trombocytopenická purpura (TTP) u pacientky s roztroušenou sklerózou – kazuistika
- Možnost predikce průběhu herpetické encefalitidy pomocí magnetické rezonance – kazuistika
-
Intraspinální lumbální synovi ální cysty I.
Přehled problematiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



