-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Intramedulární astrocytom – soubor 15 pacientů a přehled literatury
Intramedullary Astrocytoma – a Series of 15 Patients and Literature Overview
Intramedullary astrocytoma is one of the less common tumours of the central nervous system. Certain ambiguities in the literature led us to make a retrospective review of a series of our own (2003–2009) and to compare the results with available literature. This series comprised 15 patients (10 women, 5 men), mean age 42.6 years. According to the McCormick scale, 5 patients were class I, 4 class II, 1 class III and 5 class IV. No tumour was radically resected, while 11 patients underwent subtotal resection, 4 only biopsy. Morbidity/mortality was 20% (1 dead and 2 patients deteriorating on the McCormick scale). Thirteen tumours were classified as low‑grade, 1 as grade III and one as glioblastoma. During the follow‑up period (mean 29.3 months) 5 patients died, 4 due to tumour progression. Median overall survival was estimated at 35.8 months. Younger age (p = 0.03), male sex (p = 0.04) and the presence of tumour cyst (p = 0.01) were identified as positive prognostic factors influencing overall survival. Other prognostic factors from the literature are discussed and treatment recommendations are made on the basis of its reviewing.
Key words:
intramedullary tumor – astrocytoma – survival – prognostic factors – literature review
Autori: V. Beneš lll 1; O. Bradáč 2; S. Ostrý 2; P. Buchvald 1; F. Kramář 2; M. Kaiser 1; P. Suchomel 1; V. Beneš Jr 2
Pôsobisko autorov: Neurochirurgické oddělení, Krajská nemocnice Liberec, a. s. 1; Neurochirurgická klinika 1. LF UK, IPVZ a ÚVN Praha 2
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(2): 169-177
Kategória: Krátké sdělení
Súhrn
Intramedulární astrocytom patří mezi vzácnější nádory postihující centrální nervový systém. Vzhledem k nejasnostem, které jej v literatuře obklopují, byla provedena retrospektivní analýza vlastního souboru za období 2003–2009. Výsledky byly srovnány s dostupnou literaturou. Soubor tvořilo 15 pacientů (10 žen a 5 mužů), průměrného věku 42,6 let. Dle McCormickovy klasifikace spadalo pět pacientů do stupně I, čtyři do stupně II, jeden do stupně III a pět do stupně IV. Radikální resekce nebyla dosažena v žádném případě, 11 pacientů podstoupilo subtotální resekci a čtyři pouze biopsii. Bezprostřední pooperační morbidita/mortalita činila 20 % (jedna pacientka zemřela a dva pacienti se zhoršili o jeden stupeň na McCormickově škále). Histologicky se jednalo o astrocytom nižšího stupně (grade) ve 13 případech, jeden tumor byl klasifikován jako grade III, poslední jako grade IV. V dlouhodobém sledování (průměr 29,3 měsíce) zemřelo dalších pět pacientů (tedy dosud celkem šest), z toho čtyři na progresi základního onemocnění. Medián celkového přežití byl stanoven na 35,8 měsíce. Jako pozitivní prognostický faktor pro celkové přežití byl identifikován nižší věk pacienta (p = 0,03), mužské pohlaví (p = 0,04) a přítomnost nádorové cysty (p = 0,01). Ostatní prognostické faktory jsou pak vybrány z literatury a na základě jejich rozboru byla formulována doporučení ohledně léčby.
Klíčová slova:
intramedulární nádor – astrocytom – přežití – prognostické faktory – přehled literaturyÚvod
Intramedulárně lokalizované nádory jsou poměrně vzácné a v rámci nádorového postižení centrálního nervového systému představují asi 2–4%, z tumorů postihujících páteř pak 20–25% [1–4]. Zhruba 80% všech intramedulárních tumorů zaujímají ependymomy a nádory astrocytární [2]. Další větší skupinu tvoří hemangioblastomy, obzvláště v kontextu von Hippel‑Lindauovy choroby [5]. Ostatní léze (metastázy, lymfomy, gangliogliomy, dermoidy apod.) jsou raritní [6–8]. Astrocytární nádory vyššího stupně (grade) – anaplastické astrocytomy a intramedulární glioblastomy – jsou naštěstí vzácné (8–13%), ale obvykle je pro ně charakteristická rychlá progrese [9–11].
Radikální resekce představuje „zlatý standard“ v léčbě ependymomu, 70 až100% ependymomů lze radikálně odstranit [12–26]. Spektrum chirurgické terapie u infiltrativně rostoucího intramedulárního astrocytomu sahá od biopsie s kostní dekompresí až po radikální resekci, 6–70% intramedulárních astrocytomů se dá dle literatury radikálně odstranit [17–24]. Následná případná léčba astrocytomu radioterapií zůstává kontroverzní a její užití se v jednotlivých centrech velmi liší [19,23–27].
Vedle neurčité optimální léčebné strategie se v literatuře objevuje řada protichůdných názorů na prognostické faktory. Otázka ovlivnění prognózy onemocnění zaslouží bližší pozornost. Vzhledem ke kontroverzním otázkám problematiky intramedulárního astrocytomu byla provedena retrospektivní analýza 15 pacientů léčených na dvou neurochirurgických pracovištích s podobným léčebným přístupem v rozmezí šesti let a získané výsledky srovnány s dostupnou literaturou.
Soubor a metodika
Za období 2003–2009 podstoupilo celkem 15 pacientů operaci intramedulárního astrocytomu (anaplastický astrocytom a glioblastom nevyjímaje) na Neurochirurgickém oddělení Krajské nemocnice Liberec (pět pacientů) či Neurochirurgické klinice 1. LF UK, IPVZ a ÚVN Praha (10 pacientů). Chorobopisy pacientů, magnetické rezonance (MR), závěry mezioborového onkologického semináře a ambulantní záznamy byly zhodnoceny retrospektivně. U pacientů, kteří nepocházeli z obvyklé spádové oblasti, byl kontaktován ošetřující neurolog a jeho prostřednictvím doplněny informace stran dlouhodobého neurologického vývoje. Funkční stav pacienta byl ohodnocen podle McCormickovy škály (tab. 1) [15], a to před výkonem, při dimisi pacienta a při poslední ambulantní kontrole či ze zprávy ošetřujícího neurologa. Pro histologickou klasifikaci byla použita škála World Health Organization (grade I–IV) [28]. V průběhu dalšího sledování pacienta následovala v pravidelných intervalech (3–6 měsíců) kontrolní MR. Délka sledování byla počítána jako doba od operace do posledního kontaktu s pacientem či jeho ošetřujícím neurologem. Poslední aktualizace této informace proběhla na konci května roku 2009. Příčina smrti byla zjištěna z dostupné zdravotnické dokumentace. Vedení adjuvantní onkologické léčby náleželo do kompetence spádového onkologického pracoviště a záviselo na rozhodnutí onkologa. Jasný onkologický protokol vzhledem k vzácnosti onemocnění nebyl v průběhu studie uplatňován, následná léčba se tedy mohla u pacientů výrazně lišit podle rozhodnutí konkrétního onkologického pracoviště.
Tab. 1. McCormickova funkční škála [15]. ![McCormickova funkční škála [15].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fdbad91303cbf543253c327f91294e9a.png)
Radikální resekce byla definována jako kompletní odstranění tumoru bez rezidua na základě operačního protokolu a pooperační MR, která měla v tomto hodnocení přednost. Výkon menšího rozsahu byl hodnocen jako subtotální resekce či pouze biopsie. Jako chirurgická mortalita bylo definováno úmrtí do 30 dnů od výkonu a jako neurologická morbidita pak zhoršení na McCormickově škále.
Vyhodnocení výsledků bylo provedeno metodou Kaplan‑Meier [29]. Pro srovnání průběhů kumulativních funkcí přežití ve skupinách pacientů dělených dle jednotlivých sledovaných parametrů byl použit log‑rank test. Vybrané proměnné byly dosazeny do Coxova modelu proporcionálních rizik. Ke zpracování byl použit program STATISTICA CZ 8.0.
Provedení této retrospektivní studie nevyžadovalo souhlas etické komise ani jednoho ze zúčastněných pracovišť.
Výsledky
Základní charakteristika souboru
Soubor tvořilo 10 žen a pět mužů, průměrného věku 42,6 let (17–77 let). Bolest či iritační příznaky vedly k diagnóze u pěti pacientů, progredující neurologický deficit či kvadrusymptomatologie u 10 pacientů. Průměrná doba trvání příznaků činila 28,8 měsíců (1 měsíc až 12 let). Při neurologickém vyšetření byl patrný motorický deficit různého rozsahu u 12 pacientů, senzitivní deficit také u 12, sfinkterová porucha u čtyř nemocných. Při klasifikaci funkčního stavu podle McCormickovy škály [15] spadalo pět pacientů do stupně I, čtyři do stupně II, jeden pacient do stupně III a pět pacientů do stupně IV (tab. 2).
Tab. 2. Charakteristika 15 pacientů s intramedulárním astrocytomem. 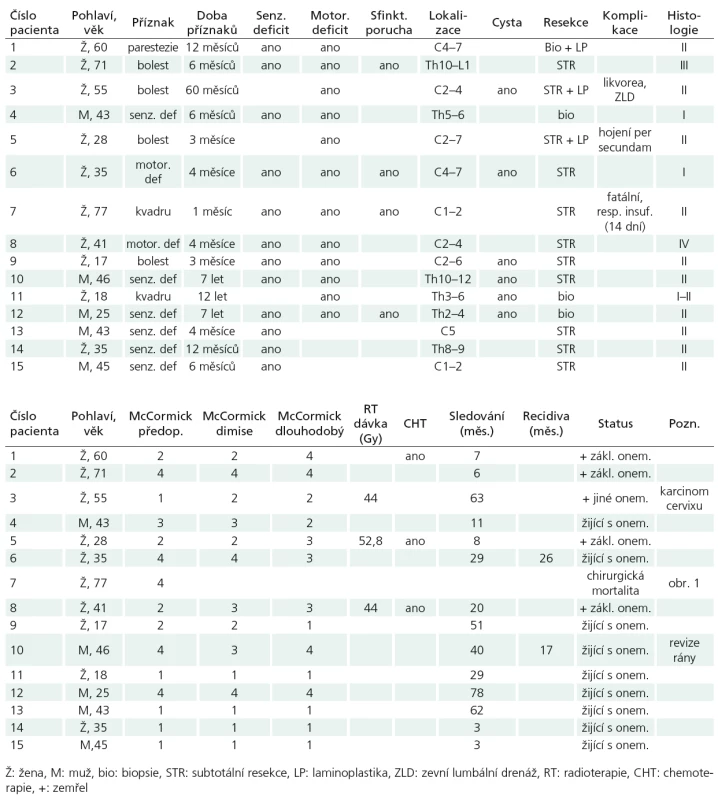
Tumor se nacházel v oblasti krční míchy v devíti a v oblasti hrudní míchy v šesti případech, průměrného rozsahu 3,3 segmentu (1–7). Cystická složka byla zřejmá u šesti tumorů.
Rozsah resekce a komplikace
Žádný tumor se nepodařilo radikálně odstranit, rozsah resekce byl klasifikován jako subtotální resekce v 11 případech, zbývající čtyři pacienti podstoupili biopsii.
Zhoršení na McCormickově funkční škále o jeden stupeň bezprostředně po výkonu bylo pozorováno u dvou pacientů. Ke zlepšení o jeden stupeň došlo u jednoho pacienta, 11 zůstalo ve stejné funkční skupině. Poslední pacientka zemřela 14 dní po operaci v oblasti C1–2 na fatální respirační insuficienci (obr. 1). Bezprostřední neurologická morbidita/mortalita činila 20% (jedna zemřelá a dva pacienti neurologicky zhoršeni). K prosakování likvoru operační ránou úspěšně vyřešené zevní lumbální drenáží a protrahovanému hojení rány per secundam došlo pokaždé u jednoho pacienta.
Obr. 1. 77letá žena s rychle progredující centrální kvadrusymptomatologií s histologicky potvrzeným astrocytomem grade II. 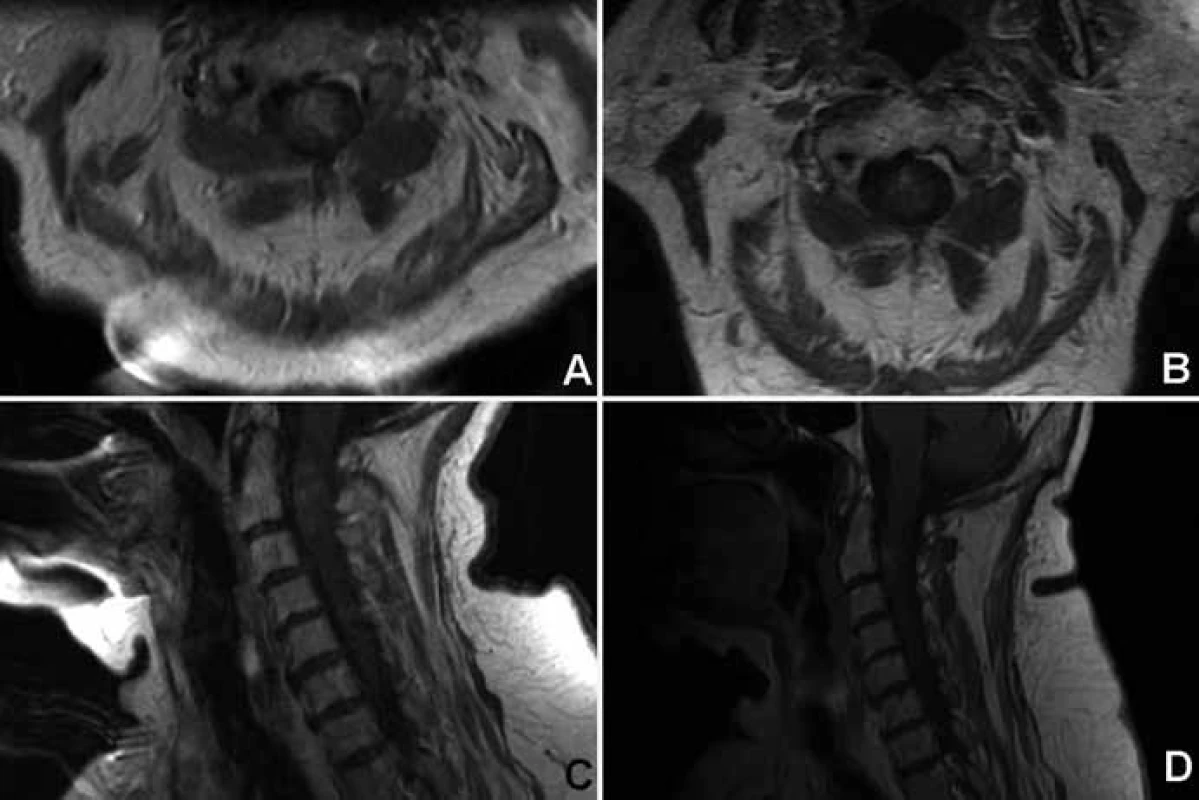
Histologie a onkologická terapie
Histologicky se jednalo o astrocytom nižšího grade (I–II) ve 13 případech, dva tumory byly klasifikovány jako grade III, resp. IV. Tato pacientka po neradikálním výkonu podstoupila chemoterapii a radioterapii (44 Gy), 20 měsíců po výkonu zemřela na progresi onemocnění.
Adjuvantní radioterapie a chemoterapie byly aplikovány u dalších dvou pacientů. Vzhledem k nízkému počtu pacientů, kteří podstoupili další onkologickou léčbu, nebylo možné bližší statistické zhodnocení jejího terapeutického efektu.
Dlouhodobé sledování
Průměrná doba sledování u 14 pacientů přeživších více než 30 dní po operaci činila 29,3 měsíce (3–78 měsíce). Ve srovnání se stavem bezprostředně po operaci došlo u jedné pacientky ke zhoršení neurologického stavu o dva stupně na McCormickově škále, tato pacientka krátce po naší kontrole zemřela na progresi základního onemocnění. Pomalá progrese onemocnění vedla ke zhoršení o jeden stupeň u dalších dvou pacientů. Ke zlepšení došlo u třech pacientů (vždy o jeden stupeň), osm pacientů zůstalo ve stejné funkční skupině.
Vyjma pacientky zemřelé v časném pooperačním období zemřelo do konce května roku 2009 dalších pět pacientů; čtyři na progresi základního onemocnění 6, 7, 8 a 20 měsíců po výkonu. Poslední pacientka zemřela na karcinom děložního čípku více než pět let po operaci. Devět dosud žijících pacientů zůstává ve sledování, u dvou z nich kontrolní MR prokázala recidivu procesu, oba podstoupili opakovanou resekci, a to 17 a 26 měsíců po první operaci, v jednom případě komplikovanou likvoreou vyžadující revizi.
Obr. 2 ukazuje Kaplan‑Meierovu analýzu celkového přežití souboru, 25. percentil kumulativní funkce přežití je 7,4 měsíce, medián přežití 35,8 měsíce.
Obr. 2. Kaplan-Meierova analýza celkového přežití souboru. 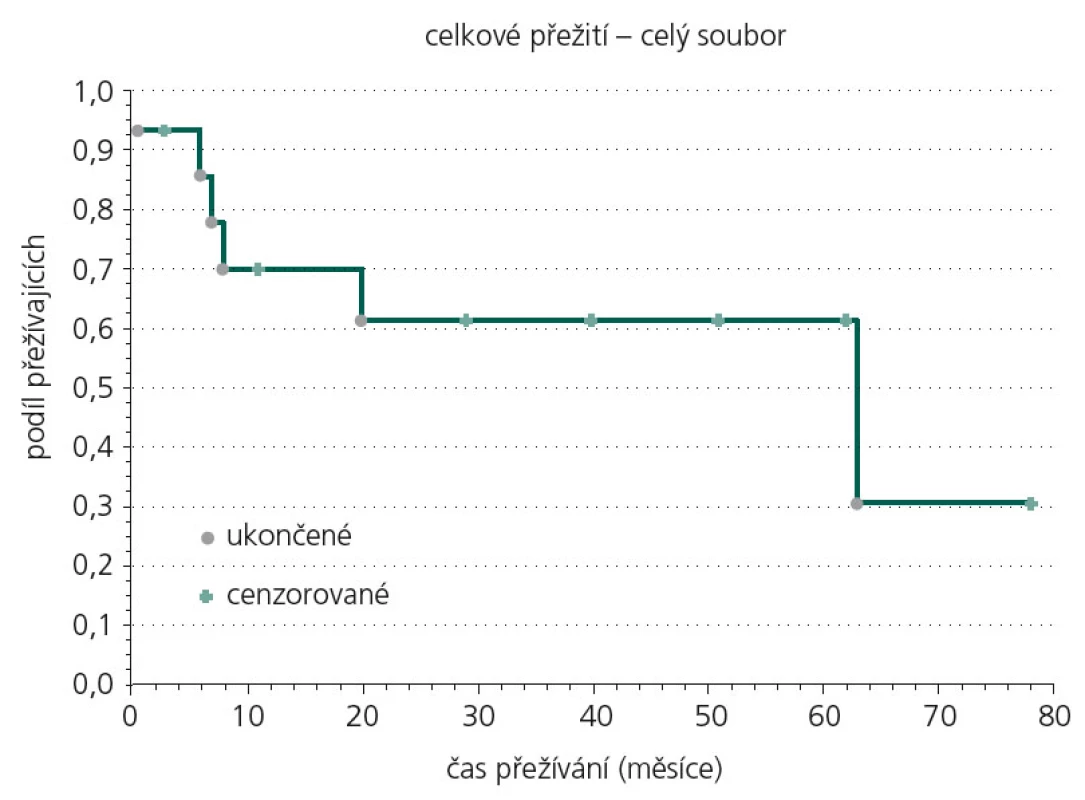
Srovnání Kaplan‑Meierových modelů celkového přežití pro skupiny rozdělené dle pohlaví, délky anamnézy (do 6 měsíců, více než 6 měsíců), iniciálních příznaků (přítomnosti či nepřítomnosti senzitivního, motorického, sfinkterového deficitu), lokalizace (C, Th mícha), rozsahu (do 3 segmentů, více než 3 segmenty), přítomnosti cysty, rozsahu resekce (biopsie, subtotální resekce), byla zjištěna statisticky významně lepší prognóza celkového přežití u pacientů mužského pohlaví (p = 0,04) a pacientů s tumorovou cystou (p = 0,01).
V Coxově modelu proporcionálních rizik byly použity proměnné věk, grade tumoru a McCormickova škála před operací. Jako signifikantní negativní prediktor celkového přežití byl stanoven vyšší věk (p = 0,03; relativní riziko r = 1,11 na rok věku).
Diskuze
Intramedulární astrocytom zůstává v literatuře zahalen celou řadou otázek. Cílem následujících řádků není tyto otázky zodpovědět, ale uvést čtenáře do širšího kontextu této problematiky.
Literatura nedisponuje k dnešnímu datustudií zabývající se čistě přirozeným průběhem onemocnění. Oplývá však množstvím retrospektivních studií překlenujících celá desetiletí, jejichž závěry omezuje malá velikost souboru, tzv. selection bias, měnící se léčebná strategie, nedostatečná či chybějící statistická analýza a řada dalších metodologických nedostatků. Nutno přiznat, že i naši studii výrazně ovlivňují právě tyto neduhy. Hlavním limitujícím faktorem většiny studií, podobně jako v našem případě, pak zůstává malé množství pacientů. Dosud největší studie pocházející z Mayo Clinic zahrnovala 136 pacientů za období 43 let, tedy zhruba tři pacienty za rok [30]. Pouze dalších šest studií obsahovalo více než 50 pacientů [14,16,17,31–33]. Pacienti s intramedulárním astrocytomem bývají nezřídka zahrnuti do většího souboru všech intramedulárních tumorů. Takové zařazení je sice akceptovatelné, pokud zohledňuje chirurgické komplikace, nicméně z onkologického hlediska zcela postrádá smysl. I přes tyto nedostatky pak ve středu debaty zůstávají prognosticky významné faktory, chirurgická morbidita/mortalita, otázka rozsahu resekce a radioterapie.
Nejasnosti ohledně prognostického významu věku pacientů nejlépe ilustrují dvěstudie ze zmiňované Mayo Clinic z roku 1995 a 2009 [20,30]. V původní studii se věk více než 20 let ukázal jako prognosticky příznivý [20], pozdější studie naopak vyzněla pozitivně pro pacienty mladší [30]. Další studie starší věk shodně označily jako negativní prognostický faktor [11,24,34,35], a to i v dětské populaci [32]. Naopak, jiní autoři souvislost mezi prognózou a věkem nenalezli [17–19,21,25,26,31,36,37]. To může být ovlivněno skladbou souboru a porovnáváním jednotlivých věkových skupin v něm, stejně jako histologickou kompozicí [20]. Zajímavým zjištěním je pak dlouhodobé přežití dětských pacientů s tumory vyššího grade (více jak deset let) [21,32,33,36,38,39], což v dospělé populaci lze považovat za výjimečné [9,11,17,19,20,26,27,30,36,40,41]. Naše studie ve shodě s výše zmíněnými [11,24,34,35] prokazuje statisticky významný negativní vliv vyššího věku na celkové přežití, nicméně malá velikost našeho souboru a ovlivnění statistických výsledků dvěma pacienty, kteří zemřeli z jiných příčin, pak limituje možné závěry.
Otázku vlivu pohlaví na prognózu sepokusila zodpovědět celá řada autorů bez většího úspěchu [11,17,19,20,30,31, 34,35,37]. Pouze Huddart et al a Jyothirmayi et al nalezli signifikantně delší přežití u žen [25,26]. Naopak, rozsáhlá multicentrická studie dětských pacientů z Francie, v níž zastoupení obou pohlaví bylo téměř shodné, vyzněla prognosticky lépe pro chlapce (10leté přežití 79 oproti 39%, p = 0,04) [32]. V kontextu dlouhodobého přežití dětí s astrocytomy vyššího grade se pak nabízí otázka biologické diverzity těchto tumorů v dětském věku. Naše sestava prokazuje významně lepší prognózu celkového přežití pacientů mužského pohlaví.
Lokalizace astrocytomu v krční míše s sebou nesla horší prognózu v některých studiích, oproti lokalizaci hrudní [20,30, 41]. Nádory lokalizované v nižších etážích potřebují delší dobu k infiltraci respiračního centra (obvyklá příčina smrti) než nádory v krční oblasti. Na druhou stranu, hrudní mícha je více náchylná k radiačnímu poškození [42,43], což může být zdrojem značné morbidity, obzvláště u dlouhodobě přežívajících. Celá řada studií, podobně jako naše, však žádnou asociaci mezi lokalizací tumoru a přežitím nenalezla [17–19,25,26,31,44].
Rozsah tumoru se dle literatury ukazuje jako prognosticky spíše nevýznamný [17,18,25,31,32,34,36,37], výjimkou mohou být tzv. holocord astrocytomy [30]. Podobně nejistá se jeví přítomnost syrinx či peritumorózní cysty [11,31,37]. Ani naše studie neprokázala významný vliv rozsahu tumoru na přežití. Otázku přítomnosti cysty, která se ukázala prognosticky významná, bychom mohli nejlépe vysvětlit její častou přítomností u nízkostupňových astrocytomů.
Naopak jasná shoda panuje ohledně histologického stupně. Studie porovnávající délku přežití u astrocytomů nízkého stupně (I a II) s astrocytomy vyššího stupně (III a IV) se shodují na signifikantně lepším přežití pacientů s příznivější histologií [19,20,22,25,26,30–32,34,35, 41,44,45]. I další autoři považují histologický stupeň za prognosticky významný [16,17,24,27,33,39,40,46–52], jejich závěry však limituje neprovedení řádné statistické analýzy. Signifikantně významný rozdíl v délce přežití byl nalezen i mezi anaplastickým astrocytomem a glioblastomem [36], jejichž závažnou prognózu potvrzují i další série zabývající se čistě problematikou vysokostupňových astrocytomů [9,11]. Parametry přežití ve významných světových studiích s ohledem na histologii pak shrnuje tab. 3. S prognózou též inverzně koreluje doba příznaků [17,20,30,32,35] – kratší anamnéza signifikantně snižuje přežití. Toto lze nejlépe vysvětlit rychlým rozvojem symptomatologie u tumorů vyššího stupně [20,30,36]. Na druhé straně problematiky stojí astrocytomy prezentující se páteřní deformitou. Ty vyžadují značnou dobu ke svému vytvoření, což napovídá pomalému růstu nádoru. Jelikož 10leté přežití těchto pacientů se pohybovalo kolem 90% [32], riskantní a agresivní léčba nemusí být v této skupině pacientů indikována. Grade tumoru nebyl v naší sestavě v rámci Coxova modelu shledán statisticky významným prediktorem celkového přežití. Tento fakt je snadno pochopitelný vzhledem k naprosté převaze tumorů nízkého grade (73%).
Tab. 3. Chronologický přehled studií publikovaných po roce 1980 zabývající se přežitím pacientů s intramedulárním astrocytomem v závislosti na histologii. 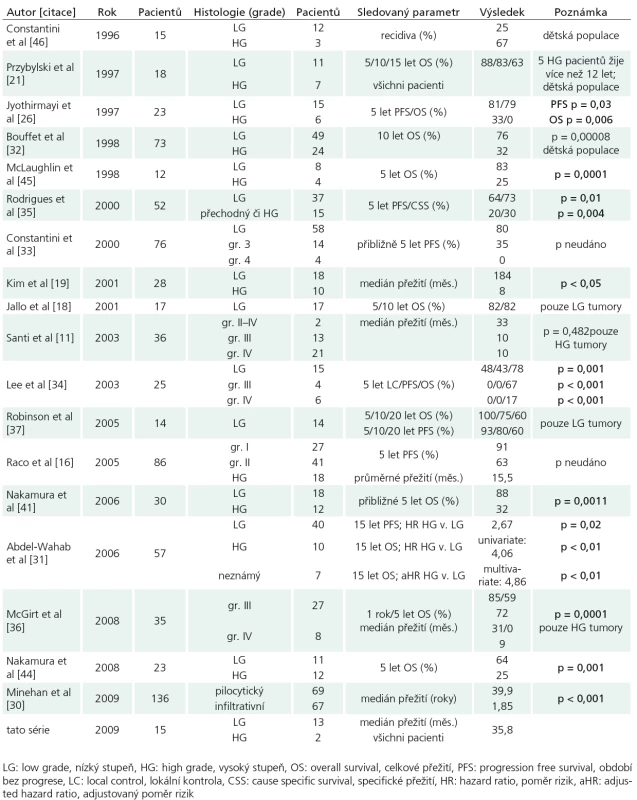
Chronologický přehled studií publikovaných po roce 1980 zabývající se přežitím pacientů s intramedulárním astrocytomem v závislosti na histologii. 
Současná léčba intramedulárního astrocytomu začíná chirurgickým výkonem. Odběr histologického vzorku dovoluje stanovení definitivní diagnózy. Zmenšení tumoru pak odstraní případné expanzivní projevy na okolní míšní tkáň, což podpoří její funkční zotavení [18,19,33,40,46]. Následná duro ‑ a laminoplastika dopřejí místo dalšímu možnému růstu nádoru. Pro adjuvantní onkologickou terapii je též přítomno menší množství rezidua. Význam radikality resekce je zapotřebí postavit do širšího kontextu možného zhoršení funkčního stavu. Jelikož histologické studie ukázaly přítomnost normálních neuronů v samotném nádoru [40], provedení radikální resekce u infiltrativně rostoucího gliového nádoru je iluzorní. Nabízí se paralela s intrakraniálními gliomy, kde studie různé kvality prokázaly delší přežití závislé na rozsahu resekce [56]. Intrakraniální gliomy však nemusí nutně obklopovat funkčně elokventní tkáň, existuje zde tedy jakási „bezpečná zóna“, která chirurgovi dovolí v určitých oblastech resekci posunout i za makroskopickou hranici samotného nádoru. V míše, kde na jednotku tkáně připadá větší množství funkčně významných drah a neuronů, taková zóna k dispozici není. Zhoršení funkčního stavu pacienta jako cena za radikálnější resekci je nepřijatelné a je spojeno se zhoršenou kvalitou života a kratším přežitím [17,19,34]. Radikální resekci lze bezpečně doporučit v případě jasné hranice nádoru. Další jistotu chirurgovi dodá i peroperační elektrofyziologické monitorování [57,58], které považujeme za standard. Větší rozsah resekce byl identifikován jako prognosticky příznivý faktor [21,22,31,33,36,41], naopak celá řada autorů, nás nevyjímaje, tuto asociaci nepotvrdila [11,14,17–19,23,25,26,32,34, 35,37,44,48–50,55], či dokonce identifikovala biopsii jako jeden z hlavních faktorů pro delší přežití ve srovnání s rozsáhlejší resekcí [30]. Na druhou stranu rozsáhlejší resekce nezpůsobila zhoršení funkčního stavu pacienta [19,33,47], a to i v případě maligních astrocytomů [36]. Nejvýznamnějším faktorem pro příznivý funkční výsledek po operaci se ukazuje předoperační neurologický stav [16,23, 33,34,40,41,44,46,48,55,59–61]. Jednou přítomný neurologický deficit se již nemusí upravit a tato pravděpodobnost rapidně stoupá s jeho tíží a dobou trvání. Přístup „wait and scan“ je tedy třeba v léčbě intramedulárních tumorů velmi zvážit.
Radioterapie v léčebném protokolu nízkostupňových intramedulárních astrocytomů zůstává kontroverzním tématem. Její užití lze ospravedlnit, jelikož nejobvyklejší manifestace recidivy je lokální [35]. Dále byl též nalezen tzv. dose‑response relationship pro pacienty ozářené více než 35 a 40 Gy [30,53]; dávka nad 50 Gy žádný další prospěch již neznamenala [20,25,26,31]. Radioterapie také prodloužila čas do recidivy po neradikální resekci intrakraniálních nízkostupňových astrocytomů, ačkoliv celkové přežití zůstalo neovlivněno [62,63]. Progrese či recidiva intramedulárního tumoru je spojena se zhoršením funkčního stavu a zhoršením kvality života, prodloužení období bez progrese je tedy žádoucí. Na druhou stranu nelze zapomínat na pomalý růst nízkostupňových astrocytomů; radioterapie nemusí být tak efektivní na buňky právě neprodělávající mitózu [55]. Tolerance míšní tkáně vůči záření je omezena, obzvláště pak v případě přítomnosti expanzivní léze, která činí míchu ještě náchylnější k poradiačnímu poškození [64–66]. Dlouhodobě přežívající pacienti „léčení“ pouze biopsií a kostěnou dekompresí nejsou v literatuře výjimkou [14,17,21]. Někteří autoři doporučují po radikálním výkonu ponechat radioterapii v rezervě pro případ recidivy [18,40]. Stejně tak se nedoporučuje radioterapie u dětských pacientů před ukončením vývoje [33]. Dlouhodobě přežívající pacienti mohou být vystaveni riziku vzniku dalšího maligního nádoru v ozařované oblasti; až 13% v období 20 let [39]. Przybylski et al [21] a Sandler et al [24] dokonce nalezli horší prognózu ozářených pacientů, důvod spatřují v aplikaci radioterapie pacientům v horším biologickém stavu. Pouze Abdel‑Wahab et al v multicentrické studii nalezli signifikantně delší období bez progrese u ozářených pacientů, celkové přežití ovlivněno nebylo [31]. Další autoři pak signifikantní rozdíl v prognóze nenalezli [18–20,32,37,41]. Lze tedy shrnout, že k dnešnímu dni literatura nedisponuje jasnou odpovědí na otázku aplikace radioterapie v léčbě nízkostupňových intramedulárních astrocytomů.
Užití radioterapie v léčbě astrocytomů vyššího stupně můžeme chápat jako nezbytnost, kde se ošetřující tým snaží prodloužit přežití všemi dostupnými způsoby a prostředky. Nejlepším příkladem takového přístupu jsou pacienti, kteří podstoupili radiochordektomii, kde zbývající míšní funkce je obětována za naději na prodloužení života [9,54]. Ačkoliv některé studie nenalezly signifikantně lepší přežití ozářených pacientů [11,31,32,41], spíše než selhání léčby tento fakt vysvětluje agresivní povaha těchto nádorů.
Chemoterapie zatím nedoznala v léčebném protokolu intramedulárního astrocytomu širší využití, ač některé menší série přinesly nadějné dlouhodobé výsledky [67–71]. Chemoterapie byla obvykle užita v rámci komplexního onkologického protokolu po resekci a radioterapii, nezřídka v případě recidivy onemocnění. V případě rozsáhlého a inoperabilního nádoru může být chemoterapie vnímána jako léčebná metoda „první linie“, stejně tak dovolí oddálit radioterapii u dětských pacientů [68]. U astrocytomů vyššího stupně chemoterapie nevedla ke zlepšení prognózy [11,36]. Jelikož biologická povaha intramedulárního glioblastomu se od intrakraniálního neliší, můžeme do budoucna předpokládat konkomitantní přidání temozolomidu do léčebného protokolu [72].
Závěr
Úspěšná léčba intramedulárního astrocytomu zůstává zatím těžko dosažitelná. Ačkoliv pacienti s nízkostupňovým astrocytomem mohou žít dlouhé období bez známek onemocnění, progrese je vždy možná, snad i nevyhnutelná. Maximálně bezpečná resekce vedená elektrofyziologickým monitoringem pravděpodobně prodlouží období bez progrese, ale nesmí jí být dosaženo za cenu zhoršení neurologického stavu. Pokud MR potvrdí radikální resekci, je možné se vyhnout aplikaci radioterapie. Radioterapie pravděpodobně prodlouží období bez progrese po neradikální resekci, nicméně její role v léčbě nízkostupňového intramedulárního astrocytomu není uspokojivě objasněna.
Diagnóza intramedulárního astrocytomu vyššího stupně je prognosticky nesmírně závažná. Adjuvantní onkologická léčba v případě tohoto tumoru selhává, snad s výjimkou skupiny dětských pacientů. Vzhledem k biologické povaze, která se od intrakraniálních protějšků neliší, lze považovat za vhodné aplikovat stejný léčebný algoritmus – maximální bezpečná resekce následovaná adjuvantní konkomitantní radio ‑ a chemoterapií.
Přijato k recenzi: 13. 7. 2009
Přijato do tisku: 29. 1. 2010
MUDr. Vladimír Beneš
Neurochirurgické oddělení
Krajská nemocnice Liberec, a.s.
Husova 10
460 63 Liberec
Tel./fax: 485 101 078
e-mail: vladimir.benes@nemlib.cz
Zdroje
1. Barker DJ, Weller RO, Garfield JS. Epidemiology of primary tumours of the brain and spinal cord: a regional survey in southern England. J Neurol Neurosurg Psychiatry 1976; 39(3): 290–296.
2. Helseth A, Mørk SJ. Primary intraspinal neoplasms in Norway, 1955 to 1986. A population‑based survey of 467 patients. J Neurosurg 1989; 71(6): 842–845.
3. Slooff JL, Kernohan JW, MacCarty CS. Primary intramedullary tumors of the spinal cord and filum terminale. Philadelphia‑London: WB Saunders Company 1964.
4. Stein BM, McCormick PC. Intramedullary neo-plasms and vascular malformations. Clin Neurosurg 1992; 39 : 361–387.
5. Conway JE, Chou D, Clatterbuck RE, Brem H, Long DM, Rigamonti D. Hemangioblastomas of the central nervous system in von Hippel‑Lindau syndrome and sporadic disease. Neurosurgery 2001; 48(1): 55–62.
6. Costigan DA, Winkelman MD. Intramedullary spinal cord metastasis. A clinicopathological study of 13 cases. J Neurosurg 1985; 62(2): 227–233.
7. Hamburger C, Büttner A, Weis S. Ganglioglioma of the spinal cord: report of two rare cases and review of the literature. Neurosurgery 1997; 41(6): 1410–1415.
8. Hautzer NW, Aiyesimoju A, Robitaille Y. „Primary“ spinal intramedullary lymphomas: a review. Ann Neurol 1983; 14(1): 62–66.
9. Cohen AR, Wisoff JH, Allen JC, Epstein F. Malignant astrocytomas of the spinal cord. J Neurosurg 1989; 70(1): 50–54.
10. Johnson DL, Schwarz S. Intracranial metastases from malignant spinal‑cord astrocytoma. Case report. J Neurosurg 1987; 66(4): 621–625.
11. Santi M, Mena H, Wong K, Koeller K, Olsen C, Rushing EJ. Spinal cord malignant astrocytomas. Clinicopathologic features in 36 cases. Cancer 2003; 98(3): 554–561.
12. Brotchi J, Dewitte O, Levivier M, Balériaux D, Vandesteene A, Raftopoulos C et al. A survey of 65 tu-mors within the spinal cord: surgical results and the importance of preoperative magnetic resonance imaging. Neurosurgery 1991; 29(5): 651–656.
13. Epstein FJ, Farmer JP, Freed D. Adult intramedullary spinal cord ependymomas: the result of surgery in 38 patients. J Neurosurg 1993; 79(2): 204–209.
14. Guidetti B, Mercuri S, Vagnozzi R. Long‑term results of the surgical treatment of 129 intramedullary spinal gliomas. J Neurosurg 1981; 54(3): 323–330.
15. McCormick PC, Torres R, Post KD, Stein BM. Intramedullary ependymoma of the spinal cord. J Neurosurg 1990; 72(4): 523–532.
16. Raco A, Esposito V, Lenzi J, Piccirilli M, Delfini R, Cantore G. Long‑term follow‑up of intramedullary spinal cord tumors: a series of 202 cases. Neurosurgery 2005; 56(5): 972–981.
17. Innocenzi G, Salvati M, Cervoni L, Delfini R, Cantore G. Prognostic factors in intramedullary astrocytomas. Clin Neurol Neurosurg 1997; 99(1): 1–5.
18. Jallo GI, Danish S, Velasquez L, Epstein F. Intramedullary low‑grade astrocytomas: long‑term outcome following radical surgery. J Neurooncol 2001; 53(1): 61–66.
19. Kim MS, Chung CK, Choe G, Kim IH, Kim HJ. Intramedullary spinal cord astrocytoma in adults: postoperative outcome. J Neurooncol 2001; 52(1): 85–94.
20. Minehan KJ, Shaw EG, Scheithauer BW, Davis DL, Onofrio BM. Spinal cord astrocytoma: pathological and treatment considerations. J Neurosurg 1995; 83(4): 590–595.
21. Przybylski GJ, Albright AL, Martinez AJ. Spinalcord astrocytomas: long‑term results comparing treatments in children. Childs Nerv Syst 1997; 13(7): 375–382.
22. Reimer R, Onofrio BM. Astrocytomas of the spinal cord in children and adolescents. J Neurosurg 1985; 63(5): 669–675.
23. Rossitch E Jr, Zeidman SM, Burger PC, Curnes JT,Harsh C, Anscher M et al. Clinical and pathological analysis of spinal cord astrocytomas in children. Neurosurgery 1990; 27(2): 193–196.
24. Sandler HM, Papadopoulos SM, Thornton AF Jr, Ross DA. Spinal cord astrocytomas: results of therapy. Neurosurgery 1992; 30(4): 490–493.
25. Huddart R, Traish D, Ashley S, Moore A, Brada M.Management of spinal astrocytoma with conservative surgery and radiotherapy. Br J Neurosurg 1993; 7(5): 473–481.
26. Jyothirmayi R, Madhavan J, Nair MK, Rajan B. Conservative surgery and radiotherapy in the treatment of spinal cord astrocytoma. J Neurooncol 1997; 33(3): 205–211.
27. Kopelson G, Linggood RM. Intramedullary spinal cord astrocytoma versus glioblastoma: the prognostic importance of histologic grade. Cancer 1982; 50(4): 732–735.
28. Kleihues P, Cavenee WK. Pathology and genetics of tumours of the nervous system. Lyon: IARC Press 2000.
29. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
30. Minehan KJ, Brown PD, Scheithauer BW, Krauss WE, Wright MP. Prognosis and treatment of spinal cord astrocytoma. Int J Radiat Oncol Biol Phys 2009; 73(3): 727–733.
31. Abdel‑Wahab M, Etuk B, Palermo J, Shirato H, Kresl J, Yapicier O et al. Spinal cord gliomas: A multi‑institutional retrospective analysis. Int J Radiat Oncol Biol Phys 2006; 64(4): 1060–1071.
32. Bouffet E, Pierre‑Kahn A, Marchal JC, Jouvet A, Kalifa C, Choux M et al. Prognostic factors in pediatric spinal cord astrocytoma. Cancer 1998; 83(11): 2391–2399.
33. Constantini S, Miller DC, Allen JC, Rorke LB, Freed D,Epstein FJ. Radical excision of intramedullary spinal cord tumors: surgical morbidity and long‑term follow‑up evaluation in 164 children and young adults. J Neurosurg 2000; 93 (Suppl 2): 183–193.
34. Lee HK, Chang EL, Fuller GN, Aldape KD, Atkinson GJ, Levy LB et al. The prognostic value of neurologic function in astrocytic spinal cord glioma. Neuro Oncol 2003; 5(3): 208–213.
35. Rodrigues GB, Waldron JN, Wong CS, Laperriere NJ. A retrospective analysis of 52 cases of spinal cord glioma managed with radiation therapy. Int J Radiat Oncol Biol Phys 2000; 48(3): 837–842.
36. McGirt MJ, Goldstein IM, Chaichana KL, Tobias ME,Kothbauer KF, Jallo GI. Extent of surgical resection of malignant astrocytomas of the spinal cord: outcome analysis of 35 patients. Neurosurgery 2008; 63(1): 55–61.
37. Robinson CG, Prayson RA, Hahn JF, Kalfas IH, Whitfield MD, Lee SY et al. Long‑term survival and functional status of patients with low‑grade astrocytoma of spinal cord. Int J Radiat Oncol Biol Phys 2005; 63(1): 91–100.
38. Merchant TE, Nguyen D, Thompson SJ, Reardon DA, Kun LE, Sanford RA. High‑grade pediatric spinal cord tumors. Pediatr Neurosurg 1999; 30(1): 1–5.
39. O‘Sullivan C, Jenkin RD, Doherty MA, Hoffman HJ, Greenberg ML. Spinal cord tumors in children: long‑term results of combined surgical and radiation treatment. J Neurosurg 1994; 81(4): 507–512.
40. Epstein FJ, Farmer JP, Freed D. Adult intramedullary astrocytomas of the spinal cord. J Neurosurg 1992; 77(3): 355–359.
41. Nakamura M, Chiba K, Ishii K, Ogawa Y, Takaishi H, Matsumoto M et al. Surgical outcomes of spinal cord astrocytomas. Spinal Cord 2006; 44(12): 740–745.
42. Lambert PM. Radiation myelopathy of the thoracic spinal cord in long term survivors treated with radical radiotherapy using conventional fractionation. Cancer 1978; 41(5): 1751–1760.
43. Phillips TL, Buschke F. Radiation tolerance of the thoracic spinal cord. Am J Roentgenol Radium Ther Nucl Med 1969; 105(3): 659–664.
44. Nakamura M, Ishii K, Watanabe K, Tsuji T, Takaishi H, Matsumoto M et al. Surgical treatment of intramedullary spinal cord tumors: prognosis and complications. Spinal Cord 2008; 46(4): 282–286.
45. McLaughlin MP, Buatti JM, Marcus RB Jr, Maria BL, Mickle PJ, Kedar A. Outcome after radiotherapy of primary spinal cord glial tumors. Radiat Oncol Investig 1998; 6(6): 276–280.
46. Constantini S, Houten J, Miller DC, Freed D, Ozek MM, Rorke LB et al. Intramedullary spinal cord tumors in children under the age of 3 years. J Neurosurg 1996; 85(6): 1036–1043.
47. Cooper PR. Outcome after operative treatment of intramedullary spinal cord tumors in adults: intermediate and long‑term results in 51 patients. Neurosurgery 1989; 25(6): 855–859.
48. Cristante L, Herrmann HD. Surgical management of intramedullary spinal cord tumors: functional outcome and sources of morbidity. Neurosurgery 1994; 35(1): 69–74.
49. Hardison HH, Packer RJ, Rorke LB, Schut L, Sutton LN, Bruce DA. Outcome of children with primary intramedullary spinal cord tumors. Childs Nerv Syst 1987; 3(2): 89–92.
50. Hulshof MC, Menten J, Dito JJ, Dreissen JJ, van den Bergh R, González D. Treatment results in primary intraspinal gliomas. Radiother Oncol 1993; 29(3): 294–300.
51. Kopelson G, Linggood RM, Kleinman GM, Doucette J, Wang CC. Management of intramedullary spinal cord tumors. Radiology 1980; 135(2): 473–479.
52. Linstadt DE, Wara WM, Leibel SA, Gutin PH, Wilson CB, Sheline GE. Postoperative radiotherapy of primary spinal cord tumors. Int J Radiat Oncol Biol Phys 1989; 16(6): 1397–1403.
53. Garcia DM. Primary spinal cord tumors treated with surgery and postoperative irradiation. Int J Radiat Oncol Biol Phys 1985; 11(11): 1933–1939.
54. Shirato H, Kamada T, Hida K, Koyanagi I, Iwasaki Y,Miyasaka K et al. The role of radiotherapy in the management of spinal cord glioma. Int J Radiat Oncol Biol Phys 1995; 33(2): 323–328.
55. Innocenzi G, Raco A, Cantore G, Raimondi AJ. Intramedullary astrocytomas and ependymomas in the pediatric age group: a retrospective study. Childs Nerv Syst 1996; 12(12): 776–780.
56. Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery 2008; 62(4): 753–766.
57. Kothbauer K, Deletis V, Epstein FJ. Intraoperative spinal cord monitoring for intramedullary surgery: an essential adjunct. Pediatr Neurosurg 1997; 26(5): 247–254.
58. Zileli M, Coşkun E, Ozdamar N, Ovül I, Tunçbay E,Oner K et al. Surgery of intramedullary spinal cord tumors. Eur Spine J 1996; 5(4): 243–250.
59. Brotchi J, Dewitte O, Levivier M, Balériaux D, Vandesteene A, Raftopoulos C et al. A survey of 65 tumors within the spinal cord: surgical results and the importance of preoperative magnetic resonance imaging. Neurosurgery 1991; 29(5): 651–657.
60. Epstein F. Spinal cord astrocytomas of childhood. Adv Tech Stand Neurosurg 1986; 13 : 135–169.
61. Epstein F, Epstein N. Surgical treatment of spinal cord astrocytomas of childhood. A series of 19 patients. J Neurosurg 1982; 57(5): 685–689.
62. Karim AB, Afra D, Cornu P, Bleehan N, Schraub S,De Witte O et al. Randomized trial on the efficacy of radiotherapy for cerebral low‑grade glioma in the adult: European Organization for Research and Treatment of Cancer Study 22845 with the Medical Research Council study BRO4: an interim analysis. Int J Radiat Oncol Biol Phys 2002; 52(2): 316–324.
63. van den Bent MJ, Afra D, de Witte O, Ben Hassel M, Schraub S, Hoang‑Xuan K et al. Long‑term efficacy of early versus delayed radiotherapy for low‑grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 2005; 366(9490): 985–990.
64. Kopelson G. Radiation tolerance of the spinal cord previously‑damaged by tumor and operation: long term neurological improvement and time‑dose‑volume relationships after irradiation of intraspinal gliomas. Int J Radiat Oncol Biol Phys 1982; 8(5): 925–929.
65. Marcus RB Jr, Million RR. The incidence of myelitis after irradiation of the cervical spinal cord. Int J Radiat Oncol Biol Phys 1990; 19(1): 3–8.
66. Wara WM, Phillips TL, Sheline GE, Schwade JG. Radiation tolerance of the spinal cord. Cancer 1975; 35(6): 1558–1562.
67. Allen JC, Aviner S, Yates AJ, Boyett JM, Cherlow JM, Turski PA et al. Treatment of high‑grade spinal cord astrocytoma of childhood with „8-in‑1“ chemotherapy and radiotherapy: a pilot study of CCG-945. Children‘s Cancer Group. J Neurosurg 1998; 88(2): 215–220.
68. Doireau V, Grill J, Zerah M, Lellouch‑Tubiana A, Couanet D, Chastagner P et al. Chemotherapy for unresectable and recurrent intramedullary glial tumours in children. Brain Tumours Subcommittee of the French Society of Paediatric Oncology (SFOP). Br J Cancer 1999; 81(5): 835–840.
69. Lowis SP, Pizer BL, Coakham H, Nelson RJ, Bouffet E.Chemotherapy for spinal cord astrocytoma: can natural history be modified? Childs Nerv Syst 1998; 14(7): 317–321.
70. Nishio S, Morioka T, Fujii K, Inamura T, Fukui M. Spinal cord gliomas: management and outcome with reference to adjuvant therapy. J Clin Neurosci 2000; 7(1): 20–23.
71. Weiss E, Klingebiel T, Kortmann RD, Hess CF, Bamberg M. Intraspinal high‑grade astrocytoma in a child-rationale for chemotherapy and more intensive radiotherapy? Childs Nerv Syst 1997; 13(2): 108–112.
72. Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352(10): 987–996.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2010 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Huntingtonova nemoc
- Trénink lokomoce v závěsu u pacientů po poranění míchy
- Neurorehabilitace
- Diffusion tensor imaging – současné možnosti MR zobrazení bílé hmoty mozku
- Prospektivní analýza subtypů a rizikových faktorů ischemické cévní mozkové příhody u dospělých do 50 let
- Srovnání české verze Montrealského kognitivního testu s Mini‑Mental State pro stanovení kognitivního deficitu u Parkinsonovy nemoci
- Faktory ovlivňující výsledek chirurgické léčby výhřezu meziobratlové ploténky bederní páteře
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Intramedulární astrocytom – soubor 15 pacientů a přehled literatury
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Úprava sníženého mozkového krevního průtoku u Wernickeovy encefalopatie po alkoholové abstinenci – kazuistika
- Webové okénko
-
Analýza dat v neurologii XX.
Statistické testy pro četnosti kategorií – test dobré shody - Profesor Bartko – bard slovenskej neurologickej obce 80-ročný
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2010
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Huntingtonova nemoc
- Neobvyklé klinické obrazy u migrény – kazuistiky
- Retrospektivní studie nálezů na magnetické rezonanci míchy a mozku u pacientů s diagnózou neuromyelitis optica
- Neurorehabilitace
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



