-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika, terapie a dispenzarizace meningeomů na NCHK FN Brno v letech 2005–2010
Meningioma Diagnosis, Therapy and Follow-up at the Neurosurgery Clinic, University Hospital Brno between 2005 and 2010
Introduction:
Meningiomas are usually slow-growing tumors that arise from meningothelial cells and represent about one third of all primary intracranial tumors. They predominate in women. A patient may have multiple meningiomas. Clinical manifestations of meningiomas are determined by location and tumor size. Treatment is mostly surgical; success rate depends on the extent of resection. Radiotherapy is another treatment modality used, whilst hormonal therapy remains on experimental field.Material and methods:
Authors describe their experience with the diagnosis, treatment and follow up of patients with meningioma (n = 314). Furthermore, they also assess postoperative morbidity and time to recurrence.Results and conclusion:
Despite mostly benign histology of meningiomas, their recurrence is relatively frequent and oscillates between 10 to 30%, always in association with the extent of resection. Therefore, these patients should be followed up and regularly monitored using magnetic resonance imaging.Key words:
meningioma – diagnostics – treatment – follow-up
Autori: M. Duba; A. Mrlian; M. Smrčka; J. Musil
Pôsobisko autorov: Neurochirurgická klinika LF MU a FN Brno
Vyšlo v časopise: Cesk Slov Neurol N 2013; 76/109(2): 211-216
Kategória: Krátké sdělení
Súhrn
Úvod:
Meningeomy jsou zpravidla pomalu rostoucí nádory, jež vznikají z meningoteliálních buněk mozkových obalů a tvoří přibližně třetinu všech primárních intrakraniálních nádorů. Vyskytují se častěji u žen. Někdy jsou mnohočetné. Klinická manifestace meningeomů je závislá na lokalizaci a velikosti tumoru. V terapii se uplatňuje hlavně chirurgická léčba, jejíž úspěšnost je spojena s radikalitou resekce. Další léčebnou modalitou je radiochirurgie, alternativou spíše experimentální zůstává hormonální terapie.Materiál a metodika:
Autoři popisují zkušenosti svého pracoviště se záchytem, diagnostikou, terapií a dalším sledováním pacientů s meningeomem (n = 314). Rovněž hodnotí pooperační morbiditu a časnost recidiv.Výsledky a závěr:
Navzdory převážné histologické benignitě meningeomů, recidivy mohou být poměrně časté a oscilují mezi 10 až 30 %, vždy ale s ohledem na stupeň radikality operace. Proto je nutná dispenzarizace těchto pacientů a pravidelné kontroly pomocí magnetické rezonance.Klíčová slova:
meningeom – diagnostika – léčba – dispenzarizaceÚvod
Meningeomy jsou zpravidla pomalu rostoucí, často kalcifikované nádory, jež vznikají z meningoteliálních buněk mozkových obalů. Tvoří skupinu nádorů, jejichž chování kolísá od vysloveně benigního (WHO grade I), přes skupinu nádorů s agresivním růstem (chordoidní, papilární) až k agresivním atypickým a anaplastickým meningeomům (WHO grade III). Jedná se o nejčastější tumory CNS a tvoří až okolo 20 až 30 % všech primárních intrakraniálních nádorů (13–26 %).Maximum výskytu je kolem 45 roků věku a častější jsou u žen (2 : 1) [1]. Někteří autoři popisují ovšem vyšší incidenci malignějších variant meningeomů u mužů [2]. Asi 1–4 % meningeomů se objevují v dětském věku a z nich přibližně jedna čtvrtina je spojena s Recklinghausenovou chorobou, pro kterou je typický i mnohočetný výskyt. Incidence meningeomů v populaci se udává v rozmezí mezi 2 a 6 na 100 tis. obyvatel [3]. Řada meningeomů je klinicky němých, proto se různí údaje vycházející z pitevního materiálu od druhých, diagnostikovaných in vivo [3,4]. Incidence vzrůstá se stoupajícím věkem a s ním klesá též doba přežití. Z etiologického hlediska se jedná o multifaktoriální proces, ve kterém důležitou roli mohou hrát například radiace nebo genetické předpoklady (aberace na dlouhém raménku chromozomu 22) [5,6]. Už od 70. let minulého století je známa existence estrogenových receptorů u meningeomů, později byly nalezeny i progesteronové, androgenové nebo somatostatinové a dopaminové D1 [7–9]. Proto se některé meningeomy začínají projevovat během gravidity a byl popsán určitý vztah ke karcinomu prsu [7]. Klinická manifestace meningeomů je závislá na lokalizaci a velikosti tumoru. Z diagnostických zobrazovacích metod může být CT vyšetření dostatečné, mohou být patrny kalcifikace, extraaxiální růst nebo přesun středočárových struktur či výrazné postkontrastní sycení. Zlatým standardem ovšem zůstává magnetická rezonance s použitím kontrastní látky (gadolinia). Ani angiografie nepatří mezi metody marginální, protože nás informuje o vztahu k okolním větším cévám, případně popisuje vaskularizaci tumoru. Pokud se angiografie spojí s embolizací vyživujících tepen, jedná se o i metodu do jisté míry terapeutickou. V terapii se uplatňuje chirurgická léčba, jejíž úspěšnost je spojena s radikalitou resekce. Od roku 1957 byla zavedena klasifikace radikality chirurgického zákroku podle Simpsona na pět stupňů. Recidiva je tím pravděpodobnější, čím menší stupeň radikality byl dosažen. U stupně 1 je to asi 10 %, u stupně 2 19 %, u stupně 3 se udává 29 % a u čtvrtého 40 % během 10 let [10]. Lokalizace procesu do jisté míry určuje možnost recidivy tumoru. Nukleární polymorfizmus, nález mitos, vyšší buněčnost či přítomnost nekróz svědčí o vyšším stupni malignity, přičemž nejvyšším stupněm dediferen-ciace je anaplastický meningeom, jehož radikální odstranění je mimo možnosti současné neurochirurgie. Meningeom jako příčina smrti je udáván 4krát častěji v případech subtotální extirpace než u nemocných s totálním odstraněním [11]. Meningeomy můžeme dále léčit pomocí radiochirurgie (Leksellův gama nůž). Tato metoda je indikována zejména u menších, pomalu rostoucích, prakticky asymptomatických procesů lokalizovaných v oblasti chiazmatu, sinus cavernosus a pontocerebellárního koutu, u pacientů vyššího věku, kde by otevřená operace byla doprovázena vysokou morbiditou a mortalitou [12]. V určitých případech může být extirpace tumoru doplněna radioterapií. Většinou je vymezena pro subtotálně nebo parciálně resekované progresivně rostoucí tumory vyššího stupně malignity. Dále je indikována u mnohočetných procesů a u tumorů s nepříznivou lokalizací, kde by ovšem měla dostat přednost radiochirurgie. Radioterapie může mít někdy nepříznivý efekt při ozařování benigních procesů ve smyslu jejich malignizace [13]. Přítomnost hormonálních receptorů v meningeomech vedla ke snaze použít např. bromokriptin či mifepriston, tato léčba ale dosud nepřesáhla hranice klinického výzkumu. Celkové přežití se různí podle jednotlivých autorů a jsou samozřejmě odděleny údaje u benigních a maligních forem. Pětileté přežití u benigních forem kolísá mezi 70 a 90 % vzhledem k tomu, že některé meningeomy mohou být maligní i svým uložením (oblast kavernozního sinu). U maligních variant se pěti let po zahájení léčby meningeomu dožije něco přes 50 % pacientů. Obecně možno konstatovat, že lepší přežití mají nemocní s benigními formami, ženy, nádory pod 2,5 cm a nemocní, kteří byli operováni a nebyli léčeni následnou radioterapií [14,15].
Vlastní soubor pacientů
V letech 2005 až 2010 bylo na Neurochirurgické klinice LF MU a FN Brno léčeno 314 pacientů pro diagnózu meningeom. Z nich jsme 282 pacientů operovali, k observaci jsme ponechali 18 pacientů, 14 pacientů bylo léčeno pouze pomocí radiochirurgie. Věkové rozmezí celé skupiny bylo 26–86 let, medián věku byl 56,6 let. Operovali jsme 79 mužů a 203 žen. Ve 278 případech jsme expanzi odstranili z kraniotomie. Čtyři pacienti byli operováni transnazálně, transsfenoidálně (grafy 1, 2). Z hlediska lokalizace tumoru byli pacienti rozděleni do dvou skupin. Supratentoriálně lokalizovaný tumor mělo 282 pacientů, 34 pacientů bylo operováno pro infratentoriální lokalizaci tumoru (tab. 1). Z hlediska stupně malignity lze meningeomy rozdělit do tří skupin (grading). Histologický typ jsme mohli stanovit pouze u operovaných pacientů (n = 282). Meningeom grade I mělo 232 našich pacientů, 46 pacientů mělo meningeom grade II a 4 pacienti byli léčeni s meningeomem grade III. Detailnější histologická analýza rozdělila pacienty do dalších podskupin (tab. 2).
Graf 1. Podíl operovaných a neoperovaných pacientů. 
Graf 2. Soubor pacientů dle jednotlivých let. 
Tab. 1. Rozdělení pacientů dle lokalizace tumoru. 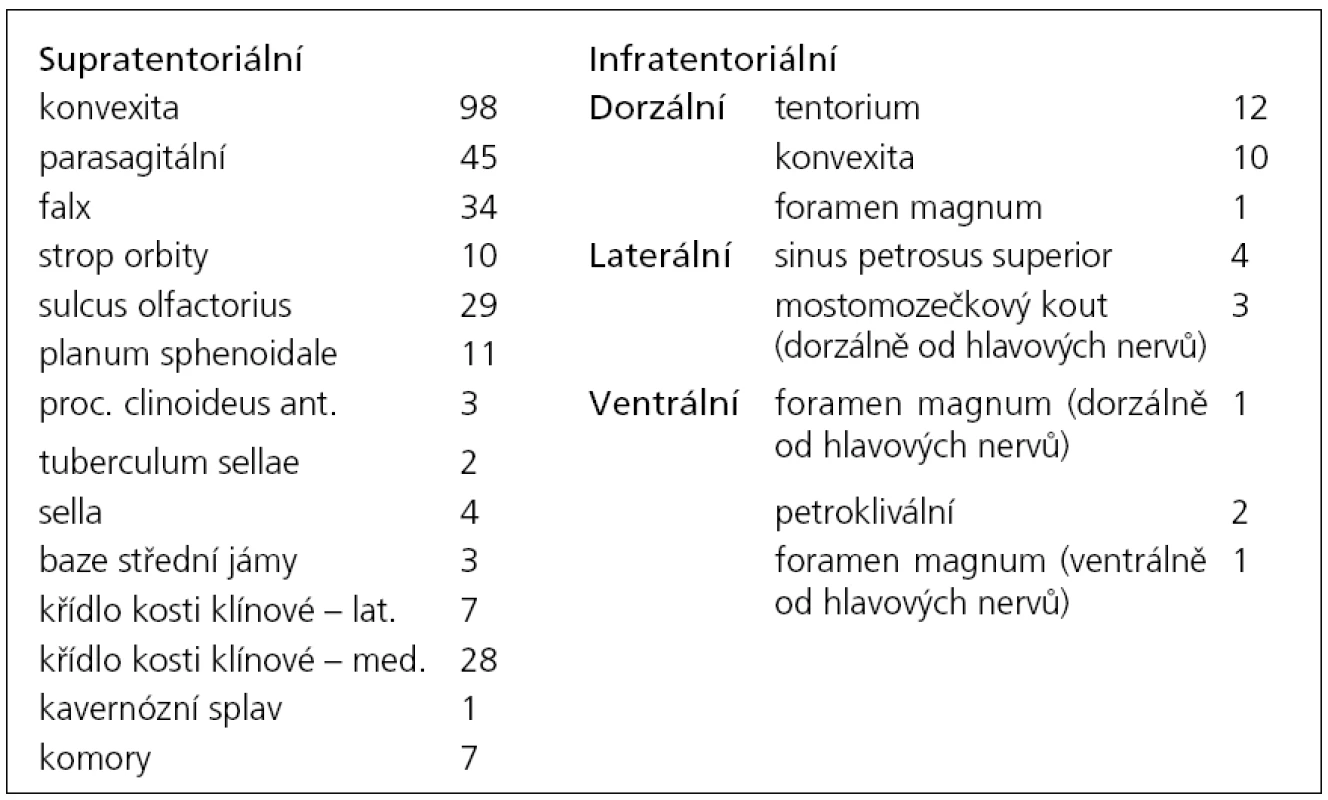
Tab. 2. Rozdělení sledovaného souboru podle histologické povahy. 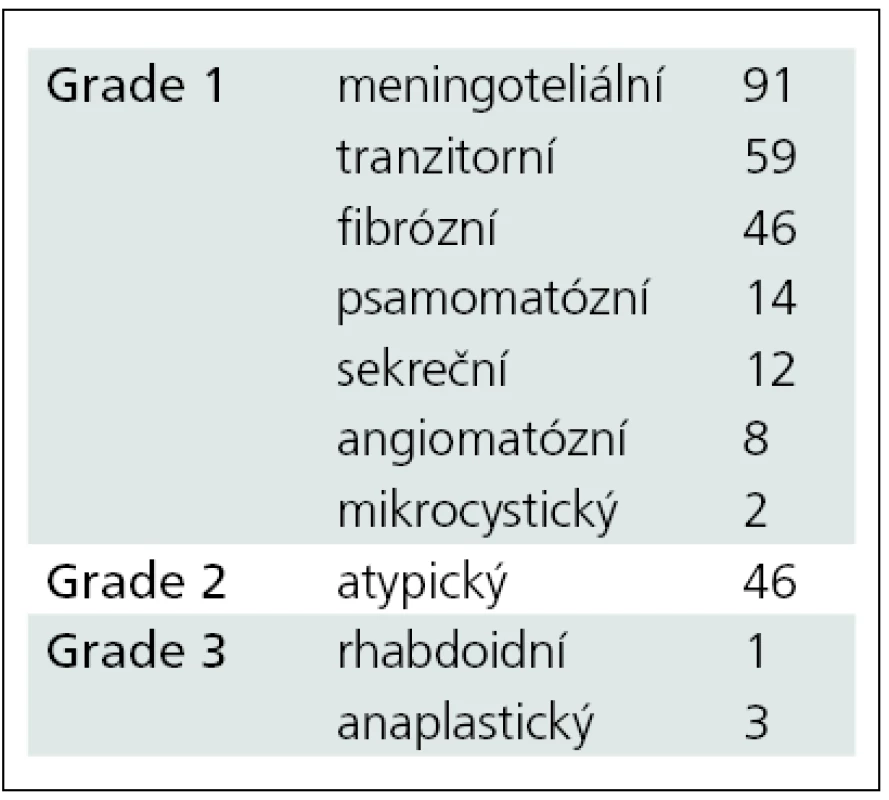
Výsledky
Radikalitu operací klasifikovanou podle Simpsona dokumentuje graf 3. Devadesáti třem pacientům byl meningeom odstraněn radikálně včetně excize postižené tvrdé pleny, resp. přilehlé kosti (S1), ve 140 případech došlo k makroskopicky totální resekci, tvrdá plena byla ošetřena bipolární koagulací (S2), 27 pacientů mělo odstraněný tumor (near total resection) bez resekce tvrdé pleny (S3), ve 12 případech jsme tumor odstranili částečně – radikalita operace variovala od biopsie až po parciální resekci (S4, S5).
Graf 3. Grafické zobrazení radikality resekce dle Simpsona. 
Dále jsme časně (do 30 dnů po operaci) sledovali komplikace, které jsou detailně znázorněny na graf 4 (30denní morbidita). U 17 pacientů se na pooperačním CT objevil hematom v lůžku po resekci, z nichž v 11 případech byla potřebná operační revize. Pooperační edém v lůžku po resekci a v okolní tkáni se objevil u 29 pacientů, u čtyř byla potřebná dekompresní kraniektomie.
Graf 4. Časná pooperační (30denní) morbidita. 
U 11 pacientů byl pooperační průběh komplikován nově se manifestující epilepsií. U šesti pacientů se jednalo o solitární parciální komplexní nebo generalizovaný záchvat, zbylých pět pacientů trpělo sekundární epilepsií dobře reagující na farmakoterapii.
V pěti případech (4 pacienti) se po exstirpaci meningeomu objevila nazální likvorea, ve třech případech se jednalo o transnazální transsfenoidální resekci, přičemž u jednoho pacienta se pro likvoreu muselo k revizi přistoupit dvakrát, dva pacienti byli léčeni konzervativně pomocí lumbální spinální drenáže. Hromadění likvoru subgaleálně při nedokonalém uzávěru tvrdé plény se vyskytlo v 26 případech (9,2 %). V první fázi jsme všem pacientům se subgaleálním hromaděním likvoru zavedli lumbální spinální drenáž a takzvaná režimová opatření (antiTrendellenburgova poloha, restrikce tekutin, komprese rány pomocí elastického obinadla). V případě, že se do sedmi dnů nepodařilo fluktuaci uspokojivě vyřešit konzervativními metodami, přistoupili jsme k extrakci lumbální spinální drenáže (i v rámci prevence infekčních komplikací) a naplánovali jsme operační revizi. Opětovný zákrok byl potřebný v 19 případech. Jednalo se vesměs o pacienty s konvexitárními meningeomy lokalizovanými v blízkosti střední čáry v oblasti vertexu (n = 11) nebo nad zadní jámou (n = 8), po kompletní resekci (S1).
U 12 pacientů se po operaci objevil trvalý neurologický deficit. Jednalo se jednak o pacienty s meningeomem lokalizovaným v elokventní zóně, u kterých nebyla zřejmá lokalizace centrální krajiny a použití neurofyziologie, resp. MR traktografie ještě nebylo možné. Druhou skupinou byli pacienti s tumorem v oblasti zadní jámy nebo čichové brázdy a námi pozorovaný neurologický deficit spočíval v poškození některého z hlavových nervů.
U 26 pacientů se ve sledované periodě vyskytla infekce. Ta se nacházela buďto v lůžku tumoru (absces) nebo v oblasti mozkových obalů (subdurálně, subgaleálně). Jedenáct pacientů mělo meningeom lokalizovaný frontobazálně a během kraniotomie došlo k arteficiálnímu otevření frontálních sinů. Zbylých 15 pacientů představovalo velmi různorodou skupinu bez další hlubší statistické analýzy. Po MR verifikaci byla pokaždé řešena operační revizí, sanací lůžka tumoru a laváží roztokem Betadine, případně peroxidem vodíku. Po operační revizi byla nasazena antibiotika, nejčastěji cefotaxim 3 g i.v. po 8 hodinách v kombinaci s metronidazolem 500 mg i.v. po 8 hodinách. Později se přecházelo na perorální dlouhodobou, několikatýdenní antibiotickou léčbu.
Po 12 měsících jsme zhodnotili výsledek léčby v celé skupině (n = 314) pomocí Glasgow Outcome Score (GOS) a pomocí Rankinova skóre. Celkem 280 pacientů vykazovalo po 12 měsících dobrý výsledek léčby, u 12 pacientů přetrvávalo těžké neurologické postižení a 4 pacienti perzistovali ve vegetativním stavu (graf 5).
Graf 5. Výsledek léčby zhodnocen po 12 měsících (GOS). 
Mortalita ve sledované skupině pacientů (n = 314) byla během prvních 12 měsíců na úrovni 5,73 % (n = 18) (graf 5). Třicetidenní mortalita operovaných pacientů byla na úrovni 1,7 % (n = 5). Během následujících 12 měsíců narostla na 4,25 % (n = 12). Jednalo se o pacienty ve věku nad 70 let s ASA II–III, s recidivující expanzí lokalizovanou v elokventní zóně. Ve skupině observovaných pacientů byla mortalita na úrovni 33 % (n = 6). Pacienty jsme po primárním záchytu meningeomu neoperovali kvůli vysokému věku (nad 80 let) a četným komorbiditám. U čtyř z těchto pacientů byl příčinou smrti akutní infarkt myokardu, u jednoho plicní embolie a u posledního akutní cévní mozková příhoda.
Během našeho sledování se v souboru operovaných pacientů dosud vyskytlo dle MR vyšetření 15 recidiv (5,3 %) spojených s klinickým korelátem. Střední doba sledování celé skupiny je dva roky, maximem je zatím sedm let. Osm recidiv (3 %) se vyskytlo ve skupině pacientů s meningeomem grade I, přičemž u dvou pacientů v této skupině byla primooperace radikální (Simpson 1), u 5 pacientů bylo dosaženo radikality primární resekce ve stupni Simpson 2 a 1 pacient měl kompletně odstraněn tumor bez možnosti ošetření tvrdé pleny (Simpson 3). Ve skupině pacientů s meningeomy grade II šest pacientů recidivovalo (10 %), přičemž u třech pacientů bylo u primooperace dosaženo radikality resekce dle Simpsona 1, u 2 pacientů činila radikalita Simpson 2 a u zbylých dvou šlo o resekci Simpson 3. Ve skupině pacientů s meningeomem grade III (n = 4) se recidiva vyskytla v jednom případě, jednalo se o pacienta s radikálně odstraněným (S1) anaplastickým meningeomem.
Z 18 observovaných pacientů šest během našeho sledování zemřelo (viz výše). Ze zbylých 12 se v 10 případech jednalo o malé incidentální meningeomy, které nadále sledujeme v periodicitě 12 měsíců a jsou bez progrese růstu. Zbylí dva přeživší pacienti jsou ženy ve věku 77 a 82 let, kde vzhledem k věku a interním komorbiditám nebyla a nebude indikována žádná intervence.
Čtrnáct pacientů jsme indikovali k radiochirurgii pomocí Leksellova gama nože, věkové rozmezí skupiny bylo 22–67 let, medián byl 35 let. Deset pacientů jsme k radiochirurgii indikovali přímo, u čtyř pacientů léčba pomocí gama nože následovala po subtotální resekci nádoru, u dvou pacientů šlo o meningeom v kavernozním splavu a u dvou o meningeom v oblasti mostomozečkového koutu.
Diskuze
Meningeomy jsou nádory vesměs benigní povahy s extraaxiálním růstem, jež svým biologickým chováním pacienta přímo neohrožují. Výjimku tvoří atypické a anaplastické meningeomy (cca 10 % případů). Morbidita a mortalita je tudíž podmíněna jinými faktory, jako jsou lokalizace nádoru a radikalita resekce. Klinicky významným faktorem je rovněž přítomnost nitrolební hypertenze. Patofyziologie nitrolební hypertenze u pomalu rostoucích nádorů je odlišná od náhle vzniklé intrakraniální hypertenze například u epidurálního hematomu. Rychlá dekomprese intrakraniálního prostoru způsobená odstraněním tumoru by mohla vést k reperfuznímu poškození mozkové tkáně. Změna hemodynamické homeostázy nastolené přítomností expanze vede při rychlé dekompresi v intrakraniu k paradoxnímu rozvoji extracelulárního edému. Dalším důležitým nepříznivým důsledkem je náhlý posun chronicky dislokovaných elokventních struktur. Tyto patofyziologické jevy by mohly zhoršovat operační výsledky u pacientů s nitrolební hypertenzí, a proto by se dalo v některých konkrétních případech uvažovat o dvoudobé operaci [15,16]. Mohlo by se jednat o pacienty mladší s dobrým perioperačním a pooperačním průběhem, s velkým meningeomem lokalizovaným nejlépe mimo elokventní zónu s relativně velkým edémem a přesunem mozkové tkáně. Posuzování operační strategie by mělo být individuální.
Operační strategie ve FN Brno se řídí několika faktory. Faktory, které favorizují operační řešení jsou syndrom nitrolební hypertenze, věk pod 70 let, celkový stav pacienta, lokalizace tumoru v chirurgicky řešitelné oblasti, vztah k okolním strukturám (cévy, hlavové nervy) a velikost tumoru nad 2 cm. Pokud anatomická situace neumožní resekci typu S1 (sinus cavernosus, chiazma, mostomozečkový kout) nebo se jedná o meningeomy grade II a III a v neposlední řadě, pokud jde o operaci recidivy tumoru, zvažujeme doplnění radioterapie. Jistým úskalím je vznik postradiačního edému, nekrózy a zajizvení arachnoidey v zasažené oblasti. Další modalitou je observace tumoru (pravidelné MR kontroly, dispenzarizace u neurologa). Využíváme ji zejména u asymptomatických (incidentálních) meningeomů u pacientů starších 70 let s četnými interními komorbiditami. Pokud dojde k progresi velikosti tumoru, zvažujeme radiochirurgické řešení, operace je až poslední možnost.
Na léčbu pomocí Leksellova gama nože se spoléháme u menších stacionárních meningeomů lokalizovaných v oblasti chiazmatu (supraselárně, ve vzdálenosti minimálně 2 mm od zrakového nervu), sinus cavernosus, resp. pontocerebellárního koutu. Konkrétní případy zvažované k radiochirurgickému řešení jsou konzultovány s pracovištěm OSRN Nemocnice Na Homolce, indikace k zákroku se řídí přesnými indikačními kritérii, kde se do úvahy bere velikost tumoru, vzdálenost od hlavových nervů, resp. od mozkového kmene.
Po operacích pacienty dispenzarizujeme a pravidelně zveme na ambulantní kontroly. Frekvence a periodicita kontrol je dána radikalitou resekce a histologickou variantou tumoru. Meningeomy grade I po resekci Simpson 1 a 2 kontrolujeme pomocí MR po 6, 12, 24 měsících. Je-li bez recidivy, dále nesledujeme. Pacienti jsou ale nadále v dispenzarizaci spádových neurologů a ti v případě recidivy klinických obtíží indikují novou MR, s jejímž výsledkem jsou znovu konzultováni u operatéra, který na základě grafického nálezu a dalších, zejména klinických faktorů, komorbidit a věku určí další léčbu. V případě indikace opětovné operace se jedná zejména o pacienty v mladším věku, bez přidružených onemocnění, kde je vyšší riziko rozvoje klinicky významné recidivy i u pomalu rostoucích expanzí. Pokud jsme dosáhli stupně resekce Simpson 3 a 4, provádíme MR po 6 a 12 měsících a dále opakovaně po roce. Pacienti s meningeomy grade II s radikalitou resekce S1 a S2 absolvují kontrolní MR po 6 a 12 měsících a dále opakovaně po roce. Pokud byl dosažen stupeň radikality S 3 a S4, provádíme MR opakovaně po 6 měsících. V případě recidivy tumoru přikračujeme, pokud pacient splní indikační kritéria, k opětovné operaci, po které následuje adjuvantní radioterapie a pravidelné MR kontroly po třech měsících. Při meningeomech grade III po operaci a následné radioterapii provádíme pravidelné MR kontroly každých šest měsíců bez ohledu na radikalitu resekce. Taktéž jsou u těchto pacientů požadovány pravidelné celotělové PET kontroly vzhledem k vysokému riziku výskytu systémových metastáz (24 %) [17,18]. V našem souboru se meningeom grade III vyskytl u čtyř pacientů, jeden pacient zemřel v průběhu 12 měsíců od operace, u jednoho proběhla druhá operace pro recidivu tumoru a byl indikován k adjuvantní radioterapii. Zbylí dva pacienti jsou prozatím bez recidivy a v dobrém klinickém stavu.
Další možnosti léčení meningeomů představují hormonální léčba a izolovaná embolizace tumoru. Na našem pracovišti se hormonální léčba nevyužívá vůbec a selektivní embolizaci tumoru používáme před plánovanou operací. Slouží k omezení krevních ztrát během operačního výkonu. K použití této metody přistupujeme po zhodnocení magnetické rezonance, určujícím kritériem je velikost a lokalizace tumoru, identifikace větší vyživující cévy. Dosud nemáme přesná indikační kritéria při použití této metody. Některé práce naznačují, že účinný efekt embolizace by mohl nastat jenom po úplné devaskularizaci tumoru [19,20].
Závěr
Meningeomy tvoří nezanedbatelnou část operativy na NCHK FN Brno. Tak jako u jiných onemocnění CNS, i v léčbě meningeomů se snažíme uplatnit principy medicíny založené na důkazech, tudíž benefit kterékoliv vybrané léčebné modality je signifikantně příznivější než riziko plynoucí z přirozeného průběhu onemocnění. Recidivy jsou limitovány stupněm radikality a výsledky jsou srovnatelné s údaji publikovanými v literatuře. Věk, přidružené komorbidity, předoperační ASA skóre 3–4 jsou nezávislé prediktory zvýšené mortality. K nim patří dále i vývoj perioperačního edému a krvácení, event. infekce v časné pooperační periodě.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Andrej Mrlian, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
email: andrejmrlian@hotmail.com
Přijato k recenzi: 7. 6. 2012
Přijato do tisku: 8. 10. 2012
Zdroje
1. Wiemels J, Wrensch M, Claus EB. Epidemiology and etiology of meningioma. J Neurooncol 2010; 99(3): 307–314.
2. Kane AJ, Sughrue ME, Rutkowski MJ, Shangari G, Fang S, McDermott MW et al. Anatomic location is a risk factor for atypical and malignant meningiomas. Cancer 2011; 117(6): 1272–1278.
3. Larjavaara S, Haapasalo H, Sankila R, Helén P, Auvinen A. Is the incidence of meningiomas underestimated? A regional survey. Br J Cancer 2008; 99 : 182–184.
4. Claus EB, Bondy ML, Schildkraut JM, Wiemels JL, Wrensch M, Black PM. Epidemiology of intracranial meningioma. Neurosurgery 2005; 57(6): 1088–1095.
5. Dumanski JP, Carlbom E, Collins VP, Nordenskjöld M. Deletion mapping of a locus on human chromosome 22 involved in the oncogenesis of meningioma. Proc Natl Acad Sci USA 1987; 84 : 9275–9279.
6. Seizinger BR, de la Monte S, Atkins L, Gusella JF, Martuza RL. Molecular genetic approach to human meningioma: loss of genes on chromosome 22. Proc Natl Acad Sci U S A 1987; 84 : 5419–5423.
7. Koehorst SG, Jacobs HM, Thijssen JH, Blankenstein MA. Detection of an oestrogen receptor-like protein in human meningiomas by band shift assay using a synthetic oestrogen responsive element (ERE). Br J Cancer 1993; 68(2): 290–294.
8. Perrot-Applanat M, Groyer-Picard MT, Kujas M. Immunocytochemical study of progesterone receptor in human meningioma. Acta Neurochir (Wien) 1992; 115(1–2): 20–30.
9. Alexiou GA, Markoula S, Gogou P, Kyritsis AP. Genetic and molecular alterations in meningiomas. Clin Neurol Neurosurg 2011; 113(4): 261–267.
10. Sughrue ME, Kane AJ, Shangari G, Rutkowski MJ, McDermott MW, Berger MS, Parsa AT. The relevance of Simpson Grade I and II resection in modern neurosurgical treatment of World Health Organization Grade I meningiomas. J Neurosurg 2010; 113(5): 1029–1035.
11. Palma L, Celli P, Franco C, Cervoni L, Cantore G. Long-term prognosis for atypical and malignant meningiomas: a study of 71 surgical cases. Neurosurg Focus 1997; 2(4).
12. Kollová A, Liščák R, Šemnická J, Šimonová G, Vladyka V, Urgošík D. Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom. Cesk Slov Neurol N 2010; 73/106(4): 415–421.
13. Pannullo SC, Fraser JF, Moliterno J, Cobb W, Stieg PE. Stereotactic radiosurgery: a meta-analysis of current therapeutic applications in neuro-oncologic disease. J Neurooncol 2011; 103(1): 1–17.
14. Pollock BE, Stafford SL, Utter A, Giannini C, Schreiner SA. Stereotactic radiosurgery provides equivalent tumor control to Simpson Grade 1 resection for patients with small - to medium-size meningiomas. Int J Radiat Oncol Biol Phys 2003; 55(4):1000–1005.
15. Náhlovský J et al. Neurochirurgie. 1st ed. Praha: Galén 2006.
16. Kozler P et al. Intrakraniální nádory. 1st ed. Praha: Galén 2007.
17. Palma L, Celli P, Franco C, Cervoni L, Cantore G. Long-term prognosis for atypical and malignant meningiomas: a study of 71 surgical cases. J Neurosurg 1997; 86 : 793–800.
18. Younis GA, Sawaya R, DeMonte F, Hess KR, Albrecht S, Bruner JM. Aggressive meningeal tumors: review of a series. J Neurosurg 1995; 82 : 17–27.
19. Bendszus M, Rao G, Burger R, Schaller C, Scheinemann K, Warmuth-Metz M et al. Is there a benefit of preoperative meningioma embolization? Neurosurgery 2000; 47(6): 1306–1311.
20. Schul DB, Wolf S, Krammer MJ, Landscheidt JF, Tomasino A, Lumenta CB. Meningioma surgery in the elderly: Outcome and validation of two proposed grading scores systems. Neurosurgery 2012; 70(3): 555–565.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek Nové pokyny pro autoryČlánek Habituace je významnější na pohybový podnět ve srovnání s reverzačním podnětem – pilotní studieČlánek Endoskopická ventrikulocisternostomie u dětí s předchozí implantací ventrikuloperitoneální drenážeČlánek Pozdní forma Tay-Sachsovy choroby napodobuje spinální svalovou atrofii III. typu – dvě kazuistikyČlánek Webové okénko
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2013 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Nové pokyny pro autory
- Creutzfeldtova-Jakobova choroba
- Elektrofyziologické vyšetření pánevního dna
- Význam a limitace zrakových evokovaných potenciálů ve studiu patofyziologie migrény
- Habituace je významnější na pohybový podnět ve srovnání s reverzačním podnětem – pilotní studie
- Rozdíly v modulaci kortikální aktivity u pacientů po cévní mozkové příhodě s reziduální spasticitou ruky léčených botulotoxinem A
- Vyhodnocení sběru epidemiologických dat u cévních mozkových příhod z registru IKTA. Incidence cévních mozkových příhod v okrese Zlín
- Komentář k práci Z. Kality et al. Vyhodnocení sběru epidemiologických dat u cévních mozkových příhod z registru IKTA. Incidence cévních mozkových příhod v okrese Zlín
- Úloha neurootologa v záchytu poradiačních komplikací u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
- X-viazaná adrenoleukodystrofia
- Sonograficky navigované operace mozkových kavernomů
- Endoskopická ventrikulocisternostomie u dětí s předchozí implantací ventrikuloperitoneální drenáže
- Diagnostika, terapie a dispenzarizace meningeomů na NCHK FN Brno v letech 2005–2010
- Normotenzní hydrocefalus – komplikace z předrénování a jejich závislost na použitém ventilu
- Pozdní forma Tay-Sachsovy choroby napodobuje spinální svalovou atrofii III. typu – dvě kazuistiky
- Spinocerebelární ataxie typ 7 (SCA7) – kazuistika
- Lymeská borelióza jako příčina bilaterální neuroretinitidy s výraznou jednostrannou hvězdicovitou makulopatií u osmileté dívky
- Zriedkavejšia príčina obštrukčného syndrómu spánkového apnoe – morbus Madelung. Kazuistiky
- X-vázaná myotubulární myopatie u dvou bratrů v důsledku nové mutace v MTM1 genu – kazuistiky
- Tortikolis při Griselově syndromu – kazuistiky
- Webové okénko
-
Analýza dat v neurologii
XXXVIII. Možnosti grafického znázornění výstupů asociačních analýz kontingenčních tabulek
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Creutzfeldtova-Jakobova choroba
- Spinocerebelární ataxie typ 7 (SCA7) – kazuistika
- Lymeská borelióza jako příčina bilaterální neuroretinitidy s výraznou jednostrannou hvězdicovitou makulopatií u osmileté dívky
- Elektrofyziologické vyšetření pánevního dna
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



