-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Volumetrické hodnocení resekability gliomů inzuly
Volumetric Evaluation of Resecability of Insular Gliomas
Aim:
We present the results of surgical resection in a group of patients with insular gliomas, we refer to our pilot study (2009 – eight patients) and include 20 surgeries performed until 2013.Groups and methods:
From 2007 to 2013 we performed 20 surgeries for gliomas with a significant invasion of the insular region; all the surgeries were conducted under general anaesthesia with motor evoked potential monitoring. The extent of resection was evaluated by means of manual computerized volumetry (software Stealth DTI, Medtronic, Minneapolis, USA).Results:
In one patient after glioblastoma multiforme resection, we observed postoperative hematoma in the tumour remnant with consequent hemiplegia, the rate of major complications was 5%. The mean extent of resection in 19 surgeries was 83% (43–100%). In 15 non-enhancing tumours (LGG and AA), we obtained the mean tumour volumetric reduction of 80%.Conclusions:
The same indication criteria for surgical resection apply to insular gliomas as to gliomas in other regions. Detailed knowledge of insular anatomy, including ability to handle vital vascular structures, is necessary for performing insular surgery with good results.Key words:
insula – glioma – volumetry – MRi
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autori: R. Bartoš 1,2; A. Malucelli 1,2; T. Radovnický 1; A. Hejčl 1,2; J. Ceé 1; P. Bartoš 2; M. Sameš 1
Pôsobisko autorov: Neurochirurgická klinika UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(5): 568-575
Kategória: Původní práce
Supported by European Regional Development Fund – Project FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
Súhrn
Cíl:
Cílem naší práce bylo rozšířit a zobecnit výsledky resekcí inzulárních gliomů. Navazujeme na náš pilotní již publikovaný soubor (2009 – osm pacientů), jenž jsme rozšířili na 20 operací.Soubor a metodika:
V období 2007 – 2013 jsme provedli 20 operací gliomů se signifikantním objemem nádoru v inzule. Operace byly prováděny v celkové anestezii při monitorování motorických evokovaných potenciálů. Radikalita operací byla hodnocena pomocí manuální počítačové volumetrie prostřednictvím software StealthDTI (Medtronic, Minneaopolis, USA).Výsledky:
U jedné pacientky po resekci multiformního glioblastomu došlo po operaci k prokrvácení rezidua s následnou hemiplegií, míra závažných komplikací činí 5 %. Během 19 operací jsme dosáhli průměrné 83% radikality resekce (43 – 100 %). V průběhu 15 operací neenhancujících nádorů (LGG a AA) jsme dosáhli v T2 vážení průměrné 80% redukce objemu nádoru.Závěr:
Gliomy inzulární oblasti jsou indikovány k chirurgickému odstranění za podobných indikačních kritérií jako gliomy v jiných oblastech mozku. Nezbytná je detailní znalost anatomie inzulární oblasti včetně schopnosti manipulace s vitálními cévními strukturami.Klíčová slova:
inzula – gliom – volumetrie – MRÚvod
Inzula, poprvé popsaná Johannem Christianem Reilem (1809) [1], je skryta v hloubce Sylvijské rýhy pod frontálním, parietálním a temporálním operkulem a větvením arteria cerebri media (ACM). Centrální inzulární sulkus ji rozděluje na dvě základní části – přední, tvořenou třemi krátkými gyry (přední, střední a zadní), a varietním akcesorním a transverzálním gyrem, navazujícími na orbitofrontální kortex; zadní část tvoří dva dlouhé gyry – přední a zadní. Oproti operkulům ohraničuje inzulární lalok přední, dolní a horní perinzulární sulkus. Větvení ACM na superiorní a inferiorní trunkus (M2) se nachází v oblasti limen insulae. Cévní zásobení inzuly je realizováno převážně krátkými inzulárními perforátory právě z M2 segmentů ACM. Početně dominující krátké perforátory nezásobují hlubší struktury. Dlouhé inzulární perforátory probíhají však až do oblasti vnitřní kapsuly a mohou odstupovat z distálnější části superiorního trunku ACM. Žilní drenáž probíhá povrchovými a hlubokými Sylvijskými žilami [2].
Inzula je funkčně nejméně prozkoumaný mozkový lalok u člověka. Zdá se, že anteriorní agranulární a dysgranulární inzula je zahrnuta do zpracování chemosenzorické informace jako čich a chuť, zatímco posteriorní granulární inzula je multimodální konvergentní zóna pro senzorické informace a zpracovává exteroceptivní informace (hmat, teplotu a bolest) a interoceptivní informace (somatoviscerální senzitivita), sluchové a vestibulární informace. Konvergence multimodálních senzorických informací a schopnost hodnocení subjektivního stavu pravděpodobně vysvětluje zapojení inzuly do zpracovávání emocí. Je spojována s pozorováním dané zevní situace a hodnocením zkušenosti s ní, znechucením – jak chutí, tak zápachem, předjímáním obav, pocity zloby, hněvu, viny a vnímáním morálních přestupků. Zpracovávání emocí je funkčně důležité pro detekování informací a signalizaci získání dalších pozornostních zdrojů a kognitivní kontroly. Inzula se tedy velice dobře hodí jako rozhraní mezi fyziologickými pocity a systémy vyšší kognitivní činnosti. V tomto smyslu ji lze označit jako oblast zapojenou do celé řady kognitivních procesů. Inzula je funkčně propojena s amygdalou, předním cingulem a zadním thalamem a tvoří síť „detekce priorit“. Je tedy integrálně zapojena do přepojování rozhodovacího procesu mezi „vykonáním“ a „zavržením“ akce [3].Tumory inzuly ani postresekční léze většinou žádný specifický deficit nezpůsobují. Nízkostupňové gliomy WHO grade II a anaplastické astrocytomy mohou v této oblasti růst poměrně dlouho indolentně, v době diagnózy jsou objemné a primárně se většinou projeví epileptickými záchvaty.
Materiál a metodika
V letech 2007 – 2013 jsme provedli 20 resekcí gliálních nádorů v oblasti inzuly u 18 pacientů. V 18 případech se jednalo o primární operaci, ve dvou o recidivu nádoru během naší dispenzarizace. Šlo o 11 žen a sedm mužů průměrného věku 45 (20 – 70) let. Podle Yaşargilovy klasifikace [4] se jednalo o typ 3A (tumor lokalizovaný pouze v inzule) a 3B (infiltrující frontální či temporální operkulum) vždy po šesti případech (obr. 1a, b), 5A (infiltrující frontobazální struktury a/ nebo temporální pól) v pěti případech a 5B (infiltrující také mediobazální struktury) ve třech případech (obr. 1c, d, 2). Průměrný objem nádorů byl 46 cm3, v širokém rozmezí 1,12 – 142,1 cm3, průměrný objem neenhancujících lézí byl 51cm3. Ve 12 případech se nádor nacházel v pravé hemisféře, v osmi případech v levé. Dle histologického výsledku je jednalo o pět multiformních glioblastomů (GBM), pět anaplastických astrocytomů (AA) a 10 nízkostupňových gliomů WHO II (LGG). V případě dvou recidiv nedošlo ani v jednom případě k přestupu nádoru ve vyšší grade. Operace byly vedeny snahou o maximální radikalitu, v celkové anestezii s vyloučením svalové relaxace pomocí TIVA, integrita motorické dráhy byla během všech operací monitorována pomocí motorických evokovaných potenciálů (MEP). Přístupovým koridorem k inzule byla široká disekce Sylvijské rýhy, techniku operace jsme popsali v naší předchozí práci [2]. Soubor pacientů shrnuje tab. 1. Jako metodu objemového výpočtu výsledku léčby jsme použili objemovou analýzu manuální konturací rozhraní T2 hyperintenzity obvodu nádorů u LGG a AA a T1 postkontrastní hyperintenzity u GBM před operací a po ní. Objem nádoru jsme stanovili s pomocí software StealthDTI (Medtronic, Minneapolis, USA), pro analýzu byly využity axiální T1 a T2 vážené obrazy s vysokým rozlišením vhodné pro použití v módu MultiPlanar Reconstruction (MPR). Pro náběr těchto obrazů byl použit přístroj Symphony 1.5T (Siemens, Erlangen, Německo). Obecně jsme hodnotili operaci jako parciální po dosažení < 80% radikality resekce, jako subtotální po dosažení 80–99% radikality resekce a zcela radikální při úplném grafickém odstranění nádoru.
Obr. 1a) Anatomická situace během resekce nízkostupňového gliomu typ 3B dle Yaşargila vlevo: pac. 17. Široká disekce Sylvijské rýhy, mobilizace inzulárních větví arteria cerebri media. PL – parietální lalok, M1/2 – bifurkace arteria cerebri media, M2I – inferiorní trunkus M2, M2S – superiorní trunkus M2. 
Obr. 1b) Předoperační snímek T2W (infiltrace frontobazálních struktur, nicméně dominantní masa tumoru v inzule). 
Obr. 1c) Anatomická situace během resekce nízkostupňového gliomu typ 5B dle Yaşargila vlevo: pac. 18. Široká disekce Sylvijské rýhy, resekce teporálního pólu a meziotemporálních struktur. FL – frontální lalok, TL – temporální lalok, SF – Sylvijská rýha, SSV – povrchová Sylvijská žíla, II – nervus opticus, III – nervus oculomotorius, ACI – arteria carotis interna, ACM – arteria cerebri media, P2 – arteria cerebri posterior – segment P2. 
Obr. 1d) Předoperační snímek T2W (infiltrace T pólu, uncu a inzuly). 
Obr. 2a–c) Výsledek 84% resekce nízkostupňového gliomu u 49leté pacientky (pac. 18) v T2W obraze dokumentující kombinovanou resekci inzuly, meziotemporálních a T neokortikálních struktur, vhodné je povšimnout si matoucího rozsahu infiltrace bazálních ganglií na obr. 1d, jednalo se zřejmě o kolaterální edém. 
Výsledky
Výsledky operací shrnuje tab. 1.
Tab. 1. Soubor pacientů a výsledky operací. 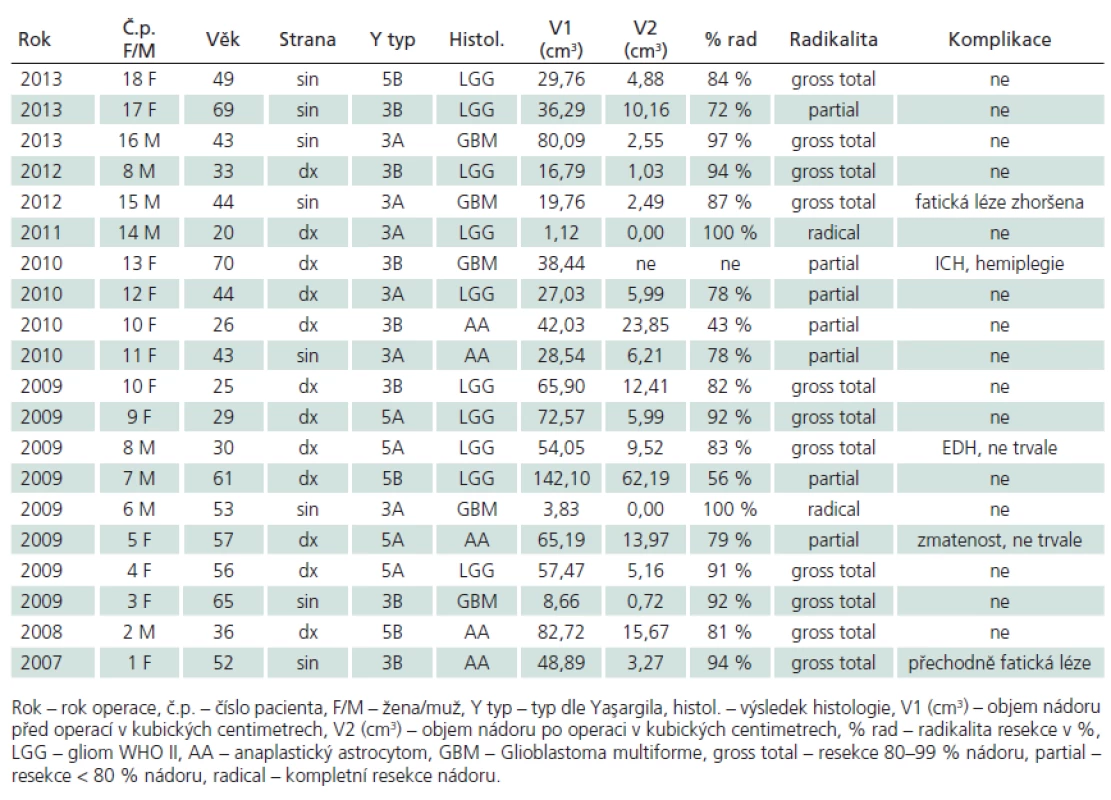
Klinické výsledky operací
K závažné komplikaci došlo v jednom případě (5,0 %). U nejstarší 70leté pacientky s glioblastomem v inzulární oblasti nastalo po nekomplikované parciální resekci prokrvácení rezidua s následnou těžkou poruchou hybnosti levostranných končetin. Již na předoperační MR bylo patrno prorůstání nádoru do pyramidové dráhy. Tuto pacientku nezahrnujeme do následujícího volumetrického hodnocení, MR nebyla po operaci prováděna (obr. 3). Dalším trvalým deficitem bylo zhoršení fatické poruchy u pacienta s GBM v dominantní posteriorní inzule (zóna dle Sanai ‑ Bergera II), nicméně fatická porucha byla u něj již prvním příznakem.
Obr. 3a, b) T1W MR s k.l. 70leté pacientky (pac. 13) s GBM v pravé hemisféře, šipkou je naznačen infiltrativní charakter nádoru s četnou neovaskularizací. 
Obr. 3c) Prokrvácení rezidua nádoru po parciální resekci s rozvojem hemiplegie. 
Trvalá neurologická morbidita v našem souboru tedy činí 10 %, z toho závažná 5 %. Všechny trvalé komplikace nastaly u pacientů s multiformním glioblastomem.
Dočasnými komplikacemi byla v jednom případě několikadenní zmatenost u jedné a přechodná fatická porucha u druhé pacientky, v obou případech došlo k úpravě. Dočasná neurologická morbidita činí tedy dalších 10 %. Jednoho pacienta jsme museli časně po operaci revidovat pro akutní EDH, naštěstí zcela bez následků.
Radikalita operací hodnocená počítačovou volumetrií
Hodnocením pomocí manuální počítačové volumetrie jsme během 15 operací neenhancujích nádorů (LGG a AA) dosáhli v T2 vážení průměrné 80% redukce objemu nádoru (43 – 100 %). Hodnocena byla MR provedená s 2–3měsíčním odstupem od operace (obr. 4). U čtyř pacientů s GBM byla průměrná radikalita resekcí 94 % (87 – 100 %), hodnocená T1 váženou MR po podání kontrastní látky do 72 hod po operaci (obr. 5). Pokud hodnotíme všechny operace, celkově jsme dosáhli 83% cytoredukce. Během sedmi operací (37 %) jsme dosáhli částečné radikality resekce. Je důležité, že redukce objemu nádoru mezi 80 a 100 % (gross total či radikální resekce) bylo dosaženo po 13 operacích (69 %).
Obr. 4a) Předoperační snímek 29leté pacientky s inzulárním LGG typu dle Yaşargila 5A (pac. 9) vpravo, před operací refrakterní epilepsie s neschopností se starat o dítě. 
Obr. 4b) Pooperační snímek, bylo dosaženo 92% radikality resekce: dosažení mediální hranice k bazálním gangliím, otevření frontálního rohu postranní komory, sporná je infiltrace uncu, která nebyla před operací patrná – může se jednat o pooperační změny, nicméně do volumetrického hodnocení byla zavzata; po operaci se pacientka vrátila do práce jako soudní zapisovatelka a byla schopna péče o dítě. 
Obr. 5a) Rozsah disekce Sylviské rýhy u pacienta s inzulárním GBM vlevo typu dle Yaşargila 3A, pac. 16. 
Obr. 5b) Ozřejmení větvení ACM, patrná je větší adhezivita nádoru k cévám než u nádorů s nižším stupněm malignity. 
Obr. 5c) T1W MR s k.l. před operací. 
Obr. 5d) T1W MR s k.l., druhá kontrola za tři měsíce po operaci po dokončení radioterapie potencované temozolomidem (v té době neprogredující reziduum 2,55 cm<sup>3</sup>). 
Diskuze
Onkocytogenetika
Odlišná cytoarchitektonická i vývojová organizace inzulární oblasti a častá lokalizace nízkostupňových gliomů v inzule vedla k domněnkám, že inzulární gliomy představují svébytný typ oproti gliomům v ostatních oblastech mozku – obecně s horší prognózou [5]. Avšak recentní práce Wu et al [6] na sérii 14 pacientů s nízkostupňovými gliomy s origem v inzule prokázala, že kodelece 1p/ 19q oligodendrogliálních nádorů inzuly jsou stejně časté (57 %) jako v ostatních oblastech mozku, a na inzulární nádory tedy nemusíme pohlížet jako na odlišný subtyp.
Klasifikace inzulárních nádorů
Klasická Yaşargilova klasifikace [4] (3A, 3B, 5A, 5B) nejlépe vystihuje šíření nádorů z inzuly jakožto struktury na pomezí neokortexu a allokortexu – zcela v kontextu s vývojem inzuly a jejích spojů. Šíření zahrnuje frontální, frontobazální oblasti a temporální pól cestou uncinátního fasciklu, dále temporální neokortikální oblasti cestou primárních a asociačních sluchových vláken, třetí hlavní cílovou oblastí je ventrální striatum, septum a meziotemporální oblasti cestou drah temporálního kmene a spojů inzuly s amygdalou [7].
Sanai ‑ Bergerova klasifikace [8] ne zcela anatomicky dělí lokalizaci inzulárních gliomů do zón I – IV, přičemž důležitá je poloha hlavní masy tumoru oproti úrovni foramen Monroi na axiálním řezu. Pokud je ten více anteriorně, leží v zóně I a IV (rozděleno ještě nad a pod úrovní Sylvijské rýhy); pokud je posteriorně, leží v zóně II a III (opět rozděleno dle polohy vůči Sylvijské rýze na sagitálním řezu); pokud se nádor nachází ve všech čtyřech zónách, je nazýván gigantický. Velice podstatná je poznámka, kterou vyslovuje F. F. Lang ve svém komentáři k početné sérii 66 neenhancujících inzulárních gliomů M. Skrapa et al v Neurosurgery 2012 [9], že důležitá je poctivost hodnocení lokalizace nádoru a nádor např. z 90 % ležící v temporálním operkulu a pouze 10 % v inzule není vhodné zařazovat mezi inzulární gliomy.
Technika operace
Existují dvě základní metodologické školy operování inzulárních nádorů.
První navazuje na techniku profesora Yaşargila [10] a používá primárně transsylvijský přístup s preparací větví ACM a devaskularizací nádoru a až následnou resekci eventuálně infiltrovaného operkula či meziotemporálních struktur. Neurochirurgové preferující tento přístup jsou například F. F. Lang (Houston) a U. Türe (Istanbul). Naše technika se taktéž kloní k transsylvijské cestě se zaměřením na koagulaci a následné přestřižení krátkých inzulárních perforátorů, což umožní mobilizaci větví ACM (obr. 6a, 1a, 5b). Za důležité ve shodě s těmito zkušenými neurochirurgy pokládáme ozřejmení odstupu laterálních lentikulostriatálních perforátorů (LLsP) (obr. 6b). V technicky zaměřených článcích [11,12] F. F. Lang et al vyzdvihují výhodnost preparace periinzulárních sulků s ozřejmením kraniokaudální hranice nádoru a dodržení hloubky resekce dané odstupem LLsP z M1. Dále kladou důraz na opatrnost při resekci v oblasti horního periinzulárního sulku, což je jediná oblast, kde může dojít k přímému poškození pyramidové dráhy. Dle osobní komunikace s profesorem Langem (Lang, Praha, 2011) je velice důvtipná taktika iniciální koagulace a přestřižení jednoho krátkého inzulárního perforátoru v největším předpokládaném průměru expanze s následným sledováním jeho průběhu do hloubi nádoru, což nám umožní určit hloubku bezpečné resekce. Hlavní „neznámou“ je možné zásobení vnitřní kapsuly dlouhými penetrujícími inzulárními perforátory z distálních úseků M2. Ty jsou velice obtížně odlišitelné od krátkých inzulárních perforátorů [13]. Profesor Türe doporučuje v případě nejistoty použití dočasného klipu a monitorování MEP. Pro vyvarování se cévních komplikací musí být operatér taktéž technicky připraven na možné vytržení drobné větévky z M2 a následné ošetření cévy 10/ 0 stehem (Türe, osobní komunikace, Istanbul, 2010). Také klade velký důraz na laboratorní přípravu upevňující orientaci operatéra v hloubce operačního pole (obr. 7).
Obr. 6a) Krátký inzulární perforátor z M2 segmentu ACM před jeho koagulací a přestřižením. 
Obr. 6b) Odstup laterálních lentikulostriatických perforátorů (LLsP) ze superiorního kmene M2; M2S – superiorní trunkus MCA, M2I – inferiorní trunkus MCA, M1–M1 segment ACM, šipka označuje perforátory. 
Obr. 7a) Iniciální flair sekvence MR pac. 8 (2009). 
Obr. 7b) Identická sekvence po druhé operaci pro inzulární nízkostupňový gliom typu 5A dle Yaşargila vlevo (2012) verifikující 94% resekci nádoru. 
Obr. 7c) Technický aspekt a orientace v operačním poli: důležité proniknutí do frontálního rohu postranní komory (vpravo), taktéž do temporálního rohu (vlevo); ozřejměno šipkami. 
Druhá možnost je transoperkulární přístup za mapování řečových funkcí, event. v non‑dominantní hemisféře bez kortikálního mapování. Tuto školu zastupují H. Duffau (Montpellier), M. Berger (San Francisco) a v recentní práci M. Skrap (Udine) [9]. Ten ve své sérii 66 pacientů s inzulárními gliomy dokonce popisuje přechod z transsylvijského k transoperkulárnímu přístupu v posledních několika letech. Podle našich osobních zkušeností někteří operatéři této školy při operacích gliomů nepoužívají mikroskop a vitální cévy chrání subpiální disekcí. Ta však již není možná v oblasti průběhu LLsP hlubokými strukturami mozku, dle mého názoru je tedy vizualizace jejich odstupu a jejich neporušení klíčem chirurgického úspěchu.
Dle polohy tumoru k LLsP Moshel et al [14] dělí inzulární gliomy na základě fúze předoperační MR s pro stereotaxi modifikovanými klasickými angiografiemi na tzv. laterální a mediální. V jejich sérii 38 pacientů bylo laterálně, tedy v pro resekci příznivé pozici 66 % nádorů (25 pacientů) a v mediální pozici s průběhem LLsP zavzatým do nádoru 34 % nádorů (13 pacientů). Tumory mediální varianty navíc často vykazovaly na T2 vážených sekvencích difúzní růst (v 85 % – 11 pacientů). Méně invazivně, pomocí 3T TOF MRA s podáním kontrastní látky vyšetřovali LLsP Saito et al [15], bohužel pouze kazuisticky u tří pacientů. I oni však zdůrazňují nutnost intraoperační identifikace prvního odstupujícího LLsP.
Komplikace
Trvalé komplikace (hemiparéza ‑ hemiplegie) spočívají nejčastěji v lézi cévního zásobení vnitřní kapsuly poraněním LLsP. Léze dané poraněním magistrálních tepen MCA je možné obejít metikulózní chirurgickou technikou transsylvijského přístupu či subpiální disekcí cévního zásobení při transkortikálním přístupu.
Poruchy řeči jsou většinou dočasné a mohou být dány poškozením řečových oblastí buď přímo či jejich otlakem, dále poraněním fasciculus arcuatus probíhajícím v blízkosti horního a dolního periinzulárního sulku.
Chirurgové hájící svůj způsob operování však vykazují obdobnou četnost trvalého neurologického deficitu: Yaşargil et al 5 % [4], Zentner et al 10 % [16], Lang et al 9 % [11], Hentschel et al a Lang et al 8 % [12], Simon et al 9 % [17], Sanai et al 6 % [8], Skrap et al 6 % [9] a Duffau et al 3 % [18]. Z této řady vybočuje Duffau s vysokou mírou přechodných komplikací (59 %), které se v naprosté většině upravují. Nad jejich únosností se z neuroonkologického hlediska při možnosti dalších léčebných modalit pozastavují ve svém komentáři J. H. Mehrkens et al [19].
Méně nápadné komplikace dané propadem kognitivních funkcí objektivizovatelné pečlivým neuropsychologickým vyšetřením hodnotí Wu et al [20]. Ve skupině 33 inzulárních gliomů neprokazují statisticky významný propad kognitivních funkcí oproti kontrolní skupině pacientů s LGG v jiných oblastech. V obou skupinách bezprostředně po operaci dochází k významnému poklesu kognitivních funkcí ve většině testů, u inzulárních gliomů dochází k mírně většímu zhoršení lexikální fluence, paměti a schopnosti učení u pacientů s nádorem v levé hemisféře, u pacientů s nádorem pravé hemisféry jsou více narušeny vizuo ‑ konstruktivní schopnosti ve WAIS – Block III Design testu. To odpovídá funkci inzuly jako multimodálního asociačního centra. Dlouhodobý vývoj neurokognitivních funkcí nebyl bohužel v této studii hodnocen.
Význam radikality
Shoda se každopádně mezi autory obou operačních směrů nachází ohledně významu radikality resekce nízkostupňového gliomu pro další přežití pacienta. Sanai et al [8] v podskupině inzulárních LGG (45 pacientů) hodnotí dobu přežití delší než pět let po dosažení > 90% resekce jako 100%, v případě menšího rozsahu resekce 84%.
Tento autor z Bergerovy skupiny prezentuje největší celkový soubor pacientů (115 operací u 104 pacientů), pro LGG dosáhli střední radikality resekcí 82 % (31 – 100 %), pro vysokostupňové gliomy 81 % (47 – 100 %). Radikalita resekcí byla stanovována obdobnou metodikou manuální počítačové volumetrie jako v naší práci. V obtížně dosažitelné zóně II byla střední hodnota resekcí 67,4 % a u gigantických gliomů celé inzuly 72,7 %.
Z recentní práce Skrapa et al [9] vycházející z největšího publikovaného souboru neenhancujících lézí (66 pacientů) vyplývá několik exaktních fakt. Skrap et al dosáhli střední radikality resekcí 80 %, za vzniku přechodného deficitu v četnosti 33,4 %, deficit perzistoval v 6 % (motorický v 3 %, porucha řeči v 3 %).
Pětiletá celková doba přežití byla u pacientů s dosaženou > 90% radikalitou resekce v 92 %, s dosaženou 70–90% radikalitou v 82 % a dosaženou < 70% radikalitou v 57 %. Skrap hodnotí i pětileté přežití v závislosti na velikosti rezidua v cm3: < 10, 10 – 20, 20 – 30, > 30 jako 90 %, 87 %, 65 % a 28 %. Zajímavý index hodnotící invazivitu nádoru a prognózu pacienta je rozdíl objemu nádoru v T2 a T1 vážení. Pokud je T2 – T1 < 30 cm3, je pětiletá doba přežití dosažena v 92 %, pokud je > 30 cm3, je pětiletá doba přežití dosažena pouze v 57 %.
Největší soubor (101 operací u 94 pacientů) spíše transsylvijské školy s pečlivým elektrofyziologickým monitoringem motorické dráhy publikovali Simon et al [17] z bonnského pracoviště, > 90% radikality dosáhli u 42 % pacientů, 70–90% radikality u 51 % a < 70% radikality u 7 % pacientů. Zde proponují vhodnou selekci pacientů, u mladých pacientů s gliomy WHO I – III v dobrém neurologickém stavu byly v 91 % výsledky výborné, naopak u pacientů s GBM spíše nedobré, s výsledným KPS menším či rovným 70 % u 65 % nemocných. Tento zoufalý trend u pacientů s GBM nemůžeme zcela potvrdit, ačkoli z dlouhodobějšího a funkčního pohledu fatální komplikace našeho souboru spočívá taktéž v prokrvácení rezidua GBM u jednoho z pěti pacientů (20 %).
Histologie
Musíme upozornit na vysoký výskyt anaplastického astrocytomu mezi neenhancujícími lézemi, 33 % v naší sérii, u kterých by „wait and see“ strategie přinesla opoždění další onkologické léčby. Toto pozorování je ve shodě se Skrapem et al [9], kteří udávají v sérii 66 neenhancujících gliomů inzuly 20% výskyt AA. Na tento fakt upozorňuje i F. F. Lang ve svém komentáři k danému článku.
Závěr
Během 20 operací inzulárních gliomů jsme dosáhli průměrně 83 % objemové radikality, za 5 % trvalé neurologické morbidity, a to u pacientky s objemným GBM infiltrujícím pyramidovou dráhu. Naše výsledky se shodují s dostupnou zahraniční literaturou.
Dle našeho názoru je snaha o maximální radikalitu resekce gliomů v této technicky náročné oblasti zcela indikována, nutná je však pečlivá laboratorní anatomická příprava, schopnost manipulace s vitálními cévami a elektrofyziologické monitorování.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Robert Bartoš, Ph.D.
Neurochirurgická klinika
UJEP a Krajská zdravotní a.s.
Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 12A
401 00 Ústí nad Labem
e-mail: mnbartos@mnul.cz
Přijato k recenzi: 8. 4. 2014
Přijato do tisku: 27. 6. 2014
Zdroje
1. Reil JC. Die sylvische Grube. Arch Physiol Halle 1809; 9 : 195 – 208.
2. Bartoš R, Sameš M, Zolal A, Radovnický T, Hejčl A, Vachata P et al. Resekce insulárních gliomů – volumetrické hodnocení radikality. Cesk Slov Neurol N 2009; 72/ 105(6): 534 – 541.
3. Stephani C, Fernandez ‑ Baca Vaca G, Maciunas R,Koubeissi M, Lüders HO. Functional neuroanatomy of the insular lobe. Brain Struct Funct 2011; 216(2): 137 – 149. doi: 10.1007/ s00429 ‑ 010 ‑ 0296 ‑ 3.
4. Yaşargil MG, von Ammon K, Cavazos E, Doczi T, Reeves JD, Roth P. Tumours of the limbic and paralimbic systems. Acta Neurochir 1992; 118(1 – 2): 40 – 52.
5. Gozé C, Rigau V, Gilbert L, Maudelonde T, Duffau H. Lack of complete 1p/ 19q deletion in a consecutive series of 12 WHO grade II gliomas involving the insula: a marker of worse prognosis? J Neurooncol 2009; 9(1): 1 – 5. doi: 10.1007/ s11060 ‑ 008 ‑ 9680 ‑ 8.
6. Wu A, Aldape K, Lang FF. High rate of deletion of chromosomes 1p and 19q in insular oligodendroglial tumors. J Neurooncol 2010; 99(1): 57 – 64. doi: 10.1007/ s11060 ‑ 009 ‑ 0100 ‑ 5.
7. Kalani MY, Kalani MA, Gwinn R, Keogh B, Tse VC. Embryological development of the human insula and its implications for the spread and resection of insular gliomas. Neurosurg Focus 2009; 27(2): E2. doi: 10.3171/ 2009.5.FOCUS0997.
8. Sanai N, Polley MY, Berger MS. Insular glioma resection: assessment of patient morbidity, survival and tumor progression. J Neurosurg 2010; 112(1): 1 – 9. doi: 10.3171/ 2009.6.JNS0952.
9. Skrap M, Mondani M, Tomasino B, Weis L, Budai R,Pauletto G et al. Surgery of insular nonenhancing gliomas: volumetric analysis of tumoral resection, clinical outcome, and survival in a consecutive series of 66 cases. Neurosurgery 2012; 70(5): 1081 – 1093. doi: 10.1227/ NEU.0b013e31823f5be5.
10.Yaşargil MG. Microneurosurgery (Vol. 4). New York: Thieme Medical Publishing 1996.
11. Lang FF, Olansen NE, DeMonte F, Gokaslan ZL, Holland EC, Kalhorn C et al. Surgical resection of intrinsic insular tumors: complication avoidance. J Neurosurg 2001; 95(4): 638 – 650.
12. Hentschel SJ, Lang FF. Surgical resection of intrinsic insular tumors. Neurosurgery 2005; 57 (Suppl 1): 176 – 183.
13. Türe U, Yaşargil MG, Al ‑ Mefty O, Yaşargil DC. Arteries of the insula. J Neurosurg 2000; 92(4): 676 – 687.
14. Moshel YA, Marcus JD, Parker EC, Kelly PJ. Resection of insular gliomas: the importance of lenticulostriate artery position. J Neurosurg 2008; 109(5): 825 – 834. doi: 10.3171/ JNS/ 2008/ 109/ 11/ 0825.
15. Saito R, Kumabe T, Inoue T, Takada S, Yamashita Y,Kanamori M et al. Magnetic resonance imaging for preoperative identification of the lenticulostriate arteries in insular glioma surgery. Technical note. J Neurosurg 2009; 111(2): 278 – 281.
16. Zentner J, Meyer B, Stangl A, Schramm J. Intrinsic tumours of the insula: a prospective surgical study of 30 patients. J Neurosurg 1996; 85(2): 263 – 271.
17. Simon M, Neuloh G, von Lehe M, Meyer B, Schramm J. Insular gliomas: the case for surgical management. J Neurosurg 2009; 110(4): 685 – 695. doi: 10.3171/ 2008.7.JNS17639.
18. Duffau H. A personal consecutive series of surgically treated 51 cases of insular WHO Grade II glioma: advances and limitations. J Neurosurg 2009; 110(4): 696 – 708. doi: 10.3171/ 2008.8.JNS08741.
19. Mehrkens JH, Noachtar S, Winkler PA, Kreth FW. In response to: Duffau H, Capelle L, Lopes M, Bitar A, Sichez JP, and Van Effenterre R: Medically intractable epilepsy from insular low ‑ grade gliomas: improvement after extended lesionectomy. Acta Neurochir (2002) 144 : 563 – 573. Acta Neurochir (Wien) 2003; 145(1): 87 – 88.
20. Wu AS, Witgert ME, Lang FF, Xiao L, Bekele BN, Meyers CA et al. Neurocognitive function before and after surgery for insular gliomas. J Neurosurg 2011; 115(6): 1115 – 1125. doi: 10.3171/ 2011.8.JNS11488.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2014 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Experimentální a klinické aplikace mezenchymálních kmenových buněk u míšního poranění
- Volumetrické hodnocení resekability gliomů inzuly
- Validita Testu 16 slov pro diferenciální diagnostiku demence Alzheimerova typu a behaviorální formy frontotemporální demence
- Asymetrie trojklaného nervu u klasické neuralgie trigeminu – zhodnocení pomocí magnetické rezonance
- Komentář ke článku autorů Urgosik et al Trigeminal Nerve Asymmetry in Classic Trigeminal Neuralgia – Evaluation by Magnetic Resonance Imaging
- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
-
Komentár ke článku autorů Bartoš et al. Česká tréninková verze Montrealského kognitivního testu (MoCA-CZ1) k časné detekci Alzheimerovy nemoci
Skríning kognitívnych porúch v klinickej praxi - Standardizace české verze testu Londýnské věže – administrace, skórování, validita
- Repetitivní transkraniální magnetická stimulace v léčbě depresivní poruchy – randomizovaná, jednoduše slepá, antidepresivy kontrolovaná studie
- Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Komentář k článku autorů Krahulík et al Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Endoskopická endonazální technika v léčbě kraniofaryngeomů
- Neuroborrelióza imitující mozkový nádor u dětí a vice versa
- Anti‑N‑ metyl‑ D‑ aspartát receptorová encefalitida
- Projekt ncRNAPain
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
- Neutralizační protilátky a Myxovirus resistance protein A při sledování biologické účinnosti interferonu β
- Vazospazmy jako komplikace subarachnoidálního krvácení – kazuistika
- Polyurie v neurointenzivní péči – kazuistika
- Webové okénko
-
Analýza dat v neurologii
XLVII. Modelové příklady spojování výsledků vzájemně nezávislých asociačních studií - Časná a individualizovaná terapie se zapojením pacienta do terapeutického procesu byly hlavními tématy letošního mezinárodního setkání odborníků v oblasti roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Česká tréninková verze Montrealského kognitivního testu (MoCA‑ CZ1) k časné detekci Alzheimerovy nemoci
- Leukodystrofie – klinické a rádiologické aspekty
- Bariéry nervového systému za fyziologických a patologických stavů
- Chirurgická léčba supratentoriálních kortiko‑ subkortikálních kavernomů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




