-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
Ketogenic diet – effective treatment of childhood and adolescent epilepsies
Ketogenic diet has been established in the treatment of epilepsy for almost 100 years. It is irreplaceable in paediatric epileptology, especially in the treatment of myoclonic-atonic epilepsy, making it the most effective therapeutic option. With growing knowledge and implementation of the modified Atkins diet and the low glycaemic index treatment in clinical practice, the usage of ketotherapy, which is an umbrella term for all dietary regimes based on carbohydrate restriction and fat surplus, has been extended to all age brackets of epilepsy patients. Nevertheless, it is still a highly-selective therapy, specified for an exclusive circle of patients with perfect compliance, which is fundamental for clinical success. This work aims to provide an overview of current knowledge in the field of ketotherapy and to provide clinicians with the insight into the important practical aspects of its management.
Key words:
ketotherapy – ketogenic – diet – intractable epilepsy
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autori: O. Horák
Pôsobisko autorov: Klinika dětské neurologie LF MU a FN Brno Centrum pro epilepsie Brno
Vyšlo v časopise: Cesk Slov Neurol N 2019; 82(1): 8-14
Kategória: Minimonografie
doi: https://doi.org/10.14735/amcsnn20198Súhrn
Ketogenní dieta se v léčbě epilepsie uplatňuje již téměř 100 let. Své nezastupitelné místo má v dětské epileptologii, především v terapii myoklonicko-atonické epilepsie, kde představuje pravděpodobně vůbec nejefektivnější způsob léčby. S poznáním a zavedením modifikované Atkinsonovy diety a diety s nízkým glykemickým indexem do praxe se pole působnosti ketoterapie, jak jsou dnes souhrnně označovány všechny dietní režimy založené na restrikci sacharidů a nadbytku lipidů, rozšířilo prakticky na všechny věkové kategorie pacientů s epilepsií. Stále se však jedná o léčbu vysoce selektivní, tzn. určenou pro úzký okruh pacientů s dokonalou compliance, která je základním předpokladem úspěchu. Tato práce si klade za cíl podat ucelený přehled současných znalostí v oblasti ketoterapie a přiblížit klinikům i některé praktické aspekty managementu dietní léčby.
Klíčová slova:
ketoterapie – ketogenní – dieta – farmakorezistentní epilepsie
Velký dík za dosavadní podporu i spolupráci nejen na poli ketoterapie patří doc. MUDr. Haně Ošlejškové, Ph.D., a dále nutričním terapeutkám Mgr. Zuzaně Přichystalové a Ireně Haluzové, Dis.
Historické aspekty
Myšlenka, že vyloučení některých potravin ze stravy či přímo hladovění může podstatně eliminovat záchvaty, pochází již z 5. století před Kristem, tj. z dob Hippokratových. První opravdu vědecký text o benefitech hladovění v léčbě epilepsie pak publikovali francouzští lékaři Guelpa a Marie v roce 1911 [1]. Následně, v roce 1921, H. R. Geyelin prezentoval soubor 20 (z 26) pacientů, u kterých záchvaty vymizely po 20denním hladovění, přičemž u dvou z nich navodilo i dlouhodobou klinickou remisi [2]. Geyelin se inspiroval prací H. W. Conklina, amerického chiropraktika, který věřil, že záchvaty provokují toxiny ze stravy, jež přecházejí z tenkého střeva do krevního oběhu a dále do mozku. Svou práci „Cause and treatment of epilepsy“, s podobnými výsledky jako Geyelin, publikoval o rok později [3]. Tyto první klinické úspěchy odstartovaly vědecký výzkum metabolických pochodů při hladovění cílený na odhalení podstaty jeho antikonvulzivního efektu a zároveň také hledání takové stravy, která by tyto pochody imitovala a přitom byla pacienty dlouhodobě tolerována. Tématu se nezávisle věnovali především R. T. Woodyatt z Chicaga a R. M. Wilder z Rochesteru, kteří jako první v roce 1921 poukázali na antikonvulzivní efekt ketolátek, resp. na to, že strava bohatá na tuky a chudá na sacharidy navozuje v organizmu obdobný ketogenní stav jako prosté hladovění [4 – 6]. Tím byly položeny základy klasické ketogenní diety (KD), které v mnoha ohledech platí dodnes. KD se v léčbě epilepsie rychle etablovala a byla používána v mnoha centrech. Zlatou éru ukončilo až v roce 1938 objevení fenytoinu a posléze dalších antiepileptik (anti-epileptic drugs; AEDs). Určitou renesanci zaznamenáváme opět od 90. let minulého století, kdy i přes dostupnost velkého počtu nových AEDs zůstává stále 20 – 30 % pacientů s epilepsií farmakorezistentních. Velkou měrou se o popularizaci KD zasloužil i americký režisér J. Abrahams, který na základě zkušenosti s nemocným synem, jehož KD zcela zbavila záchvatů, natočil v roce 1994 úspěšný autobiografický film „First Do No Harm“, aby následně ve spolupráci s John Hopkins Hospital založil nadaci The Charlie Foundation, která je na poli KD dodnes aktivní. V současnosti je KD široce rozšířenou a mezinárodně uznávanou „lege artis“ nefarmakologickou terapií v dětské, adolescentní i dospělé epileptologii.
Ketoterapie – definice, základní pojmy a typy diet
Všechny dietní režimy, založené na restrikci sacharidů a zvýšeném zastoupení tuků ve stravě, indukující v organizmu alternativní energetický metabolizmus spojený s navozením a dlouhodobým udržením ketózy, jsou dnes souhrnně označovány pojmem ketoterapie (KT) nebo „metabolism-based therapy“ (MBT). Jedná se o klasickou KD, dietu s triglyceridy se středně dlouhým řetězcem (medium-chain triglyceride; MCT), dietu s nízkým glykemickým indexem (the low-glycaemic index treatment; LGIT) a modifikovanou Atkinsonovu dietu (modified Atkins diet; MAD). Všechny uvedené typy KT/ MBT více či méně odporují zásadám zdravé, racionální výživy (obr. 1) – nelze je proto považovat za dietu v hovorovém slova smyslu, nýbrž za skutečnou a náročnou léčbu s mnoha riziky. Nepříliš exaktní pojem ketóza chápejme v kontextu KT/ MBT jako žádoucí metabolický stav charakterizovaný nadprodukcí ketolátek (acetoacetát, β-hydroxy-butyrát [BHB] a aceton) při akcentovaném zpracování vysoké dodávky tuků ze stravy procesem b-oxidace v mitochondriích hepatocytů. Pojmy ketonurie a ketonemie představují měřitelné složky ketózy – koncentraci acetonu v moči, resp. koncentraci BHB v krvi, jejichž stanovení je rutinní součástí monitoringu pacientů. Přesnější, ovšem méně využívanou, metodou je vyšetření acetoacetátu a BHB v profilu organických kyselin v moči. Ketózu jako celek validně kvantifikovat nelze – za korelát „adekvátní“ ketózy bývá sice často považována koncentrace BHB v kapilární krvi v rozmezí 4 – 6 mmol/ l, je to však nepřesná simplifikace, která zcela jistě nepostihuje všechny proměnné determinující výsledný stupeň ketózy.
Obr. 1. Zastoupení makronutrientů v jednotlivých typech ketogenní terapie; přibližné procento energetické hodnoty z tuků, proteinů a sacharidů. LGIT – dieta s nízkým glykemickým indexem; MCT – triglyceridy se středně dlouhým řetězcem
Fig. 1. Representation of macronutrients in individual types of ketogenic therapy; an approximate percentage of energy value from fats, proteins and carbohydrates. LGIT – the low-glycaemic index treatment; MCT – medium-chain triglyceride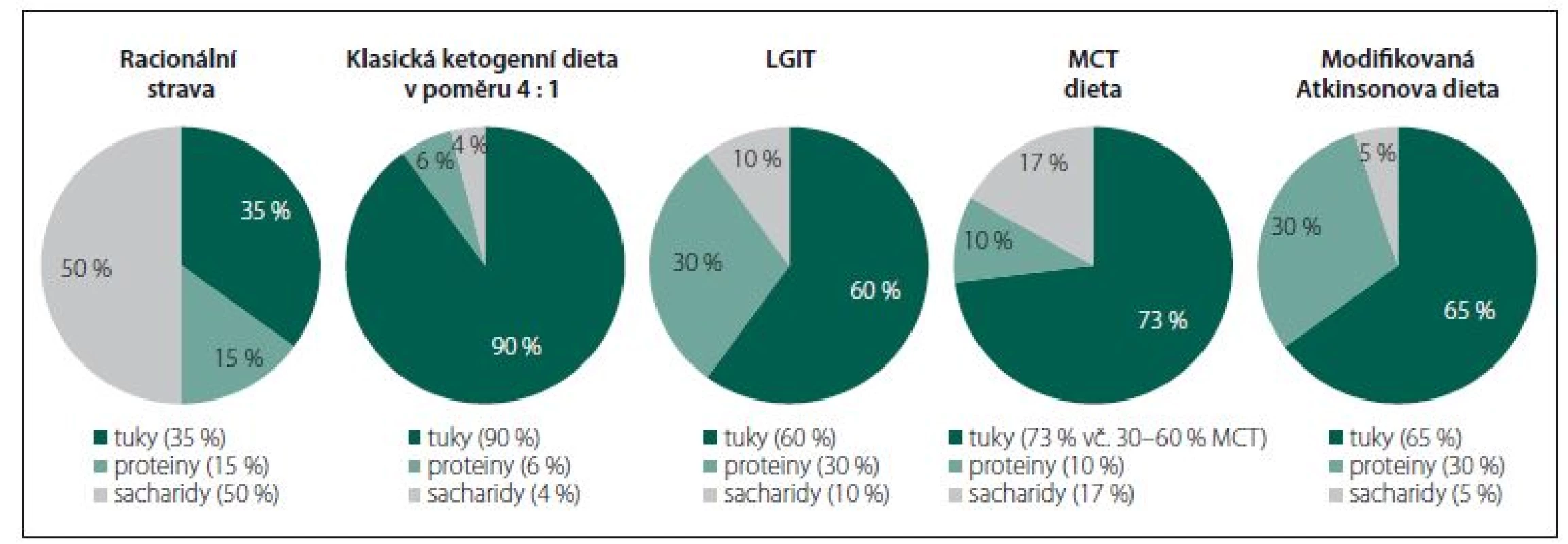
Klasická ketogenní dieta
Klasická KD je v dětské epileptologii nejdéle a stále nejčastěji používaným typem KT/ MBT. U dospělých je její využití omezené, např. jen jako iniciační fáze v rámci MAD či při zintenzivnění MAD přidáním jednoho ketogenního jídla v přísném poměru. Představuje nejpřísnější dietní režim, s nejvyššími nároky na compliance, ovšem také s nejvyšším ketogenním potenciálem. Složení stravy je přesně propočítáno a při přípravě jídel musí být všechny suroviny odvažovány s přesností na desetiny gramu. Poměrné zastoupení makronutrientů je striktně dáno tzv. ketogenním poměrem (obvykle 4 : 1 nebo 3 : 1) udávajícím počet gramů tuků k množství gramů sacharidů a proteinů dohromady. Kalorický příjem je zpravidla snížený, od dříve doporučované restrikce tekutin se již téměř upustilo. Detailní popis přípravy, iniciace a následného managementu KD bude následovat níže v textu. Na tomto místě pro úplnost uvádím stručné charakteristiky ostatních typů KT/ MBT.
MCT dieta
MCT dieta je modifikací klasické KD a poprvé ji popsali Huttenlocher et al v 70. letech minulého století [7]. Je založena na převaze MTC, které představují 30 – 60 % veškeré energetické potřeby. MCT na rozdíl od triglyceridů s dlouhým řetězcem prostupují z enterocytů přímo do portálního řečiště a k transportu do mitochondrií hepatocytů nevyžadují karnitinový přenašeč. Tyto metabolické charakteristiky MCT vedou k jejich rychlejší a výraznější oxidaci s vyšší produkcí ketolátek než při oxidaci triglyceridů s dlouhými řetězci (MCT mají vyšší ketogenní potenciál). Celkový obsah tuků tak může být při MCT dietě nižší, a naopak, obsah sacharidů a proteinů vyšší. Přílišné množství MCT však způsobuje limitující gastrointestinální obtíže, především průjmy a střevní diskomfort. Jejich 60% zastoupení proto často není pacienty tolerováno. Jejich 30% zastoupení, v rámci mírnější tzv. John Radcliffe Diet, zase ztrácí ketogenní potenciál. Pro úvodní fázi diety se proto volí kompromisní řešení, obvykle 40 – 55 % kalorií z MCT, jež zajišťuje dobrou toleranci i schopnost navodit adekvátní ketózu. Základem jídelníčků jsou purifikované MCT oleje nebo emulze (50 % MCT oleje a 50 % vody), povětšinou vyráběné z kokosového oleje, který je na MCT přirozeně bohatý. Účinnost diety s MCT je srovnatelná s klasickou KD [8].
Modifikovaná Atkinsonova dieta
Modifikovaná Atkinsonova dieta je benevolentnějším typem KT/ MBT v léčbě epilepsií používaným od roku 2003. Ketogenní poměr se pohybuje kolem 1 : 1, jídelníčky jsou chutnější a celý management jednodušší, protože není vyžadováno přesné odvažování všech surovin, a rovněž riziko nežádoucích účinků je nižší. To umožňuje iniciaci diety a edukaci pacientů ambulantní cestou. MAD je užívána v dětské, ale zejména v adolescentní a dospělé epileptologii, kde nejpřísnější režimy nelze reálně použít. I tak je ale míra non-compliance u starších dětí a dospělých vysoká – až třetina pacientů nevydrží na léčbě ani 3 měsíce [9]. Jídelníčky jsou založeny na výrazném omezení sacharidů, ovšem bez kalorické a tekutinové restrikce. Množství sacharidů je nejnižší v prvním měsíci – u dětí 10 g/ den, u adolescentů 15 g/ den, u dospělých 15 – 20 g/ den. Později se jejich obsah navyšuje na konečných 20 g/ den u dětí, resp. 30 – 40 g/ den u dospělých. Sacharidové potraviny nejsou blíže specifikovány, ale preference sacharidů s nízkým glykemickým indexem (GI) je výhodná (kombinují se tak principy MAD a LGIT). Ostatní makronutrienty není nutné přesně počítat, nicméně převaha tučných potravin musí být zachována. Pacienti si tak vlastně „hlídají“ pouze denní příjem sacharidů, což jim (alespoň v našem centru) usnadňují přehledové tabulky tzv. sacharidových potravin. Dlouhodobě lepších výsledků lze pravděpodobně dosáhnout krátkodobým zpřísněním MAD v úvodní fázi léčby („strict first month“) – většinou přidáním jednoho ketogenního jídla v poměru 4 : 1 (což zvyšuje celkový ketogenní poměr na přibližně 1,8 : 1) nebo zahájením klasickou KD v poměru 2 : 1 [10]. Opačný postup, tzn. pozvolný úvod a následné zpřísňování, může být také efektní [11,12], ale z psychologického hlediska pro pacienty hůře přijatelný.
Dieta s nízkým glykemickým indexem
Dieta s nízkým glykemickým indexem nachází uplatnění mimo epileptologii i v terapii diabetu, obezity, srdečních chorob a syndromu polycystických ovarií. V mnoha ohledech je podobná MAD, liší se především výběrem sacharidových potravin. Čistý příjem sacharidů je limitován na 40 – 60 g/ den, což představuje cca 10 % energetického zisku (pro srovnání při MAD 5 %). Základním principem je volba potravin s nízkým GI (GI < 50), tzn. s malou tendencí zvyšovat glykemii a s tím spojenou inzulinovou odpověď. Hodnotu GI ovlivňuje řada proměnných. Obecně vhodné, a proto využívané, jsou však potraviny s vysokým obsahem vlákniny, protože vláknina (např. pektin) prokazatelně snižuje glykemickou odpověď [13]. GI snižuje i současná konzumace tuků, tudíž je kombinace sacharidových a tučných potravin součástí standardů LGIT. Limitací je nedostupnost GI pro všechny potraviny, a tedy omezený výběr surovin (stanovení GI je poměrně náročné – získává se jako podíl dvou AUC [area under the curve, plocha pod křivkou], získaných měřením glykemie v dvouhodinových intervalech po konzumaci definovaného množství testované potraviny a následně glukózy, a to po zprůměrnění testování na 10 subjektech [14]).
Mechanizmy účinku
Esenciálním metabolickým procesem všech typů KT/ MBT je ketogeneze (nadprodukce ketolátek, které pak slouží jako náhradní energetický zdroj pro CNS). Sama ketóza nicméně není pro klinický účinek dostatečná a ani vždy nekoreluje s mírou účinnosti. Přesné mechanizmy účinku nejsou dosud plně pochopeny, pravděpodobně však půjde o komplexní systémovou adaptaci na s ketózou spojené pochody, především omezení glykolýzy a zintenzivnění oxidace mastných kyselin. Antikonvulzivní efekt má dle modelů jak snížené množství využitelné glukózy, tak i celková kalorická restrikce [15]. Stejně tak polynenasycené mastné kyseliny hrají zřejmě důležitou, ačkoliv ne plně objasněnou roli – inhibují napěťově řízené Na+/ Ca2+ kanály a působí na nukleární receptory PPARs (peroxisome proliferator-activated receptors), které se účastní mj. i regulace metabolizmu mastných kyselin [16]. Přímé antikonvulzivní působení acetoacetátu a acetonu (nikoli BHB) bylo prokázáno v animálním modelu [17], jejich modulační vliv na γaminomáselnou kyselinu (GABAA) a glutamátové receptory, resp. synaptickou transmisi in vivo se však následně nepotvrdil [16,18]. Rovněž úloha BHB je nejasná, pravděpodobně ale zvyšuje odolnost buněk k oxidativnímu stresu cestou inhibice histon-deacetylázy a/ nebo působí protizánětlivě prostřednictvím specifického účinku na NLRP3 inflammasome [16]. Dalšími dílčími mechanizmy působení KD jsou např. inhibice rapamycinové signální dráhy [19], zvýšení hladiny GABA [20] nebo stabilizace neuronální membrány vlivem zvýšené dostupnosti bioenergetických substrátů [16]. Za zmínku stojí také recentní poznatky z animálních modelů, jež poukazují na významnou roli KT/ MBT ve smyslu stimulace mitochondriální biogeneze a mitochondriálního metabolizmu prostřednictvím PGC1α-SIRT3-UCP2 (peroxisome proliferator-activated γ-coactivator-1α – mitochondrial NAD+-dependent deacetylase sirtuin 3 – uncoupling protein 2) osy [21].
Indikace a účinnost KT/ MBT
V kontrastu se spekulacemi nad podstatou patofyziologických mechanizmů účinku není o klinické účinnosti KT/ MBT pochyb. Efektivita byla prokázána u generalizovaných i fokálních epilepsií, resp. generalizovaných i fokálních záchvatů, a to u dětí všech věkových kategorií, adolescentů i dospělých. Po vyloučení absolutních a posouzení relativních kontraindikací (tab. 1) může tak být indikována prakticky u jakéhokoliv pacienta s farmakorezistentní epilepsií. U některých onemocnění a dětských epileptických syndromů s obecně velmi dobrou odpovědí na KT není již ani naplnění kritérií farmakorezistence mandatorní. Výčet klinických jednotek s nadprůměrnou účinností KT/ MBT (definováno jako benefit o min. 20 % vyšší, než je průměrná 50% response-rate KT) předkládá tab. 2. Jednotky s průměrnou účinností pak tab. 3. KT/ MBT tedy zdaleka není léčbou poslední volby, jak bývá mnohdy chápána, naopak – dřívějších indikací přibývá. Klíčový význam má v léčbě dvou metabolicky podmíněných syndromů – glucose transporter-1 (GLUT-1) deficience a deficitu pyruvátdehydrogenázy (PDHD), u kterých lze hovořit o terapii kauzální. V poslední době narůstá využití také v akutních stavech, tj. v léčbě super refrakterního status epilepticus vč. febrile infection-related epilepsy syndrome (FIRES), kde je účinnost KT ve srovnání s intravenózními AEDs, anestetiky i různými typy imunoterapie nejvyšší, obzvláště v iniciálním stadiu nemoci [22]. Stále se však jedná o terapii vysoce selektivní, tzn. určenou pro úzký, pečlivě zvolený okruh pacientů.
Tab. 1. Kontraindikace ketoterapie [12]. Metabolické vyšetření cílené na diagnostiku poruch β-oxidace mastných kyselin je nutno provést i při negativním výsledku novorozeneckého screennigu. ![Kontraindikace ketoterapie [12].
Metabolické vyšetření cílené na diagnostiku
poruch β-oxidace mastných
kyselin je nutno provést i při negativním
výsledku novorozeneckého screennigu.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/e464520366a00040eeffb7a43e47ea98.jpeg)
Tab. 2. Onemocnění a epileptické syndromy (abecedně uspořádané) s dokumentovaným nadprůměrným benefitem ketoterapie (alespoň o 20 % vyšší než je obecně uváděný 50% průměr ve smyslu 50% redukce záchvatů). 
* bez ohledu na epileptický syndrom (s vý hodou lze využít komerčně vyráběných přípravků s definovaným ketogenním poměrem a adekvátním množstvím mikronutrientů, což usnadňuje administraci stravy, resp. celý management ketoterapie, a zvyšuje compliance) Tab. 3. Onemocnění a epileptické syndromy (abecedně uspořádané) s dokumentovaným benefitem ketoterapie (nepřesahujícím obecný 50% průměr ve smyslu 50% redukce záchvatů). 
* CDKL5 – cyklin-dependent kinase-like 5 nebo také serine/threonine kinase 9
** epilepsie není obvyklým symptomem nemociÚčinnost KT/ MBT u dětí dokládá za téměř 100 let celá řada studií, dlouho však chyběly studie kvalitně designované a především randomizované, což bylo terčem kritiky. V roce 1998 byla autory z John Hopkins Hospital publikována první velká, dosud často citovaná prospektivní studie čítající 150 dětí s epilepsií ve věku 1 – 16 let po selhání min. dvou AEDs – po 6 měsících zůstávalo na léčbě klasickou KD 71 % pacientů, přičemž 51 % pacientů dosáhlo větší než 50% redukce a 32 % pacientů větší než 90% redukce záchvatů [23]. Následná metaanalýza 11 klinických studií autorů F. Lefevra a N. Aronsona pak poukázala na 56 % pacientů s větším než 50% zlepšením, 32 % pacientů s větším než 90% zlepšením a 16 % pacientů, kteří dosáhli kompletní klinické remise [24]. V randomizované studii Bergqvistové et al dosáhlo po 3 měsících klinické remise 21 % pacientů, a to shodně v obou testovaných skupinách – s úvodním hladověním i bez něho [25]. Výsledky bývají citovány jako důkaz, že iniciální hladovění není z pohledu dlouhodobé efektivity esenciální, což se i přes stále trvající diskuze s postupujícím časem potvrzuje [12]. Mezi lety 2008 a 2017 byly publikovány další čtyři randomizované kontrolované studie (tři s důkazem třídy III a jedna s důkazem třídy II), které výše uvedenou efektivitu KT/ MBT potvrzují – tzn. přibližně 50 % respondérů (definováno jako alespoň 50% redukce záchvatů) a 15 % pacientů (míněno z celé kohorty) zcela bez záchvatů [8,26 – 28].
Účinnost MAD (a podobně LGIT) byla v posledních 15 letech dokumentována na cca 30 různě designovaných prospektivních a retrospektivních studiích s vcelku konzistentními výsledky [12]. Pro ilustraci z kohorty 347 dětí a dospělých dosáhlo 144 (41 %) pacientů větší než 50% redukce a 86 (25 %) pacientů větší než 90% redukce záchvatů [29]. V metaanalýze 12 studií hodnotících účinnost KT/ MBT výhradně u dospělých pacientů dosáhlo větší než 50% redukce záchvatů celkem 40 % nemocných (49 % klasická KD vs. 34 % MAD) [30]. Z 27 dětí převedených z MAD na klasickou KD, 10 (37 %) dosáhlo dalšího zlepšení alespoň o 10 % a 5 (19 %) dosáhlo 100% bezzáchvatovosti, přičemž všech těchto 5 pacientů mělo myoklonicko-atonickou epilepsii (MAE) [10]. V souhrnu tedy platí, že procento respondérů je s klasickou KD srovnatelné, šance na úplnou klinickou remisi je však podstatně nižší, a to především u dětí s MAE a syndromy z blízkého spektra. V praxi proto považujeme MAD za sice účinnou, ale spíše paliativní terapii. U dětských pacientů s předpokladem významného benefitu stále preferujeme iniciaci klasickou KD.
Praktický management KD
Praktický management KT/ MBT začíná výběrem vhodného kandidáta a edukačním pohovorem s rodinou, při kterém jsou prodiskutovány všechny „cost/ benefit“ aspekty a stanoveny reálné cíle léčby. Důraz je kladen na dokonalou compliance rodiny, která je pro úspěch KT zásadní. Následuje podrobné metabolické vyšetření (k vyloučení absolutních kontraindikací), výběr konkrétního typu diety a stanovení základních parametrů – v případě klasické KD ketogenního poměru, celkového kalorického příjmu, množství bílkovin a distribuce jednotlivých porcí v průběhu dne. Parametry stanovuje erudovaný lékař (neurolog, pediatr) ve spolupráci s nutričním specialistou, který je nedílnou součástí týmu. Připravuje konkrétní jídelníčky a podílí se na edukaci rodičů/ pacientů v průběhu iniciace. Volba parametrů je do značné míry odrazem zkušeností a zvyklostí pracoviště a je více „uměním“ než „protokolární léčbou“. Nicméně pro děti do 2 let věku se používá poměr 2, 3 nebo 4 : 1 [31], pro starší batolata, předškolní a školní děti 4 : 1, pro adolescenty opět benevolentnějších 2 – 3 : 1. Odhad kalorického příjmu lze zpřesnit analýzou několikadenního záznamu dosavadního jídelníčku dítěte (tzn. nutriční re-call), popř. využít některé z dostupných rovnic pro výpočet denní energetické potřeby pro daný věk a pohlaví s přihlédnutím k fyzické aktivitě. Iniciace klasické KD probíhá ve většině center za hospitalizace s monitorací vnitřního prostředí pacienta, a to buď s úvodním 12 – 48h hladověním nebo graduovaně, tj. bez hladovění (v anglosaské literatuře také fasting, resp. non-fasting protocol). Fasting protokoly vedou k rychlejšímu navození ketózy, a tím k rychlejšímu ověření účinnosti, jsou však zatíženy větším množstvím akutních nežádoucích účinků (hypoglykemie, zvracení, rozvoj metabolické acidózy, dehydratace) [25]. Tyto nežádoucí účinky ovšem bývají přechodné, předvídatelné a dobře zvládnutelné (např. hypoglykemii lze ve většině případů dobře korigovat podáním malého množství ovocného džusu; vzestup glykemie zmírňuje i zvracení a tendenci k metabolické acidóze). Po stabilizaci dítěte na ketogenní stravě (cca 5 – 7 dní), edukaci rodiny a propuštění do ambulantní péče navazuje fáze ladění diety („fine-tuning“), kdy se parametry mohou dle individuálních potřeb upravovat. V dalším průběhu se pravidelně monitorují antropometrické ukazatele, glykémie, sérové hladiny AEDs, vitaminu D, zinku a selenu, lipidový profil, krevní obraz, parametry vnitřního prostředí a renální funkce, provádí se UZ urotraktu a při delším trvání léčby pak i vyšetření kostní denzity (DEXA scan) [12]. Pro kontrolu „stupně ketózy“ slouží jednoduché stanovení acetonu z moči nitroprusidovou metodou nebo vyšetření sérového BHB z kapilární krve – korelace těchto hodnot s mírou redukce záchvatů však není jednoznačná [12,32]. Nutná dlouhodobá suplementace vitaminů, vápníku a příp. i selenu a zinku může být doplněna o L-karnitin, který zefektivňuje využití lipidů ze stravy.
Non-fasting protokoly, jež spočívají v postupném (graduovaném) zpřísňování ketogenního poměru (např. z úvodního 1 : 1 přes 2 : 1 a 3 : 1 k cílovému 4 : 1), jsou z pohledu akutních komplikací bezpečnější, a lze je proto iniciovat i ambulantní cestou (s výjimkou dětí mladších 1 roku, kde je hospitalizace jednoznačně doporučována).
První jídelníčky připravuje nutriční specialista, další si již tvoří rodiče dle vlastních preferencí. Kalkulace a vlastní příprava jídel není složitá a brzy se stává rutinou, je však zapotřebí stále dodržovat maximální přesnost v odvažování a volbě vhodných surovin a ctít pravidla při jejich kuchyňském zpracování. Existují i programy a on-line aplikace, které tvorbu jídelníčků usnadňují a zároveň slouží jako nástroj kontroly (v našem centru: „ketokalkulačka“, dostupná na webových stránkách kd.fnbrno.cz).
Má-li být KD účinná, až v 75 % dojde k nástupu efektu již po 14 dnech [33], validní hodnocení efektivity však provádíme po 3 – 6 měsících. V případě významného benefitu pokračujeme v dietě po dobu 2 let a následně ji pozvolna ukončujeme, popř. převádíme na mírnější dietní režim. Dřívější ukončení je doporučováno u infantilních spazmů a v případě úspěšně zvládnutého super-refrakterního status epilepticus [12]. Z dětí, které na KT/ MBT dosáhly 100% klinické remise, zůstává až 80 % kompenzovaných i po návratu k racionální stravě [34], někteří pacienti jsou však na KT/ MBT „závislí“ a setrvávají na ní i několik let.
Nežádoucí účinky
Jako každá terapie i KT/ MBT má své nežádoucí účinky. Mezi nejčastější patří gastrointestinální obtíže (obstipace, zvracení, abdomenalgie), které postihují přibližně polovinu pacientů [12]. Ve většině případů jsou ale mírné a lze je zvládnout úpravou jídelníčků či běžnými medikamenty. Hyperlipidémie (zvýšené hodnoty triglyceridů a/ nebo cholesterolu) je dle studií přítomna u 14 – 59 % dětí na klasické KD [35,36], nicméně prvotní vzestup hodnot na několikanásobek normy se do 12 měsíců opět často normalizuje [37,38]. Logická konsekvence a otázka, zda hyperlipidémie zvyšuje riziko kardiovaskulárních chorob, není jasná. Testován byl dosud jen vliv hypercholesterolemie na vlastnosti stěny koronárních tepen – výsledky studií jsou však nekonzistentní [39,40]. Nefrolitiáza se vyskytuje u 3 – 7 % pacientů [41,42], zřídka ovšem bývá důvodem k přerušení KT. Jako prevence tvorby renálních konkrementů se používají perorální citráty (např. Schollův roztok), výhodné zejména při současné terapii inhibitory karbonátanhydrázy (topiramát, zonisamid). Negativní (ovšem minimální) dopad na tělesný růst je patrný u mladších dětí, růstová křivka starších dětí významně ovlivněna není [43]. Profil nežádoucích účinků při dlouholeté dietní léčbě nebyl dosud systematicky studován, byl však popsán zvýšený výskyt kostních zlomenin a renálních konkrementů, nikoliv ale dyslipidémie [38]. U adolescentních dívek a mladých žen stojí za zmínku poruchy hormonálního cyklu až sekundární amenorhoea. Přes obsáhlý výčet možných nežádoucích účinků (do kterých nutno zařadit ještě i vzácně popsané případy pankreatitidy a kardiomyopatie [44,45]) bývá však KT tolerována až překvapivě dobře, obzvláště v případech plného efektu.
Klinika dětské neurologie LF MU a FN Brno, Centrum pro epilepsie Brno – zvyklosti a zkušenosti
Od zahájení programu KT v roce 2012 jsme indikovali a realizovali KT/ MBT u 30 dětských a 10 dospělých pacientů (v 38 případech z indikace farmakorezistentní epilepsie, v jednom případě pro GLUT1-deficit s dominující ataxií a v jednom případě pro glioblastoma multiforme po vyčerpání „konvenční“ onkologické terapie; věk nejmladšího pacienta byl v době iniciace 18 měsíců). U všech dospělých a adolescentů (s výjimkou jednoho pacienta v super-refrakterním status epilepticus) byla zvolena MAD (s prvky LGIT) nebo klasická KD v nízkém ketogenním poměru s následným převedením na MAD s iniciací ambulantní cestou. U mladších dětí byla preferována klasická KD (s úvodním hladověním i bez něho dle individuálního zvážení) s iniciací za hospitalizace. Z dětské kohorty 29 pacientů s farmakorezistentní epilepsií dosáhlo šest plné klinické kompenzace (syndromologicky: 3× MAE, 1× epilepsie s kontinuálními výboji hrot-vlna ve spánku, 1× dětské absence s časným počátkem a 1× FIRES), další čtyři větší než 90% redukce záchvatů a dalších pět větší než 50% redukce záchvatů (celkový počet respondérů tedy 15; s výjimkou dvou pacientů iniciovaných v roce 2018 hodnoceno min. po 1,5 roce léčby; ve dvou případech došlo k opětovné dekompenzaci po dvou, resp. třech letech po ukončení KT/ MBT z důvodu dlouhodobé klinické kompenzace). Pouze u jednoho pacienta byla KD přerušena pro závažné nežádoucí účinky. Ve skupině devíti dospělých pacientů jsou dosažené výsledky podstatně méně optimistické – vysoká míra non-compliance (prokazatelně u tří pacientů) a pouze jediný respondér. Nicméně dva z pěti non-respondérů zaznamenali významné zlepšení kvality života z důvodu redukce nejvíce limitujícího typu záchvatu nebo podstatného zkrácení záchvatů a postparoxysmální únavy. Oba tito pacienti profitují z KT dodnes.
Závěr
Ketoterapie se svou téměř stoletou tradicí zdaleka není léčbou obsolentní, ale naopak léčbou moderní, účinnou a bezpečnou. Striktní klasická KD se uplatňuje u mladších dětí, kde nezřídka vede i k plné klinické kompenzaci. Alternativní dietní režimy dávají možnost lepší kvality života i adolescentům a dospělým s refrakterní epilepsií.
Seznam zkratek
KD – ketogenní dieta
KT – ketoterapie
AEDs – antiepileptika
MBT – metabolism-based therapy
MCT – triglyceridy se středně dlouhým řetězcem
LGIT – dieta s nízkým glykemickým indexem
MAD – modifikovaná Atkinsonova dieta
BHB – β-hydroxy-butyrát
GI – glykemický index
PPARs – peroxisome proliferator-activated receptors
GABA – γaminomáselná kyselina
GLUT-1 – glucose transporter-1
FIRES – febrile infection-related epilepsy syndrome
MAE – myoklonicko-atonická epilepsie
MUDr. Ondřej Horák
Ondřej Horák promoval na Lékařské fakultě Masarykovy univerzity v Brně v roce 2009 a ihned po promoci nastoupil na Kliniku dětské neurologie LF MU a FN Brno, kde působí dodnes – nejprve jako sekundární lékař, následně jako vedoucí lékař elektrofyziologické laboratoře a nyní jako zástupce přednosty pro LPP. Od počátku své profesní kariéry se věnuje především dětské epileptologii a epileptochirurgii, a to nejen v rovině klinické, ale i vědecké, přednáškové a publikační. Je členem epileptochirurgického týmu Centra pro epilepsie Brno – centra vysoce specializované péče o dospělé i dětské pacienty s farmakorezistentní epilepsií, které se v roce 2017 stalo součástí také evropské referenční sítě (European Reference Network) EpiCare. V roce 2012 zavedl na svém domovském pracovišti léčebný program ketogenní diety, ve kterém je jako vedoucí lékař týmu stále aktivní.
MUDr. Ondřej Horák
Klinika dětské neurologie LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: horak.ondrej@fnbrno.cz
Přijato k recenzi: 9. 5. 2018
Přijato do tisku: 9. 1. 2019
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Zdroje
1. Guelpa G, Marie A. La lutte contre l`epilepsie par la desintoxication et par la reducation alimentaire. Rev Ther Medico-Chirurgicale 1911; 78 : 8 – 13.
2. Geyelin HR. Fasting as a method for treating epilepsy. Medical Record 1921; 99 : 1037 – 1039.
3. Conklin HW. Cause and treatment of epilepsy. J Am Osteopath Assoc 1922; 26 : 11 – 14.
4. Woodyatt RT. Objects and method of diet adjustment in diabetes. Arch Intern Med 1921; 38(2): 125 – 141.
5. Wilder RM. The effect of ketonemia on the course of epilepsy. Mayo Clin Proc 1921; 2 : 307.
6. Wilder RM. High fat diets in epilepsy. Mayo Clin Proc 1921; 2 : 308.
7. Huttenlocher PR, Wilbourne AJ, Sigmore JM. Medium chain triglycerides as a therapy for intractable childhood epilepsy. Neurology 1921; 21(11): 536 – 540.
8. Neal EG, Chaffe HM, Schwartz R et al. A randomised trial of classical and medium-chain triglyceride ketogenic diets in the treatment of childhood epilepsy. Epilepsia 2009; 50(5): 1109 – 1117. doi: 10.1111/ j.1528-1167.2008.01870.x.
9. Kossoff EH, Rowley H, Sinha SR et al. A prospective study of the modified Atkins diet for intractable epilepsy in adults. Epilepsia 2008; 49(2): 316 – 319. doi: 10.1111/ j.1528-1167.2007.01256.x.
10. Kossoff EH, Bosarge JL, Miranda MJ et al. Will seizure controle improve by switching the modified Atkins diet to the traditional ketogenic diet? Epilepsia 2010; 51(12): 2496 – 2499. doi: 10.1111/ j.1528-1167.2010.02774.x.
11. Pfeifer HH, Thiele EA. Low-glycaemic index treatment: a liberalized ketogenic diet for treatment of intractable epilepsy. Neurology 2005; 65(11): 1810 – 1812. doi: 10.1212/ 01.wnl.0000187071.24292.9e.
12. Kossoff EH, Zupec-Kania BA, Auvin S et al. Optimal clinical management of children receiving dietary therapies for epilepsy: Updated recommendations of the International Ketogenic Diet Study Group. Epilepsia Open 2018; 3(2): 175 – 192. doi: 10.1002/ epi4.12225.
13. Wolover T, Jenkins D. Effect of dietary fiber and foods on carbohydrate metabolism. In: Spiller G (ed). Handbook of dietary fiber in human nutrition. 3rd ed. Boca Raton, FL: CRP Press 2001 : 321 – 362.
14. Brand-Miller J, Holt S. Testing the glycaemic index of foods: in vivo, not in vitro. Eur J Clin Nutr 2004; 58(4): 700 – 701. doi: 10.1038/ sj.ejcn.1601856.
15. Hartman AL, Rho JM. The biochemical basis of dietary therapies for neurological disorders. In: Neal E (ed). Dietary treatment of epilepsy. Chichester: John Wiley and Sons, Ltd 2012 : 34 – 44.
16. Rho JM. How does the ketogenic diet induce anti-seizure effects? Neurosci Lett 2017; 10(637): 4 – 10. doi: 10.1016/ j.neulet.2015.07.034.
17. Rho JM, Anderson GD, Donevan SD et al.Acetoacetate, acetone and dibenzylamine (a concomitant in 1-(+)-beta-hydroxybutyrate) exhibit direct anticonvulsant actions in vivo. Epilepsia 2002; 43(4): 358 – 361.
18. Thio LL, Wong M, Yamada KA. Ketone bodies do not directly alter excitatory or inhibitory hippocampal synaptic transmission. Neurology 2000; 54 : 325-331. doi: 10.1212/ wnl.54.2.325
19. McDaniel SS, Rensing NR, Thio LL et al. The ketogenic diet inhibits the mammalian terget of rapamycin (mTOR) pathway. Epilepsia 2011; 52(3): e7 – e11. doi: 10.1111/ j.1528-1167.2011.02981.x.
20. Yudkoff M, Daikhin Y, Horyn O et al. Ketosis and brain handling of glutamate, glutamine, and GABA. Epilepsia 2008; 49 (Suppl 8): 73 – 75. doi: 10.1111/ j.1528-1167.2008.01841.x.
21. Hassan-Olive MM, Lauritzen KH, Ali M et al. A ketogenic diet improves mitochondrial biogenesis and bioenergetics via tha PGC1α-SIRT3-UCP2 Axis. Neurochem Res 2018; [Epub ahead of print]. doi: 10.1007/ s11064-018-2588-6.
22. Gaspard N, Hirsch LJ, Sculier C et al. New-onset refractory status epilepticus (NORSE) and febrile infection-related epilepsy syndrome (FIRES): state of the art and perspectives. Epilepsia 2018; 59(4): 745 – 752. doi: 10.1111/ epi.14022.
23. Freeman JM, Vining EP, Pillas DJ et al. The efficacy of the ketogenic diet-1998: a prospective evaluation of intervention in 150 children. Pediatrics 1998; 102(6): 1358 – 1363.
24. Lefevre F, Aronson N. Ketogenic diet for treatment of refraktory epilepsy in children: a systematic review of efficacy. Pediatrics 2000; 105(4): E46.
25. Bergqvist AG, Schall JI, Gallagher PR et al. Fasting versus gradual initiation of the ketogenic diet: a prospective, randomized clinical trial of efficacy. Epilepsia 2005; 46(11): 1810 – 1819. doi: 10.1111/ j.1528-1167.2005.00282.x.
26. Freeman JM, Vining EP, Kossoff EH et al. A blinded, crossover study of the efficacy of the ketogenic diet. Epilepsia 2009; 50(2): 322 – 325. doi: 10.1111/ j.1528-1167.2008.01740.x.
27. Sharma S, Sankhyan N, Gulati S et al. Use of the modified Atkins diet for the treatment of refractory childhood epilepsy: a randomized controlled trial. Epilepsia 2013; 54(3): 481 – 486. doi: 10.1111/ epi.12069.
28. Lambrechts DA, de Kinderen RJ, Vles JS et al. A randomized controlled trial of the ketogenic diet in refraktory childhood epilepsy. Acta Neuol Scand 2017; 135(6): 231 – 239. doi: 10.1111/ ane.12737.
29. Chen W, Kossoff EH. Long-term follow-up of children treated with the modified Atkins diet. J Child Neurol 2012; 27(6): 754 – 758. doi: 10.1177/ 0883073812441062.
30. Ye F, Li XJ, Jiang WL et al. Efficacy of and patient compliance with ketogenic diet in adults with intractable epilepsy: a metaanalysis. J Clin Neuol 2015; 11(1): 26 – 31. doi: 10.3988/ jcn.2015.11.1.26.
31. van der Louw E, van den Hurk D, Neal E et al. Ketogenic diet guidelines for infants with refraktory epilepsy. Eur J Paediatr Neurol 2016; 20(6): 798 – 809. doi: 10.1016/ j.ejpn.2016.07.009.
32. Buchhalter JR, D`Alfonso S, Connolly M et al. The relationship between D-beta-hydroxybutyrate blood concentrations and seizure control in children treated with the ketogenic diet for medically intractable epilepsy. Epilepsia Open 2017; 2(3): 317 – 321. doi: 10.1002/ epi4.12058.
33. Kossoff EH, Laux LC, Blackford R et al. When do seizures esually improve with the ketogenic diet? Epilepsia 2008; 49(2): 329 – 333. doi: 10.1111/ j.1528-1167.2007.01417.x.
34. Martinez CC, Pyzik PL, Kossoff EH. Discontinuing the ketogenic diet in seizure-free children: recurrence and risk factors. Epilepsia 2007; 48(1): 187 – 190. doi: 10.1111/ j.1528-1167.2006.00911.x.
35. Nizamuddin J, Turner Z, Rubenstein JE et al. Management and risk factors for dyslipidemia with the ketogenic diet. J Child Neurol 2008; 23(7): 758 – 761. doi: 10.1177/ 0883073808318061.
36. Güzel O, Yilmaz U, Uysal U et al. The effect of olive oil-based ketogenic diet on serum lipid levels in epileptic children. Neurol Sci 2016; 37(3): 465 – 470. doi: 10.1007/ s10072-015-2436-2.
37. Kwiterovich PO Jr, Vining EP, Pyzik P et al. Effect of a high-fat ketogenic diet on plasma levels of lipids, lipoproteins, and apolipoproteins in children. JAMA 2003; 290(7): 912 – 920. doi: 10.1001/ jama.290.7.912.
38. Groesbeck DK, Bluml RM, Kossoff EH. Long-term use of the ketogenic diet in the treatment of epilepsy. Dev Med Child Neurol 2006; 48(12): 978 – 981. doi: 10.1017/ S0012162206002143.
39. Doksöz Ö, Güzel O, Yilmax Ü et al. The short-term effect of ketogenic diet on carotid intima-media thickness and elastic properties of the carotid artery and aorta in epileptic children. J Child Neurol 2015; 30(12): 1646 – 1650. doi: 10.1177/ 0883073815576793.
40. Coppola G, Natale F, Torino A et al. The impact of the ketogenic diet on arterial morphology and endothelial function in children and young adults with epilepsy: a case-control study. Seizure 2014; 23(4): 260 – 265. doi: 10.1016/ j.seizure.2013.12.002.
41. Sampath A, Kossoff EH, Furth SL et al. Kidney stones and the ketogenic diet: risk factors and prevention. J Child Neurol 2007; 22(4): 375 – 378. doi: 10.1177/ %883073807301926.
42. Furth SL, Casey JC, Pyzik PL et al. Risk factors for urolithiasis in children on the ketogenic diet. Pediatr Nephrol 2000; 15(1 – 2): 125 – 128.
43. Vining EP, Pyzik P, McGrogan J et al. Growth of children on the ketogenic diet. Dev Med Child Neurol 2002; 44(12): 796 – 802. doi: 10.1111/ j.1469-8749.2002.tb00769.x.
44. Stewart WA, Gordon K, Camfield P. Acute pancreatitis causing death in a child on the ketogenic diet. J Child Neurol 2001; 16(9): 682. doi: 10.1177/ 08830738010 1600910.
45. Best TH, Franz DN, Gilbert DL et al. Cardiac complications in pediatric patients on the ketogenic diet. Neurology 2000; 54(12): 2328 – 2330. doi: 10.1212/ WNL.54.12.2328.Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2019 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Genetika neurodegenerativních demencí v deseti bodech – co může neurolog očekávat od molekulárního genetika?
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Analýza dat v neurologii LXXIII. Problematika interpretace Pearsonova korelačního koeficientu
- Vieme dobre diagnostikovať dyskinetickú formu DMO? ÁNO
- Umíme dobře diagnostikovat dyskinetickou formu DMO? NE
- Umíme dobře diagnostikovat dyskinetickou formu DMO?
- Sub signum coma – súčasný pohľad na chronické poruchy vedomia
- Chronický subdurální hematom
- Editorial
- Iatrogenizácia pacientov so psychogénnymi neepileptickými záchvatmi – možné východiská
- Praktické užití a indikace transkraniální stimulace stejnosměrným proudem
- Poděkování recenzentům
- Transkraniální magnetická stimulace u hraniční poruchy osobnosti – série kazuistik
- Změny v expresi TNFα a microRNA-15b u experimentálního modelu subarachnoidálního krvácení
- Raschova analýza dotazníku Q-LES-Q-SF na podkladě odpovědí pacientů s neuropatickou bolestí
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Evokované potenciály vyvolané kontaktním teplem – vliv fyziologických proměnných
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
- Laboratorní účinnost kyseliny acetylsalicylové v sekundární prevenci ischemických cévních mozkových příhod
- Parietální atrofie na magnetické rezonanci mozku u Alzheimerovy nemoci s pozdním začátkem
- Nové možnosti ultrazvuku v predikci výskytu bolesti dolní části zad u dospívajících mužů – pilotní studie
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Chronický subdurální hematom
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




