Praktické užití a indikace transkraniální stimulace stejnosměrným proudem
Background:
Transcranial direct current stimulation (tDCS) is a modality of biological treatment, which has recently received a considerable boom in popularity both in clinics and research. Its principles include a subtreshold modification of electric current in neurons, even though the effect is not limited to neural cells. The method is economically reasonable, but the correct application requires certain operational knowledge. This review sums up recent studies and recommendations with regard to practical application and therapeutical indications, where this type of stimulation can be used effectively.
Aim:
Clarification of practical application procedures and therapeutic protocols within tDCS and its potential in neuropsychiatric practice.
Conclusion:
The therapeutic effect of tDCS has been proven in patients with non-resistant depression, craving, and fibromyalgia with high recommendation and chronic neuropathic pain due to spinal cord injury with less recommendation; nevertheless, research efforts in other areas continue.
Key words
transcranial direct current stimulation – craving – depression – schizophrenia – tinnitus – fibromyalgia – chronic neuropathy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
T. Mareš 1; J. Albrecht 1; J. Buday 1; S. Čerešňáková 2; J. Raboch 1; M. Anders 1
Působiště autorů:
Psychiatrická klinika 1. LF UK a VFN v Praze
; Národní ústav duševního zdraví, Klecany
2
Vyšlo v časopise:
Cesk Slov Neurol N 2019; 82(1): 37-47
Kategorie:
Přehledný referát
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amcsnn201937
Souhrn
Východiska:
Transkraniální stimulace stejnosměrným proudem (transcranial direct current stimulation; tDCS) je jednou z metod biologické léčby, která se dostává do popředí klinického i výzkumného zájmu. Jedním z mechanizmů účinku je podprahová modifikace vzniku elektrického potenciálu v neuronech, avšak efekt se neomezuje pouze na samotné nervové buňky. Metoda je ekonomicky nenáročná, ale její správné provedení vyžaduje určitě praktické dovednosti. V této práci byly zpracovány recentní studie a doporučení týkají se praktické aplikace a terapeutických indikací, ve kterých je možné užít tento typ stimulace s efektem.
Cíl:
Ozřejmení postupů praktické aplikace a léčebných protokolů v rámci tDCS a jeho potenciálu v neuropsychiatrické praxi.
Závěr:
V rámci současných poznatků je s významnou silou důkazu prokázána účinnost tDCS v léčbě nerezistentní depresivní poruchy, bažení a fibromyalgie, s menší silou také u chronické neuropatické bolesti při lézích míšních. Výzkumy v dalších indikacích probíhají.
Klíčová slova
transkraniální stimulace stejnosměrným proudem – bažení – depresivní porucha – schizofrenie – tinitus – fibromyalgie – chronická neuropatie
Úvod
Transkraniální stimulace stejnosměrným proudem (transcranial direct current stimulation; tDCS) je moderní terapeutickou metodou v portfoliu mnoha odborností současné medicíny. Využívá stejnosměrného proudu o nízké intenzitě k navození podprahových změn potenciálu kortikálních, ale i subkortikálních neuronů. Za svoji oblibu vděčí velmi příznivému profilu nežádoucích účinků a nízké pořizovací ceně, která by v budoucnu mohla umožnit pořízení přístroje (obr. 1) samotnými pacienty a následnou stimulaci v domácích podmínkách. Stimulační protokoly jsou velice různorodé a je potřebné při jejich vývoji a aplikaci pomýšlet na celou řadu faktorů, které mohou ovlivnit výsledek terapie. Dílčí úspěchy jsou zaznamenány v terapii chronické neuropatické bolesti (v důsledku míšních lézí) či fibromyalgie, v psychiatrii zejména depresivních poruch a bažení při různých typech závislostí.
Fig. 1. Machine for transcranial direct current stimulation HDCstim (The Magstim Company
Ltd., Whitland, UK).

Historicky můžeme odkazy na primitivní verze terapie elektrickým proudem nalézt již ve starověkém Římě, ale její význam byl marginální. Současným metodám se podobala pramálo. Proto jsou se vznikem této formy terapie spojováni Luigi Galvani, Alessandro Volta a zejména Giovanni Aldini, který jako první užil tuto metodu v terapii melancholie [1].
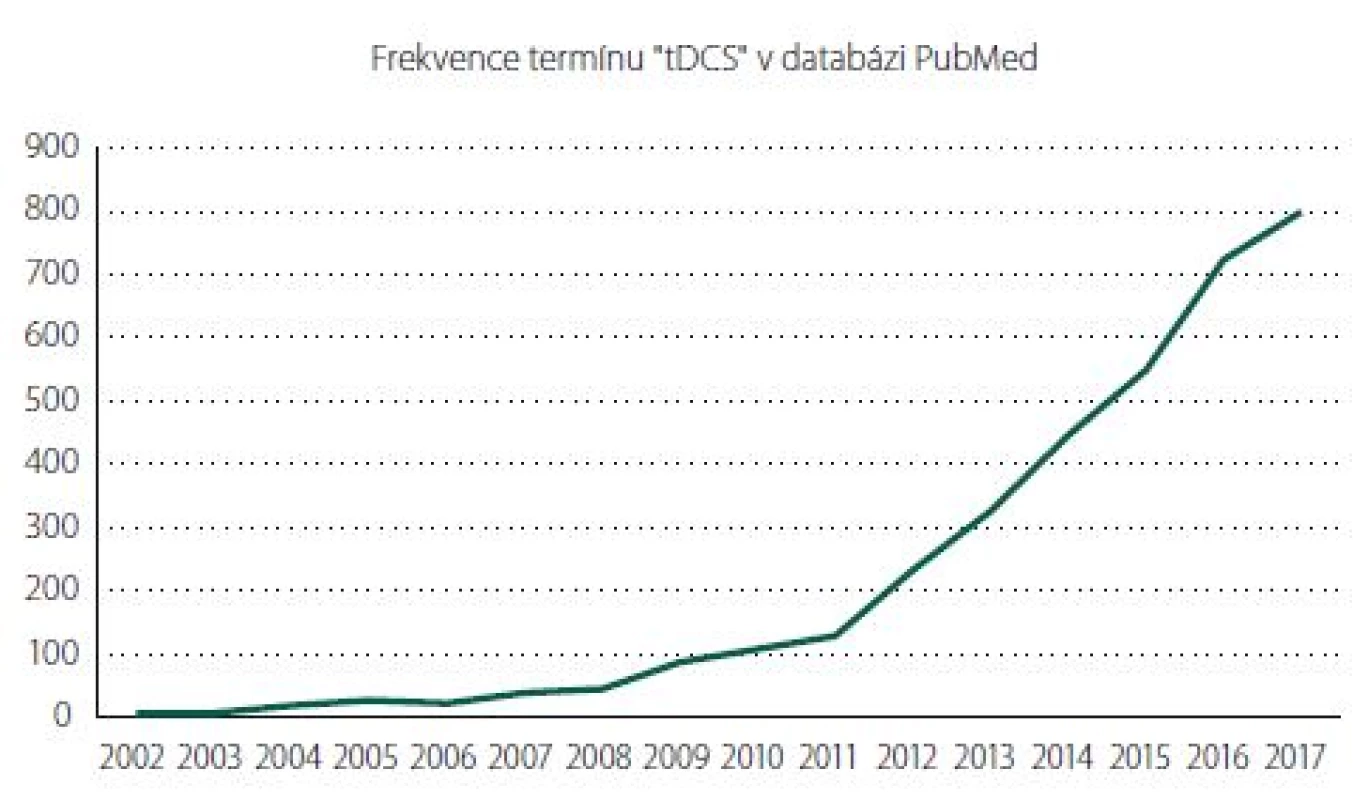
V minulém století se v této oblasti angažovali zejména Albert [2] a hlavně Nitsche a Paulus [3]. Zájem o tento typ stimulace, a především o její praktické uplatnění v klinickém prostředí, stoupá, o čemž svědčí i každoroční statistiky vyhledávače PubMed (obr. 2).
Fig. 2. Frequency of the term “tDCS“ in the PubMed database.
Principy
S ohledem na směr průchodu elektrického proudu dochází na membránách neuronů k posunu klidového membránového potenciálu směrem k hyperpolarizaci či depolarizaci [4], tj. excitaci pod anodou a inhibici pod katodou. Tyto změny jsou prokázány měřením motorických evokovaných potenciálů, jejichž amplituda při anodální stimulaci stoupá, zatímco při katodální se snižuje, a to i při velmi krátkých expozicích, přičemž délka stimulace prokazatelně ovlivňuje trvání efektu [3].
I u tDCS se prokazuje, že samotný efekt je výrazný spíše po ukončení stimulace než v jejím průběhu, což odpovídá poznatkům z repetitivní transkraniální magnetické stimulace (rTMS) [5,6]. Vliv na kortikální excitabilitu však nebyl prokázán pouze v motorických oblastech, nýbrž i v celé řadě dalších mozkových lokalit a v současné době se jedná téměř již o axiomatické pojetí toho principu.
Ovlivnění buněčného metabolizmu kalcia a kalcium-dependentní synaptické plasticity metabotropních glutamátergních neuronů se jeví být jedním z hlavních mechanizmů účinku, vzhledem k vymizení efektu stimulace následkem blokády N-methyl-D-aspartátových receptorů [7]. Pomocným mechanizmem je vliv na g-aminomáselnou kyselinu a její interakce s glutamátergním systémem [8].
Sporný mechanizmus představuje ovlivnění apoptotických procesů v buňce regulací influxu kalcia, což by bylo výhodné zejména v léčbě stavů po ischemických inzultech [9]. Někteří autoři však upozorňují na nepřesvědčivé výsledky v dlouhodobém horizontu.
V kontextu neuronálních sítí byl prokazován vliv tDCS na jejich konektivitu a synchronizaci, a to nejen na kortikální úrovni, ale taktéž na úrovni subkortikální a kortiko-subkortikální [10].
Synaptický efekt byl dlouhou dobu považován za hlavní pilíř účinku stimulace, synapse však tvoří pouze malou část CNS a výzkumy čím dál více prokazují význam axonálního působení (tedy non-synaptickému vlivu), při němž dochází ke změnám konformací membránových molekul, což dle některých prací přispívá právě k trvání efektu [11].
Stejnosměrný proud má vliv i na gliové buňky. Ty tvoří přes 50 % všech buněk CNS a jejich vliv na modulaci neurotransmise, regulaci homeostázy a krevního zásobení kortikálních regionů byl v minulosti podrobně popisován. Již zvířecí modely prokázaly přímý vliv stejnosměrného proudu na fetální gliové buňky, při jehož působení dochází už při nižších intenzitách k elongaci astrocytů a mikroglií a při vyšších intenzitách k zarovnání buněčných těl dle indukujícího elektrického pole – mikroglie rovnoběžně, astrocyty kolmo [12]. Nutno zdůraznit, že takto výrazné změny se vyskytly u intenzit elektrického proudu dalece překračujících neurodegenerační toxicitu, avšak morfologické změny byly zaznamenány v mikrogliích i při daleko nižších intenzitách [13]. Nesmíme zapomínat, že změny působením stejnosměrného proudu nejsou pouze morfologické, nýbrž následkem depolarizace astrocytů může také docházet k uvolnění glutamátu, a tím modulaci neuronální aktivity [14]. Fyziologické změny membránového potenciálu astrocytů vlivem tDCS nejsou v současnosti zcela zmapovány, ale dostupné práce i teoretické modely jejich existenci předpokládají [15].
Výzkum mikroglií je omezen i vzhledem k nemožnosti navození fyziologicky rozvětveného stavu při preparaci buněčných kultur [13]. Z hlediska působení stejnosměrného proudu se však nepředpokládá výrazný vliv rozvětvených glií i vzhledem k jejich vysokému elektrickému odporu [13]. Funkční mechanizmy améboidních mikroglií jsou popsány mnohem důkladněji a i výrazný podíl napěťově řízených iontových kanálů svědčí pro jejich roli v rámci modulace synaptické plasticity za pomoci mozkového neurotrofického faktoru a jeho interakcí s receptorem tyrozin-kinázy B, což v důsledku může vést k reorganizaci a neurorehabilitaci v rámci léčby po mozkových inzultech [16]. Tento postulát byl zevrubně zkoumán mimo jiné i na zvířecích modelech a katodální stimulace morčat se spinální lézí prokázala zvýšený axonální růst, a to i skrz oblast gliové jizvy [17].
Samotnou kapitolou je i teorie non-neuronálního působení stejnosměrného proudu v susceptibilních buňkách a tkáních, zejména ve vztahu k ovlivnění zánětlivých procesů, což zahrnuje mimo jiné endotel a lymfocyty [18]. I vzhledem k nové vlně výzkumu úlohy zánětlivých procesů u mnohých neuropsychiatrických stavů (RS, morbus Alzheimer, schizofrenie a jiné) je tato oblast výzkumu tDCS velmi dynamická a do budoucna značně slibná.
Provedení
Samotné praktické provedení tDCS je poměrně nenáročné. Pacientovi jsou umístěny elektrody na předem vybraná místa, na přístroji obsluha nastaví protokol a následně spustí stimulaci. Tento zjednodušený pohled však nereflektuje celou řadu nuancí, které úspěšnou aplikaci tDCS doprovází [19].
Elektrody
Stejnosměrný proud je aplikován za pomocí dvou či více povrchových elektrod (nejčastěji gumových), které bývají pro lepší vodivost ošetřeny (viz níže). Standardní rozměry elektrod bývají mezi 25 a 35 cm2 a jejich velikost je jedním z parametrů stimulace. Velikost je zásadní pro precizní zacílení účinku, tedy menší elektroda působí mnohem fokálněji, kdežto účinek větší elektrody je spíše disperzní. Proto bývají velké elektrody užívány v oblastech, kde není výraznější efekt fokální stimulace žádoucí. Modifikací elektrod byla vyvinuta samostatná metoda high definition-tDCS, která pro precizní fokalizaci efektu využívá jedné anody obklopené zpravidla čtyřmi katodami. Striktně lokalizovaného efektu je tak dosaženo nejenom vyšší intenzitou stimulace při užití menší elektrody (vyšší proudová hustota), ale také zejména díky potlačení (nežádoucího) účinku v přilehlých mozkových oblastech [20]. Tato konfigurace umožňuje eliminovat velikou nevýhodu čtvercových elektrod, jíž je koncentrace proudové hustoty podél hran [21]. Největší nevýhodou je naopak riziko takzvaného „shuntingu“ neboli přenosu elektrického proudu po pokožce (či likvorem) s minimálním účinkem na mozkové struktury podobně jako solný můstek při elektroencefalografii [22].
Fixace
Fixace elektrod na kalvě je problematika, kterou je třeba intenzivně řešit při praktické aplikaci tDCS, neboť jejich posun o pouhých 5 % délky může alterovat přesnost, a tím i výsledky celé stimulace [23]. V tomto ohledu máme na výběr mezi třemi základními metodami – elastické čepice ze síťoviny (dobrá přilnavost, riziko „shuntingu“), neoprenové čapky (nejspolehlivější fixace, limitace pouze na lokalizaci v systému 10–20) a gumové pásky (nejnižší cena, nerovnoměrný tlak na elektrody).
Snižování odporu
Při aplikaci elektrického proudu je (stejně jako např. při elektrokonvulzivní terapii) [24,25] prioritou minimalizace elektrického odporu. Elektrický tok musí překonávat nejen odpor samotné mozkové tkáně, ale také pokožky, podkoží, kostních struktur či likvoru a mozkových plen. Připomínáme Ohmův zákon, (obr. 3) který říká, že chceme-li při konstantní hodnotě elektrického proudu dosáhnout co nejefektivnější stimulace, musíme buď zvyšovat napětí či snižovat odpor.
Fig. 3. Representation of Ohm´s law
(U = I × R), where U = electrical voltage
(Volt), I = electrical current (Amp),
R = electrical resistence (Ohm) [57].
![Znázornění Ohmova zákona
(U = I × R), kde U = elektrické napětí (Volt),
I = elektrický proud (Amp), R = elektrický
odpor (Ohm) [57].<br>
Fig. 3. Representation of Ohm´s law
(U = I × R), where U = electrical voltage
(Volt), I = electrical current (Amp),
R = electrical resistence (Ohm) [57].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/11ec5fc834f4af7e9254edc435ecb502.jpeg)
Napětí není možné výrazně zvyšovat s ohledem na užívané přístroje a možné poškození tkání. Odpor můžeme snižovat za pomoci houbiček s fyziologickým roztokem či elektrovodivým gelem. Užití houbiček je levnější metodou, ale přináší s sebou riziko „shuntingu“ proudu po pokožce hlavy či snížení fokality stimulace [26].
Užití elektrovodivých past či gelů (např. EEG gel) je lepší možnost v rámci snižování celkového odporu [27], avšak je přítomno vyšší riziko kožní iritace vzhledem k tendenci gelu rychleji vysychat [28] a dyskomfortu „ulepených vlasů“, což je faktor potenciálně snižující adherenci k léčbě [29].
Parametry stimulace
Stimulační protokoly jsou definovány několika parametry: elektrický proud vyjadřovaný v miliampérech (většinou v rozmezí 0,5–2 mA), délka stimulace (10–30 min), umístění, velikost a tvar elektrod. Okrajově se ještě udává takzvaný ramp-up a ramp-down, tedy délka iniciálního časového úseku do dosažení požadované intenzity elektrického proudu (obyčejně 15–30 s).
Stále je všeobecně přijímáno paradigma vyšší intenzity proudu ve vztahu k velikosti účinku, ale některé práce naznačují, že tento vztah nemusí být zcela lineární. Zvýšením intenzity elektrického proudu z 1 na 2 mA v některých aplikacích může dojít k převrácení účinku [30]. Hranice 2 mA je obecně považována za bezpečnou pro užití na lidech, ale některé studie testují až dvojnásobnou intenzitu [31].
Lokalizace
Vzhledem k tomu, že jsou elektrody na skalp pouze přikládány, může být velice obtížné správně určit místo pro optimální terapeutický účinek. Jednou z možností je užití neuronavigačního softwaru, který vyžaduje MR mozku, což spolu s cenou vybavení pro neuronavigaci jde proti hlavním benefitům tDCS, tj. cenové dostupnosti a jednoduché proveditelnosti. Standardně se proto užívá EEG systém 10–20, který je optimální svou jednoduchostí a minimálními náklady.
Při vývoji nových stimulačních protokolů se v poslední době stále více uplatňuje užití výpočetních modelů, z nichž jmenujme např. předprogramovaný nástroj COMETS2 (Computational NeuroEngineering Laboratory, Hanyang University, Korea), který je schopen modelovat disperzi elektrického proudu v celosvětově rozšířeném výpočetním prostředí MatLab [32].
Nežádoucí účinky
Velkou výhodou tDCS je poměrně příznivý profil nežádoucích účinků. V rámci jednotlivých studií byly hlášeny nežádoucí účinky jen u 17 % stimulovaných a zpravidla se jednalo o svědění či zarudnutí v místě stimulace, dále o mírnou únavu či nevolnost, vzácněji i rychlé změny nálady a obtíže se soustředěním [33]. Z klinického pozorování však musíme podotknout, že paradoxně výraznější výskyt subjektivních nežádoucích účinků bývá u pacientů stimulovaných sham (placebo) stimulací a velkou roli hraje senzitivita pacienta.
Užití v praxi
Vzhledem k rozkvětu tDCS jsou oblasti výzkumu rozsáhlé a pro potřeby léčby psychických a neurologických onemocnění uvádíme jednotlivé indikace a protokoly.
Síla doporučení je uvedena na podkladě analýzy autorů Lefauchur et al, tento tým na podkladě doporučení European Federation of Neurological Societies (EFNS) z roku 2004 provedl analýzu dostupné evidence-based literatury a jednotlivé studie rozdělil do tříd (I–IV) dle hodnoty důkazu, který poskytují. Na jejich podkladě poté určil tři úrovně síly doporučení: úroveň A – „rozhodně (ne)efektivní“, úroveň B – „pravděpodobně (ne)efektivní“, úroveň C - „možná (ne)efektivní“ [34].
Podotkněme, že také z toho důvodu nejsou ve výčtu zahrnuty výzkumy kognitivního deficitu při Alzheimerově nemoci, subjektivního vnímání tinitu, motorického výkonu při Parkinsonově nemoci a stavech po CMP, a dále u epilepsie či mentální anorexie, kde jsou výsledky značně sporné [35].
Depresivní porucha
Podklad pro užití tDCS v rámci terapie depresivních stavů je překvapivě shodný s metodou rTMS [36]: tedy dosažení interhemisferické rovnováhy mezi pravým a levým dorzolaterálním prefrontálním kortexem (dorsolateral prefrontal cortex; DLPFC) [37], což je možné dvěma způsoby stimulace, tj. excitací levého či inhibicí pravého DLPFC. Lateralita není v současných výzkumech zohledněna a její vliv je proto sporný.
Anodální stimulace levého DLPFC můžeme dle protokolů rozdělit do dvou skupin. První skupina zahrnuje stimulace s anodou umístěnou nad levým DLPFC, zatímco katoda je umístěna nad pravým orbitofrontálním kortexem, přičemž kvalita recentních dat zatím poskytuje sílu doporučení B (obr. 4 a 5). Pravděpodobný účinek na depresivní prožívání u pacientů nerezistentních vůči léčbě antidepresivy při užití elektrického proudu 2 mA po dobu min. 20 min, a to min. po 10 dnů terapie [34] (tab. 1). Stimulace nižší intenzitou proudu a při nižším počtu aplikací či u skupiny farmakorezistentních pacientů nemá prokazatelný efekt.
Fig. 4. Computational model of electric potential (V) during the
therapy of depression. Anode over the left dorsolateral prefrontal
cortex, cathode over the orbitofrontal area.
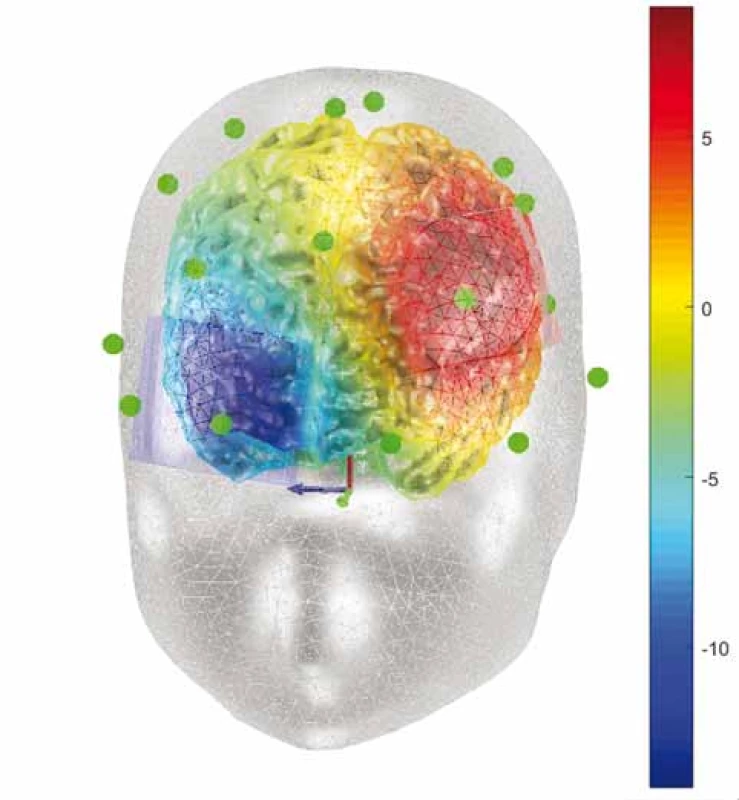
Fig. 5. 10–20 representations of the therapeutic protocol for depression
treatment. Anode (red) over the left dorsolateral prefrontal
cortex, cathode (blue) over the orbitofrontal area.
![Souhrn významných recentních studií při užití anody nad L-DLPFC a katody nad supraorbitální/orbitofrontální oblastí při
terapii deprese a jejich síla důkazu; převzato z Lefaucheur et al [34]. Prokázány pravděpodobný učinek u pacientů bez lékové rezistence
a pravděpodobná absence účinku u pacientů s farmakorezistentní depresí – síla doporučení B.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/92f403391c87ee87987a1c7a4149b724.jpeg)
Dalším protokolem, který je zastoupen v široké řadě studií, je anodální stimulace levého DLPFC s katodou umístěnou nad pravým DLPFC, ale jí je třeba podrobit extenzivním výzkumným snahám k definitivnímu závěru, neboť některé práce hovoří ve prospěch tohoto protokolu [38] a u jiných však účinnost nebyla prokázána (tab. 2).
![Souhrn významných recentních studií při užití anody nad L-DLPFC a katody nad R-DLPFC při terapii deprese a jejich síla důkazu;
převzato z Lefaucheur et al [34]. Prozatím není možno potvrdit ani vyloučit účinek na podkladě dostupných důkazů.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/edf13511f0891dda1a1feff986599beb.jpeg)
Výpočetní modely nabízí alespoň částečný vhled do mechanizmu účinku tDCS, zejména ve vztahu k hlubším neuronálním sítím zahrnujícím např. amygdalu či hipokampus [39], celkový mechanizmus účinku v terapii depresivních epizod však nebylo prozatím možné objasnit. Můžeme se domnívat, že přínos této metody bude v budoucnu spočívat ve schopnosti rychle redukovat depresivní symptomatiku u nemocných odmítajících běžnou farmakoterapii.
Fibromyalgie
Fibromyalgie a jiné „centralizované“ stavy bolesti se v současné době stávají stále častěji předmětem výzkumných snah. Samotná fibromyalgie v závislosti na diagnostických kritériích postihuje 2–8 % populace a bývá doprovázena řadou psychických komorbidit (deprese, úzkosti, posttraumatické stresové poruchy či obsedantně-kompulzivní poruchy) [40], což dále prohlubuje invalidizaci této skupiny.
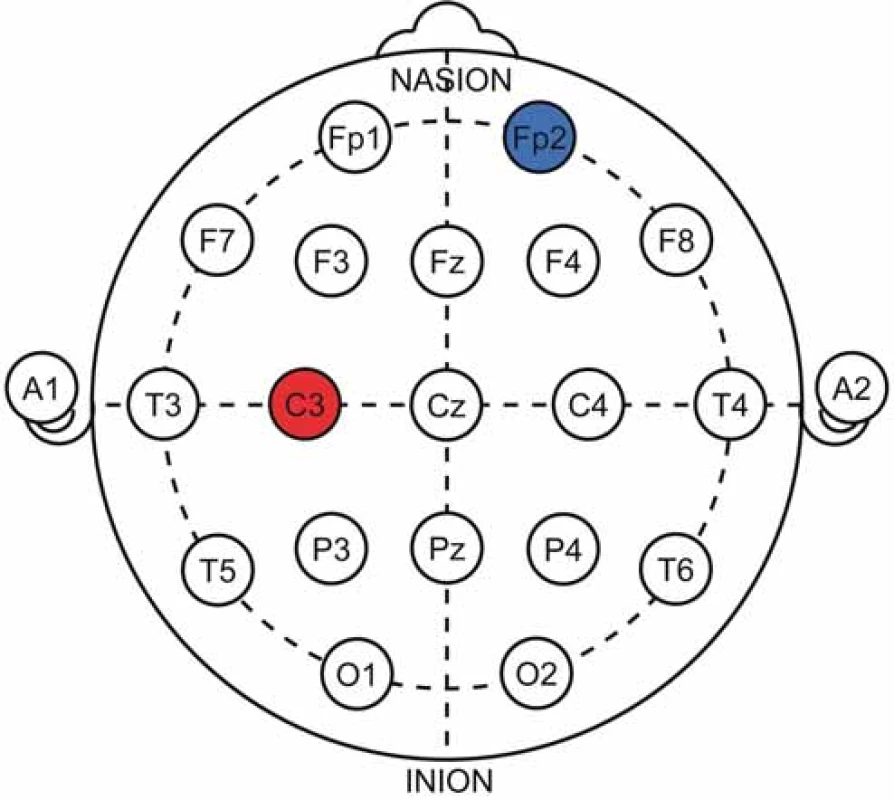
Většina prací volí pro umístění anody oblast M1 (tj. oblast C3/ C4 dle systému 10–20) (obr. 6 a 7) a v menší míře DLPFC, katoda je obvykle nad kontralaterální supraorbitální oblastí. Možný mechanizmus účinku spočívá v aktivaci descendentní inhibice bolesti či modulaci neuronálních okruhů zpracovávajících afektivní a senzorickou percepci podnětů v motorické kůře, talamu či DLPFC [41].
Fig. 6. Computational model of electric potential (V) during therapy
for fibromyalgia. Anode over the left M1 area, cathode over
the right orbitofrontal area.
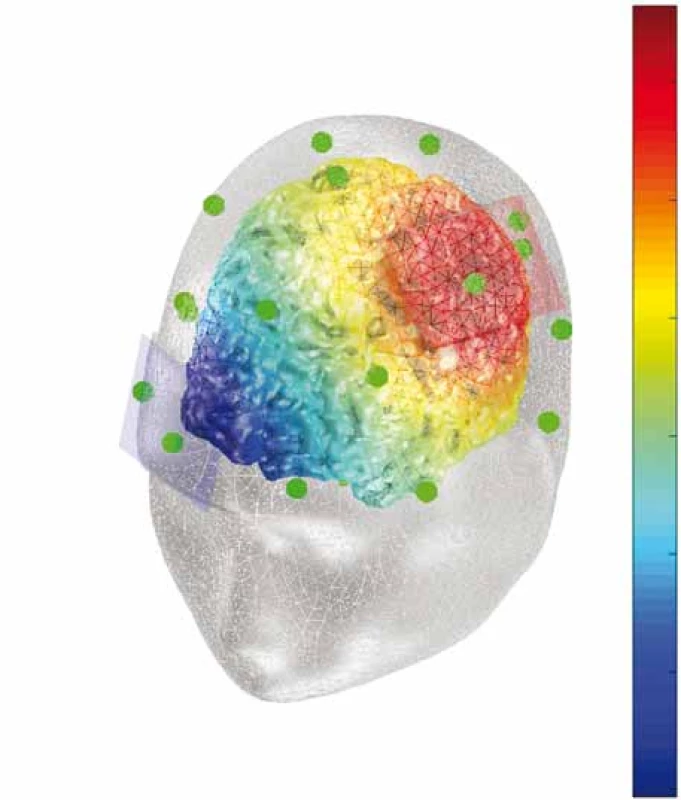
Fig. 7. 10–20 representation of therapeutic protocol for fibromyalgia
treatment. Anode (red) over the left M1 area, cathode (blue)
over the right orbitofrontal area.
Odpověď pacientů je definována zlepšením na vizuální analogové škále (VAS), současná data hovoří se silou doporučení B (tab. 3) ve prospěch anodální stimulace levého motorického kortexu při proudu 2 mA, po dobu 20 min a minimálně pěti aplikací. To vede ke snížení VAS o 14–58 % oproti stavu před stimulací, a to až po dobu 2 měsíců, což prokazatelně zlepšuje i kvalitu života [42]. Potvrdila se také korelace efektu stimulace s glutamátergní transmisí v předním cingulu [43], což odpovídá teorii glutamátergní dysregulace v patofyziologii fibromyalgie [44].
![Souhrn významných recentních studií při užití anody nad levou oblastí M1 a katody nad pravou supraorbitální oblastí při
terapii fibromyalgie a jejich síla důkazu; převzato z Lefaucheur et al [34]. Prokázán učinek na snížení vnímané bolesti a zvýšení
kvality života – síla doporučení B.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/2d65963b5faa63432db40d64da8957db.jpeg)
Sporný je poměr analgetického a antidepresivního efektu stimulace, protože pouze velmi malá část relevantních studií užila objektivizované testové metody depresivního prožívání a spíše spoléhala na sebeposuzovací dotazníky.
Chronická neuropatická bolest
Výzkumy tDCS jsou v této oblasti četné, ale vzhledem k velmi extenzivnímu dělení jednotlivých stavů spojených s bolestí a místy až striktním inkluzivním kritériím nedosahují u většiny z nich dostatečného počtu k vyslovení definitivních terapeutických doporučení.
Přesto po průkazu účinku vysokofrekvenční rTMS v úlevě od neuropatické bolesti [45] byly s velkým optimizmem zintenzivněny snahy v rámci tDCS a je nutno podotknout, že dosavadní výsledky spíše podtrhují rozdílnost těchto metod. Stimulace stejnosměrným proudem v lokalizaci M1 (kontralaterálně k místu bolesti) účinkuje v terapii bolestí dolních končetin, zatímco rTMS napomáhá spíše úlevě od bolesti obličeje a horních končetin. Někteří autoři tento rozdíl připisují rozdílnému působení obou modalit [34], ale v tuto chvíli nejsou k dispozici evidence-based data, která by tuto rozdílnost ozřejmila.
Se silou doporučení C (tab. 4) byl prokázán účinek anodální stimulace M1 v terapii chronické neuropatické bolesti dolních končetin na podkladě léze míšní, a to při užití proudu 2 mA po 20 min o minimálně pěti aplikacích [34]. Nutno podotknout, že některé studie v rámci primární analýzy prokázaly velmi silný efekt shamové stimulace a velmi malý rozdíl oproti stimulaci aktivní [46]. Není k dispozici dostatek dat k vyvození doporučení při periferních lézích, přestože některé studie vychází v tomto ohledu velmi slibně [47].
![Souhrn významných recentních studií při užití anody nad levýou oblastí M1 (či kontralaterálně od lokalizace bolesti) a katody
nad kontralaterální supraorbitální oblastí při terapii chronické neuropatické bolesti dolních končetin při lézích míšních a jejich
síla důkazu – převzato z Lefaucheur et al [34]. Prokázán učinek na snížení vnímané bolesti – síla doporučení C.](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/51bd956b0c1cfcc051e63c9f56401603.jpeg)
Dosavadní studie jsou zatíženy velkým množstvím metodických chyb a bude tedy třeba dalšího výzkumu k lepšímu porozumění této problematice, do té doby bude převažovat rTMS.
Schizofrenie
Bádání v této indikaci je často u pacientů komplikováno přítomností paranoidního nastavení vůči tDCS („elektřině do hlavy“). Výzkumy se zaměřují na dva okruhy symptomů. Těmi jsou perzistující verbálně auditivní halucinace a negativní symptomatika [48].
Úlevu od těchto obtíží by měla poskytnou anodální stimulace levého DLPFC při současné katodální stimulaci pravé temporoparietální junkce [49]. Řada zobrazovacích studií poukazuje na zvýšenou neuronální aktivitu v temporoparietální oblasti u pacientů s perzistujícími verbálně auditivními halucinacemi, přičemž negativní symptomatika je asociována zejména s hypoaktivitou v levém i pravém DLPFC [50].
Protokol o 10 aplikacích trvajících 20 min o proudu 2 mA zaznamenal 3 měsíce trvající ústup persistujících verbálně auditivních halucinací o 31 % (sham stimulace pouze 8 %), zároveň byla zaznamenána signifikantní úleva od negativní symptomatiky v Positive and Negative Syndrome Scale [51]. Jiné týmy měly potíže s replikací těchto výsledků, avšak pokud byl přesně dodržován protokol, byly výsledky alespoň částečně potvrzeny [52]. Pozdější studie užívající obdobný protokol (10 aplikací, 20 min, 2 mA, při anodě nad levým a katodě nad pravým DLPFC) zaznamenala zlepšení ve skóru negativních příznaků o 45,4 %, což bylo signifikantní vůči sham stimulaci [53].
Z výše uvedeného je patrné, že léčba některých příznaků schizofrenie pomocí tDCS je prozatím pouze velice slibnou možností a několik kvalitně provedených studií nás dělí od definitivního potvrzení účinku.
Závislosti a bažení
V rámci studia závislostního chování je DLPFC stálým zdrojem nových poznatků. Ukazuje se totiž, že DLPFC hraje důležitou roli v regulaci a inhibici „reward“ mechanizmu a je u závislých osob dysfunkční [54].
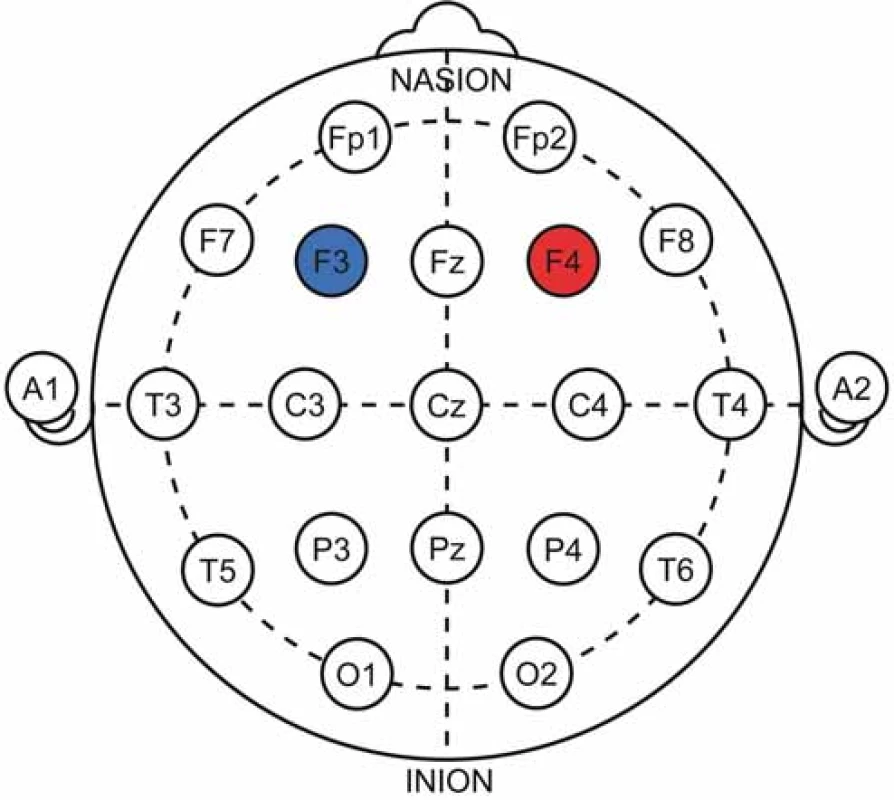
Stimulační protokol spočívá v kombinované anodální stimulaci pravého DLPFC se současnou katodální stimulací levého DLPFC (obr. 8 a 9). U závislosti na alkoholu tento přístup vedl ke zvýšení kvality života a míry abstinence (měřeno půl roku po stimulaci), přesto bažení zůstalo nezměněno [55]. Zajímavé výsledky poskytuje výzkum závislosti na kokainu, kde se podařilo prokázat pozitivní vliv na bažení, efekt však postupně vymizel po 4 týdnech [56], počet aplikací byl poněkud suboptimální (pouze pět). Podobných výsledků dosahuje i výzkum závislosti na tabáku, avšak studie jsou prozatím limitovány.
Fig. 8. Computational model of electric potential (V) during therapy
for craving. Anode over the right dorsolateral prefrontal cortex,
cathode over the left dorsolateral prefrontal cortex.
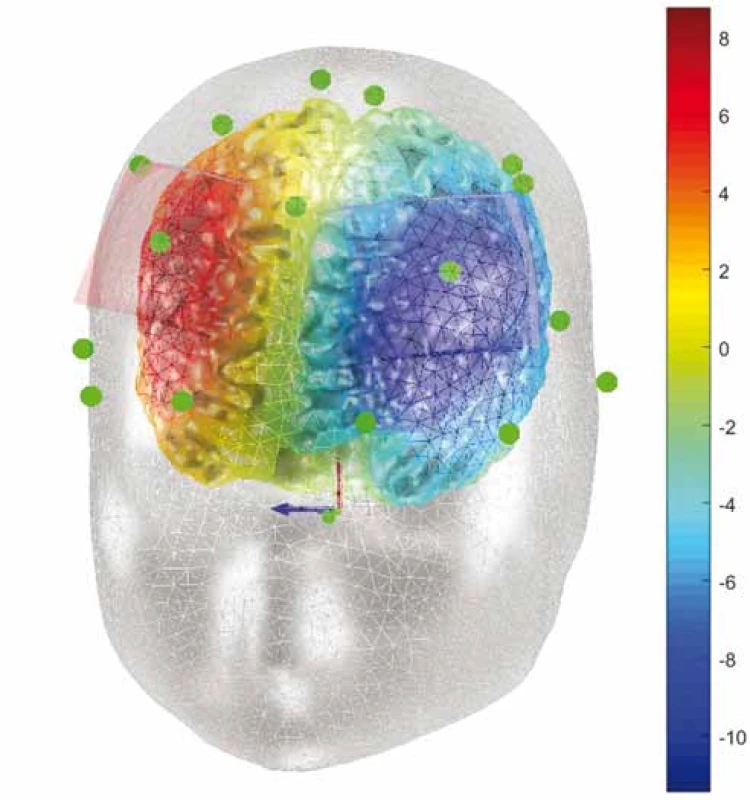
Fig. 9. 10–20 representations of the therapeutic protocol for craving
treatment. Anode (red) over the right dorsolateral prefrontal
cortex, cathode (blue) over the left dorsolateral prefrontal cortex.
Po zhodnocení kvality dostupných zdrojů můžeme efekt tDCS v terapii bažení a závislosti považovat se silou doporučení B za prokázaný [34] (tab. 5).
![Souhrn významných recentních studií při užití anody nad R-DLPFC a katody nad L-DLPFC při terapii cravingu a jejich síla
důkazu – převzato z Lefaucheur et al [34]. tDCS v této indikaci je pravděpodobně efektivní (síla doporučení B).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/7fa9f6e63f9c58d5259febfb69b3f886.jpeg)
Závěr
Transkraniální stimulace stejnosměrným proudem je rychle se rozvíjející neurostimulační metoda, jejíž účinnost je se silou doporučení B prokázána v léčbě nerezistentních depresivních poruch, fibromyalgie a bažení. Předpokládá se, že během několika let bude obdobné doporučení i pro léčbu negativních příznaků schizofrenie, perzistujících verbálně auditivních halucinací a posíleno v léčbě chronické neuropatické bolesti. Aplikace v léčbě dalších onemocnění je předmětem extenzivního výzkumu. Pořizovací náklady jsou oproti jiným modalitám biologické léčby velice nízké, nežádoucí účinky velmi mírné a jedná se proto o potenciálně ideální způsob domácí léčby pacientů s neuropsychiatrickými onemocněními, přestože je třeba nejprve zajistit bezpečné užití mimo nemocniční zařízení dle námitek IFCN (International Federation of Clinical Neurophysiology). Užití metody dosud není v ČR hrazeno z prostředků veřejného zdravotního pojištění (na rozdíl od rTMS či elektrokonvulzivní terapie) a jedná se prozatím o ryze experimentální metodu, což se vzhledem k rostoucímu množství dat o účinnosti může v budoucnu změnit.
Tato práce byla podpořena granty: MZ ČR – RVO VFN 64165; Q27/ LF1; AZV 15-31538A; NPU I (LO1611).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Tadeáš Mareš
Psychiatrická klinika
1. LF UK a VFN
Ke Karlovu 11
128 01 Praha 2
e-mail: tadeas.mares@vfn.cz
Přijato k recenzi: 12. 9. 2018
Přijato do tisku: 7. 1. 2019
Zdroje
1. Wexler A. Recurrent themes in the history of the home use of electrical stimulation: transcranial direct current stimulation (tDCS) and the medical battery (1870-1920). Brain Stimul 2017; 10(2): 187–195. doi: 10.1016/ j.brs.2016.11.081.
2. Albert DJ. The effect of spreading depression on the consolidation of learning. Neuropsychologia 4(1): 49–64. doi: 10.1016/ 0028-3932(66)90020-0.
3. Nitsche MA, Paulus W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J Physiol 2000; 527 (Pt 3): 633–639. doi: 10.1111/ j.1469-7793.2000.t01-1-00633.x.
4. Bindman LJ, Lippold OC, Redfearn JW. Long-lasting changes in the level of the electrical activity of the cerebral cortex produced bypolarizing currents. Nature 1962; 196: 584–585.
5. Anders M, Dvorakova J, Rathova L et al. Efficacy of repetitive transcranial magnetic stimulation for the treatment of refractory chronic tinnitus: a randomized, placebo controlled study. Neuro Endocrinol Lett 2010; 31(2): 238–249.
6. Santarnecchi E, Feurra M, Barneschi F et al. Time course of corticospinal excitability and autonomic function interplay during and following monopolar tDCS. Front Psychiatry 2014; 5: 86. doi: 10.3389/ fpsyt.2014.00086.
7. Nitsche MA, Fricke K, Henschke U et al. Pharmacological modulation of cortical excitability shifts induced by transcranial direct current stimulation in humans. J Physiol 2003; 553(Pt 1): 293–301. doi: 10.1113/ jphy-siol.2003.049916.
8. Stagg CJ, Best JG, Stephenson MC et al. Polarity-sensitive modulation of cortical neurotransmitters by transcranial stimulation. J Neurosci 2009; 29(16): 5202–5206. doi: 10.1523/ JNEUROSCI.4432-08.2009.
9. Lefaucheur JP. Methods of therapeutic cortical stimulation. Neurophysiol Clin 2009; 39(1): 1–14. doi: 10.1016/ j.neucli.2008.11.001.
10. Polanía R, Nitsche MA, Paulus W. Modulating functional connectivity patterns and topological functional organization of the human brain with transcranial direct current stimulation. Hum Brain Mapp 2011; 32(8): 1236–1249. doi: 10.1002/ hbm.21104.
11. Ardolino G, Bossi B, Barbieri S et al. Non-synaptic mechanisms underlie the after-effects of cathodal transcutaneous direct current stimulation of the human brain. J Physiol 2005; 568(Pt 2): 653–663. doi: 10.1113/ jphysiol.2005.088310.
12. Pelletier SJ, Lagacé M, St-amour I et al. The morphological and molecular changes of brain cells exposed to direct current electric field stimulation. Int J Neuropsychopharmacol 2014; 18(5): pii: pyu090. doi: 10.1093/ ijnp/ pyu090.
13. Gellner AK, Reis J, Fritsch B. Glia: a neglected player in non-invasive direct current brain stimulation. Front Cell Neurosci 2016; 10: 188. doi: 10.3389/ fncel. 2016.00188.
14. Ruohonen J, Karhu J. tDCS possibly stimulates glial cells. Clin Neurophysiol 2012; 123(10): 2006–2009. doi: 10.1016/ j.clinph.2012.02.082.
15. Schilling T, Eder C. Ion channel expression in resting and activated microglia of hippocampal slices from juvenile mice. Brain Res 2007; 1186: 21–28. doi: 10.1016/ j.brainres.2007.10.027.
16. Fritsch B, Reis J, Martinowich K et al. Direct current stimulation promotes BDNF-dependent synaptic plasticity: potential implications for motor learning. Neuron 2010; 66(2): 198–204. doi: 10.1016/ j.neuron.2010.03.035.
17. Borgens RB, Blight AR, McGinnis ME. Functional recovery after spinal cord hemisection in guinea pigs: the effects of applied electric fields. J Comp Neurol 1990; 296(4): 634–653. doi: 10.1002/ cne.902960409.
18. Heneka MT, Carson MJ, El khoury J et al. Neuroinflammation in Alzheimer‘s disease. Lancet Neurol 2015; 14(4): 388–405. doi: 10.1016/ S1474-4422(15)70016-5.
19. Albrecht J, Šmotek M, Anders M. Soudobé možnosti využití transkraniální stimulace stejnosměrným proudem v léčbě duševních poruch. Čes a slov Psychiatr 2014; 110(2): 88–95.
20. Rostami M, Golesorkhi M, Ekhtiari H. Methodological dimensions of transcranial brain stimulation with the electrical current in human. Basic Clin Neurosci 2013; 4(3): 190–208.
21. Miranda PC, Lomarev M, Hallett M. Modeling the current distribution during transcranial direct current stimulation. Clin Neurophysiol 2006; 117(7): 1623–1629. doi: 10.1016/ j.clinph.2006.04.009.
22. Datta A, Bansal V, Diaz J et al. Gyri-precise head model of transcranial direct current stimulation: improv-ed spatial focality using a ring electrode versus conventional rectangular pad. Brain Stimul 2009; 2(4): 201–207. doi: 10.1016/ j.brs.2009.03.005.
23. Woods AJ, Bryant V, Sacchetti D et al. Effects of electrode drift in transcranial direct current stimulation. Brain Stimul 2015; 8(3): 515–519. doi: 10.1016/ j.brs.2014.12.007.
24. Albrecht J, Kališová L, Mareš T et al. Are we familiar with the mechanism of action of electroconvulsive therapy? Čes a slov Psychiatr 2017; 113(6): 268–277.
25. Buday J, Albrecht J, Mareš T et al. Transient aphasia after right unilateral ultrabrief electroconvulsive therapy: a case report. Brain Stimul 2018; 11(5): 1203–1204. doi: 10.1016/ j.brs.2018.06.007.
26. Horvath JC, Carter O, Forte JD. Transcranial direct current stimulation: five important issues we aren‘t discussing (but probably should be). Front Syst Neurosci 2014; 8: 2. doi: 10.3389/ fnsys.2014.00002.
27. Dasilva AF, Volz MS, Bikson M et al. Electrode positioning and montage in transcranial direct current stimulation. J Vis Exp 2011; (51): pii: 2744. doi: 10.3791/ 2744.
28. Lagopoulos J, Degabriele R. Feeling the heat: the electrode–skin interface during DCS. Acta Neuropsychiatr 2008; 20: 98–100. doi: 10.1111/ j.1601-5215.2008. 00274.x.
29. Thair H, Holloway AL, Newport R et al. Transcranial direct current stimulation (tDCS): a beginner’s guide for design and implementation. Front Neurosci 2017; 11: 641. doi: 10.3389/ fnins.2017.00641.
30. Batsikadze G, Moliadze V, Paulus W et al. Partiallynon-linear stimulation intensity-dependent effects of direct current stimulation on motor cortex excitability in humans. J Physiol 2013; 591(Pt 7): 1987–2000. doi: 10.1113/ jphysiol.2012.249730.
31. Iyer MB, Mattu U, Grafman JJ et al. Safety and cognitiveeffect of frontal DC brain polarization in healthy individuals. Neurology 2005; 64(5): 872–875. doi: 10.1212/ 01.WNL.0000152986.07469.E9
32. Lee C, Jung YJ, Lee SJ et al. COMETS2: an advanced MATLAB toolbox for the numerical analysis of electric fields generated by transcranial direct current stimulation. J Neurosci Methods 2017; 277: 56–62. doi: 10.1016/ j.jneumeth.2016.12.008.
33. Brunoni AR, Amadera J, Berbel B et al. A systematic review on reporting and assessment of adverse effects associated with transcranial direct current stimulation. Int J Neuropsychopharmacol 2011; 14(8): 1133–1145. doi: 10.1017/ S1461145710001690.
34. Lefaucheur JP, Antal A, Ayache SS et al. Evidence-based guidelines on the therapeutic use of transcranial direct current stimulation (tDCS). Clin Neurophysiol 2017; 128(1): 56–92. doi: 10.1016/ j.clinph.2016.10.087.
35. Čerešňáková S, Mareš T, Albrecht J et al. Je transkraniální stimulace stejnosměrným proudem novou nadějí v léčbě mentální anorexie? Čes a slov Psychiatr 2018; 114(4): 164–169.
36. Albrecht J, Mareš T, Jaššová K et al. Stimulation parameters of repetitive transcranial magnetic stimulation in the treatment of neuropsychiatric disorders – protocols and localisation. Čes a slov Psychiat 2017; 113(4): 158–165.
37. Giordano J, Bikson M, Kappenman ES et al. Mechanisms and effects of transcranial direct current stimulation. Dose Response 2017; 15(1): 1559325816685467. doi: 10.1177/ 1559325816685467.
38. Brunoni AR, Valiengo L, Baccaro A et al. The sertraline vs. electrical current therapy for treating depression clinical study: results from a factorial, randomized, controlled trial. JAMA Psychiatry 2013; 70(4): 383–391. doi: 10.1001/ 2013.jamapsychiatry.32.
39. Bikson M, Rahman A, Datta A. Computational models of transcranial direct current stimulation. Clin EEG Neurosci 2012; 43(3): 176–183. doi: 10.1177/ 1550059412445138.
40. Clauw DJ. Fibromyalgia: a clinical review. JAMA 2014; 311(15): 1547–1555. doi: 10.1001/ jama.2014.3266.
41. García-Larrea L, Peyron R, Mertens P et al. Electrical stimulation of motor cortex for pain control: a combined PET-scan and electrophysiological study. Pain 1999; 83(2): 259–273. doi: 10.1016/ S0304-3959(99)00114-1.
42. Valle A, Roizenblatt S, Botte S et al. Efficacy of anodal transcranial direct current stimulation (tDCS) for the treatment of fibromyalgia: results of a randomized, sham-controlled longitudinal clinical trial. J Pain Manag 2009; 2(3): 353–361.
43. Foerster BR, Nascimento TD, Deboer M et al. Excitatory and inhibitory brain metabolites as targets of motor cortex transcranial direct current stimulation therapy and predictors of its efficacy in fibromyalgia. Arthritis Rheumatol 2015; 67(2): 576–581. doi: 10.1002/ art.38945.
44. Pyke TL, Osmotherly PG, Baines S. Measuring glutamate levels in the brains of fibromyalgia patients and a potential role for glutamate in the pathophysiology of fibromyalgia symptoms: a systematic review. Clin J Pain 2017; 33(10): 944–954. doi: 10.1097/ AJP.0000000000000474.
45. Lefaucheur JP, André-Obadia N, Antal A et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS). Clin Neurophysiol 2014; 125(11): 2150–2206. doi: 10.1016/ j.clinph.2014.05.021.
46. Souto G, Borges IC, Goes BT et al. Effects of tDCS-induced motor cortex modulation on pain in HTLV-1: a blind randomized clinical trial. Clin J Pain 2014; 30(9): 809–815. doi: 10.1097/ AJP.0000000000000037.
47. Kim YJ, Ku J, Kim HJ et al. Randomized, sham controlled trial of transcranial direct current stimulation for painful diabetic polyneuropathy. Ann Rehabil Med 2013; 37(6): 766–776. doi: 10.5535/ arm.2013.37.6.766.
48. Voráčková V, Albrecht J, Anders M. Transcranial direct current stimulation and cognitive deficits in schizophrenia. Čes a slov Psychiatr 2015; 111(6): 290–294.
49. Mondino M, Jardri R, Suaud-Chagny MF et al. Effects of fronto-temporal transcranial direct current stimulation on auditory verbal hallucinations and resting-state functional connectivity of the left temporo-parietal junction in patients with schizophrenia. Schizophr Bull 2016; 42(2): 318–326. doi: 10.1093/ schbul/ sbv114.
50. Hugdahl K, Løberg EM, Nygård M. Left temporal lobe structural and functional abnormality underlying auditory hallucinations in schizophrenia. Front Neurol 2009; 3(1): 34–45. doi: 10.3389/ neuro.01.001.2009.
51. Brunelin J, Mondino M, Gassab L et al. Examining transcranial direct-current stimulation (tDCS) as a treatment for hallucinations in schizophrenia. Am J Psychiatry 2012; 169(7): 719–724. doi: 10.1176/ appi.ajp.2012.11071091.
52. Fröhlich F, Burrello TN, Mellin JM et al. Exploratory study of once-daily transcranial direct current stimulation (tDCS) as a treatment for auditory hallucinations in schizophrenia. Eur Psychiatry 2016; 33: 54–60. doi: 10.1016/ j.eurpsy.2015.11.005.
53. Gomes JS, Shiozawa P, Dias ÁM et al. Left dorsolateral prefrontal cortex anodal tDCS effects on negative symptoms in schizophrenia. Brain Stimul 2015; 8(5): 989–991. doi: 10.1016/ j.brs.2015.07.033.
54. Loftus AM, Yalcin O, Baughman FD et al. The impact of transcranial direct current stimulation on inhibitory control in young adults. Brain Behav 2015; 5(5): e00332. doi: 10.1002/ brb3.332.
55. Klauss J, Penido Pinheiro LC, Silva Merlo BL et al. A randomized controlled trial of targeted prefrontal cortex modulation with tDCS in patients with alcohol dependence. Int J Neuropsychopharmacol 2014; 17(11): 1793–1803. doi: 10.1017/ S1461145714000984.
56. Batista EK, Klauss J, Fregni F et al. A randomized placebo-controlled trial of targeted prefrontal cortex modulation with bilateral tDCS in patients with crack-cocaine dependence. Int J Neuropsychopharmacol 2015; 18(12). doi: 10.1093/ ijnp/ pyv066.
57. Miller M. Common issues and installation errors-part II; HPAC Magazine 2018. [online]. Available form URL: https:/ / www.hpacmag.com/ features/ sizing-piping-controlled-device/ .
Štítky
Detská neurológia Neurochirurgia NeurológiaČlánok vyšiel v časopise
Česká a slovenská neurologie a neurochirurgie

2019 Číslo 1
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Lehká mozková poranění – konsenzuální odborné stanovisko České neurologické společnosti ČLS JEP
- Chronický subdurální hematom
- Oligoklonální IgG a volné lehké řetězce – srovnání izoelektrické fokusace v agarózovém a polyakrylamidovém gelu
- Ketogenní dieta – účinná nefarmakologická léčba dětské a adolescentní epilepsie
