-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Studijní protokol – robotická terapie chůze pomocí přístroje Lokomat Pro FreeD u pacientů v subakutní fázi ischemické cévní mozkové příhody
Study protocol – robot-assisted gait therapy using Lokomat Pro FreeD in patients in the subacute phase of ischemic stroke
Aim: Robot-assisted gait training represents a modern concept of neurorehabilitation in stroke patients. Our randomized interventional study aims to assess the additive effect of robot-assisted gait rehabilitation in subacute ischemic stroke patients and to compare its effect with patients undergoing standard institutional protocol-defined rehabilitation. The primary endpoint is the functional ambulation category. The secondary endpoints include gait time parameters (10 Meter Walk Test, Timed Up and Go), changes in body composition, modified Rankin scale, Barthel index, Berg balance scale, and a questionnaire Falls Efficacy Scale – International. Radiological sub-study evaluates the dynamics of brain structural changes and atrophy using MRI. Methods: This is a prospective randomized open monocentric study enrolling patients within 6 weeks from the onset of the firs ischemic stroke. Both groups are treated with conventional rehabilitation (physiotherapy, occupational therapy and mechanotherapy) for 60 min 5 times a week, a total of 15 times for 3 to 4 weeks (a total of 1,200 min). The Lokomat group undergoes robot-assisted gait training using the interventional exoskeleton for 20-50 minutes 5 times a week for a total of 15 times for 3 to 4 weeks (a total of 1,800 min). Data collection takes place over four time periods: pre-intervention (T0), mid-intervention (T1; day 8), post-rehabilitation assessment (T2; day 15), and 3 months post-intervention (T3).
Keywords:
gait – subacute stroke – Exoskeleton – Lokomat – neurorehabilitation
Autori: I. Fiedorová 1,2; I. Chmelová 1; P. Hanzlíková 3; P. Eliáš 3; D. Šalounová 4; M. Bar 5; R. Líčeník 6,7; O. Volný 5,6
Pôsobisko autorov: Klinika rehabilitace a tělovýchovného, lékařství FN Ostrava 1; Ústav epidemiologie a hygieny, LF OU, Ostrava 2; Ústav radiodiagnostický, FN Ostrava 3; Katedra matematických metod v ekonomice, Ekonomická fakulta, VŠB – Technická univerzita Ostrava 4; Neurologická klinika, LF OU a FN Ostrava 5; České národní centrum Evidence-, -Based Healthcare a Knowledge, Translation, LF MU, Brno 6; North West Anglia NHS Foundation, Trust, Peterborough City Hospital, Department of neurology and Stroke, Peterborough, Velká Británie 7
Vyšlo v časopise: Cesk Slov Neurol N 2021; 84/117(4): 361-366
Kategória: Původní práce
doi: https://doi.org/10.48095/cccsnn2021361Súhrn
Cíl: Roboticky asistovaný trénink chůze představuje moderní koncept neurorehabilitace u pacientů po CMP. Cílem naší randomizované intervenční studie je zhodnotit přídatný efekt robotické rehabilitace chůze u pacientů v subakutní fázi ischemické CMP a porovnání s kohortou pacientů absolvujících standardní (protokolem definovanou) ústavní rehabilitaci. Primárním sledovaným parametrem je úroveň funkční kategorizace chůze. Sekundárními sledovanými parametry jsou časové parametry chůze (10metrový test chůze, Timed Up and Go), změny tělesného složení, modifikovaná Rankinova škála, index Barthelové, balanční škála Bergové a dotazník Subjektivní hodnocení strachu z pádů. Radiologická substudie sleduje dynamiku vývoje strukturálních změn a atrofie mozkové tkáně pomocí MR. Metody: Prospektivní randomizovaná otevřená monocentrická studie zařazující pacienty do 6 týdnů od první ischemické CMP. Konvenční rehabilitací (fyzioterapie, ergoterapie a mechanoterapie) jsou léčeny obě skupiny po dobu 60 min 5× týdně, celkem 15× po dobu 3–4 týdnů (celkem 1 200 min). Intervenční skupina navíc absolvuje roboticky asistovaný trénink chůze pomocí přístroje Lokomat 20–50 min 5× týdně, celkem 15× po dobu 3–4 týdnů (celkem 1 800 min). Sběr dat probíhá ve čtyřech časových obdobích: před zahájením intervence (T0), v polovině intervence (T1; 8. den), hodnocení po ukončení rehabilitace (T2; 15. den) a 3 měsíce po ukončení (T3).
Klíčová slova:
chůze – subakutní mozková ischemie – exoskelet – Lokomat – neurorehabilitace
Úvod
Nezávislá chůze a dosažení maximální možné pohybové samostatnosti jsou hlavní cíle moderní neurorehabilitace po CMP [1–4]. Předpoklad úspěšnosti terapie chůze je v souladu s principy moderního neurorehabilitačního přístupu cíleného na podporu plasticity mozku. Hlavními zásadami jsou motivace pacienta, včasné zahájení, multisenzorická stimulace, dostatečná intenzita a trvání terapie, načasování a cílená, úkolem orientovaná činnost [2,3,5]. V tomto kontextu se roboticky asistovaný trénink chůze (robot-assisted gait training; RAGT) u pacientů po CMP jeví jako slibná pomocná technologie, která vede k neuroplastickým změnám a zlepšení chůze [5–7]. Provedené klinické studie vykazují značné rozdíly mezi výsledky výzkumu a využitím RAGT v klinické praxi [8–11]. Dosud neexistují konkrétní doporučení pro rehabilitaci v rámci jednotlivých časových období po prodělané CMP (akutní, subakutní, chronické) ani v rámci návrhů týkajících se vlastní robotické intervence, jako jsou její načasování, intenzita a frekvence RAGT. I přes tyto mezery v poznání (tzv. knowledge gaps) je využití RAGT uvedeno ve světových klinických doporučených postupech [3,8,12]. V ČR dosud není RAGT v doporučených rehabilitačních postupech zařazen.
Závěry z metaanalýz Mehrholze et al [7,13,14] hodnotící efekt RAGT v kombinaci s konvenční fyzioterapií prokazují větší pravděpodobnost dosažení nezávislé chůze, zejména u pacientů nechodících následkem CMP v období do 6 měsíců od vzniku CMP [7,13,14]. Současně je doporučeno zařazení RAGT do rehabilitační praxe, ale i nutnost budoucího studia intenzity, počtu opakování a stupňování tréninku chůze [13]. Metaanalýza autorů Moucheboeuf et al [15] vysvětluje pozorovanou heterogenitu výsledků v předchozích metaanalýzách, které byly podhodnoceny v souvislosti s výběrem vhodných pacientů k RAGT (chodící, nechodící). Mimo jiné definuje také konkrétní hodnoty rehabilitačních programů, které by měly být prováděny v minimální délce trvání 1 200 min [15]. Z dostupných metaanalýz vyplývají další praktická doporučení k výběru sledovaných parametrů a také k volbě vhodného robotického systému pro RAGT, který je podmíněn mimo jiné úrovní mobility jedince [6,7,13,15].
Předchozí studie u pacientů v subakutním stadiu CMP zaměřené na RAGT využívající Lokomat (Hocoma, Volketswil, Švýcarsko) sledovaly nejčastěji následující primární parametry: rychlost chůze, funkční kategorie chůze (Functional Ambulation Category; FAC), 10 Meter Walk Test (10MWT), 6minute Walk Test (6MWT), Timed Up and Go (TUG); sekundární výstupy jiné než chůze byly: Balanční škála Bergové (Berg Balance Scale, BBS), modifikovaná Rankinova škála (mRS), Barthel Index (BI), Tinetti škála chůze, Functional Independence Measure (FIM) a dotazníky kvality života [11,15,16]. Limitacemi dostupných randomizovaných studií byly především nízký počet zařazených subjektů, metodické nedostatky a s tím spojená rizika bias [7]. Pro potřeby naší pragmatické, na pacienta orientované studie je jako primární sledovaný parametr vybrána validovaná škála FAC, která objektivizuje, zda je pacient schopen samostatné, na okolí nezávislé chůze, či nikoliv [17,18]. Sekundární výstupy v naší studii objektivizují úroveň statické a dynamické stability během chůze či provádění aktivit denního života (activities of daily living; ADL), hodnocení tělesného složení, sledování pádů a vzniku tzv. fenoménu strachu z pádů [19–21]. Důvodem sledování parametrů MR je zpřesnění lokalizace a rozsahu ischemie (objem ischemie) s následnou monitorací dynamiky vývoje ischemických změn v čase a objektivizaci mozkové atrofie.
Vzhledem k nedostatečné evidenci týkající se aditivního účinku robotické rehabilitace chůze jsme se rozhodli sledovat aditivní účinek RAGT [22–24]. V tomto protokolu stručně popisujeme metodiku probíhající prospektivní otevřené monocentrické randomizované studie.
Metodika
Prospektivní otevřená randomizovaná studie je zaměřena na pacienty po první ischemické CMP do 6 týdnů od iktu v přední nebo zadní mozkové cirkulaci, kteří jsou po akutní fázi hospitalizováni na Klinice rehabilitace a tělovýchovného lékařství Fakultní nemocnice Ostrava (FNO); Studijní protokolje prezentován na obr. 1. Způsobilost pacientů pro zařazení do studie (tzv. eligibilita) je posuzována konsenzem neurologa a rehabilitačního lékaře během hospitalizace na iktové jednotce Neurologické kliniky FNO.
Obr. 1. Studijní protokol.
10MWT – 10 Meter Walk Test; BBS – Berg Balance Scale; BI – index Barthelové; FAC – Functional Ambulation Category;
FES-I – The Falls Efficacy Scale – International; mRS – modifikovaná Rankinova škála; RHB – rehabilitace; TUG – Timed Up and Go
Fig. 1. Study protocol.
10MWT – 10 Meter Walk Test; BBS – Berg Balance Scale; BI – Barthel Index; FAC – Functional Ambulation Category;
FES-I – The Falls Efficacy Scale – International; mRS – modified Rankin Scale; RHB – rehabilitation; TUG – Timed Up and Go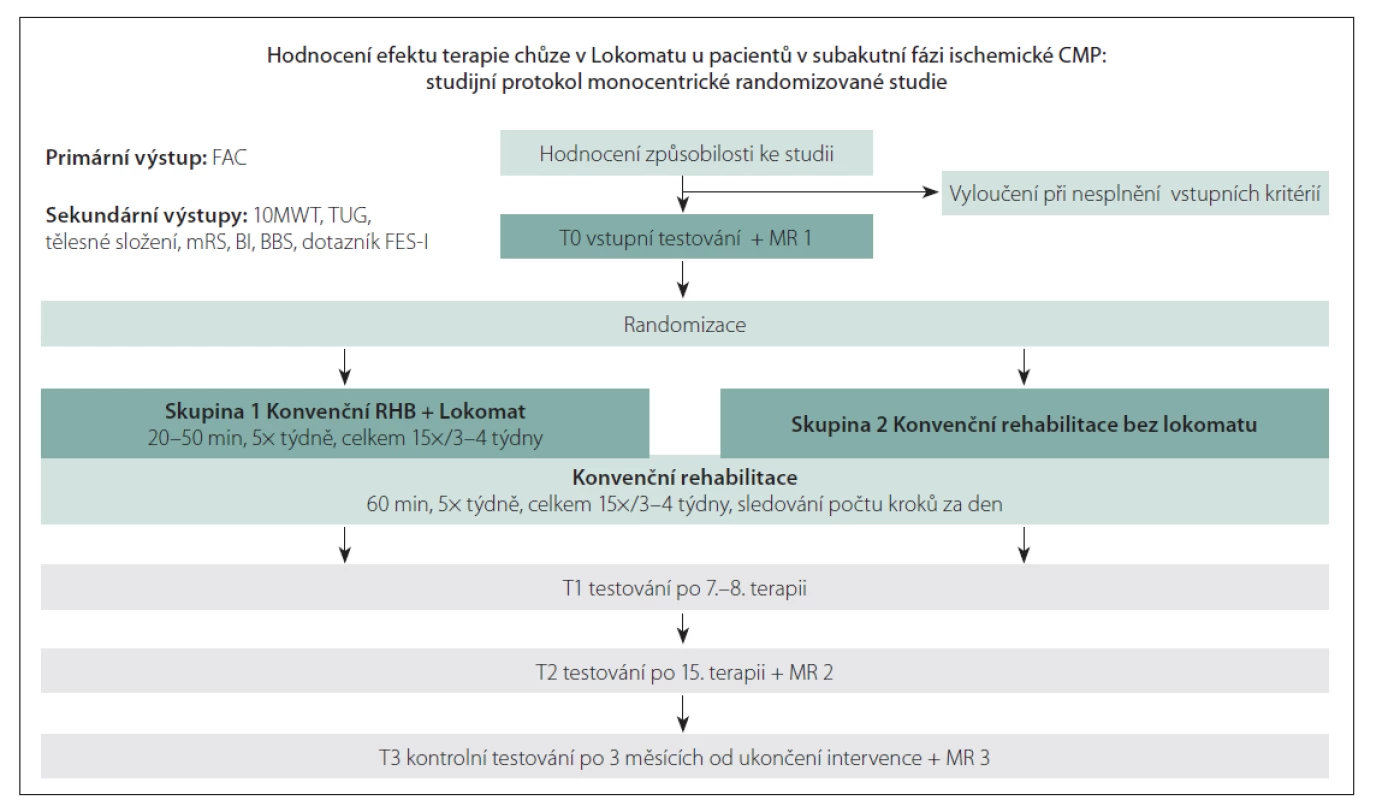
Kritéria pro zařazení: ≤ 6 týdnů od vzniku CMP, věk > 18 let, hodnota časné mRS 2–4 (premorbidní mRS 0–1), tolerance vertikály více než 15 min, FAC 0–3 (premorbidní FAC 5, tzn. samostatná chůze bez kompenzační pomůcky či dopomoci).
Vylučovací kritéria: anamnéza předchozí CMP či jiného onemocnění mozku (stav po úrazu mozku či páteře, progresivní neurologické onemocnění, např. RS či jiné diagnostikované neurodegenerativní onemocnění), interní (osteoporóza, kardiovaskulární nestabilita, pokročilý stupeň kardiovaskulárního selhání, obtížně kompenzovaný diabetes mellitus s neurologickými komplikacemi), onkologická či chirurgická komorbidita znemožňující dlouhodobou rehabilitaci či způsobující chronickou anebo progredující poruchu chůze, omezená spolupráce, účast v jiné intervenční rehabilitační studii, porušená integrita kůže v oblasti dolního trupu a končetin, intolerance vertikály do 15 min, limitace dané výrobcem přístroje Lokomat Pro FreeD.
S ohledem na pilotní charakter studie je soubor stanoven na 60 pacientů (30 pacientů/rameno) splňujících vstupní kritéria. Pro dosažení dostatečné statistické síly je v plánu zařazení minimálně 100 pacientů, tzn. 50 pacientů/rameno [15].
Randomizace: Pacienti jsou randomizován do dvou skupin: Skupina 1 – Intervence konvenční rehabilitace plus Lokomat (Lokomat) a Skupina 2 – Konvenční rehabilitace bez Lokomatu (RHB). Je použita metoda tzv. stratifikované randomizace, aby byl minimalizován bias způsobený rozdílnou funkční úrovní mobility před zahájením intervence. Jednotlivá strata jsou tedy homogenní z hlediska distribuce škály FAC. Randomizační tabulky jsou generovány pomocí softwaru MedCalc, verze 14.12.0 (MedCalc Software Ltd, Ostend, Belgie) (Random groups). Tabulka A náhodně alokuje terapii pacientům se vstupní úrovní mobility FAC 0–1, ev. mRS 4, tabulka B pacientům se vstupní úrovní mobility FAC 2–3, ev. mRS 2–3, a to podle pořadí vstupu pacienta do studie.
Intervence
Protokol konvenční RHB + Lokomat
Pacienti ve Skupině Lokomat absolvují shodný protokol konvenční rehabilitace jako Skupina RHB a navíc terapii v Lokomatu 20–50 min 5× týdně, celkem 15× po dobu hospitalizace, celková časová dotace pro tuto skupinu činí 1 800 min. Studie je realizována na přístroji Lokomat s modulem Pro FreeD (Volketswil, Hocoma, Švýcarsko). Předností zařízení jsou počítačem řízené ortézy umožňující asistovanou chůzi na běžeckém pásu. Dolní končetiny (DKK) jsou vedeny na bázi fyziologického vzorce chůze a nabízí možnost dílčího odlehčení hmotnosti a také zacílení terapie na jednotlivé segmenty DKK (kyčelní a kolenní kloub) dle tíže deficitu. Modul Pro FreeD zajišťující pohyb pánve umožňuje fyziologickou svalovou aktivitu trupu a kyčelních kloubů se snížením kompenzačních pohybů během chůze [25]. Terapii provádí pouze proškolený fyzioterapeut, který je zodpovědný za bezpečnou a kvalitní chůzi po celou dobu tréninku, upravuje vzorec chůze za účelem dosažení co nejlepšího aferentního vstupu a co nejvěrnější reprodukce fyziologické chůze pro každého pacienta, mj. se lze cíleně zaměřit na opěrnou a fázickou funkci DKK dle aktuálního klinického nálezu. Každý trénink je prováděn ve třístupňovém procesu – bezpečná chůze, fyziologická chůze a chůze zaměřená na cíl (stimulace). Tréninkový program má 3 části (1.–3. týden). Terapeut postupuje podle programu (tab. 1), který splňuje zásady tzv. progresivního tréninku s postupným navyšováním času, rychlosti a počtu kroků, snížením odlehčení tělesné hmotnosti a korekce vodicí síly [26]. Parametry jsou neustále přizpůsobovány schopnostem, potřebám i toleranci pacienta. Chůze je možná v rychlosti o rozsahu 0,5–2,5 km/h. Hodnoty každé tréninkové jednotky jsou automaticky evidovány softwarem Lokomatu a ukládány pro potřeby dalších analýz.
Tab. 1. Tréninkový program v přístroji Lokomat. 
Protokol konvenční rehabilitace
Konvenční rehabilitace sestává z fyzioterapie, ergoterapie a mechanoterapie. Všechny uvedené terapeutické přístupy jsou individuální a respektují aktuální klinický stav pacienta po CMP. Terapie je zaměřena na zvyšování svalové síly, zlepšení posturální kontroly funkční mobility, stability, koordinace a na chůzi. Fyzioterapii a ergoterapii provádějí pracovníci proškolení v oblasti konceptů na neurofyziologickém podkladě (Bobath koncept, proprioceptivní neuromuskulární facilitace, dynamická neuromuskulární stabilizace). Standardně probíhá terapie 5 dní v týdnu, ergoterapie v rozsahu 30–45 min/den, fyzioterapie 30–60 min/den, mechanoterapie 20–30 min/den, počet opakování 1x za dobu hospitalizace v celkovém čase minimálně 1 200 minut (3–4 týdny).
Skupina bez Lokomatu absolvuje pouze konvenční formu rehabilitace, která je v kompetenci fyzioterapeuta a ergoterapeuta. Časová dotace terapie chůze nesmí překročit celkovou časovou dotaci 1 800 min za období 15 dnů terapie. Každodenní pohybová aktivita je u všech jedinců snímána smart systémem (Mi Smart band 4, Xiaomi, Peking, Čína) za účelem motivace pacienta k denní pohybové aktivitě a sledování změn v hodnotách aktivity v průběhu rehabilitace po dobu intervence. Evidence hodnot se provádí 1x za 24 h a je ukládána do anonymizované databáze.
Po dokončení intervence na rehabilitační klinice protokol studie neumožňuje RAGT v následné péči po dobu 3 měsíců. Pacient je informován a je proveden záznam do propouštěcí zprávy, je dále sledován stran navazují rehabilitace v rámci následujících kategorií:
1. Po propuštění z lůžkové rehabilitace již neprobíhá žádná následná ambulantní rehabilitace.
2. Ambulantní rehabilitace.
3. Rehabilitace za pobytu v jiném rehabilitačním zařízení v trvání ≤ 6 týdnů,
4. Rehabilitace za pobytu v jiném rehabilitačním zařízení v trvání > 6 týdnů.
Sledované parametry
Vstupně (T0 – před intervencí) jsou sbírány demografické charakteristiky: pohlaví, věk, výška, hmotnost, vstupní neurologický deficit hodnocený pomocí škály NIHSS (National Institutes of Health Stroke Scale), lokalizace ischemie, způsob terapie CMP (rekanalizační léčba, konzervativní terapie), přidružená interní a chirurgická onemocnění. Ve vztahu ke sportovní anamnéze zaznamenáváme aktivitu (0 – nikdy nesportoval, 1 – sportoval do dospělosti, 2 – sportoval dosud, 3 – nesportuje již více než 1 rok).
Primární sledovaný parametr: FAC po 3 měsících od dokončení intervence.
Sekundární sledované parametry: časové parametry chůze (10MWT, TUG); změny tělesného složení (tělesná hmotnost, body mass index, sarkopenický index, procentuální zastoupení tukové tkáně, kosterního svalstva celkově, na trupu a jednotlivých končetinách), mRS, BI, BBS, dotazník české verze The Falls Efficacy Scale – International (FES-I).
Samostatnou podstudií je sledování radiologických parametrů vývoje ischemických změn. MR je prováděna podle definovaného studijního protokolu (viz níže).
Následující parametry (FAC, 10MWT, TUG, tělesné složení, mRS, BI, BBS) jsou testovány fyzioterapeutem a ergoterapeutem nezaslepeně ve čtyřech časových obdobích: vstupní testování (T0), po absolvování 7.–8. terapie (T1), postintervenční testování po 15. te - rapii (T2) a kontrolní vyšetření po 3 měsících po intervenci (T3). Na úrovni T3 fyzioterapeut vyplňuje s pacientem dotazník FES-I, jehož součástí je také počet pádů za sledované období.
MR mozku je provedena v obdobích T0, T2 a T3 (obr. 1).
Poznámky k jednotlivým testům
Funkční kategorie chůze je hodnocena pozorováním. Škála FAC (rozsah škály je 0–5) je hodnocena pozorováním: 0 – není schopen chůze nebo potřebuje pomoc dvou a více osob; 1 – potřebuje dopomoc s přenosem váhy a manuálním kontaktem 1–2 osob; 2 – schopen chůze s jednou osobou, vyžaduje intermitentní či kontinuální asistenci při přenášení váhy nebo koordinaci; 3 – chůze s pomůckou a supervizí; 4 – chodící samostatně, nezvládá schody a šikmé plochy; 5 – samostatná chůze po jakémkoliv povrchu vč. schodů [17,18].
Měření 10MWT a TUG absolvuje pacient s dohledem testujícího a instrukcí rychlé a bezpečné chůze. Je evidován medián ze třech pokusů. V obou testech lze použít kompenzační pomůcky.
Tělesné složení je měřeno metodou bioelektrické impedance na multifrekvenčním analyzátoru Tanita MC-780 MA (Tanita Corporation, Tokyo, Japonsko) se softwarem GMON Pro. Analyzátor splňuje evropské normy pro zdravotnictví Medical Device Directive 93/42/EEC a pro váhy Non Automatic Weighting Instruments European Directive 90/384/ EEC, které jsou v ČR dle zákona č. 268/2014 Sb., o zdravotnických prostředcích, č. 326/2002 Sb., Nařízení vlády, kterým se stanoví technické požadavky na váhy s neautomatickou činností, třída III, úředně ověřeny. Sledované hodnoty: tělesná hmotnost (kg), sarkopenický index (kg/m2), množství tukové a svalové hmoty (kg a procenta) celkově a na jednotlivých segmentech těla (trup, pravostranné a levostranné horní a dolní končetiny).
Škála mRS rámcově hodnotí funkční nezávislost pacienta v denním životě (0–6 : 0 – žádné symptomy; 1 – lehký deficit následkem CMP, zvládá všechny aktivity jako před CMP; 2 – není schopen zvládnout všechny předchozí aktivity, je plně soběstačný bez cizí pomoci; 3 – vyžaduje pomoc při některých aktivitách, schopen chůze bez pomoci druhé osoby; 4 – neschopen bez cizí pomoci zvládnout své tělesné potřeby; 5 – upoután na lůžko, vyžaduje trvalou péči; 6 – smrt).
Index Barthelové posuzuje soběstačnost z hlediska zvládání aktivit denního života v 10 položkách. Kategorizace podle bodového rozpětí: 0–40 nesoběstačný, 45–60 středně nesoběstačný, 65–95 mírně nesoběstačný, 100 soběstačný.
Berg Balance Scale objektivizuje balanční funkce ve 14 úkolech. Hodnotí míru rizika možného pádu v bodových intervalech: 0–20 vysoké, 21–40 střední, 41–56 nízké riziko pádu [27].
K identifikaci míry strachu z pádu používáme validovanou českou verzi dotazníku FES-I [28]. Dotazník je hodnocen po 3 měsících od dokončení intervence. Intervalové rozdělení určuje míru subjektivní obavy z možného pádu při provádění ADL: 16–19 nízké, 20–27 střední, 28–64 vysoké obavy.
V průběhu studie jsou dále sledovány: nežádoucí účinky intervence Lokomat, předčasné ukončení studie a důvod ukončení, úmrtí v souvislosti se studií anebo nesouvisející se studií.
Radiologické parametry
Vyšetření mozku MR je prováděno na přístroji Magnetom Avanto (Siemens, Mnichov, Německo) 1,5 T, SW verze Syngo B 19 : 1. měření je provedeno do 7 dnů od vzniku příznaků CMP k objektivizaci akutních ischemických změn a lokalizaci CMP, 2. měření je provedeno po ukončení intervence, resp. fyzioterapie a sledování je ukončeno 3. měřením po 3 měsících. Vyšetření probíhají na identickém přístroji, s identickým protokolem. MR je hodnocena jedním zkušeným neuroradiologem zaslepeným k alokaci pacienta. Hlavním cílem MR podstudie je objektivizovat vývoj ischemických změn v čase a sledovat vývoj atrofie.
Protokol vyšetření MR
1. sekvence DWI v axiální rovině (difuzí vážený obraz s postupně stoupající hodnotou b od 0 po nejvyšší hodnotu b 1 000) vč. ADC map (apparent diffusion coefficient) sloužící k objektivizaci rozsahu akutní ischemie;
2. T2 vážený obraz s potlačením signálu mozkomíšního moku v axiální rovině – sekvence FLAIR (fluid attenuated inversion recovery);
3. sekvence SWI (susceptibilně vážené obrazy) k detekci přítomnosti rozpadových produktů krve;
4. T2 relaxometrie axiálně v místě zjištěné akutní ischemie.
Technické parametry vyšetření MR jsou uvedeny v tab. 2. Získaná data budou využita k volumometrickým analýzám. Data z T2 relaxometrie a z DWI budou po ukončení sledování kvantifikována a umožní statistickou komparaci jednotlivých subjektů ve spolupráci s Fakultou informatiky Vysoké školy báňské (VŠB – TUO).
Tab. 2. Protokol vyšetření MR. 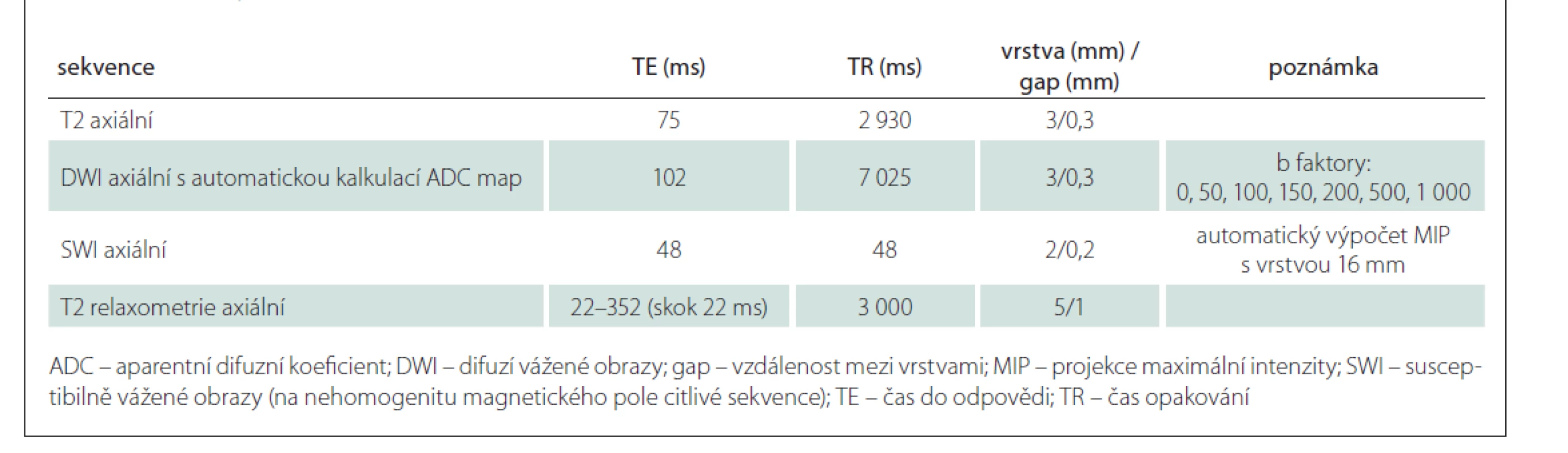
Statistická analýza
Statistické vyhodnocení dat bude postaveno zejména na srovnání klíčových parametrů mezi intervenovanou a referenční skupinou. Srovnání kvantitativních parametrů (např. čas) mezi skupinami bude provedeno pomocí dvouvýběrového t-testu, příp. Mann-Whitneyova testu. Analýza kategoriálních parametrů bude založena na analýze kontingenčních tabulek. Efekt rehabilitace v čase v první fázi bude testován párovými testy dle distribuce dat (párový t-test, párový Wilcoxonův test), poté pomocí analýzy rozptylu (ANOVA), případně jednou z jejich neparametrických variant. Data budou statisticky zpracována v programu IBM SPSS Statistics (Armonk, NY, USA) (verze 27).
Diskuze
Studie, které hodnotily parametry shodné s naší studií (FAC a 10MWT) přinesly protichůdné výsledky stran efektu RAGT na rehabilitaci chůze. Husemann et al [29] zařadili 32 pacientů s výsledkem hodnocení RAGT jako efektivní po dokončení intervence, tj. po 4 týdnech, zatímco studie autorů van Nunnen et al [30] neprokázala mezi skupinami s RAGT a bez RAGT s dobou sledování 6–9 měsíců signifikantní rozdíl [26,29,30]. Studie autorů Park et al [26] byla hodnocena zaslepeným hodnotitelem stran alokace subjektů (29 pacientů, do studie byli zařazováni i pacienti s hemoragickou CMP, poměr ischemické: hemoragické byl 15 : 14). Tato studie byla zaměřena na hodnocení efektu progresivního tréninku (postupné snižování vodicí síly) s využitím Lokomatu na škálu FAC a dobou sledování po 4 týdnech a bylo zjištěno signifikantní zlepšení u intervenční skupiny z 1 na 4, zatímco u skupiny bez robotické intervence pouze z 1 na 2 [26]. Multicentrická studie autorů Hidler et al [31] randomizovala pacienty s ischemickou i hemoragickou CMP (v poměru 19 : 11) se středně těžkým deficitem chůze (definováno jako schopnost chůze na 5 m bez fyzické asistence). Celkově zařadila 63 pacientů, u kterých nebyl zjištěn rozdíl v primárním výstupu – 6min test chůze v období sledování 3 měsíců [31]. Studie autorů Taveggia et al [32] hodnocená jako studie s nízkým rizikem bias měřila efekt intervence na Lokomatu po 3 měsících u 28 pacientů < 6 měsíců po CMP (bez rozlišení příčiny CMP). Studie prokázala zvýšení rychlosti chůze a funkční nezávislosti u pacientů v intervenční skupině s Lokomatem [32].
Pouze jediná dosud publikovaná studie sledovala vliv robotické rehabilitace chůze v Lokomatu na změny tělesného složení [29]. Tato randomizovaná studie (zařazeno 30 pacientů) prokázala možný přínos a efekt na množství svalové tkáně při intenzitě tréninku alespoň 1 200 min za 4 týdny. Vzhledem k limitované evidenci o vlivu robotické rehabilitace chůze na tělesné složení se v naší studii zaměřujeme mj. také na sledování dynamiky změn v objemu tukové a svalové hmoty, a to celkově i v jednotlivých tělesných segmentech (trup, horní a dolní končetiny).
Získaná pilotní data z této studie budou využita pro tvorbu klinických doporučených postupů zaměřených na RAGT po ischemické CMP v ČR.
Etické aspekty
Práce je prováděna ve shodě s Helsinskou deklarací z roku 1975 a jejími revizemi v letech 2004 a 2008. Studie byla schválena Etickou komisí FNO dne 30. 4. 2020, jednací číslo 395/2020. Pacienti podepisují informovaný souhlas.
Finanční podpora
Podpořeno projektem Ministerstva zdravotnictví ČR – Institucionální podpora na dlouhodobý koncepční rozvoj výzkumné organizace (Fakultní nemocnici Ostrava), RVO – FNOs/2020. Protokol i projekt byly schváleny dne 31. 3. 2020 hodnotící komisí Fakultní nemocnice Ostrava. Dr. Ondřej Volný a dr. Radim Líčeník byli podpořeni grantem: INTER-EXCELLENCE, číslo grantu LTC20031 – “Towards an International Network for Evidence-based Research in Clinical Health Research in the Czech Republic”.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Ondřej Volný, Ph.D.
Neurologická klinika
FN Ostrava
17. listopadu 1790/5
708 00 Ostrava-Poruba
e-mail: ondrej.volny@fno.cz
Přijato k recenzi: 12. 3. 2021
Přijato do tisku: 7. 7. 2021
Zdroje
1. Pollock A, Baer G, Campbell P et al. Physical rehabilitation approaches for the recovery of function and mobility following stroke. Cochrane Database Systematic Rev 2014; 2014 (4): CD001920–CD001920. doi: 10.1002/ 14651858.CD001920.pub3.
2. Albert S, Kesselring J. Neurorehabilitation of stroke. J Neurol 2012; 259 (5): 817–832. doi: 10.1007/s00415-011-6247-y.
3. Winstein CJ, Stein J, Arena R et al. Guidelines for adult stroke rehabilitation and recovery a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2016; 47 (6): E98–E169. doi: 10.1161/STR.0000000000000098.
4. Perin C, Bolis M, Limonta M et al. Differences in rehabilitation needs after stroke: a similarity analysis on the ICF core set for stroke. Int J Environ Res Public Health 2020; 17 (12): 4291. doi: 10.3390/ijerph17124291.
5. Maier M, Ballester BR, Verschure PFMJ et al. Principles of neurorehabilitation after stroke based on motor learning and brain plasticity mechanisms. Front Syst Neurosci 2019; 13 : 74. doi: 10.3389/fnsys.2019.00074.
6. Morone G, Paolucci S, Cherubini A et al. Robot-assisted gait training for stroke patients: current state of the art and perspectives of robotics. Neuropsychiatr Dis Treat 2017; 13 : 1303–1311. doi: 10.2147/NDT.S114102.
7. Mehrholz J, Thomas S, Kugler J et al. Electromechanical-assisted training for walking after stroke. Cochrane Database Syst Rev 2020; 10 (10): CD006185. doi: 10.1002/ 14651858.CD006185.pub5.
8. Calabró RS, Sorrentino G, Cassio A et al. Robotic-assisted gait rehabilitation following stroke: a systematic review of current guidelines and practical clinical recommendations. Eur J Phys Rehabil Med 2021; 57 (3): 460–471. doi: 10.23736/S1973-9087.21.06887-8.
9. Bruni MF, Melegari C, De Cola MC et al. What does best evidence tell us about robotic gait rehabilitation in stroke patients: a systematic review and meta--analysis. J Clin Neurosci 2018; 48 : 11–17. doi: 10.1016/j.jocn.2017.10.048.
10. Kim YH. Robotic assisted rehabilitation therapy for enhancing gait and motor function after stroke. Precis Future Med 2019; 3 (3): 103–115. https: //doi.org/ 10.23838/ pfm.2019.00065.
11. Tedla JS, Dixit S, Gular K et al. Robotic-assisted gait training effect on function and gait speed in subacute and chronic stroke population: a systematic review and meta-analysis of randomized controlled trials. Eur Neurol 2019; 81 (3–4): 103–111. doi: 10.1159/000500 747.
12. Platz, T. Evidence-based guidelines and clinical pathways in stroke rehabilitation-an international perspective. Front Neurol 2019; 10 : 200. doi: 10.3389/fneur.2019.00200.
13. Mehrholz J, Pohl M, Kugler J et al. The improvement of walking ability following stroke. Dtsch Arztebl Int 2018; 115 (39): 639–645. doi: 10.3238/arztebl.2018. 0639.
14. Mehrholz J, Thomas S, Werner C et al. Electromechanical-assisted training for walking after stroke: a major update of the evidence. Stroke 2017; 48 (8): E188–E189. doi: 10.1161/STROKEAHA.117.018018.
15. Moucheboeuf G, Griffier R, Gasq D et al. Effects of robotic gait training after stroke: a meta-analysis. Ann Phys Rehabil Med 2020; 63 (6): 518–534. doi: 10.1016/j.rehab.2020.02.008.
16. Swinnen E, Beckwée D, Meeusen R et al. Does robot-assisted gait rehabilitation improve balance in stroke patients? A systematic review. Top Stroke Rehabil 2014; 21 (2): 87–100. doi: 10.1310/tsr2102-87.
17. Mehrholz J, Wagner K, Meissner D et al. Predictive validity and responsiveness of the functional ambulation category in hemiparetic patients after stroke. Arch Phys Med Rehabil 2007. 88 (10): 1314–1319. doi: 10.1016/j.apmr.2007.06.764.
18. Perry J, Garrett M, Gronley JK et al. Classification of walking handicap in the stroke population. Stroke 1995; 26 (6): 982–989. doi: 10.1161/01.str.26.6.982.
19. Laren A, Odqvist A, Hansson P et al. Fear of falling in acute stroke: the fall study of gothenburg (FallsGOT). Top Stroke Rehabil 2018 25 (4): 256–260. doi: 10.1080/10749357.2018.1443876.
20. Schinkel-Ivy A, Inness EL, Mansfield A. Relationships between fear of falling, balance confidence, and control of balance, gait, and reactive stepping in individuals with sub-acute stroke. Gait Posture 2016. 43 : 154–159. doi: 10.1016/j.gaitpost.2015.09.015.
21. Minet LR, Peterson E, von Koch L et al. Occurrence and predictors of falls in people with stroke: six-year prospective study. Stroke 2015; 46 (9): 2688–2690. doi: 10.1161/STROKEAHA.115.010496.
22. Yang YR, Yen JG, Wang RY et al. Gait outcomes after additional backward walking training in patients with stroke: a randomized controlled trial. Clin Rehabil 2005; 19 (3): 264–273. doi: 10.1191/0269215505cr860oa.
23. Weng CS, Wang J, Pan XY et al. Effectiveness of backward walking treadmill training in lower extremity function after stroke. Zhonghua Yi Xue Za Zhi 2006; 86 (37): 2635–2638.
24. Chang KW, Lin CM, Yen CW et al. The effect of walking backward on a treadmill on balance, speed of walking and cardiopulmonary fitness for patients with chronic stroke: a pilot study. Int J Environ Res Public Health 2021; 18 (5): 2376. doi: 10.3390/ijerph18052376.
25. Aurich-Schuler T, Gut A, Labruyere R. The FreeD module for the Lokomat facilitates a physiological movement pattern in healthy people – a proof of concept study. J Neuroeng Rehabil 2019; 16 (1): 26. doi: 10.1186/s12984-019-0496-x.
26. Park IJ, Park JH, Seong HY et al. Comparative effects of different assistance force during robot-assisted gait training on locomotor functions in patients with subacute stroke: an assessor-blind, randomized controlled trial. Am J Phys Med Rehabil 2019; 98 (1): 58–64. doi: 10.1097/PHM.0000000000001027.
27. Berg KO, Wood-Dauphinee SL, Williams JI et al. Measuring balance in the elderly: validation of an instrument. Can J Public Health 1992; 83: S7–S11.
28. Reguli Z, Svobodová L. Česká verze diagnostiky strachu z pádů u seniorů – FES-I (Falls Efficacy Scale International). Studia Sportiva 2011; 5 (2): 5–12. doi: 10.5817/StS 2011-2-1.
29. Husemann B, Müller F, Krewer C et al. Effects of locomotion training with assistance of a robot-driven gait orthosis in hemiparetic patients after stroke: a randomized controlled pilot study. Stroke 2007; 38 (2): 349–354. doi: 10.1161/01.STR.0000254607.48765.cb.
30. van Nunen MPM, Gerrits GHL, Konijnenbelt M et al. Recovery of walking ability using a robotic device in subacute stroke patients: a randomized controlled study. Disabil Rehabil Assist Technol 2015; 10 (2): 141–148. doi: 10.3109/17483107.2013.873489.
31. Hidler J, Nichols D, Pelliccio M et al. Multicenter randomized clinical trial evaluating the effectiveness of the lokomat in subacute stroke. Neurorehabil Neural Repair 2009; 23 (1): 5–13. doi: 10.1177/1545968308326 632.
32. Taveggia G, Borboni A, Mulé C et al. Conflicting results of robot-assisted versus usual gait training during postacute rehabilitation of stroke patients: a randomized clinical trial. Int J Rehabil Res 2016; 39 (1): 29–35. doi: 10.1097/MRR.0000000000000137.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2021 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- CIDP: epidemiológia, klinický obraz a diagnostika v kocke
-
Všetky články tohto čísla
- Editorial
- Proč se dráhy kříží? Základní principy uspořádání mozku obratlovců
- Role mikroRNA v patogenezi spinální muskulární atrofie
- Nové možnosti laboratórnej diagnostiky ochorení spojených s tvorbou amyloidov
- Využití rohovkové konfokální mikroskopie u neurologických onemocnění
- Poruchy čichu po COVID-19 – diagnostika, význam a léčba
- Kappa free light chains in multiple sclerosis – diagnostic accuracy and comparison with other markers
- Studijní protokol – robotická terapie chůze pomocí přístroje Lokomat Pro FreeD u pacientů v subakutní fázi ischemické cévní mozkové příhody
- Validace dotazníku pro poruchy chůze u pacientů s roztroušenou sklerózou – česká verze MSWS-12
- Characterization of swallowing disorders in myasthenia gravis through a fibre-optic endoscopic evaluation
- Standardisation of the Slovenian version of the Alzheimer’s Disease Assessment Scale – cognitive subscale (ADAS-Cog)
- The frequency of silent brain infarcts in polycythaemia vera and essential thrombocytosis
- COVID-19 u nemocných s myasthenia gravis
- CANVAS – nově identifikovaná genetická příčina ataxie s pozdním nástupem. Popis prvních diagnostikovaných pacientů v České republice
- Benefits of 18F-FET PET in preoperative assessment of glioma heterogeneity demonstrated in two case reports
- COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
- Intramedulární absces
- Successful usage of rituximab in a patient with overlapping myelin oligodendrocyte glycoprotein encephalomyelitis and systemic lupus erythematosus
- Informace vedoucího redaktora
- Prof. MUDr. Hana Krejčová, DrSc. 90letá
- Aktualita z kongresu EAN 2021
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Poruchy čichu po COVID-19 – diagnostika, význam a léčba
- CANVAS – nově identifikovaná genetická příčina ataxie s pozdním nástupem. Popis prvních diagnostikovaných pacientů v České republice
- Proč se dráhy kříží? Základní principy uspořádání mozku obratlovců
- COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



