-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kombinovaná léčba u vlhké formy VPMD (fotodynamická terapie a intravitreálně podávaný ranibizumab)
Combined Therapy in the Exsudative Age-Related Macular Degeneration (Photodynamic Therapy and Intravitreally-Applied Ranibizumab)
The choroidal neovascularization (CNV) is the leading cause of blindness in industrial countries. CNV in age-related macular degeneration (AMRD) is dynamic, multifactor process, which cause wasn’t revealed until now. It is obvious that in multifactorial disease no single treatment is optimal, and that the monotherapy can’t cover all factors leading to the CVN development. The contemporary modern and variably effective treatment techniques have common characteristic – the treatment is very expensive and it is necessary to repeat it to obtain the treatment effect.
The authors refer about 18 months lasting period of follow-up of the group of 25 patients (9 men and 16 women, average age was 68 years, range, 59 – 76 years of age) who underwent the photodynamic therapy followed by ranibizumab intravitreal injections due to an active CNV. Mostly classical membranes were diagnosed in 18 cases (72 %), minimally classical membranes in 5 cases (20 %) and occult CNV in 2 patients (8 %). The average best corrected visual acuity before the treatment was 46 letters of EDTRS chart, and after the treatment it was 50 letters. From the total number of 25 patients, in 20 (80 %) of them the stabilization or improvement (+/ - 15 letters of EDTRS chart) was achieved, in two patients the improvement was better than 15 letters (8 %). Three patients’ visual acuity decreased by more than 15 letters (12 %). On average, to stabilize the CNV (after the PDT), 3.16 applications of ranibizumab were needed.Key words:
choroidal neovascularization, combined therapy, PDT, ranibizumab
Autori: J. Ernest; L. Hejsek; Ž. Benešová; L. Remont; P. Němec
Pôsobisko autorov: Oční klinika 1. LF UK a ÚVN, Praha, přednosta doc. MUDr. Jiří Pašta, CSc.
Vyšlo v časopise: Čes. a slov. Oftal., 66, 2010, No. 3, p. 119-126
Súhrn
Choroidální neovaskularizace (CNV) je vedoucí příčinou slepoty v rozvinutých zemích. CNV u VPMD je dynamický multifaktoriální proces, jehož příčina nebyla dosud objasněna. Je jasné, že u multifaktoriálního onemocnění není žádný lék ideální a že monoterapie nemůže postihnout všechny faktory vedoucí k rozvoji CNV. Současné moderní a různě účinné léčebné techniky mají jedno společné, léčba je velmi drahá a je nutné ji k dosažení léčebného efektu opakovat. Autoři referují o 18měsíčním sledování souboru 25 pacientů (9 mužů a 16 žen, průměrný věk byl 68 let v rozmezí 59 až 76), kteří podstoupili fotodynamickou terapii a následně intravitreální injekce ranibizumabu pro aktivní CNV. Převážně klasické membrány byly diagnostikované v 18 případech (72 %), minimálně klasické v 5 případech (20 %) a okultní CNV u 2 pacientů (8 %). Průměrná nejlépe korigovaná zraková ostrost před léčbou byla 46 písmen ETDRS, po léčbě 50 písmen. Z celkového počtu 25 pacientů jich 20 (80 %) prokázalo stabilizaci nebo zlepšení (+/ - 15 písmen ETDRS), u dvou pacientů nastalo zlepšení o více než 15 písmen (8 %). Tři pacienti se zhoršili o více než 15 písmen (12 %). V průměru vyžadovali nemocní (následně po PDT) ke stabilizaci CNV 3,16 injekcí ranibizumabu.
Klíčová slova:
choroidální neovaskularizace, kombinovaná terapie, PDT, ranibizumabÚvod
Choroidální neovaskularizace (CNV) je vedoucí příčinou slepoty v rozvinutých zemích. Způsobuje těžkou ztrátu vízu u 90 % jedinců s věkem podmíněnou makulární degenerací.
(VPMD) [17]. CNV u VPMD je dynamický multifaktoriální proces, jehož příčina nebyla dosud objasněna. Je jasné, že u multifaktoriálního onemocnění není žádný lék ideální a že monoterapie nemůže postihnout všechny faktory vedoucí k rozvoji CNV. Veškeré dosud známé léčebné postupy jsou zaměřené na léčbu projevů onemocnění, ne však jejich příčiny. Současné moderní a různě účinné léčebné techniky mají jedno společné: léčba je velmi drahá a je nutné ji k dosažení léčebného efektu opakovat. Historicky je možné sledovat množství léčebných postupů, v posledních letech se výběr ustálil na dvou technikách: fotodynamické terapii (PDT) a anti-VEGF léčbě. Obě techniky mají odlišný mechanismus účinku, rozdílný efekt a odlišné vedlejší účinky. Žádná z nich však není zcela bez komplikací.
Základním příčinným faktorem VPMD je věk. Buňky pigmentového epitelu sítnice /RPE/ s věkem mají menší schopnost metabolické aktivity, shromažďují produkty metabolismu a reaktivní materiál mezi Bruchovou membránou (BM) a pigmentovým epitelem (RPE). Histopatologické změny BM a choroidey vedou k redukci kapilární sítě a následně k hypoxii. Tato hypoxie a zánětlivá odpověď se zdají být základní příčinou rozvoje CNV u VPMD [1, 6]. Vysvětlení, proč k rozvoji CNV nedochází u všech lidí v pokročilém věku, lze najít v patologické zánětlivé, imunitní reakci disponovaných jedinců. Poslední studie ukazují, že genetické variace (komplement faktor H /HF1-CFH/) vytvářejí předpoklad pro rozvoj VPMD. CFH hraje klíčovou roli v komplementovém systému vrozené imunity, ve kterém se CFH váže na heparin a C reaktivní protein. Tkáňová hypoxie a chronické zánětlivé mechanismy spouštějí angiogenní signály pro tvorbu cévního růstového faktoru (VEGF) a proteolytickou kaskádu, na jejímž konci je patologická neovaskularizace. I když z rozvojem a zráním CNV stojí celá řada působků, nejvýznamnější z nich jsou VEGF faktory [6]. Ideální léčbou neovaskularizace je redukce zánětlivých pochodů a zastavení nebo útlum produkce VEGF faktorů jedním z přípravků. Obojího mechanismu současné době zatím nelze docílit monoterapií. Žádná dostupná monoterapie nepůsobí současně blokádu zánětlivých pochodů a produkci VEGF, aniž by současně neměla výrazné vedlejší účinky a komplikace. Logické vyústění je kombinace preparátů a využití synergického účinku látek působících na různých úrovních. Možnosti a využití synergického účinku byly prokázány v prvních studiích kombinujících PDT s kortikoidy s PDT a anti-VEGF [1, 11, 24]. Strategie kombinované léčby je běžná v onkologii, ze které intraokulární aplikace pochází. I zde byla anti-VEGF léčba prokázána jako účinná, pokud byla kombinovaná s chemoterapií [24].
Studie intravitreální aplikace anti-VEGF látek v monoterapii (pegaptanib, Macugen, OSI Pharmaceuticals, NY a ranibizumab, Lucentis, Genetech, CA) u vlhké formy VPMD prokázaly vliv na stabilizaci zrakové ostrosti, u Lucentisu i významné zlepšení vízu, pokud byla léčba opakovaná v pravidelných měsíčních intervalech [1, 7, 16]. Ranibizumab aplikovaný v pravidelných měsíčních intervalech prokázal zlepšení o 15 písmen ETDRS u téměř 40 % pacientů po 12 měsících sledování (MARINA, ANCHOR). Při aplikaci kvartální po předchozích 4 měsíčních dávkách nebylo po roce sledování zlepšení vízu významné proti výchozím hodnotám (PIER) [1]. Anti-VEGF léčba má schopnost zastavit nepříznivý vývoj a stabilizovat zrakové funkce při nepřetržitém podávání, po ukončení léčby lze však očekávat opětovný nárůst aktivity a zhoršení zrakových funkcí. I přes velké množství studií anti-VEGF léčby není dosud jasné, kolik aplikací je nezbytných k zástavě neovaskulárního růstu u VPMD. Anti-VEGF preparáty (Macugen, Lucentis, Avastin) blokují pouze vyprodukované VEGF faktory, nepůsobí bezprostředně na produkci na intracelulární úrovni, neovlivňují strukturu ani rozsah CNV. Trvalá aplikace anti-VEGF je vzhledem k ceně a rizikům nitroočního podání neudržitelná.
Studie fotodynamické terapie (PDT) a verteporfinem (Visudyne, Novartis AG) v rámci monoterapie prokázaly vliv na stabilizaci zrakových funkcí v limitovaných aplikacích [26, 27, 10]. Byl prokázán účinek na stabilizaci zraku a snížení těžké ztráty vízu, ne však na jeho zlepšení. Podstata PDT léčby s verteporfinem spočívá v mechanické blokádě a uzávěru průsvitu neovaskulárních cév. Bohužel většina pacientů potřebuje opakované aplikace [20]. Existují různé hypotézy, které vysvětlují přetrvávání choroidální neovaskularizace po PDT. Mezi nimi jsou: hypersekrece VEGF, zánět, leukocytární adheze, depozita buněk a buněčné matrix a znovuotevření lumen cév a produkce volných radikálů, které se mohou spolupodílet na růstu CNV [14, 22]. Samotná okluze cév patologického ložiska a částečně i bezprostřední okolní vaskulární sítě vede k hypoxii a nadprodukci VEGF a PEDF (Pigment Epithelium Derived Factor) faktorů, které jsou motorem rozvoje patologické revaskularizace [22]. Zvýšená produkce VEGF receptoru 3 a PEDF byla zachycena přímo v oblastech léčených PDT [22].
Úvaha o kombinované léčbě má opodstatnění v rozdílném mechanismu účinku. Verteporfin při PDT léčbě selektivně narušuje cytosklet endoteliálních buněk novotvořených cév a odstraní tak existující CNV. Tím odstraňuje i zdroj poškozující nad ložiskem ležící RPE a neuroepitel. Mechanismus účinku však zahrnuje i zánětlivou reakci a nadprodukci VEGF a dalších růstových faktorů [22]. Intraokulární injekce anti-VEGF (Lucentis, Macugen, Avastin) již v horizontu několika hodin po PDT blokuje vyprodukované růstové faktory z již vytvořené CNV a hyperprodukci růstových faktorů po PDT. Kombinace PDT a anti-VEGF synergicky blokuje jak rozsah a strukturu CNV, tak vyprodukované růstové faktory [25]. Jinou možností dalšího zvýšení protizánětlivého léčebného účinku je tzv.“triple terapie“, spočívající v kombinaci PDT a následně nitrooční injekci kortikoidu (např. triamcinolonu) a anti-VEGF látky [1].
Na základě pozitivních výsledků studií kombinované léčby PDT s anti-VEGF jsme na Oční klinice ÚVN a 1. LF UK v Praze zahájili v březnu 2008 prospektivní nerandomizovanou klinickou studii účinku kombinované léčby vlhké formy VPMD pomocí PDT a nitrooční injekce ranibizumabu (Lucentisu) v opakovaných dávkách. Cílem studie je posouzení výsledků léčby a porovnání kombinovaného přístupu proti monoterapii anti-VEGF především s ohledem k počtu nezbytných anti-VEGF aplikací, které vedou ke stabilizaci projevů VPMD.
Metodika
Do sledování jsou zařazeni pacienti s vlhkou formou VPMD se všemi typy CNV při VPMD po splnění indikačních kritérií. Indikační kritéria jsou převážně klasické, minimálně klasické a čistě okultní membrány do velikosti 5 PD, vízus od 6/12 do 6/60, membrány se subretinální hemoragií nepřekračující 25 % léze, s podílem jizvy menší než 50 % plochy léze.
Vylučovacími kritérii jsou kromě výše uvedených parametrů všechny membrány již dříve léčené jinou metodou, současná oční nebo celková onemocnění (glaukom, diabetes, myopie, angioidní pruhy, cystoidní edém makuly, vitreomakulární trakční syndrom), operace katarakty do 3 měsíců zpětně, PPV do půl roku zpětně.
Standardně u všech pacientů provádíme základní oftalmologická vyšetření, stanovení vízu podle ETDRS, nitrooční tlak, biomikroskopii, fluorescenční angiografii (FAG), optickou koherenční tomografii (OCT: firma Carl Zeiss, typ Stratus, standardně retinální mapu ze 6 diagonálních 6 mm skenů a měření centrální tloušťky sítnice v 1 mm zóně).
Vyšetření jsou opakovaná v prvním čtvrtletí v měsíčních intervalech a pak vždy po 3 měsících. Při FAG diagnostikujeme typ membrány, lokalizaci a celkový rozsah léze a rozsah aktivní porce. Všichni pacienti jsou ústně informováni o léčbě a jejích komplikacích a svůj souhlas s léčbou ztvrzují podepsáním informovaného souhlasu. Všichni nemocní jsou primárně léčeni PDT s verteporfinem (Visudyne, Novartis Ophthalmics, Basel, Switzerland) a následně druhý den aplikací anti-VEGF (Lucentis, Genetech inc., CA). Standardně u všech plánujeme 1 dávku anti-VEGF a po kontrolních vyšetřeních jsou pacienti doporučeni buď ke sledování (při klidném nálezu), nebo k další aplikaci anti-VEGF. Kritériem k pokračující aplikaci jsou buď aktivita na FAG, dále pak přetrvávající nebo narůstající centrální tloušťka sítnice na OCT. Důvod pro ukončení léčby je zhoršení zrakové ostrosti o více než 15 písmen nebo nárůst centrální tloušťky sítnice o více než 100 mikrometrů na OCT nereagující na předchozí aplikace ranibizumabu. Za stabilizaci zrakových funkcí považujeme rozmezí +/ - 15 písmen ETDRS. Vzhledem k tomu, že toto rozmezí (i když odpovídá standardům mezinárodních studií) je velmi široké, hodnotili jsme zvlášť jako stabilizaci, pokud se zraková ostrost nezměnila (rozdíl ETDRS skóre 0 až +5), a zvlášť jako zlepšení, pokud se zraková ostrost zlepšila o více než 5 písmen ETDRS.
PDT léčba s verteporfinem probíhá podle standardního protokolu léčby PDT (energie 50J/cm, 83 s). Následný den po PDT v odstupu 12 hodin podáváme nitrooční injekci Lucentisu. Aplikaci provádíme na operačním sále při dodržení zásad intraokulární aplikace léčiva podle operačního protokolu. Po aplikaci následuje instilace kapek s antibiotikem, sterilní krytí a za půl hodiny kontrola nitroočního tlaku /NT/ bezkontaktním tonometrem. Antibiotickou lokální léčbu doporučujeme ještě další 3–4 dny. Následující kontrola probíhá do týdne, v případě nejasností nebo obtíží je doporučena okamžitá kontrola aplikujícím lékařem.
Soubor pacientů
Kombinovanou léčbu PDT a nitrooční injekci Lucentisu, jsme aplikovali u celkem 25 pacientů s vlhkou formou VPMD a diagnostikovanou subfoveální CNV. U všech pacientů bylo zjištěno zhoršení zrakových funkcí v posledním půl roce. Do souboru byli zařazeni jen ti nemocní, kteří nebyli v minulosti léčení žádnou podobnou technikou. Všichni pacienti byli sledováni minimálně 1 rok (rozmezí 12–18 měsíců) v pravidelném sledovacím schématu 1., 2., 3., 6. a 12. měsíc a pak dále v půlročním intervalu. Z 25 pacientů bylo 9 mužů a 16 žen. Průměrný věk byl 68 roků, v rozmezí 59 až 76 roků. Převážně klasické membrány byly diagnostikované na základě FAG a OCT vyšetření v 18 případech (72 %), minimálně klasické v 5 případech (20 %) a okultní CNV u 2 pacientů (8 %).
Výsledky
PDT i anti-VEGF aplikace byly u všech pacientů dobře snášeny, nevyskytly se žádné komplikace nebo vedlejší účinky vyplývající z aplikace.
Průměrná nejlépe korigovaná zraková ostrost před léčbou byla 46 písmen ETDRS (rozmezí 25-70), po léčbě 50 písmen (rozmezí 12–80). V průběhu léčby byl průměrný zisk 4,5 písmen ETDRS plynulý, nenastal pokles a ztráta pod nulovou hranici. Vývoj průměrných hodnot zrakové ostrosti je znázorněn v graf 1. Z celkového počtu 25 pacientů jich 22 (88 %) prokázalo stabilizaci nebo zlepšení (+/ - 15 písmen ETDRS), u dvou pacientů nastalo zlepšení o více než 15 písmen (8 %). O více než 15 písmen se zhoršili 3 pacienti (12 %).
Graf 1. Průměrný vízus v průběhu sledování za 0-12 měsíců a porovnání se studií Pier 
Z 25 nemocných jich 21 (84 %) prokázalo stabilizaci nebo zlepšení o více než 0 písmen ETDRS, 16 pacientů (64 %) zlepšení o více než 5 písmen ETDRS.
Detailní rozbor hodnot zrakové ostrosti je v tab. č.1. Při sledování vývoje zrakové ostrosti v průběhu více než ročního sledování jsme pozorovali maximum zlepšení nebo stabilizaci mezi 2.–5. měsícem. V období mezi 5.–12. měsícem docházelo ke ztrátě původního zisku, což korelovalo s nárůstem centrální tloušťky sítnice i aktivitou diagnostikovanou při FAG.
Tab. 1. Zrakové ostrosti před léčbou a za 3, 6, 9 a 12 měsíců po zahájení léčby 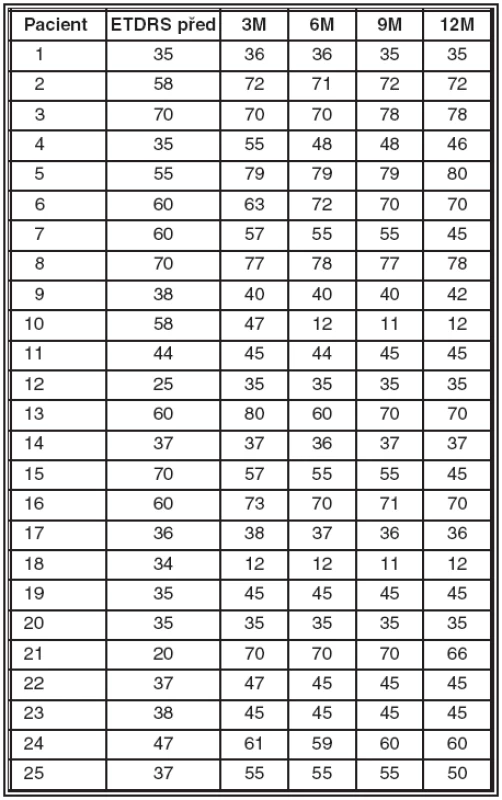
Průměrná centrální tloušťka sítnice měřená pomocí OCT byla 332 um, po 12 měsících 246 um (graf č. 2). Průměrné snížení tloušťky sítnice po 1 měsíci bylo 96 um, za 3 měsíce 98 um, za 6 měsíců 76 um, za 12 měsíců 78 um. Z 25 pacientů jich 22 (88 %) prokázalo redukci tloušťky sítnice do 1 měsíce po zahájení léčby, po 12 měsících jsme dokonce u 24 pacientů (95 %) pozorovali radikální snížení edému. Ne vždy to však odpovídalo stabilizaci nálezu.
Graf 2. Vývoj OCT (tloušťka centrální krajiny v mm) za 0–12 měsíců 
U některých pacientů se zraková ostrost zhoršila i přes snížení edému a uspokojivý anatomický výsledek (pac. č.10, 15, 18) (tab. 1). U dvou z nich za 1 měsíc po 1. dávce Lucentisu (pac. č. 10, 15) ruptura RPE v centrální části CNV znamenala zhoršení funkcí i přes výrazný pokles aktivity, snížení fluorescence na FAG a snížení edému sítnice. U třetího pacienta po 6 měsících od zahájení léčby i přes počáteční účinek a zlepšení se prohloubila atrofie RPE a choroidey. U jednoho pacienta po počátečním pozitivním vlivu léčby vzniklo svráštění a fibróza membrány, což znamenalo snížení vízu proti vstupním hodnotám (pac. č. 7). Prosakování kontrastní látky na FAG ustoupilo u 24 pacientů (98 %). Nicméně u většiny bylo možné pozorovat fluorescenci redukovaných zbytků membrány, která nebyla indikací k dalším aplikacím Lucentisu. Tato fluorescence je odlišná od zvýrazněné fluorescence, která by znamenala opětovnou aktivitu CNV. Reaktivace membrány provázená nárůstem fluorescence v okrajích původního ložiska nastala pouze u pacienta (pac. č. 7) s již dříve zmiňovanou fibrózou CNV. Průměrný počet dávek nezbytných k stabilizaci nebo zlepšení (ústupu edému, snížení aktivity) byl 3,16 při rozmezí 1–4 dávky.
5 pacientů (20 %) potřebovalo ke stabilizaci nálezu pouze 1 aplikaci Lucentisu. Na druhou stranu pouze 3 pacienti vyžadovali více než 3 injekce anti-VEGF látky. Kazuistický případ dobrého efektu uvádíme na obr. 1–4.
Obr. 1. FAG před zahájením terapie (pacient č.22) 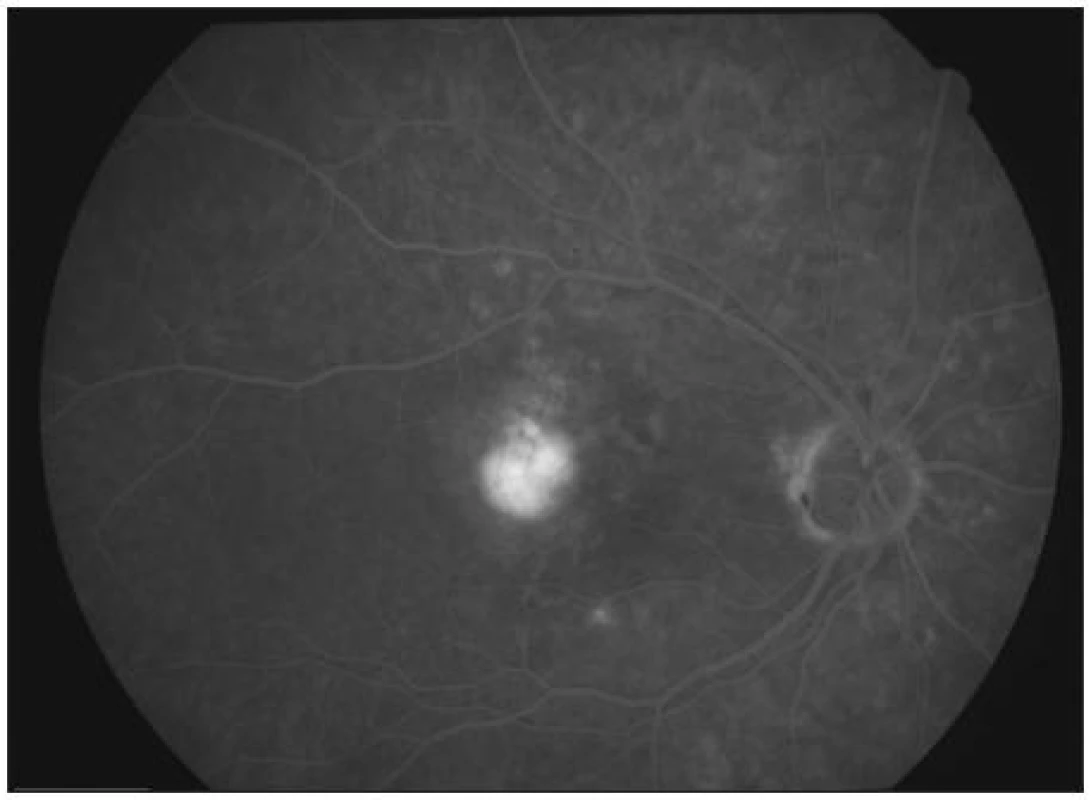
Obr. 2. FAG ve 12 měs. sledování (pacient č.22 po PDT a 2 aplikacích ranibizumabu) 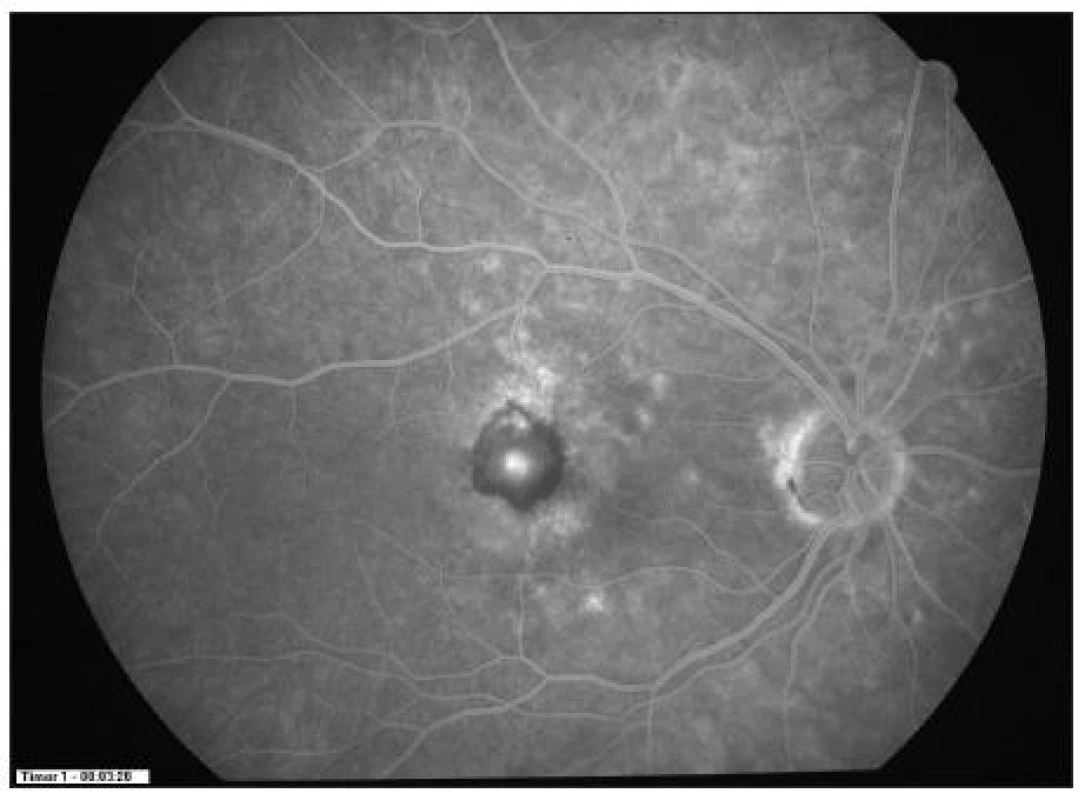
Obr. 3. OCT před započetím terapie (pacient č.22) 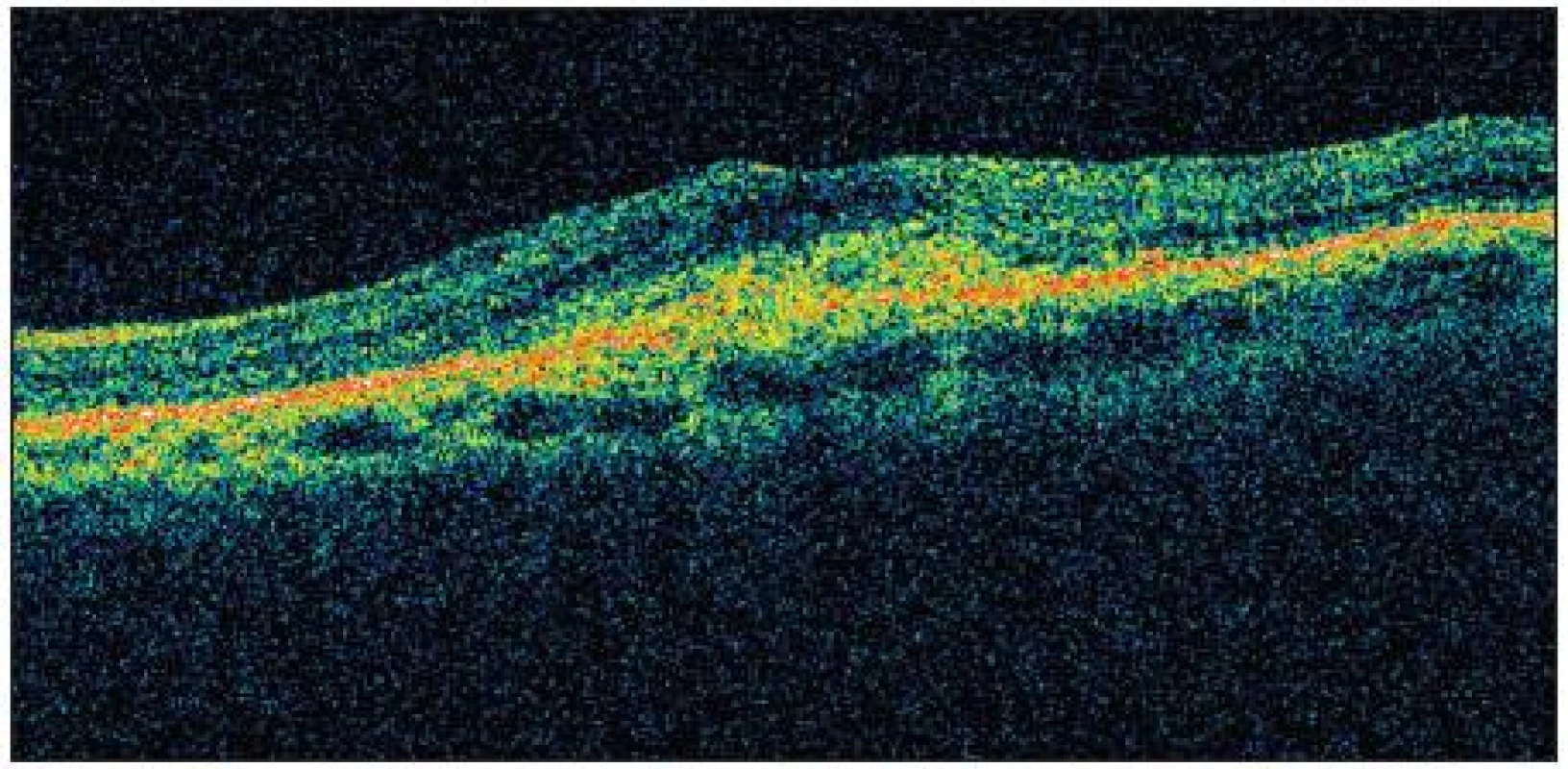
Obr. 4. OCT ve 12. měs. sledování (pacient č. 22 po PDT a 2 aplikacích ranibizumabu) 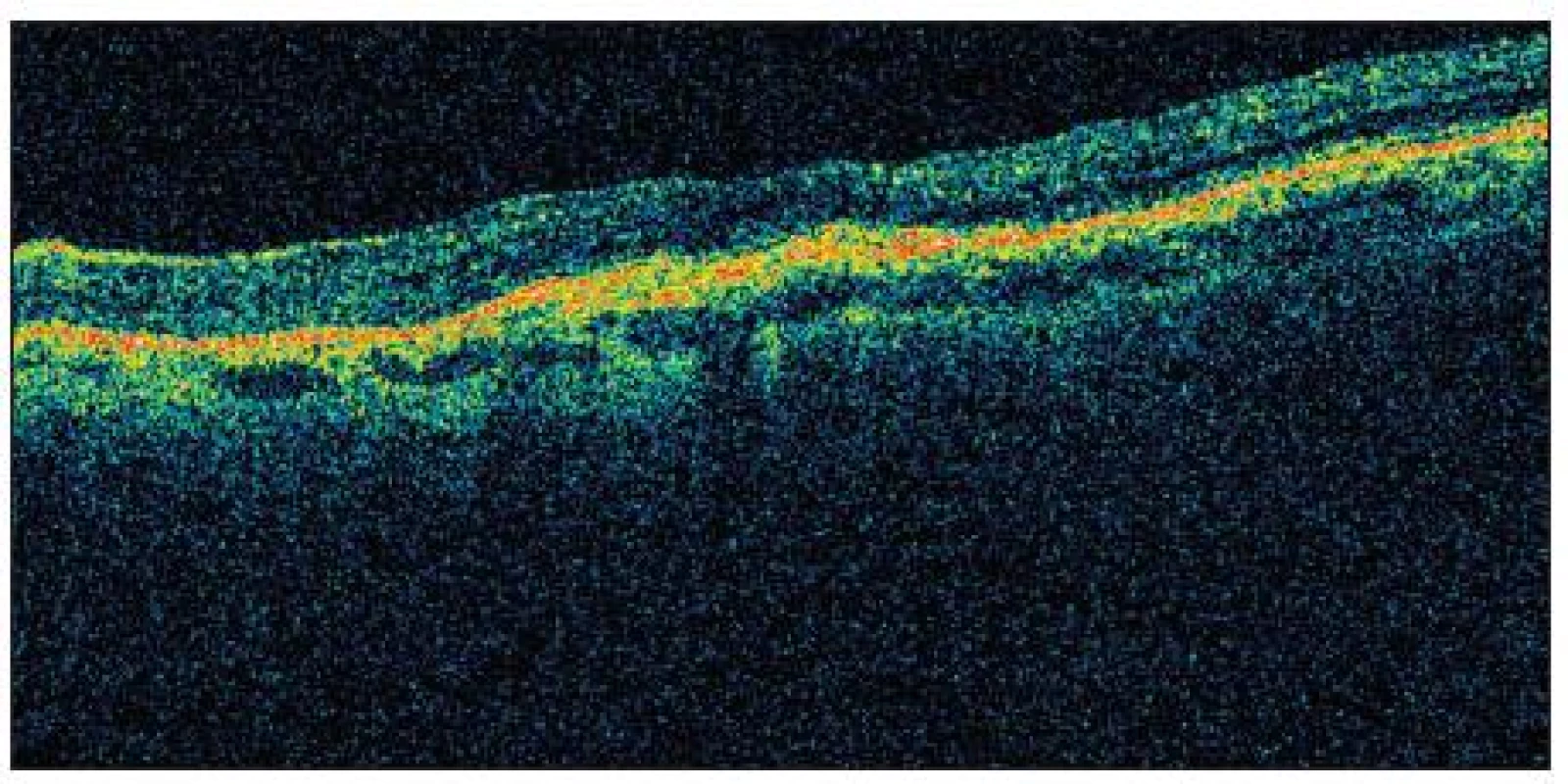
Diskuse
PDT jako monoterapie je účinnou léčbou u specifických podtypů CNV při VPMD. Bohužel nevede k trvalé a úplné okluzi CNV [21]. Některé studie kombinované léčby PDT s nitrooční injekcí triamcinolonu prokázaly lepší zrakovou ostrost a menší počet nezbytných PDT aplikací proti monoterapii [2, 18]. Bohužel četné komplikace vycházející z nitrooční aplikace kortikoidů (progrese katarakty, zvýšení nitroočního tlaku, neinfekční endoftalmitida) zabraňují rozvinutí jinak slibné techniky do klinické praxe. Experimentální studie kombinované léčby PDT s nitrooční injekcí Lucentisu prokázaly větší úbytek prosakování kontrastní látky a větší snížení edému centrálních oblastí sítnice proti PDT samotné [18, 13]. Důvod pro výraznější efekt kombinované léčby PDT s anti-VEGF proti monoterapii, ať už PDT nebo anti-VEGF, vyplývá z patofyziologie. Po PDT nastává k přechodná okluze jak patologické tak normální choriokapilaris [20, 13, 3]. Reperfuze choriokapiláris začíná v době mezi 4.–7. týdnem po PDT. Protože VEGF stimuluje migraci a proliferaci endoteliálních buněk, inhibice růstového faktoru oslabuje regenerační proces a rekanalizaci cév a může tedy optimalizovat efekt PDT. Další podání anti-VEGF látky může oddálit vedlejší a nežádoucí efekt PDT léčby. Otázkou dosud nezodpovězenou je, nakolik hypoxie subfoveálního ohraničeného ložiska vyvolaná PDT je výhodnější proti regenerativní nadprodukci VEGF faktorů po léčbě.
Ze studií MARINA a ANCHOR je zřejmé, že anti-VEGF léčba je až doposud nejúčinnější metodou v léčbě vlhké formy VPMD [3]. Vynikajících výsledků bylo však dosaženo pravidelnými měsíčními aplikacemi ranibizumabu, což je v klinické praxi dlouhodobě neudržitelné jak finančně, tak i pro riziko z opakovaných aplikací. Studie PIER, PRONTO, SUSTAIN, upravující aplikační schéma na režim s menším počtem dávek (kvartálním) nebo individualizovaná schémata respektující účinek předchozí aplikace a další aplikace až při vývoji aktivity, prokázaly vysokou účinnost, přesto však výsledků studie ANCHOR a MARINA nedosahují [19]. I při individualizovaném schématu a měsíčním sledování nálezu (PRONTO, SUSTAIN) bylo dosaženo zlepšení průměrného vízu 5,4 písmen ETDRS proti 10,2 v ANCHOR studii [3]. Následovaly randomizované studie (FOCUS, PROTECT), které hledaly, jak snížit počet aplikací, cenu léčby a udržet vysokou efektivitu léčby. Studie hodnotily účinnost a bezpečnost kombinované léčby PDT s Lucentisem. Jejich výsledky prokázaly menší počet nezbytných aplikací Lucentisu proti výsledkům studií s monoterapií Lucentisem [24]. Výsledky zrakových funkcí byly po přitom statisticky srovnatelné s výsledky při monoterapii. Tento závěr potvrzují i další klinické studie PDT s Lucentisem nebo PDT s Avastinem [9, 15, 4, 5, 11].
V naší studii jsme dosáhli během ročního sledování průměrného zisku 4,5 písmen ETDRS skóre. Bylo aplikováno jedno sezení PDT a průměrně 3,16 dávek ranibizumabu. Z ekonomického hlediska je zřejmé, že kombinovaná léčba ve vybraných indikacích podstatně omezuje náklady léčby a rizika z opakovaných aplikací při zachování dobrých dlouhodobých výsledků.
U našich pacientů vedlo více než jednoroční sledování kombinované léčby PDT s následnými injekcemi Lucentisu ke stabilizaci nebo zlepšení u 88 % pacientů (+/ - 15 písmen ETDRS), ke stabilizaci nebo zlepšení o více než 0 písmen u 84 %, ke zlepšení o 5 a více písmen u 64 % pacientů.
Závěr
Dosažené výsledky zrakové ostrosti se neliší od jiných studií s monoterapií Lucentisem, jejichž výsledky však vyžadovaly opakované nitrooční aplikace. Pro statistické zpracování a porovnání byl soubor 25 pacientů malý a při dalším sledování by bylo třeba ho rozšířit. V průměru vyžadovali naši pacienti ke stabilizaci 3,16 injekcí Lucentisu, což považujeme za nejpřínosnější sdělení v našem sledování. Téměř u všech našich pacientů se aktivita nevaskulárního komplexu snížila a edém sítnice snížil. Nevyskytly se žádné závažnější komplikace nebo vedlejší účinky léčby, které by bezprostředně vyplývaly z aplikačních procedur. Výsledky sledování našich pacientů jsou srovnatelné s výsledky sledování kombinované léčby PDT a anti-VEGF jiných autorů [9, 24, 15, 4, 5, 11].
Na základě našich výsledků doporučujeme léčit CNV kombinovanou technikou u těchto skupin pacientů:
- Převážně klasické typy CNV, kde monoterapie PDT je známá rizikem nadprodukce VEGF a následnými recidivami, které vyžadují opakovaná PDT sezení.
- Převážně klasické nebo minimálně klasické membrány v rozvinuté formě při dosud zachovaných dobrých zrakových funkcích, kde je předpoklad nutnosti opakovaných nitroočních aplikací a tedy vysokých nákladů terapie.
- CNV všech podtypů s výjimkou membrán pod ablací RPE, kde byla předchozí monoterapie (jakákoliv) neúspěšná nebo jedná-li se o monokulus.
- Kombinovanou terapii CNV považujeme za nevhodnou tam, kde je PDT kontraindikovaná, nebo jsou známé předchozí komplikace PDT při léčbě na druhé oku.
Prezentováno jako přednáška:
Ernest J., Benešová Ž., Hejsek L., Němec P., Rejmont L.:
Dlouhodobé výsledky léčby vlhké formy VPMD kombinací PDT a Lucentisu.
XVII. výroční sjezd České oftalmologické společnosti, Praha 1.–3. října 2009MUDr. Jan Ernest, PhD.
Ústřední vojenská nemocnice Praha, Oční klinika
jan.ernest@uvn.cz
Zdroje
1. Augustin, A., Puls, S., Offermann, I.: Triple therapy for choroidal neovascularization due to age-related macular degeneration. Retina, 27, 2007 : 133–140.
2. Augustin, A., Schmidt-Erfurth, U.: Verteporfin therapy combined with intravitreal triamcinolon in all type of choroidal neovascularization due to age related macular degeneration. Ophthalmology, 113, 2006 : 14–22.
3. Brown, D., Michels, M., Kaiser, P. et al.: Ranibizumab versus verteporfin photodynamic therapy for neovacular age-related macular degeneration: two years results of the ANCOR study. Ophthalmology, 116, 2009 : 57–65.
4. Costa,R., Horte, R., Calucci, D. et al.: Intravitreal bevacizumab (Avastin) in combination with verteporfin photodynamic therapy for choroidal neovascularization associated with age-related macular degeneration (Ibere Study). Grafes Arch. Clin. Exp. Ophthalmol., 245, 2007 : 1273-1280.
5. Dhala, M., Shah, G., Binder, K. et al.: Combined photodynamic therapy with verteporfin and intravitrel bevacizumab for choroidal neovacularization in age-related macular degeneration. Retina, 26, 2006 : 988–993.
6. Ferrari, N.: Vascular endothelial growth factor: basic science and clinical progress. Endocrine Reviews, 25, 2004 : 581-611.
7. Gragoudas, E., Adami, A., Cunningham, E. et al.: VEGF Inhibition Study in Ocular Neovascularization Clinical Trial Group. Pegatanib for neovascular age-related macular degeneration. N. Engl. J. Med., 351, 2004 : 2805–2816.
8. Heier, J., Boyer, D., Ciulla, T. et al.: Ranibizumab combined with verteporfin photodynamic therapy in age-related macular degeneration. Year 1 results Focus study. Arch. Ophthalmol., 124, 2006 : 1532–1542.
9. Husai, D., Kim, I., Ganthier, D. et al.: Safety and efficacy of intravitreal injection of ranibizumab in combination with verteporfin PDT on experimental choroidal neovascularization in the monkey. Arch. Ophthalmol., 123, 2005 : 509–516.
10. Kaiser, P.: Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Verteporfin therapy of subfoveal choroidal neovascularization in age-related macular degeneration: 5-year results of two randomized clinical trial with open-label extension: TAP report No. 8. Graefes Arch. Clin. Exp. Ophthalmol., 244, 2006 : 1132–1142.
11. Kaiser, P.: Verteporfin photodynamic therapy combined with intravitreal bevacizumab for neovascular age-related macular degeneration. Ophthalmology, 116, 2009 : 747-755.
12. Kaiser, P.: Verteporfin therapy in combination with triamcinolone:publishd studies investigating a potential synergetic effect. Curr. Med. Res. Opin., 21, 2005 : 705–713.
13. Kamer, M., Miller, J., Michaud, N. et al.: Liposomal benzoporphyrin derivate verteporfin photodynamic therapy. Selective treatment of choroidal neovacularization in monkeys. Ophthalmology, 103, 1996 : 427–438.
14. Kent, D., Sheridan, C.: Choroidal neovascularization: a wound healing prospective. Mol. Vis., 9, 2003 : 747–755.
15. Ladewig, M., Karl, S., Hamelmann, V. et al.: Combined intravitreal bevacizumab and photodynamic therapy for neovacular age-related macular degeneration. Graefes Arch. Clin. Exp. Ophthalmol., 246, 2008 : 17–25.
16. Lazic, R., Gabric, N.: Verteporfin therapy and intravitreal bavacizumab combined and alone in choroidal neovascularization due to age-related macular degeneration. Ophthalmology, 114, 2007 : 1179–1185.
17. Polito, A., Idoly, M., Lanzetta, C. et al.: The natural history of occult choroidal neovascularization associated with age related macular degeneration: systemic review. An. Acad. Med. Singapure, 35, 2006 : 145-50.
18. Rechtman, E., Danis, R., Pratt, L. et al.: Intravitreal triamcinolon with photodynamic therapy for subfoveal choroidal neovascularization in age related macular degeneration. Br. J. Ophthalmol., 88, 2004 : 344–347.
19. Regillo, C., Brown, D., Abraham, P. et al.: Randomized,double-masket,sham-controlled trial of ranibizumab for neovascular age-related macula degeneration: PIER study year. Am. J. Ophthalmol., 145, 2008 : 239–247.
20. Schmidt-Erfurth, U., Laqua, H., Schlotzer-Schrehard, U. et al.: Histopathological changes following photodynamic therapy in human eyes. Arch. Ophthalmol., 120, 2002 : 835–844.
21. Schmidt-Erfurth, U., Miller, J., Sichenberg, M. et al.: Photodynamic therapy with verteporfin for choroidal neovascularization caused by age related macular degeneration: results of retreatments in phase 1 and 2 study. Arch. Ophthalmol., 117, 1999 : 1177–1187.
22. Schmidt-Erfurth, U., Scholter-Schrehard, U., Cursiefen, C. et al.: Influence of photodynamic therapy on expression of vascular endothelial growth factor (VEGF) VEGF receptor 3 and pigment epithelium-derived factor. Incest. Ophthalmol. Vis. Sci., 44, 2003 : 4473–4480.
23. Spaide, R.: Perspectives. Rationale for combination therapies for choroidal neovascularization. Am. J. Ophthalmol., 141, 2006 : 149–156.
24. Spaide, R.: Rationale for combination therapy in age-related macular degeneration. Retina, 29, 2009 : 2–4.
25. Souček, P., Cihelková I.: Fotodynamická terapie s verteporfinem v éře anti-VEGF. Farmakoterapie, 3, 2007, 5 : 523–527.
26. Treatment of Age-Related macular degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macula degeneration with verteporfin: two year results of 2 randomized clinical trials-TAP report 2. Arch. Ophthalmol., 119, 2001 : 198–207.
27. Verteporfin in Photodynamic Therapy Study Group. Verteporfin therapy of subfoveal choroidal neovascularization in age-related macula degeneration: two year results of randomized clinical trial including lesions with occult with no classic choroidal neovascularization. Verteporfin in Photodynamic Therapy report 2. Am. J. Ophthalmol., 131, 2001 : 541–560.
Štítky
Oftalmológia
Článek OznámeníČlánek Nové trendy v léčbě VPMD
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2010 Číslo 3- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Výsledky léčby vlhké formy věkem podmíněné makulární degenerace u pacientů evidovaných v celonárodním registru AMADEUS
- Kombinovaná léčba u vlhké formy VPMD (fotodynamická terapie a intravitreálně podávaný ranibizumab)
- Epidemiologie věkem podmíněné makulární degenerace
- Oznámení
- Nové trendy v léčbě VPMD
- Úhrada léčby vlhké formy VPMD z prostředků veřejného zdravotního pojištění
- Léčba choroidální neovaskulární membrány preparátem ranibizumab (Lucentis): kazuistika
- Pegaptanib sodný a ranibizumab v léčbě ablace pigmentového listu sítnice u pacienta s věkem podmíněnou makulární degenerací – kazuistika
- Změna anti-VEGF při léčbě mimořádně aktivní choroidální neovaskulární membrány při věkem podmíněné makulární degeneraci
- Fotodynamická terapie s verteporfinem: od neovaskularizace k hemangiomu aneb Když sítnice makulou nekončí
- JAN VANÝSEK – oftalmolog 20. století
- Informační zázemí České oftalmologické společnosti ČLS JEP pro monitoring a hodnocení léčby vlhké formy věkem podmíněné makulární degenerace – národní projekt AMADEUS
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Nové trendy v léčbě VPMD
- Léčba choroidální neovaskulární membrány preparátem ranibizumab (Lucentis): kazuistika
- Epidemiologie věkem podmíněné makulární degenerace
- Úhrada léčby vlhké formy VPMD z prostředků veřejného zdravotního pojištění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



