-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Přínos intravitreální aplikace anti-VEGF preparátů v léčbě prahového stadia ROP 3+ v zóně I–II: Výsledky čtyřleté studie
Effects of Intravitreal Pegaptanib or Bevacizumab and Laser in Treatment of Threshold Retinopathy of Prematurity in Zone I and Posterior Zone II – Four Years Results
Purpose:
To evaluate efficacy and safety of intravitreal injection of pegaptanib or bevacizumab and laser photocoagulation for treatment of threshold stage 3+ retinopathy of prematurity (ROP) affecting zone I and posterior zone II, and to compare the results in terms of regression, development of peripheral retinal vessels with conventional laser photocoagulation or combined with cryotherapy.Methods:
In this prospective comparative study, 174 eyes of 87 premature babies, from January 2008 to December 2011, were included. All infantns were diagnosed with stage 3+ ROP for zone I or posterior II. Patients were randomly assigned to receive intravitreal pegaptanib (0.3 mg) or bevacizumab (0.625 mg/0.025 ml of solution) with conventional diode laser photocoagulation (Group A, 92 eyes of 46 infants) or laser therapy combined with cryotherapy (Group B, 82 eyes of 41 infants), bilaterally.
The main evaluated outcomes include time of regression and decrease of plus signs and development of peripheral retinal vessels after treatment, final strucutral-anatomic outcomes compared in the both groups of patients. Risk factors and other characteristics of infnats include birth weight, gestational age, Apgar score, duration of intubation and hospitalizations, postmenstrual age at treatment, sepsis, surgery for necrotizing enterocolitis, intraventricular hemorrhage.
Primary outcome of treatment success was defined as absence of recurrence of stage 3+ ROP in one or both eyes ( reccurrence rate = 0) by 55 weeks’ postmenstrual age. Treatment failure was defined as the recurrence of neovascularization (reccurrence rate = 1 or 2) in one or both eyes requiring retreatment.
The mean follow-up after treatment was 23.5 months (range 4 - 45 months) in the Group A, and 25.2 months in the Group B ( range 3 - 48 months).Results:
Final favorable anatomic outcome and stable regression of ROP at last control examination have 90.2 % of eyes after adjuvant intavitral pagaptanbib or bevacizumab in the Group A, and 62 % of eyes after only conventional treatment in the Group B (P = 0.0214).
Regression of plus disease and peripheral retinal vessels development appeared significantly more rapidly in Group A patients who received intravitreal VEGF inhibitors and laser.
An absence of recurrence of neovascularization (stage 3+ ROP) was identified at 87 % of patients in the Group A, and 53 % of patients in the Group B. This difference between the both groups was statistically significant (P = 0.0183). ROP reccured in 7 from 92 eyes (7.6 %) in the Group A, and 23 from 82 eyes (28 %) in the group B (P = 0.0276). Significantly better treatment effect was found for adjuvant intravitreal pagaptanib or bevacizumab with laser compared with conventional therapy of ROP 3+ in zone I and posterior zone II.
Perioperative retinal haemorrhages after laser photocoagulation occured in 8 % of eyes in the Group A, and 11 % of eyes in the group B (P = 0.358), in all eyes with spontaneous resorption. No systemic or significant ocular complications of intravitreal anti-VEGF injections, such as endophthalmitis or retinal detachment were found during follow-up period after operation.Conclusions:
A combination of intravitreal pegaptanib or bevacizumab injection and laser photocoagulation showed to be a safe, well tolerated and effective therapy in patients with stage 3+ ROP in zone I and posterior zone II.
Adjuvant intravitreal antiVEGF injection, as compared with conventional laser or cryotherapy, showed significant benefit in terms of better final anatomic outcome, induction of prompt regression, rapid development of peripheral retinal vascularization and decrease of recurrence rate of neovascularization. Results of this study support the administration of pegaptanib and bevacizumab as an alternative usefull therapy in the management of stage 3+ ROP.Key words:
retinopathy of prematurity, stage 3+, zone I, posterior zone II, anti–vascular endothelial growth factor therapy, pegaptanib (Macugen), bevacizumab (Avastin), intravitreal injections, RetCam photography
Autori: R. Autrata 1; K. Šenková 1; M. Holoušová 1; I. Krejčířová 1; Z. Doležel 2; I. Borek 3
Pôsobisko autorov: Dětská oční klinika LF MU a FN, Brno, přednosta prof. MUDr. Rudolf Autrata, CSc. MBA 1; Pediatrická klinika LF MU a FN, Brno, přednosta prof. MUDr. Zdeněk Doležel, CSc. 2; Neonatologické oddělení, Fakultní nemocnice, Brno, primářp MUDr. Ivo Borek 3
Vyšlo v časopise: Čes. a slov. Oftal., 68, 2012, No. 1, p. 29-36
Kategória: Původní práce
Súhrn
Cíl:
Zhodnocení strukturálních změn na očním pozadí, efektivity a bezpečnosti kombinované terapie – indirektní transpupilární fotokoagulace diodovým laserem s adjuvantní intravitreální aplikací pegaptanibu (Macugen, 0,3 mg, Pfizer) nebo bevacizumabu (Avastin, Genentech) 0,625 mg/ 0,025 ml v léčbě závažných forem ROP stadia 3+ v zóně I–II (posterior zone II). Výsledky byly srovnávány s efektem klasické léčby těchto forem ROP pomocí laserové fotokoagulace nebo kombinované s kryoterapií.Metodika:
V letech 2008–2011 bylo ošetřeno celkem 174 očí 87 dětí se zavážnou formou ROP 3+ v zóně I a posterior II. Skupinu A tvoří 92 očí (46 dětí) léčených indirektní transpupilární fotokoagulací diodovým laserem (810 nm) s adjuvantní intravitreální aplikací pegaptanibu (60 očí) nebo bevacizumabu (32 očí). Skupina B zahrnuje 82 očí (41 dětí) se stejnou formou ROP, které byly ošetřeny konvenční laserovou fotokoagulace, event. v kombinaci s kryoterapií. V případě kombinované léčby ve skupině B byl diodový laser aplikován v centrálních částech avaskulární sítnice, kryoterapie periferně od fotokoagulace.
Ve skupině A byla po laserové fotokoaguaci provedena v celkové nebo lokální anestezii intravitreální injekce pegaptanibu nebo bevacizumabu. Sledované a hodnocené parametry zahrnují: stupeň ROP před a po operaci, dobu dosažení regrese – vymizení příznaků „plus disease“, dokončení normální periferní vaskularizace, porodní hmotnost, gestační věk v době zákroku a finální strukturální změny na očním pozadí v obou skupinách.
Jako úspěch léčby byla definována nepřítomnost rekurence stadia 3+ ROP na jednom nebo obou očích v zóně I nebo posterior II do 55 týdnů gestačního věku (tzv. „recurrence rate = 0) Jako neúspěšná byla definována recidiva neovaskularizací na jednom nebo obou očích (tzv. „recurrence rate = 1, resp. 2) s nutností opakování léčebného zákroku.
Průměrná doba sledování byla 23,5 měsíců (rozmezí 4–45 měs.) ve skupině A, 25,2 měsíců (rozmezí 3–48 měs.) ve skupině B. Nálezy na fundu před a po operaci byly dokumentovány pomocí RetCAM.Výsledky:
Příznivé anatomické změny na očním pozadí a stabilní regresi ROP při poslední kontrole mělo 90,2 % všech očí ošetřených kombinovanou terapií s intravitreální injekcí pegaptanibu nebo bevacizumabu ve skupině A. Ve skupině B očí ošetřených fotokoagulací nebo kryoterapií mělo příznivé strukturální změny a regresi ROP 62 % očí (P = 0,0214). Ve skupině A bylo zaznamenáno statisticky významně rychlejší vymizení příznaků plus disease ROP a rychlejší dosažení normální periferní retinální vaskularizace než ve skupině B. Bez recidivy neovaskularizací, nebo-li bez nutnosti opakovaného léčebného zákroku (tzv. reccurence rate = 0) bylo 87 % dětí ve skupině A, 53,7 % dětí ve skupině B (P = 0,0183). Peroperační komplikace související s fotokokoagulací zahrnovaly retinální hemoragie u 8 % očí ve skupině A, u 11 % ve skupině B (P = 0,358), postupně se spontánní resorbcí. Nebyly zaznamenány žádné oční nebo systémové komplikace intravitreální injekce pegaptanibu a bevacizumabu.Závěr:
Intravitreální injekce anti-VEGF preparátů pegaptanibu nebo bevacizumabu v kombinaci s fotokoagulací diodovým laserem je účinná a bezpečná pro regresi stadia ROP 3+ v zóně I a posterior II s navozením normální vaskularizace periferní sítnice a příznivým strukturálním výsledkem.
V léčebném ovlivnění atypických forem ROP v zóně I a posterior zóně II bylo dosaženo statisticky významně lepších anatomických výsledků s menším výskytem nepříznivých strukturálních změn na očním pozadí pomocí laserové fotokoagulace v kombinaci s intravitreální aplikací pegaptanibu nebo bevacizumabu.
Z výsledků naší studie vyplývá závěrečné doporučení zařadit intravitreální aplikaci anti-VEGF preparátů – pegaptanibu nebo bevacizumabu do standardního léčebného protokolu u nedonošených dětí s rozvojem stadia ROP 3+ v zóně I a posterior II.Klíčová slova:
retinopatie nedonošených, stadium 3+, zóna I, posteriorní zóna II, Antivascular endothelial growth factor, pegaptanib (Macugen), bevacizumab (Avastin), intravitreální injekce, RetCamPodpořeno grantem IGA MZ ČR NS/9892-4
Úvod
Retinopatie nedonošených (ROP) je vazoproliferativní onemocnění, které postihuje většinou předčasně narozené a nezralé děti s porodní hmotností pod 1500 g, které se narodily před 32. gestačním týdnem a z důvodu respirační a oběhové insuficience je prováděna oxygenoterapie. Je nejčastější příčinou vrozené slepoty u dětí v rozvinutých zemích. Téměř 70 % všech nevidomých dětí tvoří pacienti po proběhlé retinopatii nedonošených. ROP probíhá ve dvou formách: akutní a chronické. Akutní forma je charakterizována narušením vaskulogeneze nezralé sítnice. Chronický pozdní vývoj je charakterizován tvorbou retinovitreálních fibrovaskulárních membrán, které mohou svojí trakcí způsobit totální nebo parciální odchlípení sítnice, ektopii makuly apod. Strukturální změny na očním pozadí pak určují míru funkčního postižení zraku. Onemocnění má v 60 % až 80 % sklon ke spontánní regresi bez významnější trvalých anatomických a funkčních následků. Přibližně 10 % až 30 % dětí s ROP je postiženo závažnými jizevnatými změnami, nezřídka totální amocí s odpovídající ztrátou zraku. Nejhorší průběh onemocnění bývá u velmi nezralých dětí s porodní hmotností pod 1000 g a narozených před 30. gestačním týdnem. Přestože je ROP oboustranné onemocnění, průběh a postižení očí je často asymetrické. Celková incidence ROP u dětí s porodní hmotností menší než 1000 g je udávána v rozmezí 52 % až 88 %, u dětí nad 1000 g je pak její výskyt ve 34 % až 60 % dětí. Celosvětová prevalence slepoty v důsledku ROP je 50 000 dětí (18).
Vaskularizace sítnice u nedonošených dětí není dokončena a sítnicové cévy končí různě daleko před nebo za ekvátorem. V důsledku oxygenoterapie vyššími koncentracemi kyslíku dochází k vazokonstrikci sítnicových arterií a ischemii periferních oblastí sítnice. Po ukončení oxygenoterapie je relativní hypoxie podnětem k dilataci retinálních cév. Vřetenovité buňky jsou stimulovány k produkci angiogenního faktoru, který odstartuje proces neovaskularizace. Vznikají arteriovenózní zkraty v oblasti rozhraní vaskularizované a avaskulární sítnice. Vývoj novotvořených kapilár v charakteristických trsech neovaskularizací je doprovázen stimulací myofibroblastů k produkci fibrotické tkáně. Tyto fibrovaskulární proliferace se šíří po zadní ploše sklivce a do sklivcového prostoru a svým tahem jsou příčinou trakčního odchlípení sítnice.
U každého akutního stadia ROP může být přítomna tzv. plus forma, která je charakterizována dilatací a tortuozitou retinálních cév, rubeózou duhovky a může být známkou výrazného urychlení průběhu ROP s horší prognózou. První a druhé stadium ROP často spontánně ustupuje. Třetí stadium může regredovat, ale je 50% riziko progrese se všemi závažnými důsledky. U těžších forem ROP, kde jsou známky plus formy, u rush typu ROP a při začátku ROP v zóně I je pravděpodobnost spontánní regrese zanedbatelná. Jednotlivá stadia typicky probíhající ROP jsou u tzv. atypických forem pozměněna. Mezi hlavní klinické jednotky atypických forem ROP patří: retinopatie zóny I jako posteriorní varianta či rush disease, hemoragické formy ROP, stop forma (blokované retinopatie), a pozdní retinopatie (ROP last minute). Většina atypických forem postihuje děti s nejnižší porodní hmotností a má horší prognózu. ROP v zóně I a posteriorní zóně II, zvláště pak je-li přítomna plus-forma je nejobtížněji léčitelná, často je třeba opakovaných zákroků v důsledku recidivy neovaskularizací (7, 14, 25, 27, 38, 39, 49).
Plus forma – tzv. stadium ROP 3+ je definována dilatací vén a tortuozitou arterií již od odstupu z terče zrakového nervu ve 2 a více kvadrantech očního pozadí.
Pro léčbu stadia 3 ROP je od roku 1988 standardně doporučována kryoterapie (11).
Od 90. letech min. století je stále více uplatňována v léčbě stadia 3+ ROP laserová terapie nebo kombinace kryoterapie a transpupilární laserové fotokoagulace. Obě metody vedou k destrukci buněk produkujících vaskulární endoteliální růstový faktor (VEGF) v avaskulární sítnici (15,47).
Od roku 2003 je doporučováno ve stadiu ROP 3+ časné použití konfluentní laserové fotokoagulace na základě výsledků studie ET-ROP (15).
Konvenční laserová terapie pro ROP 3+ v zóně I a posterior II je úspěšná průměrně u 50 % případů. V případě selhání opakované klasické laserové terapie je doporučována vitrektomie (40, 53).
VEGF hraje klíčovou roli v progresi ROP tvorbou neovaskularizací. V posledních letech se objevují v literatuře příznivé výsledky intravitreální aplikace anti-VEGF preparátu bevacizumabu redukující patologickou neovaskularizaci s navozením úspěšné regrese ROP, bez očních a celkových vedlejších účinků (19, 22, 26, 28, 35, 52, 54).
VEGF hraje zásadní roli jak ve fyziologické, tak v patologické neovaskularizaci. Izoforma 165 je zodpovědná za patologickou neovaskularizaci v oku, izoforma 121 je důležitá pro fyziologickou obnovu cévního systému. Z celkového množství syntetizovaného VEGF tvoří největší část izoforma121 a 165 (24).
Bevacizumab je neselektivní monoklonální protilátka blokující všechny izoformy VEGF. Neselektivní blokáda všech izoforem vede k omezení patologické vaskularizace, ale i fyziologického vývoje retinálního cévního systému (24).
Pegaptanib je chemicky syntetizovaný oligonukleotid – aptamer, který se váže s vysokou afinitou na izoformu VEGF 165, která je zodpovědná za patologickou neovaskularizaci, a blokuje jeho receptor na buněčné membráně. Fyziologická izoforma VEGF 121 zůstává volná. Systémová resorpce pegaptanibu je velmi nízká. V systémové cirkulaci pokusných zvířat byla naměřena koncentrace odpovídající 0,03–0,15% intravitreální koncentrace. Pro lidskou populaci je systémová koncentrace po intravitreální aplikaci 0,3 mg pegaptanibu pod nejnižším limitem detekovatelnosti (0,008 mg/ml). Bylo prokázáno, že ani po opakovaných intravitreálních aplikacích nebyla pozorována kumulace pegaptanibu (51).
V posledních letech byly publikovány studie potvrzující příznivý efekt intravitreální injekce bevacizumabu v léčbě stadia ROP 3+ v zóně I–II, bez očních a systémových komplikací (3, 13, 22, 26, 28, 29, 30, 35, 37, 52, 54).
Dosud nebyla v odborné literatuře publikována žádné studie zabývající se intravitreální aplikací selektivního anti-VEGF preparátu – pegaptanibu blokujícího izoformu VEGF 165, zodpovědnou za patologickou neovaskularizaci, v léčbě ROP. Naše studie přináší první dlouhodobé výsledky adjuvantní aplikace pegaptanibu nebo bevacizumabu v kombinaci s konveční léčbou stadia ROP 3+ v zóně I a posterior II, nebo v případech agresivní formy posterior ROP (AP-ROP). Cílem práce je zhodnotit efektivitu a bezpečnost této nové léčby u závažných forem ROP, které při užití dosud standardní konvenční terapie mohou vést až v polovině případů ke slepotě.
Metodika a soubory
V letech 2008–2011 bylo ošetřeno celkem 174 očí 87 nedonošených dětí se závažnou formou ROP 3+ v zóně I a posterior II. Stadium a lokalizace ROP byly klasifikovány dle mezinárodně platných kritérií (23).
Plus forma – tzv. stadium ROP 3+ byla definována přítomností dilatace a tortuositou sítnicových cév od terče zrakového nervu minimálně ve 2 kvadrantech očního pozadí.
Použití adjuvantní intravitrální aplikace anti-VEGF preparátů bylo povoleno Etickou komisí FN Brno v rámci schváleného grantového projektu IGA MZ ČR NS/9892-4. Rodičům všech léčených dětí byly vysvětleny možnosti konvenční léčby a možný očekávaný přínos intravitreální aplikace anti-VEGF preparátů. Od rodičů byl získán informovaný souhlas. Konvenční léčba laserovou fotokoagulací byla zahájena a provedena dle mezinárodních standardů časné léčby ROP (ETROP) (15).
Skupinu A tvoří 92 očí (46 dětí) léčených indirektní transpupilární fotokoagulací diodovým laserem (810 nm) s adjuvantní intravitreální aplikací pegaptanibu (60 očí) nebo bevacizumabu (32 očí). Skupina B zahrnuje 82 očí (41 dětí) se stejnou formou ROP, které byly ošetřeny klasickou fotokoagulací v kombinaci s kryoterapií. V případě kombinované léčby ve skupině B byl diodový laser aplikován v centrálních částech avaskulární sítnice, kryoterapie periferně od fotokoagulace při pečlivé kontrole indirektní oftalmoskopií v maximální mydriáze.
Ve skupině A byla po fotokoagulaci provedena v celkové nebo lokální anestezii intravitreální injekce pegaptanibu (0,3 mg) nebo bevacizumabu (0,625 mg/ 0,025 ml) v oblasti pars plana 2–3 mm od limbu v dolním nazálním nebo temporálním kvadrantu za aseptických podmínek po výplachu spojivkového vaku 5% roztokem Betadine. Po zákroku byly vždy aplikovány lokální antibiotika (Oftaquix gtt nebo Tobrex gtt) 5x denně po dobu 1 týdne.
Sledované a hodnocené parametry zahrnují: stupeň ROP před a po operaci, doba dosažení regrese – vymizení příznaků „plus disease“, dokončení normální periferní vaskularizace, porodní hmotnost, gestační věk v době zákroku a finální strukturální změny na očním pozadí v obou skupinách. Z hlediska celkového zdravotního stavu předčasně narozených dětí bylo hodnoceno Apgar skóre, doba event. intubace, doba hospitalizace na neonatologickém oddělení, přítomnost rizikových faktorů: sepse, nekrotizující enterokolitida, intraventrikulární hemoragie.
Jako úspěch léčby byla definována nepřítomnost recidivy stadia 3+ ROP na jednom nebo obou očích v zóně I nebo posteriorní zóně II do 55 týdnů gestačního věku (tzv. „recurrence rate = 0) Jako neúspěšná byla definována recidiva neovaskularizací na jednom nebo obou očích (tzv. „recurrence rate = 1, resp. 2) s nutností opakování léčebného zákroku. Základní charakterizující parametry a výsledky léčebných metod v obou skupinách byly statisticky zpracovány pomocí t-testu, Fisherova exaktního testu, Mann-Whitneyova testu. Hodnota P < 0,05 byla indikátorem statistické významnosti.
Všechny děti byly sledovány 1–2 měsíce po zákroku 1x týdně, později 1x za 14 dní, od 4. měsíce po operaci 1x za měsíc.
Průměrná doba sledování byla 23,5 měsíců (rozmezí 4–45 měs.) ve skupině A, 25,2 měsíců (rozmezí 3–48 měs.) ve skupině B. Nálezy na fundu před a po operaci byly dokumentovány pomocí RetCAM.
Výsledky
V obou skupinách očí byl výskyt stadia ROP 3+ v zóně I a v posteriorní zóně II zastoupen přibližně rovnoměrně. Stadium ROP 3+ v zóně I při zahájení léčby mělo 49 očí ve skupině A a 44 očí ve skupině B (P = 0,98), stadium ROP 3+ v posteriorní zóně II bylo přítomno u 43 očí skupiny A, u 38 očí skupiny B (P = 0,73). Průměrná porodní hmotnost byla 785 g ve skupině A a 813 g ve skupině B (P = 0,43). Průměrný gestační věk ve skupině A byl 24,7 týdnů a ve skupině B 25,1 týdnů (P = 0,79).
Postkoncepční věk v době provedení operace byl ve skupině A 33,8 týdnů, ve skupině B 34,2 týdnů (P = 0,21). Parametry hodnotící celkový stav nedonošených dětí (Apgar skóre, sepse, intraventrikulární hemoragie, enterokolitida, umělá plicní ventilace) v obou skupinách uvádí tabulka 1.
Tab. 1. Charakteristika 2 skupin dětí ošetřených pro ROP 3+ v zóně I a posterior zóně II 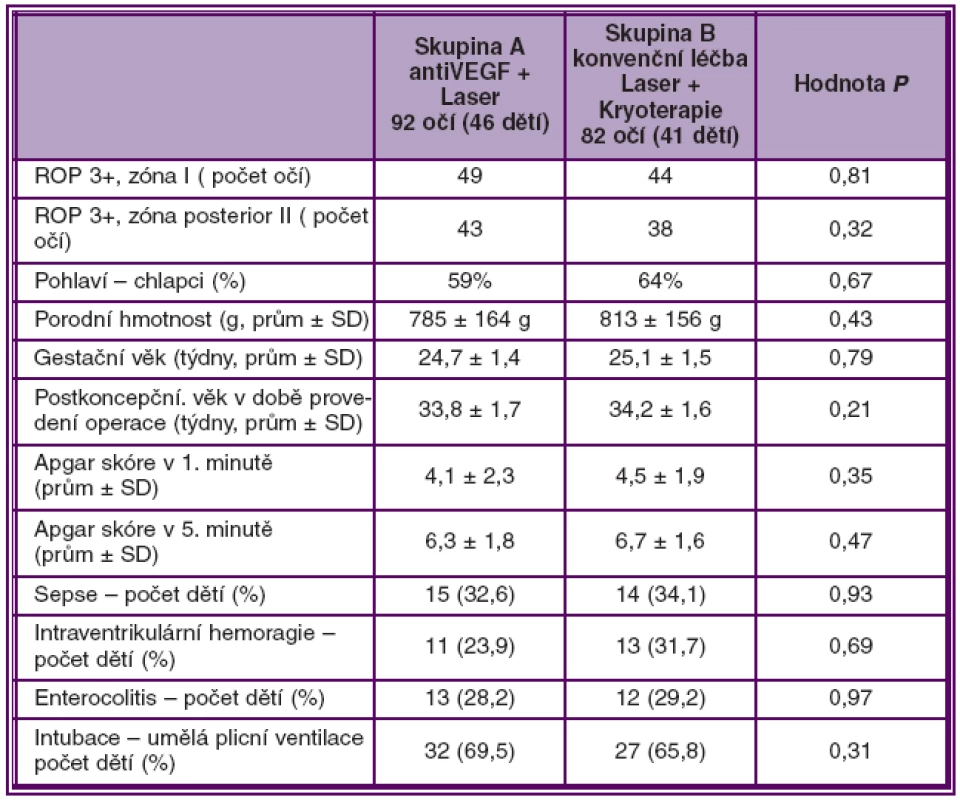
Ve skupině A bylo zaznamenáno statisticky významně rychlejší vymizení příznaků plus ROP a rychlejší dosažení normální periferní retinální vaskularizace než ve skupině B. Po provedené léčbě došlo k vymizení příznaků „plus disease“ (abnormální dilatace vén a tortuosita retinálních arterií) průměrně za 1,38 týdne ve skupině A, za 2,61 týdne ve skupině B (P = 0,0037).
Průměrná doba ukončení fyziologické periferní retinální vaskularizace byla ve skupině A 2,35 týdnů a ve skupině B 3,48 týdnů (P = 0,0126).
Bez recidivy neovaskularizací, nebo-li bez nutnosti opakovaného léčebného zákroku (reccurence rate = 0) bylo 87% dětí ve skupině A, a 53,7% dětí ve skupině B (P = 0,0183).
Recidivu neovaskularizací na jednom oku mělo 10,8 % dětí ve skupině A a 36,5 % dětí ve skupině B (P = 0,0297).
Příznivé anatomické změny na očním pozadí a stabilní regresi ROP při poslední kontrole mělo 90,2 % všech očí ošetřených kombinovanou terapií s intravitreální injekcí pegaptanibu nebo bevacizumabu ve skupině A. Ve skupině B očí ošetřených kryo - a fotokoagulací mělo příznivé strukturální změny a regresi ROP 62 % očí (P = 0,0214) (tab. 2, graf 1.).
Tab. 2. Srovnání výsledků léčby 2 skupin dětí ošetřených pro ROP 3+ v zóně I–II 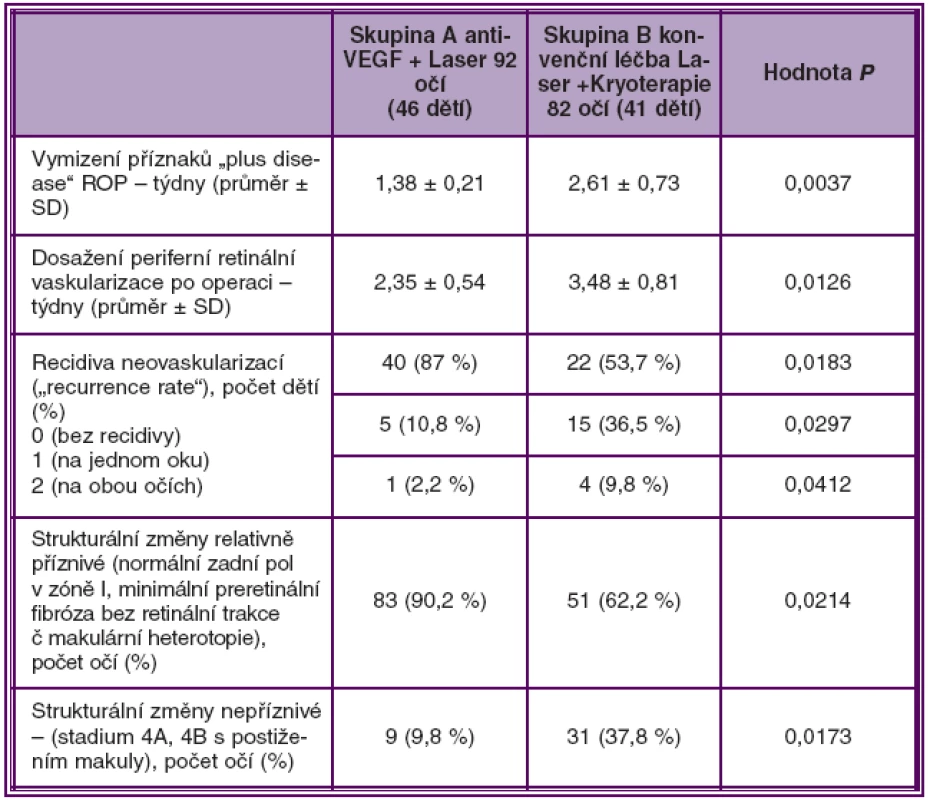
Statisticky významné hodnoty P < 0,05 (Fisherův exaktní test, Mann-Whitney U test) Graf 1. Srovnání výsledků léčby 2 skupin dětí ošetřených pro ROP 3+ v zóně I a posterior zóně II 
Při hodnocení srovnání účinnosti intravitreální aplikace pegaptanibu (60 očí) a bevacizumabu (32 očí) ve skupině A nebyly nalezeny statisticky signifikantní rozdíly mezi oběma blokátory VEGF v zastoupení finálního příznivého anatomického výsledku na očním pozadí (88,3 % versus 87,5 %, P = 0,827), v době vymizení přiznaků plus ROP a ve stimulaci normální periferní retinální vaskularizace (tab. 3, graf 2).
Tab. 3. Srovnání účinnosti pegaptanibu a bevacizumabu v kombinaci s laserovou fotokoagulací při léčbě ROP 3+ v zóně I a posterior zóně II ve skupině A 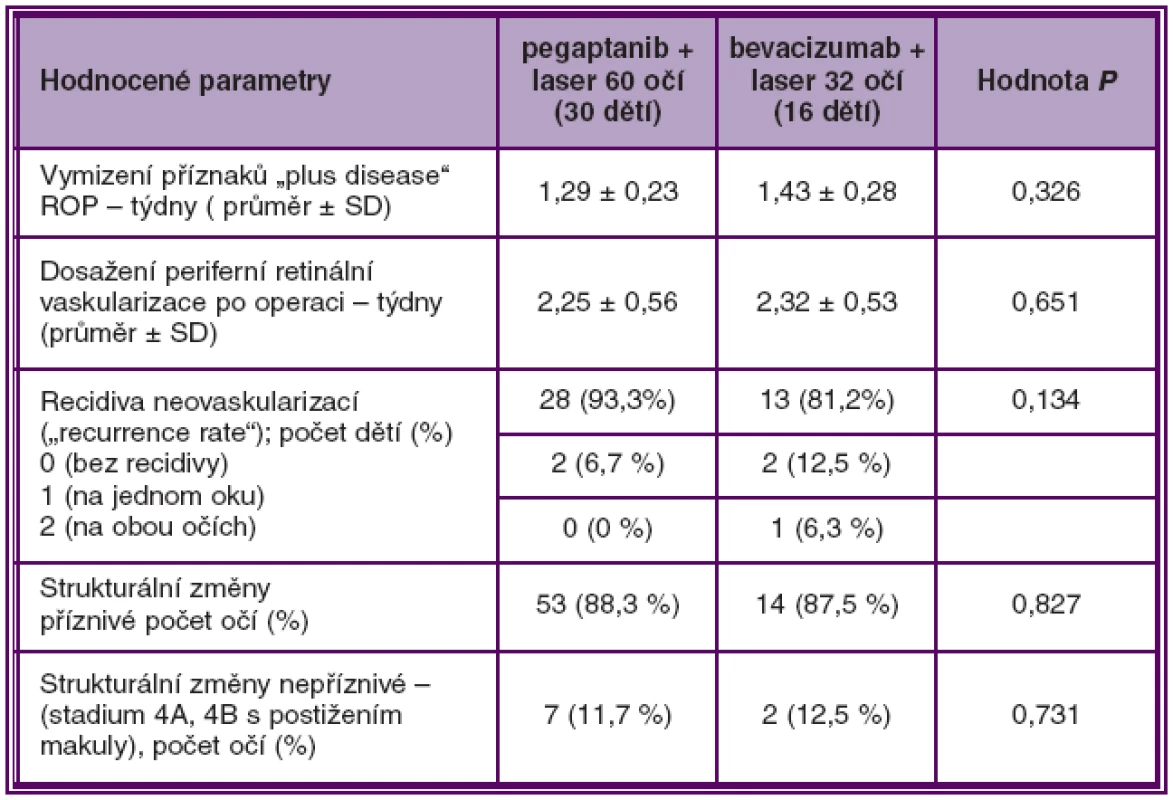
Statisticky významné hodnoty P < 0,05 (Fisherův exaktní test, Mann-Whitney U test) Graf 2. Srovnání účinnosti pegaptanibu a bevacizumabu v kombinaci s laserovou fotokoagulací při léčbě ROP 3+ v zóně I a posterior zóně II ve skupině A 
Peroperační komplikace zahrnovaly retinální hemoragie po fotokoagulaci u 8 % očí ve skupině A a 11 % očí ve skupině B (P = 0,358). Ve všech případech došlo postupně ke spontánní resorbci.
Nebyly zaznamenány žádné oční ani celkové komplikace či vedlejší účinky intravitreální injekce pegaptanibu nebo bevacizumabu.
Všichni pacienti zůstávají v pravidelném sledování a v další fázi budou hodnoceny funkční výsledky (zraková ostrost, zorné pole, elektrofyziologické testy) a výskyt refrakčních vad.
Diskuse
Zahájení naší studie v roce 2008 bylo vedeno snahou zlepšit výsledky léčby nedonošených dětí se závažnou formou ROP 3+ začínající v zóně I nebo posteriorní zóně II, tedy skupiny dětí s ROP, které jsou nejvíce ohroženy trvalou slepotou při selhání konvenční léčby. V té době byly k dispozici publikované výsledky ojedinělých případů úspěšné adjuvantní intravitreální aplikace neselektivního inhibitoru VEGF – bevacizumabu v léčbě ROP 3+, v kombinaci s klasickou laserovou fotokoagulací (19, 22, 26, 28, 52, 54).
V roce 2008 před zahájením grantového projektu byl k dispozici na naší klinice pro intravitrální aplikaci pouze bevacizumab. Díky podpoře grantu IGA MZ ČR bylo možno zahájit adjuvantní léčbu ROP pomocí intravitreální aplikace selektivního VEGF 165 inhibitoru – pegaptanibu (Macugen). Hlavním cílem bylo zlepšit výsledky standardně doporučované konvenční laserové nebo kryoterapie závažných forem ROP, zhodnotit účinnost a bezpečnost anti-VEGF terapie a doporučit nebo nedoporučit zařazení intravitreální aplikace anti-VEGF preparátů do standardů léčby ROP v ČR.
Dosud nebyla v české ani zahraniční odborné liteatuře publikována žádná systematická studie efektivity a bezpečnosti intravitreální aplikace selektivního inhibitoru VEGF – pegaptanibu v léčbě nedonošených dětí s ROP.
Rozvoj retinopatie nedonošených (ROP) probíhá ve 2 fázích: inicální fáze relativní hyperoxie s částečnou cévní obliterací je následována proliferací cév v důsledku relativní hypoxie (29). Vaskulární endoteliální růstový faktor (VEGF) jako angiogenní cytokin hraje klíčovou roli v rozvoji obou patogenních fází ROP. Za fyziologických okolností se VEGF podílí na normálním rozvoji sítnice a retinálních cév od terče zrakového nervu do periferie (2, 20). Zvýšená exprese VEGF s abnormálním rozvojem neovaskularizací ze sítnice do sklivce je nakonec provázena růstem patologické fibrovaskulární tkáně (48).
Experimentální studie prokázaly, že intravitreální injekce blokátorů VEGF umožní signifikantní inhibici neovaskularizace (1, 41).
Bevacizumab (Avastin; Genentech Inc, South San Francisco, California, USA), neselektivní anti-VEGF protilátka byla schválena k léčbě kolorektálního karcinomu a používá se také v intravitreální aplikaci v léčbě exsudativní věkem podmíněné makulární degenerace (VPMD) (45) a proliferativní diabetické retinopatie (PDR) (5).
Řada klinických studií prokázala příznivý efekt intravitreální injekce bevacizumabu v léčbě závažné formy ROP v zóně I–II, tedy v těch případech, kde konvenční léčba laserovou fotokoagulací a kryoterapií bývá často neúspěšná (8, 12, 15, 25, 38, 39).
Pegaptanib sodium (Macugen®) – selektivní RNA aptamer blokující izoformu VEGF-165 je úspěšně používán v léčbě neovaskularizací u VPMD, jeho efektivitu a bezpečnost oční i systémovou prokázala řada studií (4, 33, 46). Selektivní inhibitor VEGF-165 izoformy – pegaptanib v intravitreální aplikaci by měl být teoreticky bezpečnější možnost pro léčbu závažných forem ROP v zóně I–II. Blokuje jen izoformu VEGF zodpovědnou za patologickou neovaskularizaci. Ostatní izoformy VEGF, které jsou potřebné pro fyziologický rozvoj nervové tkáně a normální vaskulogenezi, zůstávají nedotčeny.
Retinopatie nedonošených (ROP) a její následky jsou nejčastější příčinou dětské slepoty v rozvinutých zemích (50). ROP v zóně I a posteriorní zóně II se vyskytuje přibližné u 10–20 % všech nedonošených dětí, které vyžadují léčbu. I přes provedenou konvenční léčbu laserovou fotokoagulací nebo kryoterapií stadia ROP 3+ v zóně I a II onemocnění může progredovat do strukturálně velmi nepříznivých změn – parciální nebo totální odchlípení sítnice nebo tvorbu fibrotické retrolentální tkáně.
CRYO-ROP studie uvádí 77,8 % očí s nepříznivým anatomických výsledkem po kryoterapii a studie ET-ROP prokazuje 55,2 % očí s nepříznivým anatomickým nálezem po laserové fotokoagulaci pro prahové stadium ROP v zóně I–II (12, 15).
Jiné klinické studie léčby ROP v zóně I–II uvádí taktéž rozmezí 40–77 % neúspěchu léčby v důsledku finálních patologických změn na fundu přes adekvátně provedenou laserovou fotokoagulaci (25, 27, 38). Za příčinu neúspěchu léčby ROP v těchto případech je považována aberantní angiogeneze, jejímž mediátorem je VEGF-165 (16). Dalším zdrojem zvýšené syntézy VEGF 165 při ROP jsou makrofágy ve sklivci (36).
Ačkoliv optimální dávka bevacizumabu pro intravitreální aplikaci v léčbě ROP není přesně stanovena (rozmezí 0,5 mg až 1,25 mg), publikované klinické studie prokazují účinnou a bezpečnou dávku 2,5 mg intravitreálně bez vedlejších systémových a očních vedlejších účinků a komplikací (17,31). Experimentální studie ukázaly, že dávky 0,5 až 2,5 mg bevacizumabu nemají nepříznivý vliv na hodnotu vizuálně evokovaných potenciálů a elektroretinogramu a histologicky nebyl prokázán žádný toxický efekt v sítnici (9, 32, 44).
Nejčastěji byla v klinických studiích při léčbě ROP používána dávka 0,5–0,75 mg intravitreálně (6, 10, 11, 43). V našem souboru dětí s ROP bylo podáno v intravitreální injekci 0,5 až 0,625 mg bevacizumabu nebo 0,3 mg pegaptanibu jednorázově. Tyto dávky byly dostatečné k tomu, aby v kombinaci s konvenční laserovou fotokoagulací přispěly k úspěšně regresi závažných forem ROP v zóně I – posterior II u většiny našich pacientů.
Naše výsledky přispívají k názoru, že intravitreální injekce inhibitorů VEGF bevacizumabu a pegaptanibu v léčbě stadia ROP 3+ nemusí být opakována.
Při systematické analýze bibliografických databází bylo nalezeno celkem 9 publikací 2007–2009 ve světové literatuře a všechny informují o příznivém efektu intravitreální aplikace bevacizumabu v léčbě celkem 48 nedonošených dětí (77 očí) s ROP.
Chung a spol. (22), Lalwani a spol. (28) dokumentují úspěšnou léčbu intravitreální aplikace 0,75 mg a 0,63 mg bevacizumabu v kombinaci s laserovou fotokoagulací stadia ROP 3+ v zóně I. U všech očí došlo k regresi a stabilizaci onemocnění v průběhu 3 měsíců sledování po zákroku (22, 28).
Práce Travassose a spoluautorů (52) ukazují na příznivý vliv intravitreální injekce bevacizumabu na regresi neovaskularizací v oblasti předního segmentu a urychlení resorpce tunica vasculosa lentis jako přípravu před laserovou fotokoagulací pro ROP 3 v zóně II. Překvapivě došlo po injekci bevacizumabu současně k regresi neovaskularizací v zóně II a následnému fyziologickému vývoji retinálních cév do periferie, takže nález nevyžadoval původně plánovanou laserovou fotokoagulaci (52).
Léčbu stadia ROP 4A+ po neúspěšné laserové fotokoagulaci pomocí intravitreální injekce 0,4 mg bevacizumabu a následnému přetrvání odchlípení sítnice popisuje práce Hondy a spoluautorů (19). Ačkoliv došlo k výrazné regresi neovaskulární složky fibrovaskulárních membrán po injekci, přetrvávající kontrakce fibrotických membrán způsobila odchlípení sítnice oblasti zadního pólu. Tato amoce byla nakonec úspěšně vyřešena vitrektomií. Nebyly zaznamenány žádné systémové ani lokální komplikace injekce bevacizumabu.
Kusaka a spoluautoři (26) uvádějí ve své retrospektivní studii výsledky 14 nedonošených dětí (23 očí) s ROP 3+ v zóně I až II, které byly léčeny kombinací laserové fotokoagulace a intravitrální aplikace bevacizumabu. Léčebný úspěch s příznivým anatomickým výsledkem byl zaznamenán u 15 očí. Nepříznivý finální výsledek s odchlípením sítnice mělo 8 očí.
Retrospektivní analýzu zhodnocení intravitreální aplikace bevacizumabu 0,625 mg jako monoterapie bez použití laserové fotokoagulace 22 očí u 11 nedonošených dětí s ROP v zóně I-II přináší práce Mintz-Hittnerové (35) a spoluautorů. U všech očí došlo po jediné injekci k regresi neovaskularizací s navozením kontinuální fyziologické vaskularizace do periferie sítnice.
Quiroz-Mercado a spoluatoři (54) dokumentují výsledky prospektivní studie 18 očí u 13 pacientů s ROP rozdělených do 3 skupin. V první skupině byly oči se stadiem 4A nebo 4B ROP po neúspěšné konvenční léčbě. Ve druhé skupině byly oči, u kterých optická média nebyla dostatečně čirá pro konvenční léčbu laserovou fotokoagulací. Ve 3. skupině byly oči s předprahovým nebo prahovým stadiem ROP 3. Ve všech případech byla intravitreálně aplikována jediná dávka 1,25 mg bevacizumabu. V první skupině byla dokumentována regrese do stadia I u 2 dětí. U dalších 2 dětí bylo nutno provést vitrektomii. Ve druhé a třetí skupině měly všechny děti regresi do stadia I během 4 týdnů a za 12 týdnů nebyly pozorovány žádné známky ROP. V celém souboru nebyly zaznamenány žádné systémové nebo oční komplikace intravitreální aplikace.
V posledních 2 letech byly publikovány nadějné výsledky nejen kombinované laserové fotokoagulace s intraviterální injekcí bevacizumabu, ale i jako anti-VEGF monoterapie.
Lee a spoluatoři (30) hodnotí ve své studii 16 očí (8 dětí) s ROP stadium 3 kombinovanou léčbu laserovou fotokoagulací s intravitreální injekcí bevacizumabu (0,5 mg) jako efektivní a bezpečnou. U všech očí popisují kompletní regresi do 2 týdnů po zákroku a nezaznamenali žádné systémové a oční komplikace.
Roohipoor a spoluatoři (42) použili kombinaci intravitrální injekce bevacizumabu (0,625 mg) před nebo po laserové fotokoagulaci u 12 očí s ROP stadium 3 v zóně I-II. Popisují úspěšnou regresi ROP v průběhu 1–2 týdne u 10 očí. U 2 očí bylo třeba pro recidivu neovaskularizací opakovat laserovou koagulaci do 1 měsíce po iniciálním zákroku. U všech očí byla intravitreální aplikace bevacizumabu dobře tolerována s navozením rychlé regrese a bez rozvoje komplikací, jako je endoftalmitida nebo odchlípení sítnice.
V roce 2011 Mintz-Hittner a spoluatoři (34) publikují výsledky dosud nejpočetnější prospektivní, randomizované, multicentrické studie celkem 150 nedonošených dětí s ROP 3+ v zóně I nebo posteriorní zóně II. Tato studie srovnává efekt léčby pouze intravitreální injekce bevacizumabu (0,625 mg) a klasické léčby laserovou fotokoagulací. Hlavním hodnoceným parametrem byla četnost recidivy ROP vyžadující opakovaný zákrok do 54. týdne postkoncepčního věku dítěte. Autoři prokázali signifikantně vyšší počet recidiv ROP v zóně I ve skupině dětí s konvenční laserovou léčbou (42 %) než ve skupině dětí s intravitreální aplikací bevacizumabu (6 %) (P = 0,003). Při srování počtu recidiv u dětí s ROP 3+ v posteriorní zóně II nebyl nalezen signifikantní rozdíl mezi oběma léčebnými modalitami (laser 12 % versus bevacizumab 5 %) ( P = 0,27). V celém souboru dětí (zóna I a posterior zóna II) byl nalezen vyšší počet recidiv po laserové terapii (26 %) než při monoterapii bevacizumabem (6 %). Studie prokázala příznivých léčebný efekt intravitraální aplikace bevacizumabu pro regresi ROP3+ zejména v zóně I.
Mintz-Hittner a spoluatoři (35) ve své retrospektivní studii 22 očí (11 dětí) popisují účinnou léčbu ROP 3+ v zóně I-II pouze jednorázovou intravitreální injekcí bevacizumabu bez nutnosti laserové terapie. U všech očí tohoto malého souboru byla léčba úspěšná s navozením regrese ROP. Průměrná doba sledování byla 48 týdnů a nebyly zaznámenány žádné lokální ani systémové komplikace této léčby.
Dorta a spoluatoři (13) informují o výsledcích monoterapie injekcí blokátoru VEGF v léčbě 12 očí sedmi nedonošených dětí (průměrná por. hmotnost 846 g, průměrný gestační týden 25,5) s ROP 3 v zóně I (9 očí) nebo v zóně II (3 oči). Ve všech případech byla dosažena regrese ROP a potvrzena účinnost intravitrální injekce bevacizumabu. Protože tento soubor očí je také velmi malý, autor vyzvedává potřebu dalších početnějších studií, které by potvrdily efektivitu nadějné léčby ROP pomocí intravitreální aplikace VEGF inhibitorů, jako monoterapie nebo v kombinaci s konveční laserovou fotokoagulací.
Naše prezentovaná studie potvrzuje, že adjuvantní intravitreální aplikace bevacizumabu a pegaptanibu v kombinaci s konvenční léčbou stadia ROP 3+ v zóně I–II rychleji zastaví progresi patologické neovaskulární proliferace, umožní rychlejší vymizení příznaků „plus disease“ (rozšíření a tortuosia retinálních cév) a navodí rychleji fyziologickou retinální vaskularizaci do periferie než pouze konvenční léčba laserovou fotokoagulací nebo kryoterapií. Další příznivým efektem intravitreální aplikace pegaptanibu nebo bevacizumabu je nižší výskyt recidivy neovaskularizací s nutnosti opakování léčebného zákroku. Tím nejdůležítějším výsledkem je finální příznivý anatomický – strukturální nález na očním pozadí bez postižení zadního pólu u 90,2 % očí v našem souboru. Ve srovnání s 62 % očí při použití konvenční léčby je tento rozdíl statisticky signifikantní.
Při srovnání účinnosti intravitreální aplikace pegaptanibu (60 očí) a bevacizumabu (32 očí) v našem souboru nebyly nalezeny statisticky signifikantní rozdíly mezi oběma blokátory VEGF v dosažení finálního příznivého anatomického výsledku na očním pozadí, v době vymizení přiznaků plus ROP, a ve stimulaci normální periferní retinální vaskularizace.
V naší studii nebyly zaznamenány žádné oční komplikace či systémové vedlejší účinky intavitreální aplikace bevacizumabu ani pegaptanibu v průběhu celé doby sledování po operaci.
Výsledky naší studie ukazují, že intravitreální injekce anti-VEGF preparátů pegaptanibu nebo bevacizumabu v kombinaci s fotokoagulací diodovým laserem je účinná a bezpečná pro regresi stadia ROP 3+ v zóně I a posterior II s navozením normální vaskularizace periferní sítnice a příznivým strukturálním výsledkem. Pomocí této kombinované léčby bylo dosaženo statisticky významně lepších anatomických výsledků s menším výskytem nepříznivých strukturálních změn na očním pozadí.
Závěrem lze doporučit zařazení intravitreální aplikace anti-VEGF preparátů – pegaptanibu nebo bevacizumabu do standardního léčebného protokolu u nedonošených dětí s rozvojem stadia ROP 3+ v zóně I–II. V budoucnosti lze očekávat výrazně nižší procento dětí s těžkým zrakovým postižením následkem retinopatie nedonošených.
Studie byla realizována díky podpoře grantového projektu IGA MZ ČR (NS/9892-4)
Do redakce doručeno dne 31. 1. 2012
Do tisku přijato dne 10. 2. 2012
Prof. MUDr. Rudolf Autrata, CSc., MBA
Dětská oční klinika LF MU a FN Brno
Černopolní 9
613 00 Brno
e-mail: rautrata@fnbrno.cz
Zdroje
1. Aiello, L.P., Pierce, E.A., Foley, E.D., et al.: Suppression of retinal neovascularization in vivo by inhibition of vascular endothelial growth factor (VEGF) using soluble VEGF-receptor chimeric proteins. Proc Natl Acad Sci U S A 1995; 92 : 10457–10461.
2. Alon, T., Hemo, I., Itin, A., Peter, J., Stone, J., Keshet, E.: Vascular endothelial growth factor acts as a survival factor for newly formed retinal vessels and has implications for retinopathy of prematurity. Nat Med 1995; 1 : 1024–1028.
3. Altinsoy, H.I., Mutlu, F.M., Güngör, R., Sarici, S.U.: Combination of laser photocoagulation and intravitreal bevacizumab in aggressive posterior retinopathy of prematurity. Ophthalmic Surg Lasers Imaging 2010; 27 : 345–349.
4. Apte, R.S., Modi, M., Masonson, H., et al.: Pegaptanib 1-year systemic safety results from a safety-pharmacokinetic trial in patients with neovascular age-related macular degeneration. Ophthalmology 2007; 114 : 1702–12.
5. Arevalo, J.F., Garcia-Amaris, R.A.: Intravitreal bevacizumab for diabetic retinopathy. Curr Diabetes Rev 2009; 5 : 39–46.
6. Avery, R.L., Pearlman, J., Pieramici, D.J. et al.: Intravitreal bevacizumab (Avastin) in the treatment of proliferative diabetic retinopathy. Ophthalmology, 2006; 113 : 1695–1705.
7. Axer-Siegel, R., Snir, M., Cotlear, D., et al.: Diode laser treatment of posterior retinopathyof prematurity. Br J Ophthalmol 2000; 84 : 1383–6.
8. Axer-Siegel, R., Snir, M., Cotlear, D, et al.: Diode laser treatment of posterior retinopathy of prematurity. Br J Ophthalmol 2000; 84 : 1383–1386.
9. Bakri, S.J., Cameron, J.D., McCannel, C.A., Pulido, J.S., Marler, R.J.: Absence of histologic retinal toxicity of intravitreal bevacizumab in a rabbit model. Am J Ophthalmol, 2006; 142 : 162–164.
10. Beer, P.M., Wong, S.J., Hammad, A.M., Falk, N.S., O’Malley, M.R., Khan, S.: Vitreous levels of unbound bevacizumab and unbound vascular endothelial growth factor in two patients. Retina 2006, 26 : 871–876.
11. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter trial of cryotherapy for retinopathy of prematurity: preliminary results. Arch Ophthalmol 1988; 106 : 471–9.
12. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Multicenter trial of cryotherapy for retinopathy of prematurity. Three-month outcome. Arch Ophthalmol 1990; 108 : 195–204.
13. Dorta, P., Kychenthal, A. Treatment of type 1 retinopathy of prematurity with intravitreal bevacizumab (Avastin). Retina 2010; 30: Suppl: S24–S31.
14. Drenser, K.A., Tresem M.T., Capone, A. Jr.: Aggressive posterior retinopathy of prematurity. Retina 2010; 30: Suppl: S37–S40.
15. Early Treatment for Retinopathy of Prematurity Cooperative Group. Revised indications for the treatment of retinopathy of prematurity: results of the Early Treatment for Retinopathy of Prematurity randomized trial. Arch Ophthalmol 2003; 121 : 1684–94.
16. Flynn, J.T., Chan-Ling, T.: Retinopathy of prematurity: Two distinct mechanisms that underlie zone 1 and zone 2 disease. Am J Ophthalmol, 2006, 142 : 46–59.
17. Fung, A.E., Rosenfeld, P.J., Reichel, E.: The International Intravitreal Bevacizumab Safety Survey: using the internet to assess drug safety worldwide. Br J Ophthalmol,2006, 90 : 1344–1349.
18. Gilbert, C.: Retinopathy of prematurity: a global perspective of the epidemics, population of babies at risk and implication for control. Early Hum Dev 2008; 84 : 77–82.
19. Honda, S., Hirabayashi, H., Tsukahara, Y., Negi, A.: Acute contraction of the proliferative membrane after intravitreal injection of bevacizumab for advanced retinopathy of prematurity. Graefes Arch Clin Exp Ophthalmol 2008; 246 : 1061–3.
20. Chan-Ling, T., Gock, B., Stone, J.: The effect of oxygen on vasoformative cell division. Evidence that ‘physiological hypoxia’ is the stimulus for normal retinal vasculogenesis. Invest Ophthalmol Vis Sci 1995; 36 : 1201–1214.
21. Chen, J., Smith, L.E.: Retinopathy of prematurity. Angiogenesis 2007; 10 : 133–140.
22. Chung, E.J., Kim, J.H., Ahn, H.S., Koh, H.J.: Combination of laser photocoagulation and intravitreal bevacizumab (Avastin) for aggressive zone I retinopathy of prematurity. Graefes Arch Clin Exp Ophthalmol 2007; 245 : 1727–30.
23. International Committee for the Classification of Retinopathy of Prematurity. The International Classification of Retinopathy of Prematurity revisited. Arch Ophthalmol 2005; 123 : 991–9. (Erratum, Arch Ophthalmol 2006; 124 : 1669–70.)
24. Ishida, S.,, Usui, T., Yamashiro, K., et al.: VEGF 164-mediated inflammation is required for pathological, but not physiological, ishcemia-reduced retinal neovascularization. J Exp Med 2003, 198 : 483–489.
25. Katz, X., Kychenthal, A., Dorta, P.: Zone Iretinopathy of prematurity. J AAPOS 2000; 4 : 373–6.
26. Kusaka, S., Shima, C., Wada, K., et al.: Efficacy of intravitreal injection of bevacizumab for severe retinopathy of prematurity: a pilot study. Br J Ophthalmol 2008; 92 : 1450–5.
27. Kychenthal, A., Dorta, P., Katz, X.: Zone I retinopathy of prematurity: clinical characteristics and treatment outcomes. Retina 2006; 26: Suppl: S11–S15.
28. Lalwani, G.A., Berrocal, A.M., Murray, T.G., et al.: Off-label use of intravitreal bevacizumab (Avastin) for salvage treatment in progressive threshold retinopathy of prematurity. Retina 2008; 28: Suppl: S13–S18. (Erratum, Retina 2009; 29 : 127.)
29. Law, J.C., Recchia, F.M., Morrison, D.G., Donahue, S.P., Estes, R.L.: Intravitreal bevacizumab as adjunctive treatment for retinopathy of prematurity. J AAPOS 2010;14 : 6-10.
30. Lee, J.Y., Chae, J.B., Yang, S.J, Yoon, Y.H., Kim, J.G.: Effects of intravitreal bevacizumab and laser in retinopathy of prematurity therapy on the development of peripheral retinal vessels. Graefes Arch Clin Exp Ophthalmol 2010; 248 : 1257–62.
31. Lynch, S.S., Cheng, C.M.: Bevacizumab for neovascular ocular diseases. Ann Pharmacother 2007, 41 : 614–625.
32. Manzano, R.P., Peyman, G.A., Khan, P., Kivilcim, M.: Testing intravitreal toxicity of bevacizumab (Avastin). Retina, 2006, 26 : 257–261.
33. Marcus, D.M.: VEGF Inhibition Study in Ocular Neovascularization Clinical Trial Group. Four-year safety of pegaptanib sodium in neovascular age-related macular degeneration (AMD): results of the V.I.S.I.O.N. trial. Invest Ophthalmol Vis Sci 2008; 49: E-abstract 5069.
34. Mintz-Hittner, H.A., Kennedy, K.A., and Chuang, A.Z.: Efficacy of Intravitreal Bevacizumab for Stage 3+ Retinopathy of Prematurity N Engl J Med 2011, 364;7 : 603–615.
35. Mintz-Hittner, H.A., Kuffel, R.R. Jr.: Intravitreal injection of bevacizumab (Avastin) for treatment of stage 3 retinopathy of prematurity in zone I or posterior zone II. Retina 2008; 28 : 831–8. (Erratum, Retina 2008; 28 : 1374.)
36. Naug, H., Browning, J., Gole, G., Gobe, G.: Vitreal macrophages express VEGF165 in oxygen-induced retinopathy. Clin Exp Optom, 2000, 28 : 48–52.
37. Nazari, H., Modarres, M., Parvaresh, M.M., Falavarjani, K.G.: Intravitreal bevacizumab in combination with laser therapy for the treatment of severe retinopathy of prematurity (ROP) associated with vitreous or retinal hemorrhage. Graefes Arch Clin Exp Ophthalmol 2010; 248 : 1713–8.
38. O’Keefe, M., Lanigan, B., Long, VW.: Outcomes of zone I retinopathy of prematurity.Acta Ophthalmol Scand 2003; 81 : 614–6.
39. Récsán, Z., Vámos, R., Salacz, G.: Laser treatment of zone I prethreshold andstage 3 threshold retinopathy of prematurity. J Pediatr Ophthalmol Strabismus 2003;40 : 204–7.
40. Repka, M.X., Tung, B., Good, W.V., et al.: Outcome of eyes developing retinal detachment during the Early Treatment for Retinopathy of Prematurity Study (ETROP). Arch Ophthalmol 2006; 124 : 24–30.
41. Robinson, G.S., Pierce, E.A., Rook, S.L., Foley, E., Webb, R., Smith, L.E.: Oligodeoxynucleotides inhibit retinal neovascularization in a murine model of proliferative retinopathy. Proc Natl Acad Sci U S A 1996; 93 : 4851–4856.
42. Roohipoor, R., Ghassemi, H., Ghassemi, F., Karkhanech, R. et al.: Intravitreal bevacizumab in retinopathy of prematurity: an intervetional case series Graefes Arch Clin Exp Ophthalmol 2011; 2489 : 1295–1301
43. Shah, P.K., Narendran, V., Tawansy, K.A., Raghuram, A., Narendran, K.: Intravitreal bevacizumab (Avastin) for post laser anterior segment ischemia in aggressive posterior retinopathy of prematurity. Indian J Ophthalmol, 2007, 55 : 75–76.
44. Shahar, J., Avery, R.L., Heilweil, G. et al.: Electrophysiologic and retinal penetration studies following intravitreal injection of bevacizumab (Avastin). Retina, 2006, 26 : 262–269.
45. Schouten, J.S., La Heij, E.C., Webers, C.A., Lundqvist, I.J., Hendrikse, F.: A systematic review on the effect of bevacizumab in exudative age-related macular degeneration. Graefes Arch Clin Exp Ophthalmol 2009; 247 : 1–11.
46. Singerman, L.J., Masonson, H., Patel, M., et al.: Pegaptanib sodium for neovascularage-related macular degeneration: third-year safety results of the VEGF Inhibition Study in Ocular Neovascularisation (VISION) trial. Br J Ophthalmol 2008; 92 : 1606–11.
47. Smith, L.E.H.: Through the eyes of achild: understanding retinopathy throughROP: the Friedenwald lecture. Invest Ophthalmol Vis Sci 2008; 49 : 5177–82.
48. Smith, L.E., Wesolowski, E., McLellan, A., et al.: Oxygen induced retinopathy in the mouse. Invest Ophthalmol Vis Sci 1994; 35 : 101–111.
49. Spencer, R.: Long-term visual outcomes in extremely low-birth-weight children (an American Ophthalmological Society thesis). Trans Am Ophthalmol Soc 2006;104 : 493-516.
50. Stenkuller, P.G., Du, L., Gilbert, C et al.: Childhood blindness. J AAPOS 1999, 3 : 26–32.
51. Storkebaum, E., Carmeliet, P.: VEGF: critical player in neurodegeneration. J.CLin Invest., 2004, 113: p. 14-18.
52. Travassos, A., Teixeir, S., Ferreira, P., et al.: Intravitreal bevacizumab in aggressive posterior retinopathy of prematurity. Ophthalmic Surg Lasers Imaging 2007; 38 : 233–7.
53. Quinn, G.E., Dobson, V., Barr, C.C., et al.: Visual acuity of eyes after vitrectomy forretinopathy of prematurity: follow-up at5 1/2 years. Ophthalmology 1996; 103 : 595–600.
54. Quiroz-Mercado, H., Martinez-Castellanos, M.A., Hernandez-Rojas, M.L, Salazar - Teran, N, Chan, R.V.: Antiangiogenic therapy with intravitreal bevacizumab for retinopathy of prematurity. Retina 2008; 28: Suppl: S19–S25.
Štítky
Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2012 Číslo 1- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Výskyt refrakčních vad s následnou volbou korekční pomůcky
- Naše patnáctileté zkušenosti s LASIKem
- Floppy eyelid syndrom a syndrom obstrukční spánkové apnoe
- Přínos intravitreální aplikace anti-VEGF preparátů v léčbě prahového stadia ROP 3+ v zóně I–II: Výsledky čtyřleté studie
- Plyny vo vitreoretinálnej chirurgii
- Vybrané prognostické faktory malígneho melanómu uvey
- Srovnávací studie měření nitroočního tlaku aplanační tonometrií, bezkontaktní tonometrií a TonoPenem
- Oznámení
- Pozvánka
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Plyny vo vitreoretinálnej chirurgii
- Floppy eyelid syndrom a syndrom obstrukční spánkové apnoe
- Vybrané prognostické faktory malígneho melanómu uvey
- Srovnávací studie měření nitroočního tlaku aplanační tonometrií, bezkontaktní tonometrií a TonoPenem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



