-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Perspektivy buněčné terapie v oftalmologii
2. Potenciál kmenových buněk pro léčbu onemocnění sítnice
Autori: B. Heřmánková; V. Holáň
Pôsobisko autorov: Ústav experimentální medicíny AV ČR, v. v. i, Oddělení transplantační imunologie, Praha 4, vedoucí oddělení prof. RNDr. Vladimír Holáň, DrSc.
Vyšlo v časopise: Čes. a slov. Oftal., 72, 2016, No. 1, p. 272-275
Kategória: Původní práce
Súhrn
Onemocnění sítnice představují rozsáhlou skupinu dědičných i získaných chorob, které často vedou až ke ztrátě zraku. V současné době neexistuje účinná terapie degenerace sítnice, proto je u mnoha onemocnění používána pouze podpůrná terapie. Perspektivu léčby onemocnění sítnice představuje buněčná terapie založená na využití kmenových buněk. Vhodnými kandidáty mezi kmenovými buňkami jsou mezenchymální kmenové buňky, které kromě svých schopností diferenciace v buňky sítnice mají i protektivní vliv a schopnost imunomodulace.
Klíčová slova:
onemocnění sítnice, terapie, kmenové buňky, mezenchymální kmenové buňkyÚVOD
Sítnice je jednou z nejdůležitějších částí našeho oka, jejíž hlavní funkcí je snímání a předzpracovávání přicházejících světelných signálů. Je složena z deseti vrstev rozdílných buněk, které spolu neustále vzájemně komunikují a předávají si signály. První vrstvou uloženou nejdále od dopadajícího světla jsou epiteliální pigmentové buňky (EPB), dále následuje vrstva tvořená fotoreceptory – tyčinkami a čípky, zevní ohraničující membrána, zevní jádrová vrstva, zevní plexiformní vrstva, vnitřní jádrová vrstva složená z bipolárních, horizontálních a amakrinních buněk, dále vnitřní plexiformní vrstva, vrstva gangliových buněk, vrstva axonů gangliových buněk a nervových vláken a nakonec vnitřní ohraničující membrána. Poškození kterékoliv z těchto vrstev vede k porušení funkce a homeostázy celé sítnice, což v mnoha případech způsobí zhoršení vidění až slepotu (1). V současné době neexistuje účinná možnost léčby degenerace sítnice, podávaná léčiva pouze zpomalují rozvoj degenerativních onemocnění. Jistou naději pro léčbu onemocnění sítnice poskytuje buněčná terapie založená na aplikaci kmenových buněk. Pro buněčnou terapii přicházejí v úvahu tři typy kmenových buněk: embryonální kmenové buňky (ESC) získávané z blastocysty embrya, kmenové buňky izolované z tkání dospělého organismu a tzv. indukované pluripotentní kmenové buňky (iPSC) připravované laboratorně vnesením specifických genů do somatických buněk dospělého organismu.
Kmenové buňky a terapie
Nejčastěji poškozenými buňkami sítnice jsou fotoreceptory, EPB a gangliové buňky. Ideálním řešením by byla jejich náhrada zdravými buňkami a následné obnovení interakcí mezi jednotlivými vrstvami. Perspektivu pro buněčnou terapii onemocnění sítnice představují kmenové buňky, které by nahradily konkrétní chybějící či poškozený buněčný typ.
Embryonální kmenové buňky
ESC jsou pluripotentní buňky schopné se vyvíjet v jakýkoliv buněčný typ dospělého organismu. Jejich nevýhodou je častý nekontrolovatelný růst, možnost tvorby teratomů v organismu, jejich použití také limitují etické problémy spojené s jejich původem a přípravou (1, 4).
Indukované pluripotentní kmenové buňky
Nadějnějším kandidátem pro buněčnou terapii se proto ukázaly iPSC, které jsou uměle připravovány ze somatických buněk dospělého organismu pomocí vnesení genů pro transkripční faktory Oct4, Sox2, Klf4, cMyc. Takto modifikované somatické buňky získávají vlastnosti buněk kmenových a schopnost se diferencovat do všech zárodečných linií, tento proces je nazýván reprogramace. Tyto kmenové buňky přinesly velkou naději v možnosti přípravy buněk daného jedince s následným autologním použitím v terapii. Ukázalo se však, že vlivem vnesení genů pro transkripční faktory může v reprogramovaných buňkách dojít k ovlivnění exprese i jiných genů. Bylo pozorováno, že použití takto modifikovaných buněk při jejich autologní transplantaci vedlo k aktivaci imunitního systému. Použití iPSC omezují také problémy s neúplnou reprogramací buněk a s možností přenosu cizích genů pomocí virových vektorů. Ukazuje se také, že iPSC mohou vytvářet v organismu teratomy podobně jako ESC (21).
Kmenové buňky dospělého organismu
Z výše uvedených důvodů se jako nejvhodnější typ pro buněčnou terapii onemocnění sítnice jeví kmenové buňky izolované z tkání dospělého organismu, kam můžeme zařadit například hematopoetické kmenové buňky, kmenové buňky vyskytující se specificky v jednotlivých tkáních nebo mezenchymální kmenové buňky (MSC). MSC mohou být transplantovány bez genetické modifikace, jsou schopné migrovat do místa poškození a diferencovat se na řadu různých buněčných typů, včetně buněk sítnice. Doposud nebyla zjištěna tvorba teratomů po jejich transplantaci do organismu. MSC byly prokázány prakticky ve všech tkáních mezodermálního původu a nejčastěji jsou izolovány z kostní dřeně nebo tukové tkáně (1, 19). Četné studie již potvrdily vhodnost použití MSC v léčbě poškození rohovky (7, 11).
Protektivní efekt MSC
Kmenové buňky mohou zprostředkovat terapeutický efekt jednak přímou diferenciací v buňky postižené tkáně nebo produkcí řady růstových a trofických faktorů. Parakrinní působení kmenových buněk ovlivňuje prostředí poškozené tkáně, chrání ji a aktivuje opravné mechanismy. MSC inhibují škodlivou zánětlivou reakci v místě poškození a produkují mimo jiné i neurotrofické faktory jako mozkový neurotrofický faktor (BDNF), ciliární neurotrofický faktor (CNTF), neurotrofický faktor z gliální linie (GDNF) nebo bazický fibroblastový růstový faktor (bFGF). U mnoha onemocnění spojených s poškozením sítnice bylo prokázáno zvýšené přežívání buněk při působení neurotrofických faktorů produkovaných MSC (19). Jedním ze současných směrů výzkumu je proto snaha o bezpečný a efektivní způsob dopravy neuroprotektivních buněk do místa poškození tkáně a zajištění dlouhodobé produkce neurotrofických faktorů v místě poškození (3).
Imunomodulační vlastnosti MSC
Kromě protektivního působení mají MSC i schopnost imunomodulace, potlačují aktivaci a funkce buněk přirozené i adaptivní imunity a podporují přesmyk imunitní odpovědi na protizánětlivou (15). Na buňky imunitního systému mohou MSC působit jak mezibuněčným kontaktem, tak pomocí solubilních imunomodulačních molekul jako jsou například indolamin dioxygenáza (17), oxid dusnatý (22), prostaglandin E2 (6), transformující růstový faktor-β (23) a další.
Diferenciace MSC in vitro
Bylo prokázáno, že MSC jsou kromě osteogenní, chondrogenní a adipogenní diferenciace schopné také diferencovat na buňky exprimující znaky buněk sítnice. U MSC izolovaných ze spojivky byla zjištěna po kultivaci na nanovlákenných nosičích za použití taurinu exprese znaků typických pro fotoreceptory a bipolární buňky (18) (tabulka 1). Diferenciace MSC potkana na buňky exprimující typické znaky fotoreceptorů byla prokázána i po použití taurinu, aktivinu A a epidermálního růstového faktoru (14).
Tab. 1. Typické znaky jednotlivých buněk sítnice 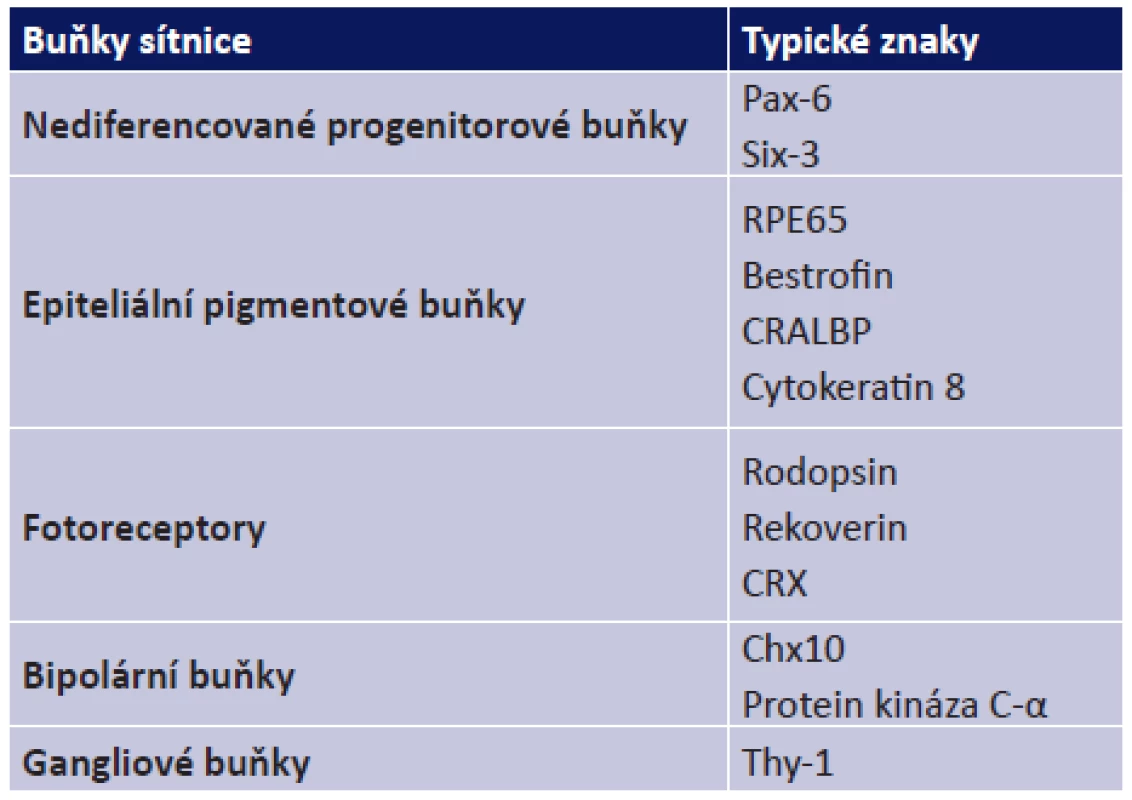
Kromě diferenciace v buňky se znaky fotoreceptorů jsou MSC schopné diferenciace také na EPB a exprimovat znaky typické pro tyto sítnicové buňky jako jsou například bestrofin nebo RPE65 (24) (tabulka 1). Exprese znaků specifických pro EPB byla zjištěna také u lidských MSC kultivovaných spolu s izolovanými lidskými EPB (10, 16). Podobné výsledky byly popsány i u MSC potkana, u kterých byla diferenciace na EPB navozena kultivačními podmínkami připomínajícími vývoj těchto buněk v rámci sítnice (8). Tyto pokusy ukazují potenciál MSC diferencovat v buňky sítnice a tak podporují perspektivu využití MSC v léčbě sítnicových onemocnění.
Onemocnění sítnice
Onemocnění sítnice patří mezi velmi závažná a často vedoucí až ke ztrátě zraku. V současné době jsou používané metody terapie velmi invazivní a spojené se závažnými vedlejšími účinky, u mnoha onemocnění sítnice navíc existuje pouze podpůrná terapie, která se snaží zmírnit důsledky onemocnění. MSC proto představují svými diferenciačními, protektivními i imunomodulačními vlastnostmi perspektivní kandidáty pro buněčnou terapii zatím neléčitelných onemocnění sítnice.
Dědičná onemocnění sítnice
Mezi nejčastější dědičná onemocnění sítnice patří retinitis pigmentosa (RP). Toto onemocnění zahrnuje řadu genetických poruch, u kterých dochází k poškození a následnému odumírání tyčinek. V pozdější fázi se vyskytuje také degradace čípků a EPB vedoucí k celkové slepotě. V současné době neexistuje úspěšná léčba této nemoci (19). V experimentálním modelu chemicky navozené RP bylo zjištěno, že po subretinálním podání se tyto buňky nachází ve vnější vrstvě sítnice a diferencují se zde na buňky exprimující znaky EPB a fotoreceptorů (9) (tabulka 1). Jiní autoři potvrdili prodloužené přežívání fotoreceptorů po transplantaci MSC izolovaných z kostní dřeně na modelu myši s vyřazeným genem pro rodopsin. MSC se integrovaly nejen do vrstvy EPB, ale také do neurálních a gliových vrstev sítnice. Důležitým faktorem v tomto případě byla hlavně produkce neurotrofických faktorů aplikovanými MSC (2). V současné době běží tři klinické studie na využití MSC při léčbě RP, které jsou zaměřené například na výběr nejvhodnějšího způsobu aplikace buněk a bezpečnost použití MSC (19).
Dalším dědičným onemocněním je Stargardtova choroba, která je nejčastějším onemocněním sítnice objevujícím se již v nízkém věku. Při tomto onemocnění odumírají EPB vzhledem k ukládání lipofuscinu, což vede také k degradaci fotoreceptorů v oblasti makuly a ztrátě centrálního vidění (4). Na experimentálním modelu laboratorního potkana bylo pozorováno, že již 2 týdny po subretinální aplikaci MSC došlo k jejich integraci do sítnice a formování buněk exprimující znaky fotoreceptotů (14) (tab. 1).
Ischemická onemocnění sítnice
Diabetická retinopatie (DR) je onemocnění sítnice, při kterém je poškozeno její cévní zásobení a v pokročilém stadiu může vést až k nevratné ztrátě zraku, DR postihuje až 60 % pacientů s diabetes mellitus. V počáteční fázi dochází k zeslabování stěn cév s tvorbou mikroaneuryzmat v jejich stěnách. Nedostatečné okysličení buněk způsobuje odumírání buněk endotelu a pericytů, vzniká vaskulární okluze, která zabraňuje dostatečnému vyživování a v důsledku toho zde dochází k hypoxii až ischemii. Tento proces je navíc doprovázen produkcí angiogenního faktoru a tvorbou nových cév. U nově vzniklých cév dochází k rupturám a krvácení do sklivce, což společně s tvorbou fibrózních jizev vede k poruchám vidění a ve finální formě k oslepnutí. V současné době je k léčbě využívána intravitreální aplikace kortikoidů, laserová fotokoagulace nebo vitreoktomie. Tyto metody jsou však velmi invazivní a jsou spojeny se závažnými komplikacemi (3).
Na modelu diabetu u laboratorního potkana bylo ukázáno, že po intravenózní aplikaci MSC se tyto buňky dostaly do poškozené sítnice a diferencovaly se zde na buňky astrocytů a buňky exprimující rodopsin. Současně bylo touto skupinou prokázáno, že MSC redukovaly hladinu glukózy v krvi a obnovily porušenou bariéru mezi krví a sítnicí (25). Podobné výsledky byly zjištěny po aplikaci lidských tukových MSC do sklivce u potkana s navozením diabetu. Po aplikaci byly MSC nalezeny hlavně v okolí cév sítnice, kde došlo k potlačení exprese zánětlivých znaků a zvýšenému přežívání buněk sítnice (20).
Ostatní onemocnění sítnice
Nejčastější příčinou poruch vidění a slepoty nejen u nás je věkem podmíněná makulární degenerace (VPMD), která se vyskytuje u pacientů starších 50 let. Postihuje fotoreceptory a vrstvu EPB v místě makuly, což vede ke ztrátě centrálního vidění. VPMD se vyskytuje v suché (atrofické) a vlhké (exsudativní) podobě. U suché formy se ukládají amorfní deposita do sítnice, což vede k degradaci EPB. Vlhká forma je méně častá ale nebezpečnější, dochází zde k choroidální neovaskularizaci, kde následná hemoragie a fibróza mohou způsobit poškození makuly. U obou typů onemocnění je zaznamenáno poškození fotoreceptorů, zatímco vnitřní část sítnice zůstává zachovaná bez poškození. Tyto patologie naznačují, že potenciální terapií by mohlo být nahrazení poškozených buněk. V současné době je vlhká forma léčena fotodynamickou terapií a také blokací vaskulárního endoteliálního růstového faktoru, pro suchou formu nyní neexistuje žádná efektivní léčba (3, 4). Na modelu degenerace sítnice u laboratorního potkan bylo ukázáno, že subretinálně podané MSC nahradily pigmentové buňky a obnovily integritu jednotlivých vrstev sítnice (5).
Glaukomy jsou skupinou chronických degenerativních onemocnění, dochází u nich k pomalé progresivní degeneraci gangliových buněk sítnice, což vede až k nevratné ztrátě zraku. V současné době je léčba zaměřena pouze na snížení nitroočního tlaku a zpomalení postupu onemocnění. Nové terapie navrhují aplikovat chybějící neurotrofické faktory jako BDNF, GDNF nebo CNTF (13). Pro dosažení požadovaného efektu je ale potřeba jejich opakované aplikace, proto by bylo vhodnějším řešením podání MSC produkujících tyto faktory přímo do místa poškození. Studie na experimentálním modelu glaukomu ukázaly, že po injekčním podání MSC do sklivce dochází v místě poškození k produkci chybějících neurotrofických faktorů, což má za důsledek snížené odumírání gangliových buněk v sítnici. Nebyla zde ale prokázána schopnost MSC se diferencovat a exprimovat znaky typické pro buňky sítnice (12, 26) (tab. 1). První klinická studie využívající MSC z kostní dřeně při léčbě glaukomu začala v roce 2013 (19).
Mechanické poškození sítnice
Sítnice může být poškozena také mechanicky při úrazu nebo při vniknutí cizího tělesa do oka. Obvykle při jejím zhmoždění vzniká otok, který brzy bez následků odezní. Pokud je ovšem poraněna přímo žlutá skvrna, může dojít k odchlípnutí sítnice a zhoršenému vidění. Dalším způsobem poškození sítnice je přímé působení ultrafialového záření, které způsobuje degeneraci a apoptózu fotoreceptorů vedoucí k nevratné ztrátě zraku. V experimentálním modelu světelným zářením poškozené sítnice u laboratorního potkana bylo ukázáno, že subretinální transplantace MSC izolovaných z kostní dřeně potlačila apoptózu fotoreceptorů a zmírnila následky poškození sítnice (27). V místě aplikace MSC byla zjištěna exprese bFGF a BDNF, které měly protektivní vliv na poškozené buňky a podporovaly jejich regeneraci. Nebyla zde však prokázána diferenciace MSC na fotoreceptory nebo jiné buňky sítnice (27).
Závěr
MSC se vzhledem ke svým vlastnostem ukazují být velmi vhodnými kandidáty pro buněčnou terapii u onemocnění sítnice. Stále ale zůstává mnoho nevyjasněných otázek, které je potřeba podrobněji prostudovat před jejich klinickým využitím. Doposud nejsou objasněny všechny mechanismy účinku MSC v místě poškození, schopnost MSC přežívat a diferencovat se in vivo, či možnost propojení jednotlivých buněk a znovu obnovení celé integrity sítnice. Zásadní roli může hrát i množství aplikovaných MSC a s tím spojený výběr jejich nejvhodnější a nejbezpečnější aplikace. Pro celkové objasnění dané problematiky musí být provedeny další experimentální a preklinické studie.
Práce byla podpořena projektem NPU LO1309 z Ministerstva školství, mládeže a tělovýchovy České republiky.
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou.
Mgr. Barbora Heřmánková
Ústav experimentální medicíny AV ČR, v.v.i.
– Oddělení transplantační imunologie
Vídeňská 1083
142 20 Praha 4
email: barbora.hermankova@biomed.cas.cz
Do redakce došlo dne 19. 10. 2015
Do tisku přijato dne 22. 1. 2016
Zdroje
1. Alonso-Alonso, M. L., Srivastava, G. K.: Current focus of stem cell application in retinal repair. World J Stem Cells, 7; 2015 : 641–648.
2. Arnhold, S., Absenger, Y., Klein, H. et al.: Transplantation of bone marrow-derived mesenchymal stem cells rescue photoreceptor cells in the dystrophic retina of the rhodopsin knockout mouse. Graefe’s Arch Clin Exp Ophthalmol, 245; 2007 : 414–422.
3. Bull, N. D., Martin, K. R.: Concise Review: Toward Stem Cell‐Based Therapies for Retinal Neurodegenerative Diseases. Stem Cells, 29; 2011 : 1170–1175.
4. Garcia, J.M., Mendonça, L., Brant, R. et al.: Stem cell therapy for retinal diseases. World J Stem Cells, 7; 2015 : 160–164.
5. Guan, Y., Cui, L., Qu, Z. et al.: Subretinal transplantation of rat MSCs and erythropoietin gene modified rat MSCs for protecting and rescuing degenerative retina in rats. Curr Mol Med, 13; 2013 : 1419–1431.
6. Hermankova, B., Zajicova, A., Javorkova, E. et al.: Suppression of IL-10 production by activated B cells via a cell contact-dependent cyclooxygenase-2 pathway upregulated in IFN-γ-treated mesenchymal stem cells. Immunobiology, 221; 2016 : 129-36..
7. Holan, V., Javorkova, E.: Mesenchymal stem cells, nanofiber scaffolds and ocular surface reconstruction. Stem Cell Rev, 9; 2013 : 609–619.
8. Huang, C., Zhang, J., Ao, M. et al.: Combination of retinal pigment epithelium cell‐conditioned medium and photoreceptor outer segments stimulate mesenchymal stem cell differentiation toward a functional retinal pigment epithelium cell phenotype. J Cell Biochem, 113; 2012 : 590–598.
9. Huo, D.M., Dong, F.T., Yu, W.H. et al.: Differentiation of mesenchymal stem cell in the microenvironment of retinitis pigmentosa. Int J Ophthalmol, 3; 2010 : 216–219.
10. Chiou, S.H., Kao, C.L., Peng, C.H. et al.: A novel in vitro retinal differentiation model by co-culturing adult human bone marrow stem cells with retinal pigmented epithelium cells. Biochem Biophys Res Commun, 326; 2005 : 578–585.
11. Javorkova, E., Trosan, P., Zajicova, A. et al.: Modulation of the early inflammatory microenvironment in the alkali-burned eye by systemically administered interferon-gamma-treated mesenchymal stromal cells. Stem Cells Dev, 23; 2014 : 2490–2500.
12. Johnson, T.V., Bull, N.D., Hunt, D.P. et al.: Neuroprotective effects of intravitreal mesenchymal stem cell transplantation in experimental glaucoma. Invest Ophthalmol Vis Sci, 51; 2010 : 2051–2059.
13. Johnson, T.V., Bull, N.D., Martin, K.R.: Neurotrophic factor delivery as a protective treatment for glaucoma. Exp Eye Res, 93; 2011 : 196–203.
14. Kicic, A., Shen, W.Y., Wilson, A.S., Constable, I.J., Robertson, T., Rakoczy, P.E.: Differentiation of marrow stromal cells into photoreceptors in the rat eye. J Neurosci, 23; 2003 : 7742–7749.
15. Krampera, M., Pasini, A., Pizzolo, G. et al.: Regenerative and immunomodulatory potential of mesenchymal stem cells. Curr Opin Pharmacol, 6; 2006 : 435–441.
16. Mathivanan, I., Trepp, C., Brunold, C. et al.: Retinal differentiation of human bone marrow-derived stem cells by co-culture with retinal pigment epithelium in vitro. Exp Cell Res, 333; 2015 : 11–20.
17. Meisel, R., Zibert, A., Laryea, M. et al.: Human bone marrow stromal cells inhibit allogenetic T-cell responses by indoleamine 2,3-dioxygenase-mediated tryptophan degradation. Blood, 103; 2004 : 4619–4621.
18. Nadri, S., Kazemi, B., Eslaminejad, M.B. et al.: High yield of cells committed to the photoreceptor-like cells from conjunctiva mesenchymal stem cells on nanofibrous scaffolds. Mol Biol Rep, 40; 2013 : 3883–3890.
19. Ng, T.K., Fortino, V.R., Pelaez, D. et al.: Progress of mesenchymal stem cell therapy for neural and retinal diseases. World J Stem Cells, 6; 2014 : 111–119.
20. Rajashekhar, G., Ramadan, A., Abburi, C. et al.: Regenerative therapeutic potential of adipose stromal cells in early stage diabetic retinopathy. PloS One, 9; 2014.
21. Rowland, T.J., Buchholz, D.E., Clegg, D.O.: Pluripotent human stem cells for the treatment of retinal disease. J Cell Physiol, 227; 2012 : 457–466.
22. Sato, K., Ozaki, K., Oh, I. et al.: Nitric oxide plays a critical role in suppression of T-cell proliferation by mesenchymal stem cells. Blood, 10; 2007 : 228–234.
23. Svobodova, E., Krulova, M., Zajicova, A. et al.: The role of mouse mesenchymal stem cells in differentiation of naive T-cells into anti-inflammatory regulatory T-cell or proinflammatory helper T-cell 17 population. Stem Cells Dev, 21; 2011 : 901–910.
24. Vossmerbaeumer, U., Ohnesorge, S., Kuehl, S. et al.: Retinal pigment epithelial phenotype induced in human adipose tissue-derived mesenchymal stromal cells. Cytotherapy, 11; 2009 : 177–188.
25. Yang, Z., Li, K., Yan, X. et al.: Amelioration of diabetic retinopathy by engrafted human adipose-derived mesenchymal stem cells in streptozotocin diabetic rats. Graefe’s Arch Clin Exp Ophthalmol, 248; 2010 : 1415–1422.
26. Yu, S., Tanabe, T., Dezawa, M. et al.: Effects of bone marrow stromal cell injection in an experimental glaucoma model. Biochem Biophys Res Commun, 344; 2006 : 1071–1079.
27. Zhang, Y., Wang, W.: Effects of bone marrow mesenchymal stem cell transplantation on light-damaged retina. Invest Ophthalmol Vis Sci, 51; 2010 : 3742–3748.
Štítky
Chirurgia maxilofaciálna Oftalmológia
Článek Oznámení
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2016 Číslo 1- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
- Oznámení
-
Perspektivy buněčné terapie v oftalmologii
1. Využití kmenových buněk v regeneraci poškozeného povrchu oka -
Perspektivy buněčné terapie v oftalmologii
2. Potenciál kmenových buněk pro léčbu onemocnění sítnice - Klinické projevy experimentální autoimunitní uveitidy
- Oční jizevnatý pemfigoid – retrospektivní studie
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Drúzy papily zrakového nervu a jejich komplikace
- Bilaterální makulární edém na podkladě drúzových papil
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Drúzy papily zrakového nervu a jejich komplikace
- Klinické zkoušky testující nové terapie pro Stargardtovu chorobu
- Bilaterální makulární edém na podkladě drúzových papil
- Oční jizevnatý pemfigoid – retrospektivní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




