-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
TERAPIE UVEÁLNÍHO MELANOMU
PŘEHLED
Autori: Š. Rusňák 1; L. Hecová 1; Z. Kasl 1; M. Sobotová 1; L. Hauer 2
Pôsobisko autorov: Oční klinika, Fakultní nemocnice v Plzni 1; Stomatologická klinika, Fakultní nemocnice v Plzni 2
Vyšlo v časopise: Čes. a slov. Oftal., 77, 2021, No. 1, p. 3-15
Kategória:
Súhrn
Cílem terapie nitroočního melanomu je dosáhnout lokální kontroly nad tumorem a snížit riziko generalizace onemocnění, zachovat oční bulbus, případně i zrakovou funkci oka. Volba terapeutického postupu vyžaduje komplexní pohled a individuální přístup. Zohledňuje se lokální nález, věk a fyzická i psychická kondice pacienta.
Zlatým standardem v léčbě uveálního melanomu je radioterapie. Vlastní účinek záření vzniká absorpcí energie ionizujícího záření, efekt záření na buňku se projeví přímým zánikem buňky (deplecí), nebo změnou cytogenetické informace buňky (mutací). Při brachyterapii se využívají sklerální aplikátory s radionuklidem – v Evropě dominují rutheniové aplikátory (Ru-106), v USA jodové aplikátory (I-125). Při zevní radioterapii je zdroj ionizujícího záření mimo tělo pacienta. Využívá se technika jak stereotaktické radiochirurgie (tj. jednorázové ozáření tumoru), tak frakcionované stereotaktické radioterapie. V ČR je léčba prováděna pomocí Leksellova gama nože nebo kybernetického nože CyberKnife, ve světě dominuje protonová terapie. Je nutné počítat s rozvojem často závažných poradiačních komplikací (radiační retinopatie, neuropatie, neovaskulární glaukom, toxic tumor syndrom atd.).
Chirurgická terapie zahrnuje celou řadu invazivních zákroků. U melanomu duhovky se provádí iridektomie. Anteriorně uložené choroidální melanomy a/nebo melanomy řasnatého tělesa mohou být řešeny transsklerální resekcí (exoresekcí). U choroidálních melanomů uložených posteriorně se využívá kombinace zevního ozáření tumoru s endoresekcí pomocí pars plana vitrektomie. Enukleace je metoda volby u pokročilých tumorů, které nelze účinně ozářit. Exenterace orbity je indikována u pokročilých nádorů s extrabulbárním šířením nebo při recidivě nádoru v orbitě po předchozí enukleaci.
Klíčová slova:
uveální melanom – radioterapie – brachyterapie – teleradioterapie – endoresekce – exoresekce
Terapie uveálního melanomu
Cílem terapie nitroočního melanomu je dosáhnout lokální kontroly nad tumorem a snížit riziko generalizace onemocnění, zároveň dominují snahy o zachování očního bulbu, resp. zrakové funkce oka. Volba terapeutického postupu u pacientů s uveálním melanomem vyžaduje komplexní pohled a individuální přístup ke každému pacientovi. Mezi zohledňované faktory patří vedle samotného lokálního nálezu (lokalizace, velikost a tvar nádoru, známky aktivity nádoru, zraková ostrost, přítomnost nitrooční komplikace) především věk a celková fyzická i psychická kondice pacienta, dále pak přání pacienta [1].
Zlatým standardem léčby uveálního melanomu je radioterapie – především brachyterapie, v případě větších tumorů pak teleradioterapie, případně v kombinaci s resekcí tumoru. V posledních letech dochází ke změně terapeutického přístupu především u malých melanocytárních lézí. Riziko generalizace uveálního melanomu závisí především na cytogenetické a histopatologické charakteristice tumoru, u velmi malých melanomů (s výškou tumoru do 3 mm) je ale riziko rozvoje generalizovaného onemocnění nízké, a to i v případech rizikového histopatologického a cytogenetického nálezu [2,3]. Dále bylo zjištěno, že některé původně prognosticky příznivé léze s časem mění své histopatologické a cytogenetické vlastnosti a stávají se z hlediska pravděpodobnosti generalizace onemocnění vysoce rizikovými [4]. Proto roste tendence přesně diagnostikovat a léčit i malé léze, které byly dříve jen observovány. Na významu tak nabývají bioptické techniky, které umožňují včasnou diagnostiku malých nebo klinicky nejednoznačných melanocytárních lézí [5,6].
Pravidelné sledování
Pravidelné sledování se využívá u malých suspektních lézí bez známek aktivity a bez průkazu růstu (dle fotodokumentace, autofluorescence, ultrazvukového vyšetření, popř. optické koherenční tomografie (OCT)), případně u starých nebo vážně nemocných pacientů bez lokální komplikace tumoru.
Laserová fotokoagulace
Technika fotokoagulace uveálního melanomu argonovým nebo kryptonovým laserem se dnes již nepoužívá. V minulosti se využívala spíše výjimečně v případě choroidálních melanomů s malou prominencí, lokalizovaných v oblasti zadního pólu oka [7].
Transpupilární termoterapie
Transpupilární termoterapie (TTT) se provádí diodovým laserem s vlnovou délkou 810 nm. Tato metoda způsobuje lokální hypertermii v tkáni do hloubky 4 mm [8,9,10]. Dříve se TTT využívala jako monoterapie u malých choroidálních juxtapapilárních nebo juxtafoveolárních tumorů, jako primární metoda léčby dnes již není doporučována. V současnosti nachází TTT uplatnění především v kombinaci s radioterapií (např. k ošetření centrálního okraje juxtapapilárních lézí) [11]. Komplikací této metody jsou výpady v zorném poli a makulopatie.
Fotodynamická terapie
Fotodynamická terapie (PDT) využívá intravenózně podanou fotosenzitivní látku, která je selektivně vychytávána v novotvořených cévách. Následným ozářením těchto cév dochází k jejich trombotizaci a k destrukci cévního endotelu kyslíkovými radikály, které se uvolní při fotochemické reakci [12]. Dnes se jako primární terapie léčby uveálního melanomu neužívá.
Radioterapie
Radioterapie (tj. terapie ionizujícím zářením) je zlatý standard v léčbě uveálního melanomu (zejména melanomu cévnatky). Využívá se jak lokální radioterapie pomocí sklerálních aplikátorů s radionuklidy (tzv. brachyterapie), tak zevní radioterapie (tj. teleradioterapie), kdy je zdroj ionizujícího záření mimo tělo pacienta.
Vlastní účinek záření na živou hmotu vzniká absorpcí energie ionizujícího záření, dochází k excitacím atomů a molekul, energie je předávána elektronům. Přenos energie v živé hmotě má kvantový charakter - v homogenně ozářeném vzorku se nacházejí místa s větším počtem ionizací a excitací a naopak místa, kde k žádnému přenosu energie nedošlo. K dosažení biologického efektu je nutno zářením zasáhnout určitou citlivou strukturu, kterou je v biologických objektech nejčastěji molekula DNA. Radiační změny DNA jsou velmi různorodé, nejčastější typickou změnou jsou zlomy DNA – jednoduché či dvojité, dále poškození bazí či lokální denaturace DNA. Biologické systémy však obvykle obsahují vysoké procento vody, kde se absorbuje značná část záření. Tzv. radiolýzou vody vznikají vysoce reaktivní produkty, jako je hydroxylový radikál OH, vodíkový radikál H či molekuly peroxidu vodíku H202. Všechny tyto produkty mohou vstupovat do dalších reakcí a tím iniciovat takzvaný nepřímý účinek záření.
Efekt záření na buňku se projeví buď přímým zánikem buňky – buněčnou deplecí, nebo změnou cytogenetické informace buňky – mutací. Zánik buňky může nastat v klidovém období – interfázi mezi dvěma obdobími dělení. Tento efekt je podmíněn vysokou dávkou ozáření, která vede k povšechné denaturaci buněčných struktur. Druhou variantou je zánik buňky v období dělení, kdy se poškození projeví neschopností buňky se dělit. Tato tzv. mitotická smrt nastává při významně nižších dávkách a projevuje se nejsnáze ve tkáních charakterizovaných rychlým buněčným dělením – vedle tumorů například krvetvorná tkáň, střevní endotelie nebo vyvíjející se zárodek.
Účinek na organismus se projevuje jednak v akutní fázi, jednak pozdním poškozením. V akutní fázi při celotělovém ozáření o dávce od 1 Gy pozorujeme akutní nemoc z ozáření, kdy v závislosti na dávce převládají v klinickém obraze příznaky od poruchy krvetvorby (1-6 Gy), gastrointestinálního traktu (kolem 10 Gy) až po poškození centrálního nervového systému (desítky Gy). Lokální akutní reakcí je nejčastěji dermatitida, stupeň poškození je závislý na dávce (od 3 Gy výše), druhu záření, velikosti a lokalizaci ozářeného pole. Další časným lokálním účinem ozáření je např. radiační zánět nosohltanu po jednorázovém ozáření orbity s prahem poškození kolem 5 Gy. Pozdní poškození následkem ionizujícího záření se projevuje např. změnami čočky (kataraktogenní je již jednorázová dávka kolem 1 Gy) nebo chronickým poradiačním zánětem kůže, který zejména v oblasti očních víček představuje svízelný problém.
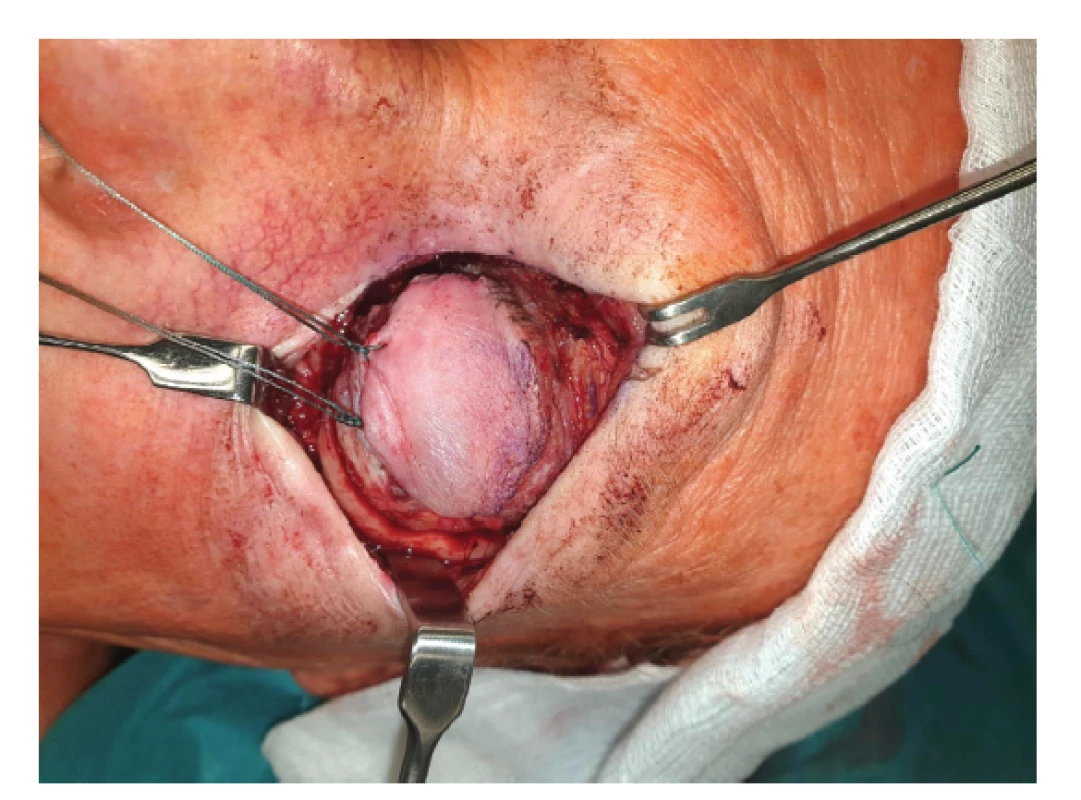
Destruktivní účinek ionizujícího záření na tkáň melanomu je žádoucí: buňky tumoru podléhají vakuolizaci cytoplasmy, ruptuře jader, jsou infiltrovány neutrofily, lymfocyty a plazmatickými buňkami. Debris nekrotických buněk, stejně jako buňky ve stadiu apoptozy jsou fagocytovány makrofágy. Deplece endoteliálních buněk vede k cévnímu prosakování, posléze k okluzi cévního lumen, objevuje se reparační proces – fibrotizace [13] (Obrázek 1). Destruktivní účinek záření zákonitě postihuje i kolaterální struktury, což je nežádoucí efekt, který vzhledem k intimní blízkosti prakticky všech očních tkání může indukovat rozvoj změn vedoucích až ke ztrátě oka.
Obr. 1. Obliterované cévy a vazivové změny v tumoru po protonové terapii 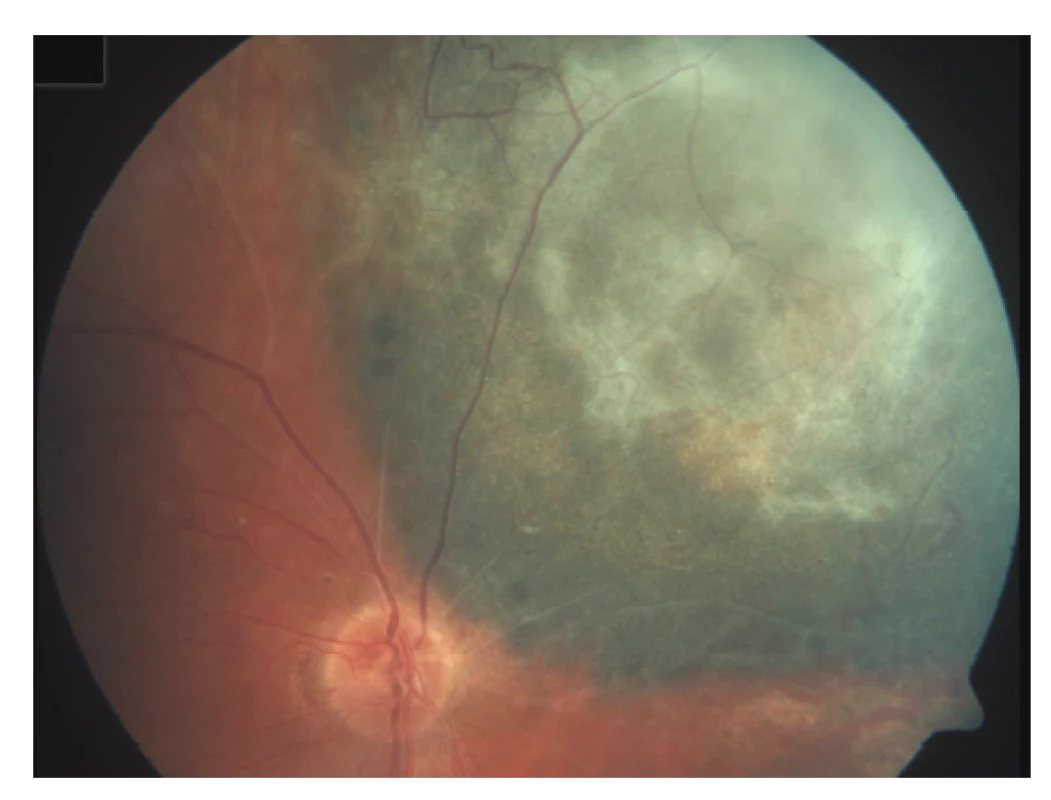
Brachyterapie
Brachyterapie je nejčastěji využívanou metodou léčby uveálního melanomu [14]. Jako první zmiňuje úspěšné využití brachyterapie při léčbě choroidálního melanomu v roce 1915 Deutschmann v Hamburku, který při léčbě pacienta s tumorem na jediném oku použil mesotherium [15]. V roce 1929 pak Moore implantoval radonová zrna do oka pacienta s choroidálním sarkomem na jediném funkčním oku [16]. Tuto techniku rozvinul Stallard ve 30. letech při léčbě retinoblastomu - vkládal zrna radonu do vosku, umisťoval je na povrch oka a později je odstraňoval [17].
Při brachyterapii se využívají sklerální aplikátory obsahující různé typy radioaktivních prvků. Po lokalizaci tumoru transluminací a indirektní oftalmoskopií se aplikátory v celkové anestezii našívají zevně na skléru nad místo baze tumoru a ponechávají se zde po takovou dobu, aby byla dosažena dávka obvykle 80–100 Gy (dle typu aplikátoru) na apex nádoru, poté je aplikátor z oka odstraněn. Pro volbu aplikátoru a výpočet doby brachyterapie je nezbytné přesně stanovit velikost tumoru (maximální výška a velikost baze tumoru) a aktuální aktivitu použitého zářiče. V dnešní době převládají aplikátory využívající radionuklidy Ru-106 a I-125. K léčbě brachyterapií jsou indikovány obvykle léze s bazí tumoru do 20 mm a s prominencí do 10 mm u jodových aplikátorů, resp. do 7 mm u rutheniových aplikátorů. Regrese tumoru začíná 1–2 měsíce po terapii a trvá několik let. Úspěšnost brachyterapie uveálních melanomů (tj. dosažení lokální kontroly nad tumorem a zachování očního bulbu) kolísá dle typu použitého aplikátoru a radionuklidu, velikosti a lokalizace tumoru i zkušeností aplikujícího chirurga [18].
Ruthenium 106
Nejčastěji používaným radioizotopem při brachyterapii v Evropě je β-zářič Ru-106. Brachyterapii za využití Ru-106 představil německý oftalmolog Peter Lommatzsch v 60. letech 20. století [19]. Oční aplikátory Ru-106 obsahují radionuklid ruthenium 106 v dlouhodobé rovnováze s dceřiným nuklidem rhodium 106. Aplikátory emitují převážně beta záření s malou příměsí gama záření. Poločas rozpadu činí 373,6 dne a nominální aktivita zdroje 4–31 MBq. Emitované beta částice mají energii 2,12 MeV. Na apex tumoru se obvykle aplikuje 100 Gy. Aplikátory se vyrábějí komerčně v různých velikostech (průměr 11,6–25,4 mm) a tvarech (okrouhlé, s otvorem pro zrakový nerv nebo tvarované k použití v oblasti limbu). Jádro rutheniového aplikátoru se skládá z 0,2 mm silné vrstvy hliníku pokryté Ru-106/Rh-106 a je uloženo ve stříbrném krytu, který funguje jako radiační štít (absorbuje přibližně 95 % beta záření). Výhodou rutheniových aplikátorů je minimální radiační zátěž pro chirurgický tým – na skléru je po lokalizaci tumoru nejprve našita akrylátová nebo stříbrná maketa aplikátoru, na připravené stehy je poté umístěn samotný rutheniový aplikátor. Aplikátor je skladován a sterilizován v kontejneru z nerezové oceli s hliníkovou vložkou (Obrázek 2).
Obr. 2. Skladovací a sterilizační kontejner pro rutheniový aplikátor 
Brachyterapie uveálního melanomu s využitím aplikátorů s Ru-106 poskytuje vynikající lokální kontrolu (dle různých autorů 73–98 % 5 let po léčbě) s nízkou mírou recidivy nádorů u nádorů s maximální výškou do 7 mm [20,21,22,23].
Jod 125
Ve Spojených státech amerických je od 80. let 20. století nejčastěji používaným izotopem při léčbě uveálního melanomu radioizotop I-125, emitující γ-záření. V porovnání s dříve využívaným aplikátorem s Co-60 je u izotopu I-125 srovnatelný průnik do hloubky 10 mm, zároveň ale výrazně nižší postižení přilehlých zdravých tkání. Díky snazšímu odclonění záření přináší tento typ aplikátoru menší radiační zátěž jak pro pacienta, tak pro chirurgický tým [24,25].
Při léčbě se využívá zlatý opakovaně použitelný obal aplikátoru v kombinaci s jednorázovou silikonovou vložkou individuálně naplněnou kapslemi s radioizotopem I-125, která je do obalu aplikátoru fixována pomocí několika kapek adhezivního silikonu. K dispozici jsou aplikátory různých velikostí (obvykle s průměrem 12–20 mm). Silikonové vložky v sobě mají otvory, do kterých jsou vkládány titanové kapsle s I-125. Radioizotop I-125 má poločas rozpadu 59,41 dne. Rozkládá se po zachycení elektronu a během svého rozkladu emituje γ-záření a rentgenových paprsků, emitované fotony mají energii až 35 keV. Emitované elektrony jsou absorbovány titanovou kapslí, ve které je radioizotop I-125 uložen.
Další radionuklidy
Při brachyterapii uveálního melanomu se využívaly nebo v menší míře využívají i další typy radionuklidů. V 60. a 70. letech 20. století to byl např. radon - zlatá zrna naplněná plynem radonu byla rovnoměrně rozmístěna po obvodu kruhovitého aplikátoru, který se přišíval na obnaženou skléru v místě tumoru a s ohledem na krátký poločas rozpadu radonu (3,8 dní) se na oku v případě dobré tolerance ponechával trvale [14,26]. Od 60. let 20. století byly hojně využívané cirkulární, srpkovité nebo půlkruhové aplikátory s kobaltem 60 (Co-60), které se našívaly zevně na skléru nad bazi tumoru s přesahem 1mm přes okraj tumoru. Omezený dlouhodobý efekt léčby a významné vedlejší nežádoucí účinky záření způsobené vysokou energií, kterou nebylo možné na vnějším povrchu účinně odstínit, vedly k tomu, že bylo v 2. polovině 80. let od užívání kobaltových aplikátorů ustoupeno a byly nahrazeny nízkoenergetickou brachyterapií [27,28,29]. Od konce 80. let 20. století jsou dostupné aplikátory využívající palladium 103 (Pd-103), které emituje fotony s nižší energií (průměrně 21 keV) a lépe absorbovatelné tkání tumoru než fotony I-125 [30]. Stroncium (St-90) emituje β-záření o vysoké energii s dobrým průnikem do hloubky 4 mm, u větších lézí je nutné brachyterapii s tímto typem aplikátoru opakovat [31]. Dalšími prvky, které lze v terapii uveálního melanomu užít, jsou např. iridium (Ir-192) nebo zlato (Au-198).
Teleradioterapie (zevní radioterapie)
Ve srovnání s chirurgickou léčbou nebo brachyterapií představuje stereotaktická radiochirurgie a frakcionovaná stereotaktická radioterapie uveálního melanomu méně invazivní terapeutickou modalitu [32]. Pro účinné a bezpečné ošetření teleradioterapií je nutné jednak dokonale zobrazit ošetřované ložisko, jednak správně zvolit ozařovací metodu, přesně ji zacílit a minimalizovat poškození okolní tkáně. V České republice se nejvíce využívají Leksellův gama nůž (LGK) a kybernetický nůž CyberKnife, na Slovensku je dostupná léčba stereotaktickým lineárním urychlovačem LINAC, ve světě v léčbě uveálního melanomu dominuje protonová terapie.
Ozáření tumoru lze provádět jednorázově nebo frakcionovaně. Největším benefitem jednorázového ozáření je větší komfort pro pacienta. Výhodou frakcionovaného ozáření je snížení radiační zátěže zdravých tkání a následných komplikací při zachování dobré kontroly nad tumorem [33]. Četnost a závažnost komplikací lze redukovat také snížením použité radiační dávky [33,34,35,36].
Leksellův gama nůž
Historie vzniku a vývoje gama nože je spjata se švédským vědcem a neurochirurgem Larsem Leksellem. První konstrukce Gamma Unit I byla uvedena do provozu v roce 1968 a byla zaměřena na indikace v oblasti funkční neurochirurgie [37]. V Česku je Leksellův gama nůž dostupný od roku 1992 v Nemocnici Na Homolce (Oddělení stereotaktické a radiační neurochirurgie).
Leksellův gama nůž využívá ionizující záření ve formě fotonů. Jde o izocentricky fokusované gama záření z velkého počtu radioaktivních zdrojů. Fotony vznikají na bázi radioaktivní přeměny radionuklidu 60Co na 60Ni. V monoenergetickém svazku dochází k exponenciálnímu snížení počtu fotonů s rostoucí hloubkou průniku do daného materiálu. Výsledná hloubková dávková křivka závisí na primárním spektru fotonového svazku, jeho kolimaci, velikosti svazku a materiálu. Dávka narůstá nejprve směrem od povrchu do své maximální hodnoty, která je pro danou energii fotonového svazku, geometrické uspořádání a absorpční materiál charakterizována vždy určitou hloubkou. Dále dávka s rostoucí hloubkou exponenciálně klesá. K získání vysoké absorbované dávky v cílovém ložisku za současné minimalizace dávky do okolní zdravé tkáně je nutné použít vysokého počtu kolimovaných izocentrických svazků, respektive svazků protínajících se v jediném bodě. Výsledný dávkový profil ze všech zdrojů v tomto objemu pak představuje průběh dávky, kdy v místě cílového ložiska, kde se promítají všechny svazky, dostáváme maximální absorbovanou dávku za současného prudkého spádu dávky do okolí [38].
Leksellův gama nůž má tři hlavní součásti, tj. radiační jednotky se zdroji záření 60Co se 4 nebo 3 kolimačními helmicemi, stereotaktické instrumentárium a plánovací systém Leksell GammaPlan.
Před vlastní radioterapií na Leksellově gama noži je provedena aktuální zobrazovací diagnostika (MR nebo CT) s označením ložiska, na základě které je vytvořen ozařovací plán. Dále je provedena montáž stereotaktického rámu, který lze invazivně (pomocí 4 hliníkových šroubů) nebo neinvazivně (pomocí měkké masky nasazené na obličej v kombinaci se senzorem umístěným na špičku nosu) fixovat k lebce pacienta, což zajišťuje neměnnou polohu struktur hlavy.
Ozařovací plán je vytvořen tak, aby bylo zaručeno nejlepší rozložení dávky do cílového místa ozáření a zároveň byly co nejvíce uchráněny okolní tkáně a orgány. Při plánování se jako předepsaná izodóza volí obvykle hodnota 50 %. Předepsaná izodóza by měla pokrývat alespoň 95 % cílového objemu a dávka na tuto izodózu je volena s ohledem na patologii nádoru, objem ozařované léze, přilehlé funkčně významné struktury a případné předchozí ozařování [38].
Mezi onemocnění léčená pomocí Leksellova gama nože patří benigní a maligní nádory (např. meningiomy, adenomy hypofýzy, vestibulární schwanomy, metastázy v mozku a některé gliomy), cévní malformace, funkční onemocnění a onemocnění oka [38].
V léčbě uveálního melanomu se Leksellův gama nůž využívá od 90. let 20. století [32]. Oči jsou vzhledem ke stereotaktickému rámu v excentrické lokalizaci, proto pacient obvykle během ozáření zaujímá polohu na břiše. Pro bezpečné provedení ošetření je nutné ozařované oko znehybnit - v retrobulbární anestezii se v místě úponu mediálního a laterálního přímého svalu bulbus fixuje 2 stehy ke stereotaktickému rámu, na oko je poté aplikována speciálně natvarovanou vaničkou vyplněnou sonografickým gelem. Znehybnění bulbu na omezenou dobu lze provést i pouhou retrobulbární aplikaci lokálního anestetika [39], popř. může pacient fixovat oko aktivně, např. pohledem do bodového zdroje světla [40]. Vlastní ozáření uveálního melanomu trvá řádově desítky minut a provádí se jednorázově obvykle v dávce 20–50 Gy v 50% izodóze [41,42,43,44,45].
CyberKnife
U zrodu kybernetického nože stál v roce 1994 prof. John Adler se svým týmem ze Stanfordské univerzity. V roce 1999 získal CyberKnife schválení od United States Food and Drug Delivery Administration (FDA) k radiační terapii tumorů hlavy a krku a v roce 2001 k radiační terapii extrakraniálních oblastí. Od roku 2010 je v provozu CyberKnife ve Fakultní nemocnici v Ostravě, v roce 2020 by měl být zprovozněn další CyberKnife v Ústřední vojenské nemocnici.
CyberKnife neboli kybernetický nůž je lineární urychlovač speciálně uzpůsobený pro stereotaktickou radioterapii a radiochirurgii, který umožňuje jednorázové nebo frakcionované precizní ozáření intrakraniálních a extrakraniálních tumorů. Zdrojem záření jsou uměle vytvořené fotony o energii 6MV. Lineární urychlovač generuje velmi tenké svazky záření, které vycházejí z 1200 různých pozic a protínají se v místě ozařovaného cíle. Samotné paprsky mají velmi malý podíl na celkové dávce záření, proto nedochází k poškození zdravé tkáně, kterou procházejí. Tímto způsobem je umožněno ozařovat cílovou tkáň s velkou přesností a minimální toxicitou pro okolní tkáně [46,47]. Lineární urychlovač je umístěn na konci robotického ramene, které se dokáže pohybovat okolo ležícího pacienta v rozsahu 358°. Pacient v průběhu ozařování leží na roboticky řízeném stole, který je polohovatelný v 6 směrech v rozsahu 10°. Kromě vysoké přesnosti zacílení ložiska má CyberKnife schopnost sledovat (2 rentgenovými detektory umístěnými u stropu ozařovny) pohyby pacienta v reálném čase a tomu přizpůsobovat ozařování. Cíle ozařování, které se pohybují v souvislosti s dýcháním pacienta, jsou sledovány pomocí systému Synchrony.
Před plánovaním a samotnou stereotaktickou radioterapií či radiochirurgií je nejprve pacientovi vytvořena stereotaktická maska, která omezuje pohyby hlavy a krku během ozařování. Jedná se o neinvazivní fixaci termoplastickou maskou vytvarovanou podle pacientova obličeje. Maska je po přiložení na obličej pacienta připevněna k půlkruhovému rámu [48]. Následně je provedeno plánovací CT, MR nebo PET vyšetření k přesnému určení velikosti, tvaru a lokalizace tumoru. Pomocí CyberKnife softwaru poté lékař vyznačí velikost ozařované oblasti, radiační dávku a identifikuje struktury, kde by radiace měla být minimalizována, a vytvoří ozařovací plán. Kybernetický nůž je schopen zacílit ložisko u nepohyblivých cílů s přesností 0,5 mm, u pohyblivých cílů do 2 mm [46], lze jím ozářit ložisko o velikosti do 5 cm a maximálně 3 ložiska [46,47,49].
CyberKnife je využíván k terapii intrakraniálních i extrakraniálních benigních a maligních tumorů (např. nádory hlavy a krku, tumory plic, páteře, slinivky, jater, prostaty). V rámci funkční stereotaktické radiochirurgie lze léčit i neuralgii trigeminu. Intrakraniální i extrakraniální stereotaktická léčba se využívá zejména u pacientů, kteří nemohou podstoupit chirurgickou léčbu z důvodu anatomické lokalizace útvaru nebo při inoperabilitě z interních příčin [47,48,49].
V oftalmologii se využívá v terapii středně velkých a velkých melanomů uvey, a to jak v rámci stereotaktické radiochirurgie, tak při frakcionované stereotaktické radioterapii [50,51]. Imobilizace oka je zajištěna aplikací retrobulbární anestezie [52], popř. umístěním blikajícího fixačního světla nad oko zdravé a kamery snímající pohyby oka nad oko postižené nádorem, pro monitoraci pohybů oka a lepší zacílení uveálního tumoru lze využít čočku s implantovanými zlatými zrny [52]. Optimální celková dávka záření a schéma frakcí nejsou zatím jednoznačně stanoveny, využívá se jak jednorázové, tak frakcionované ozáření ve 3–7 sezeních [50,53].
Linac
Na Slovensku se v terapii uveálního melanomu využívá i stereotaktický lineární urychlovač částic LINAC. Ten byl poprvé experimentálně použit v Londýně v roce 1952, od roku 1953 se využívá k léčbě humánních pacientů [54]. Podle dostupných studií je radioterapie lineárním urychlovačem LINAC efektivní u malých a středně velkých uveálních melanomů, při frakcionované stereotaktické radioterapii je obvyklá celková dávka 50–70 Gy na 80 % izodózy [55,56], při stereotaktické radiochirurgii pak jednorázová dávka 25–35 Gy [57,58].
Protonová terapie
V roce 1954 byly v radiační laboratoři v Berkeley a v roce 1957 v Uppsale provedeny první terapeutické pokusy s protonovým zářením, nejprve u pituitárních tumorů. V roce 1961 byla zahájena spolupráce mezi cyklotronovou laboratoří v Harvardu a Všeobecnou nemocnicí v Massachusetts s cílem věnovat se protonové terapii, do odstavení cyklotronu v roce 2002 byl program protonové terapie zlepšován a rozvíjen a bylo zde ošetřeno 9116 pacientů. V roce 1990 bylo v Loma Linda v Kalifornii založeno první univerzitní protonové centrum [59,60].
Radioterapie pevnými částicemi využívá tzv. hadrony (těžké částice), mezi které se řadí především protony, neutrony a lehké ionty. V klinické praxi se nejčastěji (až 90 %) používají kladně nabité částice jádra atomu vodíku (protony), méně často se používají uhlíkové ionty nebo heliony. Protonové záření, stejně jako fotonové záření (paprsky X a gama-záření) nebo elektrony, se řadí mezi svazky s nízkou relativní biologickou účinností. Protony jsou produkovány v cyklotronu odstraněním elektronu z atomu vodíku, následně jsou cyklotronem urychleny na rychlost přibližně poloviny rychlosti světla. Tím získají energii až 230 MeV, která umožňuje destrukci nádorů do hloubky 30 cm. Protony jsou poté usměrněny silným magnetickým polem do úzkého paprsku (pencil beam) s tokem více než 2 bilionů protonů za sekundu a s vysokou mírou přesnosti přeneseny do lůžka prostorově zobrazeného nádoru. Při zbrzdění v nádorové tkáni dojde k uvolnění energie, k ionizaci, uvolnění volných radikálů a poškození DNA zasažené buňky [60]. Hlavní předností protonové terapie je, že svazek protonů předá nejvyšší část své energie ve fázi tzv. Braggova vrcholu (Bragg peak), tj. v oblasti těsně před koncem doletu částice ve hmotě, kde je absorbována většina energie. Ve zdravých tkáních před nádorem ztrácí svazek protonů energii jen minimálně. V závislosti na hloubce lokalizace tumoru pod povrchem těla se do oblasti nádoru dostane 70–80 % energie svazku. Za Braggovým vrcholem je dávka záření nulová. Výhodou protonové terapie je proto minimální poškozeních zdravé tkáně v bezprostřední blízkosti tumoru, vysoká dávka v oblasti tumoru a možnost ozářit i tumor o větším objemu. Relativní nevýhodou protonové terapie je vysoká cena léčby v porovnání s konvenční radioterapií nebo jinými terapeutickými postupy [61].
Protonová terapie se využívá při léčbě tumorů CNS jako primární radioterapie (např. meningeomy v oblasti baze lební nebo juxtaspinální tumory) nebo jako pooperační radioterapie po neúplné resekci, příp. při časné recidivě tumoru. Využívá se jak frakcionované protonové terapie, tak protonové stereotaktické radiochirurgie. Další indikační oblastí jsou solidní nádory dětského věku (např. meduloblastomy, kraniofaryngeomy, inoperabilní gliomy, ependymomy), invazivní a/nebo neohraničené tumory s tendencí k infiltrativnímu růstu, dále např. tumory v blízkosti důležitých anatomických struktur (např. optický nerv, chiasma, oko, krční mícha nebo velké krční cévy), radiorezistentní tumory a tumory s vysokým rizikem lokální recidivy, tumory VDN, karcinomy štítné žlázy, tumory slzné žlázy, karcinom naso - nebo orofaryngu a karcinom prostaty.
V léčbě uveálních melanomů se používá protonový svazek s energií 62–68 MeV [62,63]. Vzácně se protonové záření používá i v terapii melanomu spojivky, retinoblastomu a hemangiomů sítnice nebo cévnatky, popř. věkem podmíněné muskulární degenerace [64]. Před samotnou radioterapií se v celkové anestezii na skléru (po lokalizaci tumoru transluminací, nepřímou oftalmoskopií nebo opto-elektrickým navigačním systémem) našívají lokalizační tantalové značky, které definují hranici tumoru [65,66]. Během zákroku se zaznamenává přesná poloha lokalizačních značek, velikost, tvar a pozice tumoru vzhledem k papile zrakového nervu, makule a lokalizačním značkám [67]. V případě melanomu duhovky se tantalové značky nepoužívají [68]. Následně je na míru vytvořena fixační maska se speciální nákusnou dlahou a provádí se rentgenové snímky hlavy pacienta v terapeutické pozici se 4 možnými pohledovými pozicemi oka [63]. Získaná data jsou uložena do interaktivního 3D plánovacího softwaru (např. Eyeplan software, Octopus software), který vypočte terapeutické parametry, včetně úhlu fixace, modulace protonového svazku nebo relativní pozice lokalizačních značek vůči protonovému paprsku. Terapie probíhá frakcionovaně – v závislosti na lokálním nálezu a zvyklostech daného protonového centra se jedná o 4–5 sezení, obvykle v po sobě následujících dnech, případně rozložená do 7–10 dnů. Ozařování při každém sezení trvá obvykle 30–60 sekund, celkem je do tumoru podána radiační dávka 60–70 CGE (cobalt Grey equivalent) [63,65,69].
Nejbližší protonová centra, nabízející protonovou léčbu u uveálního melanomu, jsou centrum BerlinProtonen při nemocnici Charité v Berlíně, protonové centrum při Paul Scherrer Insitutu (PSI) ve švýcarském Villigenu a centrum Cyclotron Centre Bronowice v polském Krakově.
Komplikace po radioterapii uveálního melanomu
Účinky ionizujícího záření na tkáně se projevují tam, kde je to žádoucí (tj. v samotném novotvaru), avšak zákonitě i v jeho okolí, různě podle typu záření, velikosti dávky, radiosenzitivity konkrétní tkáně. Vedlejší účinky se objevují v širokém časovém rozmezí, od deterministických následků v řádu hodin až po stochastické následky, které se mohou projevit za desítky let. Radioterapie uveálního melanomu je z pohledu výskytu vedlejších účinků na okolní struktury zvláště hodná pozornosti zejména pro riziko poškození pro zrak důležitých struktur, mnohdy však i pro riziko vyvolání nežádoucích změn, jejichž důsledkem je ztráta oka jako takového.
Radioterapie uveálního melanomu s sebou nese nutnost umět pochopit a zvládnout i kolaterální poškození, které tato dosud nenahraditelná léčebná metoda způsobuje. Důležitou součástí strategie léčby komplikací je prevence ireverzibilních změn - např. při brachyterapii v podobě používání na míru upraveného zářiče či častěji v excentrickém umístění zářiče [70].
Sítnice
Poradiační změny sítnice se projevují nejčastěji vaskulární inkompetencí, histologicky prakticky stejně jako u cévního systému tumoru [71]. Dochází k tvorbě nepravidelného lumen kapilár, mikroaneurysmat, rozvíjí se kolaterály (Obrázek 3). Prosakování vede k edému sítnice, objevují se lipidová depozita. V dalším vývoji pak dochází ke kolapsu lumen kapilár a jejich fibrotizaci. Exsudativní odchlípení sítnice jako následek masivního cévního prosakování vzniká při vysokodávkovém ozáření a většinou spontánně regreduje během týdnů. Perzistující exsudativní odchlípení sítnice vede k ireverzibilní atrofii fotoreceptorů, které jsou jinak jako nereplikující se struktury do značné míry radiorezistentní. Chronické odchlípení sítnice jako následek pozdní poradiační vaskulopatie může vést k rozvoji rubeozy a neovaskulárního glaukomu v rámci tzv. toxic tumor syndromu.
Obr. 3. Poradiační cévní změny – mikroaneurysmata a arteriovenozní zkraty 
Radiační retinopatie je nejčastější příčinou ireverzibilní ztráty zraku po radioterapii. Může se vyskytnout ve formě makulopatie, nejčastěji jako následek prosakování z typických vaskulárních poradiačních změn sítnice či jako odpověď na ischemický inzult při globální vaskulární inkompetenci [72]. V terapii se nejčastěji objevuje laserová fotokoagulace, fotodynamická terapie, transpupilární termoterapie, intravitreální aplikace kortikosteroidů či antiVEGF protilátek. Byla publikována řada retrospektivních studií s použitím antiVEGF léčby, většinou zahájené již v okamžiku radioterapie. Většina studií demonstruje zlepšení radiací indukované makulopatie a redukci neovaskularizace, ne vždy však doprovázené zlepšením zrakové ostrosti [73].
Retinální pigmentový epitel a cévnatka
Nejčastější první změnou v ozářeném RPE je atrofie, ztráta melaninu, akumulace lipofuscinu, následně pak hyperplazie, vše jednak jako přímý důsledek ozáření, jednak jako důsledek vaskulárních změn v přilehlé cévnatce. Zde se vyskytuje prakticky uniformní poradiační odpověď vaskulatury – nepravidelné lumen, tortuosita, tvorba mikroaneurysmat, prosakování, ztráta lumen, tvorba novotvořených cév, fibrotizace. Klinicky se nejčastěji jedná o zónu atrofie, přecházející do zrnité hypo - a hyperpigmentace kolem ozářené tkáně [74].
Zrakový nerv
Radiační neuropatie je častou příčinou závažného postižení zraku, většinou se jedná o ireverzibilní stav, nicméně až v 30 % lze pozorovat částečné spontánní zlepšení [75]. K rozvoji přímé optické neuropatie dochází obvykle po absorpci dávky přesahující 50 Gy, k rozvoji patologických změn přispívají i cévní změny ve strukturách zrakového nervu. Terapie neuropatie zrakového nervu není dosud zavedena ani standardizována. Hyperbarická oxygenoterapie byla používána s limitovaným efektem [76]. Systémové kortikosteroidy nejsou efektivní [77], při jejich lokálním (tj. intravitreálním) podání byl zaznamenán efekt v podobě rychlého ústupu edému zrakového nervu a mírného zlepšení zrakových funkcí [78]. Slibnou se opět ukazuje antiVEGF terapie [79].
Duhovka
Poradiační změny duhovky jsou přímé (atrofizace a depigmentace) nebo indukované, jako je neovaskularizace při globální ischemii zadního segmentu, vedoucí k rozvoji neovaskulárního glaukomu [80], často jakou součást toxic tumor syndromu.
Čočka
Poškození čočky, tj. rozvoj katarakty po ozáření se objevuje při dávkách přesahujících 8–10 Gy. Čočkové lamely se deformují, debris hromadící se v subkapsulární oblasti především před zadním pouzdrem zhoršuje průhlednost [81]. Spouštěcím mechanismem je zářením indukované poškození DNA proliferujících buněk čočky. Katarakta jako následek poradiačních změn je komplikace řešitelná standardní operační technikou. Současně ale bývají přítomné další změny, které mohou zákrok komplikovat – rubeoza duhovky, sekundární glaukom a zadní synechie. Významně častěji bývá popisována peroperační ruptura zadního pouzdra [82].
Skléra
Skleromalacie jako důsledek poradiačních změn je vzácnou komplikací léčby uveálního melanomu [83]. Přepokládaným mechanismem jsou opět cévní změny - ischémie, spolu s nekrotickými změnami přilehlého tumoru vedou k porušení sklerální struktury. Rizikovým faktorem je terapie rozsáhlého tumoru, popřípadě poškození řasnatého tělesa [84].
Toxic tumor syndrom
Termín toxic tumor syndrom je vyhrazen klinické jednotce, která se skládá z exsudativního odchlípení sítnice, rubeozy duhovky a neovaskulárního glaukomu z přítomnosti ischemie a nekrotických nádorových hmot po radioterapii (Obrázek 4). Ačkoliv tento stav může být ovlivněn všemi výše uvedenými terapeutickými postupy (laserová fotokoagulace, fotodynamická terapie, transpupilární termoterapie, intravitreální aplikace kortikosteroidů nebo anti-VEGF preparátů), jako nejefektivnější se jeví chirurgická endo-či exoresekce tumoru [85].
Obr. 4. Rozvoj známek toxic tumor syndromu po ošetření velkého melanomu pomocí LGK 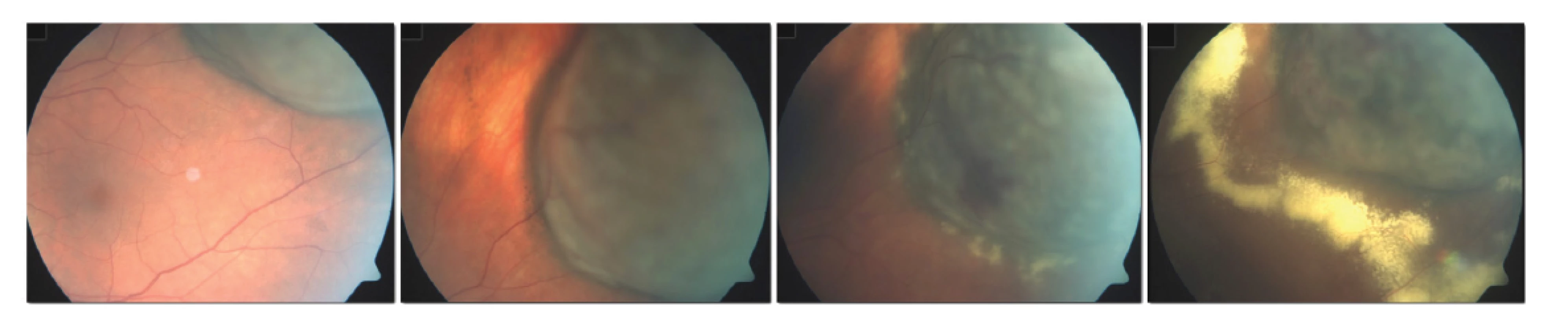
Chirurgická léčba
Chirurgická terapie uveálního melanomu zahrnuje celou řadu invazivních zákroků – od bulbus zachovávajících výkonů na duhovce, řasnatém tělese a/nebo cévnatce po radikální zákroky v podobě enukleace bulbu a exenterace očnice.
Resekce tumoru
V případě melanomu lokalizovaného čistě na duhovku se provádí iridektomie, popř. iridocyklektomie nebo iridotrabekulektomie. Anteriorně uložené choroidální melanomy a/nebo melanomy řasnatého tělesa (často s postižením duhovky) mohou být řešeny transsklerální resekcí neboli exoresekcí pomocí parciální lamelární transsklerální sklerouvektomie. U choroidálních melanomů uložených posteriorně se využívá technika endoresekce pomocí pars plana vitrektomie (PPV), tato technika se obvykle kombinuje s předchozí iradiací tumoru.
Indikací k provedení jak exoresekce, tak endoresekce uveálního melanomu jsou obvykle léze s výškou nad 8 mm [85]. U takto velkých tumorů trvá i po účinné radioterapii špatná prognóza stran dlouhodobého zachování bulbu, resp. zrakové funkce oka a je zde vysoké riziko rozvoje komplikací vyvolaných ozářením tumoru (především toxic tumor syndrom). Resekce tumoru navíc umožňuje získat materiál pro histopatologické a cytogenetické vyšetření [86] (Obrázek 5).
Obr. 5. Exoresekce uveálního melanomu 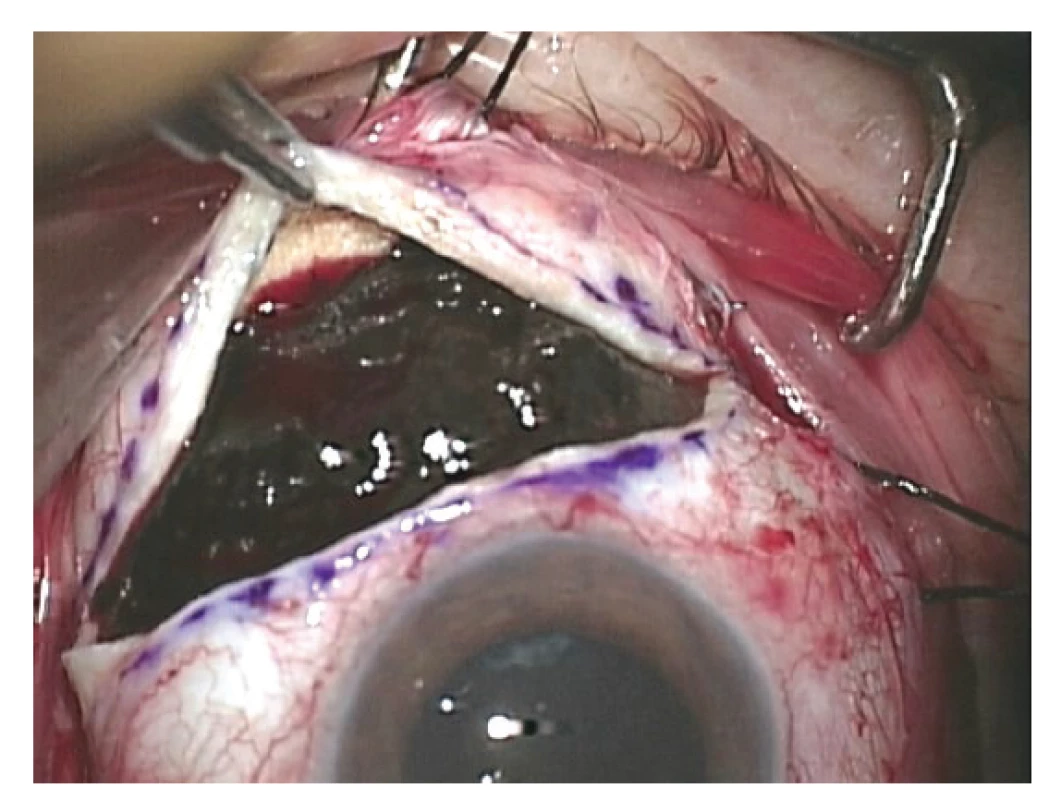
Chirurgická resekce nitroočního tumoru je technicky náročný zákrok s řadou potenciálních peroperačních i postoperačních komplikací a měl by být prováděn zkušeným sítnicovým chirurgem [85].
Iridektomie a iridocyklektomie
Iridektomie se využívá u lézí, které postihují čistě duhovku, podle umístění léze se volí sektorová nebo periferní iridektomie. Po spojivkové peritomii je vytvořen sklerokorneální flap (3/4 tloušťky skléry/rohovky) – sklerální incize je vedena perilimbálně 2–3 mm za limbem a radiální řezy 2 mm za hranicí tumoru. Nad oblastí tumoru v oblasti lůžka sklerokorneálního flapu je provedena keratektomie. Vlastní iridektomie je vedena min. 1 mm za hranicí melanomu, následně je provedena rekonstrukce zornice, resp. sutura kolobomu duhovky a jsou zpět přišity flap a spojivka [87].
U melanomu duhovky postihujícího kořen duhovky se provádí přední parciální iridotrabekulocyklektomie. Po vytvoření sklerokorneálního flapu je přední komora otevřena korneální perilimbální incizí vedenou v lůžku flapu nad anteriorním okrajem duhovkové léze, radiální incize jsou vedeny za hranici iridokorneálního úhlu přes skléru do přední části řasnatého tělesa. Poté je anteriorně min. 1 mm za hranicí tumoru zahájena incize duhovky a vedena radiálně k ciliárnímu sulku. Následně je provedena sklerální incize vedená perilimbálně v lůžku sklerokorneálního flapu a blok excidované tkáně může být extrahován [87].
V případě tumorů duhovky s postižením řasnatého tělesa je vhodné provést úplnou přední iridotrabekulocyklektomii. Výkon je opět zahájen vytvořením sklerokorneálního flapu, poté je provedena hluboká sklerální T-incize s jedním řezem paralelním k limbu a druhým radiálním řezem nad předpokládaným centrem tumoru. Incize je vedena cca ve ¾ tloušťky skléry a po stranách radiálního řezu jsou vytvořeny 2 sklerální flapy. Stejně jako u parciální iridotrabekulocyklektomie je otevřena přední komora a provedena incize duhovky a zašila rohovková část flapu. Pokračuje se provedením radiálních řezů vedených lůžkem sklerálních flapů a pars plicata min. 1 mm zevně od stran tumoru a s limbem paralelní incizí vedenou skrze sklerální lůžko a pars plana zevně za posteriorní hranicí tumoru. Následuje sutura radiální sklerální části sklerokorneálního flapu a radiální části sklerálních flapů. Mezi sklerokorneálním flapem a sklerálními flapy tak zůstane otevřená perilimbální incize, kterou je pomalu extrahována excidovaná tkáň s tumorem [88,89].
Nejčastější pooperační komplikace jsou hypotonie, katarakta, hyphaema, cyklodialýza, dehiscence rány a bulozní keratopatie [88].
Exoresekce
Pro chirurgickou exoresekci jsou vhodné iridociliární nádory postihující méně než 3 hodiny pars plicata a choroidální melanomy s bazí menší než 15 mm [86] (Obrázek 6). Vedle postradiační exoresekce velkých anteriorně uložených tumorů choroidey a tumorů řasnatého tělesa, je exoresekce indikována u nejasných iridociliárních lézí s podezřelými znaky, jako je růst velikosti nebo tloušťky tumoru nebo výrazná vaskularizace. U těchto lézí někdy není možné provedení biopsie tenkou jehlou (např. v případě lokalizace léze v iridokorneálním úhlu), různé části léze navíc mohou vykazovat různé histopatologické a cytogenetické charakteristiky a výsledky vyšetření malého vzorku tkáně mohou být zavádějící [89,90].
Obr. 6. Nález na fundu 10 let po transsklerální exoresekci melanomu po předchozí terapii LGK 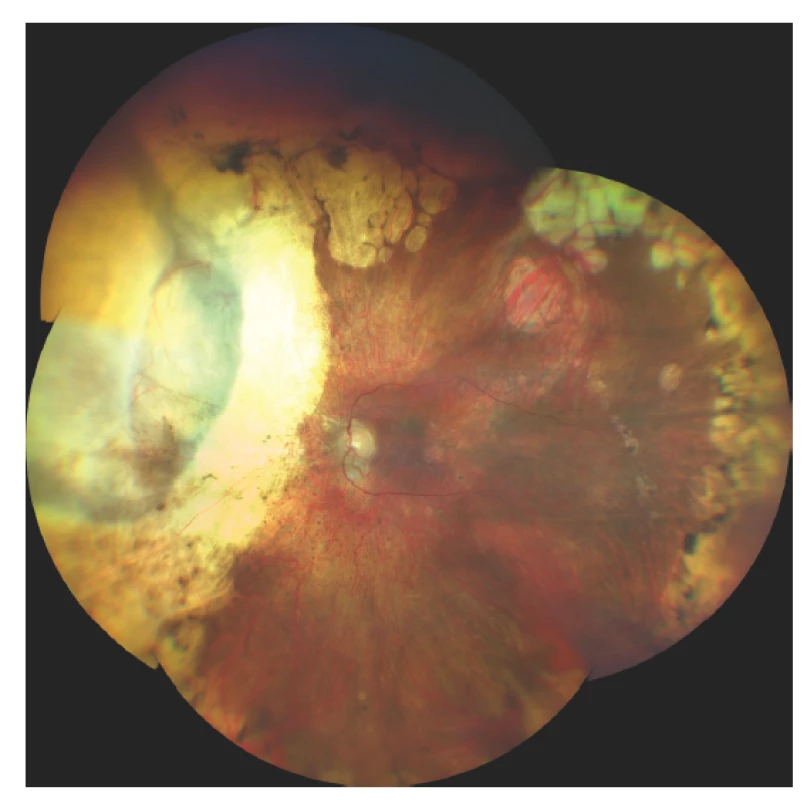
Zákrok se provádí v mírné reverzní Trendelenburgově poloze v celkové anestezii za řízené systémové hypotenze a monitoringu mozkových funkcí. Zákrok je zahájen 270° perilimbální peritomií, obnažením skléry a podvlečením 3 přímých okohybných svalů kolem tumoru. Pokud je tumor lokalizován přímo pod jedním z přímých okohybných svalů, je sval fixován na steh a přerušen. Následně se lokalizuje a na skléru vyznačí hranice tumoru – lokalizace se provádí transluminací nebo nepřímým oftalmoskopem s využitím lokalizátoru. Na skléře je poté vyznačen okraj plánovaného sklerálního flapu přesahující 3–4 mm hranice tumoru a ostrým nožem je vytvořen zářez zasahující do 80–90 % tloušťky skléry. Je vytvořena sklerální lamela, která je překlopena přes limbus. Pokud neprosvítá modrá barva přilehlé cévnatky, lůžko sklerální lamely se šetrně prohloubí. Poté je proveden obvodový řez vnitřní vrstvou skléry cca 3 mm za hranicí tumoru a je obnažena oblast uvey. Uvea se kauterizuje bipolárním kauterem, dokud nezbledne.
U uveálních tumorů s postižením duhovky se provádí paracentéza cca 90° od hlavní incize a do přední komory je aplikován viskoelastický materiál. Následně je přední komora otevřena mikrochirurgickým nožem uprostřed limbálního okraje sklerálního flapu a sklerokorneální incize je rozšířena do stran.
V případě melanomu řasnatého tělesa a/nebo choroidey je obvykle vhodné v oblasti baze sklivce provést limitovanou PPV bez infuze. Tím se sníží riziko prolapsu uvey, sítnice nebo sklivce během resekce tumoru. Samotný uveální tumor je posléze excidován pomocí Vannasových nůžek s tupými hroty. Nejprve se exciduje choroidální část, popř. oblast řasnatého tělesa, v případě postižení duhovky je posléze excidována duhovková část tumoru. Uveální nádor je spolu s naléhající tenkou lamelou skléry opatrně (technika „no-touch“) odstraněn tak, aby nedošlo k diseminaci nádorových buněk do oblasti chirurgického pole. Poté je do původní pozice přišit sklerální flap a rána je překryta spojivkou [86,91,92].
U případů s dominantním postižením řasnatého tělesa, ciliochoroidálních a iridociliochoiroidálních tumorů se měsíc po exoresekci provádí brachyterapie (Ru-106 aplikátor, dávka 100 Gy na tkáně 1 mm od vnitřního povrchu skléry). Snižuje se tak riziko lokální rekurence nádoru [86].
Hlavní peroperační komplikací je nedostatečně silný sklerální flap - při prohlubování sklerálního lůžka pak hrozí perforace skléry v oblasti tumoru s rizikem extrasklerální diseminace tumoru. Mezi nejčastější pooperační komplikace se řadí hemoftalmus, hyphaema, amoce sítnice, prosakování v oblasti sklerálního flapu, ablace choroidey, subretinální fibróza, katarakta, cystoidní makulární edém, bulozní keratopatie, lokální rekurence tumoru nebo sekundární glaukom [88].
Endoresekce
V případě endoresekce není zákrok limitován velikostí tumoru, ale u nádorů s bazí nad 15 mm stoupá riziko peroperačních i pooperačních komplikací (Obrázek 7). Kvůli špatné vizualizaci by ale měla být endoresekce zvažována u anteriorně uložených tumorů, u posteriorně uložených melanomů cévnatky by měl být odstup od papily zrakového nervu a fovey alespoň 1 PD [86].
Obr. 7. Nález na fundu 3 měsíce po endoresekci melanomu po předchozí terapii LGK 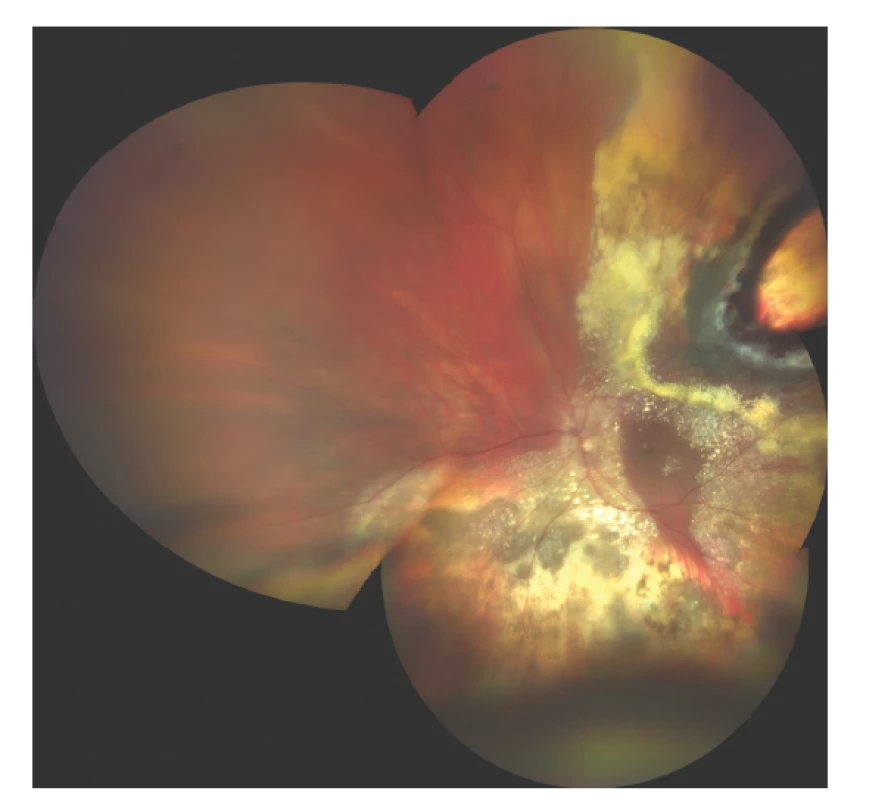
U fakických pacientů je zákrok zahájen fakoemulzifikací s implantací umělé nitrooční čočky, poté je provedena konvenční tříportová, popř. čtyřportová PPV, v oblasti tumoru se důkladně odloučí zadní hyaloidní membrána. Následně je provedena endodiatermie retinálních cév v oblasti baze tumoru, v případě přítomné subretinální tekutiny je pod perfluorodekalinem (PFCl) provedena její drenáž periferní retinotomií. V místě nejvyšší prominence tumoru je provedena retinotomie, skrze kterou je zaveden vitrektom do tumoru. Následuje vlastní transretinální endoresekce tumoru vitrektomem. Aby se minimalizovalo krvácení z cév tumoru, je v této fázi výrazně zvýšen nitrooční tlak (až na 80 mmHg) a ideálně je navozena řízená systémová hypotenze (systolický tlak pod 90 mmHg). Endoresekce je provedena až na skléru, jednotlivé sklerální a choroidální cévy jsou posléze ošetřeny endolaserem nebo endodiatermií. Průběžně je doplňován PFCl, po endoresekci jsou okraje retinektomie a choroidektomie ošetřeny endolaserem, resp. kryokoagulací. Při okraji baze původního nádoru obvykle zůstává na holé skléře lem plochých reziduí tumoru. PFCl je následně vyměněn za silikonový olej [86,93,94].
Peroperační použití plynové tamponády by mělo být pečlivě zvažováno z důvodu rizika vzduchové embolie do mozku, která může mít až fatální následky [95,96]. Častou perioperační i postoperační komplikací je krvácení, perioperačně je lze dobře kontrolovat zvýšením nitroočního tlaku, resp. cílenou endodiatermií [86]. Potenciálním rizikem endoresekce je peroperační šíření vitálních nádorových buněk. Proto je standardně doporučován kombinovaný přístup s ozářením nádoru před endoresekcí [97]. Riziko nádorové diseminace během endoresekce zpochybňuje např. Damato, který kvůli riziku postradiačních komplikací (retinopatie, neuropatie, makulopatie a především toxic tumor syndrom) endoresekci provádí i bez předchozí radioterapie [98].
Enukleace
Enukleace je metodou volby u pokročilých uveálních melanomů, které nelze účinně ošetřit teleradioterapií a/nebo způsobují úplnou nebo praktickou ztrátu zrakové ostrosti, totální odchlípení sítnice nebo bolestivý sekundární glaukom [99].
Na úvod zákroku je provedena 360° peritomie spojivky s obnažením skléry a po fixaci jsou odděleny přímé okohybné svaly od stěny bulbu, bulbus je prošit pevným fixačním sklerálním stehem. Po přerušení zrakového nervu za bulbem enukleačními nůžkami (z inferonasálního přístupu) a zastavení krvácení kombinací komprese a hemostatického implantátu je do enukleační jamky vložen biokompatibilní porézní implantát z hydroxyapatitu nebo z propustného vysoce denzního polyethylenu. V případě potřeby lze tvar polyethylenového implantátu po naložení do horkého sterilního solného roztoku individuálně upravit skalpelem. Nad implantátem jsou fixovány okohybné svaly, implantát lze také obalit vicrylovou síťkou nebo jej vložit do lůžka z dárcovské skléry a přímé okohybné svaly pak fixovat přímo k tomuto obalu. Enukleační jamka je uzavřena ve 2 vrstvách Tenonskou membránou a spojivkou. Zhruba 4–6 týdnů po enukleaci je možné začít používat na zakázku vyráběnou akrylovou nebo skleněnou oční náhradu.
Exenterace
Exenterace orbity je indikována u pacientů s pokročilým nádorem s extrabulbárním šířením nebo při recidivě nádoru v orbitě po předchozí enukleaci. Pokud to lokální nález umožňuje, využívá se techniky zachovávající víčka (Obrázek 8).
Na úvod zákroku jsou k sobě horní a dolní víčka fixována stehem procházejícím kůží, orbikulárním svalem a tarsální ploténkou. Poté je paralelně s okrajem víčka proveden kožní řez 2 mm nad a pod linií řas. Řez je veden kůží a orbikulárním svalem, které jsou tupě odpreparovány nahoru a dolů, čímž je cirkulárně za okrajem očnice obnažen periost. Poté je proveden řez periostem cca 2 mm zevně za okrajem očnice a je obnažena kost. Raspatoriem je opatrně odpreparován periost od kostěné stěny očnice. Po oddělení periostu až do hrotu očnice je tkáň vystřižena co nejblíže orbitálnímu apexu pomocí enukleačních nůžek (přístup z inferonasální strany) a extrahována za fixační víčkový steh založený v úvodu zákroku. Následuje intenzivní komprese, poté je exenterační dutina revidována a jsou odstraněny případné zbytky měkkých tkání. Po úplné hemostáze se do očnice vloží rukavicový drén a kůže víček se sešije. Cca 6–8 týdnů po zákroku je možné nasadit orbitální protézu [100].
Nové perspektivy v terapii uveálního melanomu
Radioterapie uveálního melanomu, případně v kombinaci s chirurgickou léčbou, sice zajišťuje dobrou kontrolu nad tumorem a umožňuje zachování očního bulbu, ale je často spojena s významným poklesem zrakové ostrosti. Snahou je proto nalézt účinný konzervativní léčebný přístup, který by přinesl lepší možnosti zachránit zrakové funkce postiženého oka.
U malých choroidálních melanomů se jako slibná jeví metoda využívající světlem aktivované molekuly léčiva AU-011. AU-011 se skládá ze syntetických, viru podobných částic (tzv. virus-like particles), derivovaných z lidských papilomavirů (HPV). Lék je aplikován do oka intravitreální injekcí a v oku se selektivně váže na buňky uveálního melanomu a jiné nádorové buňky, které nadměrně exprimují heparan sulfátové proteoglykany. Po aktivaci diodovým laserem o vlnové délce 689 nm, malé molekuly AU-011 selektivně zničí buněčnou membránu nádorových buněk [101]
Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou. Práce nebyla otištěna ani zadána k publikování v jiném odborném periodiku.
Do redakce doručeno dne: 7. 3. 2020
Přijato k publikaci dne: 13. 5. 2020MUDr. Štěpán Rusňák, Ph.D.
Oční klinika, Fakultní nemocnice v Plzni
Alej Svobody 80
304 60 Plzeň
rusnak@fnplzen.cz
Zdroje
1. Damato B, Heimann H. Personalized treatment of uveal melanoma. Eye. 2013 Feb;27(2):172–179.
2. Shields CL, Furuta M, Thangappan A et al. Metastasis of uveal melanoma millimeter-by-millimeter in 8033 consecutive eyes. Arch Ophthalmol. 2009 Aug;127(8):989–998.
3. Jouhi S, Jager MJ, de Geus SJR et al. The Small Fatal Choroidal Melanoma Study. A Survey by the European Ophthalmic Oncology Group. Am J Ophthalmol. 2019 Jun;202 : 100-108.
4. Bechrakis NE, Sehu KW, Lee WR, Damato BE, Foerster MH. Transformation of cell type in uveal melanomas: a quantitative histologic analysis. Arch Ophthalmol. 2000 Oct;118(10):1406–1412.
5. Frizziero L, Midena E, Trainiti S et al. Uveal Melanoma Biopsy: A Review. Cancers. 2019 Aug;11(8):1075. doi:10.3390/cancers11081075
6. Bagger MM. Intraocular biopsy of uveal melanoma Risk assessment and identification of genetic prognostic markers. Acta Ophthalmol. 2018 Jul;96 : 1–28.
7. Qiang Z, Cairns JD. Laser photocoagulation treatment of choroidal melanoma. Aust N Z J. Ophthalmol. 1993 May;21(2):87–92.
8. Mashayekhi A, Shields CL, Rishi P et al. Primary transpupillary thermotherapy for choroidal melanoma in 391 cases: importance of risk factors in tumor control. Ophthalmology 2015 Mar;122(3):600–609.
9. Shields CL, Shields JA, Perez N, Singh AD, Cater J. Primary transpupillary thermotherapy for small choroidal melanoma in 256 consecutive cases: outcomes and limitations. Ophthalmology. 2002 Feb;109(2):225–234.
10. Aaberg TM Jr, Bergstrom CS, Hickner ZJ, Lynn MJ. Long-term results of primary transpupillary thermal therapy for the treatment of choroidal malignant melanoma. Br J Ophthalmol 2008 Jun;92(6):741–746.
11. Shields CL, Cater J, Shields JA et al. Combined plaque radiotherapy and transpupillary thermotherapy for choroidal melanoma in 270 consecutive patients. Arch Ophthalmol 2002 Jul;120(7):933–940.
12. Cerman E, Çekiç O. Clinical use of photodynamic therapy in ocular tumors. Surv Ophthalmol 2015 Nov-Dec;60(6):557–574.
13. Avery RB, Diener-West M, Reynolds SM, Grossniklaus HE, Green WR, Albert DM. Histopathologic characteristics of choroidal melanoma in eyes enucleated after iodine 125 brachytherapy in the collaborative ocular melanoma study. Arch Ophthalmol. 2008 Feb;126(2):207–212.
14. Brewington BY, Shao YF, Davidorf FH, Cebulla CM. Brachytherapy for patients with uveal melanoma: historical perspectives and future treatment directions. Clin Ophthalmol. 2018 May;12 : 925-934.
15. Deutschmann R. Ueber intraokularen Tumor und Strahlentherapie. Augenheilkd. 1915;33 : 206–209. German.
16. Moore RF. Choroidal sarcoma treated by intraocular insertion of radon seeds. Br J Ophthalmol. 1930 Apr;14(4):145–152.
17. Stallard HB. A new technique for the application of radon seeds to the sclera in the treatment of glioma retinae. Br J Ophthalmol. 1938 Oct;22(10):604–608.
18. Shields CL, Shields JA, Cater J et al. Plaque Radiotherapy for Uveal Melanoma: Long-term Visual Outcome in 1106 Consecutive Patients. Arch Ophthalmol. 2000 Sep;118(9):1219–1228.
19. Lommatzsch P. Morphologische und funktionelle Veränderungen des Kaninchenauges nach Einwirkung von Betastrahlen (106Ru/106Rh) auf den dorsalen Bulbusabschnitt. [Morphological and functional changes in the rabbit eye on exposure of the dorsal bulb section to beta rays (106Ru/106Rh)]. Von Graefes Arch Klin Exp Ophthalmol. 1968;176 : 100–125. German.
20. Damato B, Patel I, Campbell IR, Mayles HM, Errington RD. Local tumor control after 106Ru brachytherapy of choroidal melanoma. Int J Radiat Oncol Biol Phys. 2005 Oct;63(2):385–291.
21. Bergman L, Nilsson B, Lundell G, Lundell M, Seregard S. Ruthenium brachytherapy for uveal melanoma, 1979-2003: survival and functional outcomes in the Swedish population. Ophthalmology. 2005 May;112(5):834–840.
22. Barker CA, Francis JH, Cohen GN et al. 106Ru plaque brachytherapy for uveal melanoma: factors associated with local tumor recurrence. Brachytherapy. 2014 Nov-Dec;13(6):584–590.
23. Tarmann L, Wackernagel W, Avian A et al. Ruthenium-106 plaque brachytherapy for uveal melanoma. Br J Ophthalmol. 2015 Dec;99(12):1644–1649.
24. Earle J, Kline RW, Robertson DM. Selection of iodine 125 for the Collaborative Ocular Melanoma Study. Arch Ophthalmol. 1987 Jun;105(6):763–764.
25. Packer S, Rotman M, Fairchild RG, Albert DM, Atkins HL, Chan B. Irradiation of choroidal melanoma with iodine 125 ophthalmic plaque. Arch Ophthalmol. 1980 Aug;98(8):1453–1457.
26. Newman GH, Davidorf FH, Havener WH, Makley TA. Conservative management of malignant melanoma – I: irradiation as a method of treatment for malignant melanoma of the choroid. Arch Ophthalmol. 1970 Jan;83(1):21–26.
27. Stallard HB. Radiotherapy for malignant melanoma of the choroid. Br J Ophthalmol. 1966 Mar;50(3):147–155.
28. Shields JA, Augsburger JJ, Brady LW, Day JL. Cobalt plaque therapy of posterior uveal melanomas. Ophthalmology 1982 Oct;89(10):1201–1207.
29. Cruess AF, Augsburger JJ, Shields JA, Brady LW, Markoe AM, Day JL. Regression of posterior uveal melanomas following cobalt-60 plaque radiotherapy. Ophthalmology. 1984 Dec;91(12):1716–1719.
30. Finger PT, Chin KJ, Duvall G. Palladium-103 ophthalmic plaque radiation therapy for choroidal melanoma: 400 treated patients. Ophthalmology. 2009 Apr;116(4):790–796.
31. van Ginderdeuren R, van Limbergen E, Spileers W. 18 years experience with high dose rate strontium-90 brachytherapy of small to medium sized posterior uveal melanoma. Br J Ophthalmol. 2005 Oct;89(10):1306–1310.
32. Henderson MA, Shirazi H, Lo SS et al. Stereotactic Radiosurgery and Fractionated Stereotactic Radiotherapy in the Treatment of Uveal Melanoma. Technol Cancer Res Treat. 2006 Aug;5(4):411–419.
33. Zehetmayer M, Kitz K, Menapace R et al. Local Tumor Control and Morbidity After One to Three Fractions of Stereotactic External Beam Irradiation for Uveal Melanoma. Radiother. Oncol. 2000 May;55(2):135–144.
34. Marchini G, Gerosa M, Piovan E et al. Gamma Knife Stereotactic Radiosurgery for Uveal Melanoma: Clinical Results after 2 Years. Stereotact Funct Neurosurg.1996;66 Suppl 1 : 208–213.
35. Langmann G, Pendl G, Klaus M, Papaefthymiou G, Guss H. Gamma Knife Radiosurgery for Uveal Melanomas: An 8-year Experience. J Neurosurg. 2000 Dec;93 (Suppl 3):184–188.
36. Langmann G, Pendl G, Mullner K, Feichtinger KH, Papaefthymiouaf G. High-compared with Low-dose Radiosurgery for Uveal Melanomas. J Neurosurg. 2002 Dec;97(Suppl 5):640–643.
37. Backlund EO. The history and development in radiosurgery. In: Stereotactic Radiosurgery Update. Proceedings of the International Stereotactic Radiosurgery Symposium, Pittsburg (USA): Elsevier Science NewYork;1991, p.1–7.
38. Liščák R. a kolektiv. Radiochirurgie gama nožem-Principy a neurochirurgické aplikace, 1st ed. Praha (Czech republic): Grada Publishing;2011. Chapter 2, Novotný J. Fyzikální principy radiochirurgie; p.19–31. Czech.
39. Langmann G, Pendl G, Schrottner O. Gamma knife of uveal melanoma radiosurgery for intraocular melanomas. Preliminary report. Spectrum Augenhelkd 1995;9 (Suppl 1):16–21.
40. Bellmann C, Fuss M, Holz F et al. Stereotactic radiation therapy for malignant choroidal tumors, preliminary, short-term results. Ophtalmology 2000 Feb;107(2):358–365.
41. Simonova G, Novotny J, Liscak R, Pilbauer J. Leksell Gamma Knife Treatment of Uveal Melanoma. J Neurosurg. 2002 Dec;97(Suppl 5):635–639.
42. Sarici AM, Pazarli H. Gamma-knife-based stereotactic radiosurgery for medium-and large-sized posterior uveal melanoma. Graefes Arch Clin Exp Ophthalmol. 2013 Jan;251(1):285–294.
43. Modorati G, Miserocchi E, Galli L, Picozzi P, Rama P. Gamma knife radiosurgery for uveal melanoma: 12 years of experience. Br J Ophthalmol. 2009 Jan;93(1):40–44.
44. Joye RP, Williams LB, Chan MD et al. Local control and results of Leksell Gamma Knife therapy for the treatment of uveal melanoma. Ophthalmic Surg Lasers Imaging Retina. 2014 Mar-Apr;45(2):125–131.
45. Kang DW, Lee SC, Park YG, Chang JH. Longterm results of GammaKnife surgery for uveal melanomas. J Neurosurg. 2012 Dec;117 Suppl:108–14.
46. Cyberknife. Mojemedicina.cz [Internet]. Roche Czech Republic;2020 [cited 2020 Jan 23]. Available from: https://www.mojemedicina.cz/pruvodce-pacienta/lecebne-metody/cyberknife-1.html. Czech.
47. Zkušenosti a výsledky extrakraniální stereotaktické radioterapie přístrojem CyberKnife - Zdraví.Euro.cz. Zdravotnictví a medicína - Zdraví.Euro.cz [Internet]. Mladá Fronta a.s.;2020 [cited 2020 Jan 23]. Available from: https://zdravi.euro.cz/clanek/postgradualni-medicina/zkusenosti-a-vysledky-extrakranialni-stereotakticke-radioterapie-pristrojem-cyberknife-481954. Czech.
48. Brain Tumor Treatment Process Accuray CyberKnife. Home Accuray CyberKnife [Internet]. Accuray;2020 [cited 2020 Jan 23]. Available from: https://www.cyberknife.com/treatment/process/brain%20tumor.
49. Výhody a omezení léčby, indikace - Kybernetický nůž Cyberknife. Kybernetický nůž Cyberknife [Internet]. Fakultní nemocnice Ostrava;2009 [cited 2020 Jan 23]. Available from: https://cyberknife.fno.cz/cs/clanky/vyhody-a-omezeni-lecby-indikace. Czech.
50. Eibl-Lindner K, Furweger C, Nentwich M et al. Robotic radiosurgery for the treatment of medium and large uveal melanoma. Melanoma Res 2016 Feb; 6(1):51-57.
51. Soykut ED, Guney YY, Dizman A et al. Retrospective review of uveal melanoma patients treated with fractionated stereotactic radiotherapy. Cumhuriyet Medical Journal 2018 Dec;40(4):421–431.
52. Klop LA, Faase –De Hoog M, Luthart L, de Pan C. Stereotactic radiosurgery of uveal melanoma on the Cyberknife M6TM [Internet]. Available from: https://www.macromedics.com/files/upload/07/dsps-eye-melanoma-poster-emc-nvmbr-congress.pdf.
53. Zorlu F, Selek U, Kiratli H. Initial results of fractionated CyberKnife radiosurgery for uveal melanoma. J Neurooncol 2009 Aug; 94(1):111–117.
54. Fry DW, Harvie RD, Mullett LB, Walkinshaw W. A traveling wave linear accelerator for 4 MeV electrons. Nature 1948 Nov;162(4126):859–861.
55. Betti OO, Derechinski VE. Hyperselective encephalic irradiation with a linear accelerator. Acta Neurochirurgica Supplement 1984; 33 : 385–390.
56. Winston KR, Lutz W. Linear accelerator as a neurosurgical tool for stereotactic radiosurgery. Neurosurgery 1988 Mar; 22(3):454–464.
57. Suesskind D, Scheiderbauer J, Buchgeister M et al. Retrospective evaluation of patients with uveal melanoma treated by stereotactic radiosurgery with and without tumor resection. Jama Ophthalmol. 2013 May;131(5):630–637.
58. Furdova A, Sramka M., Chorvath M, Kralik G. Linear accelarator stereotactic radiosurgery in intraocular malignant melanoma. Austin J Radiat Oncol Cancer 2015;1(2):1008.
59. Thornton AF, Fitzek M, Klein S et al. Proton beam radiotherapy: a specialized treatment alternative. Community Oncology. 2007 Oct;4(10):599–607.
60. Levin WP, Kooy H, Loeffler JS, DeLaney TF. Proton therapy. Br J Cancer. 2005 Oct 17;93(8):849-854.
61. Fleurette F, Charvet-Protat S. Proton - et neutronthérapie dans le traitement du cancer: considérations cliniques et économiques. [Proton and neutron radiation in cancer treatment: clinical and economic outcomes]. Bull Cancer Radiother 1996;83(1),223-27. French.
62. Damato B, Kacperek A, Chopra M, Campbell IR, Errington RD. Proton beam radiotherapy of choroidal melanoma: the Liverpool-Clatterbridge experience. Int J Radiat Oncol Biol Phys. 2005 Aug;62(5):1405–1411.
63. Courdi A, Caujolle JP, Grange JD et al. Results of proton therapy of uveal melanomas treated in Nice. Int J Radiat Oncol Biol Phys. 1999 Aug 1;45(1):5-11.
64. Kishan AU, Modjtahedi BS, Morse LS, Lee P: Radiation Therapy for Neovascular Age-related Macular Degeneration. Int J Radiat Oncol Biol Phys. 2013 Mar;85(3):583–597.
65. Fuss M, Loredo LN, Blacharski PA, Grove RI, Slater JD. Proton radiation therapy for medium and large choroidal melanoma: preservation of the eye and its functionality. Int J Radiat Oncol Biol Phys. 2001 Mar 15;49(4):1053–1059.
66. Amstutz CA, Bechrakis NE, Foerster MH, Heufelder J, Kowal JH. Intraoperative localization of tantalum markers for proton beam radiation of choroidal melanoma by an opto-electronic navigation system: a novel technique. Int J Radiat Oncol Biol Phys. 2012 Mar;82(4):1361–1366.
67. Marnitz S, Cordini D, Bendl R et al. Proton therapy of uveal melanomas: intercomparison of MRI-based and conventional treatment planning. Strahlenther Onkol. 2006 Jul;182(7):395–399.
68. Damato B, Kacperek A, Chopra M, Sheen MA, Campbell IR, Errington RD. Proton beam radiotherapy of iris melanoma. Int J Radiat Oncol Biol Phys. 2005 Sep;63(1):109–115.
69. Caujolle JP, Mammar H, Chamorey E, Pinon F, Herault J, Gastaud P. Proton beam radiotherapy for uveal melanomas at nice teaching hospital: 16 years' experience. Int J Radiat Oncol Biol Phys. 2010 Sep;78(1):98–103.
70. Russo A, Laguardia M, Damato B. Eccentric ruthenium plaque radiotherapy of posterior choroidal melanoma. Graefes Arch Clin Exp Ophthalmol. 2012 Oct;250(10):1533–1540.
71. Archer DB, Gardiner TA. Ionizing radiation and the retina. Curr Opin Ophthalmol. 1994 Jun;5(3):59–65.
72. Zahorjanova P, Furdova A, Waczulikova I, Sramka M, Kralik G, Stubna M. Radiation maculopathy after one – day session stereotactic radiosurgery in patients with ciliary body and choroidal melanoma. Čes a slov. Oftal. 2019;75(1):3–10.
73. Giuliari GP, Sadaka A, Hinkle DM, Simpson ER. Current treatments for radiation retinopathy. Acta Oncol. 2011 Jan;50(1):6–13.
74. Amoaku WM, Lafaut B, Sallet G, De Laey JJ. Radiation choroidal vasculopathy: an indocyanine green angiography study. Eye 1995;9(Pt 6):738–744.
75. Kim IK, Lane AM, Egan KM, Munzenrider J, Gragoudas ES. Natural history of radiation papillopathy after proton beam irradiation of parapapillary melanoma. Ophthalmology. 2010;117(8):1617–1622.
76. Borruat FX, Schatz NJ, Glaser JS, Feun LG, Matos L. Visual recovery from radiation-induced optic neuropathy. The role of hyperbaric oxygen therapy. J Clin Neuroophthalmol. 1993 Jun;13(2):98–101.
77. Girkin CA, Comey CH, Lunsford LD, Goodman ML, Kline LB. Radiation optic neuropathy after stereotactic radiosurgery. Ophthalmology. 1997;104(10):1634–1643.
78. Shields CL, Demirci H, Marr BP et al. Intravitreal triamcinolone acetonide for acute radiation papillopathy. Retina. 2006 May-Jun;26(5):537–544.
79. Finger PT, Chin KJ. Antivascular endothelial growth factor bevacizumab for radiation optic neuropathy: secondary to plaque radiotherapy. Int J Radiat Oncol Biol Phys. 2012 Feb;82(2):789–798.
80. Cappin JM. Malignant melanoma and rubeosis iridis. Histopathological and statistical study. Br J Ophthalmol. 1973 Nov;57(11):815–824.
81. Merriam GR, Worgul BV. Experimental radiation cataract- - its clinical relevance. Bull N Y Acad Med. 1983 May;59(4):372–392.
82. Wachtlin J, Bechrakis NE, Schueler AO, Helbig H, Bornfeld N, Foerster MH. Phacoemulsification following treatment of choroidal melanoma. Graefes Arch Clin Exp Ophthalmol. 2000 Dec;238(12):942–948.
83. Radin PP, Lumbroso-Le Rouic L, Levy-Gabriel C, Dendale R, Sastre X, Desjardins L. Scleral necrosis after radiation therapy for uveal melanomas: report of 23 cases. Graefes Arch Clin Exp Ophthalmol. 2008 Dec;246(12):1731–1736.
84. Gunduz K, Shields CL, Shields JA, Cater J, Freire JE, Brady LW. Plaque radiotherapy of uveal melanoma with predominant ciliary body involvement. Arch Ophthalmol. 1999 Feb;117(2):170–177.
85. Hamza HS, Elhusseiny AM. Choroidal Melanoma Resection. Middle East Afr J Ophthalmol. 2018 Apr-Jun;25(2):65–70.
86. Gündüz K, Bechrakis NE. Exoresection and endoresection for uveal melanoma. Middle East Afr J Ophthalmol. 2010 Jul;17(3):210–216.
87. Klauber S, Jensen PK, Prause JU, Kessing SV. Surgical treatment of iris and ciliary body melanoma: follow-up of a 25-year series of patients. Acta Ophthalmol. 2012 Mar;90(2):122–6.
88. Rospond-Kubiak I, Damato B. The surgical approach to the management of anterior uveal melanomas. Eye. 2014 Jun;28(6):741–747.
89. Marigo FA, Finger PT. Anterior segment tumors: Current concepts and innovations. Surv Ophthalmol. 2003 Nov-Dec;48(6):569–593.
90. Damato B, Woulds WS. Indications for trans-scleral local resection of uveal melanoma. Br J Ophthalmol. 1996 Nov;80(11):1029–1030.
91. Shields JA, Shields CL. Surgical approach to lamellar sclerouvectomy for posterior uveal melanomas: The 1986 Schoenberg lecture. Ophthalmic Surg. 1988 Nov;19(11):774–780.
92. Shields JA, Shields CL, Shah P, Sivalingam V. Partial lamellar sclerouvectomy for ciliary body and choroidal tumors. Ophthalmology. 1991 Jun;98(6):971–983.
93. Damato B, Jones AG. Uveal melanoma: resection techniques. Ophthalmol Clin North Am. 2005 Mar;18(1):119–128.
94. Damato B, Groenewald C, McGalliard J, Wong D. Endoresection of choroidal melanoma. Br J Ophthalmol. 1998 Mar;82(3):213–218.
95. Rice JC, Liebenberg L, Scholtz RP, Torr G. Fatal air embolism during endoresection of choroidal melanoma. Retin Cases Brief Rep 2014;8(2):127–129.
96. Joussen AM, Wong D. Egress of large quantities of heavy liquids from exposed choroid: a route for possible tumor dissemination via vortex veins in endoresection of choroidal melanoma. Graefes Arch Clin Exp Ophthalmol. 2015 Feb;253(2): 177–178.
97. Bechrakis NE, Foerster MH. Neoadjuvant proton beam radiotherapy combined with subsequent endoresection of choroidal melanomas. Int Ophthalmol Clin. 2006;46(1):95–107.
98. Damato B. Endoresection of uveal melanoma without radiotherapy. Acta Ophthalmol, 2017;95.
99. Shields JA, Shields CL. Management of posterior uveal melanoma: past, present, and future: the 2014 Charles L. Schepens lecture. Ophthalmology. 2015 Feb;122(2):414–428.
100. Shields JA, Shields CL, Suvarnamani C, Tantasira M, Shah P: Orbital exenteration with eyelid sparing: Indications, technique and results. Ophthalmic Surg. 1991 May;22(5):292–297.
101. Singh AD. Light-Activated Therapy of Choroidal Melanoma. A new modality could be an effective alternative to radiation. Retinal Physician. 2019 Jul;16 : 41–45.
Štítky
Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2021 Číslo 1- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
-
TERAPIE UVEÁLNÍHO MELANOMU
PŘEHLED -
NAŠE ZKUŠENOSTI S POUŽITÍM FAKOEMULZIFIKAČNÍ KONCOVKY
ACTIVE SENTRY A CENTURION OZIL - VYŠETŘENÍ ZORNÉHO POLE U HYPERTENZNÍCH GLAUKOMŮ
- VLIV LÉČBY NA POVRCH OKA U PACIENTŮ S JEDNOSTRANNÝM DĚTSKÝM GLAUKOMEM
- STAVY NAPODOBUJÍCÍ PACHYCHOROIDNÍ CHOROBY SÍTNICE – SOUBOR KAZUISTIK
- BLOW-IN FRAKTURA STROPU OČNICE KAZUISTIKA
-
TERAPIE UVEÁLNÍHO MELANOMU
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
TERAPIE UVEÁLNÍHO MELANOMU
PŘEHLED - BLOW-IN FRAKTURA STROPU OČNICE KAZUISTIKA
- STAVY NAPODOBUJÍCÍ PACHYCHOROIDNÍ CHOROBY SÍTNICE – SOUBOR KAZUISTIK
- VYŠETŘENÍ ZORNÉHO POLE U HYPERTENZNÍCH GLAUKOMŮ
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy