-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
VYŠETŘENÍ ZORNÉHO POLE U HYPERTENZNÍCH GLAUKOMŮ
Autori: J. Lešták; M. Fůs
Pôsobisko autorov: Oční klinika JL Fakulty biomedicínského inženýrství ČVUT v Praze
Vyšlo v časopise: Čes. a slov. Oftal., 77, 2021, No. 1, p. 22-26
Kategória: Původní práce
doi: https://doi.org/10.31348/2021/2Súhrn
Cíle: Cílem práce bylo ověřit, zda je nutné u počínajících hypertenzních glaukomů vyšetřit celé zorné pole.
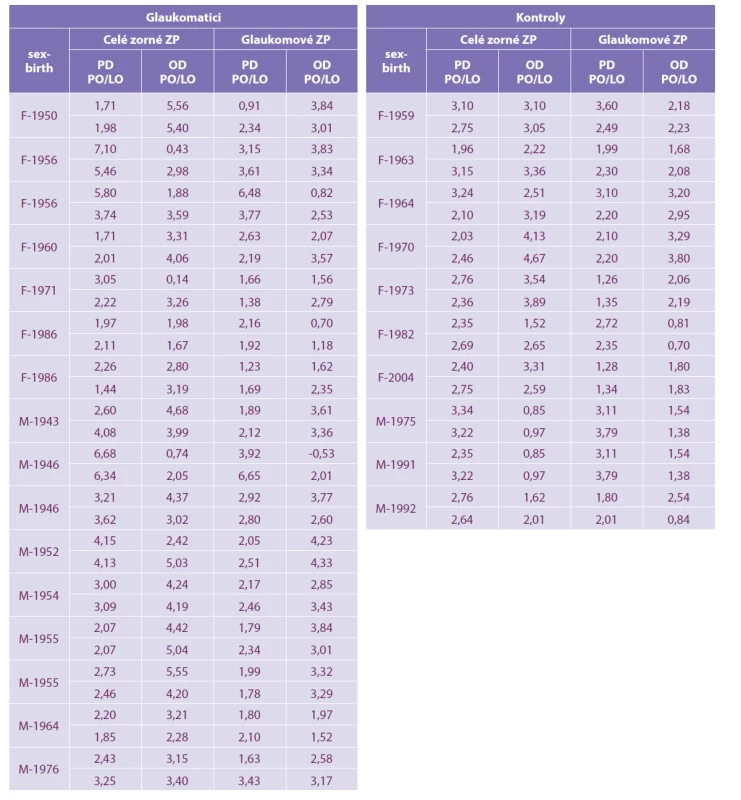
Materiál a metody: Studie zahrnuje 16 pacientů s počínajícím glaukomem (skupina HTG) bez zjevných změn v zorném poli, a kontrolní skupinu 10 pacientů s normálním očním nálezem a hodnotou 1.0 zrakové ostrosti. Pacienti obou skupin podstoupili perimetrické vyšetření testem celého zorného pole a následně glaukomového zorného pole (rychlá prahová strategie pro oba testy). Pomocí Pearsonova korelačního koeficientu byly hodnoceny parametry pattern defect (PD) a overall defect (OD).
Výsledky: Ve skupině HTG byla pomocí Pearsonova korelačního koeficientu prokázána silná závislost mezi oběma programy jak u PD (r = 0,74), tak u OD (r = 0,63). U kontrolní skupiny byla u PD prokázána střední (r = 0,54) a u OD silná korelace (r = 0,636).
Závěr: I když by se dalo očekávat, že změny v periferii zorného pole budou diagnostikované u HTG jako první, naše výsledky ukázaly, že tomu tak není. Proto je i v počínajících stadiích HTG dostačující pro dokumentaci průběhu onemocnění vyšetření glaukomovým programem.
Klíčová slova:
hypertenzní glaukom – perimetr – pattern defect – overall defect – volba program
doc. MUDr. Ján Lešták, CSc, MSc,
MBA, LLA, DBA, FEBO, FAOG
ÚVOD
Perimetrické vyšetření je v oftalmologické praxi nejčastěji indikováno u glaukomového onemocnění. Vzhledem k tomu, že se za nálezem na terči zrakového nervu může skrývat i jiná neurogenní, hlavně útlaková leze zůstává toto vyšetření nenahraditelné v prvním kontaktu oftalmologa s pacientem.
Dosavadní doporučení k výběru rozsahu perimetrického vyšetření nerozlišovali mezi hypertenzním (HTG) a normotenzním glaukomem (NTG). Přibližně jednu třetinu primárních glaukomů s otevřeným úhlem tvoří NTG [1,2].
Pro NTG jsou charakteristické změny v centrální části zorného pole a tyto mají hlubší pokles citlivosti [3,4,5,6,7].
Po zvýšení nitroočního tlaku (NOT) v experimentu dochází v sítnici k aktivaci mikroglií a makroglií [8]. Kromě této změny dochází i k přímé alteraci gangliových buněk sítnice. Dříve něž se spustí proces apoptózy se samotná buňka brání smrti tím, že se zmenší nejen její povrch ale i dendritický strom. Více jsou poškozeny magnocelulární gangliové buňky [9,10,11,12]. Tyto procesy probíhají nejen na úrovni sítnice ale i corpus geniculatum laterale (CGL) [12,13,14,15].
Touto problematikou se zabývali i Quigley a spol., kteří na kadaverozních glaukomových očích zjistili větší úbytek velkých gangliových buněk sítnice, přičemž perifoveální oblast zůstala intaktní [16,17]. Protože se magnocelulární gangliové buňky nacházejí v periferii sítnice, mělo by dojít při vyšetření zorného pole ke změnám právě v jeho periferii. Centrální část zorného pole by měla zůstat alespoň v časných stadiích intaktní. Proto bylo i cílem naší práce zjistit, zda u počínajícího hypertenzního glaukomového onemocnění stačí vyšetřit centrální část zorného pole (glaukomový program) nebo je nutné vyšetřit celé pole.
Soubor a metodika vyšetření
Do souboru bylo zařazeno sedm žen průměrného věku 53,6 let (34–70 let) a devět mužů průměrného věku 65,4 (44–77 let). Všichni měli verifikovaný hypertenzní glaukom v počátečním stadiu bez zjevných změn v zorných polích trvající alespoň tři roky. Kontrolní skupinu tvořilo sedm žen průměrného věku 39,7 let (26-61 let) a tři muži průměrného věku 40,7 let (29–45 let) s normálním očním nálezem a zrakovou ostrostí rovné 1,0.
U všech jsme vyšetřili celé zorné pole rychlou prahovou strategií (fast threshold) a následně po desetiminutovém odpočinku i glaukomovým programem na přístroji Medmont M700 (Medmont Pty Ltd, Victoria 3124, Australia). Glaukomový program se v rozsahu 0 až 22 stupňů temporálně a 0 až 50 stupňů nasálně vyšetřuje ve 104 bodech. Program k vyšetření celého pole je v rozsahu 0 až 50 stupňů a obsahuje 164 bodů. U každého zorného pole jsme hodnotili pattern defect (PD) a overall defect (OD). Ztráty fixace, falešně pozitivní i falešně negativní odpovědi byly u všech menší 10 %. Souhrnná data jsou uvedena v tabulce 1.
VÝSLEDKY
Porovnáním naměřených hodnot PD při glaukomovém programu a celém zorném poli jsme u nemocných HTG zjistili silnou korelace (r = 0,74). Podobně silnou korelaci vykázal i OD (r = 0,64). U zdravých jedinců PD středně koreloval u obou vyšetření (r = 0,54). OD vykázal silnou korelaci (r = 0,636). Tabulka 2.
Tab. 2. Pearsonův koeficient r: 0,00–0,19 velmi slabá, 0,20–0,39 slabá, 0,40–0,59 střední, 0,60–0,79 silná a 0,80–1,00 velmi silná 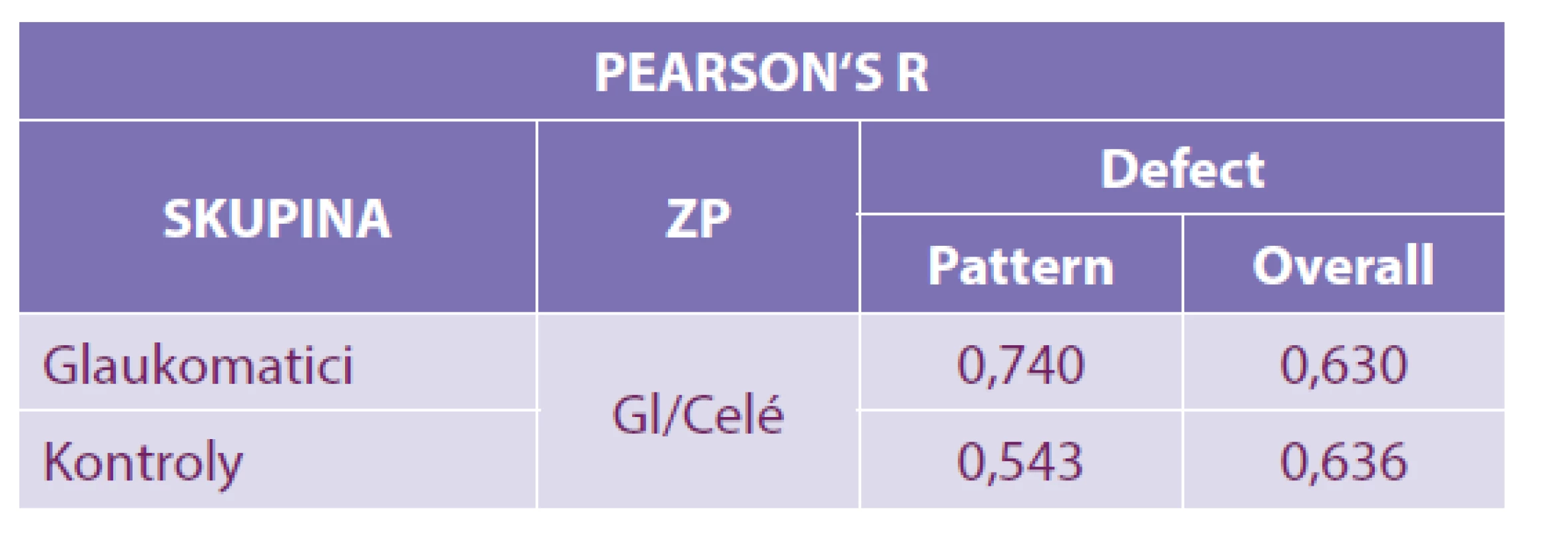
DISKUSE
U HTG dochází v počátečních stadiích onemocnění k nestabilním (přechodným) a izolovaným změnám v citlivosti vyšetřovaných bodů. Kvůli variabilitě prokázané v této studii, OCULAR Hypertension Treatment Study (OHTS) změnila svůj protokol zorného pole pro potvrzení abnormality. Vyžadují se tři po sobě jdoucí abnormální zorné pole, u nichž vada není artefakická, zahrnuje stejný index a abnormalita je na stejném místě. V této studii byly subjekty vyšetřeny programem 30-2 [18].
Co se týče výběru testu doporučují Heijl a Patella použít u glaukomu vyšetření centrálních 30 stupňů v počtu 54 vyšetřovaných bodů (Humphrey field analyser firmy Carl Zeiss Meditec SRN) [19]. Tento názor autoři sdílí i v dalším čtvrtém vydání Essential perimetry [20].
Na úvod této diskuse musíme uvést některá fakta o fyziologii a morfologii gangliových buněk sítnice a psychofyziologických vyšetření (perimetr). Počet fotoreceptorů (tyčinek a čípků), které jsou spojeny s jednou gangliovou buňkou tvoří receptivní pole. V sítnici oka se nachází několik typů gangliových buněk. Nejčastěji jsou ve spojitosti s glaukomem uváděny parvocelulární (P), magnocelulární (M) a koniocelulární (K).
P gangliové buňky sítnice jsou charakterizovány:
- velkým počtem (1 000 000),
- lokalizací více centrálně,
- nízkou axonální rychlostí vedení vzruchu,
- relativně malým receptivním polem (proto odpovídají i za centrální zrakovou ostrost),
- reagují na pomalu blikající světelné podněty,
- reagují na objekty o vysoké prostorové frekvenci a nízké kontrastní citlivosti,
- reagují na barevné podněty,
- nereagují na pohyblivé podněty [21],
M gangliové buňky sítnice jsou charakterizovány:
- malým počtem (100 000),
- lokalizací více periferně,
- vysokou axonální rychlostí vedení vzruchu,
- relativně velkým receptivním polem,
- reagují na rychle blikající světelné podněty,
- reagují na objekty o nízké prostorové frekvenci a vysoké kontrastní citlivosti,
- reagují na pohybující se podněty,
- nereagují na barevné podněty [21].
Objeví-li se v receptivním poli barva modrá, reagují K gangliové buňky [21].
Signifikantní změny v zorném poli byly spojeny se ztrátou 25–35 % gangliových buněk sítnice, přičemž přednostně umírali M buňky. Je ale nutné zdůraznit, že k vyšetření použili autoři program 30-2 (Humphrey field analyser) [22].
Tyto buněčné procesy mohou probíhat nezávisle na poškození nervových vláken gangliových buněk sítnice.
Rovněž bylo prokázáno, že RNFL předbíhají změny v zorných polích [23]. K podobným výsledků jsme došli v jiné práci i my, kdy jsme optickou koherenční angiografii (OCTA) zjišťovali vessel density (VD) v peripapilární oblasti. Prokázali jsme, že VD má u HTG velmi malý vliv na změny v zorných polích. Podobně i RNFL na změny v zorném poli. Na změnách v RNFL má ale VD středně silný vliv [24]. V další práci jsme pomocí SD-OCT RTvue-100 porovnávali tloušťku vrstvy ganglion cells complex (GCC) a RNFL s druhostrannou altitudinální polovinou zorného pole. U HTG jsme nezjistili žádnou statisticky významnou korelaci [25]. Je nutno upozornit, že vyšetření GCC, RNFL a VD dávající informace o centrální části sítnice, a ne její periferní části. I to byl důvod, proč jsme chtěli u této diagnostické skupiny poznat v počátečních stadiích i periferii zorného pole.
K podobným závěrů došli i Na a spol. [26]. Zde je důležité také uvést, že u glaukomových očí s NOT nad 20 mmHg došlo k výraznému poklesu makulární a papilární vessel density (VD) (p < 0,05) [27].
Po úpravě NOT pozorovali In a spol. výrazné zlepšení VD v peripapilární oblasti nemocných s HTGl [28].
Změny ve vrstvě nervových vláken u očí s vyšším NOT jsou známé více než třicet let. Quigley a spol. a Sommer a spol. v experimentu na opicích prokázali, že vlákna M buněk atrofovali rychleji než ostatní, i když nebyly ušetřeny ani vlákna ostatních buněk [16,29].
Když se podíváme na funkce M gangliových buněk, tak zjistíme, že reagují na kontrast, strukturu a pohyb v receptivním poli. Z toho lze vyvodit i jejich větší citlivost na perimetrické vyšetření, kde je jako stimul použit pohyb [30], kontrast spojený s pohybem [31–34] a rychle blikající světelné podněty [34–36].
Bohužel, tyto technologie pro vyšetření zorného pole se běžně nepoužívají.
Tak jak je uvedeno v úvodu, dochází v experimentu po zvýšení NOT k alteraci hlavně magnocelulárních gangliových buněk sítnice. Tento závěr jsme verifikovali i u zdravého jedince, kde jsme elektrofyziologickým měřením prokázali, že po zvýšení NOT na 40 mmHg dochází k blokádě přenosu elektrických změn napětí právě na úrovni gangliových buněk sítnice. Podobně reagovali gangliové buňky u jiného pacienta s HTG, kde jsme po vysazení antiglaukomatik zjistili pokles amplitudy N50–N95 na obou očích [37].
ZÁVĚR
Výsledky naší práce neprokázaly významnost vyšetření celého zorného pole u počínajících glaukomů. To ale neznamená, že začneme HTG léčit až při prvních změnách v zorném poli. Důležité je vyšetření RNFL a eventuálně VD, které předbíhají perimetrické změny.
Čestné prohlášení:
Autoři prohlašují, že vznik a téma odborného sdělení a jeho zveřejnění není ve střetu zájmu a není podpořeno žádnou farmaceutickou firmou. Práce nebyla zadána jinému časopisu ani jinde otištěna.
Do redakce doručeno dne: 17. 8. 2020
Přijato k publikaci dne: 11. 11. 2020
doc. MUDr. Ján Lešták, CSc, MSc, MBA, LLA, DBA, FEBO, FAOG
Oční klinika JL Fakulty biomedicínského inženýrství ČVUT v Praze
V Hůrkách 1296/10
158 00 Praha 5 – Nové Butovice
Zdroje
1. Bonomi L, Marchini G, Marraffa M. et al. Prevalence of glaucoma and intraocular pressure distribution in a defined population.The Egna-Neumarkt Study. Ophthalmology. 1998;105 : 209–215.
2. Klein BE, Klein R, Sponsel WE. et al. Prevalence of glaucoma. The Beaver Dam Eye Study. Ophthalmology. 1992;99 : 1499-1504.
3. Araie M, Yamagami J, Suziki Y. Visual field defects in normal-tension and high-tension glaucoma. Ophthalmology. 1993;100 : 1808–1814.
4. Levene RZ. Low tension glaucoma: a critical review and new material. Surv Ophthalmol. 1980;24 : 621–664.
5. Zeiter JH, Shin DH, Juzych MS, Jarvi TS, Spoor TC, Zwas F. Visual field defects in patients with normal-tension glaucoma and patients with high-tension glaucoma. Am J Ophtalmol. 1992;114 : 758–763.
6. Caprioli J, Spaeth GL. Comparison of visual field defects in the low-tension glaucomas with those in the high-tension glaucomas. Amer J Ophthalmol. 1984;97 : 730–737.
7. Lestak J, Nutterova E, Bartosova L, Rozsival P. The visual field in normal tension glaucoma and hypertension glaucoma. IJSR. 2014;3 : 49–51.
8. Rojas B, Gallego BI, Ramírez AI. et al. Microglia in mouse retina contralateral to experimental glaucoma exhibit multiple signs of activation in all retinal layers. J Neuroinflammation. 2014;11 : 133.doi:10.1186/1742-2094-11-133.
9. Glovinsky Y, Quigley HA, Dunkelberger GR. Retinal ganglion cell loss is size dependent in experimental glaucoma. Invest Ophthalmol Vis Sci.1991;32 : 484–491.
10. Morgan JE, Uchida H, Caprioli J. Retinal ganglion cell death in experimental glaucoma. Br J Ophthalmol. 2000;84 : 303–310.
11. Naskar R, Wissing M, Thanos S. Detection of Early Neuron Degeneration and Accompanying Microglial Responses in the Retina of a Rat Model of Glaucoma. Invest Ophthalmol Vis Sci. 2002;43 : 2962–2968.
12. Shou T, Liu J, Wang W, Zhou Y, Zhao K. Differential dendritic shrinkage of alpha and beta retinal ganglion cells in cats with chronic glaucoma. Invest Ophthalmol Vis Sci. 2003;44 : 3005–3010.
13. Smith EL, Chino YM, Harwerth RS, Ridder WH, Crawford MLJ, DeSantis L. Retinal inputs to the monkey’s lateral geniculate nucleus in experimental glaucoma. Clin Vision Sci. 1993;8 : 113–139.
14. Chaturvedi N, Hedley–Whyte ET, Dreyer EB. Lateral geniculate nucleus in glaucoma. Am J Ophthalmol. 1993;116 : 182–188.
15. Vickers JC, Hof RP, Schumer RA, Wang RF, Podos SM, Morrison JH. Magnocellular and parvocellar visual pathways are both affected in a macaque model of glaucoma. Aust N Z J Ophthalmol. 1997;25 : 239–243.
16. Quigley HA, Sanchez RM, Dunkelberger GR, L’Hernault NL, Baginski TA. Chronic glaucoma selectively damages large optic nerve fibers. Invest Ophthalmol Vis Sci. 1987;28 : 913–920.
17. Quigley HA, Dunkelberger GR, Green WR. Retinal ganglion cell atrophy correlated with automated perimetry in human eyes with glaucoma. Am J Ophthalmol. 1989;107 : 453–464.
18. Keltner JL, Johnson ChA,; Quigg JM. et al. Confirmation of Visual Field Abnormalities in the Ocular Hypertension Treatment Study. Arch Ophthalmol. 2000;118 : 1187–1194.
19. Heijl A, Patella VM. The field analyser primer. Essential perimetry. Third edition. Carl Zeiss Meditec Inc. 2002. ISBN: 0-9721560-0-3., s. 26
20. Heijl A, Patella VM, Bengtsson B. The field analyser primer. Essential perimetry. Fourth edition. Carl Zeiss Meditec Inc. 2012. ISBN: 0-9884795-0-8, s. 29.
21. Skalicky SE. Ocular and visual physiology. Clinical application. Springer Science+Business Media Singapore Pte Ltd., Australia 2016, Chapter 8, p. 123.
22. Kerrigan-Baumrind LA, Quigley HA, Pease ME, Kerrigan DF, Mitchell RS. Number of ganglion cells in glaucoma eyes compared with threshold visual field tests in the same persons. Invest Ophthalmol Vis Sci. 2000;41 : 741–748.
23. Klamann MK, Grünert A, Maier AK, Gonnermann J, Joussen AM, Huber KK. Comparison of functional and morphological diagnostics in glaucoma patients and healthy subjects. Ophthalmic Res. 2013;49 : 192–198.
24. Zakova M, Lestak J, Fus M, Maresova K. OCT Angiography and Visual Field in Hypertensive and Normotensive Glaucoma. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2020;164 – in press
25. Lešták J, Pitrová Š. „Ganglion cells komplex“ a vrstva nervových vláken u hypertenzních a normotenzních glaukomů. [Ganglion Cells Complex“ and Retinal Nerve Fiber Layer in Hypertensive and Normal-Tension Glaucoma]. Cesk Slov Oftalmol. 2016;72 : 199–203. Czech.
26. Na JH, Lee K, Lee JR, Baek S, Yoo SJ, Kook MS. Detection of macular ganglion cell loss in preperimetric glaucoma patients with localized retinal nerve fibre defects by spectral-domain optical coherence tomography. Clin Exp Ophthalmol. 2013;41 : 870–880.
27. Ma ZW, Qiu WH, Zhou DN, Yang WH, Pan XF, Chen H. Changes in vessel density of the patients with narrow antenior chamber after an acute intraocular pressure elevation observed by OCT angiography. BMC Ophthalmol. 2019;19 : 132. doi: 10.1186/s12886-019-1146-6
28. In JH, Lee SY, Cho SH, Hong YJ. Peripapillary Vessel Density Reversal after Trabeculectomy in Glaucoma. J Ophthalmol. 2018;26 : 8909714. doi: 10.1155/2018/8909714. eCollection 2018.
29. Sommer A, Katz J, Quigley HA, Miller NR, Robin AL, Richter RC, Witt KA.Clinically detectable nerve fiber atrophy precedes the onset of glaucomatous field loss. Arch Ophthalmol. 1991;109 : 77–83.
30. Bosworth CF, Sample PA, Weinreb RN. Motion perception thresholds in areas of glaucomatous visual field loss. Vision Res. 1997;37 : 355–364.
31. Johnson CA, Samuels SJ. Screening for glaucomatous visual field loss with frequency-doubling perimetry.Invest Ophthalmol Vis Sci. 1997;38 : 413–425.
32. Arend KO, Plange N. Diagnostic approaches for early detection of glaucoma progression. Klin Monbl Augenheilkd. 2006;223 : 194–216.
33. Ferreras A, Polo V, Larrosa JM. et al. Can frequency-doubling technology and short-wavelength automated perimetries detect visual field defects before standard automated perimetry in patients with preperimetric glaucoma? J Glaucoma. 2007;16 : 372–383.
34. Nomoto H, Matsumoto C, Takada S. et al. Detectability of glaucomatous changes using SAP, FDT, flicker perimetry, and OCT. J Glaucoma. 2009;18 : 165–171.
35. Horn FK, Jonas JB, Korth M, Jünemann A, Gründler A.The full-field flicker test in early diagnosis of chronic open-angle glaucoma. Am J Ophthalmol. 1997;123 : 313–319.
36. Horn FK, Tornow RP, Jünemann AG, Laemmer R, Kremers J. Perimetric measurements with flicker-defined form stimulation in comparison with conventional perimetry and retinal nerve fiber measurements. Invest Ophthalmol Vis Sci. 2014;55 : 2317–2323.
37. Lešták J, Fůs M. Neuroprotection in glaucoma-electrophysiology. Exp Ther Med. 2020;19 : 2401–2405.
Štítky
Oftalmológia
Článok vyšiel v časopiseČeská a slovenská oftalmologie
Najčítanejšie tento týždeň
2021 Číslo 1- Dlouhodobé výsledky lokální léčby cyklosporinem A u těžkého syndromu suchého oka s 10letou dobou sledování
- Cyklosporin A v léčbě suchého oka − systematický přehled a metaanalýza
- Účinnost a bezpečnost 0,1% kationtové emulze cyklosporinu A v léčbě těžkého syndromu suchého oka − multicentrická randomizovaná studie
- Pomocné látky v roztoku latanoprostu bez konzervačních látek vyvolávají zánětlivou odpověď a cytotoxicitu u imortalizovaných lidských HCE-2 epitelových buněk rohovky
- Konzervační látka polyquaternium-1 zvyšuje cytotoxicitu a zánět spojený s NF-kappaB u epitelových buněk lidské rohovky
-
Všetky články tohto čísla
-
TERAPIE UVEÁLNÍHO MELANOMU
PŘEHLED -
NAŠE ZKUŠENOSTI S POUŽITÍM FAKOEMULZIFIKAČNÍ KONCOVKY
ACTIVE SENTRY A CENTURION OZIL - VYŠETŘENÍ ZORNÉHO POLE U HYPERTENZNÍCH GLAUKOMŮ
- VLIV LÉČBY NA POVRCH OKA U PACIENTŮ S JEDNOSTRANNÝM DĚTSKÝM GLAUKOMEM
- STAVY NAPODOBUJÍCÍ PACHYCHOROIDNÍ CHOROBY SÍTNICE – SOUBOR KAZUISTIK
- BLOW-IN FRAKTURA STROPU OČNICE KAZUISTIKA
-
TERAPIE UVEÁLNÍHO MELANOMU
- Česká a slovenská oftalmologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
TERAPIE UVEÁLNÍHO MELANOMU
PŘEHLED - BLOW-IN FRAKTURA STROPU OČNICE KAZUISTIKA
- STAVY NAPODOBUJÍCÍ PACHYCHOROIDNÍ CHOROBY SÍTNICE – SOUBOR KAZUISTIK
- VYŠETŘENÍ ZORNÉHO POLE U HYPERTENZNÍCH GLAUKOMŮ
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy