-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Orální komplikace po alogenní transplantaci kostní dřeně
Oral Compliacation after Bone Marrow Transplantation
The bone marrow transplantation is a curative method in leukemia, lymphomas, immunodeficient states and solid tumors. Graft versus host disease (GVHD) is a significant complication in patients after bone marrow transplantion, most frequently affected of intestine, liver, skin and oral mucosa. Oral mucosa damage is presented by chronic and acute form of GVHD. The acute form is presented by painful ulcers, lichenoid lesions affecting practically whole oral cavity, while the chronic GVHD is compared to autoimmune diseases such as Sjögren syndrome. GVHD is a major complication of bone marrow transplantation with risk to health a therapeutic result. The treatment is long-term and involve interdisciplinary cooperation.
Key words:
graft versus host disease – bone marrow transplantation – oral mucositis
Autori: R. Pink 1; Z. Kadlec 3; J. Pazdera 1; P. Michl 1; P. Tvrdý 1; V. Zbořil 1; L. Rajda 2; J. Vondráková 2; E. Faber 2; K. Indrák 2
Pôsobisko autorov: Klinika ústní, čelistní a obličejové chirurgie FN, Olomouc 1; Hematoonkologická klinika FN, Olomouc 2; Klinika zubního lékařství LF UP a FN, Olomouc 3
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 111, 2011, 3, s. 71-77
Kategória: Přehledový článek
Súhrn
Transplantace kostní dřeně je léčebnou metodou u leukemií, lymfomů, imunodeficitních stavů a solidních nádorů. Reakce štěpu proti hostiteli (GVHD) představuje závažnou komplikaci alogenní transplantace kostní dřeně, nejčastěji s postižením střev, jater, kůže a sliznice. Postižení orální sliznice může být přítomno u chronické i akutní formy GVHD. Akutní orální GVHD se vyznačuje zejména bolestivými ulceracemi, lichenoidními lézemi, které postihují prakticky celou dutinu ústní, zatímco chronická forma orální GVHD je přirovnávána k symptomům autoimunitních onemocnění, jako jsou progresivní systémová skleróza nebo Sjögrenův syndrom. GVHD je závažná komplikace alogenní transplantace kostní dřeně, která ohrožuje výsledek léčby a život pacienta. Léčba je dlouhodobá a vyžaduje mezioborovou spolupráci.
Klíčová slova:
reakce štěpu proti hostiteli – transplantace kostní dřeně – orální mukozitidaÚvod
Transplantace kostní dřeně je dnes často užívanou metodou v léčbě leukemií, lymfomů, imunodeficitních stavů a solidních nádorů. Historie této léčebné metody je relativně krátká. Počátkem 50. let se začalo využívat syngenních štěpů kostní dřeně v léčbě imunodeficitních stavů u dětí, které určily směr této léčby. Velice důležitá byla identifikace tkáňových znaků, HLA antigenů (Human Leukocyte Antigens – antigeny lidských bílých krvinek) a rozpoznání histokompatibilního komplexu (MHC – major histocompatibility complex). Právě výsledky výzkumu imunitního systému na molekulární úrovni zvýšily úspěšnost transplantace kostní dřeně a minimalizovaly peritransplantační komplikace, jakými jsou infekce či právě GVHD.
Mechanismus účinku této léčebné metody spočívá v obnově krvetvorby transplantací kostní dřeně či periferních kmenových buněk. Transplantaci předchází agresivní chemoterapie, jejímž cílem je eliminace nádorového onemocnění. Krvetvorné buňky je možno získat od jiného zdravého dárce (transplantace alogenní), nebo od samotného pacienta (transplantace autologní). Přes jistou vnější podobnost existuje mezi oběma způsoby transplantace řada zásadních rozdílů. Nejedná se jen o technické provedení, ale i o odlišný terapeutický efekt a rozdílné působení na imunitní systém příjemce transplantátu. Proto oba způsoby transplantace mají své specifické indikace.
Autologní transplantace kmenových buněk představuje jakousi zajišťovací terapii po vysokodávkované chemoterapii. Principem je konzervace vlastní kostní dřeně mimo organismus po dobu aplikace velmi toxických dávek chemoterapie, která má eliminovat nádorové onemocnění. Podmínkou je, aby pacient před výkonem měl vlastní zdravé kmenové buňky. Sama autologní transplantace nemůže zabránit recidivě, pokud předchozí chemoterapie dostatečně neeliminovala nádorové onemocnění [6].
Alogenní transplantace je přenos kostní dřeně od jiného jedince. Proti autologní transplantaci má daleko širší účinky. Kostní dřeň od zdravého dárce slouží nejen jako náhrada nemocné krvetvorby, ale může za určitých okolností také navodit protinádorový efekt. Ten souvisí s reakcí leukocytů dárce proti zhoubnému onemocnění příjemce (tzv. reakce štěpu proti leukemii či nádoru). Základní podmínkou alogenní transplantace je dostupnost vhodného dárce, jehož imunitní buňky mají určitou identitu tkáňových znaků (HLA antigenů) s kostní dření příjemce [10].
HLA antigeny jsou kódovány v MHC (hlavní histokompatibilní komplex), který je lokalizován na krátkém raménku šestého chromozomu. Systém tkáňových znaků tvoří takzvaný tkáňový (HLA) typ. Modelově jej můžeme popsat jako soubor řady písmen „znaků“, které dohromady tvoří unikátní „popis těla“. Každé z písmen je zastoupeno ve dvou exemplářích (jeden dědíme od matky, druhý od otce). Od rodičů na potomky se příslušná polovina znaků předává v kompletní sadě (haplotypu). Každý HLA znak má řadu variant, které se označují čísly (např. A 3, 23, B 55, 61, C 3, 3, DR 4, 13, DG 3, 6). Z hlediska transplantace se v současné době považují za nejdůležitější takzvané HLA antigeny I. třídy A, B, C a antigeny II. třídy DR a DQ. Antigeny I. třídy jsou vyjádřeny na všech jaderných buňkách těla a umožňují imunitnímu systému rozeznat buňky tělu vlastní či nikoliv. Antigeny II. třídy se nacházejí na antigen prezentujících buňkách (APCs) a efektorových buňkách. Pomáhají regulovat imunitní reakci pomocí rozpoznání tělu cizích buněk aktivací právě antigen prezentujících buněk (APCs) a efektorových buněk. Existuje také tzv. malý histokompatibilní komplex (minor histocompatibility complex), který může při transplantaci doplňovat úlohu MHC.
Reakce štěpu proti hostiteli (graf versus host disease – GVHD)
GVHD vzniká pomnožením dárcovských T lymfocytů v organismu hostitele a jejich reakcí proti tkáním příjemce. Při GVHD jsou nejčastěji postižena střeva, játra, kůže a sliznice. Rozlišujeme akutní a chronickou formu GVHD v závislosti na časovém průběhu. Reakce štěpu proti hostiteli může dosáhnout stadia neslučitelného se životem. Tomu lze předejít právě vhodným výběrem dárce (nejčastěji pokrevný příbuzný) a podáváním imunosupresiv, v nynější době nejčastěji cyklosporinu A. V počátcích alogenní transplantace byla preferována transplantace syngenní (mezi jednovaječnými dvojčaty), právě pro imunologickou identitu. Postupně bylo zaznamenáno více relapsů základního onemocnění. Důvodem je právě shoda genetického materiálu a tedy tendence k opakovanému výskytu malignity. Při transplantaci alogenní dřeně od sourozence je výskyt GVHD vyšší, klesá však výskyt relapsů základního onemocnění. Je zřejmé, že oba jevy spolu souvisejí a do jisté míry je GVHD žádaná právě pro protinádorový efekt (reakce lymfocytů dárce proti „zbytkům“ příjemcova nádoru). Proto tento jev označujeme také jako reakci štěpu proti leukemii (graft versus leukemia GVL) [20].
Obr. 1. Změny na patrové sliznici při orálních projevech GVHD 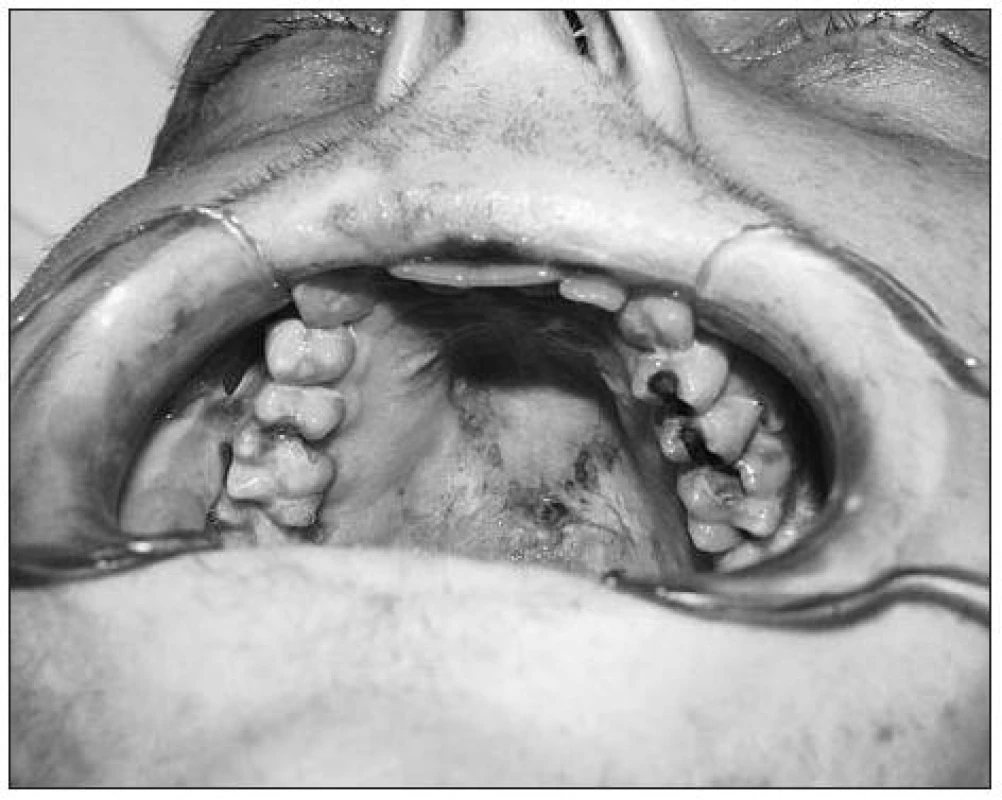
Billingham [3] popisuje tři hlavní podmínky pro vznik GVHD:
- Štěp musí obsahovat imunologicky kompetentní buňky (takzvané T lymfocyty).
- Příjemce musí mít buněčné antigeny dostatečně jiné od dárcových, tak aby byla dárcova tkáň rozpoznána jako „cizí“. To obvykle splňují malé histokompatibilní antigeny.
- Příjemce nesmí odhojit štěp kostní dřeně např. kvůli imunosupresi nebo chybě v jejím rozpoznání.
Akutní GVHD
Akutní GVHD se vyvíjí do 100. dne po alogenní transplantaci kostní dřeně přibližně u 18–70 % pacientů. Převažují klinické projevy na kůži, v játrech a gastrointestinálním traktu. Predisponujícími faktory jsou neúplná shoda v HLA systémech dárce a příjemce, rozdílná pohlaví nebo vysoký dárce a příjemce, případně vícečetná těhotenství dárkyně. Patogeneticky má akutní GVHD dvě fáze: aferentní, kdy jsou exprimovány a aktivovány buňky poškozující tkáně, a fázi eferentní, kdy dochází k poškození orgánů. V aferentní fázi dochází k aktivaci dárcovských T lymfocytů, které v počátku rozeznají antigeny na hostitelských antigenech prezentujících buňkách. Postupně produkují IL-1, nutný k aktivaci T lymfocytů. T lymfocyty produkují IL-2 s následnou aktivací dalších T lymfocytů. Mechanismus eferentní fáze akutní GVHD není zcela dobře znám [17], poslední práce ukazují, že hlavní úlohu zde hrají zánětlivé cytokiny a jejich destrukční vliv na tkáně [1].
Obecné klinické příznaky GVHD
Primárními orgány, které jsou akutní GVHD postiženy, jsou kůže, játra a gastrointestinální trakt. K objektivnímu vyhodnocení postižení těchto orgánů využíváme čtyřstupňovou klasifikaci, přičemž I. až II. stupeň je spojen jen s nízkou morbiditou či mortalitou, ale naopak u IV. stupně je zaznamenána až 100% mortalita.
Při postižení kůže dochází nejprve k tvorbě morbiliformního exantému, který predilekčně postihuje dlaně a plosky, někdy dochází k erytrodermii nebo tvorbě kožních bul. Výjimečně dochází až k toxické epidermální nekrolýze.
Postižení gastrointestinálního traktu se klinicky projevuje zvracením, nauzeou, krvavými průjmy a v krajním případě i paralytickým ileem. Při postižení jater jsou zvýšené hladiny ALP, aminotransferáz a bilirubinu. Někdy též dochází k jaternímu selhání s poruchou hemokoagulace a ascitem. Tyto příznaky jsou však často velmi těžko odlišitelné od venookluzivní choroby, která se také může vyskytnout v období mezi 10.–24. dnem po transplantaci [18].
Orální projevy GVHD
Orální komplikace se dle různých literárních pramenů vyskytují asi u 60–70 % pacientů trpících GVHD III.–IV. stupně. Orální postižení se vyznačuje zejména bolestivými ulceracemi, lichenoidními lézemi, které postihují prakticky celou dutinu ústní [5]. Diferenciálně diagnosticky je třeba odlišit herpetickou gingivostomatitis, zvláště u pacientů s pozitivními HSV protilátkami a postchemoterapeutickou orální mukozitidou (tzv. neutropenia-associated mucositis), která se obyčejně projeví mezi 7.–21. dnem po transplantaci. Pacienti s pozitivním titrem protilátek proti HSV musí být před transplantací zajištěni antivirotickou léčbou, neboť u nich často dochází k reaktivaci viru. Postchemoterapeutická orální mukozitida vzniká následkem snížené reparace epiteliálních buněk, která vede k atrofii sliznice a tím možnému propuknutí infekce (lokálního či systémového charakteru) v důsledku neutropenie. Jakmile se hladina neutrofilů v krvi a orální tekutině dostane na fyziologické hodnoty, symptomy postchemoterapeutické orální mukozitidy postupně odeznívají [12].
Hlavními rozdíly mezi postchemoterapeutickou orální mukozitidou a akutní orální GVHD jsou:
- Zhoršení orální mukozitidy po 21. dnu od transplantace, prakticky v době přihojení štěpu.
- Rozvíjející se xerostomie a bolestivost.
- Začátek příznaků orální mukozitidy po 21. dnu alogenní transplantace.
U obou orálních mukozitid se slizniční léze nejčastěji vyskytují na funkční části orální sliznice (hraně a spodině jazyka, spodině dutiny ústní a bukální sliznici), avšak u orální mukozitidy spojené s GVHD je navíc při mastikaci zraňována sliznice (hřbet jazyka a tvrdé patro) [8].
Kožní biopsie při akutní GVHD prokazuje vakuolizaci bazálních buněk, spongiózu, dyskeratózu až totální ztrátu epidermis, často doprovázenou lymfocytárním infiltrátem. Diagnostická excize z dutiny ústní není u akutní GVHD standardním postupem, neboť biopsie by u těchto pacientů mohla vyvolat krvácení s následnou infekcí sliznice, popřípadě vznik bakteriemie či sepse [2].
Profylaxe a léčba akutní GVHD
Ačkoliv jako dominantní faktor vzniku akutní GVHD se zdá být HLA kompatibilita, je ještě celá řada faktorů, které mají na jejím vzniku pozitivní či negativní účinek. Jako profylaxe má pozitivní vliv standardní dekontaminace střeva nebo využití laminárních boxů. Dalším ochranným faktorem je celková imunosuprese zajištěná hlavně metotrexátem (MTX), cyklosporinem a kortikoidy. Avšak kombinace MTX a cyklosporinu zvyšuje riziko vzniku orální mukozitidy, vnímané pacientem bolestivě, což také znamená zvýšené nároky na parenterální výživu [15]. K profylaxi GVHD se používají dle posledních léčebných protokolů monoklonální protilátky proti IL-1 a IL-2 receptorům či tacrolimus (také FK-506 nebo Fujimycin, což je imunosupresivum využívané hlavně po alogenních transplantacích k potlačení imunitního systému hostitele), který teoreticky vykazuje menší jaterní poškození než cyklosporin. Pro profylaxi akutní GVHD by mohlo být důležité snížení obsahu T buněk v dárcovském štěpu, což by však na druhé straně vedlo k možnému relapsu leukemie, lymfoproliferativnímu onemocnění nebo až k odhojení štěpu. Při rezistenci v léčbě GVHD na kortikoidy se nově používá psoralen a UV-A záření (PUVA) a protilátky proti TNF alfa.
Léčba akutní orální GVHD, která je následkem systémové GVHD, spočívá hlavně v dostatečném tlumení bolesti a úpravě orálního diskomfortu. V lokální terapii se využívají hlavně slizniční anestetika, popřípadě systémově aplikované opiáty. Ojediněle se také využívá místní aplikace steroidů ve formě past a gelů (triamcinolon, clobetasol). K léčbě xerostomie, v důsledku postradiačního či medikamentózního poškození slinných žláz, lze využít substituční přípravky sliny (gel clair) [11].
Chronická GVHD
Chronická GVHD je definována vznikem příznaků za 100 dní po transplantaci kostní dřeně, ať už de novo, nebo přechodem z akutní GVHD. Predisponujícími faktory jsou vyšší věk pacienta, předchozí GVHD či HLA inkompatibilita. Prevalence chronické GVHD je od 33 % (u příbuzenské transplantace) až po 64 % (u nepříbuzenské transplantace). Obecně lze chronickou GVHD rozdělit na limitovanou a extenzivní formu, dle rozsahu poškození orgánů [16].
Obecné klinické příznaky, orální postižení
Orální postižení u chronické GVHD může být primárním a dokonce i zcela jediným znakem. Rozsah postižení sahá od erytému, přes slizniční atrofii až po lichenoidní změny, které jsou pak pozitivním prognostickým znakem. Postižena může být jak sliznice funkční, tak i mastikační. Lichenoidní změny nejvíce připomínají orální lichen planus a jsou často doprovázeny bolestivostí, xerostomií, jejichž důsledkem je pak nedostatečná ústní hygiena s omezeným příjmem potravy. Xerostomie vzniká až u 50 % pacientů s následným zmnožením bakterií Streptococcus mutans či laktobacilem s dopadem na zvýšený výskyt zubního kazu. Důležitá je diferenciální diagnostika orálních projevů HSV či CMV, hlavně u pozitivní sérologie těchto virů [13].
U některých pacientů byla ve slině zjištěna nižší hladina IgA a naopak vzestup IgG. Snížení IgA může mít pak za následek vyšší riziko sinobronchiálních infekcí. Ve slině byla také zjištěna nižší hladina sodíku v důsledku probíhající chronické GVHD, u některých pacientů přetrvávající i jeden rok po transplantaci. To potvrzuje, že dochází k trvalejšímu poškození slinných žláz v průběhu transplantace. Tato nižší hladina sodíku byla v některých studiích popsána jako signalizující faktor pro vznik chronické GVHD.
Pacienti po alogenní transplantaci často trpí komplikacemi, jako je herpetická stomatitida, cytomegalovirová infekce či EBV infekce s následným vznikem vlasaté leukoplakie, a jiných prekanceróz s možným potenciálním rizikem vzniku maligního nádoru.
U některých pacientů s projevy chronické orální GVHD byly pozorovány pyogenní granulomy a bradavičnaté xantomy. Pyogenní granulomy pravděpodobně vznikají ve spojitosti s léčbou cyklosporinem, který má významný vliv na homeostázu pojivové tkáně, která je při chronické GVHD porušena, dochází k její větší obměně a tím eventuálnímu vzniku těchto granulomů. Vznik xantomů je naopak vysvětlován jako výsledek opakovaných poranění v dutině ústní [7].
Asi u 73 % pacientů byla pozorována fibróza měkkých tkání s následným omezeným otevíráním dutiny ústní, a to zejména u nemocných (cca u 26 %), u nichž se chronická GVHD projevila jako sklerodermatózní forma postižení. U některých pacientů došlo k omezení pohyblivosti jazyka s následnou dyslálií a nedostatečným příjmem potravy.
U pacientů s chronickou GVHD je v histopatologickém obrazu kůže patrna hyperkeratóza, hypergranulóza, akantóza, apoptóza s lymfocytárním infiltrátem. Slizniční změny představují atrofii epitelu, hydropickou degeneraci bazálních buněk a lymfocytární infiltrát. Tento obraz koreluje s obrazem tzv. lichenoidní reakce. Lymfocytární ložiska, tak jak jsou popisována u Sjögrenova syndromu, u chronické GVHD nenalezneme. Je zde však možno pozorovat lymfocytární infiltrát jako takový. Tyto změny však nemusí být zcela specifické, můžeme je také pozorovat u slinných žláz s obliterovanými vývody [9].
Léčba chronické orální GVHD
I přes všechna profylaktická opatření, ke kterým patří např. úplná shoda v HLA antigenech, dochází ke vzniku chronické GVHD asi v 50 % případů.
Prvotní léčba zpravidla zahrnuje celkové podání kortikosteroidů, při negativní odpovědi se podává azathioprin či cyklosporin. Při nedostatečné počáteční imunosupresivní terapii se jako metoda volby zvažuje podání thalidomidu, PUVA terapie, tacrolimus, nízkodávkovaná radioterapie, či extrakorporální fotoferéza. V mnoha případech ani systémová imunosupresivní terapie neeliminuje těžkou slizniční atrofii a ulcerativní léze v dutině ústní, i když v mnoha případech alespoň minimalizuje doprovodné příznaky [19].
Léčba je symptomatická a spočívá ve zmírnění bolesti, xerostomie a udržení orálního zdraví. Využívají se lokální kortikosteroidy – ať už ve formě pasty (Dexaltin), či ve formě roztoku: Betamethason či Dexamethason. Ojediněle se také užívají intravenózní injekce Triamcinolonu, pokud se jedná o větší slizniční léze. Pokud pacient nereaguje ani na topické či systémové steroidy, používá se thalidomid.
V léčbě bolesti využíváme vedle lokální terapie (2% roztok lidokainu) i terapii celkovou, včetně opiátů.
Při mírné xerostomii se doporučují umělé náhražky sliny (gel clair, saliva natura) a fluoridových roztoků, které snižují vznik zubního kazu. Podání cholinergního pilokarpinu má jen malý účinek s celou řadou nežádoucích účinků (pocení, gastrointestinální diskomfort, či posturální hypotenze). Udržení dobré ústní hygieny je základním předpokladem pro snížení infekčních komplikací, které doprovázejí chronickou GVHD. Proto jsou velmi důležité výplachy antiseptickými roztoky, pokud je pacient toleruje [14].
Závěr
V současné době zatím neexistuje objektivní hledisko pro posouzení závažnosti chronické orální GVHD. Orální změny nemusí být vždy přítomny a jejich rozsah nemusí ve všech případech zcela odpovídat závažnosti systémové GVHD. Systémová imunosupresivní léčba navíc zkresluje účinnost lokálně používaných preparátů. Chronická orální GVHD je stále spojena s poměrně vysokou mortalitou. Její profylaxe a léčení proto zůstává předmětem zájmu klinických a výzkumných týmů.
MUDr. Richard Pink, Ph.D.
Klinika ústní, čelistní a obličejové chirurgie FN
I. P. Pavlova 6
775 00 Olomouc
e-mail: richard.pink@seznam.cz
Zdroje
1. Antin, J. H., Ferrara, J. L.: Cytokine dysregulation and acute graft-versus-host disease. Blood, 80, 1992, s. 2964–2968.
2. Bauer, D. J., Hood, A. F., Horn, T. D.: Histologic comparison of autologous graft-versus-host reaction and cutaneous eruption of lymphocyte recovery. Arch. Dermatol., roč. 129, 1993, č. 7, s. 855–858.
3. Billingham, R. E.: The biology of graft-versus-host reactions. Harvey Lecture, roč. 62 (1966–1967), s. 21–78.
4. Clark, J. G., Schwartz, D. A., Flournoy, N., Sullivan, K. M., Crawford, S. W., Thomas, E. D.: Risk factors for airflow obstruction in recipient sof bone marrow transplants. Ann. Intern. Med., roč. 107, 1987, s. 648–656.
5. Dreizen, S., McCredie, K. B., Dickie, K. A., Zander, A. R., Peters, L. J.: Oral complications of bone marrow transplantation in adults with acute leukemia. Postgrad. Med., roč. 66, 1979, s. 187–196.
6. Gorin, N. C., Aegerter, P., Auvert, B., Meloni, G., Goldstone, A. H., Burnett, A., et al.: Autologous bone marrow transplantation for acute myelocytic leukemia in first remision: a European survey of the role of marrow purging. Blood, roč. 75, 1990, s. 1606–1614.
7. Heimdahl, A., Johson, G., Danielsson, K. H., Lonnquist, B., Sundelin, P., Ringden, O.: Oral condition of patients with leukemia and severe aplastic anemia. Oral Surg. Oral Med. Oral Pathol., roč. 60, 1985, s. 498–504.
8. Kolbinson, D. K., Schubert, M. M., Flournoy, N., Truelove, E. L.: Early oral ganges following bone-marrow transplantation. Oral Surg. Oral Med. Oral Pathol., roč. 66, 1988, s. 130–138.
9. Lawley, T. J., Peck, G. L., Moutsopoulos, H. M., Gratwohl., A. A., Deisseroth, A. B.: Sclerodermia, Sjogren’s-like syndrome, and chronic graft-versus-host disease. Ann. Intern. Med., roč. 87, 1977, s. 707–709.
10. McCullough, J., Hansen, J., Perkins, H., Stroncek, D., Bartsch, G.: The National Marrow Donor Program: how it works, accomplishments to date. Oncology, 1989, 3, s. 63–68.
11. Nash, R. A., Etzioni, R., Storb, R., Furlong, T., Gooley, T., Anasetti, C.: Tacrolimus (FK 506) alone or in combination with methotrexate or methylprednisolon for the prevention of acute graft-versus-host disease after marrow transplantation from HLA-matched siblings: a single center study. Blood, roč. 85, 1995, s. 3746–3753.
12. Saral, R., Burns, W. H., Laskin, O. L., Santos, G. W., Lietman, P. S.: A randomized double-blind controlled trial in bone-marrow recipients. N. Engl. J. Med., roč. 305, 1981, s. 63–67.
13. Schubert, M. M., Sullivan, K. M., Morton, T. H., Izutsu, K. T., Peterson, D. E., Flournoy, N., et al.: Oral manifestation of chronic graft-versus-host disease. Arch. Intern. Med., roč. 144, 1984, s. 1591–1595.
14. Singhal, S., Mehta, J., Rattenbury, H., Treleaven, J., Powles, R.: Oral pilocarpine hydrochlorid for the treatment of refractory xerostomia associated with chronic graft-versus-host disease. Blood, roč. 85, 1995, s. 1147–1148.
15. Storb, R., Deeg, H. J., Pepe, M., Appelbaum, F., Anasetti, C., Beatty, P.: Methotrexate et cyclosporin versus cyclosporine alone for prophylaxis of graft-versus-host disease in patients given HLA-identical marrow grafts for leukemia: long-term follow-up of a controlled trial. Blood, roč. 73, 1989, s. 1729–1734.
16. Sullivan, K. M., Shulman, H. M., Storb, R., Weiden, P. L., McDonald, R. P., Whiterspoon, R. P., et al.: Chronic graft-versus-host disease in 52 patients: adverse natural course and succesful treatment with combination immunosuppression. Blood, roč. 57, 1981, s. 267–276.
17. Unanue, E. R., Allen, P. M.: The basis for the immunoregulatory role of macrophages and other accessory cells. Science, roč. 236, 1987, s. 551–557.
18. Vogelsang, G. B., Hess, A. D., Santos, G. W.: Acute graft-versus-host disease: clinical characteristic in the cyclosporine era. Medicine (Baltimore), roč. 67, 1988, č. 3, s. 163–174.
19. Volc-Platzer, B., Honigsmann, H., Hinterberger, W., Wollf, K.: Photochemotherapy improves chronic cutaneous, graft-versus-host disease. J. Am. Acad. Dermatol., roč. 23, 1990, s. 220–228.
20. Weiden, P. L., Sullivan, K. M., Flournoy, N., Storb, R., Thomas, E. D.: Seattle Marrow Transplant Team. Antileukemic effect of chronic graft-versus-host disease contribution to improved survival after allogeneic marrow transplantation. N. Engl. J. Med., roč. 304, 1981, s. 1529–1533.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2011 Číslo 3
-
Všetky články tohto čísla
- Opodstatnenosť použitia formokrezolu v detskom zubnom lekárstve História a súčasnosť známeho ošetrovacieho postupu v detskej endodoncii
- Poextrakční zánět zubního lůžka a délka hojení závislá na druhu léčby - První část: klasická léčba
- Porovnávání záznamu stavu chrupu třemi metodami – elektronická zdravotní dokumentace versus ruční zápis do WHO karty
- Frenulektomie v léčbě diastematu
- Bioechemická studie interakce dentálních implantátů a kostní tkáně (anotace doktorské disertační práce)
- Orální komplikace po alogenní transplantaci kostní dřeně
- Mezinárodní ocenění prof. MUDr. Emila Jiravy, DrSc.
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Poextrakční zánět zubního lůžka a délka hojení závislá na druhu léčby - První část: klasická léčba
- Frenulektomie v léčbě diastematu
- Orální komplikace po alogenní transplantaci kostní dřeně
- Opodstatnenosť použitia formokrezolu v detskom zubnom lekárstve História a súčasnosť známeho ošetrovacieho postupu v detskej endodoncii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



