-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Adenoidně cystický karcinom slinných žláz.
Soubor 27 pacientů
Adenoid Cystic Carcinoma of Salivary Glands. Case Series of 27 Patients
Aim of the study:
Adenoid cystic carcinoma (AdCC) is the second most common salivary gland cancer. This malignant tumor is characterized by its slow growth and in spite of the fact that it has a histological low - grade appearance, a prolonged clinical course usually lasting for years, repeated recurrences, development of distant metastases and high mortality rate are typical signs. New facts of its biological behavior as well as new fusion oncogenes probably responsible for its carcinogenesis were described in the last few years. In light of these facts, the authors evaluate their own case series of patients suffering from AdCC in this manuscript.Methods:
The retrospective case series included 27 patients with AdCC, who were treated at the University Hospital in Pilsen in the last 30 years (01/1986–01/2016). Clinical and demographic para-meters were identified and evaluated. Detection of the 1p36 deletion and the tumor-specific MYB–NFIB fusion oncogene by fluorescence in situ hybridization were performed.Results:
The incidence of AdCC in minor salivary glands, submandibular gland, parotid gland and sublingual gland was 41%, 26%, 22 % and 11% respectively. The following staging was observed: the 1st stage in 26%, the 2nd stage in 18%, the 3rd stage in 26% and the 4th stage in 30% of cases. Metastases to regional lymph nodes were diagnosed in 26% and distant metastases in 30% of patients (55% to lung, 27% to liver, 9% to bones and 9% of peritoneal metastases). The average follow-up was 76.4 ± 67.0 months (range 7–287 months). An outcome of the treatment during follow-up was as follows: 59% of patients were with no evidence of the disease, 22% of patients died because of the disease and 19% of patients were alive with a recurrence or metastases of AdCC. The MYB-NFIB fusion transcript was detected in 79% of cases (19/24) and the 1p36 deletion in 13% of cases (3/23).Conclusion:
The AdCC of salivary glands shows a greater tendency to development of regional lymph node metastases than previously thought. The MYB-NFIB gene fusion is the major tumor-specific oncogenic event in AdCC with high detection rate. The MYB-NFIB fusion oncogene could currently only be used as a potential diagnostic tool in difficult histopathological cases of AdCC, especially in late distant metastases.Keywords:
adenoid cystic carcinoma – fusion oncogene – biomarker – MYB-NFIB
Autori: L. Hauer 1
; A. Skálová 2,3; P. Šteiner 3; D. Hrušák 1; P. Andrle 1; L. Hostička 1; O. Sebera 4
Pôsobisko autorov: Stomatologická klinika LF UK a FN, Plzeň 1; Šiklův ústav patologie LF UK a FN, Plzeň 2; Bioptická laboratoř s. r. o., Plzeň 3; ORL klinika LF UK a FN, Plzeň 4
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 116, 2016, 3, s. 57-65
Kategória: Původní práce – retrospektivní studie
Súhrn
Úvod a cíl práce:
Adenoidně cystický karcinom (AdCC) je druhým nejčastějším salivárním karcinomem. Tento maligní sialom je charakteristický svým pomalým růstem, a přestože se histologicky jedná o low-grade nádor, typickým jevem je častý prolongovaný klinický průběh trvající zpravidla roky, opakované recidivy, vznik především vzdálených metastáz a vysoká smrtnost onemocnění. V posledních několika letech byly zjištěny nejen nové skutečnosti ohledně biologického chování AdCC, ale byly objeveny i molekulárně genetické znaky, které jsou pravděpodobně zodpovědné za jeho kancerogenezi. S ohledem na tato fakta autoři v předkládané práci vyhodnocují vlastní soubor pacientů s AdCC.Metody:
Do retrospektivní klinické studie bylo zahrnuto 27 pacientů s AdCC, kteří byli léčeni ve FN v Plzni v posledních 30 letech (01/1986 až 01/2016). Byly sledovány klinické i demografické parametry. Soubor byl navíc vyšetřen pomocí fluorescenční in situ hybridizace na průkaz nádorově specifického MYB-NFIB fúzního onkogenu a na deleci 1p36.Výsledky:
AdCC vznikl ve 41 % v malých slinných žlázách, v 26 % ve žláze podčelistní, v 22 % v žláze příušní a v 11 % v žláze podjazykové. První stadium bylo zaznamenáno v 26 % případů, 2. stadium v 18 %, 3. stadium v 26 % a 4. stadium v 30 % případů. Metastázy v regionálních lymfatických uzlinách byly diagnostikovány u 26 %, vzdálené metastázy pak u 30 % pacientů (podle lokalizace – plíce 55 %, játra 27 %, kosti 9 %, peritoneum 9 %). Průměrný follow-up byl 76,4 ± 67,0 měsíců (v rozmezí 7–287 měsíců). Za dobu dispenzarizace bylo 59 % pacientů bez jakýchkoli příznaků choroby, 22 % zemřelo v důsledku AdCC a 19 % žilo s tímto onemocněním, ať již v podobě recidivy či metastáz. Fúzní onkogen MYB-NFIB byl prokázán v 79 % případů (19/24) a 1p36 delece pak ve 13 % případů (3/23).Závěr:
AdCC slinných žláz vykazuje vyšší tendenci k zakládání regionálních uzlinových metastáz, než se dříve soudilo. MYB-NFIB fúze je hlavní nádorově specifickou onkogenní událostí u AdCC s vysokou úspěšností detekce. Tento fúzní onkogen je možné v současné době potenciálně využít pouze jako pomocný diagnostický nástroj u histopatologicky sporných případů, především pak u pozdních vzdálených metastáz.Klíčová slova:
adenoidně cystický karcinom – fúzní onkogen – biomarker – MYB-NFIBÚVOD
Adenoidně cystický karcinom (AdCC) je bazaloidní nádor sestávající se z epiteliálních a myoepiteliálních buněk v různých morfologických konfiguracích, tvořících tubulární, kribriformní a solidní struktury [6]. Jedná se o nejčastější karcinom hlavy a krku s peri - a intraneurálním šířením (20–80 % případů), a to i diskontinuálním způsobem (skip lesions), což je příčinou zasahování tumoru za klinické a radiologické hranice s vysokým rizikem pro recidivy nádoru (i za předpokladu dosažení negativních resekčních okrajů) [4, 23]. Ve srovnání s ostatními salivárními karcinomy je u AdCC popsáno v lidském těle nejvíce možných lokalizací, kde může tento nádor primárně vznikat. Kromě slinných žláz postihuje i žlázu slznou, zvukovod a žlázy v horním aerodigestivním traktu (hrtan, nos a paranazální dutiny). Může ale vzácně vznikat i ve vzdálenějších orgánech, jako je trachea, bronchy, prsní žláza, prostata, kůže, ovaria, děložní hrdlo nebo Bartoliniho žlázy [19, 28]. Biologické chování a prognóza AdCC se v jednotlivých lokalizacích liší [19, 20, 22]. AdCC slinných žláz je charakteristický svým pomalým růstem, a přestože se histologicky jedná o low-grade nádor, typickým jevem je častý prolongovaný klinický průběh trvající zpravidla roky, opakované recidivy, vznik především vzdálených metastáz a vysoká smrtnost onemocnění.
Incidence salivárního AdCC se uvádí 3–4,5 případů/1 milion obyvatel/rok (pro západní Evropu se uvádí rozmezí 0,14–0,64/100 000 obyvatel/rok) [8, 9]. Představuje asi 1 % všech malignit hlavy a krku [9] a tvoří 10 % všech sialomů a 20 % všech salivárních karcinomů [28]. Je tak po mukoepidermoidním karcinomu druhou nejčastější salivární malignitou. AdCC je nejčastějším maligním sialomem žlázy podčelistní a pravděpodobně i jazyka [23]. Je také považován za nejčastější karcinom malých slinných žláz, kde představuje asi 30 % ze všech nádorů postihujících tyto žlázy (někdy se uvádí až na druhém místě po mukoepidermoidním karcinomu) [28]. Vzniká především na patře, druhou nejčastější lokalizací jsou žlázy sliznice vedlejších nosních dutin (obr. 1). Tvoří 12–15 % salivárních karcinomů příušní žlázy, 30–60 % žlázy podčelistní a 32–71 % karcinomů malých slinných žláz [28].
Obr. 1. Adenoidně cystický karcinom malé slinné žlázy tvrdého patra vpravo 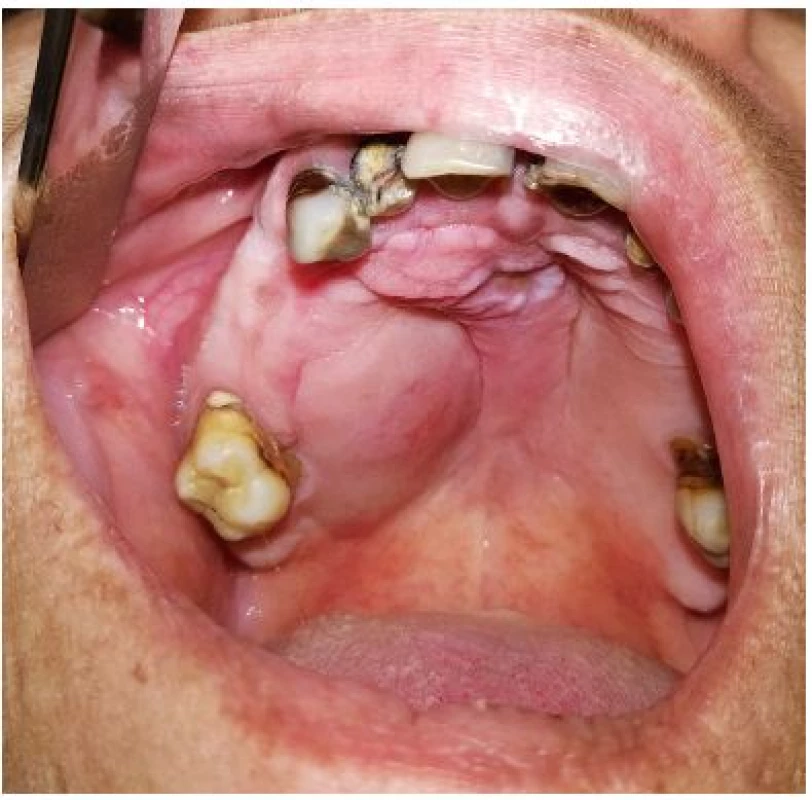
AdCC postihuje všechny věkové skupiny, nejvyšší incidence je ale u pacientů ve věku 40 až 60 let. Z hlediska výskytu u jednotlivých pohlaví není popsána významnější predilekce kromě AdCC podčelistních žláz, který vzniká téměř výhradně u žen [23].
V posledních několika letech byly zjištěny nejen nové skutečnosti ohledně biologického chování AdCC, ale byly objeveny i molekulárně genetické znaky, které jsou pravděpodobně zodpovědné za jeho kancerogenezi.
Lymfogenní metastázování do regionálních lymfatických uzlin se u AdCC tradičně považuje za vzácné (6–10 %), vznikající jen při nekontrolovaném pokročilém či recidivujícím onemocnění [2]. Jedná se ale pravděpodobně o nesprávný údaj. Podle recentní multicentrické studie se ukazuje, že regionální uzlinové postižení je u tohoto karcinomu častějším jevem, než se dříve soudilo, a to v 29 % případů (79/270). Především u orálních AdCC malých slinných žláz jsou metastázy v krčních lymfatických uzlinách relativně časté (37 %, 55/148 pacientů) oproti AdCC velkých slinných žláz (19 %, 18/95 pacientů) [2]. Metastázy nejčastěji vznikají v uzlinových oblastech I až III, nehledě na lokalizaci primárního nádoru (85 % pacientů s metastázami orálních AdCC, 55 % s metastázami AdCC velkých slinných žláz). Při elektivních krčních disekcích byly prokazovány okultní mikrometastázy v 15–44 % případů [34]. Nejčastější postižení klinicky nedetekovatelnými metastázami v lymfatických uzlinách bylo zaznamenáno u AdCC malých slinných žláz (22 % u orálních tumorů a 16 % u karcinomů paranazálních dutin) [2]. U AdCC s high-grade transformací se vyskytují metastázy v regionálních lymfatických uzlinách ve více než 50 % případů [13, 29]. Vyšší incidence nodálních metastáz se udává i u solidní varianty AdCC (grade 3).
Pro AdCC slinných žláz je typická chromozomální translokace t(6;9)(q22-23;p23-24), poprvé popsaná v roce 2009, která generuje fúzní onkogen MYB-NFIB [33]. Jedná se o recidivující a nenáhodnou translokaci a hlavní genetickou událost AdCC, velmi pravděpodobně zodpovědnou za jeho kancerogenezi. MYB-NFIB fúze nebo rearanže MYB genu, které vedou k jeho aktivaci, a tím ke zvýšené expresi MYB–NFIB fúzního proteinu nebo MYB onkoproteinu, byly dosud ze salivárních karcinomů i jiných karcinomů hlavy a krku prokázány pouze u AdCC, a to ve více než v 80 % případů [33]. Jedná se tak o charakteristický znak těchto maligních sialomů, že se u něj v současnosti zkoumají možnosti využití jako diagnostického, prognostického a terapeutického biomarkeru. Zcela recentně byl u AdCC popsán i nový fúzní onkogen MYBL1-NFIB jako následek translokace t(8;9) [26]. Translokace t(8;9) a jiné rearanže genu MYBL1 byly zjištěny u 35 % AdCC negativních na translokaci t(6;9) [26].
S ohledem na tato fakta autoři v předkládané práci vyhodnocují vlastní soubor pacientů s AdCC.
MATERIÁL A METODY
Pomocí klinických informačních systémů PC DENT (CompuGroup Medical Česká republika s.r.o., verze 3.1.1, revize:6), WinMedicalc (Medicalc software s.r.o., Česká republika, verze 2.10.8.46) a WinZis (Prodata Praha s.r. o., Česká Republika) byli vyhledáni všichni pacienti s diagnózou AdCC, kteří byli léčeni ve FN v Plzni (Stomatologická a ORL klinika) a u kterých byly dohledatelné klinické údaje o dispenzarizaci trvající nejméně šest měsíců. Bylo identifikováno 27 pacientů za období 01/1986 až 01/2016, tedy za 30 let. Ve stanoveném souboru byly sledovány tyto ukazatele: věk, pohlaví, lokalizace nádoru, klinické stadium v době diagnózy podle 7. vydání TNM klasifikace, přítomnost metastáz v regionálních lymfatických uzlinách a vzdálených metastáz, grading, průměrná doba dispenzarizace, léčba a její výsledky.
Metodika detekce MYB-NFIB fúze pomocí FISH
Čtyři mikromilimetry silné řezy tkáně formalínem fixované, v parafínu zalité (FFPE) byly naneseny na povrch pozitivně nabitých podložních skel. Neobarvené standardně deparafinizované preparáty byly inkubovány v 1x Target Retrieval Solution Citrate pH 6 (Dako, Glostrup, Německo) při 95 °C/40 minut a ve stejném roztoku chlazeny po dobu 20 minut při pokojové teplotě. Skla byla následně omyta v destilované vodě po dobu pěti minut při pokojové teplotě, natrávena v roztoku pepsinu (Sigma Aldrich, St. Louis, MO, USA) o koncentraci 0,5 mg/ml v 0,01M HCl při 37 °C/25 minut a omývána v destilované vodě po dobu pěti minut při pokojové teplotě. Následovala dehydratace vzestupnou alkoholovou řadou (70 %, 85 % a 96 % à dvě minuty) a vysušení preparátu na vzduchu.
Pro detekci fúze MYB-NFIB byla použita komerčně dostupná break-apart FISH sonda ZytoLight® SPEC MYB Dual Color Break Apart Probe (ZytoVision GmbH, Bremerhaven, Německo) a dále sondy vlastního designu, break-apart sonda SureFish NFIB Break Apart Probe a fúzní sonda SureFish MYB-NFIB Fusion Probe (Agilent Technologies, Santa Clara, California, USA). Oligonukleotidy NFIB break-apart sondy byly lokalizovány v oblasti chromozomu 9 na pozici 13740671-14140560 a 14340306-14740560. U MYB-NFIB fúzní sondy byly oligonukleotidy v oblasti chromozomu 6 lokalizovány na pozici 135271234-135771043 a v oblasti chromozomu devět na pozici 13990266--14490285 (vše Build GRCh37).
Hybridizační směs SureFish sond byla připravena z jednoho µl oranžově a jednoho µl zeleně značených částí sond, jednoho µl destilované vody a sedmi µl LSI pufru (Vysis/Abbott Molecular, IL, USA). Sonda MYB Dual Color Break Apart Probe byla již z výroby připravena k přímé aplikaci.
Podle velikosti řezu bylo na preparáty aplikováno potřebné množství sondy a přikryto krycím sklem, jehož okraje byly zalepeny lepidlem. Pak byla skla inkubována v přístroji ThermoBrite™ (StatSpin/Iris Sample Processing, Westwood, MA, USA) s následujícím programem: kodenaturace při 85 °C/8 minut a hybridizace při 37 °C/16 hodin. Po vyjmutí skel z přístroje byla odstraněna krycí sklíčka a preparáty byly omyty v post-hybridizačním roztoku 2xSSC + 0,3% NP-40 při 72 °C/2 minuty. Po oschnutí skel ve tmě byly preparáty podbarveny 4 ′, 6 ′ -diamidino-2-phenylindolem – DAPI (Vysis/Abbott Molecular) a přikryty novým krycím sklíčkem.
Interpretace FISH
Preparáty byly prohlédnuty v epifluorescenčním mikroskopu Olympus BX51 (Olympus Corporation, Tokyo, Japonsko) při stonásobném zvětšení se sety filtrů Triple Band Pass (DAPI/SpectrumGreen/SpectrumOrange), Dual Band Pass (SpectrumGreen/SpectrumOrange) a Single Band Pass (SpectrumGreen nebo SpectrumOrange).
V každém preparátu bylo hodnoceno 100 náhodně vybraných nepřekrývajících se jader v cílové oblasti. Jako pozitivní byl u break-apart sond hodnocen nález separátního zeleného nebo oranžového signálu v jádře, u fúzní sondy byl pozitivní nález značen přítomností fúzního oranžovo-žluto-zeleného signálu v jádře.
Cut-off hodnoty byly určeny u vlastní kontrolní skupiny s normálním histologickým nálezem, kde byla hodnocena jádra s abnormálním nálezem, stanoven jejich průměr a směrodatná odchylka. Cut-off byla definována jako hodnota součtu průměru + tři standardní odchylky. Pro obě break-apart sondy byla cut-off hodnota 10 % pozitivních jader, u fúzní sondy 20 %.
VÝSLEDKY
Soubor 27 pacientů s AdCC a sledované parametry shrnuje tabulka 1. Průměrný věk pacientů byl 55,8 ± 17,4 let (v rozmezí 24 – 84 let). Poměr zastoupení mužů a žen byl 1 : 1,7. AdCC vznikl v malých slinných žlázách (nebo v jim podobných žlázách horního aerodigestivního traktu) v 41 %, v podčelistní žláze v 26 %, v příušní žláze v 22 % a v podjazykové žláze pak v 11 % případů.
Tab. 1. Soubor pacientů s AdCC léčených ve FN v Plzni v letech 1986 až 2016 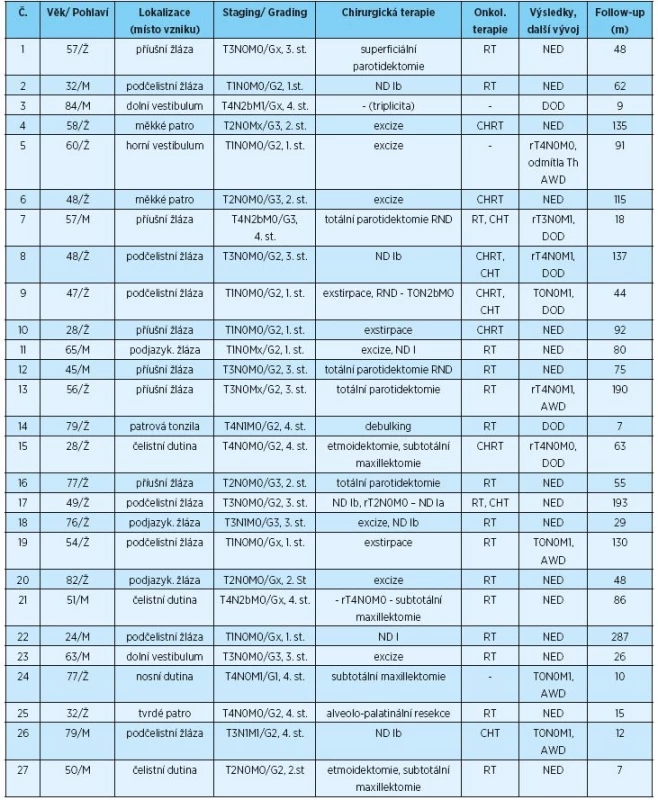
(R)ND – (radical) neck dissection, (radikální) krční disekce, Th – terapie, RT – radioterapie, CHT – chemoterapie, CHRT – chemoradioterapie, NED – no evidence of disease, bez příznaků onemocnění, AWD - alive with disease, žije s onemocněním, DOD – dead of disease, smrt v důsledku onemocnění V době diagnózy bylo zaznamenáno první klinické stadium v 26 %, druhé stadium v 18 %, třetí stadium v 26 % a čtvrté stadium v 30 % případů. Metastázy v regionálních lymfatických uzlinách byly v době diagnózy detekovány u šesti pacientů, z toho u jednoho nemocného se jednalo o přímé prorůstání karcinomu z podčelistní žlázy do uzliny. U jednoho pacienta s AdCC příušní žlázy byla diagnostikována metastáza v intraglandulární parotické uzlině, která ale podle pravidel TNM klasifikace nebyla započítána. Celkem se metastázy v regionálních lymfatických uzlinách vyskytovaly u 26 % pacientů (7/27). Vzdálené metastázy byly diagnostikovány u 30 % pacientů, u tří nemocných v době diagnózy. Nejdelší období od diagnózy AdCC do diagnózy vzdálených metastáz (plicních) bylo 11 let u pacientky bez lokoregionální recidivy. Nejčastější lokalizací vzdálených metastáz byly plíce (55 %), játra (27 %), kosti (9 %) a peritoneum (9 %). U dvou pacientů byly diagnostikovány vzdálené metastázy ve více lokalizacích. Grading byl popsán jen u 21 pacientů, a to grade 1 v 5 % případů, grade 2 v 67 % případů a grade 3 v 28 % případů. Průměrná doba dispenzarizace byla 76,4 ± 67,0 měsíců (v rozmezí 7–287 měsíců).
Všichni pacienti kromě jednoho (pacient se synchronní nádorovou triplicitou s generalizací – karcinom ledviny, tračníku a AdCC) byli primárně léčeni chirurgicky, u jedné pacientky byl proveden pouze debulking. Celkem 61 % chirurgických výkonů s cílem radikálního odstranění AdCC mělo histologicky blízké nebo pozitivní okraje resekátu. Všichni pa-cienti (kromě čtyř – nemocní se vzdálenými metastázami v době diagnózy a jedna nemocná, která odmítla léčbu) poté podstoupili adjuvantní radioterapii nebo chemoradioterapii. V případě jinak neléčitelného progresivního onemocnění pak byla indikována paliativní chemoterapie.
Za dobu dispenzarizace bylo 59 % pacientů bez jakýchkoliv příznaků choroby, 22 % zemřelo v důsledku AdCC a 19 % žilo s tímto onemocněním, ať již v podobě recidivy, či metastáz.
Genetické vyšetření souboru 26 pacientů s AdCC shrnuje tabulka 2. Při FISH vyšetření pomocí MYB break-apart sondy byla pozitivita zaznamenána v 75 % (18/24), pomocí NFIB break-apart sondy byla v 87 % (20/23) a pomocí MYB/NFIB fúzní sondy pak v 90 % případů (19/21). Souhrnná detekce fúzního onkogenu MYB-NFIB byla zaznamenána v 79 % případů (19/24) a 1p36 delece pak ve 13 % případů (3/23). U jedné pacientky bylo FISH vyšetření pomocí MYB break-apart a NFIB break-apart sond negativní, ale přesto byla potvrzena MYB - NFIB fúze. U dvou pacientů bylo vyšetření pomocí MYB break-apart sond negativní, ale NFIB break-apart pozitivní, s negativními MYB-NFIB fúzemi u obou z nich.
Tab. 2. Genetické vyšetření souboru pacientů s AdCC léčených ve FN v Plzni v letech 1986 až 2016 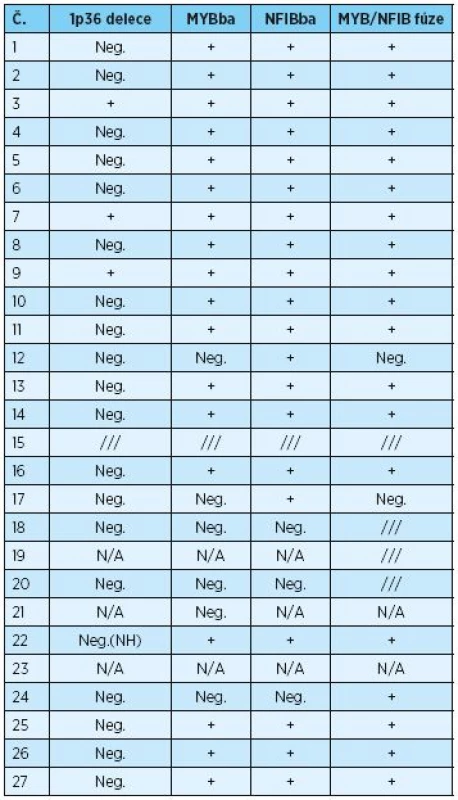
Neg. - negativní, + pozitivní, /// - nevyšetřeno, NH - nerovnoměrná hybridizace, N/A – nelze analyzovat DISKUSE
Na většině pracovišť je u operabilních AdCC „zlatým standardem“ léčby primárně chirurgická terapie s adjuvantní radioterapií nebo chemoradioterapií s cílem zlepšit lokoregionální kontrolu onemocnění. Efekt této adjuvantní onkologické léčby je však v odborné literatuře popisován kontroverzně, především z důvodu minimálního vlivu na celkové nebo nádorově specifické přežití pacientů, což je způsobeno neovlivněním častých vzdálených metastáz [35]. Při samostatné radioterapii (většinou u inoperabilních nádorů) není AdCC kurabilní [24].
Paliativní chemoterapie (především monoterapie mitoxantronem, vinorelbinem nebo antracyklinovými cytostatiky) by měla být vyhrazena jen pro minoritní část pacientů s jinak neřešitelným pokročilým onemocněním, které je rychle progredující a/nebo symptomatické, a to po zvážení všech rizikových faktorů (komorbidity, toxicita léků, preference pacienta aj.), eventuálně i jiných způsobů terapie (paliativní radioterapie, metastatektomie solitárních lézí) [18].
Vznik lokálních recidiv AdCC je považován za závažnou známku nevyléčitelnosti tohoto karcinomu a udává se v 16–85 % případů, a to i pět let po terapii [3, 6]. V prezentovaném souboru jsme v souladu s recentní literaturou [3, 9] potvrdili vysokou tendenci AdCC k lokálním recidivám (26 %, 7/27), která je způsobena především obtížnou radikální chirurgickou léčbou vzhledem k časté peri - a intraneurální invazi (61 % resekátů AdCC s histologicky blízkým nebo pozitivním okrajem). Podle jedné studie 80 % AdCC v oblasti baze lební mělo po excizi pozitivní resekční okraje, i přes to, že tyto karcinomy byly preoperačně označeny zkušeným chirurgem za radikálně operabilní [7]. Pozitivní resekční okraje jsou prokazovány v 5,9–29,4 % případů a blízké okraje (< 5 mm) pak v 1,4–74,3 % případů [10].
Metastázování hematogenní cestou jsme zaznamenali jako časný (11 % pacientů v době diagnózy) i pozdní projev AdCC, který je nezávislý na lokoregionální kontrole onemocnění (plicní metastázy až 11 let od stanovení diagnózy při lokoregionální remisi). Obecně jsou vzdálené metastázy u AdCC častým jevem (20–60 % případů) [28]. Relativně často jsou detekovány již v době diagnózy, a to i v případě karcinomů malých rozměrů (podle jedné studie nejméně 20 % případů časných stadií AdCC, které nebyly recidivami) [11, 23]. U AdCC se tak ukazuje, že potenciál k nádorovému růstu a schopnost metastázovat jsou dvě nezávislé vlastnosti nádoru [23]. Ani pozdní vzdálené metastázy AdCC nejsou ojedinělé. U 20 % pacientů vznikají mezi osmým až 20. rokem po stanovení diagnózy [11]. Nejčastějším místem hematogenního rozesevu AdCC jsou plíce (v jedné studii 74,5 % ze 145 pacientů se vzdálenými metastázami), kam se nádor šíří cestou vnitřní jugulární žíly. Méně časté je pak postižení skeletu (6,9 %), jater (3,4 %) nebo mozku (2,1 %). Více než jedna lokalizace byla diagnostikována u 13,1 % pacientů [11].
V kontrastu s dřívějšími názory na AdCC jsme zjistili vysokou incidenci metastáz do regionálních lymfatických uzlin (26 %, 7/27), čímž jsme potvrdili i výsledky jiných současných prací [2, 25]. Podhodnocení výskytu regionálních nodálních metastáz je nejspíše způsobeno relativně častým okultním postižením a také z důvodu nepříliš obvyklého provádění krčních disekcí (elektivní nejsou standardně doporučovány), a tím i absencí histopatologického vyšetření [9]. Elektivní blokové disekce jsou obecně u spinaliomů hlavy a krku prováděny z důvodu odstranění okultních uzlinových mikrometastáz, a to při riziku výskytu více než 15–20 % [12]. Při recentně prokazované vysoké incidenci okultních mikrometastáz u AdCC by již elektivní krční disekce, a to ipsilaterální v rozsahu I–III (okultní nodální metastázy byly zjištěny pouze v těchto lokalizacích), byly ospravedlnitelné a mohly by být indikovány. Podle studie s 457 pa-cienty s AdCC slinných žláz, kdy 226 pacientů (49 %) podstoupilo kromě odstranění primárního nádoru i elektivní krční disekci a u 231 nemocných (51 %) byl pouze resekován primární tumor, se zjistilo, že pětileté celkové přežití je u první skupiny 72 % a u druhé 79 % a pětileté nádorově specifické přežití pak 74 % resp. 81 % [5]. Takže statistická analýza neukázala žádné výhody z hlediska přežití u pacientů podstupujících elektivní krční disekci. Vzhledem k tomu, že tyto preventivní výkony by měly být indikovány nejen podle rizika incidence okultních metastáz v lymfatických uzlinách, ale i podle očekávaného vlivu léčby na přežití, nejsou podle výsledků dosud prezentovaných studií elektivní krční disekce u AdCC slinných žláz nadále standardně indikovány [5]. U AdCC s high-grade transformací nebo histologicky verifikovanou angio-/lymfangioinvazí a u AdCC v rizikových lokalizacích (baze jazyka), pokud není plánována adjuvantní radioterapie, by ale měly být tyto výkony zvažovány [13, 34]. U N0 pacientů, kde je pooperační radioterapie indikována například z důvodu pokročilého nádoru (T3/T4), se zdá být účelná ipsilaterální elektivní iradiace krku, bez krční disekce [34].
V průměru po více než šesti letech dispenzarizace bylo v našem souboru 59 % pacientů v kompletní remisi a 41 % nemocných zemřelo v důsledku AdCC nebo žije s pokročilým, jinak neřešitelným onemocněním, což odpovídá výsledkům léčby v jiných studiích i prognóze tohoto novotvaru, přestože v řadě případů chirurgická léčba v našem souboru neodpovídala současným doporučením (např. krční disekce v rozsahu I–III pro AdCC submandibulární žlázy) [23, 28]. Pětileté přežití se u AdCC udává 75 %, desetileté přežití 20–40 % a patnáctileté přežití pak 10–25 % [23, 28]. Mezi hlavní nezávislé negativní prognostické faktory patří: klinické stadium onemocnění, které je nadřazené gradingu, primární lokalizace nádoru, grading, pozitivita resekčních okrajů, intraneurální invaze a věk ≥ 70 let [3, 4, 6].
V případě výskytu vzdálených metastáz mají výrazně horší prognózu pacienti s postižením mozku a kostí oproti nemocným s metastázami plic nebo jater [3]. Průměrné přežití nemocného se vzdálenými metastázami AdCC jsou tři roky, pouze 20 % pacientů přežije pět let [6, 18]. Obecně lze říci, že více než polovina pacientů se vzdálenými metastázami zemře v průběhu deseti let po stanovení diagnózy (třetina pacientů umírá do dvou let od vzniku metastáz). Až 10 % pacientů ale přežívá více než deset let při pomalém růstu např. plicních meta-stáz [11, 18], což staví klinického lékaře před otázku, zda tyto pacienty lokoregionálně léčit chirurgicky.
Naopak více než polovina pacientů bez vzdálených metastáz pak přežívá více než 20 let [11].
Fúzní onkogen MYB-NFIB byl v našem souboru detekován u 79 % pacientů s AdCC (19/24). V současné době se v zahraničních studiích dosahuje většinou výsledků 50–80 % [26, 27, 30, 32]. U dvou nemocných, u kterých bylo vyšetření pomocí MYB break-apart sondy negativní a NFIB break-apart sondy pozitivní současně s negativními MYB-NFIB fúzemi, lze předpokládat jiného fúzního partnera, pravděpodobně MYBL1, což bude předmětem dalšího výzkumu. Deleci 1p36 jsme zaznamenali ve 13 % případů (3/23). V práci z roku 2008 byla zjištěna incidence této genetické změny 44 % u 53 vyšetřených AdCC se závěrem, že se jedná o nejčastější genetickou změnu signifikantně spojenou s horší prognózou pacientů [31]. Všichni tři pacienti z našeho souboru s diagnostikovanou delecí 1p36 zemřeli v důsledku AdCC v období 9–44 měsíců od stanovení diagnózy a léčby. Vzhledem k malému soubou pacientů a nízké incidenci delece 1p36, navíc při nádorové triplicitě jednoho z nemocných, nelze blíže statisticky hodnotit klinicko-patologickou korelaci tohoto markeru.
Na základě současných znalostí zatím nemůže MYB–NFIB fúze a/nebo MYB aktivace sloužit jako prognostický ani terapeutický biomarker [33]. U salivárních AdCC dosud neexistuje účinná cílená léčba, která by poskytovala větší benefit pro pacienta než klasická chemoterapie. Nejperspektivněji by se jevily léky cílené proti MYB a MYB-NFIB, které ale dosud nebyly vyvinuty (velmi obtížné vzhledem k tomu, že se jedná o transkripční faktory).
Při probíhajících studiích využívajících preparáty inhibující některé signální dráhy zapojené do regulace MYB a MYB-NFIB bylo zatím nejlepších výsledků cílené terapie dosaženo při léčbě dovitinibem, lapatinibem, cetuximabem, sunitinibem, everolimem a nebo axitinibem [1, 14, 15, 16, 17, 21]. MYB-NFIB fúzní onkogen lze u AdCC v současnosti využít pouze jako diagnostický biomarker, a to hlavně u pozdních vzdálených metastáz při lokoregionální remisi onemocnění. Ty již často nebývají dávány do souvislosti s AdCC a mohou být mylně považovány za primární nádory daných lokalizací (např. adenokarcinomy plic) nebo za metastázy neznámého origa (např. v játrech), což pak může vést klinického lékaře k dalším chybám v diagnosticko-léčebném postupu. Problémem v těchto případech bývá i to, že se biopsie z těchto orgánů primárně nedostávají k patologům specializujícím se na diagnostiku NSŽ.
ZÁVĚR
AdCC slinných žláz vykazuje vyšší tendenci k zakládání regionálních uzlinových metastáz, než se dříve soudilo. MYB-NFIB fúze je hlavní nádorově specifickou onkogenní událostí u AdCC s vysokou úspěšností detekce. Tento fúzní onkogen je možné v současné době potenciálně využít pouze jako pomocný diagnostický nástroj u histopatologicky sporných případů, především pak u pozdních vzdálených metastáz.
MUDr. et. MUDr. Lukáš Hauer, Ph.D.
Stomatologická klinika LF UK a FN
Oddělení ústní, čelistní a obličejové chirurgie
Alej Svobody 80
304 60 Plzeň
e-mail: hauerl@fnplzen.cz
Zdroje
1. Agulnik, M., Cohen, E. W., Cohen, R. B., Chen, E. X., Vokes, E. E., Hotte, S. J., Winquist, E., Laurie, S., Hayes, D. N., Dancey, J. E., Brown, S., Pond, G. R., Lorimer, I., Daneshmand, M., Ho, J., Tsao, M. S., Siu, L. L.: Phase II study of lapatinib in recurrent or metastatic epidermal growth factor receptor and/or erbB2 expressing adenoid cystic carcinoma and non adenoid cystic carcinoma malignant tumors of the salivary glands. J. Clin. Oncol., roč. 25, 2007, č. 25, s. 3978–3984.
2. Amit, M., Binenbaum, Y., Sharma, K., Ramer, N., Ramer, I., Agbetoba, A., Glick, J., Yang, X., Lei, D., Bjørndal, K., Godballe, C., Mücke, T., Wolff, K. D., Fliss, D., Eckardt, A. M., Copelli, C., Sesenna, E., Palmer, F., Ganly, I., Patel, S., Gil, Z.: Incidence of cervical lymph node metastasis and its association with outcomes in patients with adenoid cystic carcinoma. An international collaborative study. Head Neck, roč. 37, 2015, č. 7, s. 1032–1037.
3. Amit, M., Binenbaum, Y., Sharma, K., Ramer, N., Ramer, I., Agbetoba, A., Miles, B., Yang, X., Lei, D., Bjøerndal, K., Godballe, C., Mücke, T., Wolff, K. D., Fliss, D., Eckardt, A. M., Copelli, C., Sesenna, E., Palmer, F., Patel, S., Gil, Z.: Analysis of failure in patients with adenoid cystic carcinoma of the head and neck. An international collaborative study. Head Neck, roč. 36, 2014, č. 7, s. 998–1004.
4. Amit, M., Binenbaum, Y., Trejo-Leider, L., Sharma, K., Ramer, N., Ramer, I., Agbetoba, A., Miles, B., Yang, X., Lei, D., Bjørndal, K., Godballe, C., Mücke, T., Wolff, K. D., Eckardt, A. M., Copelli, C., Sesenna, E., Palmer, F., Ganly, I., Patel, S., Gil, Z.: International collaborative validation of intraneural invasion as a prognostic marker in adenoid cystic carcinoma of the head and neck. Head Neck, roč. 37, 2015, č. 7, s. 1038–1045.
5. Amit, M., Na‘ara, S., Sharma, K., Ramer, N., Ramer, I., Agbetoba, A., Glick, J., Yang, X., Lei, D., Bjoerndal, K., Godballe, C., Mücke, T., Klaus-Dietrich, W., Eckardt, A. M., Copelli, C., Sesenna, E., Palmer, F., Ganly, I., Gil, Z.: Elective neck dissection in patients with head and neck adenoid cystic carcinoma: an international collaborative study. Ann. Surg. Oncol., roč. 22, 2015, č. 4, s. 1353–1359.
6. Barnes, L., Eveson, J. W., Reichart, P., Sidransky, D.: World Health Organization classification of tumours: Pathology and genetics of head and neck tumours. Lyon, IARC Press, 2005, s. 209–281.
7. Casler, J. D., Conley, J. J.: Surgical management of adenoid cystic carcinoma in the parotid gland. Otolaryngol. Head Neck Surg., roč. 106, 1992, č. 4, s. 332–338.
8. Ciccolallo, L., Licitra, L., Cantú, G., Gatta, G.; EUROCARE Working Group.: Survival from salivary glands adenoid cystic carcinoma in European populations. Oral Oncol., roč. 45, 2009, č. 8, s. 669–674.
9. Coca-Pelaz, A., Rodrigo, J. P., Bradley, P. J., Vander Poorten, V., Triantafyllou, A., Hunt, J. L., Strojan, P., Rinaldo, A., Haigentz, M. Jr., Takes, R. P., Mondin, V., Teymoortash, A., Thompson, L. D., Ferlito, A.: Adenoid cystic carcinoma of the head and neck – An update. Oral Oncol., roč. 51, 2015, č. 7, s. 652–661.
10. Ganly, I., Amit, M., Kou, L., Palmer, F.L., Migliacci, J., Katabi, N., Yu, C., Kattan, M. W., Binenbaum, Y., Sharma, K., Naomi, R., Abib, A., Miles, B., Yang, X., Lei, D., Bjoerndal, K.,Godballe, C., Mücke, T., Wolff, K. D., Fliss, D., Eckardt, A. M., Chiara, C., Sesenna, E., Ali, S., Czerwonka, L., Goldstein, D. P., Gil, Z., Patel, S. G.: Nomograms for predicting survival and recurrence in patients with adenoid cystic carcinoma. An international collaborative study. Eur. J. Cancer, roč. 51, 2015, č. 18, s. 2768–2776.
11. Gao, M., Hao, Y., Huang, M. X., Ma, D. Q., Luo, H. Y., Gao, Y., Peng, X., Yu, G. Y.: Clinicopathological study of distant metastases of salivary adenoid cystic carcinoma. Int. J. Oral Maxillofac. Surg., roč. 42, 2013, č. 8, s. 923–928.
12. Hauer, L.: Dentoalveolární chirurgie. Test 10: Zhoubný nádor dutiny ústní – spinocelulární karcinom jazyka. LKS, roč. 25, 2015, č. 10, s. 203–207.
13. Hellquist, H., Skálová, A., Barnes, L., Cardesa, A., Thompson, L. D., Triantafyllou, A., Williams, M. D., Devaney, K. O., Gnepp, D. R., Bishop, J. A., Wenig, B .M., Suárez, C., Rodrigo, J. P., Coca-Pelaz, A., Strojan, P., Shah, J. P., Hamoir, M., Bradley, P.J., Silver, C. E., Slootweg, P. J., Vander Poorten, V., Teymoortash, A., Medina, J. E., Robbins, K. T., Pitman, K. T., Kowalski, L. P., de Bree, R., Mendenhall, W. M., Eloy, J. A., Takes, R. P., Rinaldo, A., Ferlito, A.: Cervical lymph node metastasis in high-grade transformation of head and neck adenoid cystic carcinoma: a collective international review. Adv. Ther., 2016 [Epub ahead of print].
14. Ho, A. L., Sherman, E. J., Fury, M. G., Baxi, S. S., Haque, S., Sima, C. S., Antonescu, C. R., Katabi, N., Pfister, D. G.: Phase II study of axitinib in patients with progressive, recurrent/metastatic adenoid cystic carcinoma. J. Clin. Oncol., roč. 32, 2014, č. 15, Suppl., s. 6093.
15. Chau, N. G., Hotte, S. J., Chen, E. X., Chin, S. F., Turner, S., Wang, L., Siu, L. L.: A phase II study of sunitinib in recurrent and/or metastatic adenoid cystic carcinoma (ACC) of the salivary glands: current progress and challenges in evaluating molecularly targeted agents in ACC. Ann. Oncol., roč. 23, 2012, č. 6, s. 1562–1570.
16. Keam, B., Kim, S. B., Shin, S. H., Cho, B. C., Lee, K. W., Kim, M. K., Yun, H. J., Lee, S. H., Yoon, D. H., Bang, Y. J.: Phase 2 study of dovitinib in patients with metastatic or unresectable adenoid cystic carcinoma. Cancer, roč. 121, 2015, č. 15, s. 2612–2617.
17. Kim, D. W., Oh, D. Y., Shin, S. H., Kang, J. H., Cho, B. C., Chung, J. S., Kim, H., Park, K. U., Kwon, J. H., Han, J. Y., Kim, M. J., Bang, Y. J.: A multicenter phase II study of everolimus in patients with progressive unresectable adenoid cystic carcinoma. BMC Cancer, roč. 14, 2014, s. 795.
18. Laurie, S. A., Ho, A. L., Fury, M. G., Sherman, E., Pfister, D. G.: Systemic therapy in the management of metastatic or locally recurrent adenoid cystic carcinoma of the salivary glands: a systematic review. Lancet Oncol., roč.12, 2011, č. 8, s. 815–824.
19. Li, N., Xu, L., Zhao, H., El-Naggar, A. K., Sturgis, E. M.: A comparison of the demographics, clinical features, and survival of patients with adenoid cystic carcinoma of major and minor salivary glands versus less common sites within the Surveillance, Epidemiology, and End Results registry. Cancer, roč. 118, 2012, č. 16, s. 3945–3953.
20. Lin, Y. C., Chen, K. C., Lin, C. H., Kuo, K. T., Ko, J. Y., Hong, R. L.: Clinicopathological features of salivary and non-salivary adenoid cystic carcinomas. Int. J. Oral Maxillofac. Surg., roč. 41, 2012, č. 3, s. 354–360.
21. Locati, L. D., Bossi, P., Perrone, F., Potepan, P., Crippa, F., Mariani, L., Casieri, P., Orsenigo, M., Losa, M., Bergamini, C., Liberatoscioli, C., Quattrone, P., Calderone, R. G., Rinaldi, G., Pilotti, S., Licitra, L.: Cetuximab in recurrent and/or metastatic salivary gland carcinomas: A phase II study. Oral Oncol., roč. 45, 2009, č. 7, s. 574–578.
22. Marchiò, C., Weigelt, B., Reis-Filho, J. S.: Adenoid cystic carcinomas of the breast and salivary glands (or ‚The strange case of Dr Jekyll and Mr Hyde‘ of exocrine gland carcinomas). J. Clin. Pathol., roč. 63, 2010, č. 3, s. 220–228.
23. Marx, R. E., Stern, D.: Oral and maxillofacial pathology: A rationale for diagnosis and treatment. 2. vyd., Quintessence Pub. Co., 2012, s. 547 – 598.
24. Mendenhall, W. M., Morris, C. G., Amdur, R. J., Werning, J. W., Hinerman, R. W., Villaret, D. B.: Radiotherapy alone or combined with surgery for adenoid cystic carcinoma of the head and neck. Head Neck, roč. 26, 2004, č. 2, s. 154–162.
25. Min, R., Siyi, L., Wenjun, Y., Ow, A., Lizheng, W., Minjun, D., Chenping, Z.: Salivary gland adenoid cystic carcinoma with cervical lymph node metastasis: a preliminary study of 62 cases. Int. J. Oral Maxillofac. Surg., roč. 41, 2012, č. 8, s. 952–957.
26. Mitani, Y., Liu, B., Rao, P. H., Borra, V. J., Zafereo, M., Weber, R. S., Kies, M., Lozano, G., Futreal, P. A., Caulin, C., El-Naggar, A. K.: Novel MYBL1 gene rearrangements with recurrent MYBL1-NFIB fusions in salivary adenoid cystic carcinomas lacking t(6;9) translocations. Clin. Cancer Res., roč. 22, 2016, č. 3, s. 725–733.
27. Mitani, Y., Rao, P. H., Futreal, P. A., Roberts, D. B., Stephens, P. J., Zhao, Y. J., Zhang, L., Mitani, M., Weber, R. S., Lippman, S. M., Caulin, C., El-Naggar, A. K.: Novel chromosomal rearrangements and break points at the t(6;9) in salivary adenoid cystic carcinoma: association with MYB-NFIB chimeric fusion, MYB expression, and clinical outcome. Clin. Cancer Res., roč. 17, 2011, č. 22, s. 7003–7014.
28. Myers, E. N., Ferris, R. L.: Salivary gland disorders. 1. vyd., Berlin, Springer-Verlag, 2007, s. 59–62.
29. Nagao, T.: „Dedifferentiation“ and high-grade transformation in salivary gland carcinomas. Head Neck Pathol., roč. 7, 2013, Suppl. 1, s. S37–S47.
30. Persson, M., Andrén, Y., Moskaluk, C. A., Frierson, H. F. Jr., Cooke, S. L., Futreal, P. A., Kling, T., Nelander, S., Nordkvist, A., Persson, F., Stenman, G.: Clinically significant copy number alterations and complex rearrangements of MYB and NFIB in head and neck adenoid cystic carcinoma. Genes Chromosomes Cancer, roč. 51, 2012, č. 8, s. 805–817.
31. Rao, P. H., Roberts, D., Zhao, Y. J., Bell, D., Harris, C. P., Weber, R. S., El-Naggar, A. K.: Deletion of 1p32–p36 is the most frequent genetic change and poor prognostic marker in adenoid cystic carcinoma of the salivary glands. Clin. Cancer Res., roč. 14, 2008, č. 16, s. 5181–5187.
32. Rettig, E. M., Tan, M., Ling, S., Yonescu, R., Bishop, J. A., Fakhry, C., Ha, P. K.: MYB rearrangement and clinicopathologic characteristics in head and neck adenoid cystic carcinoma. Laryngoscope, roč. 125, 2015, č. 9, s. E292–E299.
33. Stenman, G., Persson, F., Andersson, M. K.: Diagnostic and therapeutic implications of new molecular biomarkers in salivary gland cancers. Oral Oncol., roč. 50, 2014, č. 8, s. 683–690.
34. Suárez, C., Barnes, L., Silver, C. E., Rodrigo, J. P., Shah, J. P., Triantafyllou, A., Rinaldo, A., Cardesa, A., Pitman, K. T., Kowalski, L. P., Robbins, K. T., Hellquist, H., Medina, J. E., de Bree, R., Takes, R. P., Coca-Pelaz, A., Bradley, P. J., Gnepp, D. R., Teymoortash, A., Strojan, P., Mendenhall, W. M., Eloy, J. A., Bishop, J. A., Devaney, K. O., Thompson, L. D. R., Hamoir, M., Slootweg, P. J., Vander Poorten, V., Williams, M. D., Wenig, B. M., Skálová, A., Ferlito, A.: Cervical lymph node metastasis in adenoid cystic carcinoma of oral cavity and oropharynx: A collective international review. Auris Nasus Larynx, 2016, článek v tisku.
35. Subramaniam, T., Lennon, P., O‘Neill, J. P.: Ongoing challenges in the treatment of adenoid cystic carcinoma of the head and neck. Ir. J. Med. Sci., roč. 184, 2015, č. 3, s. 583–590.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2016 Číslo 3
-
Všetky články tohto čísla
-
Maturogeneze
Část 3. Klinický protokol -
DEN VÝZKUMNÝCH PRACÍ 2016
věnovaný významnému životnímu jubileu prof. MUDr. Tibora Nemétha, DrSc., 1. část -
Adenoidně cystický karcinom slinných žláz.
Soubor 27 pacientů -
Vyhodnocení výskytu orální fokální infekce.
Soubor 278 pacientů - Vliv dezinfekčních přípravků na vlastnosti dentálních otiskovacích hmot
-
Maturogeneze
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Adenoidně cystický karcinom slinných žláz.
Soubor 27 pacientů -
Vyhodnocení výskytu orální fokální infekce.
Soubor 278 pacientů -
Maturogeneze
Část 3. Klinický protokol - Vliv dezinfekčních přípravků na vlastnosti dentálních otiskovacích hmot
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



