-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chirurgická léčba parodontálních nitrokostních defektů kalcium sulfátem v kombinaci s beta-trikalcium fosfátem
Surgical Treatment of Periodontal Intrabony Defects with Calcium Sulphate in Combination with Beta Tricalcium Phosphate (Original Article – Clinical Observation Two Years Post-Surgery)
Background:
The study was designed to evaluate the clinical results of a composite material beta-tricalcium phosphate in combination with calcium sulphate in the treatment of periodontal intrabony defects. The combination of these materials is believed to aid in guieded tissue regeneration owing to their properties.Material and methods:
A total of 47 teeth with intrabony defectsin in 26 periodontitis patiens were treated with Forthoss® Vital (Biocomposites, Staffordshiere, UK). Clinical parameters were evaluated included changes in probing depth, clinical attachement levels loss and gingival recession at the baseline and two years postoperatively.Results and conslusion:
The mean in differences in mesurements between the baseline and two years postoperatively were a reduction of 2.07 ± 0.14 mm (p = 0.000) in case of probing depth and gain of 1.93 ± 1.36 mm (p = 0.000) in clinical attachement level; but an increase of 0.14 ± 0.73 mm (p = 0.571) in gingival recession. The study results showing that the treatment with the combination of beta-tricalcium phosphate and calcium phosphate and calcium sulphate led to a significantly favorable clinical improvement in periodontal intrabony defects two years after the surgery.Keywords:
beta-tricalcium phosphate – calcium sulphahate – periodontal regeneration – intrabony defekt – bone graft
Autori: S. Sukumar 1; I. Dřízhal 1; V. Paulusová 1; J. Bukač 2
Pôsobisko autorov: Stomatologická klinika LF UK a FN, Hradec Králové 1; Oddělení lékařské biofyziky LF UK, Hradec Králové 2
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 118, 2018, 2, s. 48-55
Kategória: Přehledový článek
Súhrn
Úvod:
Studie je zaměřena na zhodnocení klinických výsledků kombinovaného preparátu obsahujícího beta-trikalcium fosfát a kalcium sulfát pro léčbu parodontálních vnitrokostních defektů. Kombinace těchto materiálů dává předpoklad pro vyšší efekt řízené tkáňové regenerace při její aplikaci právě díky vlastnostem této kombinace.Materiál a metodika:
V práci jsou hodnotící výsledky léčby u 47 zubů s intrakostními defekty celkem u 26 pacientů. U všech byl použit preparát Fortoss® Vital (Biocomposites, Stafordshire, Velká Británie). Byly hodnoceny klinické parametry, což zahrnuje zjišťování změn hloubky parodontálních chobotů, úroveň gingivodentálního spojení, tedy pokles či nárůst (clinical attachement level) gingiválních recesů na začátku ošetření a po dvou letech od ošetření.Výsledky a závěr:
Průměrnou změnou po dvou letech od ošetření byla redukce hloubky parodontálních chobotů o 2,07 ± 1,14 mm (p = 0,000), nárůstek u gingivo-dentálního spojení o 1,93 mm ± 1,36 mm (p = 0,000) a změna gingiválních recesů o 0,14 ± 0,73 mm (p = 0,571). Výsledky této studie ukázaly, že léčba kombinací beta-trikalcium fosfátem a kalcium sulfátem signifikantně zlepšuje pozitivní klinické výsledky u intraoseálních defektů i po dvou letech po chirurgickém ošetření.Klíčová slova:
beta-trikalcium fosfát – kalcium sulfát – regenerace parodontu – intraoseální defekt – kostní štěpÚVOD
V parodontologické literatuře se setkáváme s mnoha chirurgickými technikami a různými materiály, které jsou úspěšně používány v léčbě intra-oseálních defektů. Ideální technika by mohla snadno a levněji docílit výsledků v regeneraci parodontu. Byly již doporučovány různé postupy ke zlepšení výsledků parodontální regenerace, než je otevřená laloková operace s debridementem (OFD – open flap debridement) [14, 16 , 24, 42]. Osvědčují se přírodní či syntetické materiály [5, 39, 41,43, 45, 46, 55] a řízená tkáňová regenerace (GTR) [3, 9, 10, 11, 29, 31]. Obecně můžeme shrnout, že GTR se ukázala jako nejlepší metoda předbíhající OFD v tom, že má lepší klinické výsledky [10, 30, 32, 34].
GTR umožňuje přesun buněk a hojení ran poškozeného parodontu, a tak dociluje regenerace ztracených parodontálních tkání. GTR umožňuje izolování kostní rány od měkkých tkání používáním membrán. Tímto zásahem se usnadňuje buňkám z parodontálních vazů obsadit prostor krevních koagul, která se formují mezi alveolární kostí a kořenem zubu. Izolace rány se dociluje za pomoci fyzikální překážky, jako jsou membrány [9, 13, 15, 26, 32, 34], které dělíme na resorbovatelné a neresorbovatelné. Lepších klinických výsledků se dosahuje při kombinaci kostního štěpu s použitím membrány. Kombinují se různé štěpy s různými membránami.
Zájem o kostní obnovu vyrůstá z přání vyplnit nitrokostní defekty, nebo i furkačním postižením vzniklé úbytky kosti doplnit než odstraňovat intaktní kostní hmotu. Předpokládá se, že aplikace kostních štěpů bude potenciálně manipulovat či startovat biologickou odpověď spíše do regenerace než do všeobecně častější reparace, která je pro hojení méně výhodná [17, 18]. Kostní náhradní štěpy mohou být zařazovány mezi lidskou kost a kostní náhrady. Jsou dále klasifikovány na autoštěpy, aloštěpy, xenoštěpy a aloplasty [33, 52].
Aloplasty jsou syntetické anorganické biokompatibilní kostní preparáty sloužící převážně jako výplňové materiály pro dříve vzniklé defekty alveolární kosti. Aloplasty mohou sloužit při kostní regeneraci v průběhu procesu zvaném osteokondukce. Beta-trikalcium fosfát je jeden z nejdříve známých vápenatých preparátů užívaných jako kostní štěp. Strukturálně porézní beta-trikalcium fosfát má tlakovou a tažnou pevnost jako má masivní kompaktní kost. Podléhá resorpci během šesti až osmnácti měsíců. Bohužel výměna beta-trikalcium fosfátu za kost nastává v nepředpověditelném časovém termínu. To znamená, že vždy je vytvořeno méně kosti, než bylo dodáno štěpového materiálu. Z tohoto důvodu beta-trikalcium fosfát bývá užíván jako pomocný materiál s ostatními méně resorbovatelnými kostními štěpy, nebo jako expandér pro autogenní kostní štěp [25, 52]. Právě tyto možnosti kombinace mají zajistit větší množství nově vytvořené kosti.
Jiná vápenatá sloučenina užívaná jako plnidlo do kostních defektů je kalcium sulfát. Ten byl užit Dreemanem v roce 1892 jako jeden z prvních materiálů k výplni defektů kosti [37]. Má pevnost v tlaku větší než kompaktní kost a působí také jako bioabsorpční membrána, která brání epiteliálním buňkám v prorůstání do míst, kde probíhá hojení parodontální rány [28, 47, 48, 49, 50], což činí z tohoto materiálu dalšího pomocníka spolu s materiály dodaného kostního štěpu pro realizaci řízené tkáňové regenerace (GTR) v parodontologii [36]. Cílem předložené publikace je retrospektivní průkaz klinických výsledků po dvou letech od provedení chirurgického výkonu při použití kompozitního materiálu beta-trikalcium fosfátu s kalcium sulfátem při léčbě nitrokostních defektů u pacientů s pokročilou parodontitidou.
SOUBOR PACIENTŮ
Soubor tvořilo 26 pacientů z oddělení parodontologie na Stomatologické klinice LF UK a FN v Hradci Králové, kteří byli celkově zdraví, s diagnostikovanou pokročilou parodontitidou a prokazatelnými nitrokostními defekty léčenými kompozitním materiálem Fortoss® Vital (Biocomposites, Stafordshire, Velká Británie). Věk pacientů se pohyboval v rozmezí 21 až 58 roků. Průměrný věk byl 42,27 ± 10,66 v době operace. V souboru bylo devět mužů a 17 žen, z tohoto počtu bylo osm kuřáků, kouřících do pěti cigaret denně. U probantů musel být přítomen nejméně jeden zub s hloubkou chobotu ≥ 5 mm a rentgenový nález prokazoval kostní defekt po provedené iniciální terapii. Nebyli zařazeni pacienti se systémovými chorobami, těhotné a kojící ženy ani ti, kteří prodělávali léčbu ovlivňující hojení ran a léčbu dokončovali v posledních šesti měsících. Byli také vyloučeni pacienti s hodnotou PBI vyšší než 15. Zuby musely být vitální či řádně endodonticky ošetřeny. Všichni probanti podepsali informovaný souhlas.
KONCEPCE STUDIE A KLINICKÉ POSTUPY
Všichni pacienti podstoupili iniciální fázi parodontologické terapie sestávající z instruktáže a dentální hygieny, scalingu a ohlazení kořenů v rozsahu celého chrupu, odstranění retenčních míst pro dentální plak. Dále byly upraveny zubní výplně a artikulační překážky. Celkem bylo zahrnuto do předložené studie 47 zubů s parodontologickými nitrokostními defekty, které byly dvoustěnné nebo třístěnné. Ve frontálním úseku jich bylo 33 a 14 u premolárů a molárů. Všechny byly ošetřeny stejným ošetřujícím, který dodržoval standardní klinické postupy. Vyšetření proběhlo těsně před chirurgickým zákrokem (hloubka chobotu, gingivální recesy, úroveň gingivodentálního spojení, krvácení po sondáži – BOPi). Jednalo se o základní a rentgenové vyšetření; za dva roky po výkonu se provedlo totéž vyšetření konečné.
Výsledky před výkonem a dva roky po chirurgickém výkonu umožnily porovnat stav před ošetřením a po ošetření a stanovit statisticky jeho efektivitu.
Chirurgický výkon se indikoval pouze za splnění požadavku, aby celková hodnota PBI indexu byla ≤ 15. V lokální anestezii byl odklopen plný muko-periostální lalok za použití okrajového řezu na bukální a orální straně každého operovaného zubu, který byl postižen. Ve frontálním úseku horní čelisti jsme používali papilu chránící řez v interdentálním prostoru. Vertikální uvolňující řezy byly použity tehdy, když byly indikovány. Po uvolnění laloku a získání přístupu se očistil povrch kořene Graceyho nebo univerzálními kyretami (Hu-Friedy, Chicago, Il., USA). Všechny granulace byly odstraněny z kostních defektů, které byly následně vypláchnuty fyziologickým roztokem. Povrchy kořenů byly kondiciovány 2,5% roztokem tetracyklin hydrochloridu po dobu dvou až tří minut, následně vypláchnuty fyziologickým roztokem. Implantovali jsme Fortoss® Vital v prášku, který jsme smíchali s destilovanou vodou na hustou kaši. Ta byla aplikována do defektů kosti a natlačena postupně do nejvyšší možné výšky tak, aby mohla být překryta uvolněným lalokem a co nejtěsněji sešita. Štěpový materiál byl natlačován úzkým raspatoriem silou prstů přes gázu do kostního defektu pod tlakem několik sekund. Přebytečná krev byla odstraněna gázou. Mukoperiostální lalok byl upraven a fixován resorbovatelným materiálem na ránu (Safil ®, Braun, Tuttlingen, SRN).
Pacienti byli instruování o pooperační péči. Vyplachovali roztokem Listerinu® (Johnson a Johnson, Maidenhead, Velká Británie) po dva týdny. Ordinována byla antibiotika (Amoxicilin 250 mg s klavulinovou kyselinou 125 mg nebo Claritromycinem 250 mg) na 7–14 dní. Stehy byly odstraněny za dva týdny, operovaná gingiva ošetřena 3% peroxidem. Pacienti byli vyšetřeni po třech, šesti a 12 měsících od operace a kontrolovala se hygiena při každé návštěvě, která byla zakončena supragingivální profylaxí.
KLINICKÁ VYŠETŘENÍ
Klinická měření byla prováděna dvěma vyšetřujícími; jeden z nich byl lékař, který realizoval chirurgické výkony. Oba vyšetřující opakovali měření po dvou letech od chirurgického výkonu. Klinické parametry byly změřeny těsně před výkonem (základní vyšetření) a za dva roky po výkonu (konečné vyšetření). Vyšetření zahrnovalo měření hloubky parodontálního chobotu (PD), gingivální recesus (GR), úroveň gingivodentálního spojení (CAL), krvácení po sondáži (BOP) vestibulárně, orálně, meziálně a distálně u všech postižených zubů. Dále se zjišťovala přítomnost plaku meziálně a distálně, zaznamenána byla viklavost. Měření se uskutečnilo kalibrovanou parodontologickou sondou (Williams color coded, Hu-Friedy, Chicago, IL, USA) na povrchu zubů, které byly postiženy.
RENTGENOVÉ VYŠETŘENÍ
Intraorální periapikální snímky se zhotovovaly před chirurgickým výkonem a za dva roky po chirurgickém výkonu. Rtg snímky byly zhotovovány jen z důvodu zjistění, zda defekt byl vyplněn, ale ne z důvodu měření, protože metoda nebyla standardizována. Rtg snímky po operaci bylo ale možno porovnat se snímky před operací, a tak zjistit, zda došlo k vyplnění defektu.
STATISTICKÁ ANALÝZA
Hodnoty získané před operací a dva roky po chirurgickém výkonu byly porovnány párovým testem a Fisherovým exaktním testem. Průměrné odchylky na jednotlivých měřených hodnotách (PD, GR,CAL) byly kalkulovány na jednotlivých površích a také na jednotlivých zubech. Hodnoceny byly všechny povrchy bez ohledu na to, zda hloubka parodontálního chobotu (PD) měla, či neměla PD ≥ 5 mm. To dovolilo stanovit efekt chirurgického výkonu také na zuby nepostižené parodontitidou. Výsledky byly vyjádřeny průměrnou standardní odchylkou. Významnost byla vyjádřena jako 0,05.
VÝSLEDKY
Z klinického hlediska se materiál užitý jako štěpový prokázal jako dobře zpracovatelný, snadno se aplikoval do kostěných defektů, dobře se spojoval s tkáněmi, tuhnul během několika minut a zřetelně byl biokompatibilní. Hojení rány bylo bez bolesti. Nikdo z pacientů si nestěžoval na bolest v prvním týdnu po operaci. Celkem osm pacientů se nedostavilo na všechny předepsané kontroly během dvou let po operaci, některé údaje sdělovali při poslední kontrole.
Pokles hloubky parodontálních chobotů byl zaznamenán z 26 u 25 pacientů. Počet poklesu pozitivních nálezů BOP se redukoval z 67 před chirurgickým výkonem na 28 po dvou letech od chirurgického výkonu. Počet nálezu dentálního plaku poklesl za stejnou dobu z 18 na 15.
Tabulky 1 a 2 ukazují rozdíly v hloubce parodontálního chobotu před výkonem a dva roky po výkonu. Provedeno bylo 188 měření před výkonem na 47 postižených zubech s měřenou hloubkou ≥ 5 mm. Dva roky po chirurgickém výkonu počet těchto zubů významně poklesl na počet 13. Tento pokles byl signifikantní pro frontální zuby, moláry a také vestibulární plochy postižených zubů.
Tab. 1. Hloubka parodontálních chobotů ≥ 5 mm před chirurgickou léčbou 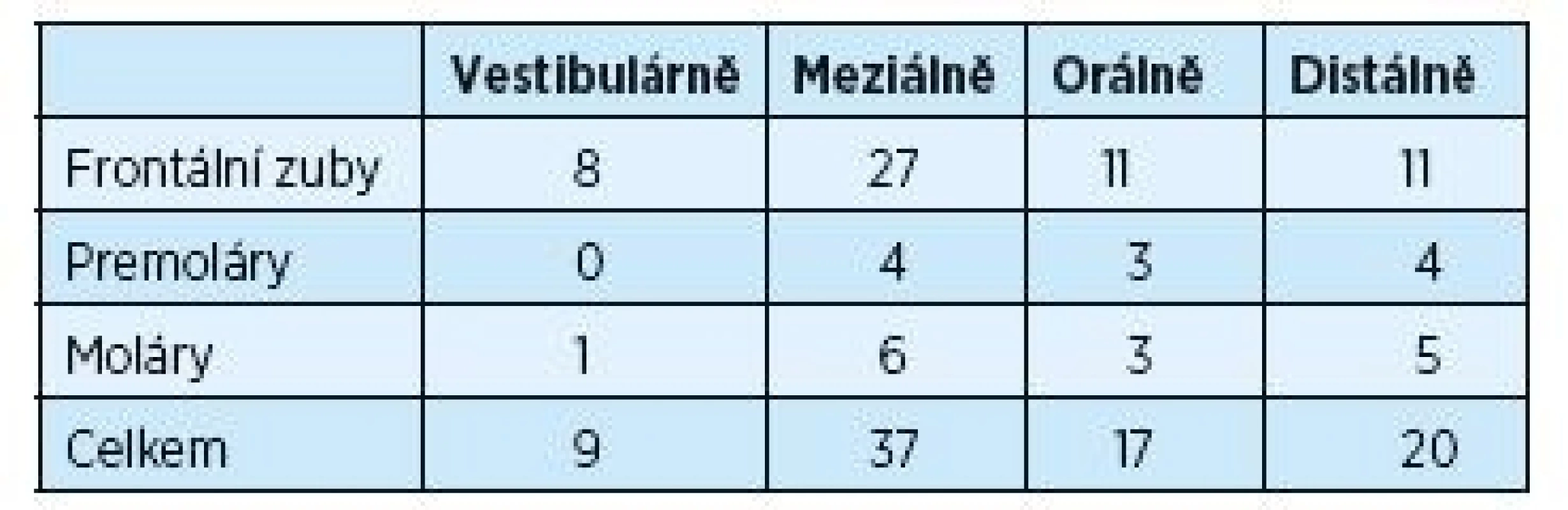
Tab. 2. Hloubka parodontálních chobotů ≥ 5mm po dvou letech po operaci 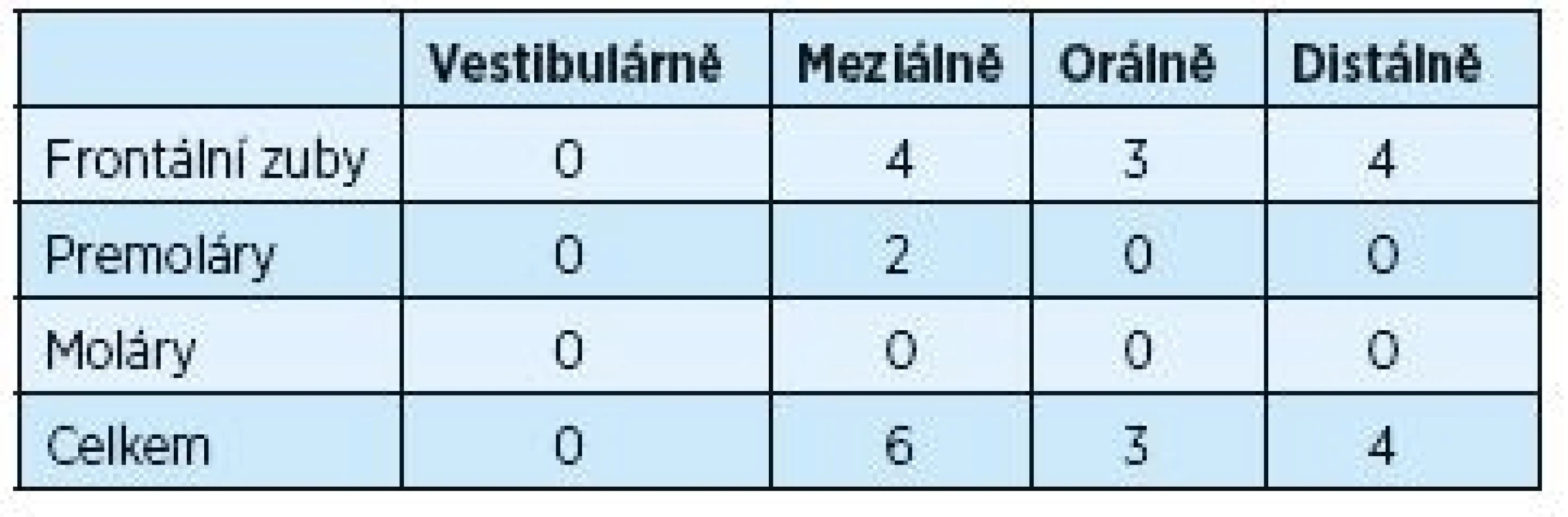
Tabulky 3 a 4 ukazují změny úrovně gingivo-dentálního spojení během dvouletého trvání experimentu. Měření úrovně gingivo-dentálního spojení bylo provedeno u chobotů hlubších než 5 mm, což bylo ve 105 případech. Po dvou letech se počet redukoval prakticky na polovinu. Opět se ukázal více signifikantní rozdíl u frontálních zubů a také na aproximálních plochách molárů.
Tab. 3. Měření úrovně dento-gingiválního spojení (CAL) ≥ 5 mm před chirurgickým výkonem 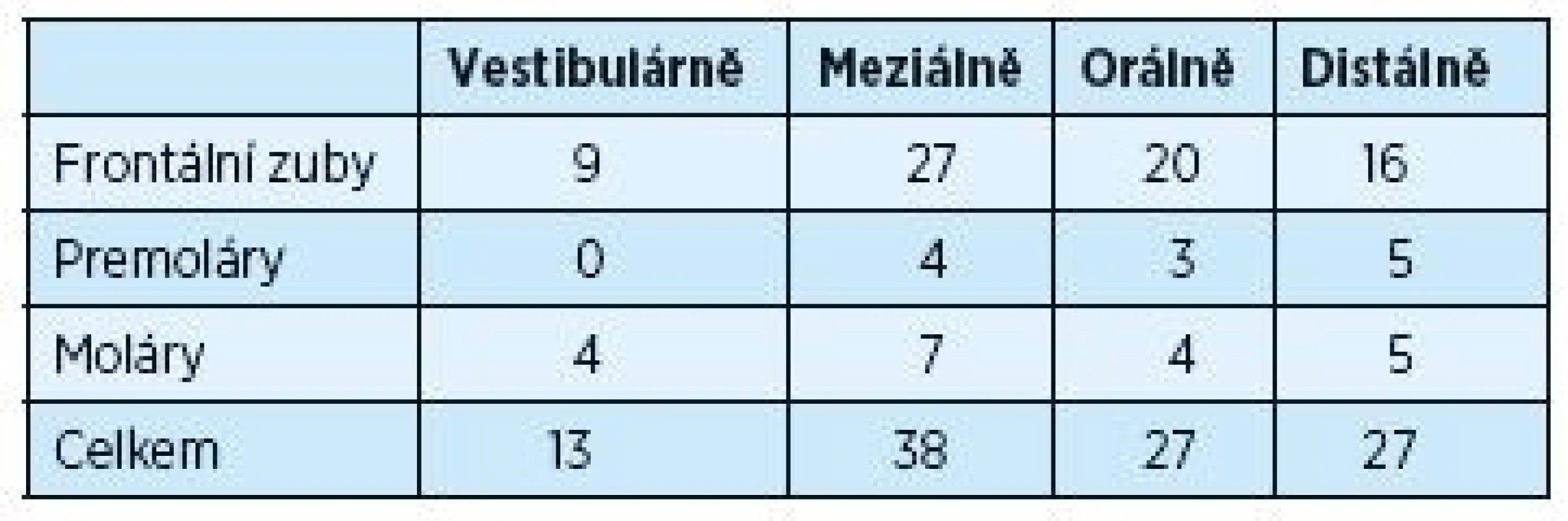
Tab. 4. Měření úrovně dento-gingiválního spojení dva roky po operačním výkonu 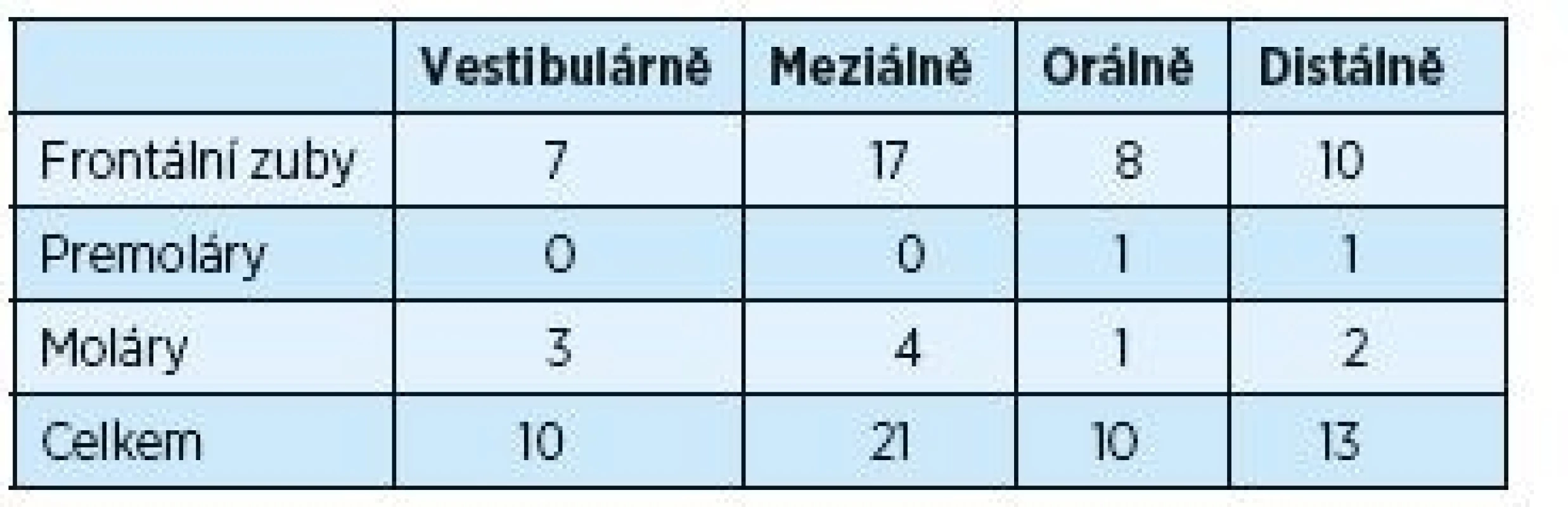
Průměrný rozdíl při měření hloubky parodontálních chobotů před chirurgickým výkonem a dva roky po chirurgickém výkonu byl snížen o 2,07 mm ± 1,14 (p = 0.000) a nárůst gingivo-dentálního spojení stoupl o 1,93 mm ± 1,36 mm (p = 0,000). Vzrůst gingiválních recesů (GR) po chirurgickém výkonu se navýšil o 0,14 ± 0,73 mm (p = 0,571). Podrobné výsledky jsou zobrazeny v tabulkách 5, 6 a 7. Tabulka 5 ukazuje průměrný nárůst gingiválního recesu na aproximálních plochách. Také se ukázalo, že maximální nárůst GR po dvou letech byl 3 mm a stejný byl pokles GR, také 3 mm.
Tab. 5. Průměrné rozdíly gingiválních recesů před operačním výkonem a po operačním výkonu za dva roky 
Tab. 6. Průměrné hloubky parodontálních chobotů (PD) před chirurgickým výkonem a za dva roky po výkonu 
Tab. 7. Průměrné hodnoty gingivo-dentálního úponu před a po chirurgickém výkonu po dvou letech 
V tabulce 6 jsou podchyceny změny hloubky parodontálních chobotů před výkonem a dva roky po výkonu. Prokázal se signifikantní pokles na aproximálních stranách zubů. Jako největší redukce hloubky chobotu byla zaznamenána hodnota 9 mm, ale také bylo zjištěno negativní prohloubení o 2 mm.
Tabulka 7 shrnuje šetření o změně úrovně gingivo-dentálního spojení, které prokázalo největší nárůst na aproximálních plochách zubů.
Nezaznamenaly se rozdíly mezi kuřáky a nekuřáky (p = 0,000) a přítomností nebo absencí dentálního plaku a pozitivního či negativního BOP. U jednoho pacienta došlo k prohloubení hloubky PD a poklesu CAL (úrovni muko-gingivální úrovně). Projevil se tak vliv různých kombinací negativních faktorů, jako kouření, nedostatečná ústní hygiena a nespolupráce uvedeného pacienta během iniciální fáze.
Intraorální snímky ukázaly vyplnění kostních defektů po chirurgické léčbě.
DISKUSE
Kostní štěpy jsou v současnosti uznávaným způsobem léčby kostních defektů zvláště v kombinaci s membránami. Používají se různé typy štěpů a také jejich kombinace s různě dobrými zkušenostmi. Odebrané štěpy přímo od pacienta (autotransplantáty) jsou považovány za zlatý standard mezi štěpy, protože indukují osteogenezi [22, 33]. Odběry těchto štěpů jsou ale limitovány možností a místem odběru, protože vždy jde o druhý chirurgický výkon. Aloplastické či syntetické štěpy nabízejí jenom částečnou náhradu při léčbě ztracené alveolární kosti. Nabízejí některé očekávané vlastnosti mechanické a také osteokonduktivní, ale jsou poměrně vzdálené od vlastností živého periostu a kosti. Slouží hlavně jako mechanická výplň. V předložené studii jsme hodnotili efektivitu nového kompozitního aloplastu na hojení parodontálních nitrokostních defektů.
Použití kompozitního štěpu obsahujícího beta-trikalcium fosfát a kalcium sulfát bylo popsáno jen v několika studiích [48, 51, 53, 54], kde bylo pozitivní hodnocení tohoto speciálního preparátu. V klinické práci publikované v roce 2009 Steinem a kol. [51] se prokázalo, že klinický efekt dvousložkové látky složené z beta-trikalcium fosfátu a kalcium sulfátu na spongiózní kosti byl daleko vyšší než pouhé odklopení laloku a ošetření kořenů pod dohledem zraku. Práce, která hodnotila tento materiál po 12 měsících, prokázala průměrný nárůst úrovně gingivo-dentálního spojení (CAL) o 3,0 ± 0,8 mm,zmenšení hloubky chobotů (PD) o 3,6 mm ± 0,7 mm [51]. Studie provedená na hraně kyčelní kosti u psů Podaropoulosem a kol. zjistila, že nárůst kosti v procentech v histologické a morfometrické studii byl 49,38 % [38]. Strukturálně porézní beta-kalcium fosfát má tlakovou a tahovou odolnost větší než kompaktní kost. Podléhá resorpci po šesti až 18 měsících. Kalcium sulfát má tlakovou odolnost větší než kompaktní kost. Může také sloužit jako bariérová membrána, což ji dělá ideálním materiálem pro použití jako doplňku k jiným používaným štěpům. Toto použití vyžaduje jen pět až sedm týdnů, aby se tento materiál plně vstřebal [4, 52].
Fortoss Vital, což je kombinace beta-trikalcium fosfátu a kalcium sulfátu, se začala užívat na léčbu parodontálních nitrokostních defektů na našem parodontologickém oddělení od roku 2003. Hlavním důvodem volby tohoto kostního štěpového materiálu místo konvenční membrány štěpové techniky bylo, že Fortoss Vital nabízí širší škálu možností. Pracovní postup je velmi snadný a dává možnost ošetření více parodontálních kostních defektů. Aplikace membrány není nutná, což zkracuje potřebný čas na ošetření, a snižuje tím ekonomické náklady.
Výsledky předložené studie ukázaly, že užitý štěpový materiál významně zlepšil klinické parametry po dvou letech od operace. Celkový pokles hloubky chobotů a nárůst úrovně gingivo-dentálního spojení byly statisticky významně zvýšeny a průměrný rozdíl gingiválních recesů před operací a za dva roky po ní byly statisticky nevýznamné. Ideální by bylo provést srovnávací studii s otevřenou lalokovou operací a provedením ošetření kořene pod přímým dohledem a užitím odlišného štěpu při léčbě intrakostních parodontálních resorpcí a porovnat výsledky tohoto postupu s výsledky dosaženými Fortoss Vitalem. Stupeň poklesu hloubky parodontálních chobotů se zvětšoval s hloubkou chobotů. U některých případů dosahovala redukce i 9 mm. Poklesu hloubky chobotů bylo docíleno u 25 pacientů z celkového počtu 26 ošetřených. V jednom případě došlo i ke zvětšení hloubky chobotů za dva roky po operaci. Lokální faktory a nespolupráce pacienta byly příčinou tohoto nepříjemného výsledku. Po dvou letech od operace jsme našli pokles hloubky chobotů s pozitivním BOP o polovinu. Rovněž se zjistil pokles nálezu plaku na aproximálních plochách zubů.
Několik studií hodnotilo efektivitu kalcium sulfátu a beta-trikalcium fosfátu v kombinaci s jinými materiály s dobrými klinickými výsledky. Studie Harrise z roku 2004 hodnotila složený kostní štěp (demineralizovaný mražený-sušený kostní alograft, kalcium sulfát, tetracyklin a porézní hydroxyapatit, kalcium sulfátovou membránu) a docílili pokles parodontálních chobotů (PD) o 4,7 mm, nárůst gingivo-dentálniho spojení (CAL) o 3,7 mm. Průměrný gingivální recesus vzrostl o 1 mm - to vše za čtyři až šest měsíců po operaci [23]. Ve studii Paolantonia a kol. byl použit kalcium sulfát jako bariéra, která prokázala průměrný pokles hloubky chobotů o 4,4 mm; průměrný nárůst gingivo-dentálního úponu byl 2,7 mm a zvýšení recesů (GR) bylo v průměru 1,6 mm za 12 měsíců po operaci [35]. Dobré výsledky měli také Döri a kol. v jednoroční studii, kdy docílili s krví obohacenou trombocyty, beta-trikalcium fosfátem a s GTR pokles hloubky chobotů (PD) 9,1 mm ± 0, 6 mm ku 3,3 mm (p < 0,001) a změnu v průměru nárůstu gingivo-dentálního spojení z 10,1 ± 1,3 mm na 5,7 ± 1,1 mm [12]. Většina z těchto studií použila klinické měření současně se standardizovanými rtg snímky pro porovnání. Naše předložená studie se liší od uvedených studií tím, že je dlouhodobá, podstatně delší než citované studie. Tyto krátkodobé studie se zaměřovaly jen na postižené partie okolo zubu, což může ovlivnit výsledky.
Měřicí metody ke zjištění proměnlivých hodnot klinického obrazu, jako jsou hloubka parodontálního chobotu, úroveň gingivo-dentálního spojení a gingivální recesy, se ukazují jako proměnlivé jednotky proto, že jsou odlišně vyšetřovány. K vyšetření se používají automatické či tlakově senzitivní sondy, také stenty jako referenční body potřebné pro stanovené úrovně gingivo-dentálního spojení [40]. Klíčovým problémem je konzistenční postup během celé studie. U předložené studie nebyly použity stentové otisky. Jako orientační body sloužily cemento-sklovinná hranice a okraj marginální gingivy. Ruční sondy byly použity k měření proměnlivých hodnot. Schopnost sondy pronikat do parodontálního chobotu je relativní vzhledem k několika faktorům, jako je tlak vyvinutý na sondu, průměr sondy a tonus gingivy [1, 27, 44]. V naší studii byla užita Williamsova sonda s barevným odlišením jednotlivých hloubek (Hu-Friedy Chicago, Il, USA), což zajistilo konzistenci průměru sondy. Klinické měření prováděli náhodně dva lékaři ve zvolených termínech, tedy před chirurgickým výkonem a dva roky po chirurgickém výkonu. Chirurg, který prováděl výkony, byl jedním ze dvou vyšetřujících lékařů. Oba lékaři střídavě prováděli vyšetření během dvouletého intervalu, což zajistilo objektivitu při vyšetřování sondou. Pevnost gingivální tkáně může být modifikována po umístění štěpové tkáně do defektu kosti, což může ovlivnit průnik sondy při měření a dává potom nepřesné výsledky [6].
Na rozdíl od většiny studií jsou v předložené publikaci zahrnuty i plochy, které nejsou postiženy, a to proto, že jsme zavzali do výzkumu i chirurgické výkony na zubu, kde nebyly změny. Ačkoliv standardní snímky nebyly zhotovovány v této studii, po dvou letech po chirurgickém výkonu docházelo k vyplnění defektu kosti podobným materiálem, který byl nezaměnitelný s přírodní kostí, a proto je považován za novou kost. Jisté problémy ale jsou spojeny s touto studií, jako rtg snímky nebo kontrola stavu zhojení defektu odklopením operovaného úseku, nepoužití stentu pro přesné měření úrovně gingivo-dentálního spojení a absence kontrolní skupiny, kde by byl použit jiný materiál či chirurgická technika.
Konvenční terapie je schopna kontrolovat parodontitidu. Odstraňování subgingiválního kamene spolu s vyhlazováním povrchu zubního kořene dovoluje docílení zmenšení hloubky parodontálních chobotů a nárůst úrovně gingivo-dentálního spojení. Parodontologická literatura je plná informací o možnosti snížit hloubku parodontálních chobotů u parodontitidy pouze odstraňováním zubního kamene, rout planingem a hygienou [2, 8, 19, 20]. Pokles hloubky parodontálních chobotů je dán částečně retrakcí gingivy projevující se jako gingivální recesus. Podkladem je zánět, který je výše uvedenými procesy odstraněn a dochází navíc také ke zvýšení úrovně gingivo-dentálního spojení [2, 8, 19, 20]. V přehledné evidenci based review Cobb kalkulují průměrné zmenšení hloubky parodontálních chobotů a nárůst gingivo-dentálního spojení, které bylo docíleno pouze root planingem v místech iniciální hloubky parodontálních chobotů 4–7 mm nebo i větších hloubek. Uvádí průměrné zmenšení 1,29 mm a 2,16 mm ve druhém případě, tedy při větší hloubce chobotů. Nárůst gingivo-dentálního spojení vzrostl v těchto případech o 0,55 mm a 1,29 mm v druhém případě [8].
Regenerativní postupy v parodontologii se indikují pouze tehdy, když je realizována iniciální fáze v celém rozsahu. Znamená to odstranění zubního kamene a ukončení root planingu a správně realizovanou ústní hygienou, čímž se docílí optimální konzistence gingivy, která se stane pevnou a naléhá na povrch zubu. Tyto procedury mohou vylepšit také vyplnění kostních defektů a dále zkvalitnění podpůrných struktur. Toto vše se odrazí v dlouhodobé pozitivní prognóze takto ošetřených zubů.
ZÁVĚR
Léčba syntetickými kostními štěpy obsahujícími kombinaci beta-trikalcium fosfátu a kalcium sulfátu vede k signifikantnímu vylepšení klinického stavu parodontálních intrakostních defektů po dvou letech od operativního ošetření. K definitivnímu ověření výsledků je ale potřeba zjistit stav po delší době sledování, podpořit motivaci pacienta a také získat větší soubory. Tím by se zlepšila validita publikace.
Tato práce byla podporována výzkumným grantem FN HK MZO 00179906.
Doc. MUDr. Ivo Dřízhal, CSc.
Stomatologická klinika LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: drizhali@volny.cz
Zdroje
1. Armitage, G. C., Svaberg, G. K., Löe, H.: Microscopic evaluation of clinical measureement of connective tissue attachment levels. J. Clin. Periodontol., 1977, 4, s. 173–190.
2. Baderstern, A., Nilveus, R., Egelberg, J.: Effect of nonsurgical periodontal therapy. I: moderate advanced periodontitis. J. Clin. Periodontol., 1981, 8, s. 57–72.
3. Becker, W., Becker, B. E.: Treatment of mandibular 3-wall intrabony defects by flap debridement and expanded polytetrafluorethylene barier membranes. Long-therm valuation of 32 treated patiens. J. Periodontol., 1993, 64, (11 Suppl.), s. 1138–1144.
4. Bell, W. H.: Resorption rates of bone and bone substitutes. Oral. Surg., 1964, 17, s. 650–657.
5. Bowen, J. A., Melonnig, J. T., Gray, J. L., Towle, H.T.: Comparison of decalcified freeze-dried bone allograft and porous particulatehydroxylapatite in human periodontal osseous defects. J. Periodontol., 1989, 60(12), s. 647–654.
6. Camargo, P. M., Lekovic, V., Weinlander, M., et al.: A controlled re-entry study on the effectiveness of bovine porous bone mineral used in combination with collagen membrane of porcine origin in the treatment of intrabony defects in humus. J. Clin. Periodontol., 2000, 27, s. 889–896.
7. Caton, J., Nyman, S., Zander, H.: Histometric evaluation of periodontal surgery: II. Connective tissue attachement levells after four years regenerative procedures. J. Clin. Periodontol., 1980, 7, s. 224–231.
8. Cobb, C. M.: Non-surgical pockkets therapy: II. Mechanical. Ann. Periodontol., 1996, 1, s. 443–490.
9. Cortellini, P., Pini Prato, G., Tonetti, M. S.: Periodontal regeneration of human intrabony defects. I. Clinical measures. J. Periodontol., 1993, 64, s. 254–260.
10. Cortellini, P., Labriola, A., Tonetti, M. S.: Regenerative periodontal therapy in intrabony defects: state of art. Minerva Stomatol., 2007, 56(10), s. 519–539.
11. Cortellini, P., Pini Prado, G., Tonetti, M. S.: Periodontal regeneration of human intrabony defects with bioresorbable membranes. A controlled clinical trial. J. Periodontol., 1996, 67(3), s. 217–223.
12. Döri, F., Hoszár, T., Nikolidakis, D., et al.: Effect of plattelet-rich plasma on the healing of intrabony defects treated with beta-tracalcium phosphatte and expanded polytetrafluoroethylene membranes. J. Periodontol., 2008, 79(4), s. 660–669.
13. Dřízhal, I., Červinka, M., Taha, M., Strnad, L.: Řízená tkáňová regenerace – uplatnění v parodontologii. Quintessenz – Parodontologie, 2001, 2(11), s. 18–25.
14. Durwin, A., Chamberlein, H., Garrett, S., Rebvert, S., Egelberger, J.: Healing after treatment of periodontal intraosseous defects IV. J. Clin. Periodontol., 1985, 12, s. 525–539.
15. Fassmann, A.: Řízená tkáňová regenerace a kostní regenerace ve stomatologii. Praha: Grada Publishing, 2002, s. 13–14.
16. Froum, S. J., Coran, M., Thaller, B., Kusher, L., Scopp, I. W., Stahl, S. S.: Periodontal healing following open debridement flap procedures. Clinical assessment of soft tissue and osseous repeat. J. Clin. Periodontol., 1982, 53, s. 8–14.
17. Garrett, S., Bogle, G.: Periodontal regeneration with bone graft. Curr. Opin. Periodontol., 1994, s. 168–177.
18. Garrett, S.: Periodontal regeneration around natural teeth. Ann. Periodontol. (World Workshop in Periodontics), 1996, 1, s. 621–666.
19. Greenstein, G.: Non surgical periodontal therapy in 2000: a literature review. J. Amer. Dent. Assoc., 2000, 131, s. 1580–1592.
20. Greenstein, G.: Periodontal response to mechanical nonsurgical therapy: a review. J. Periodontol., 1992, 63, s. 118–130.
21. Haghighati, F., Saaveh, G.: Essential in peroiodontal regeneration. JDT 2007, 4, s. 78–86.
22. Hanes, P. J.: Bone replacement grafts for the treatment of periodontal intrabony defects. Oral Maxillofac. Surg. Clin. North Am., 2007, 19(4), s. 499–512.
23. Harris, R. J.: Clinical evaluation of a composite bone graft with a kalcium sulfate barrier. J. Periodontol., 2004, 75(50), s. 685–692.
24. Heitz-Mayfield, L. J., Trombelli, I., Heitz, F., Needleman, I., Moles, D.: A systematic review of the effect of surgical debridement vs. nonsurgical debridement for the treatment of chronic periodontitis. J. Clin. Periodontol., 2002, 29(3), s. 92–102.
25. Holinger, J. O., Brekke, J.: Role of the bone substitutes. Clin. Orthoped., 1996, 324, s. 55–56.
26. Jepsen, S., Eberhard, J., Herrera, D., Needleman, I.: A systemic review of guided tissue regeneration for periodontal furcation defects. What is the effect of guided tissue regeneration compared with surgical debridement in the treatment of furcation defect. J. Clin. Periodontol., 2002, 29(3), s. 103–116.
27. Keagle, J. G., Garnic, J. J. U., Searle, J. R., King, G. E., Morse, P. K.: Gingival resistence to probing forses, I. Determination of optimal probe diameter. J. Periodontol., 1989, 60, s. 167–171.
28. Kim, C. K., Kim, H. I., Chai, J. K., et al.: Effect of calcium sulfate implant with calcium sulfate barrier on periodontal healing in 3-wall intrabony defects in dogs. J. Periodontol., 1998, 69(9), s. 982–975.
29. Laurell, I., Falk, H., Fornell, J., Johrd, G., Gottlow, J.: Clinical use of a bioresoble matrix barrier in guided tissue regeneration therapy. Case serieres. J. Periodontol., 1994, 65(10), s.967–975.
30. Laurell, L., Gottlow, J., Zybuty, M., Persson, R.: Treatment of intrabony defects by different surgical procedures. A literature review. J. Periodontol., 1998, 69(3), s. 303–313.
31. Mattson, J. S., McLey, L. L., Jabro, M. H.: Treatment of intrabony defects with collagen membrane barriers. Case reports. J. Periodontol., 1995, 66(7), s. 635–645.
32. Murphy, K. G., Gunsoley, J. C.: Guided tissue regeneration for the treatment of periodontal intrabony and furcation defects. A systematic review. Ann. Periodontal., 2003, 8(1), s. 266–302.
33. Nasr, H. F., Aichelmann-Reidy, M. E., Yukna, R. A.: Bone and bone substitutes. Periodontology, 2000, 1999, 19, s.74–86.
34. Needleman, I., Worthington, H. V., Giedrys-Leeper, E., Tucker, R. D.: Guided tissue regeneration for periodontal intrabony defects. Cochrane Database Sytematic Review 2006, 2, No.: CD001724.
35. Paolantonio, M., et al.: Surgical treatment of periodontal intrabony defects with calcium sulfate implant and barrier versus collagen barrier or open flap debridement alone: A 12 months randomized controled clinical trial. J. Periodontol., 2008, 79(10), s. 1886–1893.
36. Pecora, G., Andreana, S., Margarone, J., Covani, U., Sottosanti, J.: Bone regeneration with a kalcium sulfate barrier. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endo., 1997, 84, s.424–429.
37. Peltier, L. F.: The use of plaster of Paris to fill defects in bone. Clin. Orth., 1961, 21, s. 1–31.
38. Podaropoulos, L., Veis, A. A., Papadimitriou, S., Alexandridis, C., Kaly, D.: Boneregeneration using beta-tricalcium fosfate in a kalcium sulfate matrix. J. oral Impl., 2009, 35(1), s. 28–36.
39. Quintero, G., Melloning, J., Gambili, V., Pelea, B.: A six-month clinical evaluation of decalcified freeze dry bone allograft in periodontal osseous defects. J. Periodontol., 1982, 53, s. 726–730.
40. Reddy, M. S., Jeffcoat, M. K.: Methods of essesing of essesing periodontal regeneration. Periodontology, 2000, 1999, 19, s. 87–103.
41. Renvert, S., Garrett, S., Schallhorn, R., Egelberg, J.: Healing after treatment of periodonta lintraossous defects. III. Effect of ossous rafting and citric acid conditioning. J. Clin. Periodontol., 1985, 12, s. 441–455.
42. Renvert, S., Nilveus, T., Egelberg, J.: Healing after treatment of periodontal intraosseous defects. V. Effect of root planing versus flap surgery. J. Clin. Periodontol., 1985, 12, s. 619–629.
43. Reynolds, M. A., Aiuchlmann-Reidy, M. E., Branch-Mays, G. L., Gunsolley, J. C.: The efficacy of bone replacement grafts in the treatment of periodontal ossous defects. A systematic review. Ann. Periodontol., 2003,8, s. 227–265.
44. Robinson, P. J., Vitek, R. M.: The relationship between gingival inflammation and resistance in probe penetration. J. Periodont. Res., 1979, 14, s. 239–243.
45. Rosen, P. S., Reynolds, M. A., Bowers, G. M. The treatment of intrabony defects with bone grafts. Periodontology 2000, 2000, 22, s. 88–103.
46. Rosenbreg, E., Rose, L. F.: Biological and clinical consideration for autograft and allografts in periodontal regeneration therapy. Det. Clin. North Am., 1988, 42, s. 467–490.
47. Sottosand, J. S.: Aesthetics extraction with calcium sulfate and the principles of guided tissue regeneration. Pract. Periodont. Aesth. Dent., 1993, 5, s. 61–69.
48. Sottosanti, J.: Calcium sulfate: a biodegradace and biocompatible barrier for guided tissue regeneration. Compend. Contin. Educ. Dent., 1992, 13, s. 226–234.
49. Sottosanti, J. S.: Calcium sulfate an aid to periodontal, implant and restrative therapy. Calif. Dent. Assoc. J., 1992, 20, s. 45, 60, 62.
50. Sottosanti, J. S.: Calcium sulfate: a valuace addiction to the implant/bone regeneration complex. Dent. Implantol. Update, 1997, 8, s. 25–29.
51. Stein, J. M., Fickl, S., Hoischen, S., Ocklenburg, C., Smeets, R.: Clinical evaluation of a biphasic kalcium composite rafting material in the treatment of human pedriodontal intrabony defects: a 12 month randomized control clincal trial. J. Periodontol., 2009, 80(11), s. 1774–1782.
52. Sukumar, S., Dřízhal, I.: Bone grafts in periodontal therapy. Acta Medica (Hradec Kralove) 2008, 51(4), s. 203–207.
53. Tözüm, T. F., Erdal, C., Saygun, I.: Treatment of periapical dental implant patology with guided tissue regeneration – case report. Turk. J. Med. Sci., 2006, 36(3), s.191–196.
54. Tözüm, T. F., Sencimen, M., Ortakoglu, K., Ozdemir, A., Aydin, O., Keles, M.: Diagnosis and treatment of a large periapical implant lesion associated with adjcent natural tooth: a case report. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endol., 2006, 101(6), s. 132–138.
55. Yukua, R. A.: Osseous defekt responses to hydroxyl apatite rafting versus open debridement. J. Clin. Periodontol., 1989, 16(7), s. 398–402.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2018 Číslo 2
-
Všetky články tohto čísla
- Konference úsměv 2018
- Rejstříky
- Rejstříky
- Neobvyklé postižení parodontu stálého horního středního řezáku vyvolané implantací cizorodého materiálu (lokalizovaná destrukce parodontu)
- Primární Sjögrenův syndrom
- Chirurgická léčba parodontálních nitrokostních defektů kalcium sulfátem v kombinaci s beta-trikalcium fosfátem
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Primární Sjögrenův syndrom
- Neobvyklé postižení parodontu stálého horního středního řezáku vyvolané implantací cizorodého materiálu (lokalizovaná destrukce parodontu)
- Chirurgická léčba parodontálních nitrokostních defektů kalcium sulfátem v kombinaci s beta-trikalcium fosfátem
- Konference úsměv 2018
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



