-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Farmakoterapie recidivující aftózní stomatitidy u pacientů s geneticky podmíněnou sníženou schopností metabolizovat kyselinu listovou – pilotní studie
Pharmacotherapy of recurrent aphthous stomatitis in patients with genetically impaired ability to metabolize folic acid – pilot study
Introduction, aim: When treating recurrent aphthous stomatitis (RAS), a so-called Skach‘s therapy, in which patients are administered folic acid and vitamin B6, is recommended. The human body can process folic acid only in the form of active folate (vitamin B9); methylenetetrahydrofolate reductase (MTHFR) plays an important role in metabolic transformation, function of this enzyme is fundamentally influenced by gene polymorphisms. The aim of the study was to verify the assumption that administration of the active form of folic acid together with vitamins B6 and D3 can positively affect the frequency of aphthae/ulcers eruption and the course of their healing in patients with RAS.
Methods: In the pilot study, we clinically examined ten patients in whom we analyzed haplogenotypes in the MTHFR gene. Conditions for inclusion of patients with RAS were: age 18–50 years, Czech nationality, genetically impaired ability to metabolize folic acid (poor metaboliser – PM or intermediate – IM) and the absence of systemic disease (Crohn‘s disease, Behçet‘s disease, kidney disease and other diseases). Pharmacotherapy in a modified double-crossed blind study (cross-over design) ran from spring 2018 and lasted three months. Patients were treated with active folate (glucosamine salt 5-methylfolate), vitamins B6 and D3 in the three-phase regimen, they were not allowed to use any other food supplements during the therapy. They kept daily records of their health status and possible risk factors for RAS and were examined clinically and in the laboratory at monthly intervals.We recorded both the subjective evaluation of the effect of the therapy by patients and the obtained laboratory
data, which were evaluated by statistical software Statistica v.13.Results: The study was comprised of three men and seven women with RAS, aged 28 to 47 years; according to the MTHFR gene profile, three were defined as PM and seven as IM of folic acid. Based on the subjective assessment, one patient reported a deterioration, two patients did not observe a change in their health state during therapy, and seven were satisfied because they had a lower or no aphthae eruption and/or healing time was significantly shorter. Subjective evaluation of therapy positively correlated with objective clinical finding (r = 0.993, P < 0.001). The laboratory analysis showed that administration of vitamin D3 significantly increased serum concentrations of 25-OH D3 from low/limit to optimal values, median of concentrations prior to study was 54.2 nmoll-1, just before administration 68.1 nmoll-1 vs. month after administration 96.6 nmoll-1 (norm: 50–175 nmoll-1), (P ≤ 0.01). The other studied parameters, such as concentration of folic acid in serum, homocysteine, ALT, AST, and blood count, were within the physiological range before and after therapy.
Conclusion: The proposed modification of Skach‘s vitamin therapy seems to be appropriate for the treatment of patients suffering from RAS with genetic predisposition for reduced MTHFR function as during our observation, 70% of patients experienced subjective and objective improvement of their state.
Keywords:
oral mucosa disease – Pharmacogenetics – Metabolism – Folic acid
Autori: P. Bořilová Linhartová 1,2; A. Fassmann 1; J. Linhartová 1,3; L. Izakovičová Hollá 1,2
Pôsobisko autorov: Stomatologická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice u sv. Anny, Brno 1; Ústav patologické fyziologie, Lékařská fakulta Masarykovy univerzity, Brno 2; Lékárna Plumlov, s. r. o., Plumlov 3
Vyšlo v časopise: Česká stomatologie / Praktické zubní lékařství, ročník 119, 2019, 1, s. 4-11
Kategória: Původní práce
Súhrn
Úvod a cíl: Při terapii recidivující aftózní stomatitidy (RAS) se doporučuje tzv. Škachova kúra, při které pacienti užívají kyselinu listovou a vitamin B6. Kyselina listová je v organismu využitelná pouze ve formě aktivního folátu (vitamin B9); v metabolické přeměně sehrává důležitou úlohu enzym methylentetrahydrofolát reduktáza (MTHFR), jehož funkčnost je zásadně ovlivněna genovými polymorfismy. Cílem práce bylo ověřit předpoklad, že podání aktivní formy kyseliny listové spolu s vitaminy B6 a D3 může pozitivně ovlivnit četnost výsevu aft i průběh jejich hojení u pacientů s RAS.
Metody: V rámci pilotní studie jsme klinicky vyšetřili deset pacientů, u nichž jsme analyzovali haplogenotypy v genu MTHFR. Podmínky pro zařazení pacientů s RAS byly: věk 18–50 let, česká národnost, geneticky podmíněná snížená schopnost metabolizovat kyselinu listovou (špatný metabolizátor – PM nebo intermediární – IM) a nepřítomnost systémového onemocnění (Crohnova choroba, Behçetova choroba, onemocnění ledvin a další nemoci). Farmakoterapie v upraveném designu dvojitě zaslepené zkřížené studie (cross-over design) probíhala od jara 2018 v délce trvání tří měsíců. Pacientům byl ve třífázovém schématu podáván aktivní folát (glukosaminová sůl 5-methylfolátu), vitaminy B6 a D3, po dobu terapie nesměli užívat žádné jiné potravinové doplňky. Vedli si denní záznamy o svém zdravotním stavu a možných rizikových faktorech RAS a byli v měsíčních intervalech klinicky i laboratorně vyšetřeni. Zaznamenali jsme jak subjektivní hodnocení efektu terapie pacienty, tak i získaná laboratorní data, která byla vyhodnocena statistickým softwarem Statistica v.13.
Výsledky: Do studie jsme zařadili tři muže a sedm žen s RAS ve věku 28 až 47 let; tři z nich byli podle genového profilu MTHFR definováni jako PM a sedm jako IM kyseliny listové. Podle subjektivního hodnocení jedna pacientka udala zhoršení stavu, dva pacienti nepozorovali během terapie změnu svého zdravotního stavu a sedm osob bylo spokojeno, neboť u nich došlo k méně častému/žádnému výsevu aft a/nebo doba hojení byla významně kratší. Subjektivní hodnocení terapie pozitivně korelovalo s objektivním klinickým nálezem (r = 0,993, p < 0,001). Z laboratorní analýzy vyplynulo, že podání vitaminu D3 signifikantně zvýšilo sérové koncentrace 25-OH D3 z nízkých/limitních na optimální hodnoty. Medián koncentrací před zahájením studie byl 54,2 nmoll-1, těsně před podáním 68,1 nmoll-1 versus měsíc po podání 96,6 nmoll-1 (norma: 50–175 nmoll-1), (p ≤ 0,01). Další sledované parametry, jako koncentrace kyseliny listové v séru, homocysteinu, ALT, AST a krevní obraz, byly u pacientů ve fyziologickém rozmezí před terapií i po ní.
Závěr: Navržená modifikace Škachovy vitaminové kúry se zdá být vhodná pro léčbu pacientů s RAS, u kterých je genetická predispozice ke snížené funkci enzymu MTHFR, neboť během našeho pozorování došlo u 70 % pacientů k subjektivnímu i objektivnímu zlepšení stavu.
Klíčová slova:
onemocnění sliznice dutiny ústní – farmakogenetika – metabolismus – kyselina listová
Úvod
Recidivující aftózní stomatitida (RAS) je chronické onemocnění sliznice dutiny ústní s dosud nejasnou etiopatogenezí, které postihuje až 25 % populace [1]. Jsou známy pouze rizikové faktory, mezi které se řadí genetická predispozice [2], imunopatologické reakce a přítomnost infekčního agens, endokrinní i psychické vlivy (stres), nutriční deficience (železo, kyselina listová, vitaminy skupiny B) a lokálně působící faktory (přikusování, poranění při stomatologickém ošetření a jiné). Aftám podobné ulcerace jsou symptomem mnoha systémových onemocnění, např. Crohnovy choroby (CD), Behçetovy choroby (BD), ulcerózní kolitidy, celiakie, neu-tropenie a dalších.
Kauzální léčba RAS dosud neexistuje, v současnosti máme k dispozici pouze symptomatickou terapii. Jedním z léčebných přístupů je podání tzv. Škachovy vitaminové kúry [3] s různými modifikacemi (délka a opakování terapie). Podávají se při ní preparáty obsahující kyselinu listovou (Acidum folicum 2x denně 1 tbl.), vitaminy B6 (Pyridoxin 3x denně 1 tbl.) a B12 (intramuskulárně 300 µg obden), a to nikoliv kontinuálně, ale intermitentně s pauzami, například ve schématu: třítýdenní kúra – tři týdny pauza – třítýdenní kúra – šest týdnů pauza – třítýdenní kúra.
Na podání Škachovy vitaminové kúry však pozitivně nereagují všichni pacienti s RAS, což může být dáno sníženou schopností jejich organismu metabolizovat některé z jejích složek. Kyselina listová je v organismu využitelná pouze ve formě aktivního folátu (L-5-methylfolát, vitamin B9); v metabolické přeměně sehrává důležitou úlohu enzym methylentetrahydrofolát reduktáza (MTHFR). Snížené koncentrace 5-methylfolátu jsou pozorovány u pacientů s diabetem mellitem, CD, atrofickou gastritidou, hyperhomocysteinemií a jinými chorobami. Za rizikové faktory spojené s nedostatečnou koncentrací L-methylfolátu je považována obezita i malnutrice, kouření, expozice těžkým kovům a toxinům, užívání alkoholu a některých léčiv (orální kontraceptiva, orální antidiabetika, antikonvulziva, metotrexát) a také polymorfismy v genech kódujících enzymy zapojené v metabolizaci kyseliny listové. Z nich je nejvíce studována variabilita v genu pro methylentetrahydrofolát reduktázu, konkrétně funkční varianty C677T (rs1801133, Ala222Val) a A1298C (rs1801131, Glu429Ala).
Přítomnost minoritní alely T C677T v sekvenci genu MTHFR vede při jeho expresi ke vzniku termolabilního enzymu. Také polymorfismus A1298C v genu MTHFR byl asociován se sníženou aktivitou enzymu, se změnou distribuce intracelulárního folátu a koncentrací homocysteinu [4]. U heterozygotů C677T a homozygotů AA A1298C (+-/- - haplogenotyp) je aktivita enzymu MTHFR mírně vyšší (přibližně 65%) než u heterozygotů pro obě varianty (přibližně 50%), proto byl A1298C polymorfismus popsán jako faktor přispívající k výslednému fenotypu [5]. Po analýze genotypů obou variant lze jednotlivým kombinacím (haplogenotypům, v tomto případě diplotypům) přiřadit míru ztráty funkce enzymu neboli teoretický fenotyp (tab. 1).
Tab. 1. Předpokládaná funkce enzymu MTHFR podle haplogenotypu C677T a A1298C variant genu MTHFR. Definice fenotypu studovaných pacientů s RAS a jejich výsledné subjektivní hodnocení terapie.
Tab. 1 Predicted function of MTHFR enzyme by haplogenotype composed from MTHFR C677T and A1298C variants. Definition of phenotype of studied patients with RAS and their final subjective evaluation of therapy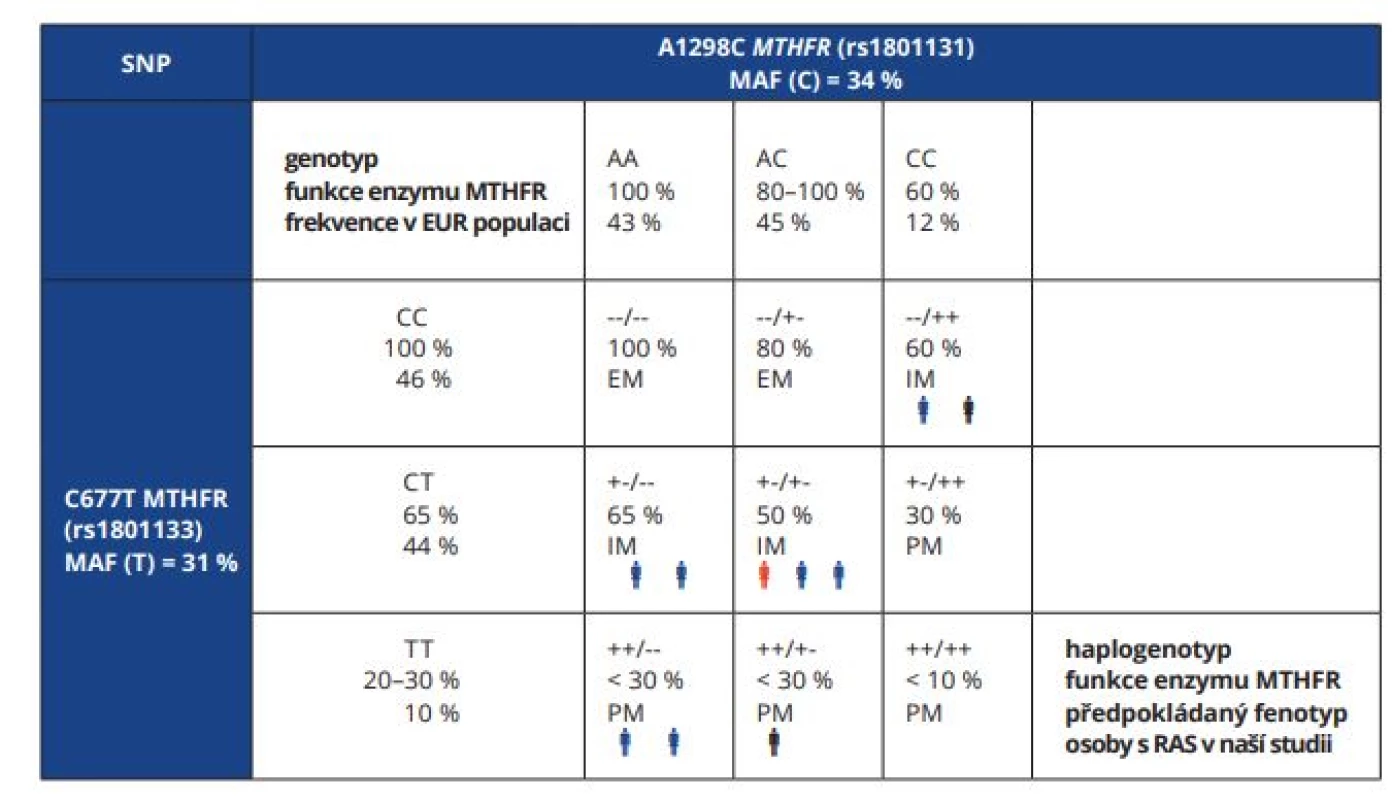
+ minoritní alela;
- majoritní alela;
SNP – jednonukleotidový polymorfismus; MAF – frekvence minoritní alely; EM – normální metabolizátor; IM – intermediární metabolizátor; PM – špatný metabolizátor; modrá/černá/červená osoba, pozitivní/neutrální/negativní hodnocení terapie subjektem Pozn.: Alelické a genotypové frekvence pro evropskou populaci jsou uvedeny podle NCBI databáze.
+ minor allele;
- major allele;
SNP – single nucleotide polymorphism; MAF – minor allele frequency; EM – extensive (normal) metaboliser; IM – intermediate metaboliser; PM – poor metaboliser; blue/black/red person, positive/ neutral/negative evaluation of therapy by a subject Note: Allelic and genotype frequencies for the European population are listed according to the NCBI databaseVitamin D3 (cholekalciferol) je významným imunoregulátorem, neboť má jak protiinfekční a imunopotenciační, tak také imunosupresivní účinky. Vzhledem k tomu, že je u pacientů s RAS i BD často pozorována deficience vitaminu D [6], zdá se mít jeho suplementace potenciál v léčbě i profylaxi těchto stavů [7].
Cílem práce bylo ověřit předpoklad, že podání aktivní formy kyseliny listové spolu s vitaminy B6 a D3 může pozitivně ovlivnit četnost výsevu aft i průběh/rychlost jejich hojení u pacientů s RAS, kteří mají sníženou aktivitu enzymu MTHFR.
Metodika
Studované osoby
Podmínky pro zařazení pacientů s RAS byly: věk 18–50 let, česká národnost, nepřítomnost systémového onemocnění (CD, BD, onemocnění ledvin a dalších chorob) a geneticky podmíněná snížená schopnost metabolizovat kyselinu listovou (špatný metabolizátor – PM nebo intermediární metabolizátor – IM). Pacienti s alergií na laktózu nebyli do studie zařazeni vzhledem k tomu, že podávaný přípravek obsahoval laktózu.
Podepsaný informovaný souhlas byl schválen etickou komisí FNUSA Brno. Pacienti nebyli finančně ani jinak za účast ve studii odměněni.
Klinické vyšetření a laboratorní analýza
Před zařazením do studie byli pacienti detailně vyšetřeni zkušeným zubním lékařem. Nemocní se podrobili i klinickému a laboratornímu imunologickému vyšetření v Ústavu klinické imunologie a alergologie FNUSA v Brně, kde byly sledovány zejména parametry k potvrzení/vyloučení systémových onemocnění, jako je CD, BD, ulcerózní kolitida, celiakie a další, které jsou spojované s tvorbou aftám podobných ulcerací nejenom na sliznici dutiny ústní.V průběhu studie byly pacientům provedeny odběry žilní krve podle protokolu před zahájením první fáze a po jejím ukončení a po druhé a třetí fázi (celkem čtyři odběry). Ve stejných časech byli pacienti opakovaně vyšetřeni zubním lékařem a byl jim podán individuálně vyráběný léčivý přípravek (IVLP), na začátku druhé fáze i tableta s vitaminem D3.Po ukončení studie všichni pacienti obdrželi závěrečnou zprávu o výsledcích vyšetření. V laboratoři FNUSA v Brně byly standardními metodami analyzovány následující parametry: krevní obraz + diferenciál, glomerulární filtrace, koncentrace Ca2+, kreatininu, homocysteinu, kyseliny listové, vitaminu B12, ALT, AST a 25-OH D3.
Izolace DNA a genetická analýza
Před zařazením do studie jsme z 9 ml žilní krve odebrané do zkumavky s EDTA izolovali DNA pacientů standardní izopropanol-fenol-chloroformovou metodou s využitím proteinázy K.
V Ústavu patologické fyziologie LF MU jsme analyzovali polymorfismy C677T (rs1801133) a A1298C (rs1801131) v genu MTHFR metodou qPCR s fluorescenčně značenými TaqMan sondami (C___1202883_20 a C___850486_20, ThermoScientific, Grand Island, NY, USA) na přístroji ABI PRISM 7000, Applied Biosystems, USA. Data byla vyhodnocena softwarem SDS version 1.2.3, Applied Biosystems, USA.
Podle dostupné literatury byl určen předpokládaný fenotyp pacienta odpovídající jeho haplogenotypovému profilu MTHFR.
Osoby s aktivitou enzymu MTHFR 30–65 % jsou považovány za IM a pacienti s nižší funkcí (< 30 % normální aktivity enzymu) byli označeni fenotypem PM.
Výroba IVLP
Celkem jsme v lékárně vyrobili deset sad po třech baleních s 28 tobolkami s bílou sypkou hmotou (840 průhledných tobolek). Každý pacient obdržel na začátku každé fáze jeden šroubovací plastový kelímek popsaný jeho jménem, číslem fáze, datem výroby a spotřeby IVLP a místem výroby s podpisem odpovědné osoby. Celkem 560 tobolek obsahovalo pouze 0,5 g lactosum monohydricum a 280 tobolek obsahovalo 60 mg pyridoxinum hydrochloricum se 400 µg glukosaminové soli 5-methylfolátu a lactosum monohydricum q.s.
Design terapie
Osoby zařazené do naší studie v průběhu tří měsíců v období jara 2018 podstoupily třífázovou terapii, která byla navržena jako dvojitě zaslepená (double-blinded) zkřížená studie (cross-over design) s modifikací. Při standardní zkřížené studii pacient v randomizovaném pořadí dostane postupně obě terapie, mezi nimi je wash-out perioda, která musí být dostatečně dlouhá na to, aby výsledek druhé léčby nebyl ovlivněn užíváním přípravku v první terapii. Modifikace obvyklého designu spočívala v tom, že studie pro všechny pacienty probíhala ve schématu, kdy po kontrolní fázi následovala fáze terapeutická a jako poslední proběhla sledovací fáze.
Neporovnávali jsme přitom dvě terapie, ale období bez užívání vitaminových doplňků a účinek navržené vitaminové kúry a její efekt. Ošetřující zubní lékař ani pacient neměli informaci o tom, v jaké fázi jsou vitaminy v IVLP obsaženy. Každá fáze trvala 28 dní a během ní pacienti každý den užívali jednu tobolku a denně zaznamenávali do jednoduchého papírového archu, že tobolku vzali, zda měli/neměli výsev aft a jejich případnou lokalizaci, přítomnost stresu, jiného onemocnění, kouření, příjem alkoholu (i jeho druh), přítomnost dalších rizikových faktorů (potravin, návštěvy zubního lékaře, mechanické podráždění a jiné), a ženy uváděly i dobu menstruace.
V první (kontrolní) fázi pacienti užívali 0,5 g lactosum monohydricum, na začátku druhé (terapeutické) fáze byl pacientům v ordinaci podán vitamin D3 s postupným uvolňováním po dobu 12 týdnů (Vitamin D3 Axonia 30 000 UI/1 tbl., výrobce Pharma Patent kft. Budapešť, Maďarsko – obvykle předepisováno jako měsíční dávka), a denně užívali tobolku s obsahem 60 mg pyridoxinum hydrochloricum s 400 µg glukosaminové soli 5-methylfolátu a lactosum monohydricum q.s. Před podáním vitaminu D3 byla laboratorně zkontrolována funkce ledvin a koncentrace Ca2+ a kreatininu, neboť hyperkalcemie i onemocnění ledvin jsou podle souhrnu údajů o přípravku (SPC) kontraindikací jeho použití. Ve třetí (sledovací) fázi byl podáván IVLP shodný s první fází.
Statistická analýza
Ke statistickému hodnocení bylo využito zejména neparametrických testů (Wilcoxonův párový test, Spearmanův korelační test). Za hladinu významnosti byla zvolena p-hodnota ≤ 0,05. Data byla vyhodnocena statistickým softwarem Statistica v.13.
Výsledky
Do studie jsme zařadili tři muže a sedm žen s RAS ve věku 28 až 47 let, tři z nich byli podle genového profilu MTHFR definováni jako PM a sedm jako IM kyseliny listové. Tři ženy uvedly, že kouří, a to tři až deset cigaret denně, ostatní pacienti byli nekuřáci. Tři pacienti jsou léčení alergici.
Všech deset osob trpělo podle klinického vyšetření před zahájením terapie na afty typu minor s frekvencí výsevu minimálně jedenkrát za tři měsíce v počtu tří a více afekcí. Celkem 50 % těchto osob před začátkem terapie uvedlo, že ulcerace na sliznici dutiny ústní má prakticky permanentně. U poloviny osob ze souboru docházelo k difuznímu výsevu aft, u dalších se jednalo o různé lokalizace: v oblasti patrových oblouků, v horní a/nebo dolní čelisti vestibulárně, na vnitřní sliznici dolního rtu, v podjazykové krajině a na bukálních sliznicích. Obvyklá doba hojení aft byla u tří osob do deseti dní a u sedmi osob delší než 14 dní. Žádný z pacientů neuváděl přítomnost ulcerací jinde než na sliznici dutiny ústní. Medián věku, kdy se pacientovi poprvé objevila afta, byl 15 let (12–18 let, kvartil 25 % až kvartil 75 %). Dva pacienti (20 % ze souboru) uvedli, že RAS trpí i jejich rodič a/nebo potomek. Jako nejčastější rizikové faktory pacien-ti zmiňovali infekční onemocnění, psychický stres a mechanické podráždění. Před zařazením do studie 70 % osob pravidelně užívalo vitaminy skupiny B. Při primárním screeningu u nich byl medián sérové koncentrace 25-OH D3 61,8 nmoll-1 (46,8–67,3 nmoll-1); norma je 50–175 nmoll-1. Tento odběr však proběhl v různých ročních obdobích, proto nebyl statisticky dále hodnocen. Před první (kontrolní) fází byl medián sérové koncentrace 25-OH D3 u pacientů 54,2 nmoll-1 (20,8–75,1 nmoll-1), těsně před podáním vitaminu D3 68,1 nmoll-1 (53,0–81,4 nmoll-1). Měsíc po jeho podání byl medián sérové koncentrace 25-OH D3 96,6 nmoll-1 (89,2–122,0 nmoll-1) a po 56 dnech 108,6 nmoll-1 (73,5–124,8 nmoll-1). Po podání vitaminu D3 se signifikantně zvýšila sérová koncentrace 25-OH D3 (p ≤ 0,01, hodnoceno Wilcoxonovým párovým testem), viz graf 1. U pacientky č. 2 byla koncentrace při ukončení terapie nad normu (193,1 nmoll-1) a u pacientky č. 10 byla i přes podání vitaminu D3 diagnostikována snížená koncentrace 25-OH D3.
Graf 1. Sérové koncentrace 25-OH D3 u pacientů s RAS před terapií, v jejím průběhu a při ukončení terapie
Grapf 1 25-OH D3 serum levels in patients suffered by RAS before, during and after the therapy
Chybí čtyři hodnoty koncentrace v různém čase u různých pacientů z důvodu selhání laboratorní analýzy. Hodnoceno Wilcoxonovým párovým testem.
Stav před zařazením do sledované skupiny pacientů s RAS nebyl do analýzy zahrnut, jelikož stanovení nebylo u pacientů provedeno ve stejném ročním období a výsledky by byly zavádějící. Modrá oblast znázorňuje normu sérové koncentrace 25-OH D3 (50–175 nmoll-1).
modrá/černá/červená osoba, pozitivní/neutrální/negativní hodnocení terapie subjektem
Osa x:
1 – stav před zařazením do sledované skupiny;
2 – stav před 1. (kontrolní) fází;
3 – stav před 2. (terapeutickou) fází, po odběru krve byla podána tableta vitaminu D3;
4 – stav po 2. fázi;
5 – stav po 3. (sledovací) fázi
Note: In different patients, four concentration values are missing at different times due to a failure of laboratory analysis. The blue area shows the serum concentration of 25-OH D3 (50–175 nmolL-1).
blue/black/red person, positive/neutral/negative evaluation of therapy by a subject
Axis x:
1 – status prior to inclusion in the monitored group;
2 – status before the 1st (control) phase;
3 – status before the 2nd (therapeutic) phase, after vitamin D3 administration;
4 – status after the 2nd phase;
5 – status after the 3rd (tracking) phase
Z laboratorní analýzy vyplynulo, že hodnoty krevního obrazu, koncentrace homocysteinu, kyseliny listové, ALT, AST i dalších parametrů byly u vyšetřovaných osob ve fyziologickém rozmezí před terapií i po ní. U jedné pacientky byl před zahájením terapie zaznamenán zvýšený počet trombocytů, a to i při opakovaném vyšetření (až 506 109 l-1, kdy norma je 150–400 109 l-1),
a proto byla žena odeslána na specializované hematologické oddělení.Celkem 90 % pacientů při denních záznamech uvedlo, že v průběhu druhé (terapeutické) fáze mělo nejméně dnů s výsevem aft (medián 3,5 dne [0–16 dnů]) oproti první (kontrolní) a třetí (sledovací) fázi (mediány deset dnů [7–17 dnů] a 10,5 dne [4–18 dnů], p = 0,08 a p = 0,05, hodnoceno Wilcoxonovým párovým testem), viz graf 2. Počet dnů s výsevem aft pozitivně koreloval mezi všemi třemi fázemi (korelační koeficenty = 0,792 a 0,765 a 0,905, p ≤ 0,01, hodnoceno Spearmanovým korelačním testem). Záznamy pacientů odpovídaly klinickému nálezu při vyšetřeních. Podle subjektivního hodnocení udala pacientka č. 2 zhoršení stavu, pacienti č. 7 a 10 nepozorovali během terapie změnu svého zdravotního stavu a sedm osob bylo spokojeno, neboť u nich došlo k méně častému/žádnému výsevu aft a/nebo doba hojení byla významně kratší (graf 1). Subjektivní hodnocení terapie pozitivně korelovalo s objektivním klinickým nálezem v průběhu druhé (terapeutické) fáze (korelační koeficent = 0,993, p < 0,001, hodnoceno Spearmanovým korelačním testem). U pacientky č. 2, která bezprostředně po terapii uvedla nespokojenost s terapií, byl po dvou měsících od ukončení terapie klinický nález bez výsevu aft. Tato žena měla opakovaně nejnižší koncentrace vitaminu B12 z celé sledované skupiny (161–197 pmoll-1; norma je 145–569 pmoll-1). U pacienta č. 7, který je PM a nepozoroval během terapie změnu v souvislosti s RAS, bylo uvedeno, že byl celé tři měsíce permanentně ve stresu a téměř permanentně (77 dní z 84) měl difuzní výsev aft. Tento muž uvedl, že více než každý druhý den požíval alkohol. Pacientka č. 10 měla při všech měřeních sérové koncentrace 25-OH D3 pod dolní hranicí normy, pouze v případě odběru měsíc po podání suplementu byla stanovena hodnota 50,2 nmoll-1.
Diskuse
Vitamin D a folát regulují řadu mechanismů, které slouží jako ochrana organismu před potenciálními environmentálními stresory. Nedávné poznatky, které shrnula práce Jones a kol. [8], ukazují na interakce mezi UV zářením, typem kůže, vitaminem D3, foláty a variabilitou v genech kódujících receptor pro vitamin D a enzymy zapojené do folátového cyklu. Existuje hypotéza nazvaná „vitamin
D-folát“, podle které se zbarvení kůže vyvinulo jako vyrovnávací mechanismus pro udržení koncentrací obou vitaminů [8, 9]. UV záření na jedné straně stimuluje produkci vitaminu D v kůži, ale také může způsobit degradaci folátu při jeho absorpci a/nebo oxidaci volnými radikály.Současná doporučení pro podávání vitaminu D a kyseliny listové jsou využívána především v prevenci řady onemocnění, neboť jejich deficit je spojován s rizikem a nástupem mnoha chronických stavů, jakými jsou kardiovaskulární nemoci, diabetes mellitus a nádorová onemocnění. Koncentrace zejména vitaminu D je odlišná v různých ročních obdobích, a po zimě je zpravidla nejnižší. Rozhodli jsme se proto, že námi navrženou terapii pacienti s RAS podstoupí jednotně na jaře.
S ohledem na genetickou predispozici ke snížené funkci enzymu MTHFR u osob zařazených do studie jsme pacientům podávali aktivní folát, konkrétně glukosaminovou sůl 5-methylfolátu, která je oproti předchozí generaci folátů (vápenné soli 5-methylfolátu) dlouhodobě stabilní, má vysokou rozpustnost ve vodě, lepší biologickou dostupnost a bezpečnost. Nepřipravili jsme glukosaminovou sůl 5-methylfolátu a vitaminem B6 spolu s vitaminem D3 do jedné lékové formy nejenom kvůli jejich odlišným chemickým vlastnostem (stabilita by nebyla optimální), ale i proto, že jsme nejprve museli laboratorně ověřit (koncentrace Ca2+ a funkce ledvin), že pacientům bude možné vitamin D3 podat. Lactosum monohydricum jsme zvolili kvůli jeho vlastnostem a protože je jako pomocná látka obsažen v podávané tabletě s vitaminem D3. Vitamin B12 jsme pacientům neaplikovali jednak z důvodů nutnosti podávání obden (intramuskulárně 300 µg), ale také proto, že koncentrace tohoto vitaminu byla před terapií u všech osob v normě (i po terapii byly hodnoty u všech pacientů ve fyziologickém rozmezí).
První (kontrolní) fázi jsme do terapie zařadili proto, abychom eliminovali tzv. carry-over effect, neboli přenos léčebného efektu léčby z předchozího období. Toto měsíční období by se dalo nazvat i „wash-out“ fází vyloučení vitaminových preparátů z organismu. Pacienti proto vysadili potravinové doplňky a neužívali jiné vitaminové preparáty než ty, které jsme jim při terapii podali.
Zvolený metodický přístup je vhodný pouze pro studium chronických, život neohrožujících onemocnění, jako je například RAS. Výhodou tohoto designu studie je, že lze porovnávat období bez užívání vitaminových preparátů s účinkem terapie u stejné osoby. Tento přístup vyžaduje menší počet respondentů než studie, při které jedna skupina obdrží placebo a druhá skupina léčivý preparát. Obvyklou nevýhodu tohoto přístupu, že lze studovat jen krátkodobé účinky léčby, jsme eliminovali zařazením sledovací fáze. Žádný z pacientů neodstoupil v průběhu terapie ze studie, což může ukazovat na jejich důvěru v ošetřujícího zubního lékaře a u většiny i spokojenost s terapií a zlepšením stavu v průběhu druhé fáze.
Za jeden z důležitých faktorů v etiopatogenezi RAS je považována také psychika pacientů. Pozitivně mohla být ovlivněna už samotnou účastí ve studii a péčí, která jim byla věnována. Na druhou stranu je však možné i její negativní působení a vyvolání určité míry stresu, dané opakovanými návštěvami zubní ordinace s odběry žilní krve i nutností podrobně vyplňovat záznamové archy. Expozici stresu v průběhu terapie pacienti subjektivně hodnotili a zaznamenávali; výsledky jsou velmi variabilní (0–28 dní v každé z fází, minimum–maximum).
U 80 % pacientů s RAS byla sérová koncentrace 25-OH D3 při ukončení terapie v normě (graf 1), což mohlo být důsledkem jednak ročního období s řadou slunných dnů (jaro/léto), ale také podání suplementu vitaminu D3. Ve druhé (terapeutické) fázi byl v celé sledované kohortě nejnižší medián počtu dnů s výsevem aft (graf 2) a 70 % osob subjektivně pozorovalo zlepšení svého zdravotního stavu (tab. 1). Terapii RAS s použitím modifikované Škachovy kúry tak lze považovat za úspěšnou. Pouze u pacientky č. 2 byla terapie neúspěšná. Její stav se v průběhu léčebné fáze zhoršil (graf 2), a to jak subjektivně, tak i na základě objektivních vyšetření. Sérová koncentrace 25-OH D3 se po podání tablety tohoto vitaminu v následujícím měsíci snížila a v dalším období skokově zvýšila nad normu (graf 1). Důvody nejsou jasné, jedním z možných vysvětlení může být i chyba při laboratorní analýze. Nicméně tato pacientka je nyní (dva měsíce) po ukončení studie objektivně bez nového výsevu aft. U pacienta č. 7, který je PM, se stav nezměnil. Ačkoliv došlo k mírnému zlepšení v průběhu druhé (terapeutické) fáze, forma a frekvence výsevu aft je u něj stále závažná, což může být i důsledkem jeho životního stylu (permanentní stres, alkohol). Pacientka č. 10, která terapii hodnotila neutrálně, neměla výsev aft ve druhé (terapeutické) fázi, ale subjektivně nepozorovala zlepšení. Její sérové koncentrace 25-OH D3 jsou i po suplementaci na spodní hranici normy.
Graf 2. Počet dnů s výsevem aft během terapie
Graph 2 Number of days with aphthae during therapy
černá/červená osoba, neutrální/negativní hodnocení terapie subjektem
Osa x:
1 – stav v průběhu
1. (kontrolní) fáze;
2 – stav v průběhu
2. (terapeutické) fáze;
3 – stav v průběhu
3. (sledovací) fáze
black/red person, neutral/negative evaluation of therapy by a subject
Axis x: 1 – status during
the 1st (control) phase;
2 – status during
the 2nd (therapeutic) phase;
3 – status during
the 3rd (tracking) phaseVšem pacientům zařazeným do studie jsme doporučili, aby vzhledem ke své genetické predispozici ke snížené aktivitě enzymu MTHFR v užívání aktivního folátu a vitaminu B6 pokračovali, a budeme je dále sledovat. Domníváme se, že je vhodné u nich kontrolovat také koncentraci vitaminu D3 v séru a při jejím poklesu podat vitaminový suplement.
Pilotní projekt plánujeme rozšířit o další pacienty s RAS. Modifikovanou Škachovu vitaminovou kúru by bylo vhodné vyzkoušet v různých časových (případně dávkových) schématech. Vitamin D3 by mohl být podáván i pacientům, kteří jsou normální metabolizátoři kyseliny listové (EM), při snížených sérových koncentracích 25-OH D3 a za nepřítomnosti kontraindikací. Navržený terapeutický přístup není kauzální léčbou, může však být považován za personalizovanou profylaxi. Pro pochopení etiopatogeneze onemocnění RAS a následnou optimalizaci léčby je nutný další výzkum.
Závěr
Navržená modifikace Škachovy vitaminové kúry se zdá být vhodná pro léčbu pacientů s RAS, u kterých je genetická predispozice ke snížené funkci enzymu MTHFR, neboť během našeho pozorování došlo u 70 % pacientů k subjektivnímu i objektivnímu zlepšení stavu. Doporučujeme zvážit provedení analýzy variability v genu MTHFR se snahou docílit individualizace léčebného postupu zejména u pacientů s RAS, kteří na standardně podávanou terapii neodpovídají.
Článek vznikl s podporou Ministerstva zdravotnictví České republiky, grantu NV15-29336A, grantu GAČR GB14-37368G, projektu Specifický výzkum MUNI/A/1008/2017 a z prostředků poskytnutých Lékařskou fakultou MU juniorskému výzkumníkovi Petře Bořilové Linhartové.
Děkujeme studentům Natálii Mlčůchové, Mgr. Bc. Simoně Slezákové, Bc. Davidu Novákovi a zdravotním sestrám FN u sv. Anny, Brno za pomoc při odběru a zpracování vzorků.
RNDr. Petra Bořilová Linhartová, Ph.D.
Stomatologická klinika a Ústav patologické fyziologie
LF MU a FNUSA
Kamenice 5, 625 00 Brno
e-mail: plinhart@med.muni.cz
Zdroje
1. Slezák R, Kopecký O, Krejsek J.Recidivující afty. 1. vydání. Praha: Galén; 2000.
2. Bořilová Linhartová P, Valová S, Izakovičová Hollá L.Vrozená náchylnost k recidivující aftózní stomatitidě. Čes Stomat. 2017; 117(2): 27–34.
3. Škach M, Švejda J, Liška K. Onemocnění ústní sliznice: patologie, terapie a diferenční diagnostika onemocnění ústní sliznice. 1. vydání, Praha: Avicenum; 1975.
4. van der Put NM, Gabreëls F,Stevens EM, Smeitink JA, Trijbels FJ, Eskes TK, van den Heuvel LP, Blom HJ.A second common mutation in the methylenetetrahydrofolate reductase gene: an additional risk factor for neural-tube defects? Am J Hum Genet. 1998; 62(5): 1044–1051.
5. Weisberg I, Tran P, Christensen B, Sibani S, Rozen R.A second genetic polymorphism in methylenetetrahydrofolate reductase (MTHFR) associated with decreased enzyme activity. Mol Genet Metab. 1998; 64(3): 169–172.
6. Ślebioda Z, Szponar E, Dorocka-Bobkowska B.Vitamin D and its relevance in the etiopathogenesis of oral cavity diseases. Arch Immunol Ther Exp (Warsz). 2016; 64(5): 385–397.
7. Anand A, Singh S, Sonkar AA, Husain N, Singh KR, Singh S, Kushwaha JK.Expression of vitamin D receptor and vitamin D status in patients with oral neoplasms and effect of vitamin D supplementation on quality of life in advanced cancer treatment. Contemp Oncol (Pozn). 2017; 21(2): 145–151.
8. Jones P, Lucock M, Veysey M, Beckett E.The vitamin d-folate hypothesis as an evolutionary model for skin pigmentation: an update and integration of current ideas. Nutrients. 2018; 10(5): pii: E554. doi: 10.3390/nu10050554.
9. Branda RF, Eaton JW.Skin color and nutrient photolysis: an evolutionary hypothesis. Science. 1978; 201(4356): 625–626.
Štítky
Chirurgia maxilofaciálna Ortodoncia Stomatológia
Článek EditorialČlánek Akt dospělosti
Článok vyšiel v časopiseČeská stomatologie / Praktické zubní lékařství
Najčítanejšie tento týždeň
2019 Číslo 1
-
Všetky články tohto čísla
- Editorial
- Metody používané k výzkumu morfologie obličeje
- Výskyt vývojových vad skloviny dočasných řezáků u dětí narozených s velmi nízkou a extrémně nízkou porodní hmotností
- Úvodník prof. Eduarda Nessela z prvního vydání časopisu v lednu 1900
- Od časopisu „zubní lékařství“ k periodiku „česká stomatologie“
- Akt dospělosti
- Farmakoterapie recidivující aftózní stomatitidy u pacientů s geneticky podmíněnou sníženou schopností metabolizovat kyselinu listovou – pilotní studie
- Česká stomatologie / Praktické zubní lékařství
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Farmakoterapie recidivující aftózní stomatitidy u pacientů s geneticky podmíněnou sníženou schopností metabolizovat kyselinu listovou – pilotní studie
- Výskyt vývojových vad skloviny dočasných řezáků u dětí narozených s velmi nízkou a extrémně nízkou porodní hmotností
- Metody používané k výzkumu morfologie obličeje
- Od časopisu „zubní lékařství“ k periodiku „česká stomatologie“
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



