-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zobrazení karcinomu prostaty metodami nukleární medicíny
Nuclear medicine imaging of prostate cancer
Nuclear medicine imaging has been at the disposal of urologists for a number of decades. Alongside scintigraphy, positron emission tomography combined with computed tomography (PET/CT) is becoming widely available for clinical use. A range of radiopharmaceuticals has been reported in recent scientific literature, some of which are now available in the Czech Republic. The significance of this trend is that new and more effective diagnostic modalities have become available for use by practitioners. The aim of this brief communication is to provide a basic review of modern nuclear medicine techniques for imaging prostate cancer. The properties of radioactive glucose and choline derivatives as well as osteotropic radiopharmaceuticals are described. Due to the biological heterogeneity of prostate cancer no particular radiopharmaceutical agent is universally superior. The benefits of nuclear medicine imaging techniques can be seen in the detection of metastases in an otherwise cryptogenic localised disease, and in the timely localisation of biochemical recurrences. In both of these cases early disease detection might change the applicable therapeutic process.
Key words:
diagnostic imaging, nuclear medicine, positron-emission tomography and computed tomography, prostatic neoplasms.
Autori: Otakar Bělohlávek 1; Ladislav Jarolím 2
Pôsobisko autorov: Oddělení nukleární medicíny – PET centrum, Nemocnice Na Homolce, Praha 1; Urologická klinika 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Ces Urol 2012; 16(4): 205-213
Kategória: Přehledový článek
Súhrn
Zobrazování metodami nukleární medicíny je k dispozici urologům již několik desetiletí. Vedle dávno etablované scintigrafie se stává stále dostupnější pozitronová emisní tomografie (PET) v kombinaci s výpočetní tomografií (CT). V odborné literatuře je popisováno využití celé řady různých radiofarmak, z nichž některá jsou dostupná i v České republice. Klinikům se tak otevírají nové diagnostické možnosti. Cílem tohoto stručného přehledu je poskytnout základní orientaci v moderních nukleárně medicínských metodách pro zobrazování karcinomu prostaty. Zmíněny jsou vlastnosti radioaktivních derivátů cholinu a glukózy a také osteotropních radiofarmak. S ohledem na biologickou heterogenitu karcinomu prostaty nelze jednoduše upřednostnit jedno radiofarmakum před druhým. Využití radionuklidových zobrazovacích metod lze spatřovat především při odhalování kryptogenních metastáz u jinak klinicky lokalizovaného onemocnění a pak také při časné lokalizaci zdroje PSA u biochemické recidivy, neboť v obou těchto případech se nabízí změna dalšího terapeutického postupu.
Klíčová slova:
diagnostické zobrazování, novotvary prostaty, nukleární medicína, pozitronová emisní tomografie a výpočetní tomografie.ÚVOD
Zobrazování metodami nukleární medicíny je k dispozici urologům již několik desetiletí. Vedle dávno etablované scintigrafie se stává stále dostupnější pozitronová emisní tomografie (PET) v kombinaci s výpočetní tomografií (CT). V odborné literatuře je popisováno využití celé řady různých radiofarmak, z nichž některá jsou dostupná i v České republice. Klinikům se tak otevírají nové diagnostické možnosti. Ty lze do určité míry využít pro odhalení generalizace klinicky lokalizovaného karcinomu, které, je-li prokázáno, vede k odstoupení od jinak plánované radikální prostatektomie. Jiným využitím radionuklidového zobrazování je časná lokalizace zdroje PSA při biochemické recidivě. V případě nálezu solitárního zdroje lze využít lokální terapii s kurativním záměrem a ušetřit pacienta nadbytečné systémové léčby. Při průkazu lokální recidivy v oblasti anastomózy měchýře s uretrou je tak indikována salvage radioterapie, v případě limitovaného uzlinového postižení může být kurativní léčbou cílená lymfadenektomie. Cílem tohoto stručného přehledu je poskytnout základní orientaci v moderních nukleárně medicínských metodách pro zobrazování karcinomu prostaty.
SCINTIGRAFIE, SPECT A SPECT/CT
Doposud se nepodařilo vyvinout vhodné radiofarmakum, které by se koncentrovalo v buňkách karcinomu prostaty s takovým kontrastem vůči okolí, který by byl v běžné praxi dostatečný pro přímé scintigrafické zobrazení nádorové tkáně. Řadu desetiletí se ale využívá nepřímého zobrazení zvýšené osteoplastické činnosti osteoblastů, které bývají velmi často aktivovány u kostních metastáz karcinomu prostaty. Kostní scintigrafie pomocí 99mTc značených difosfonátů (oxidronát, medronát) se tak v minulosti stala a dodnes zůstává standardem při odhalování generalizace karcinomu prostaty do skeletu. Její výhodou je neinvazivnost provedení, celotělový rozsah zorného pole, dobrá dostupnost, nízká radiační zátěž a dobrá senzitivita. Slabinou je nižší specificita, kterou lze zvýšit jednak pečlivým doplněním anamnestických údajů o traumatech, jednak porovnáním s RTG či CT nálezem. Víceméně automatickou součástí moderní scintigrafie skeletu je doplnění celotělového snímání o jednofotonovou emisní tomografii (SPECT), která dále zřetelně zvyšuje citlivost i specifičnost vyšetření. Postupně se rozšiřují i hybridní SPECT/CT kamery nabízející možnost operativního doplnění CT dle aktuálního scintigrafického nálezu. V závislosti na své konstrukci některé umožňují provést plnohodnotné CT vyšetření skeletu, zatímco jiné jen nízkodávkové zobrazení pro účely upřesnění anatomické lokalizace scintigrafického nálezu.
POZITRONOVÁ EMISNÍ TOMOGRAFIE (PET A PET/CT)
Vývoj PET skenerů umožnil od devadesátých let 20. století rutinně provádět klinická onkologická vyšetření pomocí 18F značené fluorodeoxyglukózy (FDG). FDG se zvýšeně akumuluje v buňkách s vysokou glykolytickou aktivitou, ke kterým patří buňky většiny maligních tumorů včetně anaplastických forem karcinomu prostaty (obr. 1). Záhy se ale ukázalo, že FDG selhává u některých pomaleji rostoucích nádorů, mezi něž patří i diferencovaný karcinom prostaty. Zvýšená akumulace FDG v karcinomu prostaty je spojována s vyššími hodnotami Gleasonova skóre (1). Podle úrovně akumulace FDG nelze spolehlivě odlišit zdravou tkáň prostaty od benigní hyperplazie či karcinomu; pro primární diagnostiku onemocnění prostaty se tedy nehodí. Naopak existují práce poukazující na význam FDG při průkazu recidivy karcinomu u pacientů po radikální prostatektomii, kdy byla v 31 % případů správně odhalena recidiva, a to především mimo lůžko prostaty (2).
Obr. 1. Pacient s biopticky ověřeným anaplastickým karcinomem prostaty byl v rámci iniciálního stagingu indikován k FDG-PET/CT. Patologicky zvýšená konsumpce glukózy v prostatě (a), zvětšené parailické uzlině vlevo (b) a v drobné kostní lézi sakra vpravo (c) svědčí pro generalizaci karcinomu prostaty. V močovém měchýři a ve střevech je akumulace FDG fyziologicky zvýšená. Vlevo CT v režimu nízké dávky, vpravo jeho fúze s FDG-PET. Fig. 1. Patient with bioptically proven anaplastic prostate cancer was investigated by FDG-PET/CT as a part of initial staging. Abnormally increased glucose consumption in prostate (a), in enlarged left parailiac lymph node (b) and discrete bone lesion of the sacrum (c) represents metastatic prostate cancer. Increased FDG uptake in urinary bladder and gut is a normal variant. Left: low-dose CT; right: fusion of low-dose CT with FDG-PET. 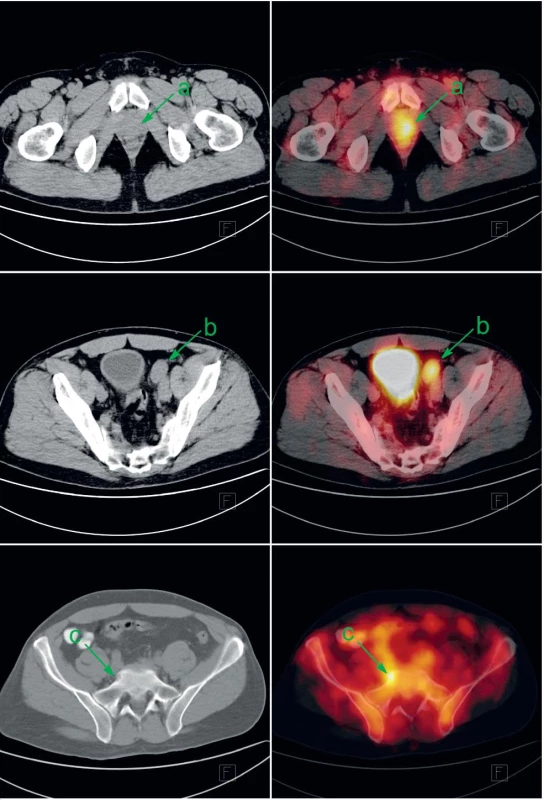
S ohledem na uvedené limitace FDG se proto u karcinomu prostaty více než u jiných typů nádorů soustředila pozornost na alternativní radiofarmaka, mezi nimiž sehrál důležitou úlohu [11C]methylcholin. První literární zprávy o jeho využití v humánní PET diagnostice spadají už do poloviny osmdesátých let 20. století (3), nicméně teprve na přelomu století vznikla celá řada prací, které vyhodnotily jeho diagnostický přínos u karcinomu prostaty. Cholin rychle přestupuje do buňky, kde je fosforylován a dále inkorporován do fosfatidylcholinu (= lecithinu), stavebního kamene buněčných membrán. Výhodou je nízká exkrece tohoto radiofarmaka do moči (4), což je pro zobrazení prostaty uložené v těsné blízkosti močového měchýře velmi důležité. V souboru 100 pacientů po radikální terapii se střední hodnotou PSA 6,57 µg/l byla nalezena ložiska zvýšené akumulace [11C]methylcholinu ve 47 % případů, zatímco FDG jen u 27 % případů (5). Někteří tak považují PET/CT s [11C]methylcholinem za metodu první volby pro restaging při podezření na recidivu karcinomu prostaty (6). Jiní jsou v tomto směru skeptičtější a upozorňují na nespecifickou akumulaci cholinu v zánětlivých ložiscích, na neschopnost detekovat mikrometastázy a na nižší citlivost pro průkaz kostních metastáz (7, 8). Proto nedoporučují touto metodou nahrazovat biopsii sentinelové uzliny a ani kostní scintigrafii. Zásadní nevýhodou je krátký fyzikální poločas rozpadu inkorporovaného radioaktivního uhlíku 11C (20,4 minut), který omezuje využitelnost tohoto radiofarmaka jen na pracoviště vybavená cyklotronem s právem individuální přípravy radiofarmak (v České republice takové pracoviště zatím neexistuje). Tím je dána i velmi vysoká cena diagnostického přípravku.
Za účelem částečné eliminace těchto logistických nevýhod byl následně vyvinut [18F]fluormethylcholin (FCh), derivát cholinu značený 18F (poločas rozpadu 109,8 minut). Ten má podobnou farmakokinetiku jako [11C]methylcholin, na rozdíl od něj se však intenzivně vylučuje do moči, což komplikuje zobrazení prostaty. Výzkum se zaměřil především na úlohu FCh při biochemické recidivě. Ve studii 56 pacientů se zvýšenou hladinou PSA po radikální prostatektomii FCh-PET/CT odhalila recidivu u 20 % pacientů s PSA ≤ 1 µg/l, u 44 % pacientů s PSA 1–5 µg/l a 81,8 % u pacientů s PSA ≥ 5 µg/l (9). K podobným výsledkům vedla i analýza 183 vyšetření u pacientů s časným laboratorním relapsem při PSA < 1,5 µg/l, u kterých FCh-PET/CT odhalila recidivu v 28 % případů (10). Příklad FCh-PET/CT je uveden na obrázku 2. Podobně jako v případě [11C]methylcholinu ani FCH není ve srovnání s histologickým vyšetřením dostatečně citlivým testem pro průkaz uzlinového postižení při vstupním stagingu; Poulsen et al. dosáhli na 210 členném souboru senzitivity 56 % a specificity 94 %. Je třeba ovšem podotknout, že falešně negativní uzliny měly střední velikost jen 4,6 mm (11). Zajímavým zjištěním je, že na rozdíl od Picchia et al. (8) prokázali vyšší senzitivitu cholinové PET ve srovnání s kostní scintigrafií pro průkaz kostních metastáz. Metodika provádění FCh-PET/CT není zatím v klinické praxi ještě zcela ustálená. Spolu s injekcí FCh lze odstartovat krátké dynamické snímání omezeného zorného pole (axiálně cca 15 cm) cíleného na prostatu se záměrem odlišit časnou patologickou akumulaci v nádoru od pozdější fyziologicky vyloučené aktivity do moči. Následné snímání celého trupu v časné fázi cca 10 minut po aplikaci poskytuje přehledné a pravděpodobně nejvýtěžnější zobrazení. V některých případech lze doplnit odložené snímání jednu hodinu po aplikaci.
Obr. 2. Pacient po radikální prostatektomii s biochemickou recidivou a retroperitoneální lymfadenopatií byl indikován k FCh-PET/CT. Patologicky zvýšená konsumpce cholinu v mírně zvětšených retroperitoneálních uzlinách (a), v nezvětšené interlobární uzlině vlevo (b) a v kostní dřeni 6. žebra vlevo (c) svědčí pro generalizaci karcinomu prostaty. V játrech a ve střevech je akumulace FCh fyziologicky zvýšená. Vlevo CT v režimu velmi nízké dávky, vpravo jeho fúze s FCh-PET. Fig. 2. Patient after radical prostatectomy with biochemical recurrence and retroperitoneal lympadenopathy was indicated to FCh-PET/CT. Abnormally increased choline consumption in slightly enlarged retroperitoneal lymph nodes (a), in normal-size interlobar lymph node on the left (b) and in the bone marrow of 6<sup>th</sup> rib on the left (c) represents recurrent metastatic prostate cancer. Increased choline uptake in the liver and gut is a normal variant. Left: minimal-dose CT; right: fusion of minimal-dose CT with FCh-PET. 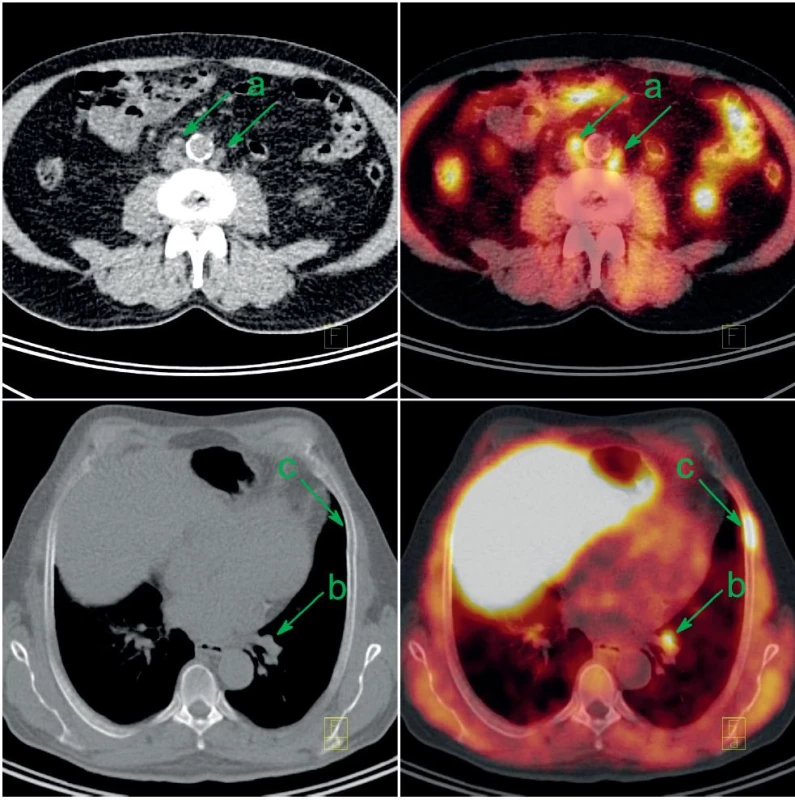
Pro průkaz kostních metastáz nabízí PET zajímavou alternativu ke kostní scintigrafii. Využívá se při tom [18F]fluoridu sodného (NaF), který je v kosti akumulován v závislosti na aktivitě osteoblastů. PET i scintigrafie tak vyjadřují shodný patofyziologický kostní proces. NaF však vykazuje oproti difosfonátům rychlejší plazmatickou clearance, a umožňuje tak vyšší kontrast zobrazení. To v kombinaci s lepšími vlastnostmi PET snímání vede ke zřetelně vyšší kvalitě zobrazení a lepší detektabilitě kostních lézí (obr. 3). Přestože NaF-PET/CT nezobrazuje přímo nádorové buňky v kostní dřeni, ale až sekundární reakci přiléhající kostní trámčiny, v případě podezření na přítomnost metastázy karcinomu prostaty ve skeletu se jeví NaF-PET/CT jako ideální vyšetřovací modalita, a to s ohledem na doložený fakt, že kostní scintigrafie v této situaci předčí [11C]methylcholin (8). Pomocí NaF ovšem z podstaty věci nelze na rozdíl od FDG a FCh zobrazit metastázy mimo skelet.
Obr. 3. Porovnání nálezu téhož pacienta vyšetřeného v odstupu 10 dní kostní scintigrafi í SPECT pomocí difosfonátu (vlevo) a PET pomocí NaF (vpravo). Nahoře koronární řezy, dole sagitální řezy hrudní a části bederní páteře. S pomocí NaF-PET je dosaženo zřetelně vyšší kvality zobrazení rezultující v odhalení většího počtu kostních metastáz díky vyššímu kontrastu NaF a lepšímu prostorovému rozlišení PET. Fig. 3. Comparison of bone scan (SPECT with labelled diphosphonate) on the left with NaF-PET on the right. Both investigations were undertaken within 10 days. Top: coronal slices; bottom sagittal slices of thoracic and part of lumbar spine. NaF-PET off ers image of substantially higher quality with the ability to discover more bony metastases thanks to higher contrast of NaF and thanks to better spatial resolution of PET. 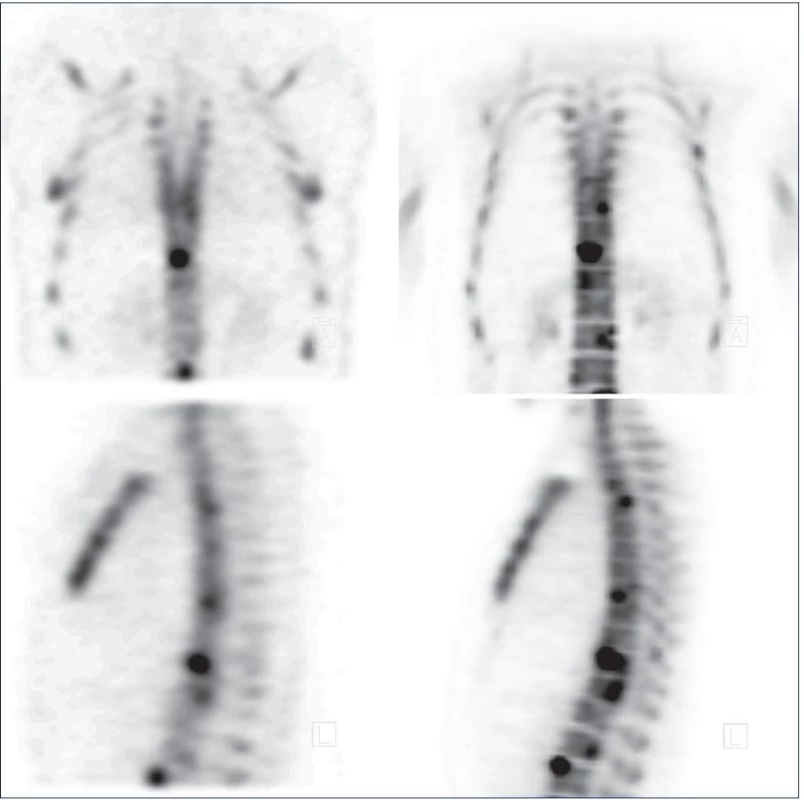
Z ostatních radiofarmak užívaných v PET diagnostice karcinomu prostaty stojí za zmínku ještě [11C]acetát, jehož intracelulární metabolismus je méně probádaný. Radiouhlík z něj přestupuje do fosfatidylcholinu a neutrálních buněčných lipidů. Sporadické práce dokládají podobnou spolehlivost pro zobrazení karcinomu prostaty, jakou dosahuje [11C]methylcholin. Potenciál [11C]acetátu lze spatřovat především ve výzkumných aplikacích a nelze očekávat, že by se kdy rozšířil do klinické praxe. To ale s ohledem na fyzikální poločas rozpadu platí pro všechna radiofarmaka značená uhlíkem 11C.
ZÁVĚR
Lze shrnout, že nukleární medicína dnes nabízí několik metod, které jsou specificky cílené na určité patofyziologické pochody u karcinomu prostaty. V České republice je široce dostupná kostní scintigrafie, na PET pracovištích také PET/CT s pomocí FDG a NaF. Omezeně je k dispozici FCh-PET/CT s ohledem na nákladný individuální dovoz radiofarmaka ze zahraničí. Radiofarmaka značená uhlíkem 11C jsou v České republice nedostupná. PET/CT dává kvalitnější zobrazení než SPECT či SPECT/CT. S ohledem na biologickou heterogenitu karcinomu prostaty však nelze jednoduše upřednostnit jedno radiofarmakum před druhým. Optimální volba je individuálně závislá a navíc logisticky podmíněná; v potaz je třeba brát výsledky a vlastnosti dalších diagnostických metod.
Žádnou ze zmiňovaných metod nelze doporučit pro diferenciální diagnostiku primárního tumoru prostaty, a nahradit tak biopsii. Jak při vstupním stagingu, tak i při průkazu recidivy anaplastických agresivních forem karcinomu prostaty je možné použít dostupnější FDG-PET/CT (12). Výhodou je velký rozsah zorného pole a schopnost zobrazit uzlinové i orgánové metastázy včetně dřeňových; negativní nález však nevylučuje přítomnost generalizace těch forem karcinomu, které nevykazují zvýšenou glykolytickou aktivitu. U těch je vhodnější použít PET/CT s FCh, je-li k dispozici. Schopnost lokalizovat nádorové bujení touto metodou roste s hladinou PSA; zobrazení mikrometastáz v časných fázích biochemické recidivy však v praxi nelze očekávat. Protože karcinom prostaty velmi často metastazuje do skeletu, NaF-PET/CT je ideální volbou pro průkaz kostních metastáz, a to bez ohledu na biologické vlastnosti nádoru (obr. 4). Zmiňované metody jsou dobře využitelné v individuálních případech; s výjimkou kostní scintigrafie však pro jejich plošné nasazení zatím neexistuje obecné konsenzuální doporučení (13).
Obr. 4. U pacienta s biochemickou recidivou CA prostaty je v CT obrazu patrná drobná osteosklerotická léze na přechodu stydké a sedací kosti vlevo (a). Původní podezření, že by se mohlo jednat metastázu, bylo vyvráceno díky mizivé akumulaci NaF. Jedná se tedy pravděpodobně o vývojový rudiment představující ostrůvek kompakty ve spongióze. Avšak dorzálně od této léze je patrné ložisko intenzivně zvýšené akumulace NaF bez specifi ckého nálezu v CT obrazu, které představuje časnou fázi reakce osteoblastů na přítomnou metastázu (b). Vlevo CT v režimu nízké dávky, vpravo jeho fúze s NaF-PET; sklopené řezy. Fig. 4. There is small osteosclerotic lesion at the attachment of left pubic and ischiadic bones on the CT (a) at the patient with biochemical recurrence. No NaF uptake excludes metastasis; the lesion represents probably rudimental benign island of cortical bone within spongiosa. On the other hand at the dorsal aspect of this benign lesion, there is a focus of intense NaF uptake without any specific sign on the CT (b). It represents early phase osteoblastic reaction to bone metastasis. Left: low-dose CT; right: fusion of low-dose CT with NaF-PET; tilted slices. 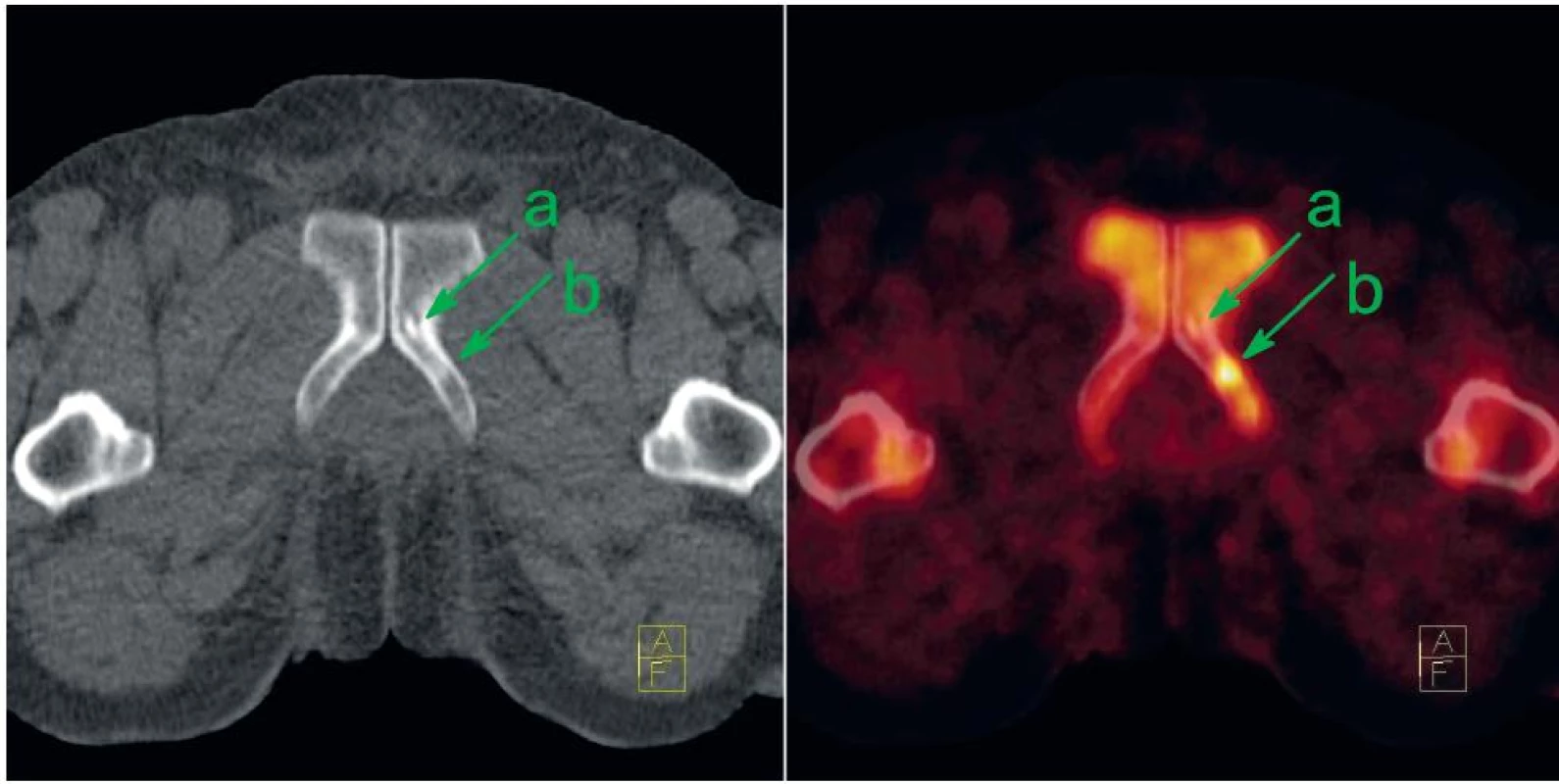
Rychlý vývoj PET detektorů v posledním desetiletí vedl ke zřetelnému zlepšení detektability drobných lézí a lze předpokládat, že tento vývoj bude ještě pokračovat. Do budoucna lze tedy očekávat určité zlepšení výše popisovaných hodnot senzitivity metody. Je otázkou, jaké klinicky významné aspekty přinese již započatý vývoj hybridních PET/MRI skenerů v dnešní době, kdy archivační a komunikační datové systémy (PACS) umožňují snadno provádět uspokojivé fúzní zobrazení obou modalit. Kontinuální pokroky na poli molekulární onkologie otevírají možnosti pro přípravu nových radiofarmak, která by mohla dále zlepšit zobrazování karcinomu prostaty.
Došlo: 25. 6. 2012.
Přijato: 1. 10. 2012.
Kontaktní adresa
doc. MUDr. Otakar Bělohlávek, CSc.
Oddělení nukleární medicíny – PET centrum, Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
e-mail: otakar.belohlavek@homolka.cz
Střet zájmů: žádný.
Zdroje
1. Oyama N, Akino H, Suzuki Y, et al. The increased accumulation of [18F]fluorodeoxyglucose in untreated prostate cancer. Jpn J Clin Oncol 1999; 29 : 623–629.
2. Schöder H, Herrmann K, Gönen M, et al. 2-[18F]Fluoro-2-Deoxyglucose Positron Emission Tomography for the Detection of Disease in Patients with Prostate-Specific Antigen Relapse after Radical Prostatectomy. Clin Cancer Res 2005; 11 : 4761–4769.
3. Gauthier S, Diksic M, Yamamoto L, Tyler J, Feindet W. Positron emission tomography with [11C]choline in human subjects. Can J Neural Sci 1985; 12 : 214.
4. Hara T, Kosaka N, Kishi H. PET Imaging of Prostate Cancer Using Carbon-11-Choline. J Nucl Med 1998; 39 : 990–995.
5. Picchio M, Messa C, Landoni C, et al. Value of [11C]choline-positron emission tomography for re-staging prostate cancer: a comparison with [18F]fluorodeoxyglucose-positron emission tomography. J Urol 2003; 169 : 1337–1340.
6. Fazio F, Picchio M, Messa C. Is 11C-choline the most appropriate tracer for prostate cancer? For. Eur J Nucl Med Mol Imaging 2004; 31 : 753–756.
7. Zöphel K, Kotzerke J. Is 11C-choline the most appropriate tracer for prostate cancer? Against. Eur J Nucl Med Mol Imaging 2004; 31 : 756–759.
8. Picchio M, Spinapolice EG, Fallanca F, et al. [11C]Choline PET/CT detection of bone metastases in patients with PSA progression after primary treatment for prostate cancer: comparison with bone scintigraphy. Eur J Nucl Med Mol Imaging 2012; 39 : 13–26.
9. Pelosi E, Arena V, Skanjeti A, et al. Role of whole-body 18F-choline PET/CT in disease detection in patients with biochemical relapse after radical treatment for prostate cancer. Radiol Med 2008; 113 : 895–904.
10. Cimitan M, Hodolic M, Borsatti E, et al. The potential of 18F-choline PET/CT to detect distant metastases in recurrent prostate cancer with early PSA relapse (< 1.5 ng/ml) when local salvage radiotherapy is intended: the role of Gleason score. In: Molecular Imaging in Radiation Oncology 2012; Vídeň: http://www.miro-online.org/docs/presentations/OP40_Hodolic.pdf.
11. Poulsen MH, Bouchelouche K, Høilund-Carlsen PF, et al. [(18)F]fluoromethylcholine (FCH) positron emission tomography/computed tomography (PET/CT) for lymph node staging of prostate cancer: a prospective study of 210 patients, BJU Int 2012; DOI: 10.1111/j.1464-410X.2012.11150.x. [Epub ahead of print].
12. Jadvar H. Prostate Cancer: PET with 18F-FDG, 18F - or 11C-Acetate, and 18F - or 11C-Choline. J Nucl Med 2011; 52 : 81–89.
13. Heidenreich A, Bastian PJ, Bellmunt J, et al. Guidelines on Prostate Cancer. European Association of Urology 2012 [online]. [Cit. 2012-09-19]. Dostupné z: http://www.uroweb.org/gls/pdf/08%20Prostate%20Cancer_LR%20March%2013th%202012.pdf.
Štítky
Detská urológia Nefrológia Urológia
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2012 Číslo 4- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- Zobrazení karcinomu prostaty metodami nukleární medicíny
- Využití molekulární genetiky v diferenciální diagnostice nádorů ledvin
- Srovnání laparoskopické a retropubické radikální prostatektomie – zkušenosti z jednoho centra
- Prognóza pacientů s T1G3 uroteliálním karcinomem močového měchýře léčených vakcínou BCG – retrospektivní analýza
- Využití extraanatomického stentu (EAS) u pacientů s pokročilým maligním onemocněním
- Liposarkom retroperitonea v lokalizaci dolního polu ledviny
- Myoglobinurie jako projev rabdomyolýzy po extrémní fyzické zátěži
- 12th Central European Meeting
- Ohlédnutí za 58. výroční konferencí ČUS v Ostravě
- Zpráva z kurzu endourologie v Amsterdamu
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Myoglobinurie jako projev rabdomyolýzy po extrémní fyzické zátěži
- Zobrazení karcinomu prostaty metodami nukleární medicíny
- Prognóza pacientů s T1G3 uroteliálním karcinomem močového měchýře léčených vakcínou BCG – retrospektivní analýza
- Liposarkom retroperitonea v lokalizaci dolního polu ledviny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



