-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fotodynamický antiseptický efekt fotoaktivních nanovláken při léčbě bércových vředů
Photodynamic Antiseptic Effect of Photoactive Nanofibers in the Treatment of Leg Ulcers
Nanofiber textiles doped with 5,10,15,20-tetraphenylporphyrin (TPP) photosensitizer prepared by electrospinning from highly hydrophilic polyurethane TecophilicTM were characterized with microscopic methods and time-resolved spectroscopy. Complete inhibition of bacterial growth of the three tested bacterial strains on the surface of nanofiber textiles with encapsulated TPP was observed on illuminated samples in vitro. The antibacterial effect is based on photogeneration of cytotoxic singlet oxygen O2(1Δg) upon illumination by visible light. The antibacterial activity was also clinically tested in 162 patients with chronic leg ulcers. The application of illuminated doped nanofiber textiles yielded to a 35% decrease in wound size as assessed with computer aided wound tracing. The wound related pain estimated by the visual analogue scale declined by 71%. This methodology seems to be an effective alternative to topical antibiotics and antiseptics in chronic wounds and shows broad spectrum of application in medicine, particularly in dermatology, burn units and surgery.
Key words:
leg ulcer – nanofabrics – photosensitizer – photodynamic therapy
Autori: P. Arenberger 1; M. Arenbergerová 1; S. Gkalpakiotis 1; J. Hugo 1; M. Bednář 2; P. Kubát 3; J. Mosinger 4,5
Pôsobisko autorov: Dermatovenerologická klinika 3. LFUK a FNKV, Praha přednosta prof. MUDr. Petr Arenberger, DrSc., MBA 1; Ústav lékařské mikrobiologie 3. LFUK a FNKV, Praha přednosta doc. MUDr. Marek Bednář, CSc. 2; Ústav fyzikální chemie J. Heyrovského AV ČR, Praha ředitel prof. RNDr. Zdeněk Samec, DrSc. 3; Katedra anorganické chemie, Přírodovědecká fakulta UK, Praha děkan fakulty prof. RNDr. Bohuslav Gaš, CSc. 4; Ústav anorganické chemie AV ČR, v. v. i., Řež ředitelka Ing. Jana Bludská, CSc. 5
Vyšlo v časopise: Čes-slov Derm, 87, 2012, No. 5, p. 176-182
Kategória: Terapie, farmakologie a klinické studie
Súhrn
Nanotkaniny dopované fotosenzibilizátorem 5,10,15,20-tetrafenylporfyrinem (TPP) byly připraveny pomocí elektrospiningu z vysoce hydrofilního polyuretanu (TecophilicTM) a charakterizovány mikroskopickými metodami a časově rozlišenou spektroskopií. V in vitro experimentech byla vyvolána kompletní inhibice bakteriálního růstu tří testovaných bakteriálních kmenů na povrchu nanotkaniny, s enkapsulovaným TPP po ozáření viditelným světlem. Antibakteriální efekt je založen na fotogeneraci cytotoxického singletového kyslíku O2(1Δg) po ozáření viditelným světlem. Klinicky byly antibakteriální účinky testovány u 162 pacientů s chronickými bércovými vředy. Aplikace ozařované nanotkaniny s fotosenzibilizátorem vedla k 35% zmenšení velikosti vředu, což bylo dokumentováno pomocí počítačového měření velikosti rány. Bolestivost ve vředu, zjišťována vizuální analogovou škálou, se snížila o 71 %. Tato metoda je účinnou alternativou lokálních antibiotik a antiseptik u chronických ran a nabízí široké spektrum použití v medicíně, především v dermatologii, popáleninových centrech a chirurgii.
Klíčová slova:
bércový vřed – nanotkanina – fotosenzibilizátor – fotodynamická terapieÚVOD
Polymerní nanovlákna se stávají hojně využívaným nanomateriálem. Vzhledem ke svým výjimečným vlastnostem (velký specifický povrch, nízká hmotnost, nízké náklady na výrobu a mechanická pružnost) se již nyní používají k modernímu ošetřování ran jako dočasné kožní kryty nebo nosiče léků.
„Electrospinning“ je jednoduchou a levnou metodou pro přípravu polymerních vláken, jejichž průměr je v řádu nanometrů až několika mikrometrů. Technologickým postupem se z nich dají vytvořit materiály s velkým povrchem a porézní strukturou. Takto vyrobené tzv. nanotkaniny napodobují strukturu pars reticularis koria a mohou být užity jako kostra pro tkáňové inženýrství (především pro reparaci a regeneraci tkání), jako nosiče schopné uvolňovat léky a jako biosenzory. Antimikrobiálních účinků se může dosáhnout přidáním nanočástic (obsahujících ionty stříbra, peroxidy), fotosenzibilizátorů či jiných chemických sloučenin. Takovéto materiály mohou být vhodnou alternativou antibiotik, vzhledem k narůstající rezistenci mikroorganismů vedoucí k nižší účinnosti konvenční léčby.
Náš přístup k přípravě antimikrobiálního materiálu využívá fotoinaktivaci bakterií, založenou na generování singletového kyslíku uvnitř polymerních nanovlákenných materiálů. Tyto materiály, vykazující nízkou toxicitu ve tmě, jsou aktivovány světlem. Antimikrobiální mechanismus účinku zahrnuje fotoexcitaci zabudovaného fotosenzibilizátoru, vznik jeho excitovaného tripletového stavu a přenos energie z tripletového stavu fotosenzibilizátoru na tripletový kyslík za vzniku singletového kyslíku (obr. 1). Krátce žijící cytotoxický singletový kyslík je silným oxidačním činidlem, je schopen degradovat buněčné struktury bakterií.
Obr. 1. Princip fotoaktivace nanovlákenných materiálů dopovaných tPP fotosenzibilizátorem Po aktivaci světlem je na základě fotosenzitizované reakce přenosem energie z tripletového stavu fotosenzibilizátoru (3tPP) na kyslík generován singletový kyslík s cytotoxickým účinkem. antibakteriální účinek je demonstrován namodrozelených koloniích <i>E. coli</i> dh5α s plasmidem pgeM11Z. 
Chronické rány jsou defekty v kůži, které se nezhojí do 8 týdnů od svého vzniku, a to přes profesionálně vedenou léčbu [21]. Vřed dolní končetiny postihující hluboké tkáně, je nejběžnějším typem chronické rány. Chronické rány jsou významným medicínským problémem, představují značné finanční zatížení zdravotního systému a vedou až k mnoholetým obtížím pacienta [22].
Jedním z úkolů při léčbě vředů dolních končetin je navození aseptického prostředí jak vlastní rány, tak jejího krytí. Tohoto může být dosaženo tradičně aplikací antiseptik a antibiotik [2]. Tento postup však nejen inhibuje množení patogenů, ale zároveň i proliferaci kolagenu v koriu a rekolonizaci granulační tkáně keratinocyty, což zpomaluje hojící proces [8]. Dalším problémem pak je i stoupající rezistence na antibiotika, což vede k nižší účinnosti standardní léčby [20]. Oba tyto problémy prodlužují dobu léčby a zvyšují počet pacientů s chronickými vředy dolních končetin [24].
Náš přístup k přípravě antimikrobiálního nanomateriálu spočívá ve fotoinaktivaci bakterií, založené na fotogenerování molekul singletového kyslíku s velmi krátkou dobou života uvnitř polymerních nanovláken, biokompatibilních s kožní tkání [12]. Singletový kyslík má velmi krátkou dobu života (ve vodných roztocích cca 3,5 µs) [3] a tím krátkou difuzní dráhu (v polymerech a vodných roztocích v řádech desítek až stovek nanometrů) [7]. To zajišťuje bezpečný povrchový antibakteriální efekt, který neinterferuje s procesem hojení. Materiál z nanovláken je optimálním nosičem fotosenzibilizátoru [4, 5]. Nanovlákna jsou extrémně tenká, průsvitná, umožňují tedy snadný přístup světla a tím maximální fotoaktivaci fotosenzibilizátoru. Zároveň pevně přiléhají k bakteriálnímu biofilmu na spodině rány. To zaručuje přímý účinek singletového kyslíku na proteiny [15] a buněčné membrány [13] především bakterií a tím antiseptické vlastnosti [14, 16]. Metoda je vhodnou alternativou k lokální aplikaci antibiotik a antiseptik jak v podmínkách in vitro tak in vivo. Navíc má minimální nežádoucí účinky.
Pacienti a metody
Chemikálie
Byl koupen 5,10,15,20-tetrafenylporfyrin (TPP), N,N-dimethylformamid (DMF) a tetraethylammonium bromid (TEAB) od fy Sigma-Aldrich (USA). Polyurethan TecophilicTM, byl koupen od fy Novotex (Itálie).
Detailní protokoly fotofyzikálních měření byly publikovány v předchozích pracích [10, 17].
Příprava polymerních nanovláken
Nanovlákna a z nich vytvořené nanotkaniny byly připraveny metodou „electrospinning“, technologií NanospiderTM [5].
Polyuretanový roztok (PUR) TecophilicTM (15 % v DMF) použitý pro přípravu PUR nanovlákenného materiálu obsahoval 1 % TPP, 0,01 % TEAB a 98,99 % PUR.
Morfologie nanovlákenného materiálu byla analyzována pomocí SEM (FEI Quanta 200 s Everhart-Thornley sekundárním elektronovým detektorem) [5].
Antibakteriální experimenty v podmínkách in vitro
Bakteriální kmeny Staphylococcus aureus CCM 3953, Pseudomonas aeruginosa CCM 3955, Escherichia coli CCM 3954 (Česká sbírka mikroorganismů, Přírodovědecká fakulta Masarykovy univerzity, Brno, Česká republika) byly oživeny podle instrukcí dodavatele. Z čistých 16hodinových kultur kmenů na živném agaru (Kmána, Šarišské Michalany, Slovensko) byly připraveny suspenze ve fyziologickém roztoku o denzitě 0,5 McFarlandovy stupnice. Ty byly následně pětkrát zředěny fyziologickým roztokem. Takto připravené bakteriální suspenze byly individuálně použity pro inokulaci na povrch testovaných vzorků nanotkanin. Pro testování bakteriálního růstu byl použit Muellerův-Hintonův agar (Oxoid Ltd.) o tloušťce 4 mm v Petriho miskách o průměru 90 mm. Testované vzorky byly nastříhány sterilními nůžkami do čtverců o ploše 2 x 2 cm a následně odděleny z papírového nosiče sterilními klíšťkami.
Vždy dva vzorky nanotkanin s fotosenzibilizátorem a jeden bez fotosenzibilizátoru byly umístěny na povrch Muellerova-Hintonova agaru. Na povrch všech tří zkoumaných vzorků bylo pomocí mikrotitrační pipety naneseno 100 μl každé ze tří bakteriálních suspenzí. Misky se vzorky byly umístěny do inkubátoru za konstantní teploty 37 °C. Víčka misek byla otevřena a 2 z pokusných vzorků (jeden s fotosenzibilizátorem a jeden bez něho) byly ozářeny studeným bílým světlem halogenové lampy o výkonu 150 W (Kruss fibre-optic light source KL 5125, Německo). Spektrum lampy je od 400 do 860 nm s vrcholem 690 nm. Zdroj záření byl umístěn vně inkubátoru a vodič světla byl zaveden pracovním kanálem do jeho nitra. Zakončení světelného vodiče bylo 3 cm nad povrchem nanovláken. Časy expozice byly 0 (neosvíceno), 5, 10, respektive 30 minut. Všechny pokusy byly prováděny trojmo. Po expozici světlu byly Petriho misky uzavřeny víčky a ponechány v inkubátoru po dobu 12 hodin. Po uplynutí této doby byly misky vizuálně zkontrolovány a rozdíly v bakteriálním růstu (hustota kolonií) zkoumány u všech vzorků.
Design klinického experimentu
Klinický výzkum porovnával 3 léčebné varianty. Pacienti (n = 162) byli rozděleni do tří skupin v poměru 2 : 1 : 1. Skupina 1, v níž bylo 84 pacientů, byla ošetřována pomocí osvícené nanotkaniny s fotosenzibilizátorem. Skupina 2, ve které bylo 39 osob, byla ošetřována pomocí osvícené nanotkaniny bez fotosenzibilizátoru. Skupina 3 se stejným počtem pacientů byla ošetřována pomocí nanotkaniny s fotosenzibilizátorem, která však byla chráněna před světlem. Primárním cílem bylo zjistit, jaký antimikrobiální efekt mají světlem aktivované nanotkaniny s fotosenzibilizátorem. Sekundárním cílem bylo pozorovat redukci rozsahu vředů, efekty léčby a bezpečnost terapie. Pacienti podstupovali léčbu po dobu 42 dnů. Rozdělení pacientů bylo zaslepené pro pacienty a lékaře, zatímco zdravotní sestry byly odslepeny.
Léčba
Nezávislá etická komise schválila klinickou část experimentu podle mezinárodně přijatých standardů. Pacienti přijatí do výzkumu byli informování jak ústně, tak písemně a svoji dobrovolnou účast stvrdili písemným souhlasem. Účastníci byli nabíráni během let 2008–2011. Podmínkou bylo, aby byli starší 18 let a měli chronický vřed déle jak 8 týdnů. Vřed musel být široký minimálně 1,6 cm v kterémkoli směru, s maximální plochou 50 cm2.
U pacientů byl vyšetřován poměr krevního tlaku nad kotníkem a na paži, který musel být vyšší než 0,8, a dále byla provedena kromě klinického flebologického vyšetření buď duplexní sonografie, nebo flebografie. Pacienti byli požádáni, aby během dne dodržovali kompresní terapeutický režim se začátkem minimálně 2 týdny před započetím experimentu a po dobu jeho trvání. Typ bandáže byl volitelný, ale musel být stejný po celou dobu výzkumu. Zvolená bandáž musela vyvolávat dostatečnou kompresi, aby udržela konstantní obvod kolem kotníku.
Vylučovacími kritérii z účasti ve studii bylo těhotenství či kojení u žen, vaskulitida, současná léčba systémovými antibiotiky, kortikoidy (více než 10 mg/den prednisonu nebo jeho ekvivalentu), případně jinými imunosupresivy či protinádorovými chemoterapeutiky, užívaná jeden měsíc před zahájením experimentu.
Pacienti zůstávali po dobu vyšetřování na lůžkovém oddělení. Léčebný proces zahrnoval dvakrát denně aplikaci krytí nanotkaninou s fotosenzibilizátorem, která byla buď 60 minut 2krát denně osvícena 150 W halogenovou lampou se studeným bílým světlem, nebo byla před světlem chráněna. Kontrolní skupina byla ošetřována pouze nanotkaninou bez fotosenzibilizátoru. V mezidobí mezi osvětlováním byly nasazeny kompresní bandáže. Skupina pacientů, jejichž nanotkanina nebyla osvěcována, snímala bandáže stejnou dobu jako ostatní dvě skupiny, ale jejich nanotkanina byla udržována ve tmě. Při osvětlování byl konec světelného vodiče 5 cm nad povrchem vředu. Všem pacientům byly na noc vředy překryty gázami napuštěnými vazelínou, podle standardního postupu péče. Účastníci výzkumu byli takto ošetřováni po 6 týdnů, kratší dobu pouze v případě, že se rána zhojila již před uplynutím daného časového období. Pacienti byli navíc požádáni, aby i po skončení výzkumu docházeli do nemocnice jednou týdně z důvodu postintervenční observace. V závěru několik pacientů požádalo o pokračování léčby v případech, kdy se rána nestihla zcela zahojit. Těmto žádostem bylo vyhověno, ale výsledky byly zpracovány odděleně.
Antibakteriální efekt v podmínkách in vivo
Všem pacientům byl proveden stěr z rány nejprve před začátkem pokusu a dále na počátku každého týdne, za použití totožné techniky a materiálu. Standardní mikrobiologické techniky analýzy takto získaných vzorků zahrnovaly identifikaci typu přítomného mikroorganismu. Semikvantitativní techniky umožňovaly určit stupeň bakteriálního růstu pomocí pozorování na čtyřech kvadrantech misky s agarem, kdy každý kvadrant byl sekvenčně inokulován z předešlého, za použití sterilní kličky, takže vždy došlo ke zředění oproti předchozímu kvadrantu. Čím větší množství bakterií bylo přítomno na originálním stěru, tím více kvadrantů vykázalo bakteriální růst [1]. Tato semikvantitativní škála pro popis bakteriálního růstu je analogická ke stupnici křížků (+, ++, +++, ++++), užívané v některých laboratorních hodnoceních. Pro statistické zpracování byly místo křížků použity číslice. Ke zjištění, zda existuje signifikantní rozdíl mezi třemi skupinami našich pacientů, byly použity statistické metody: analýza kontingenčních tabulek a Pearsonův chi-kvadrátový test. Výsledky byly dále potvrzeny pomocí neparametrického testu analýzy variance Kruskal-Wallis (ANOVA). V případě vysoké hladiny významnosti (p < 0,001) byly pro ověření rozdílů mezi skupinami provedeny testy mnohočetného porovnání.
Velikost rány, hojení a zmírnění bolesti
Velikost rány byla sledována pomocí počítačového měření okrajů vředu. Toto hodnocení probíhalo v 15., 28. a 42. dni. Analýza variance (ANOVA) z opakovaných měření byla použita u všech tří skupin pro určení, zda se velikost rány signifikantně změnila po provedené léčbě. Pokud byl nalezen vysoce signifikantní výsledek (p < 0,001), byl pro jeho ověření proveden ještě post-hoc Bonferroniho test.
Hojení rány bylo posuzováno těmito parametry: odumřelá tkáň, fibrinové povlaky, zdravá granulační tkáň a epitelizace. Zmírnění bolesti bylo pacienty registrováno ve vizuální analogové škále (VAS; 0 = žádná, 10 = maximální).
Bezpečnost
Bezpečnost léčby byla monitorována podle Evropských standardů pro testování zdravotnických prostředků na lidských subjektech. Příčinná souvislost nežádoucího účinku se sledovala v parametrech posuzujících vztah k léčbě a byla rozdělena do tří skupin: související, potenciálně související a bez souvislosti s léčbou. Všechny nežádoucí účinky byly nahlášeny buď spontánně pacienty, nebo vyšetřujícím personálem.
VÝSLEDKY
Vlastnosti nanotkanin
Nanovlákenná struktura připravených textilií byla ověřena pomocí skenovacího elektronového mikroskopu (SEM). Plošná hmotnost vzorků činila 2 g/m2, s tloušťkou 30 µm a průměrem jednotlivých nanovláken 95–400 nm. UV/VIS spektrum nanotkanin vykazuje intenzivní absorpci v modré oblasti (tzv. Soretův pás při 415 nm) a slabší absorpci v ostatních oblastech spektra (tzv. Q-pásy).
K ověření fotogenerace singletového kyslíku (O2(1Δg)) byla využita metoda časově rozlišené spektroskopie. Nanotkaniny dopované TPP byly ozařovány pulzním barvivovým laserem (λexc = 425 nm, šířka pulzu = 28 ns). Byla sledována charakteristická fosforescence singletového kyslíku na vlnové délce 1270 nm.
Fotogeneraci a následné zhášení singletového kyslíku popisuje rovnice:
kde ASO je konstanta úměrná kvantovému výtěžku O2(1Δg), τT je doba života tripletových stavů fotosenzibilizátoru a τΔ je doba života O2(1Δg).
Signál (intenzita fosforescence) singletového kyslíku v čase byl fitován shora uvedenou funkcí. Fitováním byly získány doby života tripletových stavů fotosenzibilizátoru TPP (τT =2,9 ± 0,3 µs v kyslíkové atmosféře a τT =18 ± 2 µs v atmosféře vzduchu) a singletového kyslíku (τΔ = 15 ± 3 µs v atmosféře kyslíku i vzduchu). Hodnoty ukazují, že excitované tripletové stavy TPP jsou účinně zhášeny (za přenosu energie) kyslíkem. Doby života singletového kyslíku jsou typické pro prostředí polyuretanových polymerů [5].
Vyšetřovaný soubor
Vyšetřovaný soubor sestával ze 162 pacientů s chronickým venózním vředem dolních končetin, který přetrvával déle než 8 týdnů. Tito pacienti byli rozděleni podle poměru 2 : 1 : 1 do tří skupin. Skupina 1: pacienti byli ošetřováni osvětlovanou nanotkaninou s fotosenzibilizátorem (84); skupina 2: pacienti byli ošetřováni osvětlovanou nanotkaninou bez fotosenzibilizátoru (39); skupina 3: pacienti byli ošetřováni nanotkaninou s fotosenzibilizátorem, chráněnou před světlem (39). Nábor účastníků studie probíhal v letech 2008–2011 na Dermatovenerologické klinice Fakultní nemocnice Královské Vinohrady. Celkem bylo ošetřováno 191 chronických ran. Průměrný věk pacientů byl 54 let, s rozmezím od 39 do 92 let. Analýza vyšetřovaných skupin ukázala, že účastníci byli rovnoměrně rozděleni podle pohlaví. Průměrná doba přetrvávání chronického vředu byla 2,7 let, s rozmezím od 3 měsíců do 10 let.
Antibakteriální experiment v in vitro podmínkách
Antibakteriální efekt nanovláken s fotosenzibilizátorem byl testován na 3 bakteriálních kmenech: Staphylococcus aureus CCM 3953, Pseudomonas aeruginosa CCM 3955 a Escherichia coli CCM 3954. U každého kmene byly zkoumány tři testované varianty:
- a) osvětlovaná nanotkaninou s fotosenzibilizátorem;
- b) osvětlovaná nanotkaninou bez fotosenzibilizátoru;
- c) nanotkanina s fotosenzibilizátorem chráněná před světlem. Test byl hodnocen po 5, 10 a 30 minutách osvitu.
Po 5 minutách osvitu nebyly ani u jednoho ze tří vzorků přítomny rozdíly v růstu bakterií (tab. 1). Po 10 minutách osvitu byly pozorovány ve vzorcích s fotozenzitizátorem rozdílné účinky na redukci bakteriálního růstu. Tento účinek byl nižší pro Pseudomonas aeruginosa než pro Escherichia coli a Staphylococcus aureus (obr. 2). Nanotkanina bez fotosenzibilizátoru neovlivňovala bakteriální růst, stejně jako neosvícené vzorky s nanotkaninou s fotosenziblizátorem. Maximální efekt byl pozorován u všech třech bakteriálních kultur po 30 minutách osvitu ve vzorcích s nanovlákny obsahujícími fotosenzibilizátor, kde nebyly nalezeny žádné kolonie. Naproti tomu stejný postup neovlivňoval růst bakteriálních kultur, pokud byla použita nanotkanina bez fotosenzibilizátoru nebo neosvětlovaná tkanina s fotosenzibilizátorem.
Tab. 1. Rozdíly v proliferaci bakterií inokulovaných na nanotkaninách s fotosenzibilizátorem (+) nebo bez něho (-) po různě dlouhé době osvícení 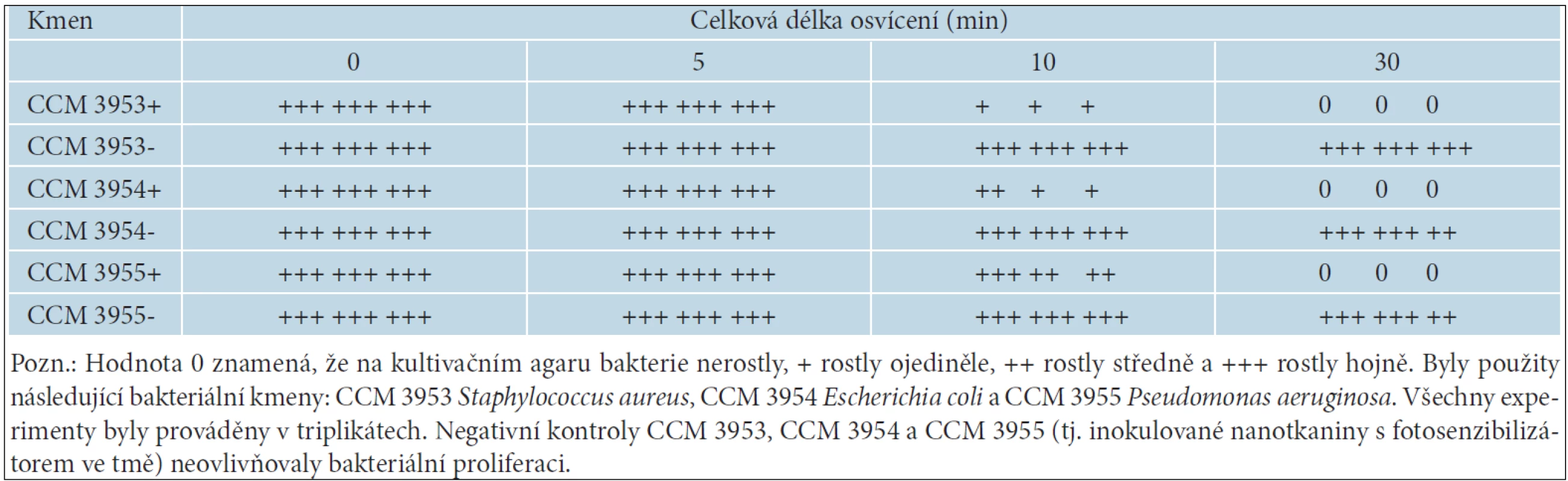
Obr. 2. Antimikrobiální účinek nanotkanin při různých variantách experimentu <i>Staphylococcus aureus</i> CCM 3953 byl inokulován na nanotkaninu (a) s fotosenzibilizátorem a osvětlováním, (B) osvětlovanou bez fotosenzibilizátoru a (C) s fotosenzibilizátorem ve tmě. osvětlované nanotkaniny byly exponovány světlu po dobu 30 min před dvanáctihodinovou inkubací při 37 °C na Muellerově-Hintonově agaru. 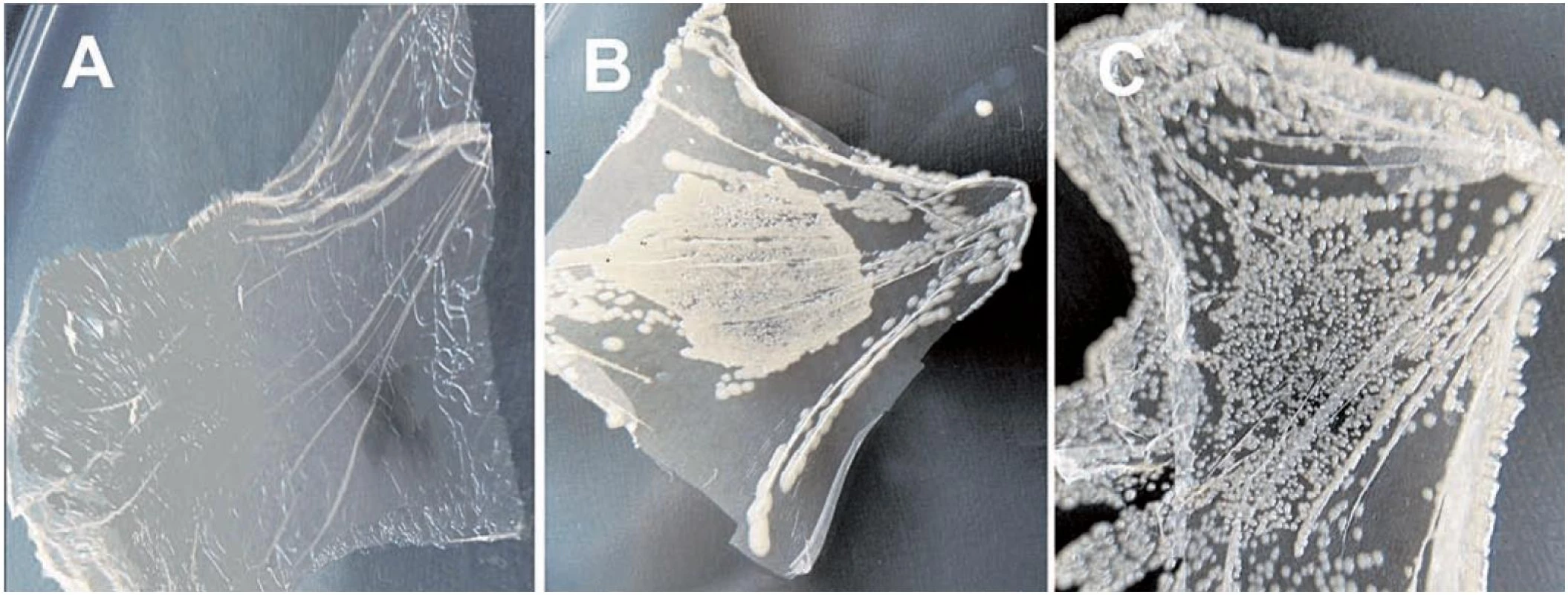
Antibakteriální experiment v in vivo podmínkách
Z bércových vředů byl v definovaných časových odstupech odebírán stěr na kultivační vyšetření u každého z pacientů. Výsledky pro každou terapeutickou skupinu byly statisticky zhodnoceny pomocí U testu Mann-Whitney. Semikvantitativní bakteriální kultivace byla s ohledem na množství bakterií kategorizována jako nulová (0), nízká (1), mírná (2), střední (3) a masivní (4). Nalezli jsme statisticky signifikantní rozdíly u všech tří skupin v 28. a 42. dni. Ve skupině 1 byla ve 28. dni přítomna kolonizace kvadrantů o stupni 0–1 v 63 % a ve 42. dni v 90 % případů. V porovnání s tím, ve skupině 2 byla v 28. dni většina případů kolonizována stupněm 2–3, kdy se tento stav signifikantně nezměnil až do 42. dne. Skupina 3 vykazovala ve 28. dni maximální kolonizaci o stupni 2–4, ve 42. dni ovšem bylo v některých případech pozorováno další zhoršení. Ve všech zmiňovaných případech byly hladiny významnosti p < 0,001. Mnohočetný komparativní test ANOVA prokázal vysoce signifikantní rozdíl v 28. a 42. dni.
Pokud bylo možné izolovat mikroorganismy z rány, nejčastěji nalézaným patogenem byl Staphylococcus aureus, s výskytem v téměř 90 % ran. Kmeny Pseudomonas aeruginosa a Escherichia coli byly rovněž detekovány, ale s nižším množstvím výskytu. Pouze v 6 % stěrů byl identifikován druh Streptococcus species.
Velikost rány
Ve skupině 1 s osvětlovanou nanotkaninou s fotosenzibilizátorem se velikost rány zmenšila v průměru z 12,5 cm2 na 8,1 cm2 (p < 0,001) – obrázek 3. V této skupině pacientů se 11 vředů zhojilo kompletně. Ve skupině 2 s osvětlovanou nanotkaninou bez fotosenzibilizátoru se po 6 týdnech terapie zmenšila velikost rány z 11,8 cm2 na 11,6 cm2 (p > 0,05). Jediný signifikantní rozdíl této skupiny byl pozorován po 2 týdnech léčby, kdy se velikost rány redukovala z 11,8 cm2 na 10,9 cm2 (p < 0,05). U skupiny 3 s nanotkaninou s fotosenzibilizátorem chráněnou před světlem se velikost rány zvětšila z 11,1 cm2 na 12,6 cm2.
Obr. 3. Absolutní změny velikosti vředu Tři terapeutické skupiny byly porovnávány podle velikosti plochy vředu. velikost vředu byla změřena na začátku studie a v léčebných dnech 15, 28 a 42. Byly zaznamenány statisticky signifikantní rozdíly při zmenšení ploch vředu mezi jednotlivými skupinami. Plocha vředu u pacientů léčených osvětlovanou nanotkaninou s fotosenzibilizátorem se snížila v průměru z 12,5 cm<sup>2</sup> na 8,1 cm<sup>2</sup> (p < 0,01). ve 2. skupině, která byla léčena osvětlovanou nanotkaninou bez fotosenzibilizátoru, se po 6 týdnech terapie zmenšila plocha vředu z 11,8 cm<sup>2</sup> na 11,6 cm<sup>2</sup> (p > 0,05). u pacientů ve 3. skupině, která byla léčena nanotkaninou s fotosenzibilizátorem chráněnou před světlem, se během léčby zvětšila plocha vředu z 11,1 cm<sup>2</sup> na 12,6 cm<sup>2</sup>. 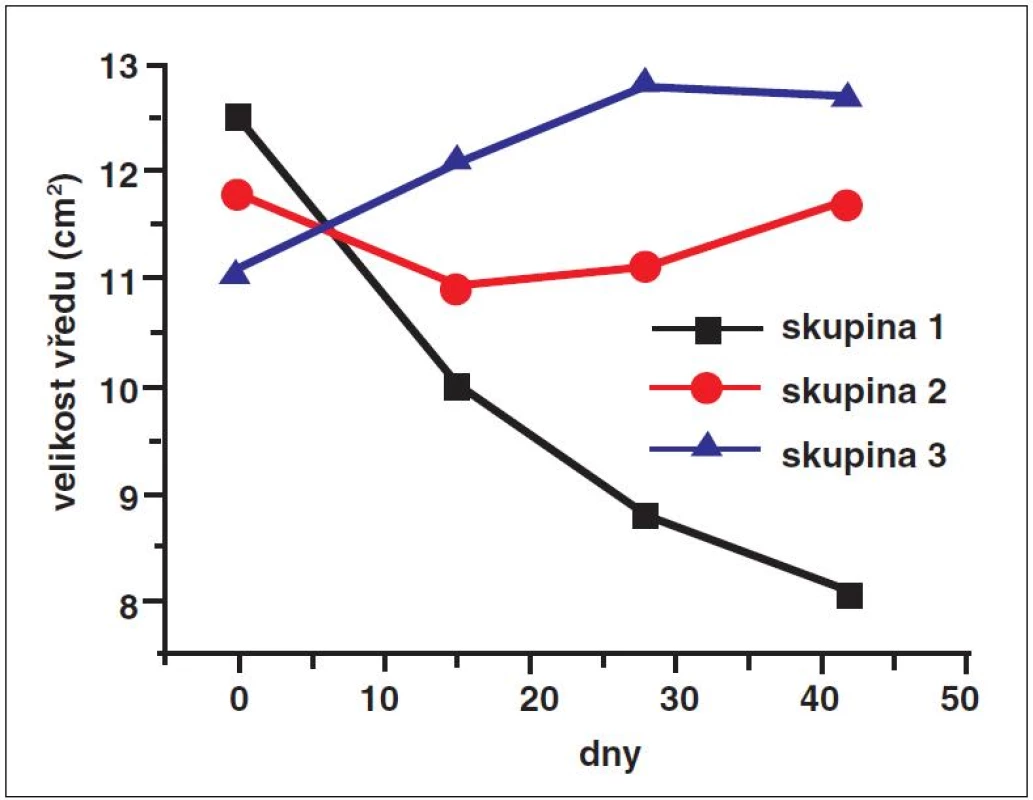
Hojení ran a zmírnění bolesti
Hojení rány bylo posuzováno těmito parametry: nekrotická tkáň, fibrinové povlaky, zdravá granulační tkáň a epitelizace. Hodnocení probíhalo 15., 28. a 42. den terapie. Ve skupině 1 byl pozorován rozdíl mezi baseline a 42. dnem: úbytek nekrotické tkáně o 78 %, redukce fibrinového povlaku o 92 % a naopak přibývání epitelizace o 71 % a zvýšení přítomnosti zdravé granulační tkáně o 65 % (obr. 4). Ve skupině 2 byl ve stejném časovém období zjištěn úbytek nekrotické tkáně o 24 %, fibrinových povlaků o 19 %, naproti tomu vzestup epitelizace o 16 % a zdravé granulační tkáně o 22 %. Ve skupině 3 byl zjištěn pokles odumřelé tkáně o 15 % a fibrinového povlaku o 6 %, nárůst epitelizace o 8 % a zvýšení množství granulační tkáně o 11 %.
Obr. 4. Klinický obraz dvou pacientů ze skupiny 1 (pacient č. 7 – černá písmena, pacient č. 48 – bílá písmena) ošetřovaných osvětlovanou nanotkaninou s fotosenzibilizátorem a = baseline, B = 15. den, C = 42. den 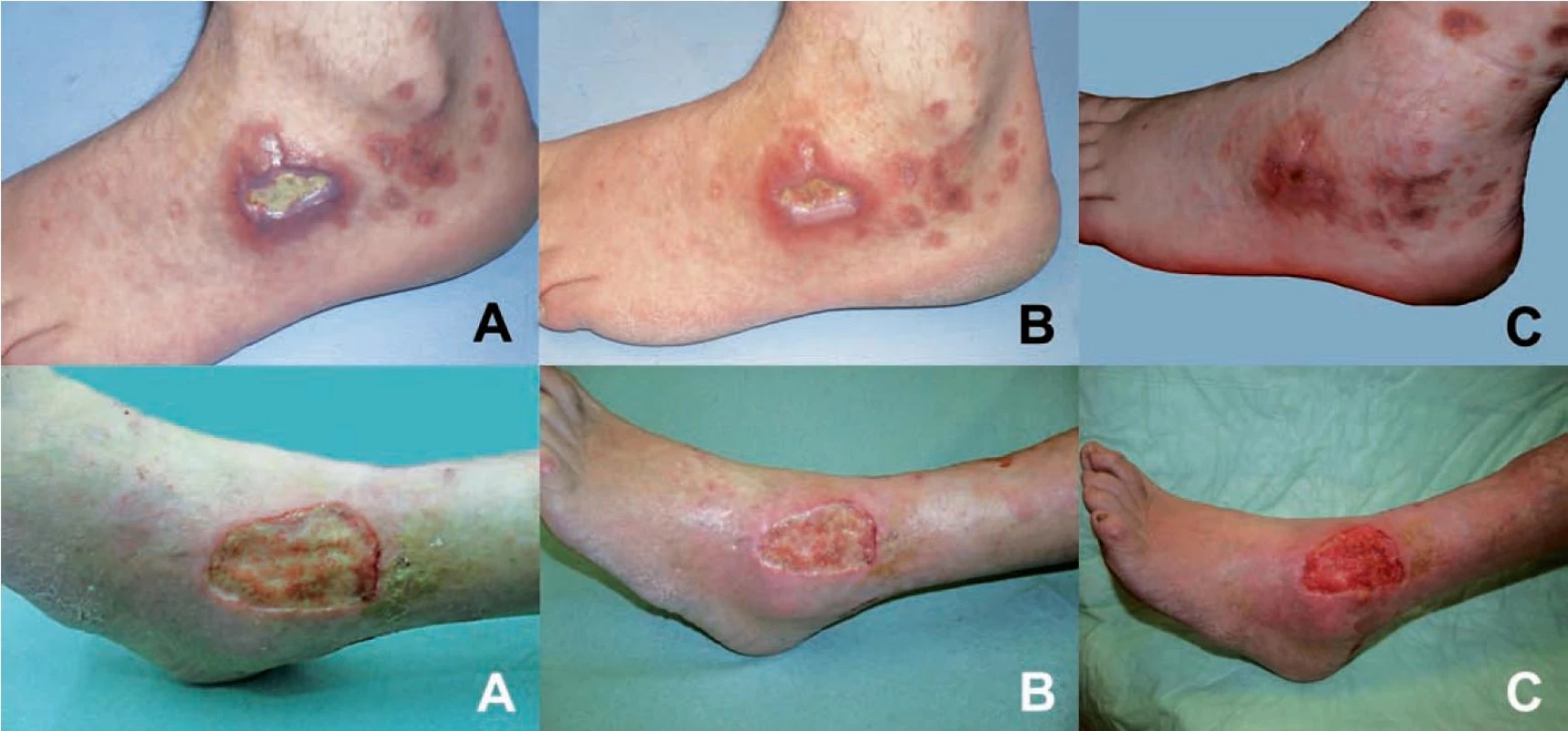
Intenzita bolesti byla odhadována pacienty ve všech skupinách pomocí vizuální analogové škály (VAS; 0 = žádná, 10 = maximální). Testování probíhalo v baseline, 15., 28. a 42. den terapie. Ve skupině 1 byla počáteční střední hodnota 6,2, která klesla k 42. dni o 71 % na hodnotu 1,8 (p < 0,001). Ve skupině 2 klesla ve stejném období počáteční střední hodnota 5,1 o 49 % na hodnotu 2,6 (p < 0,05). Ve skupině 3 klesla k 42. dni počáteční střední hodnota 4,8 o 6 % na 4,5 (p > 0,05).
Nežádoucí účinky
Celkem se vyskytlo 19 případů nežádoucích účinků u 15 pacientů. Ve skupině 1 byl nahlášen nežádoucí účinek léčby u 11 % případů (9/84). Ve skupině 2 byly zjištěny nežádoucí účinky u 15 % případů (6/39). A ve skupině 3 se vyskytly nežádoucí účinky u 10 % (4/39).
Většina nežádoucích účinků byla povahy pálení ošetřované oblasti během osvitu. Všechny nahlášené nežádoucí účinky byly pouze mírné intenzity a terapie proto nemusela být u pacientů přerušena. Během studie se nevyskytly žádné závažné nežádoucí účinky s příčinnou souvislostí k prováděnému výzkumu.
DISKUSE
Hojení chronických ran je složitý proces. Pro toto klinické hodnocení byly proto vybráni pacienti s vředy DK venózního původu jako relativně homogenní skupina z hlediska patofyziologie vzniku chronické rány a předchozí léčby [6].
Přítomnost polymikrobiálního biofilmu v ranách vede ke zvýšenému uvolňování prozánětlivých cytokinů, vzestupu aktivity tkáňových metaloproteináz a inhibici migrace a adhezivity keratinocytů. Antimikrobiální prostředky mají svá omezení z pohledu účinnosti, kontaktní senzibilizace, zvyšující se rezistence patogenů na antibiotika a negativních vlivů na proliferaci tkáně [11, 18]. Vývoj nových alternativ k antibiotikům se proto stal předmětem velkého komerčního zájmu [19].
Data prezentovaná v této studii demonstrují antibakteriální účinky fotoinaktivace původců, která je založena na fotosenzibilizátorem vytvářeném vysoce reaktivním singletovém kyslíku O2(1Δg). Tyto výsledky jsou ve shodě s recentními in vitro studiemi, které potvrdily antibakteriální aktivitu vůči Streptococcus mutans za použití fotodynamické metodiky [23]. Tento postup je založen na aplikaci kyseliny 5-aminolevulové, o níž je známo, že je účinná při léčbě acne vulgaris [9]. Nanotkanina je optimálním nosičem fotosenzibilizátoru, neboť je extrémně tenká, což umožňuje průnik světla tkaninou s nejvyšší možnou aktivací fotosenzibilizátoru. Navíc dobře adheruje k bakteriálnímu biofilmu na spodině vředu, což zajišťuje přímý antiseptický účinek molekul singletového kyslíku O2(1Δg).
Extrémní reaktivita toxických produktů kyslíku aktivovaných světlem způsobuje, že mohou eliminovat pouze ta agens, která jsou v přímém kontaktu s nanotkaninou, neboť toxicita se ztrácí téměř okamžitě po uvolnění z nanotextilie. To zabraňuje poškození okolní granulační tkáně i hlubších struktur, a přispívá tak k bezpečnosti léčby.
Tato studie hodnotila několik klinických aspektů hojení ran, přičemž sledované osoby byly rozděleny do tří skupin. Ve skupině, ošetřované osvětlovanou nanotkaninou obsahující tetrafenylporfyrinový fotosenzibilizátor, došlo po 42 dnech ke zmenšení vředu, redukci množství odumřelé tkáně a fibrinových povlaků, a naopak ke zvýšení množství zdravé granulační tkáně a epitelizace. Dále bylo dosaženo zmírnění bolesti provázející chronické rány a současně nebyly pozorovány žádné závažné nežádoucí účinky léčby.
Studie prokázala oprávněnost použití světlem aktivovaných nanotkanin s tetrafenylporfyrinovým fotosenzibilizátorem jako aseptického krytí v léčbě vředů dolní končetiny. Náš přístup je založen na fotoinaktivaci bakterií. Tato metoda je založena na generování vysoce reaktivních molekul singletového kyslíku O2(1Δg) s krátkým poločasem, které vykazují antibakteriální účinek pouze na povrchu materiálu. Efekt je tak značně povrchový v porovnání se standardními antiseptickými postupy, lze tedy předpokládat, že námi zvolená metoda neinterferuje s hojícím procesem. Zde popsaná metoda je vhodnou alternativou k lokální aplikaci antibiotik a antiseptik, je účinná jak při použití in vitro, tak in vivo a způsobuje minimální nežádoucí účinky. Závěrem lze shrnout, že tato metoda nabízí široké spektrum použití v medicíně.
Poděkování: Tato práce byla podpořena grantem Ministerstva zdravotnictví ČR IGA NS/10093-4/2008 a Ministerstva školství, mládeže a tělovýchovy ČR MSM 0021620857.
Do redakce došlo dne 18. 5. 2012.
Kontaktní adresa
Prof. MUDr. Petr Arenberger, DrSc., MBA
Dermatovenerologická klinika 3. LF UK a FNKV
Šrobárova 50
100 34 Praha 10
e-mail: pa@avemedica.cz
Zdroje
1. BILL, T. J., RATLIFF, C. R., DONOVAN, A. M. et al. Quantitative swab culture versus tissue biopsy: a comparison in chronic wounds. Ostomy Wound Manage, 2001, 47, p. 34–37.
2. CITRON, D. M., GOLDSTEIN, E. J., MERRIAM, C. V. et al. Bacteriology of moderate-to-severe diabetic foot infections and in vitro activity of antimicrobial agents. J. Clin. Microbiol., 2007, 45, p. 2819–2828.
3. DE ROSA, M. C., CRUTCHLEY, R. J. Photosensitized singlet oxygen and its applications. Coord. Chem. Rev., 2002, p. 233–234, p. 351–371.
4. EGOROV, S. Y., KAMALOV, V. F., KOROTEEV, N. I. et al. Rise and decay kinetics of photosensitized singlet oxygen luminescence in water. Measurements with nanosecond time-correlated single photon counting technique. Chem. Phys. Letters, 1989, 163, p. 421–424.
5. GIROTTI, A. W. Lipid hydroperoxide generation, turnover, and effector action in biological systems. J. Lipid Res., 1998, 39, p. 1529–1542.
6. GOTTRUP, F., JØRGENSEN, B., KARLSMARK, T. et al. Reducing wound pain in venous leg ulcers with Biatain Ibu: a randomized, controlled double-blind clinical investigation on the performance and safety. Wound Repair Regen, 2008, 16, p. 615–625.
7. GRACANIN, M., HAWKINS, C. L., PATTISON, D. I. et al. Singlet-oxygen-mediated amino acid and protein oxidation: Formation of tryptophan peroxides and decomposition products. Free Radical Biol. Med., 2009, 47, p. 92–102.
8. GROAH, S. L., LIBIN, A., SPUNGEN, M. et al. Regenerating matrix-based therapy for chronic wound healing: a prospective within-subject pilot study. Int. Wound J., 2011, 8, p. 85–95.
9. HARRIS, F., PIERPOINT, L. Photodynamic therapy based on 5-aminolevulinic acid and its use as an antimicrobial agent. Med. Res. Rev., 2011, Jul 26. doi 10.1002/med.20251. [Epub ahead of print]
10. JESENSKA, S., PLISTIL, L., KUBAT, P. et al. Antibacterial nanofiber materials activated by light. J. Biomed. Maters Res. A, 2011, 99, p. 676–683.
11. KIRKETERP-MØLLER, K., GOTTRUP, F. Bacterial biofilm in chronic wounds. Ugeskr Laeger, 2009, 171, p. 1097.
12. LANG, K., MOSINGER, J., WAGNEROVA, D. M. Photophysical properties of porphyrinoid sensitizers non-covalently bound to host molecules; models for photodynamic therapy. Coord. Chem. Rev., 2004, 248, p. 321–350.
13. MARTINS, A., CHUNG, S., PEDRO. A. J. et al. Hierarchical starch-based fibrous scaffold for bone tissue engineering applications. J. Tissue Eng. Regen. Med., 2009, 3, p. 37–42.
14. MOSINGER, J., JIRSAK, O., KUBAT, P. et al. Bactericidal nanofabrics based on photoproduction of singlet oxygen. J. Mater. Chem., 2007, 17, p. 164–166.
15. MOSINGER, J., LANG, K., HOSTOMSKY, J. et al. Singlet oxygen imaging in polymeric nanofibers by delayed fluorescence. J. Phys. Chem. B, 2010, 114, p. 15773–15779.
16. MOSINGER, J., LANG, K., KUBAT, P. et al. Photofunctional polyurethane nanofabrics doped by zinc tetraphenylporphyrin and zinc phthalocyanine photosensitizers. J. Fluorescence, 2009, 19, p. 705–713.
17. MOSINGER, J., LANG, K., PLISTIL, L. et al. Fluorescent polyurethane nanofabrics: A source of singlet oxygen and oxygen sensing. Langmuir, 2010, 26, p. 10050–10056.
18. NELSON, E. A., O’MEARA, S., GOLDER, S. et al. Systematic review of antimicrobial treatments for diabetic foot ulcers. Diabet. Med., 2006, 23, p. 348–359.
19. OMAR, N. S., EL-NAHAS, M. R., GRAY, J. Novel antibiotics for the management of diabetic foot infections. Int. J. Antimicrob. Agents, 2008, 31, p. 411–419.
20. O’MEARA, S., AL-KURD, I. D., OLOGUN, Y. et al. Antibiotics and antiseptics for venous leg ulcers. Cochrane Database Syst. Rev., 2010, CD003557.
21. RAFFETTO, J. D. The definition of the venous ulcer. J. Vasc. Surg., 2010, 52 (5 Suppl), p. 46–49.
22. SEN, C. K., GORDILLO, G. M., ROY, S., KIRSNER, R. et al. Human skin wounds: a major and snowballing threat to public health and the economy. Wound Repair Regen, 2009, 17, p. 763–771.
23. SCHNEIDER, M., KIRFEL, G., BERTHOLD, M. et al. The impact of antimicrobial photodynamic therapy in an artificial biofilm model. Lasers Med. Sci., 2011, 3, p. 615–620.
24. SCHULTZ, G. S., DAVIDSON, J. M., KIRSNER, R. S. et al. Dynamic reciprocity in the wound microenvironment. Wound Repair Regen, 2011, 19, p. 134–148.
Štítky
Dermatológia Detská dermatológia
Článek Růžová makulopapula na hrudiČlánek Blahopřání doc. NožičkovéČlánek Odborné akce v roce 2012
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2012 Číslo 5- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Kožní melanom: diagnostika, léčba a pooperační sledování
- Doškolování lékařů – kontrolní test
- Fotodynamický antiseptický efekt fotoaktivních nanovláken při léčbě bércových vředů
- Sarkoidóza – případ s málo obvyklými klinickými projevy
- Úspěšná léčba pacientky s metastazujícím melanomem ipilimumabem
- Klinický případ: Bolestivá papula na uchu
-
Prim. MUDr. Josef Kastl –
zemřel - Růžová makulopapula na hrudi
-
Zápis ze schůze výboru ČDS
konané dne 14. června 2012 v Bratislavě -
21. kongres Evropské akademie dermatologie (EADV)
Praha, 26.–30. 9. 2012 - Blahopřání doc. Nožičkové
- Odborné akce v roce 2012
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinický případ: Bolestivá papula na uchu
- Kožní melanom: diagnostika, léčba a pooperační sledování
- Úspěšná léčba pacientky s metastazujícím melanomem ipilimumabem
- Sarkoidóza – případ s málo obvyklými klinickými projevy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




