-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jak v praxi zlepšit histopatologickou diagnostiku hepatocelulárního karcinomu
How to improve the histopathological diagnosis of hepatocellular carcinoma in daily practice?
Hepatocellular carcinoma (HCC) is one of the most common cancers in the world with an increasing incidence. Recently, an East-West consensus on the histopathologic criteria for the diagnosis of high-grade dysplastic nodules and early hepatocellular carcinoma was published. In addition to classical morphological criteria such as nucleocytoplasmic ratio, thickness of cell plates, mitotic index, and architectural disturbance, a new one – the stromal invasion – was recognized as a crucial criterion for the diagnosis of early HCC. Immunohistochemical detection of glypican-3 was shown as a specific marker for HCC that can be used to distinguish between the benign hepatocellular lesions and HCC.
Keywords:
early hepatocellular carcinoma – histopathology – glypican-3 – stromal invasion
Autori: E. Honsová; A. Lodererová
Pôsobisko autorov: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM, Praha
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 2, p. 40-43
Kategória: Přehledový článek
Súhrn
Hepatocelulární karcinom (HCC) je jedním z nejčastěji se vyskytujících maligních nádorů se stoupající incidencí. Mezinárodní pracovní skupina pro hepatocelulární neoplazie složená z expertů z Asie a západního světa nedávno publikovala návrh histologických diagnostických kriterií pro dysplastické noduly a především pro časný dobře diferencovaný HCC. Vedle klasických morfologických kritérií jako nukleoplazmatický poměr, tloušťka trámců, mitotický index a porucha architektury, byla hlavním morfologickým kriteriem diagnózy HCC stanovena tzv. stromální invaze. Specifickým markerem pro diagnózu HCC je imunohistochemický průkaz glypicanu-3, který může být využit k rozlišení benigních hepatocelulárních lézí od HCC.
Klíčová slova:
časný hepatocelulární karcinom – histopatologie – glypican-3 – stromální invazeHepatocelulární karcinom (HCC) je jedním z nejčastěji se vyskytujících maligních nádorů se stoupající incidencí nejenom v Asii, ale i v rozvinutých zemích (1,2). HCC je pátým nejčastějším maligním nádorem u mužů a osmým u žen. Současně představuje, po nádorech plic a žaludku, třetí nejčastější příčinu úmrtí na maligní onemocnění (2). Hlavním rizikovým faktorem pro vznik HCC je cirhóza různé etiologie. V posledním desetiletí došlo k velkému rozvoji zobrazovacích technik, což umožnilo změnu v přístupu k pacientům s vysokým rizikem vzniku HCC, zvl. pacientů s virovou hepatitidou B (HBV) a C (HCV). Byl vytvořen protokol, podle kterého jsou sledováni pacienti s rizikem vývoje HCC a který nezahrnuje jenom diagnostické testy, ale také vede ke standardizaci pravidel v rozhodování o dalších léčebných postupech včetně transplantace jater.
Diagnóza hepatocelulárního karcinomu
Rozvoj zobrazovacích metod v posledních desetiletích změnil diagnostiku HCC. Diagnóza HCC může být radiologická nebo bioptická. O tom, která metoda bude použita k objasnění biologické povahy ložiska, rozhodují okolnosti, za kterých bylo ložisko v játrech zjištěno. Podle doporučení publikovaných v roce 2005 (3) a upravovaných v následujících letech (4), nádory větší než 2 cm vznikající v cirhóze, nevyžadují bioptické potvrzení diagnózy, pokud splňují typická radiologická kriteria spočívající především v arteriální hypervaskularizaci a vymizení signálu ve venózní fázi zobrazení. Pokud má ložisko atypické radiologické charakteristiky, nízké hladiny alfa-fetoproteinu v séru anebo se nachází v játrech bez cirhózy, pak by měla být provedena biopsie k ověření diagnózy. Tento přístup přináší několik problémů. Jedním z nich je posuzování malých abnormálních nebo podezřelých uzlů v cirhóze. Časné karcinomy lze bez histologického ověření jen velmi obtížně odlišit od cirhotických uzlů. Je dobře známo, že samotná velikost nemůže být použita jako kritérium malignity, i když většina uzlů velikosti pod 1 cm nejsou HCC, na druhé straně ale některé nenádorové cirhotické uzly mohou být větší než 2 cm. Diagnostiku komplikuje fakt, že většina časných HCC je klinicky němá a má také negativní sérologický screening (především nízké hladiny alfa-fetoproteinu v séru).
Podle současných kritérií každý uzel větší než 1 cm nacházející se v cirhotických játrech je považovaný za podezřelý z malignity a často je provedena biopsie k ověření biologické povahy ložiska. U takto malých lézí kromě standardní histopatologie neexistuje technika, která by spolehlivě umožnila stanovit diagnózu HCC. Ani na úrovni genetických/proteomických metod není znám marker nebo test, který by nyní mohl být diagnosticky používán. Donedávna patřila diagnóza časného HCC k jedné z nejproblematičtějších, protože ani v histopatologii neexistovala spolehlivá a reprodukovatelná kritéria malignity. Hepatocyty fyziologicky nemají souvislou bazální membránu, jejíž překročení bývá diagnostickým kritériem maligního chování v jiných lokalizacích. Proto posuzování malých ložisek, které by byly ekvivalentem karcinomu in situ v jiných orgánech, bylo velmi komplikované. Diagnostická kritéria, která by umožnila diferenciaci mezi dysplastickými uzly a dobře diferencovaným HCC, byla velmi obecně definovaná a také velmi nejistě interpretovaná různými patology. Nebylo výjimkou, že stejnou lézi hodnotilo několik expertů specializovaných v hepatopatologii zcela odlišně, v rozmezí od benigní po maligní. Dlouhodobě existovaly také rozdíly v aplikaci diagnostických kritérií mezi patology z Evropy a severní Ameriky na jedné straně a patology z Asie na straně druhé. Několik jednání mezinárodní pracovní skupiny pro hepatocelulární neoplazie z obou geografických oblastí vedlo v roce 2009 k formulaci návrhu histologických diagnostických kritérií pro dysplastické noduly a především pro časný dobře diferencovaný HCC (4).
Histopatologická diagnóza časného dobře diferencovaného HCC
Největší problémy v histologické diagnostice uzlů v játrech s cirhózou představovala diferenciace mezi uzly s high-grade dysplázií a časným dobře diferencovaným HCC. Současná klasifikace zpřesnila definice některých znaků a přidala imunohistochemické markery, a tím významně snížila počet problematických případů hodnocených v rutinním bioptickém provozu.
Základní znaky, které zlepšují v praxi histopatologickou diagnózu HCC jsou:
- stromální invaze
- nepárové artérie
- pozitivní průkaz glypicanu-3 (GPC3).
Stromální invaze charakterizuje časný HCC a představuje stav, kdy jednotlivé trámce nádorových hepatocytů pronikají do stromatu původních portálních polí nebo vazivových sept (obr. 1). Stromální invaze se posuzuje podobně jako v jiných oblastech onkologické diagnostiky, kde se hodnotí prorůstání nádoru do pouzdra. Okrsky stromální invaze se vyskytují fokálně a v jehlové biopsii nemusí být zastiženy. Nicméně stromální invaze je nejdůležitějším morfologickým znakem, který umožňuje rozlišení high-grade dysplastického uzlu od časného dobře diferencovaného HCC.
Obr. 1. Stromální invaze na periferii nádorového uzlu. Trámce nádorových buněk pronikají do vaziva. HE, zvětšení objektiv 40x. 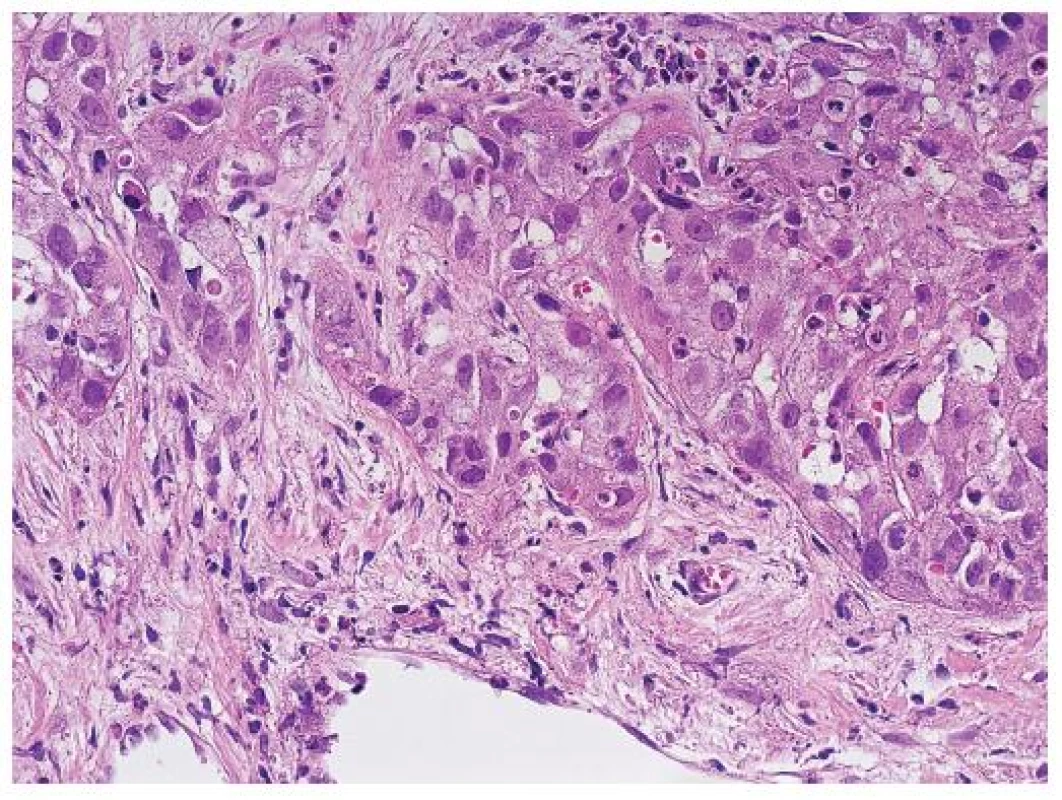
Nepárové artérie jsou artérie, které jsou zastiženy v jaterní tkáni izolovaně mezi hepatocyty. Jsou tedy lokalizované mimo portální pole, kde normálně doprovázejí žlučovod (obr. 2, 3) a jsou vlastně histologickým korelátem neovaskularizace, která představuje hlavní diagnostický znak HCC v průběhu zobrazovacích metod (arteriální hypervaskularizace na CT nebo sonografii s kontrastem). Nepárové artérie se na rozdíl od stromální invaze mohou vyskytovat i v benigních lézích (adenom) nebo v dysplastických nodulech.
Obr. 2. Nepárová artérie v centru je obklopená trámci nádorových hepatocytů. HE, zvětšení objektiv 40x. 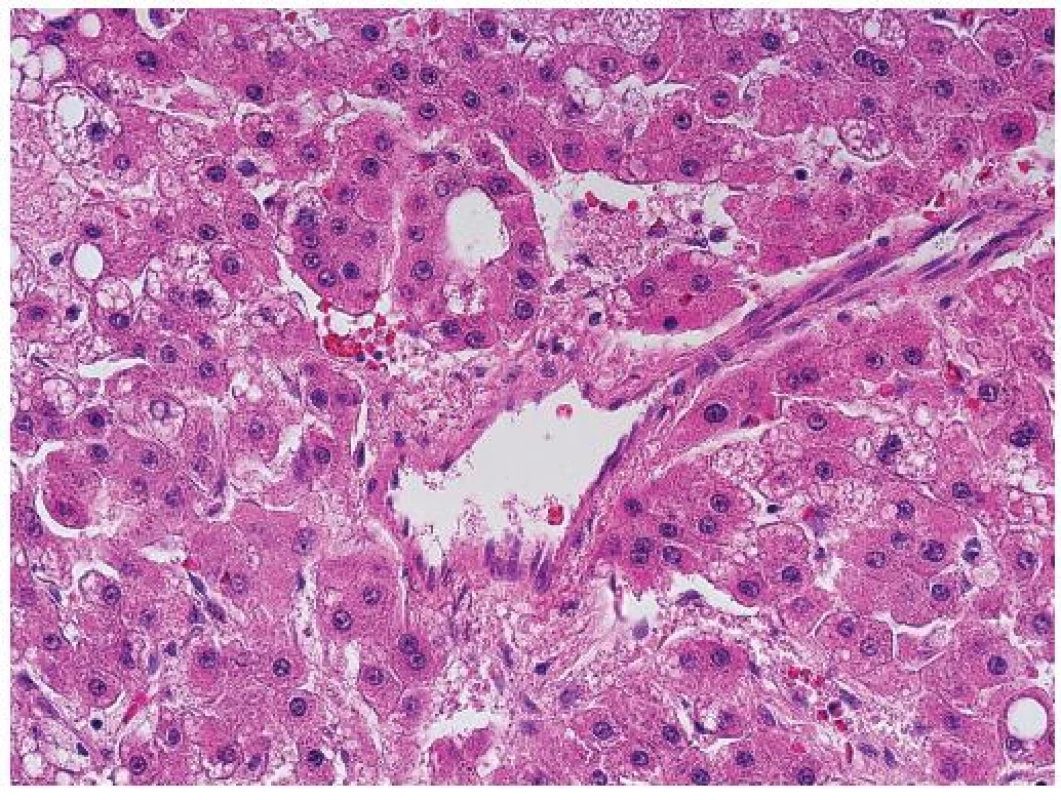
Obr. 3. Nepárové artérie mezi trámci nádorových hepatocytů, imunohistochemický průkaz hladkosvalového aktinu, zvětšení objektiv 20x. 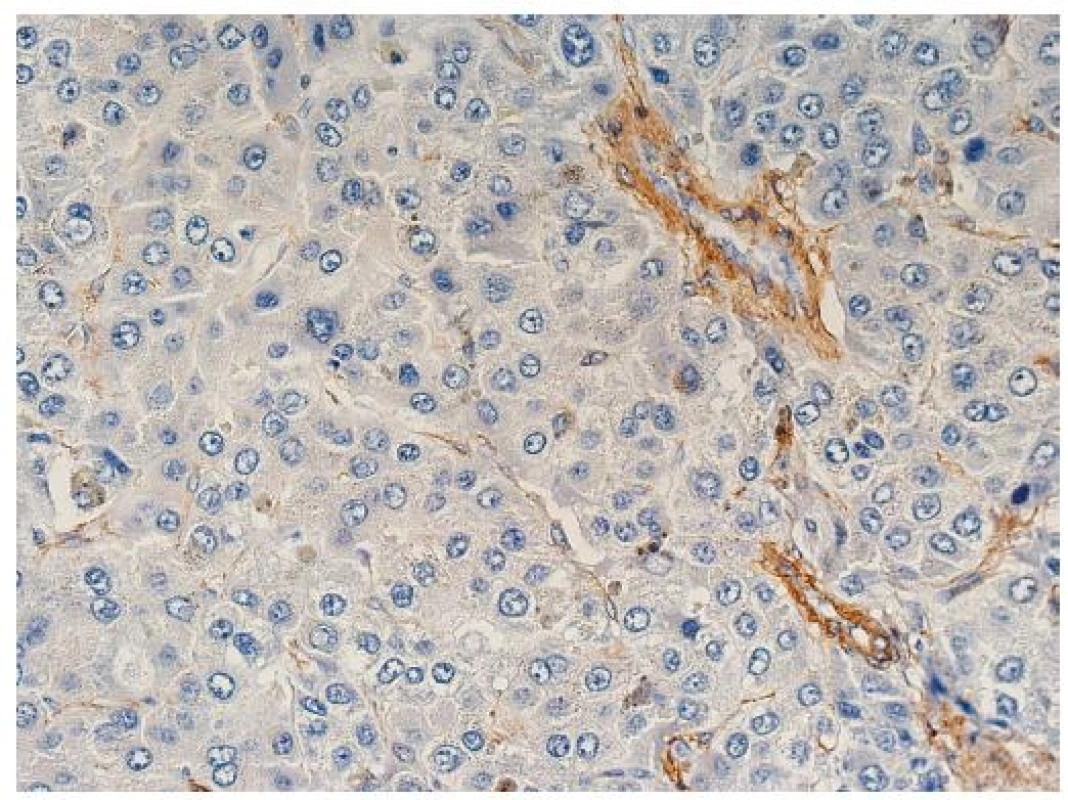
Imunohistochemický průkaz glypicanu-3 znamená téměř revoluci v diagnostice HCC. GPC3 je onkofetální protein, který je vysoce exprimován v játrech a střevu během fetálního vývoje, kde ovlivňuje morfogenezi a kontroluje růst (5). V normálních játrech u dospělých exprimován není. Jeho exprese se znovu objevuje v buňkách HCC. Exprese může být cytoplazmatická, membránová nebo kanalikulární (obr. 4, 5). Prakticky ve všech případech je fokální a má různou intenzitu (obr. 6). Bylo publikováno několik studií o expresi GPC3 v hepatocelulárních tumorech s obdobnými výsledky, které dokumentují významné zlepšení v rozlišení benigních lézí a časného HCC (6–8). Průkaz GPC3 má vysokou senzitivitu (77%) a především specificitu (96%), pozitivní výsledek s vysokou pravděpodobností predikuje maligní nádor z hepatocytů. Největší limitací průkazu GPC3 je jeho fokální exprese, která může vést k negativnímu výsledku, a také to, že průkaz je citlivý na fixaci (9). Pouze zřídka byl zjištěn pozitivní průkaz GPC3 v jiných maligních tumorech, např. v melanomu (10), ovariálních nádorech a v nádoru ze žloutkového váčku (11).
Obr. 4. Hepatocelulární karcinom s nepárovou artérií a pozitivním imunohistochemickým průkazem glypicanu-3 (anti-Glypican-3, clone 1G12, Santa Cruz Biotechnology CA, USA; detekce Histofinem a červenou koncovkou s 3-amino-9-ethylcarbazolem). Zastižena je membránová a cytoplazmatická pozitivita. Zvětšení, objektiv 40x. 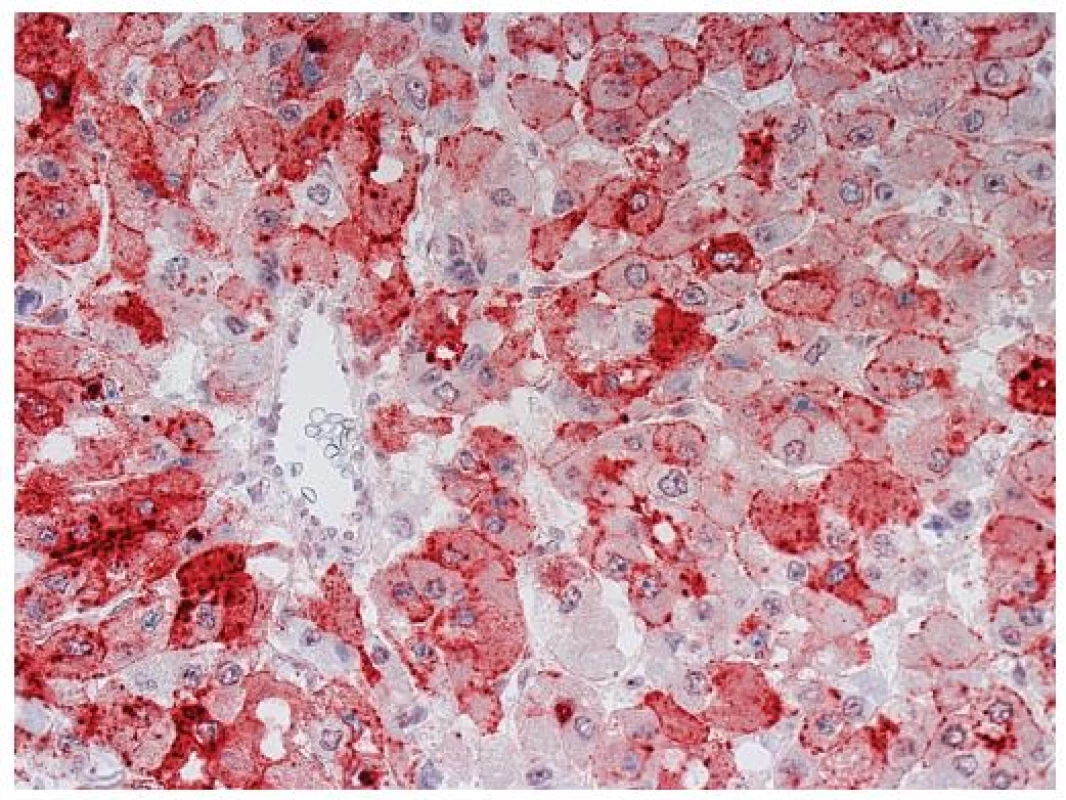
Obr. 5. Hepatocelulární karcinom s difúzně pozitivním cytoplazmatickým a kanalikulárním imunohistochemickým průkazem glypicanu-3. Zvětšení, objektiv 20x. 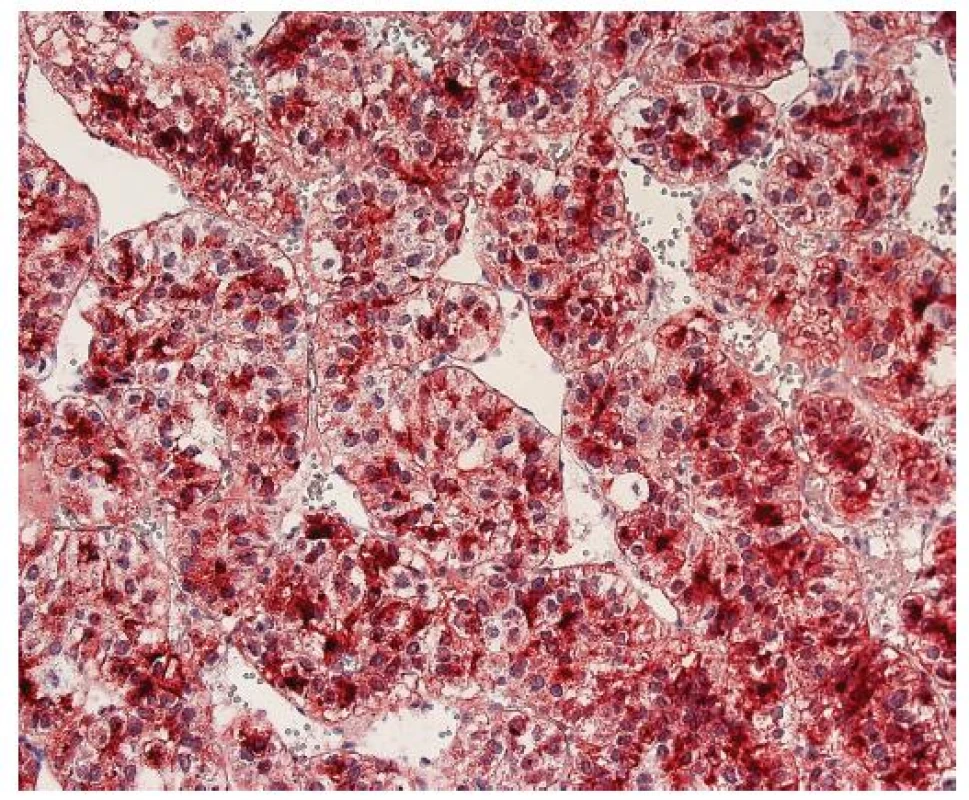
Obr. 6. Hepatocelulární karcinom s fokálně pozitivním převážně kanalikulárním imunohistochemickým průkazem glypicanu-3. Zvětšení, objektiv 40x 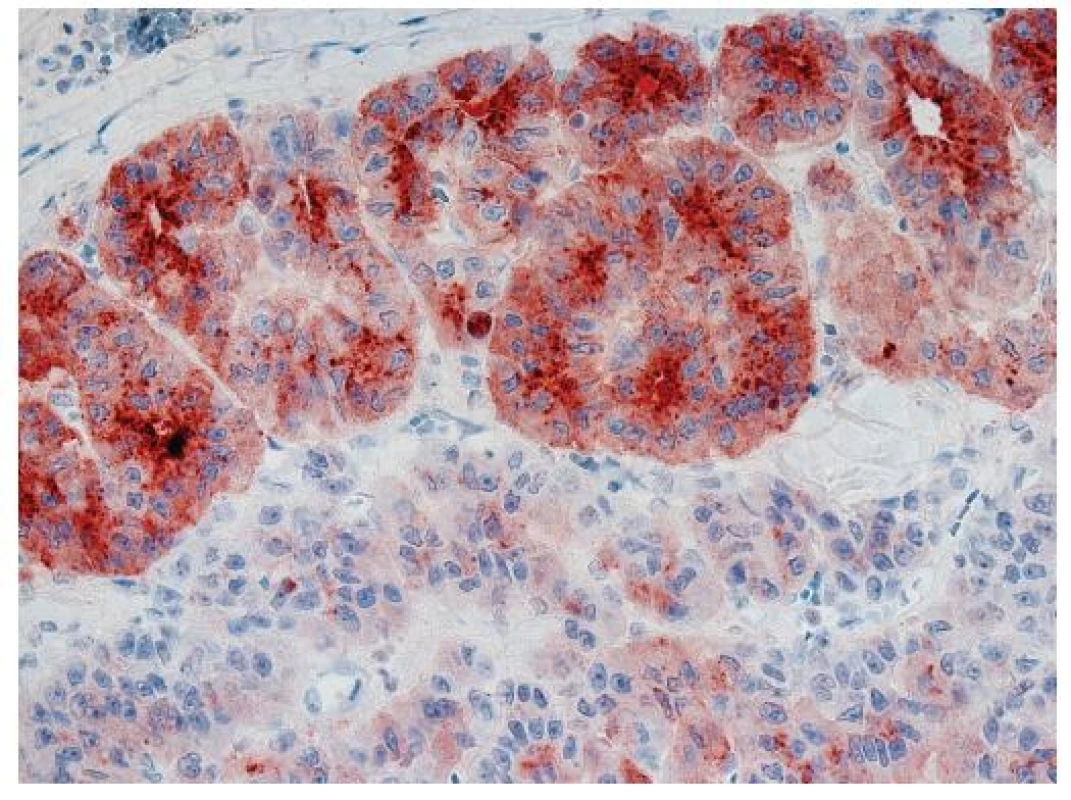
Další imunohistochemické markery
Další doporučované imunohistochemické znaky mají většinou významná omezení.
Alfa-fetoprotein je sérologickým markerem pro pokročilé HCC. Časné HCC nemají obvykle zvýšené hladiny v séru a v histologii průkaz alfa-fetoproteinu nepomůže, protože má velmi nízkou sensitivitu.
Detekce CD34na endotelu sinusoid se zvyšuje v místech, kde je převážně arteriální cévní zásobení a proto je častěji pozitivní v HCC. Časné HCC, které ještě obsahují portální pole, jsou zásobeny vedle arteriálního novotvořeného oběhu také portálním oběhem, proto budou mít průkaz CD34 v různém rozsahu negativní. Na druhé straně adenomy a fokální nodulární hyperplazie (která pravděpodobně představuje reakci na vaskulární abnormalitu), budou mít fokálně pozitivní průkaz CD34. Pozitivní průkaz CD34 je třeba hodnotit v kontextu dalších morfologických znaků, sám o sobě neindikuje maligní proces.
Hep-Par1 je velmi užitečný pokud potřebujeme rozlišit HCC od metastázy jiného karcinomu, ale nepomůže v odlišení benigního a maligního tumoru z hepatocytů (Hep-Par1 je monoklonální protilátka, která reaguje s epitopem jaterních mitochondrií).
Glutamin syntetáza (GS) katalyzuje syntézu glutaminu, který je hlavním zdrojem energie pro nádorové buňky. GS je exprimovaná v hepatocytech v okolí terminálních venul. V cirhotických játrech bývá pozitivních cca 10% hepatocytů. Změna v rozsahu pozitivního průkazu GS (< 50% nádorových buněk) je zaznamenána v případech tumorů jater s mutací β-cateninu (GS je cílovým genem β-cateninu); tj. cca ve 20% adenomů a 20-34% HCC.
Heat shock potein 70 (HSP70) se účastní v procesech tumorigeneze ovlivněním regulace buněčného cyklu a apoptózy a představuje významný antiapoptotický faktor. Chronické infekce HCV a HBV, které vedou ke vzniku cirhózy a HCC, vedou také k syntéze HS70. Pozitivní imunohistochemický průkaz HS70 (obvykle jaderný i cytoplazmatický) je fokální a lze ho pozorovat u časných i plně vyvinutých HCC.
Genetické/proteomické studie dosud nepřinesly pokroky v praktické diagnostice HCC. I když v posledních 2 letech se objevily práce, které ukazují, že podle výsledků molekulární diagnostiky bude pravděpodobně možné odlišit více či méně agresivní nádory a tím také vybrat pacienty, kteří budou indikováni k resekci nebo transplantaci jater (12).
Závěr
Přes velký pokrok ve výzkumu kancerogeneze jaterních nádorů, histopatologie zůstává klíčovou diagnostickou metodou časných HCC. Konsenzuální formulace návrhu histopatologických diagnostických kritérií pro malé nodulární léze v cirhotických játrech z roku 2009 významně zpřesnila diagnózu časných HCC. Hlavním morfologickým znakem, který umožňuje diagnostické rozlišení dysplastických nodulů od časných HCC je stromální invaze. Mezi doporučovanými imunohistochemickými markery má největší význam průkaz GPC3, jehož pozitivita je silným argumentem podporujícím diagnózu hepatocelulárního karcinomu.
Poděkování
Práce byla podpořena Výzkumným záměrem IKEM MZO 00023001.
Adresa pro korespondenci:
MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: eva.honsova@ikem.cz
Zdroje
1. Bosch X, Ribes J, Cléries R, Díaz M. Epidemiology of hepatocellular carcinoma. Clin Liver Dis 2005; 9 : 191–211.
2. Ferenci P, Fried M, Labrecque D, et al. Hepatocellular carcinoma (HCC) a global perspective. J Clin Gastroenterol 2010; 44 : 239–245.
3. Bruix J, Sherman M. Practice Guidelines Committee, American Association for the Study of Liver Diseases. Hepatology 2005; 42 : 1208–1236.
4. International Consensus group for hepatocellular neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology 2009; 49 : 658–664.
5. Filmus J. Glypican in growth control and cancer. Glycobiology 2001; 11 : 19–23.
6. Coston W, Loera S, Lau SK, et al. Distinction of hepatocellular carcinoma from benign hepatic mimickers using Glypican-3 and CD34 immunohistochemistry. 2008; 32 : 433–444.
7. Shirakawa H, Suzuki H, Shimomura M, et al. Glypican-3 expression is correlated with poor prognosis in hepatocellular carcinoma. Cancer Sci 2009; 100 : 1403–1407.
8. Wang H, Anatelli F, Zhai QJ, et al. Glypican-3 as a useful diagnostic marker that distinguishes hepatocellular carcinoma from benign hepatocellular mass lesions. Arch Pathol Lab Med 2008; 132 : 1723–1728.
9. Takai H, Kato A, Ishiguro T, at al. Optimization of tissue processing for immunohistochemistry for the detection of human glypican-3. Acta Histochem 2010; 112 : 240–250.
10. Nakatsura T, Kageshita T, Ito S, et al. Identification of glypican-3 as a novel tumor marker for melanoma. Clin Cancer Res 2004; 10 : 6612–6621.
11. Zynger DL, Everton MJ, Dimov ND, et al. Expression of glypican-3 in ovarian and extragonadal germ cell tumors. Am J Clin Pathol 2008; 130 : 224–230.
12. Schwartz M, Dvorchik I, Roayaie S, et al. Liver transplantation for hepatocellular carcinoma: extensity of indications based on molecular markers. J Hepatol 2008; 49 : 581–588.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Pokroky v hepatopatologiiČlánek JAKÁ JE VAŠE DIAGNÓZA?
Článok vyšiel v časopiseČesko-slovenská patologie

2011 Číslo 2-
Všetky články tohto čísla
- Pokroky v hepatopatologii
- Vždy som bol a aj som optimistom
- Jak v praxi zlepšit histopatologickou diagnostiku hepatocelulárního karcinomu
- Virové hepatitidy na začátku 21. století – význam jaterní biopsie v kontextu rozvoje neinvazivních diagnostických metod a ve vztahu k moderní léčbě chronických virových hepatitid
- Prague Hepatology Meeting 2010 – novinky z hepatopatologie
- JAKÁ JE VAŠE DIAGNÓZA?
- Fibrotizující cholestatická hepatitida – onemocnění nejen transplantovaných pacientů
- Pseudoangiomatózna stromálna hyperplasia s obrovskými viacjadrovými bunkami: lézia ženského prsníka bez asociácie s neurofibromatózou?
- Imunohistochemická detekce 3-nitrotyrosinu vázaného na proteiny u zánětlivých myopatií
- Histologický registr mamárních karcinomů - MAGISTER
- Patologie na území Ostravy v proměnách času
- 70-roční jubileum Doc. MUDr. Jaroslava Horáčka, CSc.
- Životní jubileum prof. Josefa Špačka
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fibrotizující cholestatická hepatitida – onemocnění nejen transplantovaných pacientů
- JAKÁ JE VAŠE DIAGNÓZA?
- 70-roční jubileum Doc. MUDr. Jaroslava Horáčka, CSc.
- Životní jubileum prof. Josefa Špačka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



