-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Fibrotizující cholestatická hepatitida – onemocnění nejen transplantovaných pacientů
Fibrosing cholestatic hepatitis – disease not only of transplanted patients. A report of eight cases
Fibrosing cholestatic hepatitis (FCH) is a rapidly progressive, sometimes fatal form of hepatitis B or C in patients who are under immunosuppressive treatment. This condition was originally described in hepatitis B virus-infected recipients after a liver transplantation. It is characterized clinically by cholestatic hepatic dysfunction, and pathologically by marked hepatocyte swelling, cholestasis, periportal peritrabecular fibrosis, and only mild inflammation. Here we present 8 patients with hepatitis B and C related FCH. Three patients developed FCH after liver transplantation, two of them died due to hepatic failure. One recipient of a kidney/pancreas transplant developed “de novo” hepatitis C with features of FCH. He underwent antiviral treatment and survived with good liver function, unfortunately both of his grafts failed. Four patients suffered from a reactivation of their respective hepatitis B infections after chemotherapy treated hematological malignancy. Three of them needed an urgent liver transplantation and survived with good liver function and with a remission of their hematological diseases. The last patient died due to liver failure. Although FCH is a rare variant of viral hepatitis, it should be emphasized that prompt diagnosis is important for the management of patients.
Keywords:
fibrosing cholestatic hepatitis – viral hepatitis B – viral hepatitis C
Autoři: E. Honsová 1; J. Šperl 2
Působiště autorů: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM, Praha 1; Klinika hepatogastroenterologie, Transplantcentrum IKEM, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 2, p. 55-58
Kategorie: Původní práce
Souhrn
Fibrotizující cholestatická hepatitida je závažná rychle progredující forma virových hepatitid B nebo C, kterou mohou onemocnět imunosuprimovaní pacienti. Původně byla popsaná u pacientů po transplantaci jater pro cirhózu při hepatitidě B. V klinice je onemocnění charakterizováno progredující cholestatickou dysfunkcí jater. V histologickém obraze je charakteristická pro hepatitidu neobvykle minimální zánětlivá infiltrace, nápadné je zduření hepatocytů s cholestázou a periportální peritrabekulární fibrózou. Prezentujeme osm pacientů s fibrocholestatickou hepatitidou při hepatitidě B nebo C. Šlo o 3 pacienty po transplantaci jater, dva z nich zemřeli na selhání funkce štěpu jater. U dalšího pacienta, diabetika po kombinované transplantaci ledviny a pankreatu, se vyvinula fibrocholestatická hepatitida jako součást projevů „de novo“ hepatitidy C. Po protivirové léčbě přežil s dobrou funkcí jater, bohužel během léčby došlo k selhání funkce obou štěpů. U zbývajících 4 pacientů se vyvinula fibrocholestatická forma hepatitidy v rámci reaktivace hepatitidy B po chemoterapii při hematologickém maligním onemocnění. U 3 z nich si rychlá progrese dysfunkce vyžádala urgentní transplantaci jater; všichni žijí s dobrou funkcí štěpu a hematologickým onemocněním v remisi. Čtvrtá pacientka se transplantace nedožila a zemřela na selhání jater. Ačkoli fibrocholestatická hepatitida představuje relativně vzácnou formu virových hepatitid, vzhledem k jejímu závažnému průběhu je její včasné rozpoznání důležité pro léčbu a další osud pacienta.
Klíčová slova:
fibrocholestatická hepatitida – virová hepatitida B – virová hepatitida CFibrotizující cholestatická hepatitida (FCH, též fibrocholestatická hepatitida) představuje vzácnou, ale průběhem velmi těžkou formu hepatitidy B (HBV) a C (HCV). Termín se začal používat v letech 1991–1992 u pacientů s rekurencí virové hepatitidy B po transplantaci jater (1,2). Později se ukázalo, že stejným typem hepatitidy mohou onemocnět pacienti s HCV nebo HBV po transplantacích kostní dřeně nebo solidních orgánů, včetně ledvin, pankreatu a srdce (3,4,5). Po transplantaci nově získaná virová hepatitida B nebo C může také probíhat pod obrazem FCH. Předpokladem pro vznik FCH je imunosuprese pacienta. Se stále úspěšnější léčbou maligních a autoimunních onemocnění počet těžce imunosuprimovaných pacientů narůstá. K léčbě onkologických i autoimunních onemocnění se běžně používají preparáty, které přímo ovlivňují funkci imunitního systému, jako např. rituximab, tj. anti-CD20 protilátka. Pacienti, kteří podstupují onkologickou terapii a v minulosti prodělali HBV, i když nemají aktivní hepatitidu ani fibrózu nebo cirhózu jater, jsou v riziku reaktivace onemocnění, které může mít velmi těžký průběh odpovídající FCH (6,7).
POPIS PŘÍPADŮ
Klinický průběh
Prezentujeme soubor celkem 8 pacientů s FCH rozdělených do 2 skupin. Skupinu A tvoří 4 případy FCH u transplantovaných pacientů diagnostikované v letech 2001–2004. U všech šlo o komplikovaný průběh HCV, z toho u pacienta č. 4 o infekci „de novo“. Skupinu B tvoří 4 pacienti s FCH po chemoterapii hematologických malignit. Onemocnění jsme diagnostikovali v letech 2008–2009; ve všech případech se jednalo o reaktivaci HBV.
Skupina A – FCH u pacientů po transplantaci solidních orgánů
Základní klinická data jsou shrnuta v tabulce č. 1.
Tab. 1. Skupina A – pacienti s FCH po transplantaci 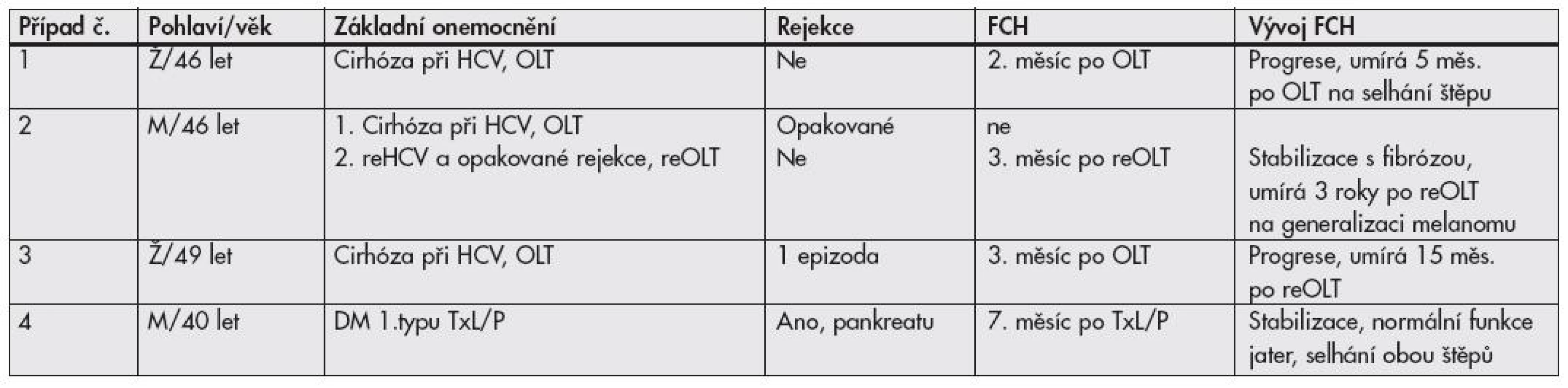
FCH: fibrotizující cholestatická hepatitida; HCV: hepatitida C; M: muž; OLT: transplantace jater; reHCV: rekurence hepatitidy C; reOLT: retransplantace jater; TxL/P: kombinovaná transplantace ledvina/pankreas; Ž: žena Případ č. 1. Žena ve věku 46 let podstoupila transplantaci jater (orthotopic liver transplantation, OLT) pro cirhózu při hepatitidě C. Výkon byl nekomplikovaný; pro vzestup jaterních testů byla ve 2. měsíci po transplantaci provedena biopsie jater, která zastihla rekurenci HCV s významným cytopatickým efektem a bylo vysloveno podezření na další vývoj k FCH. I přes antivirovou terapii (interferon, ribavirin), hepatitida progredovala, v následující biopsii v odstupu jednoho měsíce byla plně vyvinutá FCH a pacientka zemřela 5 měsíců po transplantaci na selhání jaterního štěpu.
Případ č. 2. 46 letý muž s cirhózou při HCV podstoupil OLT. Výkon byl nekomplikovaný; ale pacient měl krátce po transplantaci několik epizod akutní celulární rejekce, jejichž léčba byla obtížná (vzhledem k HCV se nepoužívají steroidy) a stav progredoval do chronické rejekce; současně se objevila rekurence HCV. Dysfunkce štěpu vedla k retransplantaci. Ve 3. měsíci po retransplantaci (reOLT) se u pacienta vyvinula FCH. Během antivirotické léčby došlo ke stabilizaci stavu s vývojem peritrabekulární a septální fibrózy. Ve 3. roce po reOLT byl u pacienta diagnostikován melanom a pacient během několika měsíců umírá na generalizaci maligního melanomu.
Případ č. 3. Žena s cirhózou při HCV podstoupila OLT ve 49 letech. Pooperační průběh byl nekomplikovaný, v 1. měsíci po transplantaci měla 1 epizodu akutní rejekce. Ve 3. měsíci byla diagnostikována rekurence HCV s fibrocholestatickými rysy a velmi pravděpodobným vývojem k FCH. Pro dysfunkci štěpu byla zařazena k reOLT a po 15 měsících od diagnózy FCH zemřela na vykrvácení při retransplantaci.
Případ č. 4. 40 letý diabetik 1. typu byl 7 měsíců po kombinované transplantaci ledvina/pankreas přijat pro elevaci jaterních enzymů. Funkce obou štěpů byla dobrá, pro infekci v ráně byl opakovaně léčen ATB. Byla provedena biopsie jater s morfologickým obrazem cholestázy s místy floridní marginální duktulární proliferací, a nález byl hodnocen jako porucha žlučové drenáže. Sérologické vyšetření markerů hepatitid bylo negativní. Následně provedené ERCP prokázalo edém papily (řešený papilotomií) a velmi štíhlé „oteklé“ žlučovody. Jaterní testy poklesly, ale nenormalizovaly se. Po 4 týdnech byl pacient znovu hospitalizován a byla provedena další biopsie jater, která už byla hodnocena jako vysoce suspektní FCH. Virologický průkaz HCV-RNA byl pozitivní a byla zahájena protivirová léčba interferonem a ribavirinem. Po 5 měsících bylo dosaženo normalizace jaterních testů a negativity HCV-RNA. Během léčby došlo k humorální rejekci štěpu ledviny se selháním funkce a k těžké rejekci pankreatu se snížením funkce. Štep ledviny funkci neobnovil a štěp pankreatu omezeně fungoval ještě 2 roky.
Skupina B – FCH u pacientů s reaktivací HBV po onkologické léčbě
Základní klinická data jsou shrnuta v tabulce č. 2.
Tab. 2. Skupina B – pacienti s reaktivací HBV po onkologické léčbě 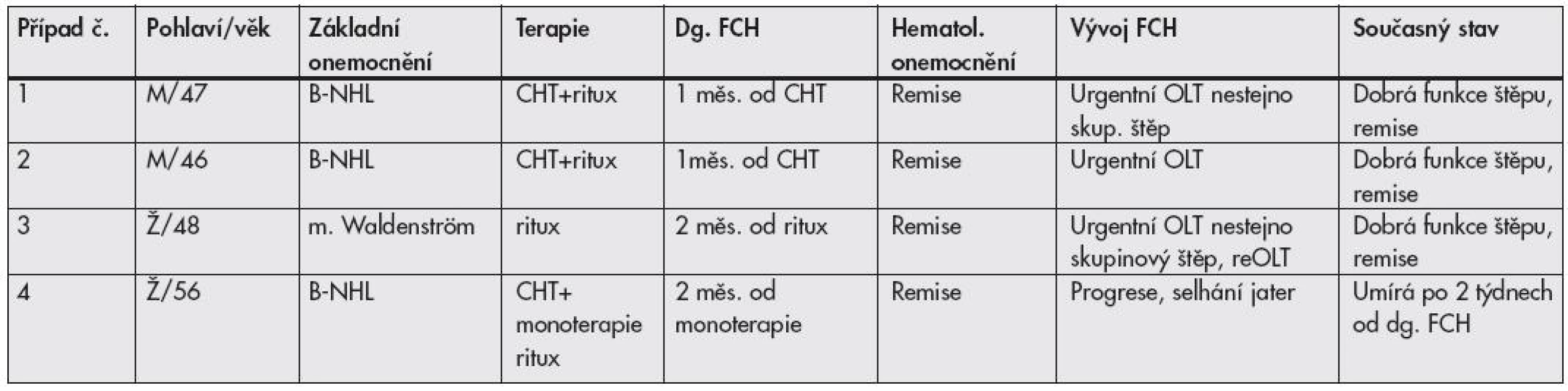
B-NHL: non-Hodgkinský maligní lymfom z B buněk; dg.: diagnóza; FCH: fibrotizující cholestatická hepatitida; HBV: hepatitida B; CHT: chemoterapie; M: muž; OLT: transplantace jater; reOLT: retransplantace jater; ritux: rituximab (anti-CD20 protilátka); Ž: žena Případ č. 1. 47 letý muž podstoupil chemoterapii pro velkobuněčný B lymfom. Měsíc po 6. cyklu se objevil ikterus a jaterní dysfunkce. Pacient byl přeložen do IKEMu, kde během 2 dnů dospěl do jaterního selhání a jako urgentnímu příjemci mu byl 3. den od přijetí transplantován nestejnoskupinový štěp (příjemce krevní skupina A, dárce AB).
Případ č. 2. 43 letý muž s folikulárním lymfomem, s infiltrací kostní dřeně; měsíc od 8. cyklu chemoterapie se objevil ikterus a pacient byl přeložen do IKEMu s rychle progredujícím selháním jater a 3. den od přijetí podstoupil transplantaci jater.
Případ č. 3. 48 letá žena s Waldenstrőmovou makroglobulinemií léčenou rituximabem, 2 měsíce od poslední dávky přichází s ikterem a progredující dysfunkcí jater. Byla zahájena antivirová terapie a pacientka byla zařazena na čekací listinu. Během 14 dnů se stav zhoršil a vyžádal si převedení na eliminační metodu Prometheus. Za další 2 dny podstoupila nestejnoskupinovou transplantaci (příjemce krevní skupina A, dárce B), krátce poté se u pacientky vyvinuly protilátky proti AB0 systému a humorální rejekce s progredující dysfunkcí štěpu, která vedla 16. pooperační den k retransplantaci.
Všichni 3 pacienti jsou nyní rok až rok a půl po transplantaci, mají dobrou funkci štěpu a jejich hematologické onemocnění je v remisi.
Případ č. 4. 56letá žena s 10 letou anamnézou lymfomu z B buněk, po 2 relapsech léčených chemoterapií a rituximabem, tč. v remisi. Přes pozitivitu HBsAg nebyla při probíhajících chemoterapiích podávána profylaktická protivirová léčba. Pro progredující jaterní dysfunkci byla provedena biopsie jater. Histologický obraz odpovídal FCH při reaktivaci HBV. Přes protivirovou léčbu stav progredoval a po 2 týdnech pacientka zemřela v jaterním kómatu.
Histopatologické nálezy
FCH charakterizuje morfologická diagnostická trias:
- nápadné zduření hepatocytů s poruchou trabekulárního uspořádání a s minimem zánětlivé celulizace v portálních polích i v lobulech
- cholestáza doprovázená nápadnou duktulární reakcí na periferii portálních polí
- periportální peritrabekulární fibróza.
Pro FCH je typická minimální zánětlivá celulizace v portálních polích i v lobulech. Celulizaci v portálních polích tvoří převážně polynukleáry, zánět je lokalizován na periferii portálních polí a doprovází marginální duktulární reakci/proliferaci, stejně jako u obstrukce žlučových cest. Současně je patrné zduření hepatocytů s jejich vybočením z normálně uspořádaných trámců a velmi nápadná je cholestáza (obr. 1). Cholestáza může být intracelulární i intrakanalikulární (obr. 2). V časných stádiích je cholestáza centrolobulární, teprve v plně vyvinutých případech je panlobulární. Morfologický obraz doplňuje fibróza, která z počátku onemocnění chybí a vyvíjí se postupně; typicky je periportální, peritrabekulární a pericelulární (obr. 3). V některých případech dominují četná acidofilní tělíska jako korelát individuálního zániku hepatocytů. Vzhledem k cytopatickému efektu se někdy onemocnění označovalo jako fibrotizující cytolytická nebo cytolytická fibrosteatotická hepatitida (obr. 4).
Obr. 1. Fibrocholestatická hepatitida typu C u pacienta po transplantaci jater. Mírná zánětlivá celulizace portálních polí s převahou polynukleárů. Nápadně zduřelé cholestatické hepatocyty uspořádané do cholestatických rozet. HE, objektiv 10x. 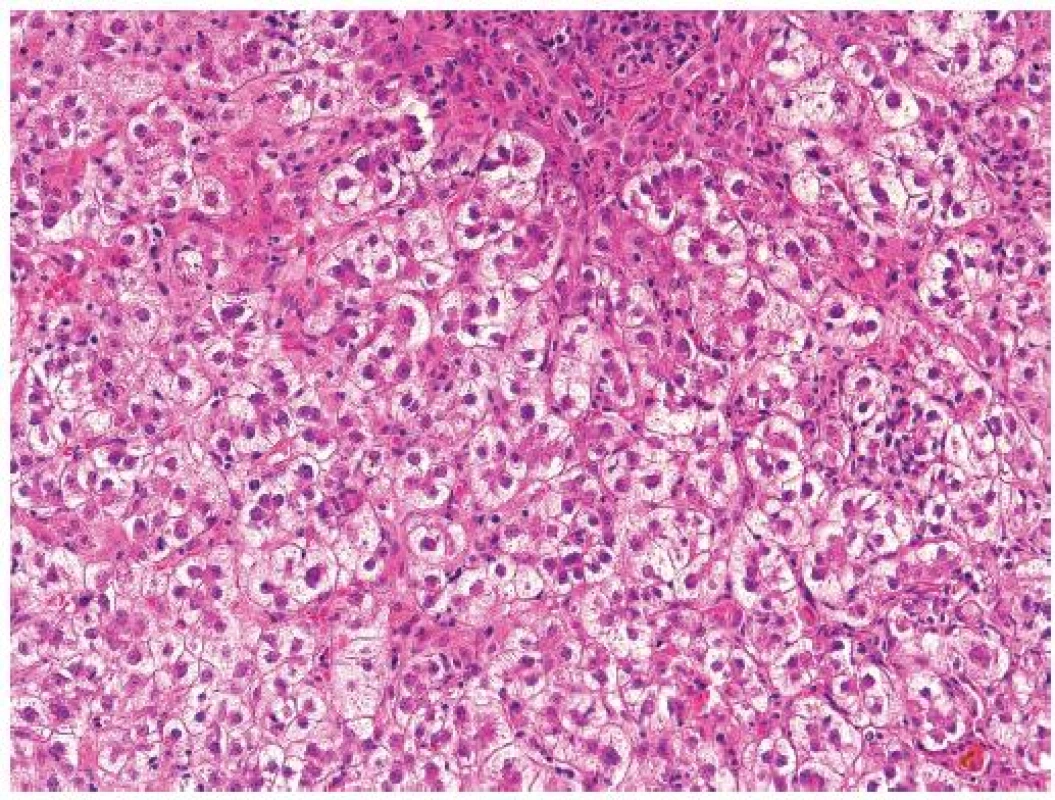
Obr. 2. Detail okraje portálního pole s marginální duktulární proliferací s polynukleáry dokonale napodobuje poruchu žlučové drenáže. Zduřelé a cholestatické hepatocyty s minimem zánětlivé celulizace. HE, objektiv 40x. 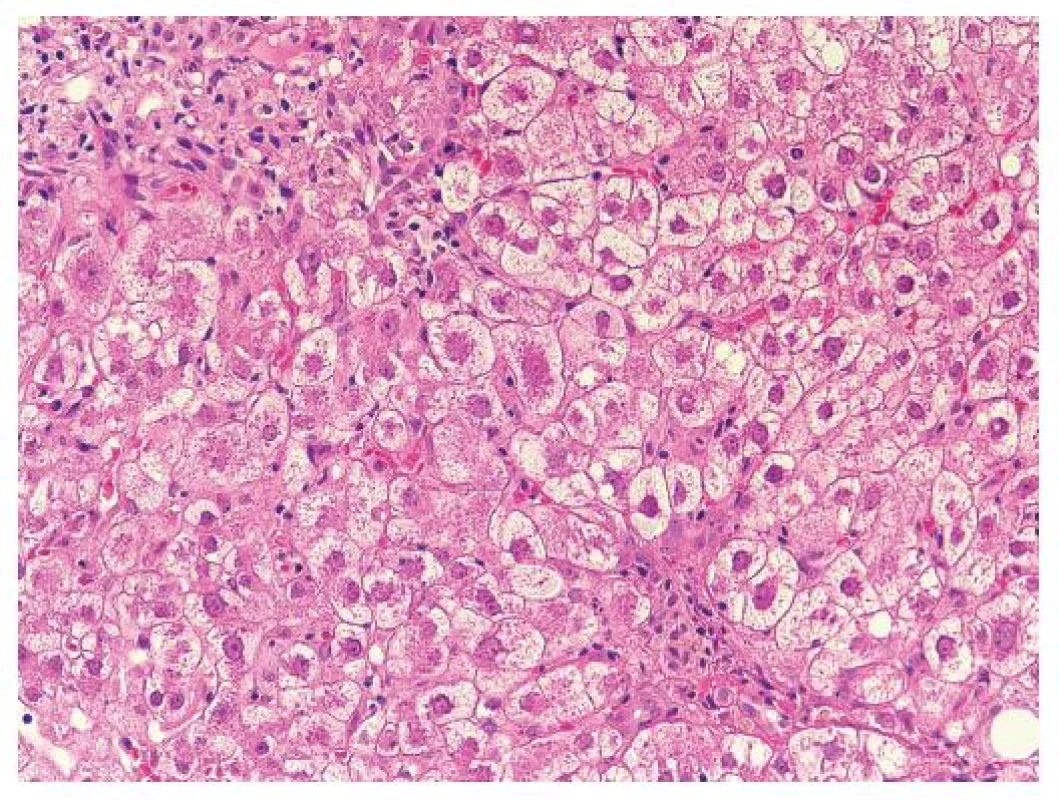
Obr. 3. Plně vyvinutá peritrabekulární fibróza; stejný případ jako obr. 1. Gömöriho impregnace (retikulum), objektiv 10x. 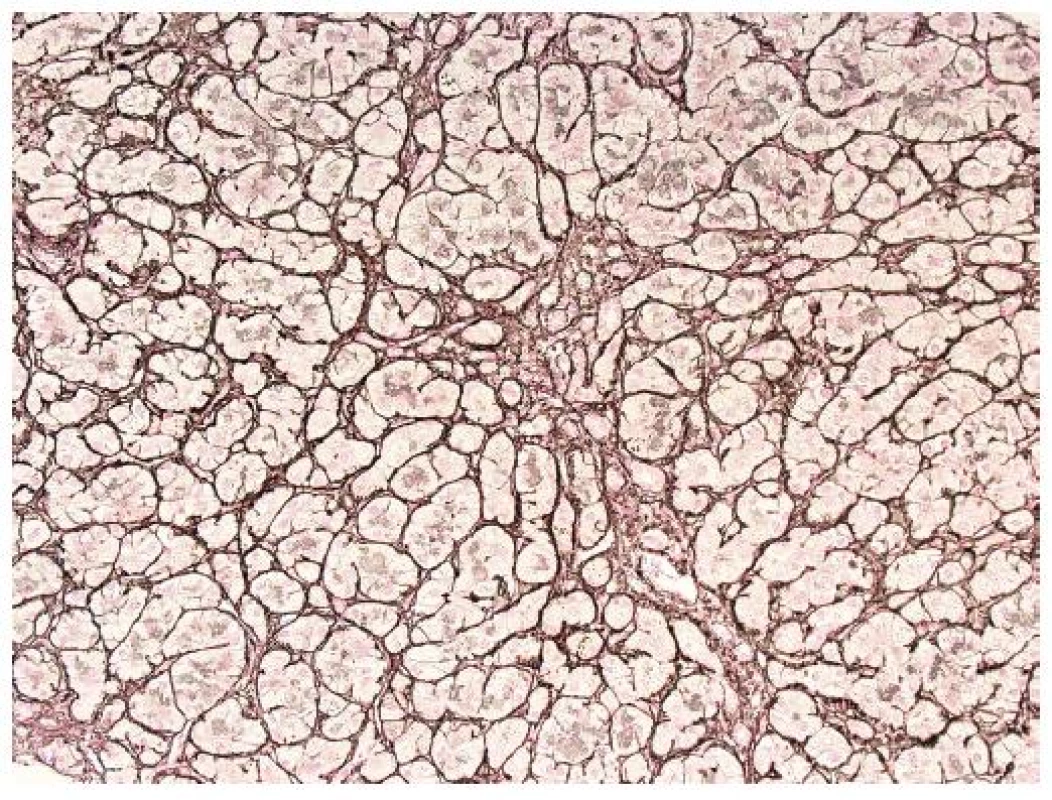
Obr. 4. Cytolytická forma fibrocholestatické hepatitidy s četnými acidofilními tělísky (šipky), s cholestatickým zduřením hepatocytů. HE, objektiv 40x. 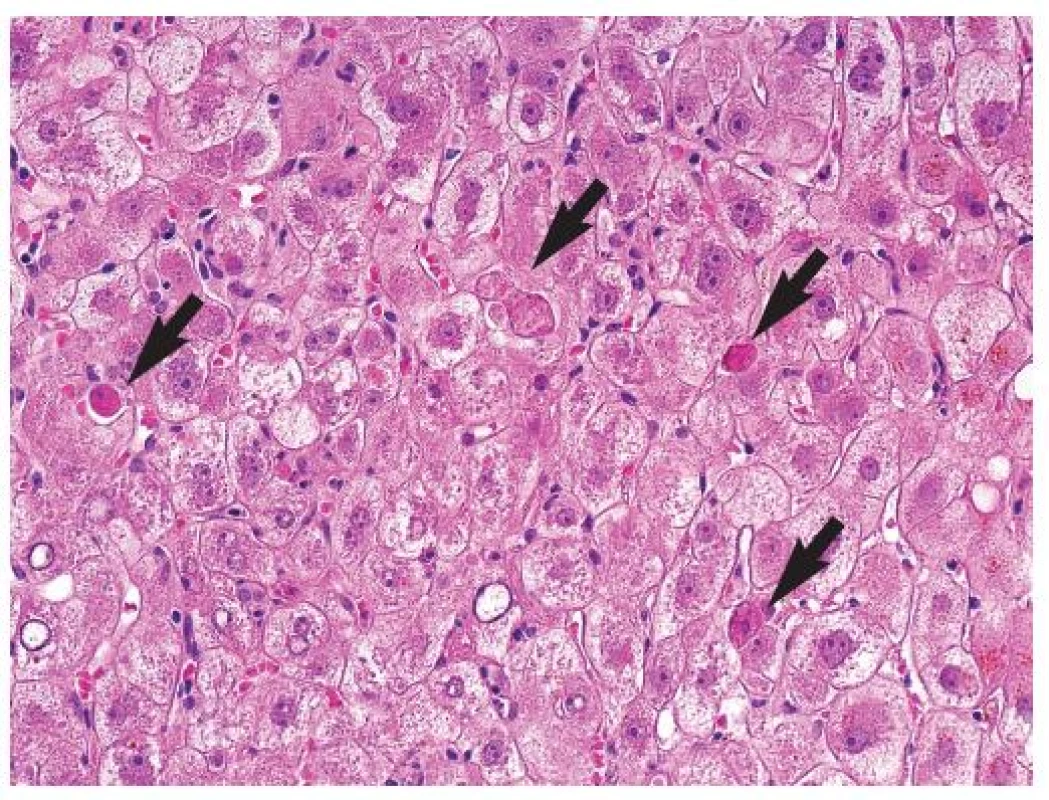
DISKUZE
FCH je termín používaný pro neobvyklý typ virové hepatitidy B nebo C s klinicky těžkým průběhem u pacientů v imunosupresi (2, 8). Předpokládá se, že imunosuprese vede k nekontrolované replikaci viru, který se na rozdíl od běžné infekce stává pro hepatocyty patogenní a přímo je poškozuje, což se projeví dramatickými klinickými příznaky a rychlou progresí onemocnění do selhání jater, obvykle během několika týdnů až měsíců. Jde o velmi závažné onemocnění, bez včasné diagnózy s vysokou mortalitou.
Diagnóza FCH patří mezi obtížné histopatologické diagnózy a pokud na tuto kategorii patolog nepomýšlí, velmi snadno ji mine (9). V časných fázích, kdy je v biopsii pouze centrolobulární cholestáza v nápadně zduřelých hepatocytech, bez zánětu, lze snadno afekci interpretovat jako součást poruchy žlučové drenáže, zejména je-li přítomná duktulární reakce. Většina morfologických znaků obou afekcí je prakticky totožná. Dobrým pomocným diagnostickým znakem jsou nápadná velká jadérka v hepatocytech v případě FCH, výraznější než v průběhu afekcí spojovaných s poruchou žlučové drenáže. Jde-li o reaktivaci HBV, lze provést imunohistochemickou detekci HBcAg a HBsAg, kde masivní pozitivita HBcAg vede ke správné diagnóze. V případě HCV neexistuje imunohistochemické vyšetření, které by nasměrovalo k bezchybnému diagnostickému závěru. Ani znalost výsledků sérologického vyšetření nepomůže, protože pacienti v imunosupresi často netvoří protilátky. Naopak, klinický údaj o negativní sérologii infekčních hepatitid může být v těchto případech zavádějící. Pouze vysoký počet kopií viru je indikátorem diagnózy. Také v našem souboru jsme první biopsii pacienta s „de novo“ fibrocholestatickou formou HCV hodnotili jako poruchu žlučové drenáže. Až další biopsie provedená v odstupu 4 týdnů měla charakteristické znaky FCH a spolu s pozitivním průkazem HCV-RNA vedla k diagnóze.
U pacientů po transplantaci jater je velmi obtížné odlišit ischemické poškození při trombóze arterie, které vždy vede k poškození žlučovodů a v biopsii se projeví poruchou žlučové drenáže (játra mají dvojí krevní zásobení, ale žlučovody jsou zásobeny pouze z artérie).
Léková toxicita představuje další problém v diferenciální diagnóze. Především u pacientů po chemoterapii, pokud patolog na fibrocholestatickou hepatitidu nepomýšlí, může nezánětlivou morfologii velmi snadno hodnotit jako tzv. „toxickou cholestázu“. V těchto případech je velmi účelné provedení imunohistochemických průkazů HBcAg a HBsAg, protože při reaktivaci jde prakticky vždy o reaktivaci HBV. Z neznámých důvodů u pacientů s chemoterapií a HCV k těžkým průběhům fibrocholestatické formy hepatitidy nedochází.
Situace je komplikovanější u pacientů po transplantaci jater s rekurencí HCV, kdy bývá léková toxicita často zvažována. Na druhou stranu, v této situaci se většinou ocitá klinik seznámený s problematikou a definitivní interpretace morfologie se provede často až se znalostí počtu kopií viru.
V posledních desetiletích narůstá počet pacientů, kteří jsou léčeni imunosupresivními preparáty nebo je jim imunosuprese navozena chemoterapií při terapii nádorových onemocnění. Část virových chorob se pod vlivem imunosuprese chová jinak a způsobí odlišné onemocnění, které má jiný morfologický obraz a často má i mnohem závažnější klinické projevy, než s jakými se setkáváme při přirozeném vývoji těchto chorob. V případě fibrocholestatické formy virových hepatitid jen včasná diagnóza dává pacientovi šanci přežít závažné onemocnění a patolog, který zná neobvyklé morfologické projevy tohoto typu hepatitidy, může být jedním z pilířů týmu, který zachrání pacientovi život.
PODĚKOVÁNÍ
Práce byla podpořena Výzkumným záměrem IKEM MZO 00023001.
Adresa pro korespondenci:
MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
email: eva.honsova@ikem.cz
tel.: 261 365 231, fax: 261 363 076
Zdroje
1. Davies SE, Portmann BC, O’Grady JG, et al. Hepatic histological findings after transplantation for chronic hepatitis B virus infection, including a unique pattern of fibrosing cholestatic hepatitis. Hepatology 1991; 13 : 150–157.
2. OęGrady JG, Smith HM, Davies SE, et al. Hepatitis B virus reinfection after orthotopic liver transplantation. Serological and clinical implications. J Hepatol 1992; 14 : 104–111.
3. Lam P, Wachs M, Somberg K, et al. Fibrosing cholestatic hepatitis in renal transplant recipients. Transplantation 1996; 61(3): 378–381.
4. Delgado J, Munoz de Bustillo E, Ibarrola C, et al. Hepatitis C virus related fibrosing cholestatic hepatitis after cardiac transplantation: is azathioprine a contributory factor? J Heart Lung Transplant 1999; 18 : 607–610.
5. Kojima H, Abei M, Takei N, et al. Fatal reactivation of hepatitis B virus following cytotoxic chemotherapy for acute myelogenous leukemia: fibrosing cholestatic hepatitis. Eur J Haematol 2002; 69 : 101–104.
6. Yeo W, Chn T, Leung N, et al. Hepatitis B virus reactivation in lymphoma patiens with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab. J Clin Oncol 2009; 27(4): 605–611.
7. Kusumoto S, Tanaka Y, Mizokami M, Ueda R. Reactivation of hepatitis B virus following systemic chemotherapy for malignant lymphoma. Int J Hematol 2009; 90 : 13–23.
8. Demetris AJ. Evolution of hepatitis C virus in liver allografts. Liver Transpl 2009; 15(Suppl 2): 35–41.
9. Xiao SY, Lu L, Wang H. Fibrosing cholestatic hepatitis: Clinicopathologic spectrum, diagnosis and pathogenesis. Int J Clin Exp Pathol 2008; 1 : 396–402.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Pokroky v hepatopatologiiČlánek JAKÁ JE VAŠE DIAGNÓZA?
Článok vyšiel v časopiseČesko-slovenská patologie

2011 Číslo 2-
Všetky články tohto čísla
- Pokroky v hepatopatologii
- Vždy som bol a aj som optimistom
- Jak v praxi zlepšit histopatologickou diagnostiku hepatocelulárního karcinomu
- Virové hepatitidy na začátku 21. století – význam jaterní biopsie v kontextu rozvoje neinvazivních diagnostických metod a ve vztahu k moderní léčbě chronických virových hepatitid
- Prague Hepatology Meeting 2010 – novinky z hepatopatologie
- JAKÁ JE VAŠE DIAGNÓZA?
- Fibrotizující cholestatická hepatitida – onemocnění nejen transplantovaných pacientů
- Pseudoangiomatózna stromálna hyperplasia s obrovskými viacjadrovými bunkami: lézia ženského prsníka bez asociácie s neurofibromatózou?
- Imunohistochemická detekce 3-nitrotyrosinu vázaného na proteiny u zánětlivých myopatií
- Histologický registr mamárních karcinomů - MAGISTER
- Patologie na území Ostravy v proměnách času
- 70-roční jubileum Doc. MUDr. Jaroslava Horáčka, CSc.
- Životní jubileum prof. Josefa Špačka
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Fibrotizující cholestatická hepatitida – onemocnění nejen transplantovaných pacientů
- JAKÁ JE VAŠE DIAGNÓZA?
- 70-roční jubileum Doc. MUDr. Jaroslava Horáčka, CSc.
- Životní jubileum prof. Josefa Špačka
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



