-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Histopatologická diagnostika myokarditid
Histopathological diagnosis of myocarditis
Histopathological assessment of the endomyocardial biopsy represents a gold standard in diagnosis of myocarditis (MC). For a long time, the microscopic diagnosis relied on Dallas criteria. They defined MC on morphological grounds as a presence of inflammatory infiltrate accompanied by signs of myocyte damage. However, these criteria were abandoned due to large proportion of false negative results and substantial interpersonal variability in the histopathological evaluation. The immunohistochemistry was implemented in the diagnostic process as well. Morphological classification of MC is based on the type of the inflammatory infiltration. The most common type of MC in the routine bioptic practice is lymphocytic MC. Giant cell, granulomatous, neutrophilic and eozinophilic MC are less frequent. The aim of this work is to inform about the current level of knowledge in histopathological diagnostics of MC and, in relation to previous article “ Štěchovský, Adla, Bonaventura: Clinical perspective on the myocarditis and cardiomyopathies”, discuss also a different clinical and pathological view on this group of diseases.
Keywords:
histopathology – myocarditis – endomyocardial biopsy – Dallas criteria
Autori: Ondřej Fabián 1; Cyril Štěchovský 2
Pôsobisko autorov: Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha 1; Kardiologická klinika 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 55, 2019, No. 4, p. 218-223
Kategória: Přehledový článek
Súhrn
Histopatologické vyšetření endomyokardiální biopsie je dodnes zlatým standardem v diagnostice myokarditid (MK). Mikroskopická diagnóza se dlouhá léta opírala o tzv. Dallaská kritéria, která MK na morfologické úrovni definovala jako přítomnost zánětlivé celulizace a známek poškození kardiomyocytů. Vysoké procento falešně negativních výsledků a značná subjektivita v interpretaci nálezů však vedly ke změně těchto kritérií a zařazení imunohistochemie do diagnostického procesu. Morfologická klasifikace MK pak vychází ze složení zánětlivého infiltrátu. Nejčastějším typem MK v bioptické praxi je MK lymfocytární, méně časté jsou pak MK obrovskobuněčné, granulomatózní, eozinofilní a neutrofilní. Cílem tohoto doškolovacího článku je informovat o aktuálním stavu histopatologické diagnostiky MK a v návaznosti na předchozí práci v tomto čísle časopisu „Štěchovský, Adla, Bonaventura: Myokarditidy a kardiomyopatie z pohledu kardiologa“ komentovat rozdílný klinický a patologický pohled na tuto skupinu chorob.
Klíčová slova:
Dallaská kritéria – endomyokardiální biopsie – histopatologie – myokarditida
Mikroskopické vyšetření endomyokardiální biopsie (EMB) s pozitivním záchytem zánětlivé celulizace je dodnes považováno za zlatý standard v diagnostice myokarditid (MK) (1). Nicméně nutnost invazivního výkonu a vysoké procento falešně negativních výsledků jsou předmětem přetrvávající nespokojenosti na klinické i patologické úrovni. Kontinuální snaha o zkvalitnění klinických diagnostických metod a zpřesnění histopatologických kritérií je tak pochopitelná a výsledkem jsou časté změny v interpretaci EMB i její pozice v rámci multidisciplinárního diagnostického algoritmu.
V předchozí práci „Štěchovský, Adla, Bonaventura: Myokarditidy a karidomyopatie z pohledu kardiologa“ si autoři kladli za cíl informovat o klinické klasifikaci MK a přiblížit čtenářům kardiologickou část diagnostického procesu. Tento doškolovací článek na předchozí text navazuje histopatologickou diagnostikou MK, komentuje její výhody a limitace, klasifikuje MK z morfologického pohledu a informuje o aktuálně užívaných mikroskopických diagnostických kritériích.
TECHNICKÉ ASPEKTY ODBĚRU A ZPRACOVÁNÍ VZORKU
Rozhodnutí provést EMB obvykle vychází z klinické suspekce na závažné nebo rychle probíhající onemocnění a každá EMB tak představuje pro patologa diagnostickou výzvu. Množství materiálu je většinou značně limitováno a jakkoliv nesprávně provedený odběr, transport či zpracování vzorku mohou zásadním způsobem snížit výtěžnost biopsie a ovlivnit výslednou diagnózu. Při suspekci na myokarditidu se EMB obvykle provádí z pravé srdeční komory transjugulární nebo femorální cestou. Žilní přístup je méně technicky náročný než přístup arteriální a v rukou zkušeného kardiologa představuje relativně bezpečnou proceduru s nízkým procentem život ohrožujících komplikací. Nevýhodou je však vysoké procento falešně negativních výsledků, které se v případě odběru standardního počtu vzorků (obvykle 3-4) pohybuje okolo 70 % a u některých diagnóz, jako např. sarkoidóza srdce, dosahuje až 90 % (2,3). Vyšší záchytnost má kombinovaný odběr z pravé i levé komory, případně echokardiograficky či skiaskopicky navigovaná EMB (4-6). Standardní odběr EMB pro potřeby světelné mikroskopie by měl zahrnovat alespoň 3 vzorky o velikosti 1-2 mm3 (7). Případné další vzorky a jejich počet se odvíjí od klinicky zvažované diagnózy. V případě MK je často odebírán jeden vzorek navíc, který je využit k izolaci nukleových kyselin a průkazu přítomnosti virů metodou polymerázové řetězové reakce (PCR). U kardiomyopatií, kde je mnohdy zapotřebí provést i další specializovaná vyšetření (elektronová mikroskopie, imunohistochemie,...) je množství materiálu obvykle větší. Odebraný materiál by měl být kardiologem šetrně vyjmut z bioptických kleští (nejlépe jehlou, pinzeta drobné vzorky často zhmoždí) a transportován na patologické oddělení. Vzorky jsou zasílány zásadně v nativním stavu, o případné formolové fixaci či jiné formě zpracování rozhoduje až patolog. Vhodný není ani transport ve zkumavce naplněné fyziologickým roztokem, nasáklý plovoucí vzorek může komplikovat diagnostický proces nepříjemnými artefakty, které mohou věrně imitovat intracelulární edém a v některých případech i dokonce imponovat jako střádavé metabolické onemocnění. Jako ideální se jeví vzorek položit do Petriho misky na kus gázy navlhčené fyziologickým roztokem (8). Vlhké prostředí zabrání vyschnutí vzorku a zároveň nedojde k jeho nasáknutí.
Materiál je doporučeno fixovat v 10% pufrovaném formolu o pokojové teplotě (7). Jak již bylo zmíněno, jeden vzorek lze ponechat v nativním stavu a využít jej pro potřeby mikrobiologického vyšetření (8-10). Peroperační histopatologická diagnostika ze zmraženého materiálu není doporučována z důvodu obtížného a často nespolehlivého rozpoznávání zánětlivých infiltrátů (7). Vzorky jsou následně prokrájeny v sériových řezech na více skel, minimem by mělo být 10 řezů. Kvalitně provedené barvení hematoxylinem a eozinem je pak základním kamenem diagnostiky MK. Z dalších specializovaných metod má význam Massonův trichrom nebo Movatův pentachrom ke zhodnocení fibrotizace (7,11). Imunohistochemické vyšetření v diagnostice MK je komentováno níže.
HISTOPATOLOGICKÁ KRITÉRIA PRO DIAGNOSTIKUMYOKARDITID
Prvními standardizovanými diagnostickými kritérii byla tzv. Dallaská kritéria z roku 1987 (12) (tab. 1), která byla extenzivně užívána v bioptické praxi po více než dvě následující dekády. Podle těchto kritérií je pro diagnózu MK vyžadována „Přítomnost zánětlivého infiltrátu v myokardu spolu s nekrózou a/nebo degenerací okolních kardiomyocytů, neodpovídající ischemickému poškození v rámci koronárního onemocnění.“ Jak vyplývá z definice, degenerací myocytů nemusí být nutně vyvinutá nekróza. Naopak, nález je mnohdy diskrétní, v podobě mírné hypereozinofile nebo „setřelého“ vzhledu cytoplazmy, ztráty příčného pruhování či přítomnosti intracytoplazmatických lymfocytů. Při každém nálezu zánětlivého infiltrátu je tak zapotřebí v jeho okolí po těchto změnách aktivně pátrat. V první biopsii je dle Dallaských kritérií nález zánětlivého infiltrátu spolu s výše popsanou degenerací kardiomyocytů hodnocen jako aktivní MK. Pakliže je přítomný pouze zánět bez prokazatelné destrukce myocytů, odpovídá obraz tzv. borderline MK. V případě následných kontrolních biopsií je pak kombinace zánětlivého infiltrátu a myocytárního poškození hodnocena jako perzistující MK a samotný zánět (který bývá obvykle mírnější než v první biopsii) jako hojící se MK. V rámci bioptické zprávy by měl patolog specifikovat složení zánětu a vyjádřit se k přítomnosti a distribuci fibrotizace. Je důležité zmínit, že přítomnost či absence fibrózy nijak nesouvisí s diagnózou aktivní nebo perzistující MK, terminologie vychází čistě z faktu, zda se jedná o první nebo následnou biopsii (13).
Tab. 1. Dallaská kritéria pro histopatologickou diagnostiku lymfocytární myokarditidy 
Dallaská kritéria s sebou nicméně přinesla i řadu kontroverzí. Je to předně jejich značná subjektivita, a to nejen stran hodnocení diskrétního myocytárního poškození, ale i přítomnosti zánětlivého infiltrátu. Zejména lymfocytární celulizace může být zaměněna s jádry žírných buněk, příčně zachycenými jádry fibroblastů nebo endoteliemi kapilár (14). Problematické jsou v tomto zejména pediatrické EMB, dětský myokard je totiž výrazně buněčnější než dospělý. Mezi další limitace pak patří vysoké procento falešně negativných výsledků a nemožnost rozpoznání proběhlé MK z první biopsie (14,15). Dallaská kritéria se tak v řadě publikací stále častěji stávala terčem kritiky (za vše hovoří práce od Baughmana KL: Diagnosis of myocarditis: death of Dallas criteria, 14). Zásadní změnu přinesl společný projekt Světové Zdravotnické Organizace a International Society and Federation of Cardiology Task Force on the Definition and Classification of Cardiomyopathies. Jeho výsledkem bylo etablování tzv. Marburských kritérií (tab. 2), jejichž součástí se stal i imunohistochemický průkaz lymfocytů v bioptickém vzorku (16). Dle těchto kritérií je MK na mikroskopické úrovni definována nálezem 14 a více leukocytů detekovaných imunohistochemicky na mm2 vzorku, z nichž minimálně 7 musí tvořit T-lymfocyty a maximálně 4 makrofágy. Dříve používaný průkaz antigenů LCA a CD3 je dnes nahrazen protilátkou proti CD45RO, která má v diagnostice MK vyšší záchytnost (17). Obdobně jako v Dallaských kritériích je i zde pro diagnózu akutní MK v první biopsii vyžadována přítomnost zánětlivého infiltrátu spolu s myocytárním poškozením. Pouhá přítomnost zánětu, která by dříve odpovídala borderline MK, byla nahrazena termínem chronická MK (znovu zcela nezávisle na přítomnosti či absenci fibrotizace). Diagnóza MK v následné biopsii pak odpovídá kritériím v první biopsii, jednotlivé kategorie se liší pouze podle toho, zda intenzita zánětu ubývá či nikoliv.
Tab. 2. Histopatologická kritéria myokarditidy dle World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of Cardiomyopathies. 
Hodnocení fibrózy
Množství: Žádné (grade 0); mírné (grade 1); střední (grade 2); výrazné (grade 3)
Lokalizace: Endokardiální; intersticiální; nahrazující myokardMarburská kritéria přinesla nepochybně zpřesnění diagnostiky MK díky využití imunohistochemických metod a v současné době jsou součástí doporučených postupů European Society of Cardiology (9) a figurují i v oficiálních doporučených postupech pro odběr a zpracování EMB dle Association for European Cardiovascular Pathology a Society for Cardiovascular Pathology (18). Bohužel, ani Marburská kritéria však neodkázala odstranit některé subjektivní obtíže v hodnocení, zejména myocytárního poškození. Obligátní použití imunohistochemie navíc může v řadě případů vést k nadhodnocení výsledků, což se týká zejména resekčních a post mortem vzorků. Jak Dallaská, tak i Marburská kritéria byla etablována pro EMB. Neexistuje však validace pro nekroptický materiál či explantovaná srdce (19). Samostatnou kapitolou je pak přítomnost lymfocytů v myokardech pediatrických pacientů, která se zdá být fyziologická ve vyšším množství než v myokardu dospělém. V nedávné době se objevila snaha stanovit kritéria pozitivity pro MK u dětí do 1 roku (20,21), což vedlo k extrémnímu nárůstu záchytu MK v nekroptickém materiálu u novorozenců a kojenců zemřelých pod obrazem syndromu náhlého úmrtí. U malých dětí (novorozenci, kojenci) se tak stále doporučuje spíše spoléhat na Dallaská kritéria (19).
V neposlední řadě je zapotřebí zmínit, že obě kritéria jsou platná pro diagnostiku lymfocytární MK. Pro jiné druhy MK (eozinofilní, obrovskobuněčná,...) není nezbytný nález myocytárního poškození (i když ve většině případů přítomno je).
DETEKCE PŘÍTOMNOSTI VIRŮ Z BIOPTICKÉHO VZORKU
Průkaz virové nukleové kyseliny metodou PCR dle některých doporučení patří do rukou patologa (22), v řadě případů však patologické oddělení pouze izoluje nukleové kyseliny a následně je poskytne mikrobiologickému ústavu nebo vzorek na mikrobiologii odesílá přímo kardiolog v rámci bioptického odběru. Jak již bylo zmíněno v předchozí práci, samotný průkaz přítomnosti virové nukleové kyseliny bez nálezu zánětlivé celulizace není pro diagnózu myokarditidy dostačující. Viry lze metodou PCR detekovat i v EMB nebo explantovaných srdcích s jinými diagnózami, například dilatační kardiomyopatií, a dokonce i v dárcovských srdcích či náhodně odebraných vzorcích z nekropsie (23,24). Někdy se prokáže i přítomnost více virů zároveň (25). Každý vzorek z EMB navíc obsahuje určité množství krve a PCR provedená z bioptického materiálu tak nezaručuje, že se jedná o virus pocházející přímo z dané tkáně a ne jen z periferní cirkulace. Řada autorů tak upřednostňuje přímý průkaz virů formou in situ hybridizace (26-30). Klinický význam by tak mohl mít paradoxně spíše negativní nález. Dle některých prací (22) totiž absence virové nukleové kyseliny v EMB s histopatologicky prokázanou myokarditidou predikuje lepší prognózu.
JEDNOTLIVÉ MORFOLOGICKÉ VZORCE MYOKARDITID
Ve všech odvětvích nenádorové patologie platí základní poučka, že patolog nevidí konkrétní choroby, nýbrž morfologické vzorce a každý z těchto vzorců má svojí diferenciální diagnózu. Stejně tak je tomu i v histopatologické diagnostice MK, kdy nevycházíme z etiologické klasifikace (MK virová, bakteriální, autoimunitní,...), ale z klasifikace morfologické, která se odvíjí od složení zánětlivého infiltrátu.
Lymfocytární myokarditida
Lymfocytární MK je nejčastějším typem MK v bioptické praxi. Definuje jí převaha lymfocytů v zánětlivém infiltrátu spolu s absencí mnohojaderných buněk či granulomů (obr. 1A a 1B). Minoritní příměs neutrofilů či eozinofilů je častá a diagnózu nevylučuje. Nicméně převaha granulocytů či směsná buněčná populace by měla vést k úvaze nad jiným typem MK nebo MK ve fázi hojení (15,31,32). Zánět bývá většinou fokální, méně často difúzní. Jeho distribuce je zcela náhodná, bez jakékoliv predilekční lokalizace, z čehož vyplývá vysoké procento falešně negativních výsledků (3).
Obr. 1. A: Myokard s přítomností několika drobných skupinek lymfocytů, avšak bez přesvědčivé destrukce kardiomyocytů. Dle Dallaských kritérií by diagnóza odpovídala borderline myokarditidě (hematoylin & eozin, 200x). B: Stejná biopsie s imunohistochemickým průkazem antigenu CD45RO, demonstrující početné T-lymfocyty v intersticiu myokardu. Dle Marburských kritérií nález svědčí pro akutní lymfocytární myokarditidu (200x). 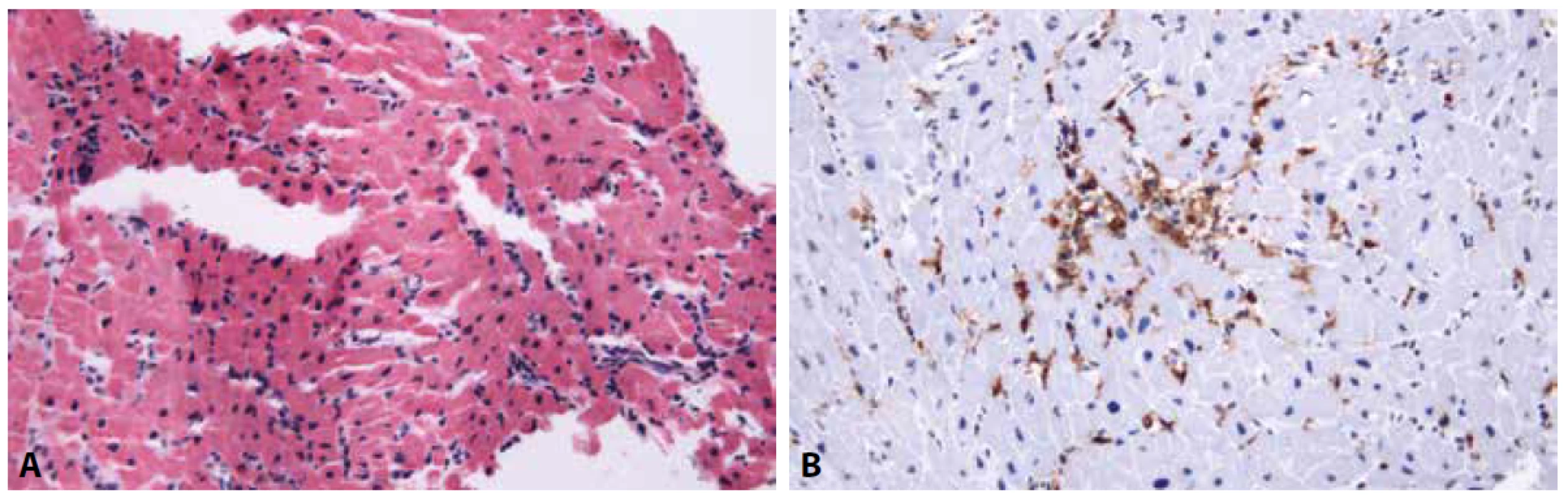
Z etiologického hlediska je tento typ MK nejméně specifický. Většinu případů tvoří virová MK, agens však mnohdy není detekováno a zvažován je autoimunitní proces, ať již primární nebo v návaznosti na předchozí infekci (32-34). V malé části případů může lymfocytární vzorec vykazovat i bakteriální MK, zejména Lymeská borelióza, nebo parazitní onemocnění typu toxoplazmózy nebo Chagasovy nemoci, kde může napomoct přímý záchyt agens v cytoplazmě kardiomyocytů (často spolu s rizikovou epidemiologickou anamnézou a tkáňovou či periferní eozinofilií) (4,9,35,36).
Obraz lymfocytární MK je z morfologického hlediska neodlišitelný od celulární rejekce. U pacientů po transplantaci srdce tak patolog neodkáže odlišit rejekční zánětlivý infiltrát od infekčního (37).
Lymfohistiocytární myokarditida
Tato skupina je definována směsnou populací lymfocytů a makrofágů s nekonstantní příměsí mnohojaderných buněk. Spadají sem dvě podkategorie:
Obrovskobuněčná myokarditida
I v případě obrovskobuněčné MK jsou dominantní buněčnou populací lymfocyty. Je to však právě přítomnost mnohojaderných histiocytů, většinou doprovázená i vyšším počtem jednojaderných makrofágů, která ji odlišuje od lymfocytární MK (obr. 2). Součástí zánětu bývají i eozinofilní granulocyty, často i ve větším počtu (38-40). Z klinického hlediska jde o závažné, často fulminantně probíhající onemocnění, což reflektuje i mikroskopický nález s extenzivním, často až difúzním postižením myokardu. EMB má v tomto případě vysokou záchytnost (až 80%) (41). Onemocnění většinou postihuje obě srdeční komory, popsána však byla i obrovskobuněčná MK s predilekční lokalizací v síních. Jedná se nejspíše o samostatnou jednotku, která má indolentní průběh a dobrou prognózu (42,43). Jako MK s mnohojadernými buňkami se v některých případech mohou manifestovat i specifické infekce (ačkoliv ty většinou nabývají obrazu granulomatózní MK) nebo tento obraz může napodobovat reakce na cizorodý materiál (např. různé srdeční implantáty) (44).
Obr. 2. Obrovskobuněčná myokarditida s rozsáhlou destrukcí myokardu a přítomností mnohojaderných buněk (hematoxylin & eozin, 200x). 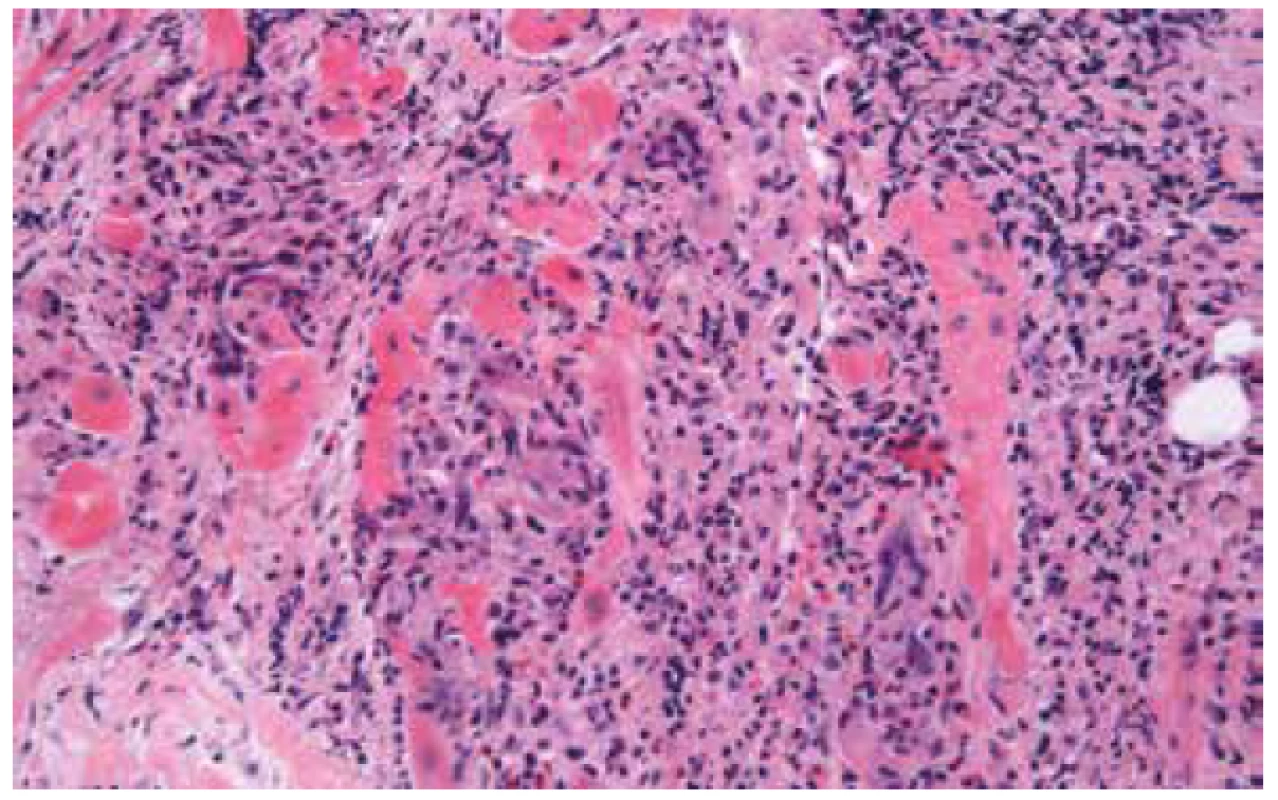
V diferenciální diagnóze je nutné vyloučit zejména granulomatózní myokarditidu (tab. 3). Jakýkoliv záchyt epiteloidního granulomu vylučuje obrovskobuněčnou MK a téměř jistě znamená diagnózu srdeční sarkoidózy, která představuje drtivou většinu granulomatózních zánětu srdce. Velké procento srdečních sarkoidóz však dobře formované granulomy postrádá a přítomny jsou jen izolované mnohojaderné buňky. Diagnóza je v těchto případech složitá a je zapotřebí si všímat doprovodných histopatologických nálezů. K odlišení těchto dvou afekcí napomůže výše zmíněná intenzita zánětu, která je v případě obrovskobuněčné MK výraznější. Dalším pomocným nálezem je přítomnost eozinofilů, která je pro obrovskobuněčnou MK typická a u sarkoidózy téměř vždy chybí, nebo je zastihneme jen zcela ojediněle (45). V případě, že je mikroskopický nález nejasný nebo neodpovídá klinické prezentací (například obraz obrovskobuněčné MK u pacienta s mírným průběhem onemocnění) je doporučován termín lymfohistiocytární MK s obrovskými buňkami (37).
Tab. 3. Histopatologická diferenciální diagnostika obrovskobuněčné myokarditidy a sarkoidózy srdce (granulomatózní myokarditidy) 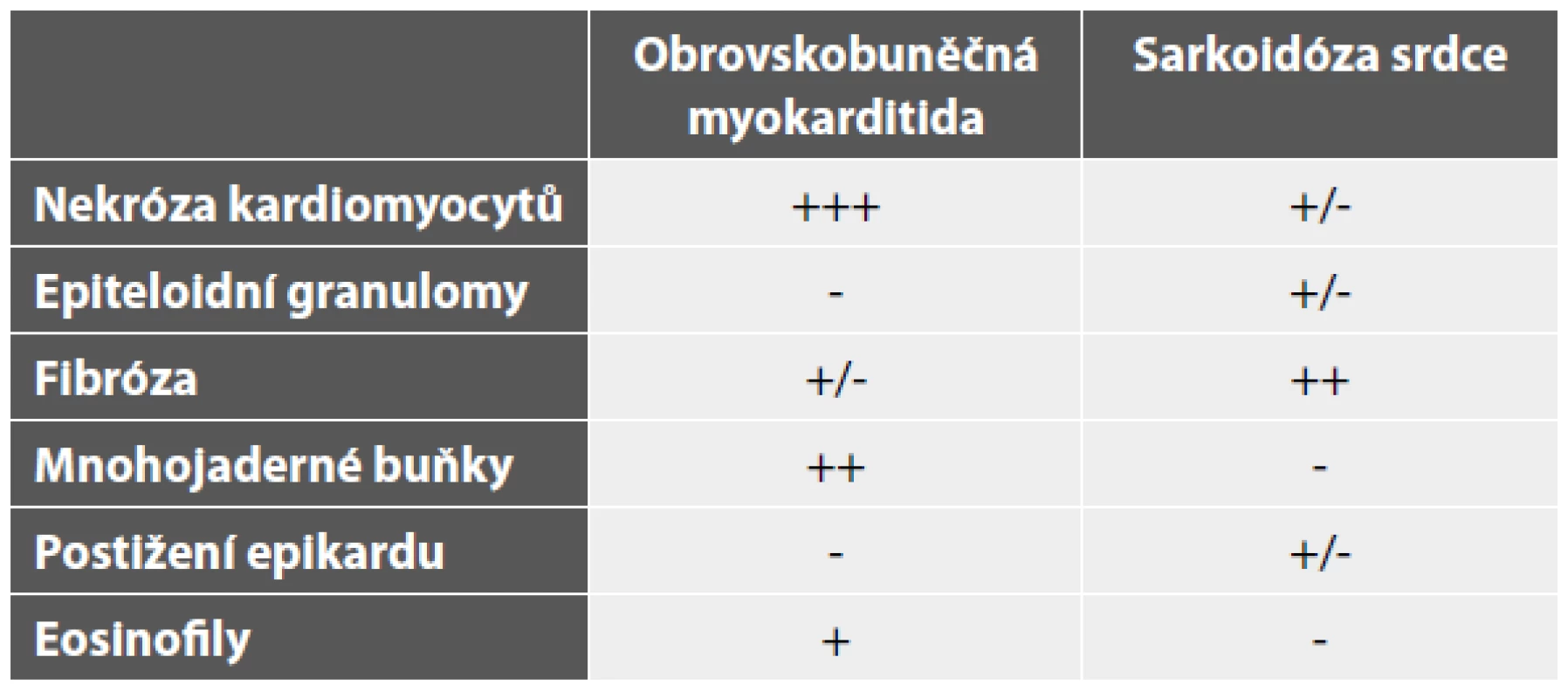
Obr. 3. Eozinofilní myokarditida s přítomností početných eozinofilních granulocytů a dystrofickými změnami kardiomyocytů (hematoxylin & eozin, 200x). 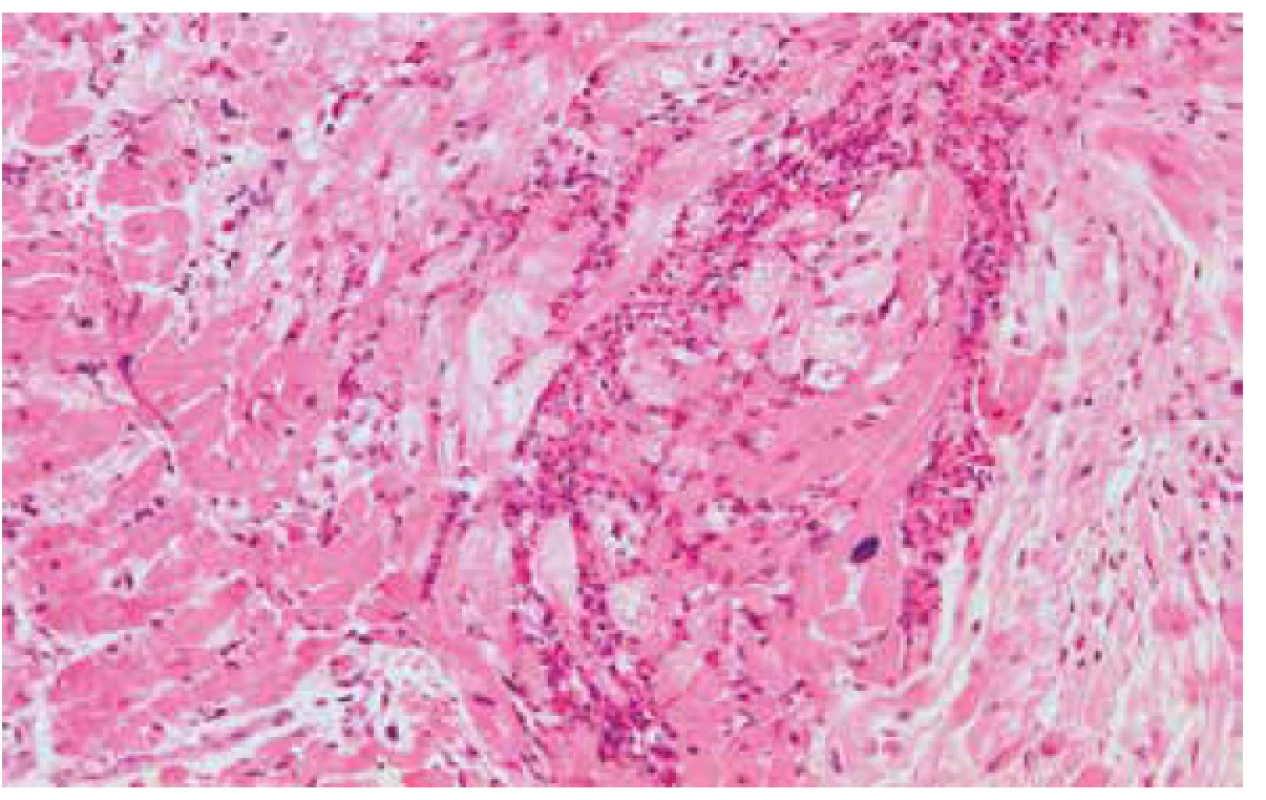
Granulomatózní myokarditida
Granulomatózní MK definuje přítomnost epiteloidních granulomů. Z etiologického hlediska se v drtivé většině případů jedná o sarkoidózu, čemuž odpovídá i morfologie granulomů, které jsou kompaktní, okrouhlé, bez nekrózy, často doprovázené extenzivní fibrotizací. Napomoct může i nález asteroidních či Schaumannových inkluzí, jejich přítomnost však není 100% patognomická. Granulomy většinou zastihneme v komorovém septu a volné stěně levé komory. Z toho důvodu má standardní EMB z pravé komory zpravidla malou výtěžnost (2,39,40,46). Jak již bylo zmíněno výše, přítomnost granulomů není pro diagnózu sarkoidózy srdce podmínkou a často zastihneme pouze izolované mnohojaderné buňky. V případě nálezu granulomů je zapotřebí zvážit i tuberkulózní či mykotickou etiologii, která mívá na rozdíl od jiných orgánů málokdy nekrotizující charakter. Jakýkoliv záchyt granulomu v srdci by tak měl vést k cílenému vyloučení těchto agens barvením Ziehl-Nielsen nebo PAS (8,44). Napomůže i klinické zasazení, mnohdy jde o imunokompromitované pacienty s extrakardiálním postižením, zpravidla plicním (46).
Eozinofilní myokarditida
Diagnóza eozinofilní MK nebývá obtížná díky obvykle dobře patrné eozinofilní zánětlivé celulizaci, která tvoří výhradní nebo minimálně značně převažující složku zánětu. Eozinofily jako minoritní komponenta jsou naopak necharakteristický nález, který může doprovázet i jiné typy MK (47,48). Mírnější eozinofilní zánět s jen minimálním doprovodným poškozením kardiomyocytů zpravidla svědčí pro hypersenzitivní MK, většinou léky indukovanou (zejména antibiotika, diuretika, psychofarmaka) (15,31). Denzní eozinofilní zánět s extenzivním myokardiálním poškozením pak odpovídá nekrotizující eozinofilní MK, která obvykle přichází v rámci některých ze syndromů spojených se systémovou eozinofilií, jako např. primární hypereozinofilní syndrom nebo léky indukovaná systémová eozinofilie (tzv. DRESS syndrom - drug rash with eosinophilia and systemic symptoms), popřípadě koexistuje s postižením endokardu jako Löfflerova endomyokarditida (47-52).
Neutrofilní myokarditida
Predominance neutrofilů je charakteristická pro neutrofilní myokarditidu. Většinou značí bakteriální infekci a objevuje se v rámci diseminované bakterémie nebo sepse, proto se s tímto obrazem často setkáváme při pitvě. Někdy můžeme pozorovat i drobné mikroabscesy. Objemné intramurální abscesy přicházejí spíše jako komplikace bakteriální endokarditidy (9,31,35,36).
Hojící se a zhojená myokarditida
Ve fázi hojení se začínají stírat původní histopatologické vzorce a jsou nahrazovány směsnou zánětlivou celulizací s účastí neutrofilů, lymfocytů, eozinofilů a početnějších makrofágů. Právě takovýto směsný obraz by měl vést k úvaze o subakutním charakteru onemocnění. Často bývají přítomny i okrsky granulační tkáně nebo fibrotizace. Jizvení bývá nepravidelné, mnohdy obkružuje reziduální kardiomyocyty a postrádá perivaskulární či subendokardiální distribuci typickou pro ischemické poškození. Subepikardiálně lokalizované jizvení pak při klinickém vyloučení embolizace do periferních větví koronárních arterií téměř vždy znamená zhojenou myokarditidu (37,53).
Myokardiální vaskulitida
Myokardiální vaskulitida přichází obvykle v rámci systémových autoimunitních onemocnění typu revmatoidní artritidy či lupus erythematodes nebo jako součást systémových vaskulitid. Častější bývá i u uživatelů kokainu. Z morfologického pohledu jde o intramyokardiální kapilaritidu, která mikroskopicky imponuje jako delikátní difúzní síťovitý lymfocytární zánět v intersticiu, obvykle bez doprovodné destrukce kardiomyocytů. Obraz tak může věrně imitovat borderline MK, ta však prakticky nikdy nemívá difúzní charakter (37).
ZÁVĚR
Histopatologický nález zánětlivého infiltrátu spolu s myocytárním poškozením je nejspolehlivějším průkazem MK. Jelikož etiologie MK zůstává na klinické úrovni mnohdy neobjasněna, a naopak složení zánětlivého infiltrátu ovlivňuje terapeutický postup, má jeho záchyt přímý vliv na prognózu pacienta. Změny v diagnostických kritériích spolu se zavedením imunohistochemie bezpochyby přispěly k vyšší záchytnosti MK v EMB. Výsledky však stále nejsou optimální a procento falešně negativních výsledků je stále vysoké. Úzká spolupráce patologa s klinickým lékařem je zde, stejně jako v jiných odvětvích nenádorové patologie, naprosto stěžejní.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Práce byla podpořena MZ ČR – RVO, FN v Motole 00064203.
MUDr. Ondřej Fabián
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol
V Úvalu 84
150 06, Praha 5
tel.: +420 224 435 645
e-mail: Ondrej.Fabian2@fnmotol.cz
Zdroje
1. Kühl U, Schultheiss HP. Myocarditis: early biopsy allows for tailored regenerative treatment. Dtsch Arztebl Int 2012; 109(20): 361-368.
2. Sekhri V, Sanal S, Delorenzo LJ, Aronow WS, Maguire GP. Cardiac sarcoidosis: a comprehensive review. Arch Med Sci 2011; 7(4): 546-554.
3. Chow LH, Radio SJ, Sears TD, McManus BM. Insensitivity of right ventricular endomyocardial biopsy in the diagnosis of myocarditis.J Am Coll Cardiol 1989; 14(4): 915-920.
4. Frustaci A, Bellocci F, Olsen EG. Results of biventricular endomyocardial biopsy in survivors of cardiac arrest with apparently normal hearts. Am J Cardiol 1994; 74(9): 890-895.
5. Mavrogeni S, Dimitroulas T, Kitas GD. Multimodality imaging and the emerging role of cardiac magnetic resonance in autoimmune myocarditis. Autoimmun Rev 2012; 12(2): 305-312.
6. Pieroni M, Smaldone C, Bellocci F: Myocarditis presenting with ventricular arrhythmias: role of electroanatomical mapping-guided endomyocardial biopsy in differential diagnosis. In: Cihakova D. Myocarditis. InTechOpen; 2011 : 365-386.
7. Stone JR, Basso C, Baandrup UT et al. Recommendations for processing cardiovascular surgical pathology specimens: a consensus statement from the Standards and Definitions Committee of the Society for Cardiovascular Pathology and the Association for European Cardiovascular Pathology. Cardiovasc Pathol 2012; 21(1): 2-16.
8. Cunningham KS, Veinot JP, Butany J. An approach to endomyocardial biopsy interpretation. J Clin Pathol 2006; 59(2): 121-129.
9. Caforio AL, Pankuweit S, Arbustini E et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34(33): 2636-2648.
10. Cooper LT, Baughman KL, Feldman AM et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology. Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol 2007; 50(19): 1914-1931.
11. Xu J, Brooks EG. Giant Cell Myocarditis: A Brief Review. Arch Pathol Lab Med 2016; 140(12): 1429-1434.
12. Aretz HT, Billingham ME, Edwards WD et al. Myocarditis. A histopathologic definition and classification. Am J Cardiovasc Pathol 1987; 1(1): 3-14.
13. Chimenti C, Frustaci A. Histopathology of myocarditis. Diagnostic Histopathology 2008; 14(8): 401-407.
14. Baughman KL. Diagnosis of myocarditis: death of Dallas criteria. Circulation 2006; 113(4): 593-595.
15. Cooper LT Jr. Myocarditis. N Engl J Med 2009; 360(15): 1526-1538.
16. Richardson P, McKenna W, Bristow M et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation 1996; 93(5): 841-842.
17. Woudstra L, Biesbroek PS, Emmens RW et al. CD45 is a more sensitive marker than CD3 to diagnose lymphocytic myocarditis in the endomyocardium. Hum Pathol 2017; 62 : 83-90.
18. Leone O, Veinot JP, Angelini A et al. 2011 consensus statement on endomyocardial biopsy from the Association for European Cardiovascular Pathology and the Society for Cardiovascular Pathology. Cardiovasc Pathol 2012; 21(4): 245-274.
19. Grasmeyer S, Madea B. Immunohistochemical diagnosis of myocarditis on (infantile) autopsy material: Does it improve the diagnosis? Forensic Sci Med Pathol 2015; 11(2): 168-176.
20. Dettmeyer R, Baasner A, Schlamann M et al. Role of virus-induced myocardial affections in sudden infant death syndrome: a prospective postmortem study. Pediatr Res 2004; 55(6): 947-952.
21. Rognum TO, Arnestad M, Bajanowski T et al. State of the art conference on the stratification of SUDI. Consensus on diagnostic criteria for the exclusion of SIDS. Nordisk Rettsmedisin 2003; 3/4 : 49-88.
22. Angelini A, Crosato M, Boffa GM et al. Active versus borderline myocarditis: clinicopathological correlates and prognostic implications. Heart 2002; 87(3): 210-215.
23. Donoso Mantke O, Meyer R, Prösch S et al. High prevalence of cardiotropic viruses in myocardial tissue from explanted hearts of heart transplant recipients and heart donors: a 3-year retrospective study from a German patients’ pool. J Heart Lung Transplant 2005; 24(10): 1632-1638.
24. Schenk T, Enders M, Pollak S, Hahn R, Huzly D. High Prevalence of Human Parvovirus B19 DNA in Myocardial Autopsy Samples from Subjects without Myocarditis or Dilative Cardiomyopathy. J Clin Microbiol 2009; 47(1): 106-110.
25. Kühl U, Pauschinger M, Noutsias M et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with “idiopathic” left ventricular dysfunction. Circulation 2005; 111(7): 887-893.
26. Guarner J, Bhatnagar J, Shieh WJ et al. Histopathologic, immunohistochemical, and polymerase chain reaction assays in the study of cases with fatal sporadic myocarditis. Hum Pathol 2007; 38(9): 1412-1419.
27. Tracy S, Chapman NM, McManus BM, Pallansch MA, Beck MA, Carstens J. A molecular and serologic evaluation of enteroviral involvement in human myocarditis. J Mol Cell Cardiol 1990; 22(4): 403-414.
28. Koepsell SA, Anderson DR, Radio SJ. Parvovirus B19 is a bystander in adult myocarditis. Cardiovasc Pathol 2012; 21(6): 476-481.
29. Pankuweit S, Klingel K. Viral myocarditis: from experimental models to molecular diagnosis in patients. Heart Fail Rev 2013; 18(6): 683-702.
30. Bock CT, Klingel K, Kandolf R. Human parvovirus B19-associated myocarditis. N Engl J Med 2010; 362(13): 1248-1249.
31. Kindermann I, Barth C, Mahfoud F et al. Update on myocarditis. J Am Coll Cardiol 2012; 59(9): 779-792.
32. Basso C, Calabrese F, Angelini A, Carturan E, Thiene G. Classification and histological, immunohistochemical, and molecular diagnosis of inflammatory myocardial disease. Heart Fail Rev 2013; 18(6): 673-681.
33. Leuschner F, Katus HA, Kaya Z. Autoimmune myocarditis: past, present and future. J Autoimmun 2009; 33(3-4): 282-289.
34. Rose NR. Myocarditis: infection versus autoimmunity. J Clin Immunol 2009; 29(6): 730-737.
35. Blauwet LA, Cooper LT. Myocarditis. Prog Cardiovasc Dis 2010; 52(4): 274-288.
36. Sagar S, Liu PP, Cooper LT Jr. Myocarditis. Lancet 2012; 379(9817): 738-747.
37. Buja LM, Butany J. Cardiovascular Pathology (4th ed). United States: Academic Press; 2015 : 348-349, 406.
38. Cooper LT Jr. Acute heart failure due to fulminant and giant cell myocarditis. Herz 2006; 31(8): 767-770.
39. Cooper LT Jr. Giant cell and granulomatous myocarditis. Heart Fail Clin 2005; 1(3): 431-437.
40. Blauwet LA, Cooper LT. Idiopathic giant cell myocarditis and cardiac sarcoidosis. Heart Fail Rev 2013; 18(6): 733-746.
41. Shields RC, Tazelaar HD, Berry GJ, Cooper LT Jr. The role of right ventricular endomyocardial biopsy for idiopathic giant cell myocarditis. J Card Fail 2002; 8(2): 74-78.
42. Larsen BT, Maleszewski JJ, Edwards WD et al. Atrial giant cell myocarditis: a distinctive clinicopathologic entity. Circulation 2013; 127(1): 39-47.
43. Bose AK, Bhattacharjee M, Martin V, Kendall S. Giant cell myocarditis of the left atrium. Cardiovasc Pathol 2010; 19(2): e37-38.
44. Cooper LT Jr. Giant cell myocarditis: diagnosis and treatment. Herz 2000; 25(3): 291-298.
45. Litovsky SH, Burke AP, Virmani R. Giant cell myocarditis: an entity distinct from sarcoidosis characterized by multiphasic myocyte destruction by cytotoxic T cells and histiocytic giant cells. Mod Pathol 1996. 9(12): 1126-1134.
46. Lagana SM, Parwani AV, Nichols LC. Cardiac sarcoidosis: a pathology-focused review. Arch Pathol Lab Med 2010; 134(7): 1039-1046.
47. Ginsberg F, Parrillo JE. Eozinophilic myocarditis. Heart Fail Clin 2005; 1(3): 419-429.
48. Al Ali AM, Straatman LP, Allard MF, Ignaszewski AP. Eozinophilic myocarditis: case series and review of literature. Can J Cardiol 2006; 22(14): 1233-1237.
49. Murphy JG, Wright RS, Bruce GK et al. Eozinophilic-lymphocytic myocarditis after smallpox vaccination. Lancet 2003; 362(9393): 1378-1380.
50. Benezet-Mazuecos J, de la Fuente A, Marcos-Alberca P, Farre J. Loeffler endocarditis: what have we learned? Am J Hematol 2007; 82(10): 861-862.
51. Thongsri T, Chularojanamontri L, Pichler WJ. Cardiac involvement in DRESS syndrome. Asian Pac J Allergy Immunol 2017; 35(1): 3-10.
52. Morikawa D, Hiraoka E, Obunai K, Norisue Y. Myocarditis Associated with Drug Reaction with Eozinophilia and Systemic Symptoms (DRESS) Syndrome: A Case Report and Review of the Literature. Am J Case Rep 2018; 19 : 978-984.
53. Burke A, Tavola F. Practical Cardiovascular Pathology (Har/Psc ed). United States: Lippincott Williams & Wilkins; 2011 : 241-242.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek Dopis redakci
Článok vyšiel v časopiseČesko-slovenská patologie

2019 Číslo 4-
Všetky články tohto čísla
- Novinky v kardiovaskulární patologii
- Nová učebnice PATOLOGIE je tady
- MONITOR, aneb nemělo by vám uniknout, že...
- Praktický přístup k pitvě srdce s vrozenou srdeční vadou
- Myokarditida a kardiomyopatie z pohledu kardiologa
- MONITOR, aneb nemělo by vám uniknout, že...
- Histopatologická diagnostika myokarditid
- Nejnovější poznatky v mikroskopické diagnostice kardiomyopatií
- Lymfom z plášťové zóny diagnostikovaný z materiálu z radikální prostatektomie provedené pro adenokarcinom - kazuistika
- Incidentálna fokálna idiopatická sklerozujúca mezenteritída u 4-mesačného dieťaťa
- Inflamatorní myofibroblastický tumor dělohy – kazuistika
- Fumarát hydratáza deficientní karcinom z renálních buněk a jemu podobný karcinom z renálních buněk: Komparativní studie 23 geneticky testovaných případů
- Spomienka na emeritného primára MUDr. Petra Kosseya, CSc.
- Chondroidní melanom: kazuistika
- Dopis redakci
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Myokarditida a kardiomyopatie z pohledu kardiologa
- Fumarát hydratáza deficientní karcinom z renálních buněk a jemu podobný karcinom z renálních buněk: Komparativní studie 23 geneticky testovaných případů
- Inflamatorní myofibroblastický tumor dělohy – kazuistika
- Praktický přístup k pitvě srdce s vrozenou srdeční vadou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




