-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky v klinické diagnostice ischemické choroby srdeční a aktuální doporučené terapeutické postupy
State of the art in diagnostics of ischemic heart disease and current recommended therapeutic approach
Several changes have occurred during last few years in diagnostics and treatment of the ischemic heart disease, especially due to introduction of so called high-sensitive troponins, implementation of new antiplatelet drugs, using of drug-eluting stents in percutaneous coronary interventions or novel definitions of acute myocardial infarction types. The European Society of Cardiology and Czech Society of Cardiology established new recommendations for management of both acute and chronic forms of the ischemic heart disease. Recently discovered inhibitors of the PCSK9 molecule that have been slowly introduced in the clinical practice represent a breakthrough in the treatment of dyslipidemia. Future research will certainly aim at detection of early forms of the atherosclerotic involvement of the coronary arteries.
Keywords:
ischemic heart disease – revised guidelines of European Society of Cardiology/Czech Society of Cardiology – new antiplatelet drugs – inhibition of PCSK9
Autori: Kateřina Bouzková
Pôsobisko autorov: Klinika kardiologie, Kardiocentrum, Institut klinické a experimentální medicíny (IKEM), Praha
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 1, p. 13-17
Kategória: Přehledový článek
Súhrn
Během posledních let došlo v diagnostice i v léčbě ischemické chorobě srdeční k několika změnám. Svou roli v tomto hraje zavedení laboratorního stanovení tzv. vysoce specifických troponinů, farmakologická implementace nových protidestičkových léků, použití lékových stentů u perkutánní koronární intervence nebo například nová definice typů infarktu myokardu. Evropská kardiologická společnost, potažmo Česká kardiologická společnost v posledních letech vydala nové doporučení týkající se ischemické choroby srdeční jak u forem akutních, tak u forem chronických. K převratné léčbě dyslipidémií dochází objevem inhibice PCSK9, jejichž molekuly se postupně dostávají do praxe. Co se týče budoucnosti, výzkum bude jistě zaměřen na detekci časných forem aterosklerotického postižení koronárního řečiště.
Jedná se o skupinu chorob vznikající na podkladě onemocnění koronárních tepen, jimž je společná ischemie (tj. nepoměr mezi potřebou a dodávkou kyslíku). Ve více jak 90 % vzniká na podkladě koronární aterosklerózy, vzácněji pak ischemickou chorobu srdeční (ICHS) způsobují embolie do věnčitých tepen, disekce aorty se šířením na koronární tepny, koronární arteritidy (polyarteritis nodosa, Kawasakiho nemoc), či vrozené malformace věnčitých tepen.
KLASIFIKACE ICHS
ICHS klasicky dělíme do dvou hlavních skupin, a to do formy akutní, kam zařazujeme jednotku akutní koronární syndrom, a do formy chronické, kam patří chronická angina pectoris (AP), vasospastická AP, mikrovaskulární AP, němá ischemie a stavy po infarktu myokardu (IM). (1)
Akutní koronární syndrom
Akutní koronární syndrom (AKS) definujeme jako soubor klinických symptomů, které vznikají v důsledku akutní ischemie myokardu, nejčastěji na podkladě aterosklerózy. Do AKS klasicky spadají dvě formy - akutní IM a nestabilní anginu pectoris (NAP), nicméně toto rozdělení se vlivem zavedení laboratorních stanovení vysoce senzitivních troponinů posunulo. T.č. je nestabilní AP přiřazována k jednotce tzv. NSTEMI, protože mají stejné terapeutické postupy. Příčina AKS je ruptura nestabilního aterosklerotického plátu v koronární arterii a nasedající intraluminální trombóza. Trombus způsobí progresi stenózy věnčité tepny, či její okluzi. Rozdíl v IM, či NAP je, zda dojde, či nedojde k nekróze myokardu. Ta je typická právě pro IM a projevuje se vyplavením některých molekul z postiženého myokardu do krve, kde je s výhodou můžeme stanovit (1,2).
Definice infarktu myokardu se opírá o: průkaz nekrózy myokardu, tj. elevaci troponinu, a minimálně jedné známky ischemie myokardu: 1) ischemické symptomy, 2) EKG změny (ST-T denivelace, blokáda levého Tawarova raménka, tzv. Q-kmity), 3) nově vzniklé regionální poruchy kinetiky (1).
Diagnostika
Diagnostika AIM představuje kardiologickou urgenci. Zde se opíráme o anamnestický údaj typické stenokardie (plošná, svíravá, tlaková, pálivá, často s iradiací do levého ramene/levé paže/krku, doba trvání alespoň 20 minut), ale i méně typické jako dušnost, nauzea/zvracení, palpitace, synkopa, dále zjišťujeme rizikové faktory aterosklerózy (rodinná anamnéza, nikotinismus, arteriální hypertenze, dyslipidémie, neméně důležitý je údaj o předchozím kardiovaskulárním onemocnění, aterosklerotickém postižení jiných lokalit a diabetes mellitus). Z farmakologické anamnézy nás zajímá užívání chronické antiagregační či antikoagulační terapie. Hodnotná je v praxi informace o alergii (vzhledem k podávané jodové kontrastní látce během selektivní koronarografie, SKG). Klinicky se (kromě obligátního zjištění stavu vědomí, srdečního rytmu, hodnoty krevního tlaku), zaměřujeme na známky srdečního selhání (zejména levostranného), v praxi používáme stupnici dle Killipa (Killip I - bez známek srdečního selhání, II – auskultačně přítomné chrůpky nad bazemi plic, III – plicní edém, IV - kardiogenní šok), dále se poslechově soustředíme na šelest, který by mohl značit akutní mitrální regurgitaci (při ruptuře nekrotického papilárního svalu) nebo rupturu interventrikulárního septa, patřící do mechanických komplikací IM. Samozřejmá je monitorace EKG, která nám slouží k detekci arytmických komplikací (1-4).
Stran laboratorní diagnostiky IM se dříve používalo vícero kardiálních enzymů. Laboratorně se stanoval myoglobin, který se do plasmy vyplavuje 2 hod od začátku IM, jedná se však o nespecifický marker pro myokard, je přítomen i v kosterních svalech. Dále se určovala kreatinkináza (izoenzym CK-MB) stoupající 2-4 hod od vzniku akutního IM, která je však v menší míře přítomna i v kosterní svalovině, a konečně troponin T a I, což jsou kardiospecifické enzymy (cTn), tzv. markery nekrózy myokardu (tedy nejen ischemického původu). Již několik let máme k dispozici laboratorní diagnostiku tzv. high-senzitive troponinů, které z diagnostiky IM vytlačily dříve používané biomarkery. Vysoce senzitivní stanovení ve srovnání se standardním stanovením srdečního troponinu jeví tyto charakteristiky: má vyšší negativní prediktivní hodnotu pro akutní IM; zkracuje „troponin-slepý“ interval, což vede k časnější detekci akutního IM a odpovídajícímu úbytku diagnózy nestabilní anginy; a je spojeno s dvojnásobným nárůstem detekce IM 2. typu (viz níže) (1,2).
Naprosto zásadní při diagnostice IM je 12-svodové EKG. Podle přítomnosti ST elevací rozlišujeme dvě skupiny akutního IM, s přítomností ST elevací mluvíme o tzv. STEMI, bez ST elevací tzv. non-STEMI. Toto rozdělení je důležité kvůli odlišným terapeutickým postupům. Morfologickým substrátem STEMI je uzávěr větší koronární tepny, při jejím včasném nezprůchodnění dochází k transmurálnímu postižení stěny myokardu. V případě NSTEMI se jedná „pouze“ o subendokardální postižení. Tzv. Q-infarkt je charakterizován přítomností Q-kmitů na EKG, v pre-reperfuzní éře do Q-infaktů dospěla většina STEMI, v době primární perkutánní koronární intervence (PCI) k nim dospějí pouze některé STEMI (1,3,4).
U pacientů se STEMI je indikována strategie primární PCI, tzn. emergentní koronarografie a PCI na infarktové tepně, maximální časová prodleva od stanovení diagnózy do primární PCI (zavedení vodiče) by měla být kratší než 120 min (2).
Pacienti se STEMI podstupující primární PCI by měli být léčeni duální protidestičkovou léčbou (dual antiplatelet therapy, DAPT), tj. kombinace kyseliny acetylsalicylové (ASA) a inhibitoru receptoru P2Y12 spolu s parenterálně podávaným antikoagulanciem co nejdříve od stanovení diagnózy. Mezi preferované inhibitory P2Y12 dle současných doporučení patří prasugrel a ticagrelor, a to kvůli rychlému nástupu účinku a významnému ovlivnění mortality. Pokud nejsou k dispozici (nebo pokud jsou kontraindikovany), alternativa k nim je podání clopidogrelu. Mezi možná antikoagulancia při primární PCI patří nefrakcionovaný heparin, event. enoxaparin a bivalirudin. Podání fibrinolytické léčby se doporučuje zahájit do 12 hodin od nástupu symptomů v případech, kdy nelze provést primární PCI do 120 min od stanovení diagnózy STEMI, což je v našich podmínkách dostupnosti PCI center zcela raritní situace (4).
U pacientů se STEMI se rutinně doporučuje okamžité zahájení monitorace a hospitalizace na koronární jednotce po dobu min 24 hodin, delší doba monitorace by měla být zvážena u pacientů s hemodynamickou nestabilitou, závažnými arytmiemi, hodnotou ejekční frakce levé komory menší než 40 %, neúspěšnou reperfuzí, dalšími kritickými stenózami velkých koronárních tepen nebo komplikacemi v souvislosti s PCI. Zahájení rehabilitace je individuální, nemocní bez komplikací mohou začít s chůzí u lůžka již 2. den. Během hospitalizace provádíme rutinně echokardiografické vyšetření ke stanovení funkce komor, mechanických komplikací a vyloučení přítomnosti trombu v levé komoře (3,4).
Co se týče dlouhodobé léčby po STEMI je jednoznačně doporučována úpravy životosprávy, mezi které patří zanechání kouření, kontrola krevního tlaku, úprava stravování, kontrola tělesné hmotnosti a vyšší fyzická aktivita. Ve farmakologické intervenci je indikováno užívání DAPT po dobu 12 měsíců od PCI, dále ASA v monoterapii trvale. Z dalších medikamentů se jedná o hypolipidemickou léčbu, léky první volby jsou statiny ve vysokých dávkách. Do léčby AKS standardně patří užívání beta-blokátorů, inhibitory angiotensin konvertujícího enzymu, při jejich netoleranci blokátory receptoru AT1 pro angiotensin II. Léčba antagonisty mineralokortikoidních receptorů se doporučuje u pacientů s ejekční frakcí levé komory pod 40 % (4).
V roce 2017 vydala Česká kardiologická společnost (ČKS) nová doporučení stran léčby AKS s ST elevacemi, tím došlo k aktualizaci pět let starých doporučených postupů. Z vybraných můžeme zmínit preference radiálního přístupu k PCI u lékařů mající zkušenosti s touto technikou a použití lékových stentů (DES, drug eluting stent) oproti stentům kovovým (BMS, bare metal stent). Dále se do strategie léčby, která by měla být zvážena, dostala kompletní revaskularizace, a to buď během primární PCI, či časná v průběhu hospitalizace (s postižením více koronárních arterií se lze u pacientů se STEMI setkat cca v 50 %). Došlo ke zkrácení doporučené délky hospitalice, nyní je možné zvážit dimisi 48–72 hod po přijetí oproti dřívějším 72 hodinám. Nově se posunula hranicie použití léčebného kyslíku, nyní je oxygenoterapie indikovaná při poklesu saturace hemoglobinu kyslíkem arteriální krve až pod 90 %, oproti dřívějším 95 %. V nových doporučení se odrazily i výsledky i několika studií, které byly zaměřeny na koncentrace LDL cholesterolu v souvislosti s výskytem KV rizika a jejichž výsledek by se dal simplifikovat do téze „čím méně, tím lépe“, a tedy výrazně podporují další snižování koncentrace LDL cholesterolu. Pokud je tedy LDL při maximální tolerované dávce statinu vyšší než 1,8 mmol/l, mělo by se do kombinace přidat další hypolipidemikum. V klinické praxi se často můžeme setkat s pacienty, kteří mají blokádu levého raménka Tawarova, pokud je nově vzniklá či nejasného stáří a u pacienta jsou přítomny příznaky ischemie, jedná se o ekvivalent STEMI. Ostatní doporučení viz obr. 1 (4).
Obr. 1. Co je nového v doporučených postupech pro léčbu STEMI z roku 2017? 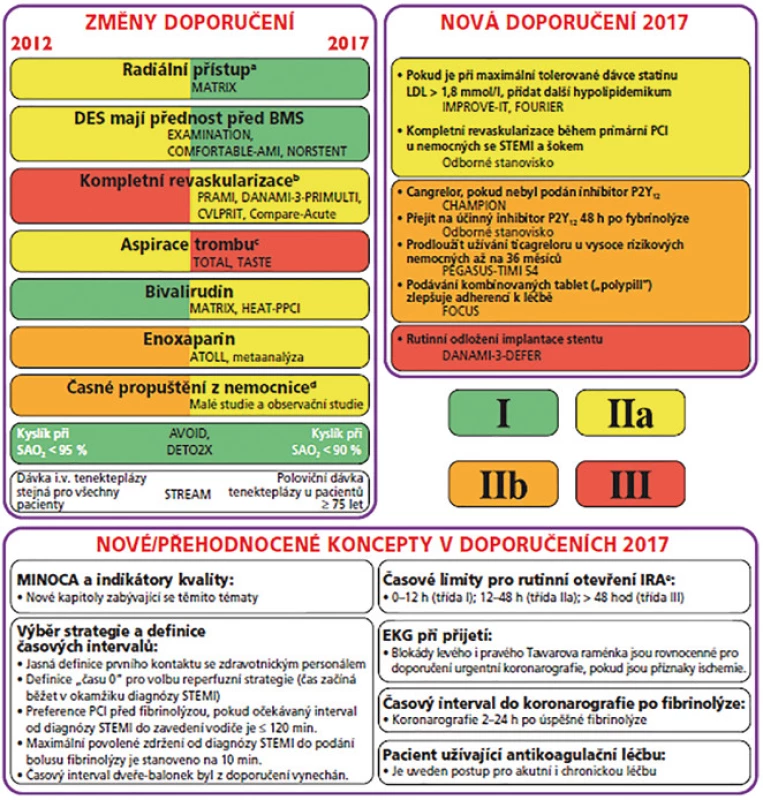
BMS – kovový stent; DES – lékový stent; EKG – elektrokardiogram; IRA – infarktová tepna; LDL – lipoproteiny nízké denzity; PCI – perkutánní koronární intervence; SaO2 – saturace hemoglobinu kyslíkem v arteriální krvi, STEMI – infarkt myokardu s elevací úseku ST
a Pouze pro lékaře mající zkušenost s radiálním přístupem.
b Před propuštěním z nemocnice (buď okamžitá, nebo postupná).
c Rutinní aspirace trombu (záchranná strategie v určitých případech).
d V doporučeních 2012 časné propuštění zvážit po 72 h, v doporučeních 2017 časné propuštění zvážit 48-72 h po přijetí.
e Pokud jsou přítomny známky hemodynamické nestability, IRA by měla být otevřena bez ohledu na dobu od začátku příznaků.Do druhé skupiny – NSTEMI patří pacienti s bolestí na hrudi bez perzistujících elevací úseku ST (non-STE AKS). EKG změny v této skupině mohou zahrnovat přechodné elevace úseku ST (STE), perzistující nebo přechodné deprese úseku ST, inverze vln T, pseudonormalizace vln T, ploché vlny T nebo může být dokonce EKG křivka normální. Klinické spektrum non-STE AKS sahá od asymptomatických pacientů až po jedince se srdeční zástavou. Patologickým korelátem je nekróza kardiomyocytů (infarkt myokardu bez elevací úseku ST) nebo méně často ischemie myokardu bez ztráty buněk (nestabilní angina). Zavedení vysoce senzitivních metod stanovení srdečního troponinu u pacientů s podezřením na non-STE AKS zvýšilo detekci IM a naopak snížilo četnost diagnózy nestabilní anginy pectoris. NSTEMI můžeme očekávat většinou u starších nemocných, s anamnézou chronické ICHS, polymorbidních pacientů, diabetiků či osob s chronickou renální insuficiencí, což jsou důvody, kvůli kterým ve vyspělých zemích diagnóza NSTEMI mírně stoupá (2).
V roce 2016 byla publikována nová doporučení od ČKS pro léčbu AKS bez ST elevací, která reflektují doporučení Evropské kardiologické společnosti vydané o rok dříve. Jsou zde definovány klinické situace, které nám pomohou rozhodnout se v načasování revaskularizace. K dispozici máme skórovací systémy, např. GRACE 2.0 kalkulátor (www.gracescore.org, k dispozici je i mobilní aplikace), které nám pacienty stratifikují dle kritérií do velmi vysokého rizika, vysokého, středního a nízkého, dle nich indikujeme SKG okamžitou (v případě pokračující ischemie, nebo při hemodynamické nestabilitě, tj. < 2 hod od přijetí k hospitalizaci, analogická léčbě STEMI), časnou - do 24 hodin od přijetí do nemocnice; u nejméně rizikových pacientů postačí do 72 hod. Stejně jako u STEMI je preferován radiální přístup. V nových guidelinech nově nenajdeme doporučení k zahájení léčby inhibitory P2Y12 co nejdříve od stanovení diagnózy bez ohledu na zvolený léčebný postup. Poprvé je zmiňována možnost podání cangreloru – tj. první parenterálně podávaný inhibitor receptoru P2Y12. Dále zde můžeme najít potřebné informace ohledně terapeutických postupů u pacientů s jednotlivými komorbiditami, např. pacientů vyžadující dlouhodobou antikoagulační léčbu (individualizována dle rizika krvácení), diabetiků či pacientů s renální insuficiencí (2,5).
Na základě patologických, klinických a prognostických odlišností dle třetí univerzální definice IM z roku 2013 lze IM dělit na 5 typů:
- IM 1.typu, tedy IM spontánního typu. Jedná se o příhodu související s rupturou, ulcerací, fisurací, erozí nebo disekcí aterosklerotického plátu a následným vznikem intraluminálního trombu v jedné nebo více koronárních tepnách.
- O IM 2. typu mluvíme tehdy, když ischemická choroba srdce není příčinou hypoxie myokardu. Stavy, které vedou k IM 2. typu jsou např. koronární spasmus, embolizace do koronární tepny, hypertenze, hypotenze, anemie, septické stavy, brady - či tachyarytmie.
- Srdeční smrt v důsledku infarktu myokardu nazýváme IM typu 3. Jedná se o případy, kdy pacienti podléhající srdeční smrti mají příznaky svědčícími pro možnou myokardiální ischémii a předpokládanými novými ischemickými změnami na EKG nebo nově vzniklou blokádou levého Tawarova raménka (ovšem bez dostupných hodnot biomarkerů).
- Infarkt myokardu spojený s revaskularizačními procedurami je případ IM typů 4 a 5. K periprocedurálnímu poškození či infarktu myokardu s elevací hodnot cTn může dojít během mechanických revaskularizačních zákroků, ať již PCI (4. typu, trombóza stentu či restenóza), nebo při našití aortokoronárního bypassu (5. typu) (6).
Chronická ICHS
Poslední doporučení ohledně chronické ICHS jsou ČKS publikovány v r. 2014 (7).
Stabilní angina pectoris
Angina pectoris, neboli stenokardie je pojem, kterým se nazývá bolest vznikající jako reakce na ischemii myokardu. Dochází-li k aterosklerotickým změnám pomaleji při postupném narůstání plátu bez ruptury, dochází k tzv. námahové AP. Morfologickým podkladem jsou většinou hemodynamicky významné stenózy, tj. na 70% zúžení, nebo chronické uzávěry tepen s kolaterálním oběhem. Jak vyplývá z názvu, stenokardie jsou přítomny při námaze (fyzické i psychické spojené s vyšší aktivitou sympatického nervového systému), kdy jsou zvýšeny metabolické nároky myokardu. Stenokardie se objevují při fyzické aktivitě, po uvedení do klidu či po aplikace nitroglycerinu by měly ustávat do 5 minut. Bolest trvající déle než 15 minut a neustávající po nitroglycerinu je již suspektní z akutního koronárního syndromu (1).
Vasospastická (Prinzmetalova) angina pectoris
Tento druh AP je také charakterizován intermitentní ischemií myokardu (typicky vznikající v noci nad ránem, při námaze se většinou neobjevuje), příčina ischemie je však odlišná, jedná se o spasmy věnčitých tepen. Etiologie je neznámá, pravděpodobně se jedná o důsledek endoteliální dysfunkce. Ve vzácných případech může způsobit nekrózu myokardu. Na EKG při bolesti jsou přítomny ST elevace. Na koronárních tepnách nacházíme většinou normální nález (event. hemodynamicky nevýznamné změny při kombinaci jednotlivých AP), někdy lze detekovat spasmus tepny, který reaguje na aplikace nitroglycerinu. U této formy intervenujeme pouze farmakologicky, a to podáváním blokátorů kalciových kanálů a nitrátů (1).
Mikrovaskulární angina pectoris
Tuto diagnózu stanovujeme pacientům, u kterých se vyskytují typické stenokardie, ale mají normální koronarogram na velkých tepnách. U těchto pacientů předpokládáme postižení tepen menšího kalibru (1).
Němá ischemie
Ischemie bez doprovázených typických bolestí se objevují zejména u diabetiků s neuropatií (u nich musíme myslet i na tzv. ekvivalenty stenokardií, tj. nejčastěji dušnost), jindy se může vyskytnout u nediabetiků v případě nedostatečné hloubce ischemie nebo zvýšeným prahem bolesti (1).
Anginozní potíže můžeme hodnotit dle klasifikace CCS – Canadian Cardiology Society, jedná se o jakýsi ekvivalent symptomatologie u pacientů se srd. selháním se stupnicí NYHA (New York Heart Asssociation). U pacientů ve funkční třídě CCS I jsou stenokardie přítomny pouze při mimořádně velké námaze, v třídě CCS II jsou stenokardie přítomny při větší, ale v běžném životě obvyklé námaze, v CCS III se objevují stenokardie při malé námaze a ve třídě CCS IV je angina přítomna i v klidu (1,7).
Diagnostika anginy pectoris
U pacientů ve funkční třídě CCS III-IV indikujeme rovnou SKG. V případě nižšího stupně nejprve volíme zátěžové vyšetření, dle výsledku se dále rozhodujeme o doplnění SKG. Ze zátěžových vyšetření využíváme zátěžovou ergometrii s monitorací EKG k detekci ischemických změn. U osob s abnormalitami EKG (např. blokádou levého Tawarova raménka), které nedovolují posouzení křivky při zátěžovém EKG, nebo při známém angiografickém obraze před event. revaskularizací, kdy jsou pochybnosti o funkčním významu stenózy, provádíme vyšetření pomocí perfúzní izotopové scintigrafie. Problémem zátěžových testů je jejich nedostatečná senzitivita i specificita (1,7).
Léčba anginy pectoris
V léčbě využíváme revaskularizační metody i metody farmakologické, které spolu jdou ruku v ruce.
Z revaskularizačních metod se rozhodujeme dle postižení koronárních tepen mezi chirurgickým překlenutím stenotického či okludovaného úseku věnčité tepny, tedy našitím bypassu (ACB), či katetrizační zavedením stentu, tj. PCI. V případě bypassu je možné použít žílu dolních končetin (vena saphena magna či parva) nebo tepnu, nečastěji arteria mammaria interna. Delší „životnost“ mají bypassy tepenné, které jsou po 10 letech průchodné v 90-95 %, žilní jen v 50-60 %. Obě metody mají velkou úspěšnost v odstranění anginózních potíží, bylo však prokázáno, že v případě PCI dochází častěji k recidivám stenokardií a nutnosti dalších revaskularizací. Dále byl dokázán nesignifikantní rozdíl v ovlivnění mortality u obou metod, s výjimkou pacientů s vyššími riziky. Obecně platí, že ACB je doporučen u pacientů s prognosticky závažným nálezem, u zhoršené funkce levé komory, u diabetiků a pacientů s renální insuficiencí. V katetrizační léčbě byl nejprve využíván postup bez použití stentu tzv. perkutánní koronární angioplastiky, kvůli vysokému riziku restenózy se později do míst intervence začal zavádět stent. Stenty se dříve aplikovaly kovové (BMS – bare metal stent), u nichž docházelo taktéž k relativně častým restenózám díky růstu svalových buněk přes kovový materiál. Proto byly do praxe zavedeny stenty uvolňující cytostatika (DES – drug eluting stent), u nichž je výskyt restenózy o polovinu menší, na stranu druhou brání tvorbě endotelu na povrchu stentu a je tak u nich naopak vyšší riziko trombózy. Z tohoto důvodu je podávána DAPT u DES na minimálně 6 měsíců. V případě BMS je doporučeno dávat DAPT na 1 měsíc (1,7).
Farmaka, které využíváme v terapii chronické ICHS, rozdělujeme do těch zlepšující prognózu a do léků symptomatických. Do první skupiny zařazujeme protidestičkové léky, statiny, betablokátory a ACEi/AT1 blokátory. Do léků zmírňujících symptomy řadíme nitráty, blokátory kalciových kanálů, léky ovlivňující metabolismus myokardu (trimetazidin) (1,7).
Pokud nejsou přítomny kontraindikace, léky ovlivňující prognózu zařazujeme do chronické farmakoterapie vždy, symptomatické léky se snažíme konkrétnímu pacientovi ušít na míru. Vzhledem k tomu, že v současnosti v této oblasti není na obzoru vývoj nových léčiv, je snaha vytvořit léčebná schémata, např. v r. 2018 uvedená Diamantová cesta léčby anginy pectoris, v které si dle klinické situace můžeme vyhledat doporučené postupy u konkrétního pacienta. Samozřejmostí jsou režimová opatření. Při edukaci pacientů využíváme tabulek, např. skórovací systém SCORE (1,7).
NOVINKY V LÉČBĚ DYSLIPIDÉMIE
Panuje všeobecná shoda, že koncentrace LDL cholesterolu určuje míru rizika ICHS a stává se tak terapeutickým cílem. Někdy se ani kombinací klasicky užívaných hypolipidemik nedaří snížit LDL cholesterolu na potřebné hodnoty. Nadějí může být recentně do klinické praxe uvedené inhibitory proprotein konvertáz subtilisin-kexinu 9 (PCSK9). Tento protein byl objeven v r. 2003 a v důsledku jeho blokády se zvyšuje počet recirkulujích receptorů na povrchu hepatocytu, což vede k poklesu LDL cholesterolu a dalších aterogenních lipidů o 50-70 % navíc k zavedené hypolipidemické terapii. Jedním z prvních dostupných humánních monoklonálnich protilátek je evolocumab. Od r. 2018 je hrazen z veřejného zdravotního pojištění i v ČR v indikacích primární hypecholesterolémie či smíšené dyslipidémie, a to ve dvou konkrétních případech:
- V kombinaci s vysoce intenzivní hypolipidemickou terapií u pacientů s heterozygotní familiární hypercholesterolémií s koncentrací LDL cholesterolu ≥ 4 mmol/l navzdory vysoce intenzivní hypolipidemické léčbě.
- V kombinaci s vysoce intenzivní hypolipidemickou terapií u pacientů ve velmi vysokém kardiovaskulárním riziku s manifestním kardiovaskulárním onemocněním a s koncentrací LDL cholesterolu ≥ 3,0 mmol/l navzdory vysoce intenzivní hypolipidemické léčbě (9,10).
BUDOUCNOST
Co se týče diagnostiky ICHS, je snaha odhalovat časné fáze ICHS, abychom mohli co nejdříve terapeuticky zasáhnout. S ohledem na doposud známou patogenezi aterosklerózy jsou studovány některé laboratorní markery, které by mohly odhadnout rizika či přítomnost aterosklerotických změn. Relativně běžně se používá stanovení (mikro)albuminurie u pacientů s hypertenzí či diabetem, která značí mikrovaskulární komplikace. Ostatní laboratorní parametry se běžně v praxi zatím nestanovují, velké naděje se vkládají do C-reaktivního proteinu měřeného vysoce senzitivní metodou (hs-CRP). V ranku laboratoří jsou i ostatní zánětlivé markery, např. interleukin-6. Jejich nevýhodou je jistě nízká specificita, neboť se z podstaty věci zvyšují i při dalších zánětlivých onemocnění (11).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Kateřina Bouzková
Klinika kardiologie
Kardiocentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
email: bouk@ikem.cz
Zdroje
1. Staněk V. Kardiologie v praxi (1. edice). Praha: Axonite; 2014 : 112-160.
2. Widimský P, Rokyta R, Hlinomaz O. Summary of the 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Prepared by the Czech Society of Cardiology. Cor Vasa 2016; 58(1): e4-e28.
3. Kettner J., Kautzner J. Akutní kardiologie (2. edice). Praha: Mladá fronta; 2017.
4. Kala P, Mates M, Želízko M, Rokyta R, Ošťádal P. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Summary of the document prepared by the Czech Society of Cardiology. Cor Vasa 2017; 59(6): e613-e644.
5. Táborský M, Kaoutzner J, Moťovská Z et al. Novinky v kardiologii 2016 (2. edice). Praha: Mladá fronta; 2016 : 20-27.
6. Vojáček J, Janský P, Janota T. Third universal definition of myocardial infarction. Cor Vasa 2013; 55(3): e228-e235.
7. Želízko M, Toušek F, Skalická H. Summary of the 2013 ESC guidelines on the management of stable coronary artery disease: Prepared by the Czech Society of Cardiology. Cor Vasa 2014; 56(3): e259-e273.
8. Srbová E. ESC 2018 „Diamantová cesta“ – moderní přístup v léčbě anginy pectoris. Kardiol Rev Int Med 2018, 20(3): 238-241.
9. Vrablík M. Evolocumab – protilátka proti PCSK9 s mohutným hypolipidemických účinkem. Kardiol Rev Int Med 2015, 17(4): 362-366.
10. Čillíková K. Podmínky úhrady inhibitorů PCSK9 v ČR – aktuální stav. Kardiol Rev Int Med 2018, 20(3): 224-225.
11. Piťha J. Detekce časných stadií aterosklerózy. Interní Med 2016; 18(1): 9–13.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek PŘEDSTAVUJEME NOVÉ EDITORYČlánek Jessenius o srdci
Článok vyšiel v časopiseČesko-slovenská patologie

2020 Číslo 1-
Všetky články tohto čísla
- Deset let redakční práce a změny do budoucna
- PŘEDSTAVUJEME NOVÉ EDITORY
- Monitor aneb nemělo by Vám uniknout, že...
- Prof. MUDr. Zdeňka Vernerová, CSc.
- Novinky v klinické diagnostice ischemické choroby srdeční a aktuální doporučené terapeutické postupy
- Diferenciální diagnostika tumorózních lézí srdce
- Aktuální nomenklatura a histopatologická kritéria pro hodnocení nezánětlivých degenerativních onemocnění aorty
- Echinococcus multilocularis: Diagnostický problém v punkční biopsii jater - kazuistika
- A rare subtype of papillary kidney tumors (case report)
- Úloha patologa v chirurgickém stagingu karcinomu děložního hrdla
- Rosai and Ackerman’s Surgical Pathology
- Prof. Dr. Leo Taussig - zapomenutý průkopník komplexní cytologie mozkomíšního moku
- Jessenius o srdci
- Spomienka na prof. MUDr. Štefana Kopeckého, PhD.
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diferenciální diagnostika tumorózních lézí srdce
- PŘEDSTAVUJEME NOVÉ EDITORY
- Echinococcus multilocularis: Diagnostický problém v punkční biopsii jater - kazuistika
- Novinky v klinické diagnostice ischemické choroby srdeční a aktuální doporučené terapeutické postupy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



