-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky v páté verzi WHO klasifikace nádorů trávicího systému – 1. Gastrointestinální trakt
Comments on the 5th edition of WHO classification of digestive system tumors – Part 1. Gastrointestinal tract
The new 2019 WHO classification of digestive system tumors reflects some important advancements in our understanding of etiopathogenesis and molecular background of selected neoplastic diseases of the gastrointestinal tract, offers more integrated review of non-epithelial neoplasms and updates the spectrum of genetic tumor syndromes of the digestive system. Recently recognized conditions, such as gastroblastoma and “gastric adenocarcinoma and proximal polyposis of the stomach” are described, including molecular alterations associated with these entities. On the other hand, the new interpretation of some topics, mainly grading of serrated lesions or ICD-O coding of adenomas and dysplasia, is rather controversial. Last but not least, the definition of pTis in the large intestine according to WHO conflicts its definition according to AJCC/UICC TNM classification, 8th edition, issued in 2017.
Keywords:
Gastrointestinal tract – Digestive system – tumors – WHO classification
Autori: Ondřej Daum 1,2
; Magdaléna Daumová 1,2; Marián Švajdler 1,2
Pôsobisko autorov: Šiklův ústav patologie LF UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 4, p. 194-206
Kategória: Přehledový článek
Súhrn
Nové vydání WHO klasifikace nádorů trávicího systému z roku 2019 přináší některé novinky týkající se molekulárně genetického podkladu vybraných nádorových onemocnění a jejich etiopatogeneze, ucelenější pohled na neepitelové nádory gastrointestinálního traktu a rozšíření spektra genetických nádorových syndromů. Nově popisuje gastroblastom a „syndrom žaludečního adenokarcinomu a proximální polypózy žaludku“ včetně molekulárních alterací asociovaných s těmito jednotkami. Na druhou stranu jsou některá témata, jako třeba grading serrated (pilovitých) lézí nebo onkologické kódování adenomů a dysplázií, zpracována diskutabilně až kontroverzně. Za vyloženě nešťastný lze považovat rozpor v definici pTis kolorektálního karcinomu podle WHO a podle 8. vydání TNM klasifikace AJCC/UICC, zejména v podmínkách ČR, kde se součástí povinného hlášení novotvarů do Národního onkologického registru stane i hlášení adenomů tlustého střeva.
Klíčová slova:
gastrointestinální trakt – trávicí systém – nádory – WHO klasifikace
V roce 2019 vyšlo nové (5.) vydání WHO klasifikace nádorů trávicího systému. Vzhledem k tomu, že předchozí edice vyšla již v roce 2010 a že vydání nové se oproti původnímu plánu opozdilo přibližně o dva roky, byla finální verze nových (dosud pečlivě utajovaných) mezinárodních standardů očekávána se značným napětím. Nicméně dnes již můžeme říci, že očekávání naplněna nebyla. Pravda, na první pohled nová „modrá kniha“ vypadá slibně – je téměř dvakrát tlustší než předešlá a obsahuje poměrně mnoho nových molekulárně biologických poznatků – ale některé klíčové otázky neřeší, případně je řeší poněkud diskutabilně (1).
Nejvýraznější formální změnou v nové WHO klasifikaci je omezení anatomicky specifických kapitol na epitelové nádory (včetně neuroendokrinních), zatímco nádory ostatní (hematolymfoidní, mezenchymové a „jiné“) jsou pojednány ve vlastních samostatných kapitolách, podobně jako genetické nádorové syndromy s projevy v GIT.
Pokud jde o nedostatky publikace, již zde lze zmínit úvodní kapitolu, v níž je konkrétně řečeno, že byla standardizována terminologie prekurzorových lézí (ve skutečnosti se jedná o léze premaligní) invazivního karcinomu, a to tak že termín „dysplázie“ je preferován v (tubulárním) gastrointestinálním traktu, zatímco termín „intraepiteliální neoplázie“ v pankreatobiliárním systému. Bohužel tomu tak v následujících, etážově-specifických, kapitolách není. Například v jícnu je pro dlaždicobuněčné léze preferován termín „intraepiteliální neoplázie“, podobně jako je tomu v kolorektu pro „glandulární intraepiteliální neoplázie asociované s IBD“. Naštěstí autoři na uvedené standardizaci netrvají a uvádějí, že akceptovatelné jsou obě terminologické formy. Vyloženě frustrující je také nedostatečná koordinace přístupu autorských kolektivů jednotlivých etážově specifických kapitol, což vedlo například k tomu, že „medulární karcinom“ se v (téměř) každé části trávicího traktu jmenuje jinak.
SEZNAM POUŽITÝCH ZKRATEK
AFP: alfa-fetoprotein
AJCC: American Joint Committee on Cancer
ASIN: anální skvamózní intraepiteliální neoplázie
CCS: světlobuněčný sarkom (clear cell sarcoma)
CMMRD: syndrom konstitučního deficitu mismatch repair systému (constitutional mismatch repair deficiency
CRC: kolorektální karcinom (colorectal cancer)
CTNNB1: gen kódující beta catenin
DALM: dysplasia-associated lesion or mass
EBER: Epstein–Barr virus-encoded small RNAs
EBV: virus Epsteina a Barrové (Epstein-Barr virus)
EGFR: receptor pro epidermální růstový faktor (epidermal growth factor receptor)
FAP: familiární adenomatózní polypóza
G1-3: stupně diferenciace 1-3 (grade 1-3)
GAPSS: syndrom žaludečního adenokarcinomu a proximální polypózy žaludku (gastric adenocarcinoma and proximal polyposis of the stomach)
GCT: nádor z granulárních buněk (granular cell tumor)
GIST: gastrointestinální stromální tumor
GNET: maligní gastrointestinální neuroektodermální tumor
HAMN: high grade apendikální mucinózní nádor
HER2: human epidermal growth factor receptor 2
HG: high grade
HSIL: high grade skvamózní intraepiteliální neoplázie
IAPN: intraampulární papilárně-tubulární nádor
IBD: idiopatický střevní zánět (inflammatory bowel disease)
IFP: inflamatorní fibroidní polyp (Vaňkův tumor)
IMT: inflamatorní myofibroblastický tumor
ISH: in situ hybridizace
LAMN: low grade apendikální mucinózní nádor
LAST: terminologie skvamózních lézí dolní anogenitální oblasti (lower anogenital squamous terminology)
LG: low grade
LLS: Lynch-like syndrom
LS: Lynchův syndrom
LSIL: low grade skvamózní intraepiteliální neoplázie
MAP: MUTYH-asociovaná polypóza
MKN-O: Mezinárodní klasifikace nemocí pro onkologii
MMR: mismatch repair
MSI: nestabilita mikrosatelitů (microsatellite instability)
MSS: stabilita mikrosatelitů (microsatellite stability)
MUTYH: gen kódující MutY DNA glycosylázu
NAP: NTHL1-asociovaná polypóza
NOS: blíže nespecifikovaný (not otherwise specified)
NTHL1: gen kódující Nth Like DNA glycosylázu 1
PD-1: receptor „programmed cell death protein 1“
PDGFRA: gen kódující platelet derived growth factor receptor alpha
PD-L1: ligand 1 pro receptor PD-1 (programmed death-ligand 1)
PECom: nádor z perivaskulárních epiteloidních buněk (perivascular epithelioid cells)
PPAP: polymerase proofreading-associated polyposis
PSIN: perianální skvamózní intraepiteliální neoplázie
PTEN: gen kódující Phosphatase And Tensin Homolog
RNF43: gen kódující Ring finger protein 43
SFT: solitární fibrózní tumor
SSL: sesilní serrated léze
SSL-D: sesilní serrated léze s dysplázií
SWI/SNF: SWItch/Sucrose Non-Fermentable
TCGA: Atlas nádorového genomu (The Cancer Genome Atlas)
TSA: tradiční serrated adenom
UICC: Union for International Cancer Control
WHO: Světová zdravotnická organizace (World Health Organization)
NÁDORY JÍCNU
Jak již uvedeno výše, tato kapitola nově pojednává jen o epitelových nádorech. V tomto přehledovém článku se navíc budeme zabývat jenom „klasickými“ epitelovými nádory, zatímco o nádorech neuroendokrinních pojednává samostatný článek.
Nově je do přehledu jednotek zahrnut dlaždicobuněčný (skvamózní) papilom jako jediný zástupce benigních nádorů jícnu. Dále byly (jak jsme již zmiňovali) „premaligní léze“ (zahrnující glandulární dysplázie a skvamózní intraepiteliální neoplázie) přejmenovány na „prekurzory“, pravděpodobně z esteticko-psychologických důvodů podmíněných snadnou dostupností internetových zdrojů široké veřejnosti. Z našeho pohledu však jde o terminologicky problematický manévr, protože tak dochází ke stírání rozdílů mezi původně definovanými premaligními lézemi (progredientními prekancerózami) a prekurzorovými lézemi (stacionárními prekancerózami), které zde představuje především Barrettův jícen. Další nově přidanou jednotkou je karcinom podobný lymfoepiteliomu (lymphoepithelioma-like carcinoma), klasifikovaný jako podtyp nediferencovaného karcinomu (tab. 1).
Tab. 1. Epitelové nádory jícnu. 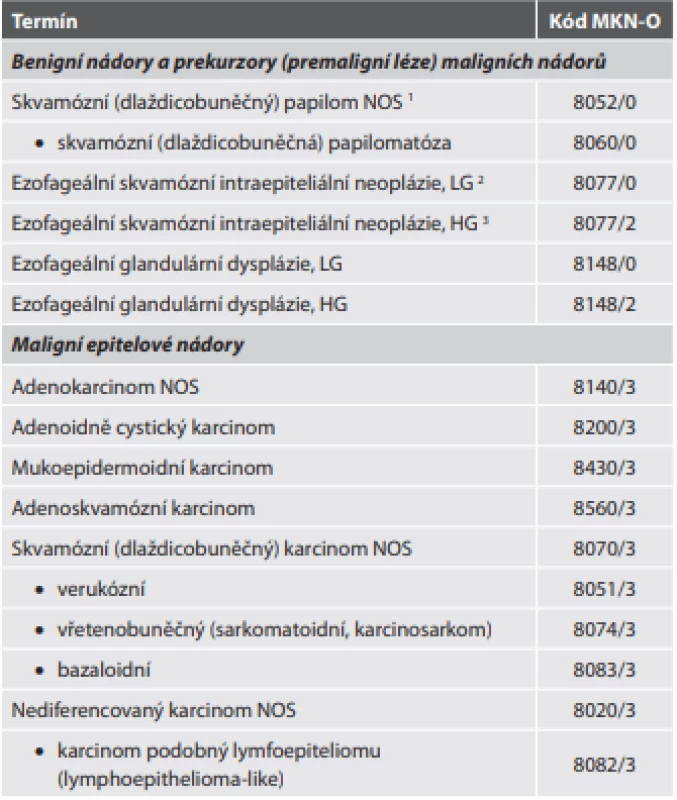
1 NOS – blíže nespecifi kovaný (not otherwise specifi ed)
2 LG – low grade (nízkého stupně)
3 HG – high grade (vysokého stupně)Adenokarcinom NOS prodělal v nové klasifikaci poměrně výrazné změny. Jednak je konečně pod adenokarcinom jícnu řazen i adenokarcinom gastroesofageální junkce, který byl v minulé klasifikaci pojednáván odděleně (a ještě k tomu kódován „žaludečním“ lokalizačním kódem C16.0), jednak je detailněji zpracována problematika prekurzorových (Barrettův jícen) a premaligních (dysplázie) lézí, včetně rozlišení intestinálního a foveolárního typu dysplázie. Problematické je tvrzení, že v evropských zemích není pro diagnózu Barrettova jícnu vyžadována přítomnost pohárkových buněk v metaplastické kolumnární sliznici (protože Evropa neleží ve Velké Británii). Významným počinem je bezpochyby oficiální vyjádření skepse nad účinností antirefluxní terapie v prevenci progrese onkogeneze v Barrettově jícnu (užívání inhibitorů protonové pumpy je spíše asociováno se zvýšením rizika této progrese) a uvedení fundoplikace jako účinnější prevence vzniku adenokacinomu. Grading se doporučuje dvoustupňový, který je ovšem založen na klasickém třístupňovém gradingu: low grade odpovídá G1 (> 95 % nádoru tvoří žlázky) a G2 (žlázky tvoří 50-95 % nádoru), high grade je G3 (< 50 % nádoru je tvořeno žlázkami).
V oblasti dlaždicobuněčného karcinomu (ať již NOS nebo jeho variant) nedoznala nová WHO klasifikace podstatných změn. Na rozdíl od adenokarcinomu je v případě skvamózního karcinomu zachován třístupňový grading, který je také zařazen mezi parametry patologických prognostických skupin dlaždicobuněčného karcinomu jícnu (2,3).
Nediferencovaný karcinom je nově klasifikován jako samostatný typ nádoru (v předchozí klasifikaci byl zařazen spíše pod grade 4 dlaždicobuněčný karcinom). Jeho podtypem je karcinom podobný lymfoepiteliomu, jehož asociace s EBV není tak signifikantní jako v morfologicky obdobných nádorech hlavy a krku.
Stagingové systémy jsou vypracovány odlišně pro dlaždicobuněčný karcinom a adenokarcinom NOS. Pro adenoidně cystický karcinom se doporučuje užívat systém pro adenokarcinom, u adenoskvamózního a mukoepidermoidního karcinomu není doporučení uvedeno, stage nediferencovaného karcinomu má být hodnocen jako stage dlaždicobuněčného karcinomu.
NÁDORY ŽALUDKU
Nejrozsáhlejší změny v klasifikaci epitelových nádorových lézí žaludku se oproti minulému vydání odehrály v kategorii prekurzorů (premaligních lézí) adenokarcinomu. Sice zůstalo základní rozdělení na (polypoidní) adenomy a (nepolypoidní) dysplázie (intraepiteliální neoplázie), další subklasifikace je však už poněkud komplikovaná a v původní tabelární formě dokonce zmatečná. Dovolujeme si tedy představit mírně upravenou tabelární formu a problematice prekurzorů věnujeme zvláštní podkapitolu (tab. 2).
Tab. 2. Prekurzory (premaligní léze) adenokarcinomu žaludku. 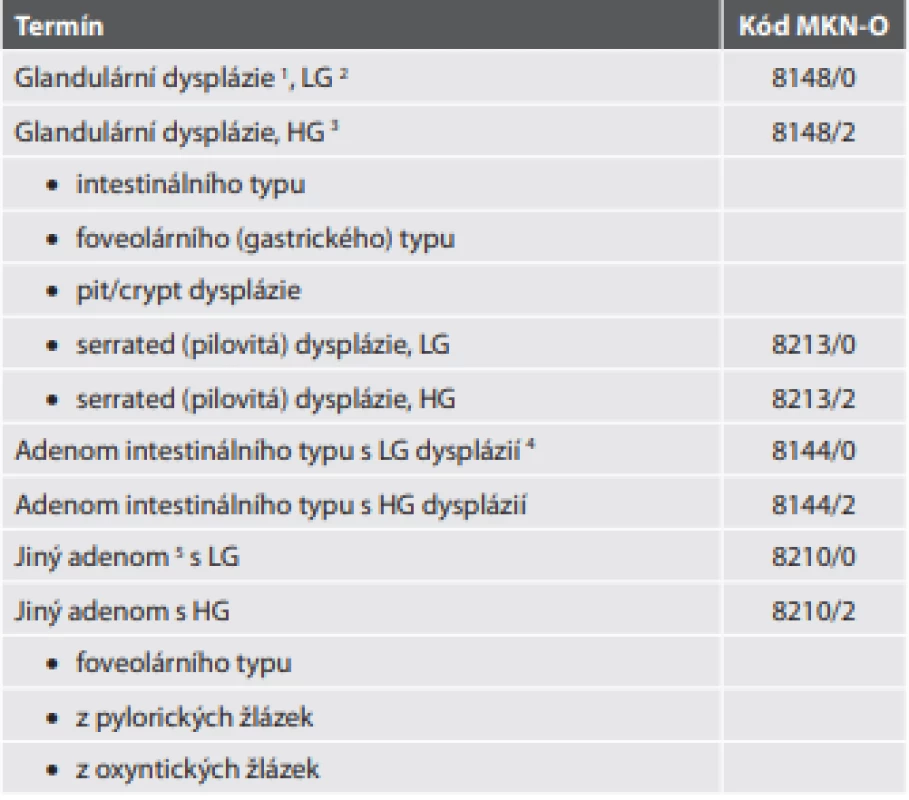
1 V originální verzi se používá termín „glandulární intraepiteliální neoplázie“,ale protože pojem „dysplázie“ je synonymní, v obecném úvodu pro tubulární GIT preferovaný a dokonce v textové části uváděný na prvním místě, volíme i z prostorově úsporných důvodu tuto verzi.
2 LG – low grade (nízkého stupně)
3 HG – high grade (vysokého stupně)
4 Originální verze užívá termín „low grade (nebo high grade) adenom“, v našem prostředí nám však připadá vhodnější extendovaná verze.
5 V původní tabulce uveden jako „adenomatózní polyp“, což je však pojem, jenž byl v ČR po desetiletí usilovně mýcen a nepřipadá nám vhodné se k němu vracet. Námi navržená národně specifi cká forma navíc vyjadřuje fakt, že nejde o „jakýkoli adenomatózní polyp“, ale o typy adenomu odlišné od intestinálního typu.Prekurzory (premaligní léze) adenokarcinomu žaludku
Dysplázie (nebo glandulární intraepiteliální neoplázie) je termín užívaný pro nepolypoidní morfologické nádorové změny žaludečního epitelu bez stromální invaze. Základní dva typy dysplázie jsou intestinální a foveolární (gastrický). Nicméně přestože autoři v textu uvádějí, že v mnoha případech je fenotyp smíšený, není smíšený typ dysplázie v původní tabelární formě obsažen. Zato je v ní obsažena pit/crypt dysplázie (úmyslně nepřekládáme, protože překlad by mohl vést k záměně s jinými typy), charakterizovaná dysplastickými změnami v bazální části foveol s maturací epitelových buněk směrem k povrchu, a pohříchu i serrated (pilovitá) dysplázie, která má dokonce jako jediný z typů svůj vlastní kód, přestože se od pit/crypt dysplázie liší jen minimálně a její klinický význam je nejasný. Navíc tabelární forma uvádí její rozlišení na low grade a high grade, přestože nejsou uvedena diagnostická kritéria těchto stupňů a navíc se naopak obecně grading serrated lézí nedoporučuje. Kromě striktně nepolypoidních lézí se však termín dysplázie (glandulární intraepiteliální neoplázie) používá i v případě dysplastických změn v primárně nenádorovém (benigním) polypu, jmenovitě ve fundickém glandulárním polypu a hyperplastickém polypu, případně hamartomových polypech žaludku.
Adenomy jsou lokalizované polypoidní léze tvořené dysplastickým epitelem. Hlavním typem je adenom intestinálního typu, který má i svůj vlastní MKN-O kód. Další typy adenomů nejsou v původní tabelární formě uvedeny, všechny spadají do kategorie s matoucím názvem „adenomatózní polyp“ a všechny tedy mají stejný MKN-O kód. Patří mezi ně adenom foveolárního typu, adenom z pylorických žlázek a adenom z oxyntických žlázek. Posledně jmenovaný je poněkud problematický jednak v tom, že je na rozdíl od jiných adenomů definován jako benigní, přestože také obsahuje dysplázii a uvádí se jeho vysoká míra rizika progrese v adenokarcinom, a také v tom, že je prekurzorem adenokarcinomu typu z fundických žlázek (jde sice pouze o terminologický detail, který však může být vzhledem k existenci fundického glandulárního polypu matoucí, a není jasné, proč se současná přejmenovávací mánie zrovna tomuto problému vyhnula). Pro klasifikaci adenomů (a dysplazií) do jednotlivých typů je za dostatečné vyšetření považováno hodnocení morfologie buněk v konvenčním barvení, zatímco určení imunofenotypu intestinálního (pozitivní v průkazu MUC2, CDX-2 a CD10), foveolárního (MUC5AC), pylorického (MUC6) a oxyntického (pepsinogen I pro hlavní buňky, H+/K+ ATPáza pro parietální buňky, koexprese pepsinogenu I a MUC6 pro nezralé hlavní buňky) je uvedeno pouze jako volitelné pomocné vyšetření.
Adenokarcinom žaludku
Ačkoli WHO klasifikace uvádí i jednotku adenokarcinom NOS, je vhodné její užívání omezit na minimum (malé endoskopické biopsie, vzácné blíže neurčitelné případy). Příslušný MKN-O kód 8140/3 lze pak aplikovat navíc u těch vzácných variant, které vlastní kód nemají (tab. 3).
Tab. 3. Maligní epitelové nádory žaludku 
Tubulární adenokarcinom, který odpovídá adenokarcinomu intestinálního typu dle Lauréna, a špatně kohezivní karcinom (difúzního typu dle Lauréna) jsou dva nejčastější typy. Druhý jmenovaný lze ještě rozlišit na karcinom z prsténčitých buněk a špatně kohezivní karcinom NOS, který je tvořen buňkami podobnými lymfocytům nebo makrofágům.
Novými typy adenokarcinomu uvedenými ve WHO klasifikaci jsou mikropapilární karcinom, mukoepidermoidní karcinom, karcinom z parietálních buněk, karcinom z Panethových buněk a adenokarcinom z fundických žlázek (který sice není uveden v tabelární formě, ale je o něm pojednáno v textové části). Dále se do kategorie adenokarcinomu dostaly některé jednotky, které dříve byly uváděny jako samostatné kategorie. Jde jednak o medulární karcinom s lymfoidním stromatem (který se v jícnu pod názvem karcinom podobný lymfoepiteliomu stal podtypem nediferencovaného karcinomu), jednak hepatoidní karcinom a další AFP produkující nádory (dobře diferencovaný tubulární nebo papilární karcinom se světlou cytoplazmou, adenokarcinom s enteroblastickou diferenciací a karcinom podobný nádoru ze žloutkového váčku).
Nediferencovaný karcinom
Tato kategorie, která v minulé klasifikaci nebyla blíže komentována, nyní zahrnuje čtyři specifické podtypy: velkobuněčný karcinom s rhabdoidním fenotypem, pleomorfní karcinom, sarkomatoidní (vřetenobuněčný) karcinom a karcinom s obrovskými buňkami podobnými osteoklastům. Pravděpodobně pouze kvůli nedostatečné meziautorské koordinaci se do textu o nediferencovaném karcinomu vloudil i medulární karcinom s lymfoidním stromatem (karcinom podobný lymfoepiteliomu), který je zařazen do kategorie adenokarcinomu.
Gastroblastom
Tento bifázický nádor představuje skutečnou novinku ve WHO klasifikaci. Vychází z žaludeční tunica muscularis propria. Je tvořen hnízdy monomorfních epitelových buněk, mezi nimiž probíhají snopce uniformních podlouhlých vřetenitých buněk. Jde o potenciálně maligní nádor, k jehož diagnóze je nezbytný průkaz fúze MALAT1-GLI1.
Grading
Morfologický grading karcinomu žaludku se explicitně vztahuje pouze na tubulární a papilární typ adenokarcinomu (i když lze z obecného hlediska předpokládat, že nediferencovaný karcinom by si zasloužil grade 4). Uvedený grading tubulárního a papilárního adenokarcinomu je dvoustupňový, přičemž jeho vztah ke staršímu třístupňovému gradingu je obdobný jako u adenokarcinomu jícnu, tedy low grade zahrnuje G1 a G2, high grade G3. Problém je, že v nové WHO klasifikaci není uvedena definice G1-G3 a navíc (na rozdíl od podobně špásovného vyjádření ke gradingu kolorektálního karcinomu), nepomůže ani nahlédnutí do předchozího vydání WHO klasifikace. Ta totiž praví, že G2 je mezi G1 a G3. Což by jednak „jednoho nenapadlo“, jednak jde o natolik exaktní kritérium, že ani nemá smysl hodnotit „interobserver“ a „intraobserver“ variabilitu.
Imunohistochemie a molekulární patologie v diagnostice žaludečního karcinomu
V samotné diagnostice typů žaludečního karcinomu je jediným vyžadovaným molekulárně genetickým vyšetřením již zmíněný průkaz fúze MALAT1-GLI1 v případě gastroblastomu. K typizaci některých vzácných jednotek (karcinom z parietálních buněk, karcinom z Panethových buněk, adenokarcinom typu z fundických žlázek a AFP produkující nádory) lze sice využít imunohistochemického průkazu některých diferenciačně specifických antigenů, ale nejde o závazná vyšetření.
Rozdělení žaludečního karcinomu na 4 molekulární podtypy podle TCGA zatím nemá praktický význam. Výjimku zatím do určité míry představují typy s globální hypermetylací (podtyp s MSI a EBV-pozitivní podtyp). Perspektivně (a na žádost onkologa) přichází tedy v úvahu možnost vyšetření EBER ISH a MSI u vybraných karcinomů (zejména medulárních s lymfoidním stromatem), s následným imunohistochemickým vyšetřením exprese PD-L1 jako prediktoru odpovědi na imunoterapii zasahující PD-1/PD-L1 checkpoint. Dnešní realitou však je prediktivní vyšetření HER2 v případě zvažované anti-HER2 terapie.
NÁDORY TENKÉHO STŘEVA A AMPULY
Výskyt epitelových nádorů tenkého střeva klesá od duodena (až 75 %) po ileum (přibližně 10 %), přičemž většina nádorů duodena vzniká v oblasti Vaterovy ampuly.
V novém vydání autoři sloučili dříve oddělené kapitoly pro ampulu a tenké střevo do jedné, což prakticky žádné výhody nepřináší. Patologie epitelových nádorů ampuly se totiž od problematiky tenkého střeva značně odlišuje, což je dáno její komplikovanou anatomickou strukturou. Obecně (s určitou individuální variabilitou) totiž ampulu tvoří 4 struktury: duodenální sliznice kryjící povrch ampuly; přechodní zóna v ústí papily krytá epitelem foveolárního typu s disperzními pohárkovými buňkami; intraampulární oblast, tedy konečné úseky choledochu a hlavního pankreatického vývodu; a konečně stěna ampuly obsahující pankreatické akcesorní dukty a peribiliární žlázky ve svalovině Oddiho svěrače. Z toho důvodu v této oblasti mohou vznikat léze s dosti polymorfní buněčnou kompozicí (4). Tento problém autoři vyřešili tím, že jak adenomy, tak karcinomy stejně rozdělili do zvláštních kapitol pro Vaterovu ampulu a pro mimoampulární tenké střevo, problémem však zůstává tabelární přehled nádorových jednotek, který je v originální verzi sumární a tím pádem poněkud nepřehledný, protože z něj není jasné, které jednotky jsou platné pro jakou lokalizaci. Dále se tedy hlavně zaměříme na jasné vymezení topografické příslušnosti jednotlivých nádorových jednotek, včetně tabelárního rozdělení podle příslušné lokalizace.
Neinvazivní nádorové léze ampuly
Současná klasifikace rozlišuje dvě formy (tab. 4). První je adenom intestinálního typu vznikající z duodenálního povrchu ampuly. Na rozdíl od předchozí verze není uvedeno rozlišení na tubulární, tubulovilózní a vilózní adenom. Navíc, jak je v textové části zmíněno, vzácně se zde může vyskytovat i adenom z pylorických žlázek, v tabelární formě však uveden není. V samotném luminu ampuly pak vzniká intraampulární papilárně-tubulární nádor (IAPN). Může částečně protrudovat i na duodenální povrch, tato část by však měla tvořit < 25 % nádoru. Problém je, že nová klasifikace uvádí i původní termíny (neinvazivní pankreatobiliární papilární nádor s low grade dysplázií, neinvazivní pankreatobiliární papilární nádor s high grade dysplázií), a to dokonce i v tabelární formě. Navíc pro tyto původní názvy jsou uvedeny i MKN-O kódy, zatímco pro IAPN nikoli. Vzhledem k tomu, že jde pouze o terminologickou změnu, lze předpokládat, že kód zůstává stejný. Podivuhodné je také to, že se nová klasifikace nevyjadřuje k rozdělení IAPN na low grade a high grade (na rozdíl od jeho předchůdce – neinvazivního pankreatobiliárního papilárního nádoru). Lze tak jen spekulovat, zda stav zůstává stejný, nebo se grading neprovádí, případně jestli automaticky nepovažovat všechny IAPN za high grade (čemuž by nasvědčoval údaj, že > 80 % těchto nádorů obsahuje jak low grade, tak high grade ložiska, a že v 75 % resekovaných případů je již přítomna invazivní komponenta). V IAPN převažuje pankreatobiliární diferenciace epitelu, v 50 % lézí však lze zastihnout intestinální i pankreatobiliární diferenciaci).
Tab. 4. Epitelové nádory ampuly. 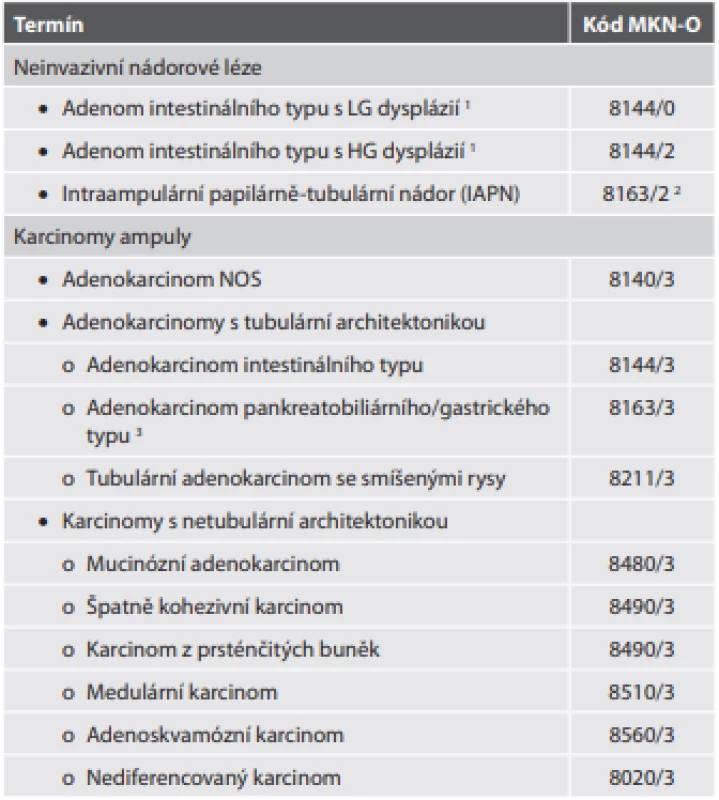
1 Problematika překladu stejná jako v tab. 2.
2 Kód 8163/X není pro IAPN v originální verzi výslovně uveden, je však uveden jako kód terminologického předchůdce IAPN (neinvazivní pankreatobiliární papilární nádor). Konkrétní kód 8163/2 (tedy high-grade) odvozujeme pouze z neuvedení rozdělení IAPN na low grade a high grade v kombinaci s praktickými hledisky (blíže rozvedeno v textu)
3 Ačkoli je možné (i imunohistochemicky) prokázat gastrický fenotyp, nová WHO klasifi kace připouští sloučení těchto dvou typů diferenciace do jedné skupinyKarcinom ampuly
Ampulární lokalizace karcinomu (téměř vždy adenokarcinomu) je dána jeho epicentrem v oblasti ampuly. U pokročilých nádorů samozřejmě již může být nemožné spolehlivě určit, jestli nádor vznikl v ampule, přilehlém mimoampulárním duodenu, hlavě pankreatu nebo distálním choledochu. Blíže lze topograficky ampulární karcinomy rozdělit na karcinom (peri)ampulárního duodena (vycházející z duodenálního povrchu ampuly); intraampulární karcinom vznikající z IAPN (tvořící masu vyplňující ampulu); intraampulární karcinom vycházející z ampulárních duktů (lokalizovaný ve stěně ampuly a vedoucí k její cirkumferenciální konstrikci); a konečně ampulární karcinom NOS (když se nelze rozhodnout mezi výše uvedenými třemi možnostmi).
Histologické typy karcinomu ampuly lze rozdělit do dvou hlavních skupin: adenokarcinomy s tubulární architektonikou, které mohou vykazovat intestinální nebo pankreatobiliární/gastrickou diferenciaci, a karcinomy s netubulární architektonikou (tab. 4).
Adenom tenkého střeva mimo ampulu
V tenkém střevě se vyskytují dva hlavní typy adenomu. Adenom intestinálního typu, který je v 60 % součástí hereditárního karcinomového syndromu (téměř vždy familiární adenomatózní polypózy, FAP), se může vyskytovat kdekoli v tenkém střevě. Adenom z pylorických žlázek se vyskytuje hlavně v proximálním duodenu, což souvisí s jeho předpokládaným vznikem v terénu heterotopie žaludeční sliznice, gastrické metaplázie sliznice duodena nebo hyperplázie Brunnerových žlázek. Originální tabelární forma kromě těchto dvou typů adenomu navíc uvádí i jednotku serrated (pilovitá) dysplázie, ačkoli pak v textové části (ampulární i mimoampulární) není vůbec zmíněna. Jde tedy o podobně kontroverzní počin jako v žaludeční lokalizaci (včetně rozlišení na low grade a high grade).
Karcinom tenkého střeva mimo ampulu
Karcinomy tenkého střeva jsou až na výjimky adenokarcinomy. Jejich četnost v jednotlivých oddílech v podstatě kopíruje četnost distribuce adenomů. S tím souvisí i určité rozdíly v liniích diferenciace adenokarcinomů mezi duodenem a zbytkem tenkého střeva. V duodenu totiž nejsou výjimkou adenokarcinomy se znaky gastrické, případně i pankreatobiliární diferenciace, což souvisí s výše uvedeným výskytem gastrické metaplázie, heterotopie, adenomů z pylorických žlázek, případně i blízkého topografického vztahu k (zejména aberantním) pankreatobiliárním duktálním strukturám. Tento fakt může samozřejmě komplikovat určení přesného origa u pokročilejších nádorů. Nicméně subtypizace enterálních adenokarcinomů ve vztahu k této diferenciaci není vyžadována (tab. 5).
Tab. 5. Epitelové nádory tenkého střeva mimo ampulu. 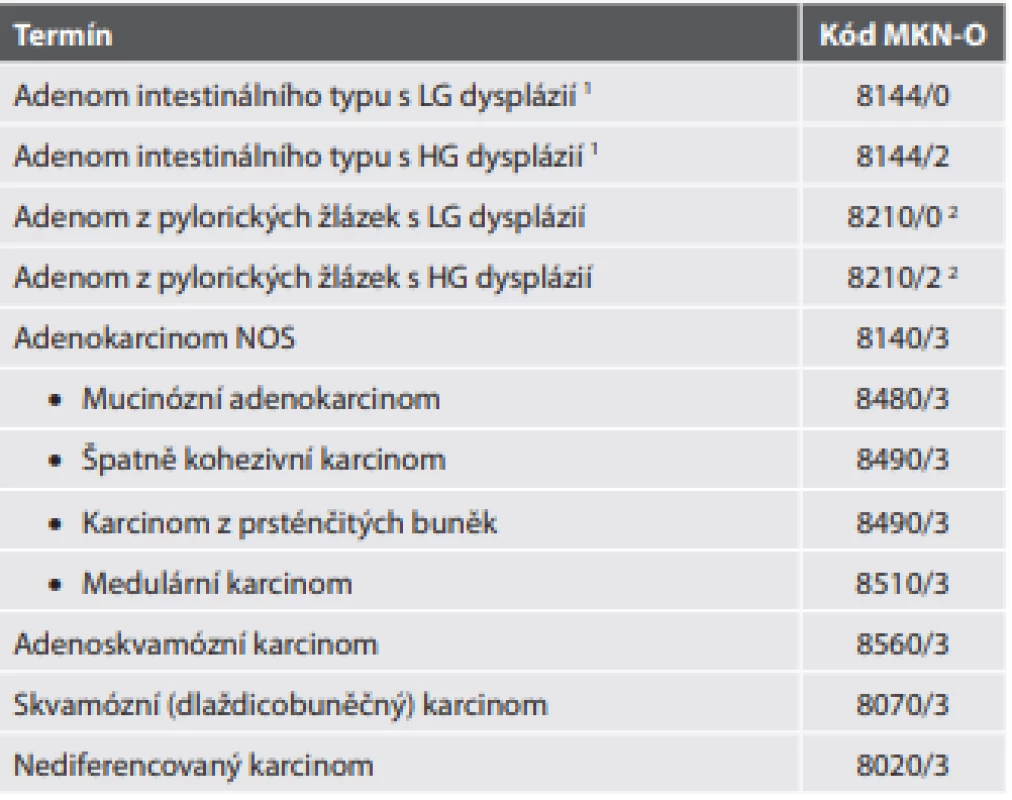
1Problematika překladu stejná jako v tab. 2.
2Nejedná se de facto o specifický kód pro adenom z pylorických žlázek, ale pro „jiný adenom“ (v originále „adenomatózní polyp“), navíc v případě adenomu z pylorických žlázek je možnost gradingu spornáNÁDORY APENDIXU
Kategorie epitelových nádorů apendixu doznala v novém vydání WHO klasifikace značných změn. Jednak došlo ke zpřehlednění problematiky neinvazivních lézí jejich vyčleněním do samostatných podkapitol pro serrated léze a pro apendikální mucinózní nádory, jednak byl tzv. „karcinoid z pohárkových buněk“ konečně oficiálně přejmenován na „adenokarcinom z pohárkových buněk“ (i když fakticky byl, vzhledem ke svým biologickým vlastnostem, řazen mezi karcinomy již v minulém vydání).
Serrated (pilovité) léze a polypy
Tato skupina zahrnuje hyperplastický polyp (obdobného charakteru jako v tlustém střevě) a serrated (pilovité) léze s tendencí k cirkumferenciálnímu postižení sliznice. S touto jednotkou lézí jsou bohužel obdobné problémy jako ve vyšších etážích GIT. Zatímco v tabelární formě je její forma bez dysplázie uvedena jako „sesilní serrated léze bez dysplázie“, v textu se píše pouze o „serrated lézi bez dysplázie“ (tab. 6). Vzhledem k doprovodnému histologickému popisu je však i zde ve skutečnosti míněna sesilní serrated léze. Závažnější diskrepance se vyskytuje u dysplastické formy, tedy „serrated léze s dysplázií“. Dysplázie je dále v textu subtypizována na „konvenční adenoma-like dysplázii“, „tradiční serrated adenoma-like dysplázii“ a „serrated dysplázii“. Zatímco první dvě jsou obdobou stejnojmenných kolorektálních lézí a lze je tak gradeovat, u serrated dysplázie grading výslovně uveden není (a obecně se grading těchto dysplázií nedoporučuje). Navzdory tomu je v tabelární formě uvedena pouze „serrated dysplázie“ a ještě k tomu je rozdělena na low grade a high grade. I kdybychom připustili, že se autoři opět dopustili terminologické nepřesnosti (tedy že místo „serrated léze s dysplázií“ uvedli „serrated dysplázie“), nevyřeší to rozpory mezi textovou a tabelární formou, o objasnění nejasností ohledně gradingu nemluvě (5).
Tab. 6. Epitelové nádory apendixu. 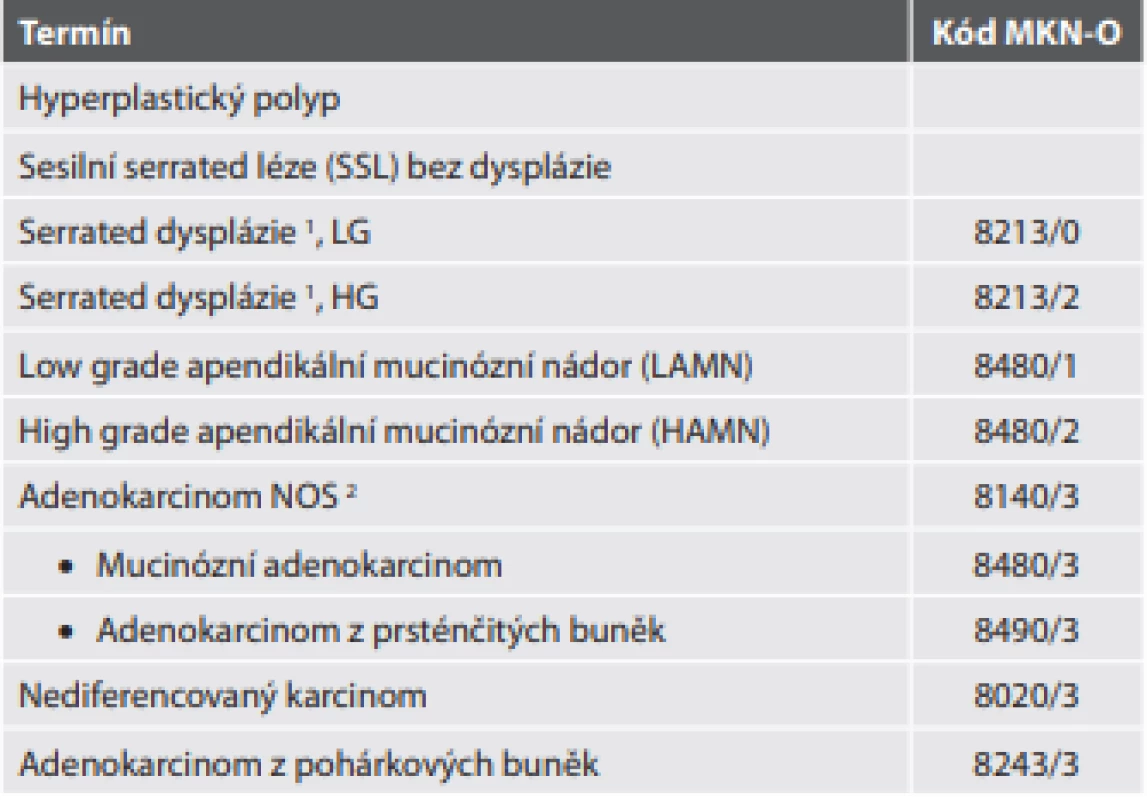
1 Problematika terminologie „serrated dysplázie“ a jejího gradingu řešena v textu
2 Kód adenokarcinomu prakticky použitelný pro nemucinózní adenokarcinomVe vztahu k následující kategorii je důležité a užitečné upozornění na rozlišení mezi serrated lézí a LAMN (viz dále), který také může někdy vykazovat pilovitou architektoniku. Na rozdíl od druhé jmenované jednotky serrated léze nenarušují normální stavbu apendixu, zachovávají lamina propria mucosae a muscularis mucosae, nevedou k fibróze submukózy a nevedou k pseudomyxoma peritonei.
Apendikální mucinózní nádory
Nové vydání WHO klasifikace kromě běžného LAMN (low grade apendikálního mucinózního nádoru) již uvádí i HAMN (high grade apendikální mucinózní nádor). Odlišení LAMN od serrated lézí je uvedeno výše. Na rozdíl od předchozího vydání již není uveden termín „pseudomyxoma peritonei“ či „mucinózní karcinom peritonea“, ani varianty „diseminovaná peritoneální adenomucinóza“ a „peritoneální mucinózní karcinomatóza“ (6), hovoří se pouze o peritoneálních metastázách a peritoneální diseminaci.
Grading primárních apendikálních mucinózních nádorů (a adenokarcinomů) apendixu i jejich peritoneálních metastáz je třístupňový (tab. 7).
Tab. 7. Grading apendikálních mucinózních nádorů, adenokarcinomů apendixu a jejich peritoneálních metastáz. 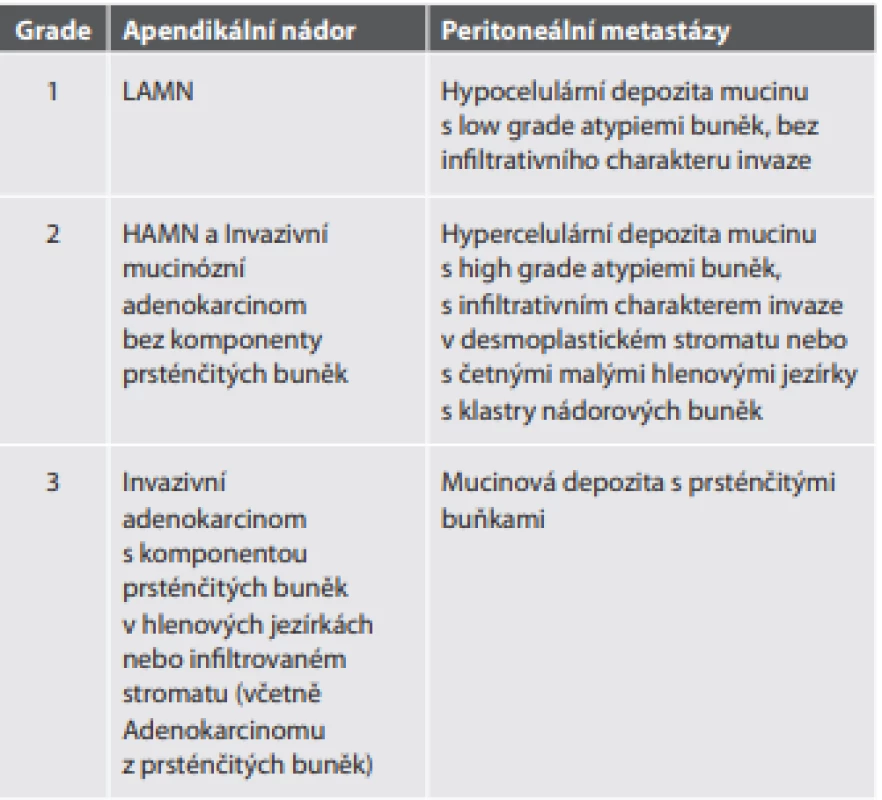
Staging je mírně nestandardní. V době vydání 8. edice TNM klasifikace AJCC/UICC ještě nebyla jednotka HAMN oficiálně součástí WHO klasifikace a není tedy v TNM klasifikaci uvedena. Nicméně podle instrukcí WHO pro něj platí stejná pravidla jako pro LAMN. Tedy postihuje-li nádor stěnu apendixu maximálně do vrstvy muscularis propria, jde o pTis. Postižení subserózy je pT3 (pT1 a pT2 tedy pro LAMN a HAMN neexistuje).
Karcinom apendixu
Adenokarcinomy apendixu mohou být nemucinózní (většinou běžného tubulárního typu jako v kolorektu), mucinózní nebo z prsténčitých buněk. Jejich problematika, stejně jako problematika vzácného nediferencovaného karcinomu je obdobná jako v kolorektu.
Grading mucinózního adenokarcinomu a adenokarcinomu z prsténčitých buněk je součástí specifického třístupňového gradingu apendikálních nádorů (tab. 7), zatímco pro nemucinózní adenokarcinom se používá dvoustupňový grading jako v kolorektu.
Adenokarcinom z pohárkových buněk
Přestože jde terminologicky o adenokarcinom, je tomuto amfikrinnímu nádoru vyhrazena zvláštní podkapitola. Ačkoli lze jeho parciální neuroendokrinní diferenciaci potvrdit průkazem chromograninu a zejména synaptofyzinu, není imunohistochemické vyšetření k diagnóze vyžadováno, hodnocení charakteristické morfologie v konvenčním barvení je požadováno za dostatečné. Nezbytnou podmínkou diagnózy je přítomnost komponenty klasického obrazu low grade adenokarcinomu z pohárkových buněk.
Grading tohoto nádoru je třístupňový, založený na rozsahu komponenty s high grade histologickými znaky (charakterizovanými ztrátou klasického uspořádání buněk do tubulů nebo klastrů, přičemž tyto buňky v high grade komponentě mohou tvořit komplexní anastomozující tubuly, kribriformní masy, difúzní plochy tvořené „pohárkovými“ nebo prsténčitými buňkami s výraznými jadernými atypiemi, četnými mitózami, případně i atypickými mitózami a nekrózami). Grade 1 má < 25 % high grade komponenty, v grade 2 tvoří high grade komponenta 25-50 % nádoru a v nádoru grade 3 představuje high grade komponenta > 50 % jeho objemu.
NÁDORY KOLOREKTA
Kapitola věnovaná kolorektálním nádorům je asi největším zklamáním. Zejména kvůli některým nesplněným očekáváním. Mezi ta v první řadě patřila změna morfologického gradingového systému kolorektálního adenokarcinomu, aby více reflektoval biologické vlastnosti nádoru, ke které nakonec nedošlo. Na půli cesty zůstalo vyřešení některých nejasných otázek v problematice serrated lézí (o nekonzistentním postoji ke gradingu serrated dysplázie už byla opakovaně řeč v předchozích kapitolách). Zcela nečekaným lapsem je ovšem konflikt WHO klasifikace se současnou TNM klasifikací AJCC/UICC v kategorii pTis.
Serrated (pilovité) léze a polypy
Do této kategorie patří hyperplastický polyp, sesilní serrated léze (SSL) (termín nahradivší předchozí sesilní serrated adenom/polyp (SSA/P), tradiční serrated adenom (TSA) a konečně neklasifikovaný serrated adenom. Zvláštní je, že ačkoli je v tabelární formě jmenovitě uveden hyperplastický polyp (a dokonce i jeho podtypy), ostatní jednotky v ní uvedeny nejsou. Snad jsou tedy zahrnuty v termínu „serrated dysplázie“ nebo „jiný adenom“ (v originále „adenomatous polyp“), což je ale vzhledem k přejmenování SSA/P na SSL poněkud překombinovaná situace (tab. 8).
Tab. 8. Benigní epitelové nádory a prekurzory (premaligní léze) CRC. 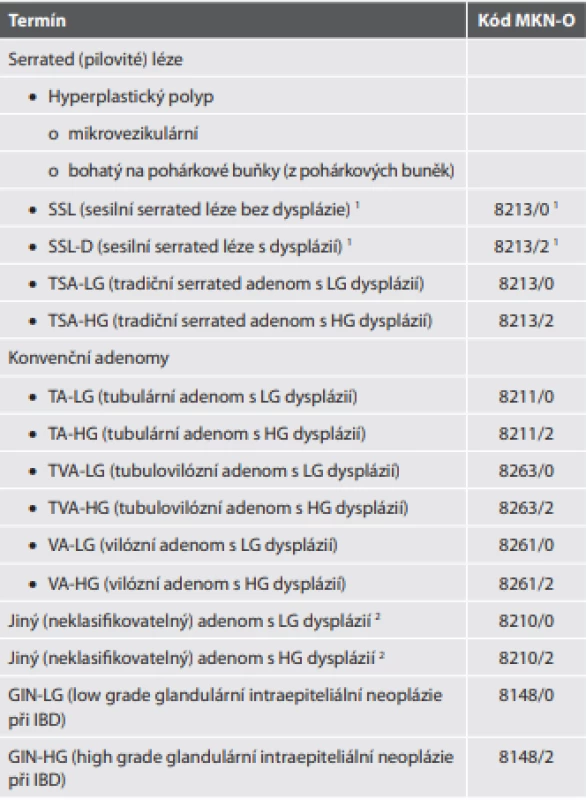
1 Pro kódování SSL použity kódy v originálním znění označeny jako „serrated dysplasia“, stejně jako pro TSA. Nicméně jejich užití v případě SSL bylo modifi kováno. Jednak i samotný SSL (bez „cytologické dysplázie“) má již charakter prekurzoru, jednak jeho architektonické znaky jsou některými znaky označovány jako „architektonické dysplázie“, takže jej lze z praktických důvodů označit za LG lézi. Na druhou stranu, pro grading dysplázie v SSL-D chybí přesvědčivá kritéria, většinou autorů není doporučován a mnohými je samotná přítomnost jakékoli „cytologické dysplázie“ v SSL považována z hlediska biologického chování za HG lézi, což činí toto použití MKN-O kódu pravděpodobně nejracionálnější z možných variant.
2 Jedná se o kód vyhrazený pro skutečně blíže neurčitelné léze, neměl by být zneužíván jako „spořič času a námahy“.Novinkou je nejen samotný nový název SSL, ale i její minimální diagnostické kritérium: nově stačí k diagnóze SSL přítomnost jediné nepochybně pilovité krypty. Ta musí však vykazovat jasné znaky krypty SSL (signifikantní dilatace bazální třetiny krypty, její horizontální extenze podél lamina muscularis mucosae, pilovitý profil zasahující až k bazi krypty nebo asymetrická proliferace). Pokud jde o sesilní serrated lézi s dysplázií (SSL-D) typu serrated dysplázie, je výslovně řečeno, že grading serrated dysplázie se nedoporučuje. V tomto kontextu je naprosto nejasné, proč v úvodu této kapitoly jsou jako jediné dva MKN-O kódy uvedené kódy pro LG a HG serrated dysplázii, když zdaleka ne všechny léze této skupiny jsou dysplastické, i pokud jsou tak nemusí jít o serrated dysplázii, jejíž grading se navíc nedoporučuje (5).
Neklasifikovaný serrated adenom je „odpadkový koš“ pro případy, které nelze jednoznačně určit jako TSA nebo SSL, navíc se sem řadí i relativně nedávno popsaný serrated tubulovilózní adenom. Důvod, proč vzhledem k heterogennosti této skupiny nebyl zvolen neutrálnější termín jako třeba „neklasifikovaná serrated léze“, je nejasný. Snad aby bylo příště zase co přejmenovávat.
Konvenční kolorektální adenom
Tímto termínem se v odborné literatuře již delší dobu označují souhrnně běžné tubulární (< 25 % vilózní komponenty), tubulovilózní (25-75 % vilózní komponenty) a vilózní (> 75 % vilózní komponenty) adenomy, aby se odlišily od kategorie serrated lézí/polypů.
V úvodu této kapitoly je sice jako jediný MKN-O kód uveden kód pro „adenomatózní polyp“ (v LG a HG formě), ale vzhledem k tomu, že v tabelární formě jsou k dispozici i kódy pro jednotlivé podtypy konvenčního adenomu (tab. 8), pokládáme za vhodné používat spíše tyto specifické kódy, a kód „adenomatózní polyp“ užívat spíše ve formě „jiný adenom“ pro jiné typy adenomů (resp. preneoplastických lézí). Praktickým opodstatněním tohoto přístupu je zejména očekávané povinné hlášení všech adenomů (i s MKN-O kódy) do Národního onkologického registru. Máme-li už totiž něčemu zadarmo, povinně, aktivně (a proti naší vůli) věnovat svůj čas, mělo by to vést aspoň k možnosti validního statistického zpracování získaných údajů (v opačném případě bychom mohli zcela rezignovat na jakoukoli subtypizaci preneoplastických lézí).
Závěr kapitoly přináší již avizovaný konflikt se současnou verzí TNM klasifikace dle AJCC/UICC. V ní je totiž v kolorektální oblasti za pTis považován pouze intramukozální (adeno)karcinom, nikoli high grade dysplázie (jako tomu bylo dříve) (2,3). V nové WHO klasifikaci je však explicitně uvedeno, že high grade dysplázie je pTis. Tomuto pojetí navíc odpovídá i MKN-O kód pro adenom s high grade dysplázií, který formálně odpovídá „karcinomu in situ“.
Kolorektální dysplázie asociovaná s IBD
V souladu s oficiálním zrušením pojmu DALM (dysplasia-associated lesion or mass) před 5 lety (7) přejímá WHO klasifikace termín glandulární intraepiteliální neoplázie, přičemž korektně poznamenává, že i v terénu IBD se mohou vyskytnout „běžné“ sporadické adenomy, nicméně je nelze spolehlivě odlišit od dysplázií kauzálně asociovaných s chronickým zánětem střevní sliznice. Hlavními dvěma podtypy je dysplázie intestinálního typu a dysplázie serrated typu. Pouze v této kapitole je výslovně uvedeno rozlišení dysplázie serrated typu na low grade a high grade, včetně obrazové dokumentace. Nicméně kritéria pro toto stanovení nejsou jednoznačná a ani fotodokumentace nepůsobí přesvědčivě. Navíc se i zde opakuje nešťastná, již výše zmíněná, kolize s 8. vydáním klasifikace TNM dle AJCC/UICC v definici pTis.
Kolorektální karcinom
Spektrum typů kolorektálního karcinomu doznalo pouze mírných změn (tab. 9). Samozřejmě jde v drtivé většině o adenokarcinomy. V této kategorii se už v nové WHO klasifikaci nenalézá kribriformní adenokarcinom komedonového typu (který byl jako nová jednotka zaveden v předchozím vydání). Nově byl do klasifikace zahrnut adenoma-like adenokarcinom (dříve často popisován jako vilózní adenokarcinom, nebo invazivní papilokarcinom). Pro tuto diagnózu musí být alespoň polovina nádoru tvořena dobře diferencovanou vilózně uspořádanou komponentou bez infiltrativního charakteru invaze a s minimální dezmoplastickou reakcí (což činí jeho rozpoznání jako karcinomu v endoskopické biopsii poměrně obtížným). Dále byly ze skupiny karcinomu z prsténčitých buněk vyčleněny špatně kohezivní karcinomy, které prsténčité buňky postrádají.
Tab. 9. Kolorektální karcinom. 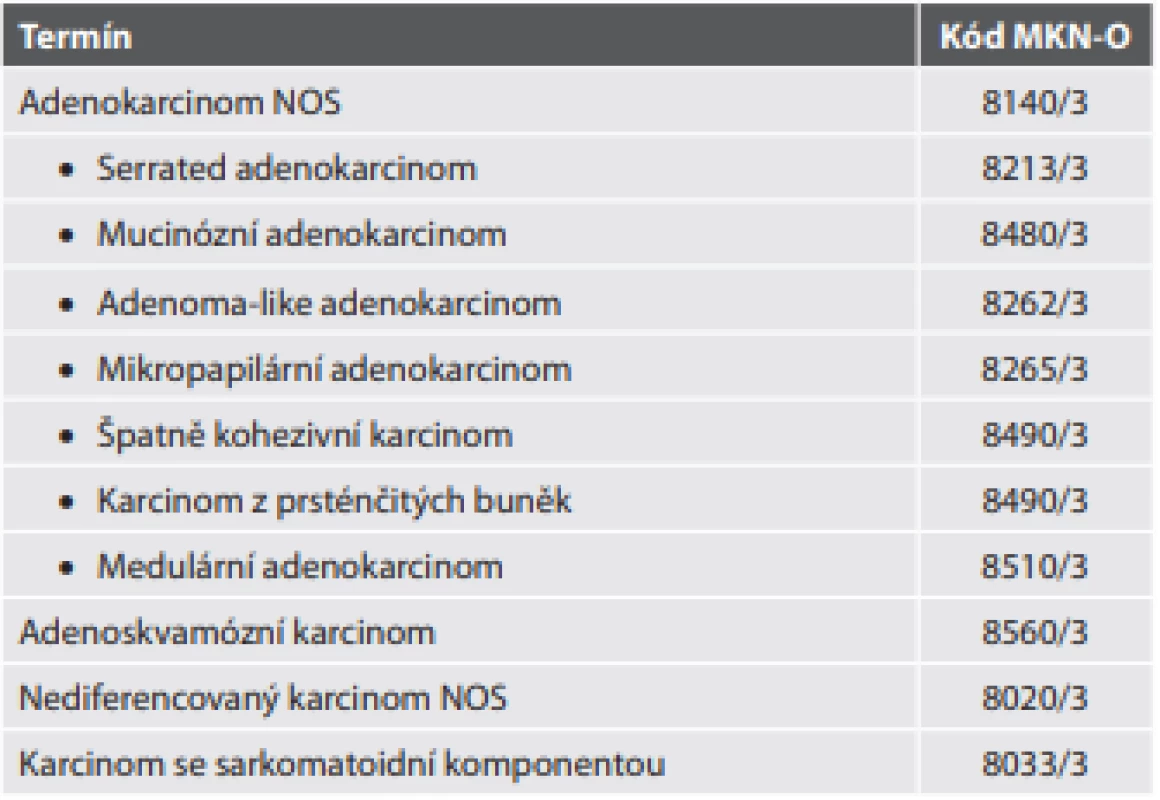
Novou jednotkou je také karcinom se sarkomatoidní komponentou. Do této diagnózy tedy pravděpodobně nyní spadá dříve samostatně uváděný vřetenobuněčný karcinom. Sarkomatoidní komponenta však může mít i pleomorfní obrovskobuněčný charakter nebo rhabdoidní fenotyp (který je často asociován s deficiencí komplexu SWI/SNF). Skvamózní (dlaždicobuněčný) karcinom nová WHO klasifikace neuvádí, pravděpodobně pro jeho vzácnost.
Grading kolorektálního karcinomu se nevydal cestou přiblížení se k biologickému gradingu (které slibovalo např. hodnocení nádorového „buddingu“ nebo špatně diferencovaných klastrů nádorových buněk), ale zůstal tradiční, tedy založený na procentuálním zastoupení luminizovaných glandulárních struktur. Doporučuje se dvoustupňový grading, tedy low grade (odpovídá G1 a G2) a high grade (G3). Definici G1-G3 však nová klasifikace neuvádí, takže je nutné podívat se do předchozího vydání, což je řešení poněkud dadaistické. Laskavým čtenářům zde tedy přinášíme chybějící informaci: low grade je G1 (> 95 % nádoru tvoří žlázky) a G2 (žlázky tvoří 50-95 % nádoru), high grade je G3 (< 50 % nádoru je tvořeno žlázkami). Důležité je, že grading je platný pouze pro adenokarcinom NOS a (nově) pro mucinózní adenokarcinom (jehož grading byl dříve založen na stanovení MSI). V ostatních typech kolorektálního karcinomu se grading neprovádí, s výjimkou nediferencovaného karcinomu, který má automaticky grade 4. Zvláštní je instrukce k provádění gradingu, podle níž má být grading založen na „nejméně diferencované komponentě“. Toto sdělení lze totiž chápat různě, mimo jiné i tak, že jestliže 5 % nádoru není tvořeno diferencovanými žlázkami, potom výběr této minoritní komponenty pro hodnocení posune grade adenokarcinomu z G1 do G3, což se jeví být v groteskním rozporu s hlavní definicí.
Zmiňovaný nádorový „budding“ a špatně diferencované klastry zůstaly na úrovni prognostických faktorů spolu s infiltrativním typem invaze, perineurální invazí, lymfatickou invazí, vaskulární invazí, nádorovými depozity, tumor-infiltrujícími lymfocyty, Crohn-like lymfoidními noduly a případně sofistikovanějším Imunoskóre založeném na imunohistochemickém vyšetření denzity a lokalizace CD3 a CD8 lymfocytů. Z molekulárních negativních prognostických markerů WHO klasifikace uvádí mutace BRAF. Podle jiných zdrojů však toto platí pouze v případě MSS karcinomů (8).
Mezi prediktivními markery rezistence na terapii anti-EGFR protilátkami uvádí WHO klasifikace kromě (již tradičních) mutací genů RAS i mutace genu BRAF (ty jsou však v současné době dosud našimi plátci zdravotní péče vnímány pouze jako marker prognostický). Markery predikující účinnost terapeutické inhibice PD-1/PD-L1 jsou označeny za dosud ne plně ověřené.
NÁDORY ANÁLNÍHO KANÁLU
Vlastním předmětem patologie anu jsou léze samotného análního kanálu, tedy v anatomickém rozsahu od anorektálního prstence v úrovni m. puborectalis po anální okraj, zatímco perianální oblast je spíše dermatopatologickým terénem a je ve WHO klasifikaci nádorů trávicího systému jen letmo zmíněna, což ochotně budeme respektovat i my.
Dysplázie análního dlaždicového epitelu
V novém vydání WHO klasifikace došlo k posunu od terminologie ASIN (anální skvamózní intraepiteliální neoplázie) k názvosloví navrženému projektem LAST (lower anogenital squamous terminology), které je společné pro lokalizace anální, genitální a perianální (což je vzhledem ke sdílené papilomavirové etiologii pochopitelné). Změny nejsou nijak výrazné, je zachován dvoustupňový grading, pouze se místo termínu ASIN, případně PSIN (perianální skvamózní intraepiteliální neoplázie) používá pro všechny lokalizace jednotně zkratka SIL, respektive podle stupně dysplázie LSIL nebo HSIL. Avšak vzhledem k sílícím hlasům volajícím po odstoupení od názvosloví projektu LAST a po návratu k třístupňovému gradingu intraepiteliální neoplázie v oblasti děložního čípku je otázkou, zda je LAST opravdu „poslední verzí“ terminologie, nebo spíše kdy dojde k další reklasifikaci (9).
Skvamózní (dlaždicobuněčný) karcinom
V problematice dlaždicobuněčného karcinomu, včetně jeho nejdůležitějších variant, tedy bazaloidního karcinomu a verukózního karcinomu, mnoho novinek není. Výjimkou je odlišení verukózního karcinomu od tumoru (obrovského kondylomu) Buschke-Löwenstein (které byly ještě v předchozím vydání WHO klasifikace uváděny jako synonyma). Zatímco tumor Buschke-Löwenstein je léze asociovaná s infekcí low risk HPV, verukózní karcinom je HPV-negativní léze.
Přibližně polovina análních dlaždicobuněčných karcinomů vykazuje expresi PD-L1 a dosavadní výsledky cílené terapie inhibitory PD-1 se jeví slibně.
Anální adenokarcinom
Vzhledem ke komplikované struktuře análního kanálu se nejedná o homogenní jednotku. Lze rozlišit podtyp mukozální (vycházející ze žlázové sliznice horní části análního kanálu, s problematikou obdobnou rektálnímu adenokarcinomu) a podtyp extramukozální.
Extramukozální adenokarcinomy se dále tradičně dělí na adenokarcinomy vycházející z análních žlázek (CK7+, MUC5AC+, CK20-, CDX2-) a adenokarcinomy asociované s anální píštělí (histologicky mohou vykazovat morfologii obdobnou rektálnímu adenokarcinomu, adenokarcinomu z análních žlázek nebo z epitelu přechodní zóny). Nově se rozlišuje ještě třetí podtyp – extrakumozální adenokarcinom nevycházející z análních žlázek a bez asociace s anální píštělí, který vychází z intramurálních žlázových struktur, které mají původ např. v některých vývojových anomáliích stavby anální stěny.
Přestože v původní tabelární formě klasifikace je uveden pouze adenokarcinom NOS, doplňujeme tabulku ještě o mucinózní adenokarcinom, již proto, že jde o nejčastější morfologickou variantu adenokarcinomu asociovaného s anální píštělí (tab. 10).
Tab. 10. Epitelové nádory análního kanálu. 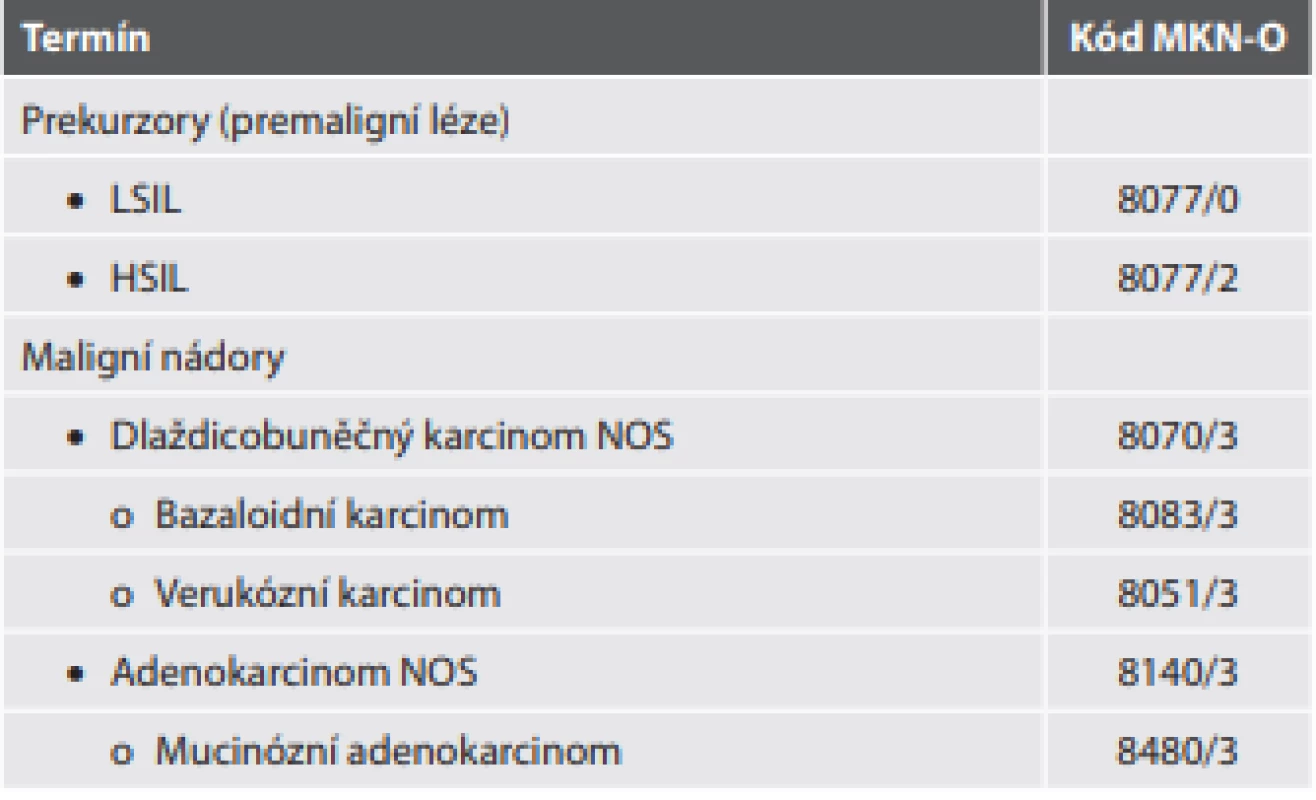
MEZENCHYMOVÉ NÁDORY GASTROINTESTINÁLNÍHO TRAKTU
V trávicí trubici se pochopitelně může vyskytnout jakýkoli mezenchymový nádor, pro potřeby WHO klasifikace nádorů trávicího systému bylo však třeba výběr racionálně omezit pouze na ty jednotky, jejichž výskyt není vyloženě raritní, případně je gastrointestinální trakt jejich výhradní nebo typickou lokalizací. V tabelární úpravě i v textové části jsou mezenchymové nádory členěny podle předpokládané buněčné linie původu nebo diferenciace, přičemž samostatná kapitola je vyhrazena gastrointestinálnímu stromálnímu tumoru (GIST) jako nejdůležitějšímu a nejčastějšímu mezenchymovému nádoru GIT a sarkomu vůbec.
GIST
Vzhledem k tomu, že tento rok byl vydán Doporučený postup pro bioptické vyšetření gastrointestinálního stromálního tumoru Společnosti patologů ČLS JEP, omezíme se zde na upozornění na nejdůležitější změnu v porovnání s předchozím vydáním: přestože nová WHO klasifikace zachovává stratifikaci GIST do prognostických skupin, nejsou nyní těmto skupinám již přiřazeny termíny určující jejich biologické chování (benigní, s nejistým maligním potenciálem, maligní). Navíc je v tabelární i textové části uveden pro GIST pouze jeden MKN-O kód, a to 8936/3, tedy maligní, což mimo jiné zjednodušuje onkologické hlášení tohoto novotvaru.
Nádory z (myo)fibroblastů a tukové tkáně
Je zvláštní, že ani v tomto vydání WHO klasifikace se nedočkal inflamatorní fibroidní polyp (IFP, Vaňkův tumor) uznání jako opravdový nádor, přestože jeho nádorová povaha asociovaná s mutací PDGFRA byla prokázána již před vydáním předchozí edice, což je v nápadném kontrastu s plexiformním fibromyxomem, tedy nádorem velmi podobným, ale podstatně vzácnějším a mnohem později popsaným, kterému se cti přidělení vlastního MKN-O kódu dostalo právě již ve 4. vydání WHO klasifikace nádorů trávicího systému.
Rozšiřující se spektrum genových fúzí charakterizujících inflamatorní myofibroblastický tumor (IMT) je shrnuto v článku Imunohistochemie a molekulární genetika v diferenciální diagnostice mezenchymálních lézí gastrointestinálního traktu na stránkách tohoto časopisu (10). WHO klasifikace dále zdůrazňuje důležitost identifikace jeho podtypu zvaného epiteloidní inflamatorní myofibroblastický sarkom, který je asociován s výrazně agresivnějším chováním než běžný IMT.
Problematika fibromatózy je v nové WHO klasifikaci poněkud komplikována úvodním rozdělením na fibromatózu dezmoidního typu a abdominální fibromatózu, přičemž ale jako synonymum abdominální fibromatózy uvádí i adjektivum mezenteriální, což je de facto fibromatóza intraabdominální. Z toho důvodu situaci zjednodušujeme uvedením intraabdominální a abdominální fibromatózy s jediným MKN-O kódem. Přestože molekulárně genetické vyšetření není v diagnóze fibromatózy pokládáno za nutné, zmiňuje WHO klasifikace význam negativního průkazu mutace genu CTNNB1 jako markeru vysokého rizika hereditární formy v rámci familiární adenomatózní polypózy.
U solitárního fibrózního tumoru (SFT) je již nově uvedeno, že jeho imunohistochemickým znakem je pozitivita STAT6 a zapomenuta je tak nespolehlivá kombinace markerů CD34, bcl-2 a CD99. Z variant WHO klasifikace zmiňuje lipomatózní SFT, který lze zaměnit za dobře diferencovaný nebo dediferencovaný liposarkom, a obrovskobuněčný angiofibrom, který by mohl vzdáleně napodobovat angiosarkom.
V diagnostice lipomu je důležitější než rozpoznání jeho málo důležitého a v GIT vzácného podtypu angiolipomu odlišení intramukozálního lipomu, který je velmi často znakem syndromu Cowdenové, od banálního submukózního lipomu.
Nádory z hladké a příčně pruhované svaloviny
Vzhledem k banálnosti leiomyomu trávicího traktu považujeme za vhodné pouze vysvětlit pojem „seedling leiomyoma“, v překladu „sazenice leiomyomu“, čímž jsou míněny incidentální drobné (< 7 mm) leiomyomy v oblasti gastrointestinální junkce (snad by bylo vhodnější v analogii s GIST používat termín jako “mikroleiomyom” nebo “leiomyomový tumorlet” než hledat inspiraci v agronomickém názvosloví). Leiomyomatóza jícnu může být hamartomatózním onemocněním asociovaným s Alportovým syndromem, nebo se může vyskytovat i sporadicky. Na rozdíl od leiomysarkomu zaslouží bližší zmínku ve WHO klasifikaci jen letmo zmíněný a do původní tabelární formy ani nezařazený EBV-asociovaný hladkosvalový nádor, který se vyskytuje u imunosuprimovaných pacientů a vyznačuje se širokou variabilitou histologického obrazu i biologického chování. Diagnostickým markerem je průkaz EBER metodou in situ hybridizace (ISH).
Rhabdomyosarkom je ve všech svých variantách v trávicím traktu velmi vzácný a jeho problematika se zde neliší od lokalizace v měkkých tkáních.
Vaskulární a perivaskulární nádory
Přestože se dnes na hemangiom (nebo alespoň některé jeho podtypy) nahlíží jako na léze blízké spíše venózním malformacím, považujeme zařazení léze Dieulafoy, gastrické vaskulární ektázie (GAVE) nebo angiodysplázie do kapitoly věnované hemangiomu vzhledem k jejich morfologicky zjevně nenádorové povaze za poněkud násilné a v naší verzi tabelární formy je ani neuvádíme (tab. 11).
Tab. 11. Mezenchymové nádory GIT. 
Kaposiho sarkom, angiosarkom, nádory z glomových buněk, lymfangiom a lymfangiomatóza gastrointestinálního traktu se neliší od stejných lézí v jiných, častějších lokalizacích.
Neurální nádory
Gastrointestinální schwannom se liší od své měkkotkáňové varianty morfologicky (je neopouzdřený, nemívá palisádovaná jádra a kromě S100-pozitivních Schwannových buněk jsou v něm přítomny i GFAP-pozitivní nervová vlákna) i molekulárně geneticky (až na výjimky nevykazuje inaktivaci genu NF2). Z jeho variant stojí za zmínku slizniční hamartom ze Schwannových buněk, který se prezentuje jako drobná (většinou kolorektální) polypoidní léze tvořená difúzní proliferací S100-pozitivních vřetenitých buněk bez příměsi gangliových buněk a axonů, v níž jsou zachyceny střevní krypty normálního vzhledu. Ačkoli nádor z granulárních buněk (granular cell tumor) také vychází ze Schwannových buněk, je z historických důvodů pojednán v samostatné kapitole, ve které je mimo jiné výslovně uvedeno, že synonymní termíny jako „myoblastom“ nebo „Abrikossoffův tumor“ již nejsou doporučovány. Byly popsány i vzácné případy s maligním chováním.
Kapitola věnovaná perineuriomu je jedním z příkladů, kde nová WHO klasifikace zůstala v půli cesty. Pojednává totiž jak o skutečných perineuriomech lokalizovaných většinou v submukóze a podobných klasickým měkkotkáňovým perineuriomům (včetně častých alterací chromozomu 22 postihující gen NF2), tak o kolorektálních slizničních perineuriomech, dříve označovaných jako benigní fibroblastický polyp colon. Tyto léze jsou tvořeny proliferací vřetenitých buněk s imunofenotypem perineurálních buněk okolo krypt „serrated“ morfologie. Pouze v buňkách těchto krypt byla detekována mutace BRAF V600E, zatímco v okolních perineurálních buňkách tato mutace prokázána nebyla (ani alterace genu NF2). Pravděpodobně se tedy jedná pouze o reaktivní proliferaci perikryptálních fibroblastů s perineurální diferenciací okolo krypt hyperplastického polypu nebo SSL. Z toho důvodu byl již před 10 lety navržen termín serrated kolorektální polyp (hyperplastický polyp/sesilní serrated léze) s perineurálním stromatem, jehož přijetí by zabránilo terminologické záměně se skutečným perineuriomem (11).
Ganglioneurom a ganglioneuromatóza jsou léze tvořené směsí gangliových buněk, Schwannových buněk a nervových vláken. Zatímco solitární ganglioneurom bývá většinou izolovaný sporadický slizniční polyp, vícečetný nebo difúzní výskyt musí vzbudit podezření na hereditární nádorový syndrom, který vyžaduje genetické vyšetření. Obraz ganglioneuromatózní polypózy může být podle současné klasifikace asociován se syndromem Cowdenové, byl však popsán i při tuberózní skleróze a syndromu juvenilní polypózy. Difúzní ganglioneuromatóza má silnou asociaci se syndromem mnohočetné endokrinní neoplázie (MEN) 2B, méně často se vyskytuje při neurofibromatóze 1. typu.
Nádory nejisté diferenciace
Nádory z perivaskulárních epiteloidních buněk se vyskytují v trávicím traktu vzácně. V tubulárním GIT se vyskytují prakticky výhradně PEComy tvořené epiteloidními buňkami bez hladkosvalové a adipocytární komponenty (připouští se však minoritní složka vřetenitých buněk), zatímco v játrech se vyskytují jak PEComy, tak angimyolipomy (včetně inflamatorního podtypu). Druhé jmenované mohou být asociovány s tuberózní sklerózou. Diagnózu je doporučeno ověřit imunohistochemicky, na základě koexprese melanocytárních markerů (převažujících v epiteloidní komponentě) a hladkosvalových markerů (převažujících ve vřetenobuněčné komponentě), případně TFE3 (je pozitivní hlavně v případě PEComů s rearanží genu TFE3).
Synoviální sarkom se v GIT vyskytuje vzácně, nejčastěji v žaludku. Bohužel bývá většinou monofázický vřetenobuněčný, s mnoho neříkající fokální pozitivitou v imunohistochemickém průkazu cytokeratinů a epiteliálního membránového antigenu (EMA). Z nejasných důvodů je ve WHO klasifikaci opomenut diagnostický význam imunoexprese TLE-1, která může významně přispět k indikaci pro diagnózu nezbytného průkazu rearanží SS18-SSX1, SS18-SSX2 nebo SS18-SSX4.
Světlobuněčný sarkom (CCS) a gastrointestinální neuroektodermální tumor (GNET) jsou buď blízce příbuzné jednotky, nebo (spíše) dokonce pouze dva konce spektra obrazů nádorové proliferace vycházející z primitivních buněk autonomního nervového systému neurální lišty. Sdílejí spolu genu EWSR1, většinou EWSR1-ATF1 nebo EWSR-CREB1, a imunopozitivitu S100 a SOX10. Nádory, které exprimují navíc melanocytární markery HMB45, melan A nebo MITF, bývají označovány jako CCS. Je-li naopak spolu s S100 a SOX10 přítomna exprese neuroendokrinních/neurálních markerů jako synaptofyzinu, chromograninu nebo CD56, klasifikují se tyto nádory jako GNET (v nové WHO klasifikaci je sice v jednom odstavci uvedeno, že melanocytární markery jsou ve skupině CCS/GNET negativní, a hned v dalším, že jejich pozitivita svědčí pro CCS, což působí jako oxymoron, předpokládáme tedy, že jde o práci redakčního šotka).
GENETICKÉ NÁDOROVÉ SYNDROMY GASTROINTESTINÁLNÍHO SYSTÉMU
Podrobný popis jednotlivých syndromů projevujících se zvýšenou incidencí nádorů v tubulárním trávicím traktu je mimo možnosti tohoto přehledového článku. Zaměříme se tedy na terminologické změny, nově popsané syndromy a nové poznatky o fenotypické i genotypické variabilitě těchto dědičných onemocnění, jejichž souhrnný přehled s nejdůležitějšími informacemi uvádíme v upravené tabelární formě (tab. 12).
Tab. 12. Hereditární nádorové syndromy v GIT. 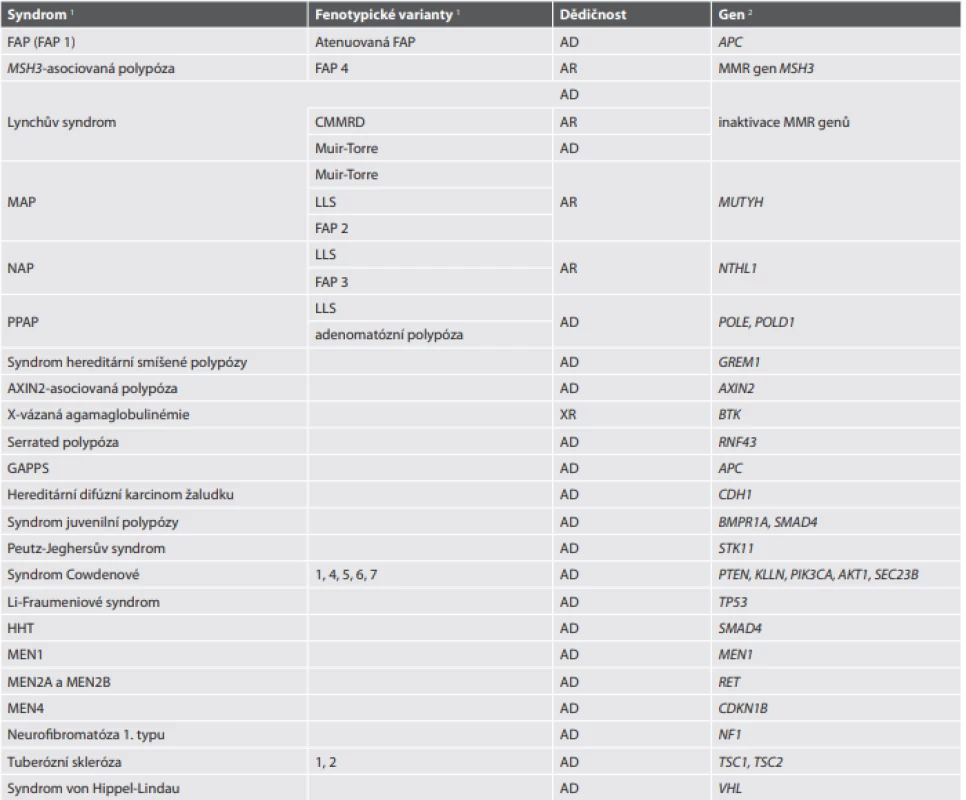
1 Vzhledem k množství zkratek vyskytujících se v této tabulce odkazujeme na úvodní Seznam použitých zkratek
2U některých, zejména vzácnějších syndromů uvedené genetické alterace charakterizují pouze (někdy značně minoritní) část případůVzhledem k tomu, že nová WHO klasifikace pojednává i o některých genetických nádorových syndromech, které nejsou asociovány se vznikem karcinomu, je zarážející, že v této kapitole nejsou zmíněny (a do tabelární formy zahrnuty) syndromy projevující se zvýšeným výskytem GIST, tedy syndrom familiárního GIST (způsobený germinální mutací genu KIT), jeho varianta podmíněná germinální mutací genu PDGFRA (někdy nazývaný PDGFRA-mutantní syndrom vzhledem k odlišnému fenotypu, který mimo jiné může zahrnovat i vícečetný výskyt IFP) a syndrom Carney-Stratakis, jehož genetickým podkladem je germinální mutace některého z genů kódujících podjednotky mitochondriální sukcinátdehydrogenázy (SDHx).
Familiární adenomatózní polypóza (FAP)
V nové WHO klasifikaci je FAP uváděna jako FAP 1, přičemž je ale poněkud matoucí, že se vůbec nezmiňuje FAP s jinými indexy. Z praktického hlediska je to sice správné rozhodnutí, protože numerické rozlišování jednotek je nepřehledné a obtížně zapamatovatelné (vzpomeňme zde členění Lynchova syndromu na typy 1-3 nebo GIST na typy 1 a 2), na druhou stranu se ovšem tedy zdá zbytečné použití indexu i v případě FAP 1. Pro zvídavé čtenáře však uvádíme přehled syndromů označovaných FAP 2-4 v tab. 12.
Obecně platí, že za FAP 1 je označován syndrom způsobený germinální mutací genu APC, tedy klasická familiární adenomatózní polypóza i její varianty jako atenuovaná FAP a z čistě genetického hlediska snad i nově popsaný syndrom žaludečního adenokarcinomu a proximální polypózy žaludku (gastric adenocarcinoma and proximal polyposis of the stomach, GAPSS), který má ale zase naopak vyhrazenou zvláštní kapitolu, protože má zcela odlišnou fenotypickou prezentaci. Doporučuje se nepoužívat nadále termíny Gardnerův syndrom (vzhledem k tomu, že údajně prakticky všichni pacienti s FAP mají některou z lézí definujících Gardnerův syndrom) a Turcotův syndrom, který je však přesto v dalším textu WHO klasifikace používán.
Označení FAP 2-4 přísluší v databázi OMIM syndromům, které mohou fenotypem napodobovat skutečnou FAP, mají však jiný genetický podklad. Jmenovitě jde o germinální mutace genů MUTYH, NTHL1 nebo MSH3. Situace je o to komplikovanější, že tyto syndromy, zejména MUTYH-asociovaná polypóza (MAP) a NTHL1-asociovaná polypóza (NAP), se kromě fenotypu napodobujícího FAP mohou prezentovat i jako Lynch-like syndrom (LLS) (tab. 12).
Syndrom žaludečního adenokarcinomu a proximální polypózy žaludku (GAPSS)
Tento výše již zmíněný syndrom byl popsán teprve nedávno a ve WHO klasifikaci je uveden poprvé. Jeho molekulárně genetickým podkladem je germinální mutace v oblasti promotoru 1B genu APC. Morfologickou prezentací je polypóza těla a fundu žaludku sestávající především z fundických glandulárních polypů (v menší míře mohou být zastoupeny i hyperplastické polypy nebo adenomy foveolárního typu). Arbitrárně bylo stanoveno diagnostické kritérium > 100 polypů u probanda a > 30 polypů u jeho příbuzných prvního stupně. Na rozdíl od klasické či atenuované FAP (při kterých může být též přítomna polypóza žaludku) není postiženo duodenum a kolorektum.
Lynchův syndrom (LS)
Vzhledem k tomu, že problematika LS byla v poslední době opakovaně a detailně diskutována jak na odborných fórech, tak na stránkách tohoto časopisu, omezíme se zde na připomenutí jeho fenotypických variant a problematiky Lynch-like syndromu (LLS).
Muir-Torre syndrom se vyznačuje přítomností premorbidního fenotypu ve formě kožních lézí charakterů keratoakantomů a sebaceózních nádorů. Nemusí však jít vždy pouze o variantu LS, tímto fenotypem se může prezentovat i MAP.
Syndrom konstitučního deficitu mismatch repair systému (constitutional mismatch repair deficiency, CMMRD) je podmíněn germinální bialelickou inaktivací některého z MMR genů. Na rozdíl od klasického Lynchova syndromu se projevuje polypózou, kožními lézemi napodobující neurofibromatózu 1. typu a zvýšeným výskytem hematologických malignit a mozkových nádorů, a to již v mladém až dětském věku. Podle současných poznatků je CMMRD příčinou většiny případů Turcotova syndromu.
Lynch-like syndrom (LLS) je definován průkazem MSI (nebo MMR deficience), absencí mutace BRAF a nepřítomností hypermetylace promotoru genu MLH1 s negativním průkazem germinálních mutací či epimutací asociovaných s LS. Z genetických příčin tohoto zdánlivě paradoxního stavu jsou známé zejména somatické bialelické inaktivace některého z MMR genů. Přestože by tyto somatické mutace měly být příčinou sporadických nádorů, ve skutečnosti se i za nimi může skrývat genetický nádorový syndrom. Mohou totiž být sekundárním důsledkem germinální inaktivace jiných genů účastnících se udržování integrity genomu. Kromě výše uvedené MAP a NAP byl fenotyp LLS popsán i u syndromu PPAP (polymerase proofreading-associated polyposis) způsobeného germinální mutací domén čtecího rámce genů polymeráz POLD1 a POLE (tab. 12).
Serrated polypóza
Tento geneticky dosud poněkud obskurní syndrom má nová klinická diagnostická kritéria. Kritérium 1 vyžaduje přítomnost ≥ 5 serrated lézí nebo polypů (tedy hyperplastických polypů, SSL, SSL-D, TSA a/nebo neklasifikovaných serrated adenomů) proximálně od rekta, které všechny musí mít maximální rozměr ≥ 5 mm a alespoň 2 z nich ≥ 10 mm. Kritérium 2 je definováno jako přítomnost > 20 serrated lézí nebo polypů jakékoli velikosti v celém tlustém střevě, z nichž alespoň 5 je lokalizováno proximálně od rekta. Přibližně čtvrtina pacientů s tímto syndromem splňuje podmínky kritéria 1, zatímco samotné kritérium 2 definuje asi 45 % pacientů. Zbytek případů splňuje definici obou kritérií.
Přestože tabelární forma uvádí jako genetický podklad serrated polypózy germinální mutace genu RNF43, vyskytují se tyto alterace pouze u 2 % pacientů splňujících klinická kritéria. Obraz serrated polypózy může součástí také MAP, syndromu hereditární smíšené polypózy, vzácně i syndromu Cowdenové či juvenilní polypózy, u většiny případů je však genetická příčina neznámá.
Syndrom Cowdenové
V literatuře je syndrom Cowdenové někdy uváděn jako synonymum PTEN-hamartomového syndromu. Není to tak úplně pravda, protože germinální inaktivací genu PTEN jsou způsobeny také fenotypicky odlišné syndromy Bannayan-Riley-Ruvalcaba a Proteus. A na druhou stranu neplatí ani to, že syndrom Cowdenové je geneticky charakterizován germinální alterací PTEN. Současná klasifikace totiž rozlišuje 5 podtypů tohoto syndromu, z nichž každý má jiný molekulárně genetický podklad (tab. 12).
ZÁVĚR
Vzhledem k mnoha oblastem charakteru „hic sunt leones“ a některým kontroverzním doporučením současné WHO klasifikace nádorů trávicího systému nezbývá než některé otevřené otázky řešit formou konsenzu na úrovni regionálních společností a s napětím očekávat její 6. vydání.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
Prof. MUDr. Ondřej Daum, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 523
e-mail: DAUM@fnplzen.cz
Zdroje
1. WHO Classification of Tumours Editorial Board. Digestive system tumours (5th ed). Lyon, France: IARC; 2019.
2. Amin MB. AJCC Cancer staging manual (8th ed). New York: Springer; 2017.
3. Brierley JD, Gospodarowicz MK, Wittekind C. TNM Klasifikace zhoubných novotvarů (8. vydání). Praha, ČR: ÚZIS; 2018.
4. Pant M, Pehlivanoglu B, Erbarut-Seven I, Adsay NV. Intra-ampullary papillary-tubular neoplasm: an update on the ampullary counterparts of pancreatobiliary intraductal neoplasms. AJSP: Reviews & Reports 2018; 23(1): 38-43.
5. Pai RK, Bettington M, Srivastava A, Rosty C. An update on the morphology and molecular pathology of serrated colorectal polyps and associated carcinomas. Mod Pathol 2019; 32(10): 1390-1415.
6. Carr NJ, Bibeau F, Bradley RF, et al. The histopathological classification, diagnosis and differential diagnosis of mucinous appendiceal neoplasms, appendiceal adenocarcinomas and pseudomyxoma peritonei. Histopathology 2017; 71(6): 847-858.
7. Laine L, Kaltenbach T, Barkun A, et al. SCENIC international consensus statement on surveillance and management of dysplasia in inflammatory bowel disease. Gastroenterology 2015; 148(3): 639-651.
8. Toon CW, Chou A, DeSilva K, et al. BRAFV600E immunohistochemistry in conjunction with mismatch repair status predicts survival in patients with colorectal cancer. Mod Pathol 2014; 27(5): 644-650.
9. Castle PE, Adcock R, Cuzick J, et al. Relationships of p16 immunohistochemistry and other biomarkers with diagnoses of cervical abnormalities: implications for LAST terminology. Arch Pathol Lab Med 2019, In press.
10. Daumová M, Vaňková B, Švajdler M, Michal M, Daum O. Imunohistochemie a molekulární genetika v diferenciální diagnostice mezenchymálních lézí gastrointestinálního traktu. Cesk Patol 2020, In press.
11. Agaimy A, Stoehr R, Vieth M, Hartmann A. Benign serrated colorectal fibroblastic polyps/intramucosal perineuriomas are true mixed epithelial-stromal polyps (hybrid hyperplastic polyp/mucosal perineurioma) with frequent BRAF mutations. Am J Surg Pathol 2010; 34(11): 1663-1671.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek ′ UROPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ PATOLOGIE ORL OBLASTIČlánek ′ PULMOPATOLOGIEČlánek ′ PATOLOGIE GITČlánek ′ HEPATOPATOLOGIEČlánek ′ PATOLOGIE MĚKKÝCH TKÁNÍČlánek ′ PULMOPATOLOGIEČlánek ′ NEFROPATOLOGIEČlánek ′ GYNEKOPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ CYTODIAGNOSTIKAČlánek ′ NEUROPATOLOGIEČlánek ′ GYNEKOPATOLOGIE
Článok vyšiel v časopiseČesko-slovenská patologie

2020 Číslo 4-
Všetky články tohto čísla
- Gastrointestinální trakt – WHO klasifikace, imunohistochemie a molekulární genetika
- Chtěl jsem být bankovní lupič, ale nevěděl jsem, kde se na to studuje
- ′ UROPATOLOGIE
- ′ PATOLOGIE SERÓZNÍCH POVRCHŮ
- ′ KARDIOPATOLOGIE
- ′ PATOLOGIE ORL OBLASTI
- ′ PULMOPATOLOGIE
- ′ PATOLOGIE GIT
- ′ HEPATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PULMOPATOLOGIE
- ′ NEFROPATOLOGIE
- ′ GYNEKOPATOLOGIE
- ′ KARDIOPATOLOGIE
- Novinky v páté verzi WHO klasifikace nádorů trávicího systému – 1. Gastrointestinální trakt
- ′ CYTODIAGNOSTIKA
- Novinky v histopatologické klasifikaci neuroendokrinních nádorů v 5. vydání WHO klasifikace nádorů trávicího traktu (2019)
- ′ NEUROPATOLOGIE
- Imunohistochemie a molekulární genetika v diferenciální diagnostice mezenchymálních lézí gastrointestinálního traktu
- Mucormycosis occurring in an immunocompetent patient: a case report and review of literature
- Myokarditida pravé komory srdeční indukovaná plicní trombembolií
- Prof. MUDr. Ľudovít Danihel, PhD. jubiluje.
- ′ GYNEKOPATOLOGIE
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Chtěl jsem být bankovní lupič, ale nevěděl jsem, kde se na to studuje
- Novinky v páté verzi WHO klasifikace nádorů trávicího systému – 1. Gastrointestinální trakt
- Prof. MUDr. Ľudovít Danihel, PhD. jubiluje.
- Novinky v histopatologické klasifikaci neuroendokrinních nádorů v 5. vydání WHO klasifikace nádorů trávicího traktu (2019)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



