-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mukormykóza: kazuistika
Mucormycosis: Case report
Mucormycosis is a fungal disease caused by fibrous saprophytic fungi called mucorales. The most important genera include Lichtheimia, Mucor and Rhizopus. For a weakened person they are pathogenic. The disease progression is serious, with high mortality. The clinical picture is varied, depending on the organ affected. We distinguish several main forms: rhino-cerebellar, pulmonary, cutaneous, disseminated, gastrointestinal and other rare forms. Our case concerns a less common gastrointestinal form that affected a patient after a lung transplant and was accompanied by perforation of a fungal ulcer of the gastric wall with bleeding and hemorrhagic shock.
Keywords:
mucormycosis – gastrointestinal form – high mortality
Autori: Jana Jakešová; Roman Boháč; Jan Betlach
Pôsobisko autorov: Oddělení patologie, Nemocnice Havlíčkův Brod
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 3, p. 166-168
Kategória: Původní práce
Súhrn
Mukormykózy jsou plísňová onemocnění způsobená vláknitými saprofytickými houbami zvanými mucorales. Mezi nejvýznamnější rody patří Lichtheimia, Mucor a Rhizopus. Patogenní jsou pro oslabeného člověka. Průběh bývá vážný s vysokou mortalitou. Klinický obraz je pestrý, v závislosti na postiženém orgánu. Rozlišujeme několik hlavních forem: rhino-orbito-cerebrální, plicní, kožní, diseminovanou, gastrointestinální a další vzácné formy. Náš případ se týká méně časté gastrointestinální formy, která postihla pacienta po transplantaci plic, a byla provázená perforací mykotického vředu žaludeční stěny s krvácením a hemoragickým šokem.
Klíčová slova:
mukormykóza – gastrointestinální forma – vysoká mortalita
Mukormykózy neboli zygomykózy jsou onemocnění způsobená vláknitými zygomycetami – pravými plísněmi zvanými mucorales. Mezi nejvýznamnější rody patří Lichtheimia (Absidia) spp., Rhizomucor spp., Mucor spp., Rhizopus spp., Cunninghamella spp., Saksenaea spp., a Apophysomyces spp. (1,2). Vyskytují se běžně v přírodě v saprofytické podobě, zejména v rozkládající se organické hmotě. Jejich konidie jsou hojně přítomny v prachu a snadno se šíří vzduchem (2,3). Patogenní jsou především pro oslabeného člověka, u kterého vyvolávají oportunní infekci, která není již dále nakažlivá (4,5).
Mucorales napadají především imunokompromitované pacienty – jako jsou pacienti s hematologickými malignitami, po transplantacích, s nekontrolovaným diabetem, s granulocytopenií, na dlouhodobé léčbě kortikoidy a podobně (6). Pacientů s imunosupresí přibývá a s tím narůstá i incidence těchto onemocnění (7). Na rozdíl od jiných vláknitých hub napadají ve vysokém procentu i imunokompetentní pacienty (8,9).
Průběh bývá vážný s vysokou mortalitou. V těle se šíří per continuitatem nebo hematogenně. Podle klinického obrazu rozlišujeme obvykle šest forem: rhino-orbito-cerebrální, plicní, kožní, gastrointestinální, diseminovanou a další vzácné formy onemocnění.
Nejčastější bývá rhino-orbito-cerebrální, která obvykle postihuje diabetiky (6). Infekce začíná inhalací spór, šíří se do paranasálních dutin, kde způsobuje nekrotizující sinusitidu, dále do orbity, kavernózních sinusů a do mozku. Projevuje se jednostrannou bolestí tváře, periorbitálním edémem, horečkou, parézami hlavových nervů a diplopií a černými nekrotickými lézemi na patře či nosní sliznici (5,7).
Plicní forma je častější u pacientů s hematologickými malignitami, neutropenií a po transplantacích solidních orgánů. Příznaky jsou nespecifické – horečka, kašel, dušnost, bolest na hrudi.
Kožní forma se rozvíjí po přímé inokulaci spór v místě poškozené kůže (trauma, popáleniny) a může zůstat lokalizovaná na kůži, šířit se do hlubších struktur nebo může dojít k hematogennímu rozsevu do dalších orgánů. Jako jedna z mála forem postihuje imunokompetentní pacienty a mívá lepší průběh (1).
Gastrointestinální forma je jednou z nejméně častých forem, rozvíjí se po spolknutí spór. Nejčastěji bývá lokalizována v žaludku. Postihuje nemocné po transplantaci a s hematologickými malignitami. Je také popisována u nezralých novorozenců. Projevuje se bolestí břicha, krvácením ze zažívacího traktu. Způsobuje nekrózu stěny trávicí trubice, její ulceraci a perforaci s následnou peritonitidou.
Diseminovaná forma je definovaná jako infekce postihující nejméně dva nesousedící orgány. Rozvíjí se především u pacientů v těžké imunosupresi a má nejvyšší mortalitu.
Mezi méně běžné formy patří infekce kostí, kloubů, endokarditida, peritonitida, pyelonefritida a lokalizovaná mozková forma (1,5,7).
Náš případ se týká málo běžné gastrointestinální formy mukormykózy.
POPIS PŘÍPADU
Pacient, hypertonik, diabetik, podstoupil ve svých 61 letech transplantaci plic pro intersticiální fibrotizující proces charakteru exogenní alergické alveolitidy, na poslední kontrole, která proběhla 3 měsíce od transplantace, bez potíží. Druhý den večer, po této kontrole, náhle dušný. Při příjezdu záchranné služby kolabující, hypotenzní. Ve voze záchranné služby porucha vědomí, s desaturací a rozvojem šokového stavu. Přivezen na oddělení ARO, kde známky masivního krvácení do horní části GIT, gastroskopicky bylo možno prohlédnout pouze jícen a vyloučit jako příčinu jícnové varixy, žaludek přeplněn endoskopicky neodstranitelnými sraženinami s patrným přítokem čerstvé krve. Přistoupeno k revizi na operačním sále – zde krvácení z a. lienalis narušené penetrujícím vředem proximální části žaludku. Provedena splenektomie, resekce proximální části žaludku, krvácení zastaveno, oběh se stabilizuje. Druhý den odpoledne opětovný rozvoj šokového stavu, druhá revize – krvácení z pankreatických cév při nekróze části pankreatu, i toto krvácení se daří zastavit a stav se stabilizuje, ponecháno ,,open abdomen“. Pacient přeložen na vyšší pracoviště do FN Motol, kde podstoupil ještě několik revizí s odstraněním nekrotické tkáně v oblasti pankreatu a nekrotické části tenkého střeva. Nakonec zemřel po necelém měsíci od začátku příznaků. Následovala pitva, jako příčina úmrtí stanovena sepse a hemoragický šok při dehiscenci enteroanastomózy.
Makroskopický nález
Na naše oddělení byla dodána proximální část žaludku 11 x 7 x 4 cm. U orálního resekčního okraje patrna perforace stěny žaludku průměru 5 cm s prokrvácenými, rozbředlými okraji (obr. 1), na okolní sliznici hemoragie. Ve vzdálenosti 3 cm od distálního okraje chirurgicky sešitá gastrotomie délky 7 cm. Připojeny ještě zbytky malého a velkého omenta. Dále slezina 12 x 10 x 6 cm, 315g (po fixaci), s hladkým povrchem, na řezu bez ložisek.
Obr. 1. Perforace stěny žaludku průměru 5cm s prokrvácenými, rozbředlými okraji, na okolní sliznici hemoragie. 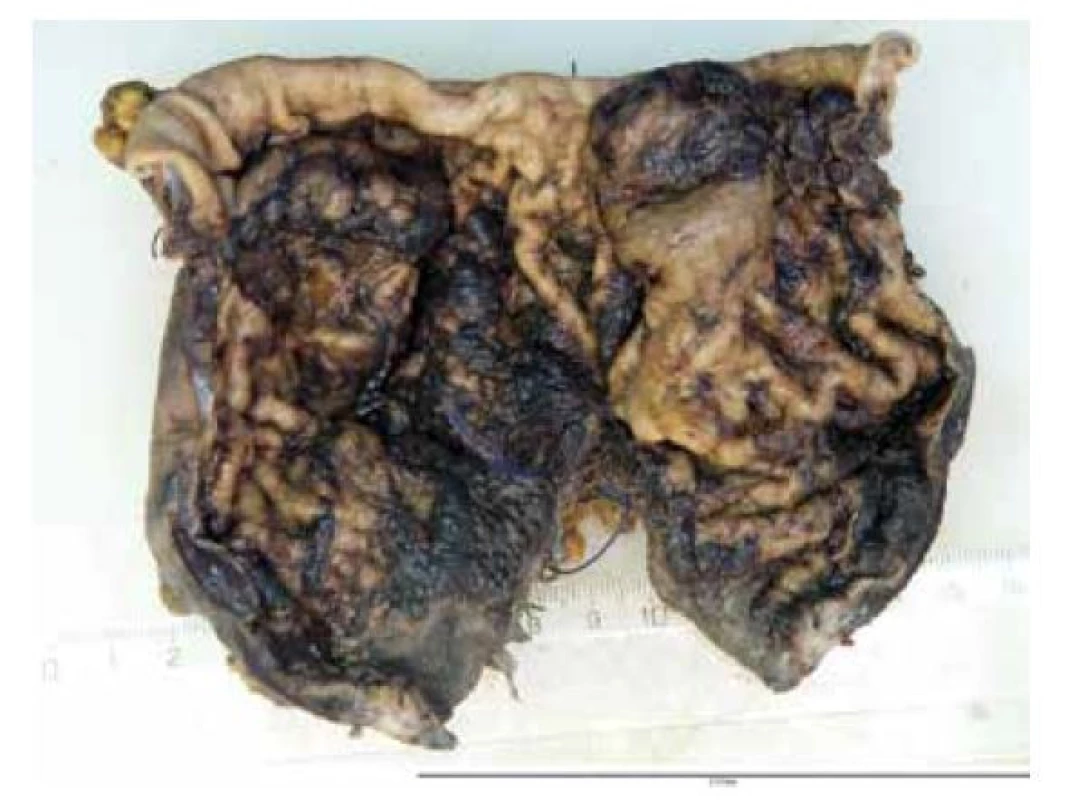
Mikroskopický nález
Odebrané vzorky fixovány v 10% formolu, zpracovány standardním způsobem a barveny hematoxylin-eosinem a speciálním barvením PAS. Histologicky zastižena žaludeční stěna krytá prokrvácenou korporální sliznicí s plošnými ulceracemi s nekrotickými hmotami. Na spodině až s chronicky hnisavě zánětlivě změněnou nespecifickou granulační tkání. Ložiskově nekróza transmurální s perforací stěny (obr. 2). Na seróze fibrinózně hnisavý zánět. V nekróze a buněčném detritu při okraji perforace přítomny PAS pozitivní mykotické struktury, tvořené širokými neseptovanými hyfami, větvícími se místy pod úhlem 90 stupňů (obr. 3).
Obr. 2. Žaludeční stěna krytá prokrvácenou korporální sliznicí s plošnými ulceracemi s nekrotickými hmotami (HE, 100x). 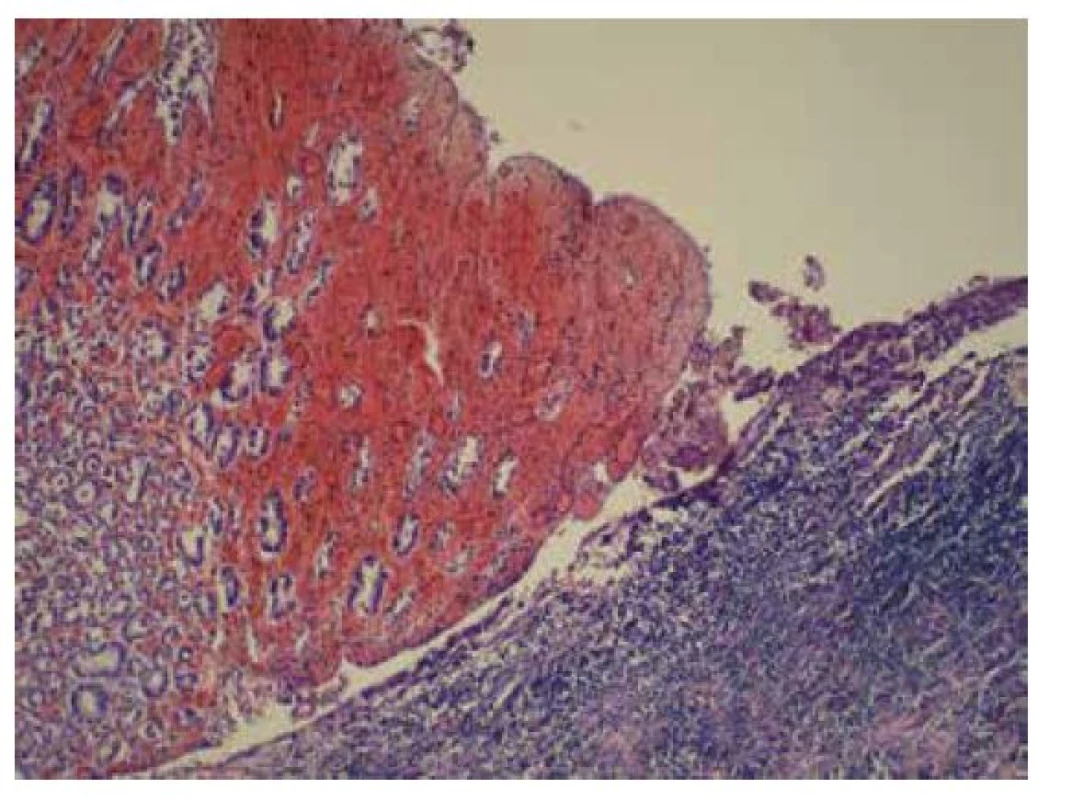
Obr. 3. A: V nekróze a buněčném detritu při okraji perforace přítomny mykotické struktury, tvořené širokými neseptovanými hyfami, větvícími se místy pod úhlem 90 stupňů (HE, 400x). B: Mykotické struktury pozitivní v barvení PAS (PAS, 400x). 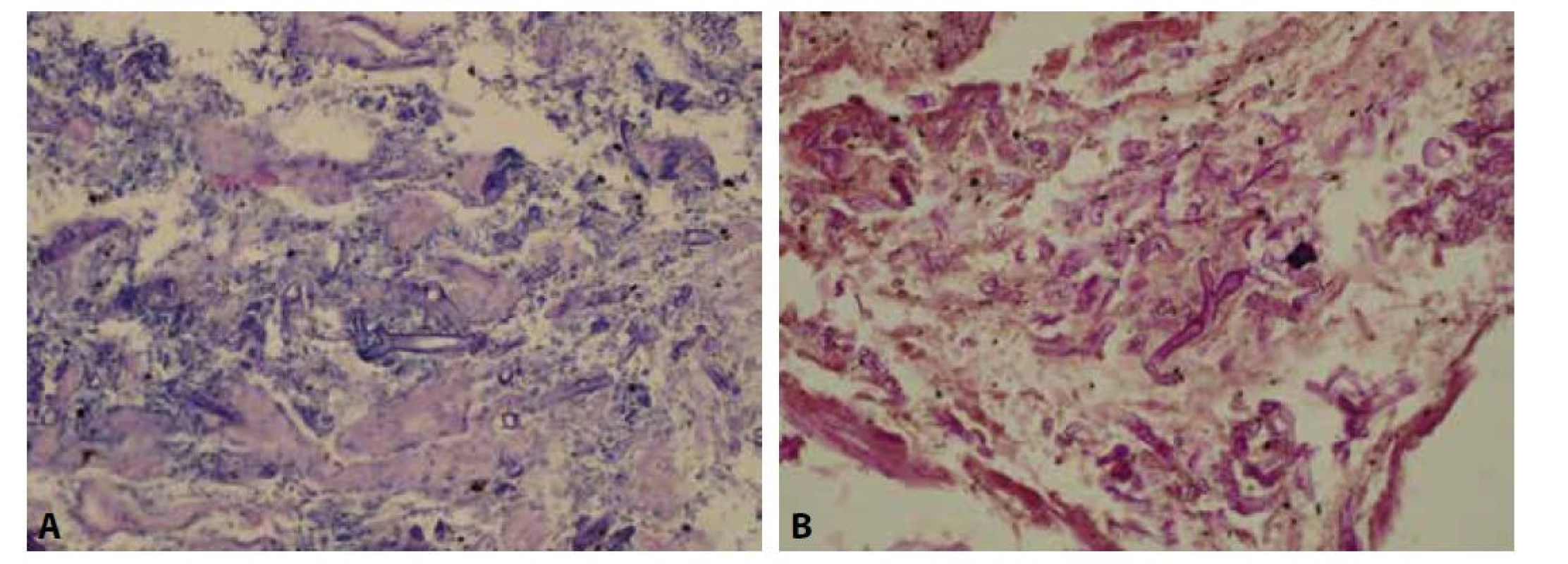
Slezina s kongescí, drobným trombem v jedné z žil v oblasti hilu, bez známek mykózy.
Ze vzorku žaludeční biopsie z parafínového bločku izolována DNA, která předána na Ústav lékařské mikrobiologie 2. LF UK a FN Motol. Zde provedena PCR mykotické DNA, která prokázala přítomnost mukormycety Rhizopus spp. Pro mykologické vyšetření se podařilo získat ve FN Motol během další revize dutiny břišní i nefixovanou tkáň z nekrotických hmot dutiny břišní a z pankreatu, kde rovněž potvrzena přítomnost mukormycety Rhizopus spp. metodou PCR a kultivací. Tato tkáň vyšetřena i fluorescenční mikroskopií, která odhalila silná mycelární vlákna, septa řídce větvená v pravých nebo ostrých úhlech, na koncích paličkovitě ztluštělá. Kromě mukormycet vykultivována i Candida spp. a Trichosporon asahii.
DISKUZE
Gastrointestinální forma mukormykózy patří mezi vzácnější formy, vyznačuje se vysokou mortalitou. Rozlišujeme formu primární a sekundární v rámci diseminované formy. Primární forma postihuje především pacienty po transplantaci solidních orgánů, jako v našem případě, nebo s hematologickou malignitou, či nezralé novorozence. Patogen se dostává do těla polknutím kontaminované potravy nebo kontaminovanými zdravotnickými pomůckami. Nejčastěji postihuje žaludek, dále tlusté a tenké střevo a jícen. Nejčastějšími příznaky jsou bolest břicha a krvácení do zažívacího traktu (meléna, hemateméza) (10). Při endoskopii jsou patrny ulcerace kryté nekrotickou tkání či vláknitou plísní (7). V našem případě toto patrno nebylo pro masivní koagula. Teprve při chirurgické revizi a odsátí koagul se objevil perforovaný vřed nekrotické stěny žaludku.
K průkazu zygomycet se odebírá biologický materiál a seškraby. Kvůli rychlosti a specificitě se v prvé řadě provádí mikroskopický průkaz: jsou kultivačně nenáročné, během 1-3 dnů vytvoří bílé, šedobílé nebo šedohnědé vatovité mycelium. Pro zygomycety je charakteristické neseptované či velmi řídce septované mycelium, kromě rodu Mucor tvoří tzv. rhizoidy, krátké kořínkovité útvary sloužící k ukotvení mycelia k povrchu. Mezi svazečky rhizoidů se vyklenují obloukovitě ohnuté hyfy, tzv. stolony. Z mycelia odstupují sporangiofory s kolumelou (hlavicí) se sporangiemi a s konidiemi (3,5).
Velký význam má histologické vyšetření, kromě samotných zygomycet je patrná postižená tkáň a její reakce.
V základním barvení hematoxylin-eosin se může obarvit pouze jejich stěna a jsou špatně viditelná. Speciální barvení – Grocott methenamin – silver (GMS) a periodic acid-Schiff (PAS) vlákna zviditelní. V poslední době je dostupná i imunohistochemie s monoklonální protilátkou proti Rhizopus arrhizus (1).
Histologicky proliferující mycelium bývá tlustší (5-25 μm) a neseptované s výraznou polymorfií s postranními zduřeními. Větví se neorganizovaně v ostrém i pravém úhlu. Invadující mycelium je mimořádně agresivní, prorůstá často do stěny cév, způsobuje nekrózu jejich stěn s následnou trombózou a infarktem spádové oblasti. Invaze do cév přispívá i k hematogennímu šíření a je negativním prognostickým faktorem. (10). Invaze do cév začíná interakcí mezi bílkovinou CotH na povrchu spór a endoteliálním regulačním proteinem pro glukózu GRP78. Expresi těchto proteinů, a tím i schopnost invazivního růstu zygomycet, zvyšuje hyperglykémie, ketoacidóza a přísun železa, což bývá u diabetiků a u pacientů s krvácející vředovou lézí (11). Zda měl vředovou lézi před infekcí mukormykózou i náš pacient zpětně posoudit nedokážeme.
Mukormycety se šíří i lymfogenně. Reakce organismu je různá. U pacientů s těžkou imunodeficiencí či v terminální fungémii nebývá žádná reakce. U akutně probíhajících infekcí (jako v našem případě) zastihneme obvykle hnisavě nekrotizují zánět. U protrahovaných případů pak granulomatózní reakci.
Kultivační průkaz je časově náročný a ne vždy se zdaří, může také dojít ke kontaminaci z prostředí. Umožňuje bližší specifikaci infekčního agens a určí jeho citlivost k antimykotikům (1,5).
V poslední době je velkým přínosem v diagnostice metoda PCR, kterou je možné provést z čerstvé, ale i z fixované tkáně zalité v parafinu. A testují se i neinvazivní metody – PCR detekce cirkulující DNA zygomycet v krvi (1).
Terapii je potřeba zahájit co nejdříve, jedná se o rychle postupující onemocnění. Zygomycety jsou navíc vysoce rezistentní. K léčbě se používá nejčastěji Amfotericin B v kombinaci s chirurgickým odstraněním postižené tkáně a úprava predisponujících faktorů (5,11). Mortalita i přes komplexní léčbu je stále vysoká. V souvislosti s nárůstem imunokompromitovaných pacientů a tohoto onemocnění vzrůstá i povědomí o této oportunní infekci, navíc se zkoušejí zavádět nové diagnostické metody, které by urychlily diagnostiku. To vše by mohlo vést do budoucna ke zlepšení prognózy těchto pacientů.
PODĚKOVÁNÍ
Děkujeme za spolupráci FN Motol, zvláště paní prim. Novákové Kodetové z Ústavu patologie a molekulární medicíny 2. LF UK a FNM.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Jana Jakešová
Oddělení patologie, Nemocnice Havlíčkův Brod
Husova 2624, 58022
tel: +420 569 472 457
e-mail: jana.jakesova@onhb.cz
Zdroje
1. Skiada A. Epidemiology and Diagnosis of Mucormycosis: An Update. Journal of Fungi 2020; 6(4): 265.
2. Kolářová L, et al. Obecná a klinická mikrobiologie (1. vydání). Praha: Galén; 2020 : 182 - 183.
3. Samson RA. Introduction to food-borne fungi (5th edn). Baarn: Centraalbureau voor Schimmelcultures; 1996 : 6.
4. Koďousek R. Mykózy – lékařsky významná mykotická onemocnění člověka (1. vydání). Olomouc: Univerzita Palackého v Olomouci; 2003 : 42-46.
5. Votava M, Růžička F, Woznicová V, et. al. Lékařská mikrobiologie vyšetřovací metody (1. vydání). Brno: Neptun; 2010 : 466-468.
6. Jeong W, Keighley C, Wolfe R, et al. The epidemiology and clinical manifestations of mucormycosis: a systematic review and meta - analysis of case reports. Clin Microbiol Infect 2019; 25(1): 26-34.
7. Serris A, Danion F, Lanternier F. Disease entities in mucormycosis. J Fungi. 2019; 14;5(1): 23.
8. Roden MM, Zaoutis TE, Buchanan WL, et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clin Infect Dis 2005; 41(5): 634-653.
9. Sanath AK, Nayak MT, Jd S, Malik SD, Aithal S. Mucormycosis occurring in an immunocompetent patient: a case report and review of literature. Cesk Patol 2020; 56(4): 223-226.
10. Uchida T, Okamoto M, Fujikawa K, et al. Gastric mucormycosis complicated by a gastropleural fistula, A case report and review of the literature. Medicine 2019; 98(48): 18142.
11. Pilmis B, Alanio A, Lortholary O, Lanternier F. Recent advances in the understanding and management of mucormycosis. F1000Res 2018; 7 : 1429.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek 'NEUROPATOLOGIEČlánek 'NEFROPATOLOGIEČlánek 'HEPATOPATOLOGIEČlánek 'ORTOPEDICKÁ PATOLOGIEČlánek 'KARDIOPATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE ORL OBLASTIČlánek 'PULMOPATOLOGIEČlánek 'UROPATOLOGIE
Článok vyšiel v časopiseČesko-slovenská patologie

2022 Číslo 3-
Všetky články tohto čísla
- Novinky ve WHO klasifikaci nádorů CNS 2021
- … obor paleontologie se v roce 1989 otevíral jenom v Leningradě …
- 'NEUROPATOLOGIE
- 'NEFROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'PULMOPATOLOGIE
- 'UROPATOLOGIE
- Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2021
- Efektivní schéma využívané v diagnostice nádorů CNS
- Molekulárně patologické profilování vybraných nádorů centrálního nervového systému metodou MLPA
- Nádory CNS – klinické a radiologické aspekty
- Obrovskobuněčný fibroblastom: kazuistika
- Mukormykóza: kazuistika
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2021
- Nádory CNS – klinické a radiologické aspekty
- Mukormykóza: kazuistika
- Obrovskobuněčný fibroblastom: kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



