-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hlavní změny ve WHO klasifikaci 2022 testikulárních tumorů
Key changes in WHO classification 2022 of testicular tumors
Compared to the WHO classification of the male genital tumors in 2016, minimal changes were introduced in the current WHO 2022. Classification of germ cell tumors remains the same as in the previous edition, dividing germ cell tumors into those derived from germ cell neoplasia in situ (GCNIS) and those independent of GCNIS. The group of GCNIS derived germ cell tumors is essentially unchanged. Most remarkable change was made to the chapter teratoma with somatic malignancy. Primitive neuroectodermal tumor (PNET), a particular type of somatic malignancy arising in the setting of teratoma, is currently termed embryonic-type neuroectodermal tumor (ENET). Diagnostic criteria for teratoma with somatic type malignancy have been mildly modified. Seminoma now belongs to the group of germinomas. There is one novel entity in the category of germ cell tumors independent of GCNIS, namely testicular neuroendocrine tumor, prepubertal type. Similar to other organ systems, the term carcinoid is no longer used.
Two new entities were introduced in the category of sex cord stromal tumors: myoid gonadal stromal tumor and signet ring stromal tumor. Diagnostic criteria for malignant sex cord stromal tumors were moderately changed. Mitotic activity is now assessed according to mm2 instead of historical assessment according to the number of mitoses per high power fields.
There is a new separate chapter named Genetic tumor syndromes. Intratubular large cell hyalinizing Sertoli cell neoplasia which arises exclusively in patients with Peutz-Jeghers syndrome, now belongs here. Large cell calcifying Sertoli cell tumor occurs as a hereditary tumor in patients with Carney complex as well as sporadically. Therefore, it is enlisted both in the chapter on sex cord tumors and as well as in genetic tumor syndromes. Well differentiated papillary mesothelial tumor was added as a new entity to the section of testicular adnexal tumors. Sertoliform cystadenoma, a tumor previously belonging to testicular adnexal tumors, is currently recognized as a subtype of Sertoli cell tumor.
Keywords:
testicular tumors – WHO classification 2022 – tumors of the testis
Autori: Květoslava Michalová 1,2
; Ondřej Hes 1,2; Michal Michal 1,2
Pôsobisko autorov: Šiklův ústav patologie, Lékařská fakulta Univerzity Karlovy v Plzni a Fakultní nemocnice Plzeň, Česká republika 1; Bioptická laboratoř s. r. o., Plzeň, Česká Republika 2
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 4, p. 198-204
Kategória: Přehledový článek
Súhrn
Pátá edice WHO klasifikace nádorů varlat z roku 2022 představila v porovnání s předchozí z roku 2016 minimum novinek. Členění germinálních tumorů na tumory odvozené od germinální in situ neoplazie (GCNIS) a tumory vznikající bez souvislosti s GCNIS bylo zcela přejato do WHO klasifikace 2022. Skupina germinálních tumorů odvozená od GCNIS zůstává téměř neměnná, nebyla obohacena o žádnou novou jednotku ani o žádnou nepřišla. Nejvýraznější novinkou je změna terminologie u somatické malignity v rámci postpubertálního teratomu: primitivní neuroektodermální tumor (PNET) byl přejmenován na neuroektodermální tumor embryonálního typu (ENET; embryonic-type neuroectodermal tumor). Drobně změněna byla rovněž diagnostická kritéria pro teratom se somatickým typem malignity. Seminom je nově řazen do skupiny germinomů. Ve skupině germinálních tumorů vznikajících bez souvislosti s GCNIS přibyla jedna nová samostatná jednotka, testikulární neuroendokrinní tumor prepubertálního typu. Od termínu karcinoid bylo, podobně jako v jiných oblastech, upuštěno.
Ve skupině sex cord stromálních tumorů přibyly 2 nové jednotky: myoidní gonadální stromální tumor a stromální nádor z prstenčitých buněk. Mírně se upravilo jedno z diagnostických kritérií malignity sex cord stromálních tumorů, nově se již mitotická aktivita hodnotí dle mm2 a nikoliv dle počtu mitóz na pole velkého zvětšení, jako tomu bylo v minulosti. Vzhledem k tomu, že intratubulární hyalinizující velkobuněčná neoplazie ze Sertoliho buněk (intratubular large cell hyalinizing Sertoli cell neoplasia) vzniká pouze v rámci Peutz-Jeghersova syndromu, byl tento tumor přeřazen do nově vzniklé sekce geneticky podmíněných nádorových syndromů urogenitálního traktu a není již samostatnou jednotkou mezi sex cord stromálními tumory. Velkobuněčný kalcifikující nádor ze Sertoliho buněk (large cell calcifying Sertoli cell tumor) se může vyskytovat jednak hereditárně, ve spojitosti s Carneyho komplexem, jednak sporadicky. Tento tumor je proto zařazen do obou sekcí. Změnami v adnexálních testikulárních tumorech je určení dobře diferencovaného papilárního mezoteliálního tumoru jako samostatné jednotky. Naopak, z této skupiny byl vyjmut Sertoliformní cystadenom. Ten je nově subtypem nádorů ze Sertoliho buněk.
Klíčová slova:
nádory varlat – testis – WHO klasifikace 2022
Potíže v diagnostice testikulárních tumorů činí jednak jejich obrovská morfologická diverzita, jednak jejich vzácnost. Více než 90% nádorů varlat tvoří germinální tumory. Historicky byly členěny na základě morfologických znaků a dělily se na čisté a smíšené. Postupem času vyšly najevo slabiny této klasifikace, dělení pouze dle morfologie vedlo ke smísení biologicky odlišných jednotek pod jeden diagnostický termín. WHO klasifikace z roku 2016 (1) přinesla velké změny v členění germinálních tumorů, tohoto dělení se drží i aktuální WHO klasifikace 2022 (2). Zásadní role v klasifikaci germinálních tumorů byla udělena prekurzorové lézi, kterou je germinální in situ neoplazie (GCNIS; germ cell neoplasia in situ). Na základě její přítomnosti či absence se vydělily dvě patogeneticky odlišné skupiny: 1) germinální tumory odvozené od GCNIS a 2) germinální tumory vznikající bez souvislosti s GCNIS. Germinální tumory odvozené od GCNIS je morfologicky pestrá, v ostatních aspektech však homogenní skupina nádorů. Jde o biologicky maligní tumory, zastoupené jednotky mají společné epidemiologické, cytogenetické a pochopitelně patogenetické znaky. Skupina germinálních tumorů vznikajících bez souvislosti s GCNIS je různorodá, biologicky benigní či indoletní, avšak bez dalších pojítek mezi zastoupenými tumory.
GCNIS je ve WHO klasifikaci 2022 řazena do kategorie neinvazivních germinálních tumorů spolu s dalšími dvěma lézemi: specializovanými formami intratubulární germinální neoplazie (např. intratubulární seminom, intratubulární embryonální karcinom) a gonadoblastomem. Gonadoblastom dříve patřil do kategorie smíšených germinálních a sex cord stromálních tumorů. Neoplastická je však pravděpodobně jen germinální komponenta, která roste na pozadí nezralých sex cord elementů. Nyní je gonadoblastom považován za in situ lézi s možným invazivním zvratem do seminomu. Z WHO klasifikace 2022 tudíž zcela vypadla kategorie smíšených germinálních a sex cord stromálních tumorů, v minulé klasifikaci reprezentována právě jen gonadoblastomem. Následující text je zaměřen pouze na léze, kterých se dotkly změny ve WHO klasifikaci 2022 nebo u kterých došlo v nedávné době k novým důležitým poznatkům.
GERMINÁLNÍ TUMORY
Seminom
Kategorie seminomu zůstala ve WHO klasifikaci 2022 v podstatě nezměněná. Drobná změna se udála pouze v zařazení seminomu do skupiny germinomů. Jelikož testikulární seminom je obdobný tumor jako ovariální dysgerminom a extragonadální germinom, je do budoucna snaha terminologii sjednotit (3). To však zatím nenastalo, z důvodu zdůraznění příbuznosti s obdobnými tumory vznikajícími v jiných lokalizacích nastala pouze změna kategorizace pod skupinu germinomu. Stejně jako v předchozí klasifikaci nejsou uznávány morfologické varianty seminomu (např. anaplastický, tubulární, na stroma bohatý) jako samostatné subvarianty, jejich znalost slouží pouze k diagnostickým účelům. Z praktických důvodů je uznávána pouze jedna varianta, a to seminom se syncytiotrofoblastickými elementy. Tento typ seminomu může navíc laboratorně vykazovat zvýšené hodnoty hCG a vést tak k záměně za choriokarcinom. Seminom se syncytiotrofoblastickými elementy se ovšem prognosticky nijak neliší od běžného seminomu a bylo by chybou k němu terapeuticky přistupovat jako k non-seminomu (v případě chybné diagnózy smíšeného germinálního tumoru s komponentami seminomu a choriokarcinomu by byl z léčebného hlediska považován za non-seminom). Zvýšenou hodnotu hCG však mohou vzácně mít i seminomy bez syncytiotrofoblastických elementů, zdrojem elevace hCG jsou v těchto případech pravděpodobně buňky seminomu (4).
Teratom se somatickým typem malignity
Jde o teratom, který obsahuje non-teratomovou somatickou maligní komponentu. Somatický typ malignity se vyskytuje asi v 5% případů testikulárních teratomů a přisuzuje se maligní transformaci určitých elementů v teratomech, nejčastěji do podoby sarkomu či karcinomu (5). WHO klasifikace 2022 zde upravila diagnostická kritéria. Teratom se somatickým typem malignity může být diagnostikován za předpokladu, že somatická malignita tvoří v teratomu alespoň 5mm2 nádorové plochy. Musí se jednat o oblast tvořenou čistě somatickou malignitou, bez účasti komponent teratomu (pokud by byla takto veliká oblast smísena s teratomem, správná diagnóza je v takovém případě postpubertální teratom). Dříve se k diagnóze sice rovněž uznávalo toto kritérium, ale alternativně ještě záchyt somatické malignity na ploše zabírající alespoň 1 pole malého zvětšení (4x objektiv). Vzhledem k tomu, že velikost objektivů se u různých typů mikroskopů může lišit, šlo o nepřesné kritérium, od kterého je ve WHO klasifikaci 2022 snaha upustit. V praxi se můžeme setkat i s případy, kdy budou malé okrsky (menší než diagnostické pro somatickou malignitu) atypických mezenchymálních či epitelových buněk přítomny v několika blocích, smísené s komponentami teratomu či odděleně od něj. Pokud součet délky jednotlivých okrsků somatické malignity splňuje rozměr 5mm2, lze i takové případy diagnostikovat jako teratom se somatickým typem malignity (2). Je důležité mít na paměti, že postpubertální teratomy běžně vykazují cytologické atypie, které v případě epitelové komponenty mohou dosahovat až vzhledu high grade dysplazie či v případě chrupavky chondrosarkomu grade 1. Tyto atypie však patří do obrazu postpubertálního teratomu, reflektují jeho původ v maligní germinální kmenové buňce a neopravňují patologa k diagnóze teratomu se somatickým typem malignity.
Neuroektodermální tumor embryonálního typu (embryonic-type neuroectodermal tumor; ENET) patří mezi relativně časté typy somatických malignit patří. ENET je dle WHO klasifikace z roku 2022 novým termínem pro nádory dříve známé jako primitivní neuroektodermální tumor (PNET) (6-9). Testikulární ENET vyrůstají jako somatická malignita v rámci germinálních tumorů a jejich původem je nezralý neuroektoderm. Jde o tumory podobné tzv. embryonálním tumorům (embryonal tumors with multilayered rossettes) centrálního nervového systému (10), dříve nazývané PNET centrálního typu (Obr. 1). Změna terminologie v testikulární patologii byla nevyhnutelná, neboť s publikací WHO klasifikace centrálního nervového systému z roku 2016 termín PNET centrálního typu zanikl. Důvodem pro odlišnou terminologii od podobných nádorů v CNS (11), byla snaha o jasné odlišení této léze od testikulárního embryonálního karcinomu. ENET postrádají translokaci 22.chromozomu, jsou tedy odlišné od Ewingova sarkomu (12). Jelikož pro Ewingův sarkom býval PNET synonymem, dřívější terminologie k záměně sváděla. Ewingův sarkom se ve varleti ve zcela raritních případech rovněž vyskytuje (13,14), avšak bez souvislosti s tumorem jiného typu.
Obr. 1. Charakteristickým histologickým obrazem neuroektodermálního tumoru embryonálního typu (ENET) jsou tubulárně a rozetovitě uspořádané primitivní neurální buňky s hyperchromními jádry a malým množstvím cytoplazmy. 
Imunohistochemické znaky teratomů se somatickým typem malignity kopírují somatické protějšky jiných orgánů. Podobnost s germinálními tumory může značit pouze marker SALL4, s nímž si tyto tumory v různé míře zachovávají reaktivitu (15). Molekulárně geneticky je však teratom se somatickým typem malignity je analogický „klasickému“ teratomu a tímto germinálním tumorům odvozeným od GCNIS (2).
Nález somatické malignity v testikulárním tumoru však není rovnítkem pro teratom se somatickým typem malignity. Nedávná publikace studující 124 tumorů klasifikovaných jako teratom se somatickým typem malignity prokázala, že signifikantní počet těchto lézí ve skutečnosti představují nádory ze žloutkového váčku: glandulárně-alveolární typ v případě lézí diagnostikovaných jako karcinom vyrůstající z teratomu či sarkomatoidní typ v případě sarkomu vyrůstajícího z teratomu (15). Autoři diagnózu glandulární formy nádoru ze žloutkového váčku opírali o reaktivitu s glypicanem 3 a AFP a negativitu s CK7 a EMA. Dále vypozorovali, že glandulární forma nádoru ze žloutkového váčku nese často endometroidní diferenciaci, kdežto karcinom v rámci teratomů má spíše mucinózní či enterickou diferenciaci. Tumory finálně klasifikované jako sarkomatoidní nádory ze žloutkového váčku byly pozitivní se SALL4, glypicanem 3 a AE1/3, kdežto sarkomy v rámci teratomů byly negativní. Jako diskriminačně nevýznamný se v této diferenciální diagnóze ukázal AFP, neboť byl v obou typech tumorů negativní (15).
Všeobecně lze říct, že nález somatického typu malignity znamená výrazně horší prognózu, pokud je přítomen v metastáze germinálního tumoru. Naopak, nemusí tomu tak být v případě, kdy se nachází pouze v primárním nádoru (16-19). Prognóza tumorů lokalizovaných v testis je určena stadiem (stage) tumoru. Terapeutická odpověď na chemoterapii cisplatinou bývá u somatických malignit nedostatečná (16), tyto tumory někdy lépe zabírají na specifické typy chemoterapie užívané k léčbě konkrétních somatických malignit (20).
Teratom prepubertálního typu
U teratomu prepubertálního typu nedošlo ve WHO klasifikaci 2022 k žádným změnám, budou proto zmíněny jen některé relativně nové a praktické poznatky. Prepubertální teratom patří do skupiny germinálních tumorů vznikajících bez souvislosti s GCNIS. Jde o benigní tumor bez metastatického potenciálu (1). Rozlišení od postpubertálního typu teratomu je tudíž zásadní, neboť pacienti s prepubertálním typem teratomu jsou léčeni pouze chirurgicky (orchidektomie či resekce nádorového ložiska) a jsou ušetřeni chemoterapie i zařazení do sledovacích (follow-up) programů. Tyto tumory se nejčastěji vyskytují před 6.rokem věku (1). Histologicky se nejčastěji vyskytují v čisté formě, zastoupené tkáně nemají cytologické atypie, jsou diferencované („zralé“). V okolí tumoru chybí GCNIS a dysgenetické změny testikulárního parenchymu (významná tubulární atrofie, tubulární skleróza, mikrolitiáza, Sertoli cell-only tubuly).
Molekulárně geneticky jsou diploidní, nenesou žádné genetické abnormality. Amplifikace chromozomu 12p (i12p) z definice chybí. (1). Čisté teratomy bez cytologických atypií, bez nezralých oblastí, bez známek dysgeneze a GCNIS v okolním parenchymu, a zároveň tumory vyskytující se u prepubertálních pacientů, mohou být diagnostikovány jako benigní prepubertální teratom i bez molekulárně genetického vyšetření (21).
Ve vzácných, avšak dobře zdokumentovaných případech, se prepubertální typ teratomu vyskytuje i u dospělých pacientů (21,22). Takové tumory jsou ve všech aspektech identické prepubertálním typům tumorů vyskytujícím se u věkově odpovídajících pacientů. Avšak vzhledem k malému počtu popsaných případů a z toho plynoucích neukotvených morfologických kritérií musí být diagnóza prepubertálního teratomu u postpubertálního pacienta vždy potvrzena molekulárně genetickým vyšetřením (metodou FISH prokazující absenci amplifikace 12p, jakožto i dalších molekulárních abnormalit) (21). Pokud se nepodaří absenci alterace chromozomu 12p doložit, např. vlivem technických problémů, měl by být tumor považován za postpubertální teratom a pacient adekvátně sledován (21).
Testikulární neuroendokrinní tumor prepubertálního typu
Jde o velmi vzácný tumor, který je ve WHO klasifikaci 2022 novou jednotkou. Dříve se považoval za specializovaný subtyp prepubertálního teratomu a nazýval se karcinoid (1,21,23). U prepubertálních pacientů se ve varleti nejčastěji vyskytuje v čisté formě, vzácněji ho lze nalézt společně s teratomem (buď s prepubertálním teratomem či jeho podtypy - dermoidní či epidermoidní cystou). Imunomorfologicky jsou tyto tumory identické neuroendokrinním tumorům dobře známým z gastrointestinálního traktu, hlavně z tenkého střeva (Obr. 2). Protože dobře diferencovaný primární neuroendokrinní tumor se vyskytuje rovněž u postpubertálních pacientů, byla navržena morfologická kritéria: tumor musí být dobře diferencovaný, s nízkým mitotickým indexem (Ki-67 menší než 2%), bez nekróz. Pokud se současně vyskytuje teratom, musí být prepubertálního typu. Jedině takové léze mají podle publikovaných dat (1,21,23-25) prognózu analogickou s prepubertálními teratomy, nevyžadují tedy kromě chirurgického odstranění tumoru další terapii ani sledování pacienta. Atypické neuroendokrinní tumory či dobře diferencované neuroendokrinní tumory ve spojení s postpubertálním typem teratomu se ve varleti rovněž vyskytují a pravděpodobně mají metastatický potenciál vyžadující odlišnou terapii (25,26). Vzhledem k vzácnosti neuroendokrinních testikulárních tumorů se však s přibývajícím počtem dat budou jejich diagnostická kritéria pravděpodobně modifikovat.
Obr. 2. Testikulární neuroendokrinní tumor prepubertálního typu je histologicky identický neuroendokrinním tumorům gastrointestinálního traktu. 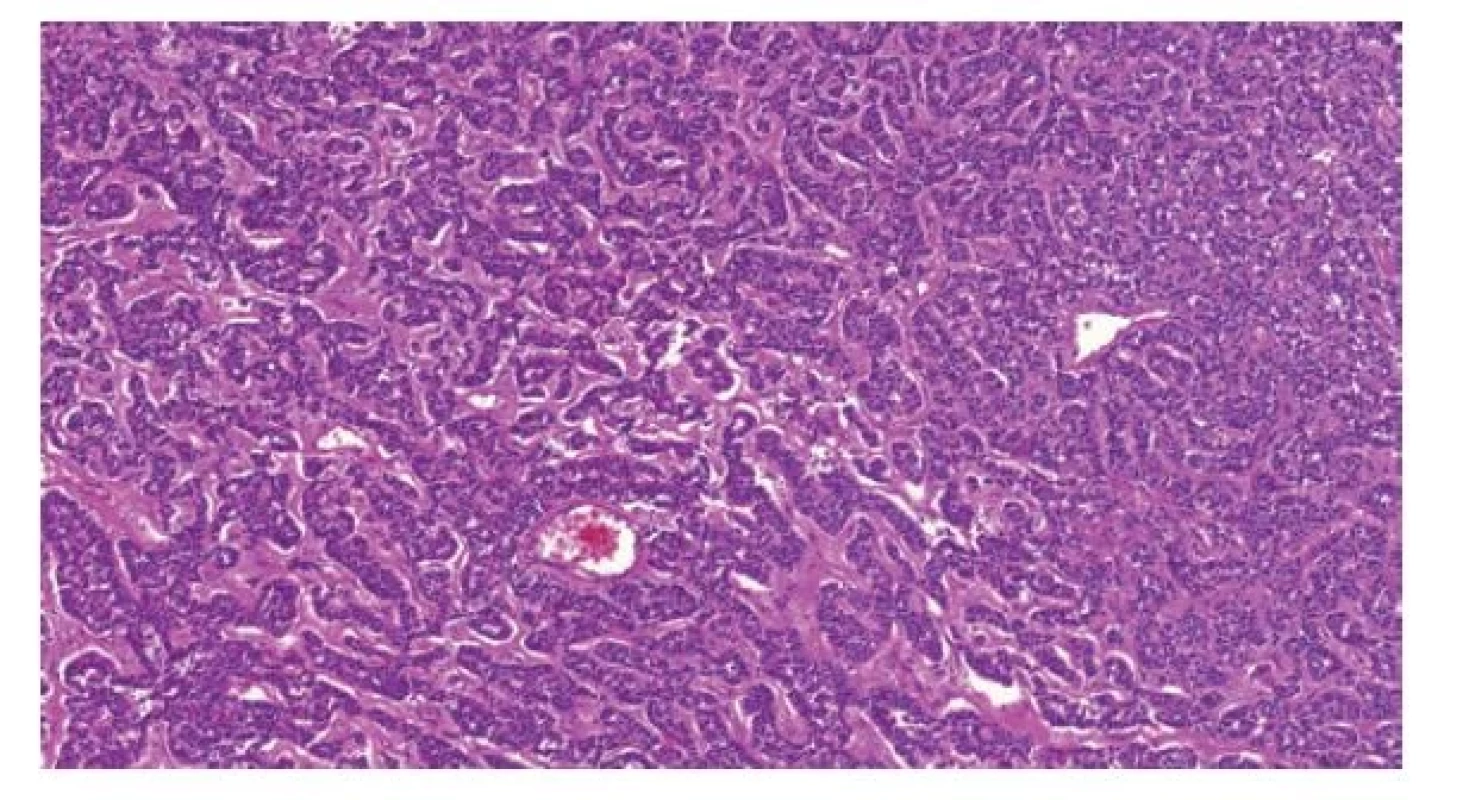
Spermatocytický tumor
Ve WHO klasifikaci 2022 nenastala u tohoto tumoru žádná změna. Spermatocytický tumor je považován za benigní. Agresivní chování lze pozorovat pouze u spermatocytických tumorů asociovaných se sarkomem. Je však evidentní, že existují určité přechodné formy. Byly publikovány případy spermatocytických tumorů, které vykazovaly metastatický potenciál. Molekulárně geneticky měly amplifikaci chromozomu 12p, což je známá alterace určující germinální tumory derivované od GCNIS. Většina těchto tumorů byla morfologicky více atypická než klasická forma (tzv. anaplastický spermatocytický tumor (27-30) (Obr. 3)), byl však popsán i případ s klasickou morfologií (31). K tomu, aby se tento objev odrazil ve WHO klasifikaci, je zatím reportováno málo případů.
Obr. 3. Anaplastický spermatocytický tumor. Histologicky jde o tumor uniformního vzhledu, což je dáno přítomností pouze intermediárního typu buněk (klasický spermatocytický tumor je charakterizován nádorovými buňkami třech velikostí). 
SEX CORD STROMÁLNÍ TUMORY
Diagnostika sex cord stromálních tumorů je obtížná vzhledem k jejich vzácnosti a heterogenitě. Zvláštní potíž činí stanovení jejich biologického potenciálu. Značná část sex cord stromálních tumorů nemá vzhled jasně benigního nádoru, avšak nejsou přítomné ani jednoznačné znaky malignity. V těchto případech se nelze vyjádřit s jistotou k prognóze a až vznik či absence metastáz rozhoduje o biologickém chování tumoru. Z morfologického hlediska podporují maligní chování tumoru tyto znaky: tumor větší než 5 cm v největším rozměru, nekrózy, zvýšená mitotická aktivita (hodnotí se rovněž již jen dle počtu mitóz na mm2, kolik mitóz je však určujících pro malignitu není specifikováno), infitrativní růst mimo varle a angioinvaze (3).
WHO klasifikace 2022 uznává 2 nové samostatné jednotky: myoidní gonadální stromální tumor a stromální nádor z prstenčitých buněk. Dále nastala změna terminologie: neklasifikované sex cord stromální tumory jsou nyní pojmenované „sex cord stromální tumory, NOS“. Důvodem změny názvu je skutečnost, že termín „neklasifikovaný“ byl často nesprávně zaměňován za dediferencovaný a názvy těchto tumorů tudíž nesprávně implikovaly špatné biologické chování. Ve skutečnosti jde však pouze o nezařaditelné tumory, které mohou být histopatologicky jednoznačně benigní, pouze svou imunomorfologií nespadají pod žádnou definovanou jednotku.
Myoidní gonadální stromální tumor
Ve WHO klasifikaci 2016 byl tento tumor zařazen jako nově vznikající jednotka (emerging entity), nyní je novou nádorovou jednotkou. Myoidní gonadální stromální tumor se oddělil z heterogenní skupiny inkompletně diferencovaných sex cord gonadálních stromálních tumorů. Je to velmi vzácný tumor, doposud bylo publikováno celkem 16 případů (32-40), největší série popisuje 4 případy (38). Myoidní gonadální stromální tumor vykazuje diferenciaci na pomezí hladké svaloviny a sex cord gonadálního stromatu. Jeho původem jsou pravděpodobně intertubulární primitivní mezenchymální buňky, které prošly myogenní diferenciací (34,35). Medián výskytu je 40 let (38). Tumory jsou unilaterální, bez endokrinní aktivity. Makroskopicky jsou to dobře ohraničené, malé tumory velikosti 1,2-3,5 cm (34). Většina případů se nachází v blízkosti rete testis. Histologicky jde o celulární solidně rostoucí tumory složené z blandních vřetenitých fascikulárně uspořádaných buněk s eozinofilní cytoplazmou, promíchaných s variabilním množstvím kolagenních vláken (Obr. 4). Jádra jsou rovněž bez atypií, protáhlá, některá mohou mít zářezy. Imunohistochemicky nádorové buňky exprimují hladkosvalový aktin, FOXL2, SF-1 a S100 protein a negativní reakci vykazují s h-caldesmonem, calretininem, SOX9, CD34 (41,42). Inhibin je pozitivní většinou slabě a fokálně (1,42). Průkaz desminu, calponinu a WT1 je variabilní (34). Rovněž je popisována pozitivita s AE1/3, což potvrzují i naše zkušenosti s těmito tumory (37). Kritériem k diagnóze je vřetenobuněčná morfologie, absence sex cord elementů a imunoreaktivita s S100 proteinem a hladkosvalovým aktinem (38). Molekulárně geneticky zatím nebyly prokázány žádné diagnosticky užitečné alterace (38). Všechny reportované případy myoidních gonadálních stromálních tumorů měly benigní průběh.
Obr. 4. Myoidní gonadální stromální tumor roste solidně, je celulární a často se vyskytuje v blízkosti rete testis (A). Nádorové buňky jsou vřetenité a fascikulárně uspořádané (B). 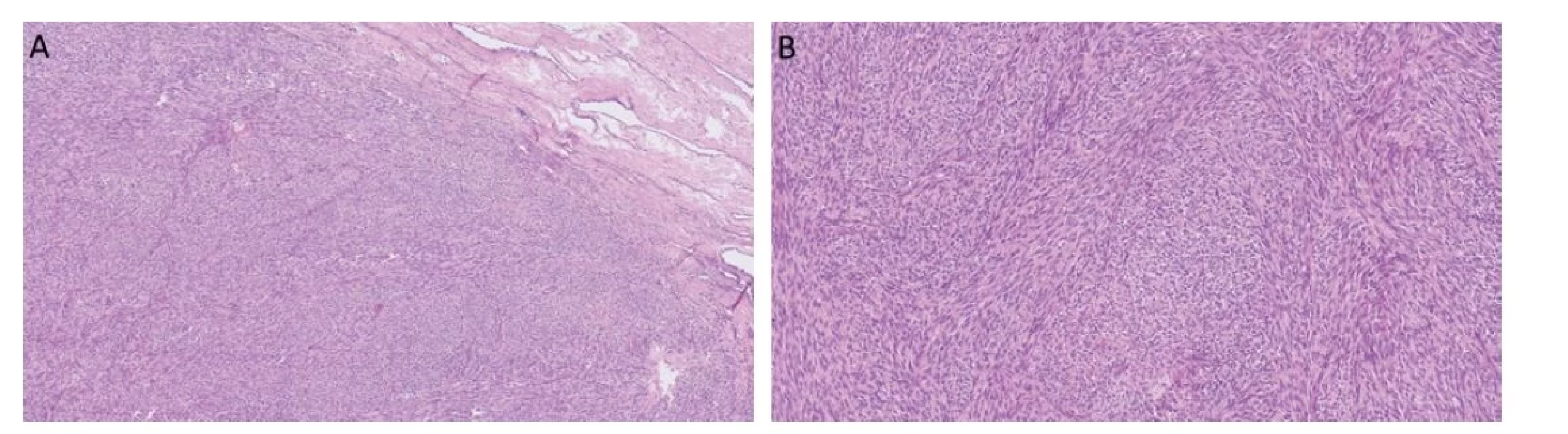
Stromální nádor z prstenčitých buněk
Tento tumor je ve WHO klasifikaci 2022 novou jednotkou. Identický tumor je znám v ovariu (43). Testikulární stromální nádor z prstenčitých buněk je mnohými, i přes jeho přijetí do WHO klasifikace 2022, považován za podtyp nádorů ze Sertoliho buněk.
Jde o benigní tumor, bývá dobře ohraničený, histologicky je složen z prstenčitých či eozinofilních buněk poskládaných nejčastěji solidně či trabekulárně ve variabilním množství fibrózního stromatu. Imunohistochemicky je konzistentně pozitivní v reakci s beta-cateninem (Obr. 5), CD10, cyclinem D1 a negativní s inhibinem a calretininem. Molekulárně geneticky jsou tumory charakterizovány rovněž konzistentním záchytem mutace genu CTNNB1 v exonu 3 – genu kódujícího beta-catenin.
Obr. 5. Stromální nádor z prstenčitých buněk je histologicky složen z prstenčitých či eozinofilních buněk. Existují nádory s čistě prstenčitou či eozinofilní morfologií. Často lze však zastihnout obě komponenty v jednom tumoru (A). Prstenčité buňky jsou blandní, cytoplazmatická vakuola je prázdná, neobsahuje mucin ani jiné substance (B). Tumory mají variabilní množství fibrózního stromatu, v některých případech stromální složka tumoru dominuje (C). Imunohistochemicky jsou tyto tumory konzistentně nukleárně pozitivní v reakci s beta-cateninem. 
Stromální nádor z prstenčitých buněk se morfologicky překrývá se solidním pseudopapilárním tumorem pankreatu. Imunohistochemicky i molekulárně geneticky jsou tyto jednotky identické. Ve varleti solidní pseudopapilární tumor uznáván není, tyto léze jsou řazeny pod nádory ze Sertoliho buněk. Solidní pseudopapilární tumor je již dlouhodobě uznávanou jednotkou v ovariální patologii (44-47) a je zřejmé, že i varleti nepochybně existuje (48-51). Jelikož není příliš logické, aby se identické tumory v ovariu nazývaly solidními pseudopapilárními tumory a ve varleti patřily pod nádory ze Sertoliho buněk, je možné, že se v budoucnosti dočká klasifikace těchto tumorů ještě dalších modifikací.
Ačkoliv je metastáza karcinomu do varlete raritní záležitostí (na rozdíl od ovariální patologie), je důležité tyto léze umět odlišit. Stromální nádor z prstenčitých buněk se liší blandním vzhledem prstenčitých buněk, jejichž cytoplazmatická vakuola je prázdná, neobsahuje mucin ani jiné substance.
ADNEXÁLNÍ TUMORY
Dobře diferencovaný papilární mezoteliální tumor
Tento tumor se v nové WHO klasifikaci oddělil od adenomatoidního tumoru a maligního mezoteliomu. Je to v této lokalizaci velmi vzácná léze s původem v tunica vaginalis testis. Klinicky se manifestuje nejčastěji jako hydrokéla (52). Většina případů nemá souvislost s expozicí azbestu, vzácně však takové případy popsány byly (53). Dobře diferencované papilární mezoteliální tumory rostou papilárně či tubulárně, cytologicky se podobají nenádorovému mezotelu. Invaze do stromatu chybí. Dle WHO klasifikace 2022 mohou být jako dobře diferencované papilární mezoteliální tumory akceptovatelné i léze s minimální stromální invazí. WHO klasifikace toto kritérium však dále nerozvádí. Zdroj, ze kterého vychází (54), popisuje tato invazní ložiska jako malou oblast v rámci celého tumoru (blíže nespecifikováno) tvořenou blandními mezoteliálními buňkami ve fibrózním stromatu, solidními oblastmi blandních mezoteliálních či vřetenitých buněk a v menšině případů i jako cytologicky více atypické mezotelie zformované do solidních útvarů či žlázových struktur. Invazivní ložiska byla uložena většinou povrchově a omezena na polypózní část tumoru, byl zde však zahrnut i případ s invazí do tukové tkáně a případ s několika invazními ložisky. Tyto případy měly tendenci recidivovat, avšak nemetastazovaly.
Případy, které mají navíc k typickým tubulárním a papilárním strukturám i okrsky s komplexní (solidní či kribriformní) architektonikou a/nebo zvýšenou mitotickou aktivitu, by měly být nazývány „mezoteliomy nejasného maligního potenciálu“ (55,56). U dobře diferencovaných papilárních mezoteliomů je, na rozdíl od maligních mezoteliomů, imunohistochemická exprese proteinu BAP1 intaktní (zachovaná nukleární pozitivita) (53). Dle aktuálního konsenzu by se diagnóza dobře diferencovaného papilárního mezoteliálního tumoru měla opírat o blandní cytomorfologické znaky, absenci invaze či minimální invazi, imunoreaktivitu s mezoteliálními markery (např. calretinin, WT1, D2-40) a absenci molekulárně genetických znaků vyskytujících se v maligním mezoteliomu (delece genu CDKN2A). Ačkoliv je dobře diferencovaný papilární mezoteliální tumor považován za benigní, vzhledem k malému počtu případů a zjevně doposud ne zcela jasným inkluzním kritériím je po chirurgickém odstranění tumoru doporučeno pacienty sledovat (57).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Květoslava Michalová, Ph.D.
Bioptická laboratoř s.r.o.
Mikulášské nám. 4, 326 00 Plzeň
email: kveta.michalova@biopticka.cz
Zdroje
1. Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part A: Renal, Penile, and Testicular Tumours. Eur Urol 2016; 70(1): 93 - 105.
2. WHO Classification of Tumours Editorial Board. Urinary and male genital tumours (5th ed). Lyon: International Agency for Research on Cancer; 2022.
3. Berney DM, Cree I, Rao V, et al. An Introduction to the WHO 5(th) Edition 2022 Classification of Testicular tumours. Histopathology In press 2022.
4. Hes O, Pivovarcikova K, Stehlik J, et al. Choriogonadotropin positive seminoma-a clinicopathological and molecular genetic study of 15 cases. Ann Diagn Pathol 2014; 18(2): 89 - 94.
5. Ulbright TM, Loehrer PJ, Roth LM, et al. The development of non-germ cell malignancies within germ cell tumors. A clinicopathologic study of 11 cases. Cancer 1984; 54(9): 1824 - 1833.
6. Ganjoo KN, Foster RS, Michael H, Donohue JP, Einhorn LH. Germ cell tumor associated primitive neuroectodermal tumors. J Urol 2001; 165(5): 1514-1516.
7. Kato K, Ijiri R, Tanaka Y, et al. Testicular immature teratoma with primitive neuroectodermal tumor in early childhood. J Urol 2000; 164(6): 2068-2069.
8. Michael H, Hull MT, Ulbright TM, Foster RS, Miller KD. Primitive neuroectodermal tumors arising in testicular germ cell neoplasms. Am J Surg Pathol 1997; 21(8): 896-904.
9. Flood TA, Ulbright TM, Hirsch MS. “Embryonic - type Neuroectodermal Tumor” Should Replace “Primitive Neuroectodermal Tumor” of the Testis and Gynecologic Tract: A Rationale for New Nomenclature. Am J Surg Pathol 2021; 45(10): 1299-1302.
10. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, eds. World Health Organization classification of tumours of the central nervous system (revised 4th ed). Lyon, IARC; 2016.
11. WHO Classification of Tumours Editorial Board. Central Nervous System Tumours. (5th ed). Lyon: International Agency for Research on Cancer; 2021.
12. Ulbright TM, Hattab EM, Zhang S, et al. Primitive neuroectodermal tumors in patients with testicular germ cell tumors usually resemble pediatric-type central nervous system embryonal neoplasms and lack chromosome 22 rearrangements. Mod Pathol 2010; 23(7): 972-980.
13. Heikaus S, Schaefer KL, Eucker J, et al. Primary peripheral primitive neuroectodermal tumor/Ewing’s tumor of the testis in a 46-year-old man-differential diagnosis and review of the literature. Hum Pathol 2009; 40(6): 893-897.
14. Grimsby GM, Harrison CB. Ewing sarcoma of the scrotum. Urology 2014; 83(6): 1407-1408.
15. Magers MJ, Kao CS, Cole CD, et al. “Somatic - type” malignancies arising from testicular germ cell tumors: a clinicopathologic study of 124 cases with emphasis on glandular tumors supporting frequent yolk sac tumor origin. Am J Surg Pathol 2014; 38(10): 1396-1409.
16. Colecchia M, Necchi A, Paolini B, Nicolai N, Salvioni R. Teratoma with somatic-type malignant components in germ cell tumors of the testis: a clinicopathologic analysis of 40 cases with outcome correlation. Int J Surg Pathol 2011; 19(3): 321-327.
17. Ahmed T, Bosl GJ, Hajdu SI. Teratoma with malignant transformation in germ cell tumors in men. Cancer 1985; 56(4): 860-863.
18. Motzer RJ, Amsterdam A, Prieto V, et al. Teratoma with malignant transformation: diverse malignant histologies arising in men with germ cell tumors. J Urol 1998; 159(1): 133-138.
19. Hwang MJ, Hamza A, Zhang M, et al. Somatic - type malignancies in testicular germ cell tumors: A clinicopathologic study of 63 cases. Am J Surg Pathol 2021; 46(1): 11-17.
20. Donadio AC, Motzer RJ, Bajorin DF, et al. Chemotherapy for teratoma with malignant transformation. J Clin Oncol 2003; 21(23): 4285-4291.
21. Wagner T, Scandura G, Roe A, et al. Prospective molecular and morphological assessment of testicular prepubertal-type teratomas in postpubertal men. Mod Pathol 2020; 33(4):713-721.
22. Zhang C, Berney DM, Hirsch MS, Cheng L, Ulbright TM. Evidence supporting the existence of benign teratomas of the postpubertal testis: a clinical, histopathologic, and molecular genetic analysis of 25 cases. Am J Surg Pathol 2013; 37(6): 827-835.
23. Williamson SR, Delahunt B, Magi-Galluzzi C, et al. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the International Society of Urological Pathology Testis Consultation Panel. Histopathology 2017; 70(4): 335 - 346.
24. Ulbright TM. Gonadal teratomas: a review and speculation. Adv Anat Pathol 2004; 11(1): 10-23.
25. Wang WP, Guo C, Berney DM, et al. Primary carcinoid tumors of the testis: a clinicopathologic study of 29 cases. Am J Surg Pathol 2010; 34(4): 519-524.
26. Fujita K, Wada R, Sakurai T, Sashide K, Fujime M. Primary carcinoid tumor of the testis with teratoma metastatic to the para-aortic lymph node. Int J Urol 2005; 12(3): 328-331.
27. Matoska J, Ondrus D, Hornak M. Metastatic spermatocytic seminoma. A case report with light microscopic, ultrastructural, and immunohistochemical findings. Cancer 1988; 62(6): 1197-1201.
28. Steiner H, Gozzi C, Verdorfer I, et al. Metastatic spermatocytic seminoma--an extremely rare disease. Eur Urol 2006; 49(1): 183-186.
29. Horn T, Schulz S, Maurer T, Gschwend JE, Kübler HR. Poor efficacy of BEP polychemotherapy in metastatic spermatocytic seminoma. Med Oncol 2011; 28 Suppl 1: S423-425.
30. Mikuz G, Böhm GW, Behrend M, et al. Therapy - resistant metastasizing anaplastic spermatocytic seminoma: a cytogenetic hybrid: a case report. Anal Quant Cytopathol Histpathol 2014; 36(3): 177-182.
31. Wagner T, Grantham M, Berney D. Metastatic spermatocytic tumour with hybrid genetics: breaking the rules in germ cell tumours. Pathology 2018; 50(5): 562-565.
32. Weidner N. Myoid gonadal stromal tumor with epithelial differentiation (? testicular myoepithelioma). Ultrastruct Pathol 1991; 15(4-5): 409-416.
33. Du S, Powell J, Hii A, Weidner N. Myoid gonadal stromal tumor: a distinct testicular tumor with peritubular myoid cell differentiation. Hum Pathol 2012; 43(1): 144-149.
34. Kao CS, Ulbright TM. Myoid gonadal stromal tumor: a clinicopathologic study of three cases of a distinctive testicular tumor. Am J Clin Pathol 2014; 142(5): 675-682.
35. Greco MA, Feiner HD, Theil KS, Mufarrij AA. Testicular stromal tumor with myofilaments: ultrastructural comparison with normal gonadal stroma. Hum Pathol 1984; 15(3): 238 - 243.
36. Evans HL. Unusual gonadal stromal tumor of the testis. Case report with ultrastructural observations. Arch Pathol Lab Med 1977; 101(6): 317-320.
37. Renshaw AA, Gordon M, Corless CL. Immunohistochemistry of unclassified sex cord-stromal tumors of the testis with a predominance of spindle cells. Mod Pathol 1997; 10(7): 693-700.
38. Renne SL, Valeri M, Tosoni A, et al. Myoid gonadal tumor. Case series, systematic review, and Bayesian analysis. Virchows Arch 2021; 478(4): 727-734.
39. Nistal M, Puras A, Perna C, Guarch R, Paniagua R. Fusocellular gonadal stromal tumour of the testis with epithelial and myoid differentiation. Histopathology 1996; 29(3): 259 - 264.
40. Allen PR, King AR, Sage MD, Sorrell VF. A benign gonadal stromal tumor of the testis of spindle fibroblastic type. Pathology 1990; 22(4): 227-229.
41. Cornejo KM, Young RH. Sex cord-stromal tumors of the testis. Diagnostic Histopathology 2019; 25(10): 398-407.
42. Lau HD, Kao CS, Williamson SR, et al. Immunohistochemical characterization of 120 testicular sex cord-stromal tumors with an emphasis on the diagnostic utility of SOX9, FOXL2, and SF-1. Am J Surg Pathol 2021; 45(10): 1303-1313.
43. WHO Classification of Tumours Editorial Board. Female genital tumours (5th ed). Lyon: International Agency for Research on Cancer; 2020.
44. Deshpande V, Oliva E, Young RH. Solid pseudopapillary neoplasm of the ovary: a report of 3 primary ovarian tumors resembling those of the pancreas. Am J Surg Pathol. 2010; 34(10): 1514-1520.
45. He S, Yang X, Zhou P, Cheng Y, Sun Q. Solid pseudopapillary tumor: an invasive case report of primary ovarian origin and review of the literature. Int J Clin Exp Pathol 2015; 8(7): 8645-8649.
46. Kominami A, Fujino M, Murakami H, Ito M. beta-catenin mutation in ovarian solid pseudopapillary neoplasm. Pathol Int 2014; 64(9): 460-464.
47. Cheuk W, Beavon I, Chui DT, Chan JK. Extrapancreatic solid pseudopapillary neoplasm: report of a case of primary ovarian origin and review of the literature. Int J Gynecol Pathol 2011; 30(6): 539-543.
48. Michalova K, Michal M, Sedivcova M, et al. Solid pseudopapillary neoplasm (SPN) of the testis: Comprehensive mutational analysis of 6 testicular and 8 pancreatic SPNs. Ann Diagn Pathol 2018; 35 : 42-47.
49. Michal M, Bulimbasic S, Coric M, et al. Pancreatic analogue solid pseudopapillary neoplasm arising in the paratesticular location. The first case report. Hum Pathol 2016; 56 : 52 - 56.
50. Mengoli MC, Bonetti LR, Intersimone D, Fedeli F, Rossi G. Solid pseudopapillary tumor: a new tumor entity in the testis? Hum Pathol 2017; 62 : 242-243.
51. Michalova K, Michal M, Jr., Kazakov DV, et al. Primary signet ring stromal tumor of the testis: a study of 13 cases indicating their phenotypic and genotypic analogy to pancreatic solid pseudopapillary neoplasm. Hum Pathol 2017; 67 : 85-93.
52. Butnor KJ, Pavlisko EN, Sporn TA, Roggli VL. Mesothelioma of the tunica vaginalis testis. Hum Pathol 2019; 92 : 48-58.
53. Stevers M, Rabban JT, Garg K, et al. Well-differentiated papillary mesothelioma of the peritoneum is genetically defined by mutually exclusive mutations in TRAF7 and CDC42. Mod Pathol 2019; 32(1): 88-99.
54. Churg A, Allen T, Borczuk AC, et al. Well-differentiated papillary mesothelioma with invasive foci. Am J Surg Pathol 2014; 38(1): 990 - 998.
55. Brimo F, Illei PB, Epstein JI. Mesothelioma of the tunica vaginalis: a series of eight cases with uncertain malignant potential. Mod Pathol 2010; 23(8): 1165-1172.
56. Trpkov K, Barr R, Kulaga A, Yilmaz A. Mesothelioma of tunica vaginalis of “uncertain malignant potential” - an evolving concept: case report and review of the literature. Diagn Pathol 2011; 6 : 78.
57. Tan WK, Tan MY, Tan WS, et al. Well-Differentiated Papillary Mesothelioma of the Tunica Vaginalis: Case Report and Systematic Review of Literature. Clin Genitourin Cancer 2016; 14(4): e435-439.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek ONDŘEJ HES, 1968-2022Článek 'PULMOPATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'HEPATOPATOLOGIEČlánek 'GYNEKOPATOLOGIEČlánek 'PATOLOGIE CNSČlánek 'PATOLOGIE GITČlánek 'KARDIOPATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE ORL OBLASTIČlánek 'HISTORIE PATOLOGIE
Článok vyšiel v časopiseČesko-slovenská patologie

2022 Číslo 4-
Všetky články tohto čísla
- Ondřej Hes, 21. 7. 1968 – 2. 7. 2022
- ONDŘEJ HES, 1968-2022
- 'PULMOPATOLOGIE
- 'CYTODIAGNOSTIKA
- 'HEPATOPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'PATOLOGIE CNS
- 'PATOLOGIE GIT
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'HISTORIE PATOLOGIE
- Novinky ve WHO klasifikaci renálních nádorů 2022
- Nádorové léze penisu a skróta dle WHO klasifikace 2022
- Hlavní změny ve WHO klasifikaci 2022 testikulárních tumorů
- Zmeny a novinky vo WHO klasifikácii nádorov prostaty z roku 2022
- Novinky 5. vydání WHO klasifikace nádorů vylučovacího a mužského genitálního traktu - vývodné močové cesty
- Cystický trofoblastický tumor semenníka: kazuistika
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Novinky ve WHO klasifikaci renálních nádorů 2022
- Nádorové léze penisu a skróta dle WHO klasifikace 2022
- Hlavní změny ve WHO klasifikaci 2022 testikulárních tumorů
- Zmeny a novinky vo WHO klasifikácii nádorov prostaty z roku 2022
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



