-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky 5. vydání WHO klasifikace nádorů vylučovacího a mužského genitálního traktu - vývodné močové cesty
The 5th edition of WHO classification of the urinary tract tumors – what is new?
The 5th edition of WHO classification of the urinary tract tumors is only mildly edited version of the previous WHO classification (from year 2016). The most prominent changes are represented by modifications in the structure and concept of chapters and there are minor alterations in the nomenclature of some entities. Histological characteristics are still the gold standard for classification of urothelial tract neoplasms.
Keywords:
urothelial carcinoma – WHO 2022 classification – urinary tract
Autori: Kristýna Pivovarčíková 1,2; Tomáš Pitra 3; Ondřej Hes 1,2
Pôsobisko autorov: Šiklův ústav patologie LF UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň, Česká Republika 2; Urologická klinika LF UK a FN Plzeň 3
Vyšlo v časopise: Čes.-slov. Patol., 58, 2022, No. 4, p. 207-211
Kategória: Přehledový článek
Súhrn
5. vydání WHO klasifikace nádorů vývodných cest močových je ve své podstatě pouze lehce upravená a více učesaná verze 4. vydání WHO z roku 2016. Asi nejmarkantnější změnou se tak stává úprava konceptu a uspořádání kapitol a minimální změny v nomenklatuře. Histologická/morfologická klasifikace zůstává zlatým standardem klasifikace neoplazií vývodných cest močových.
Klíčová slova:
uroteliální karcinom – WHO 2022 klasifikace – močový trakt
Páté vydání WHO klasifikace nádorů vývodných močových cest je ve své podstatě pouze lehce upravená a více učesaná verze 4. vydání WHO z roku 2016 (1). Asi nejmarkantnější změnou se tak stává úprava konceptu a uspořádání kapitol a drobné změny v nomenklatuře (tím však není myšleno zavádění nových názvů či jednotek, ale jen lehké „slovíčkaření“ v rámci dlouho známých a jasně popsaných jednotek). Histologická/morfologická klasifikace zůstává zlatým standardem klasifikace neoplasií vývodných cest močových. Přehled jednotek aktuální klasifikace vyobrazen v tabulce 1 (2).
Tab. 1. Přehled jednotek aktuálního 5. vydání WHO klasifikace nádorů vylučovacího a mužského genitálního traktu - kapitola nádorů vývodných cest močových (2). 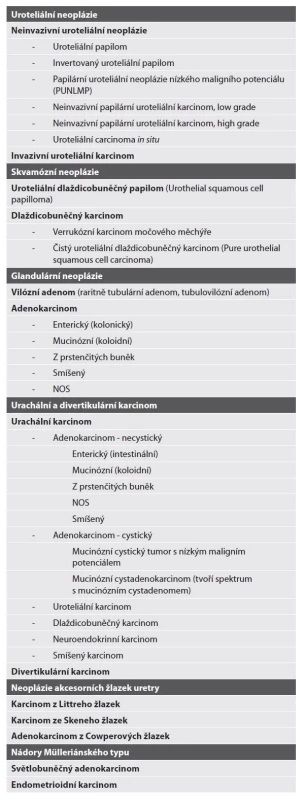
Nastíníme-li změny v konceptu, je třeba zmínit, že nádory měkkých tkání (vznikající nejčastěji v rámci močového měchýře) byly z kapitoly nádorů močového traktu přesunuty do samostatné kapitoly pojednávající souhrnně o měkkotkáňových tumorech v rámci urogenitální patologie (stejný koncept a uspořádání již známe např. z 5. vydání WHO nádorů trávicího systému). Též neuroendokrinní tumory bychom již marně hledali v rámci vylučovací sekce, nově jsou samostatnou kapitolou a též pojednávají o neopláziích nikoli pouze ve vývodných močových cestách, ale v celém urotraktu (s vyjímkou tzv. s léčbou asociovaného neuroendokrinního prostatického karcinomu, který je začleněn do kapitoly národů prostaty). Nádorům horních cest močových již není věnována samostatná kapitola.
Tento článek si neklade za cíl popsat všechny jednotky nové WHO, jedná se o článek konkrétně komentující změny u jednotlivých okruhů neoplázií, ty jsou shrnuty v následujícím textu.
Uroteliální neoplázie močového traktu
Stejně jako do všech odvětví patologie začínají i do této kapitoly promlouvat molekulárně genetické metody. I přes neustále přibývají množství nových studií ovšem chybí dostatečná integrace získaných dat do klinického kontextu. To, výrazná heterogenita studií, nejasné závěry a vysoká cena vyšetření brání posunu v implementaci genetických metod do rutinní klasifikace uroteliálních neoplázií a tedy i do WHO klasifikace. Již předchozí WHO klasifikací zmiňovaný koncept dvou molekulárních cest rozvoje uroteliálního karcinomu (který je paralelou k histomorfologické klasifikaci - low-grade a high-grade cesta), zůstává. Víme však, že obě cesty mají překryvné mutační spektrum a rozdílnou prevalenci různých genetických alterací. Uroteliální karcinomy jsou hlediska genomiky heterogenní skupinou a jsou asociované s vysokou mutační zátěží (mutation burden). Specifické alterace genomu mohou být spojeny s odlišnými klinickými výstupy u pacientů a znalost genetického pozadí může pomoci při predikci a výběru onkologické léčby. I proto zůstává dlouhodobá snaha velkého množství autorů identifikovat různé molekulární subtypy neoplázií (na základě analýzy klastrů) a pro zlevnění vyšetření nejlépe ještě najít pro jednotlivé molekulární subtypy i adekvátní zástupné imunohistochemické markery. V literatuře tak najdeme množství studií, ty však bohužel uvádí různé klasifikace, různé názvy a různé molekulární podtypy. I přes různost všech skupin a názvů, většina publikací nakonec vykazuje výrazný překryv mezi jednotlivými klasifikacemi a skupinami což do situace vnáší jen zmatek a brání tak širokému rozšíření používání. Konsenzu bylo prozatím dosáhnuto pouze u svalovinu infiltrujících karcinomů, kde je v současnosti rozlišováno šest molekulárních subtypů (tabulka 2) (3), některé asociovány s horším přežíváním.
Tab. 2. Molekulární subtypy svalovinu infiltrujících karcinomů (3). 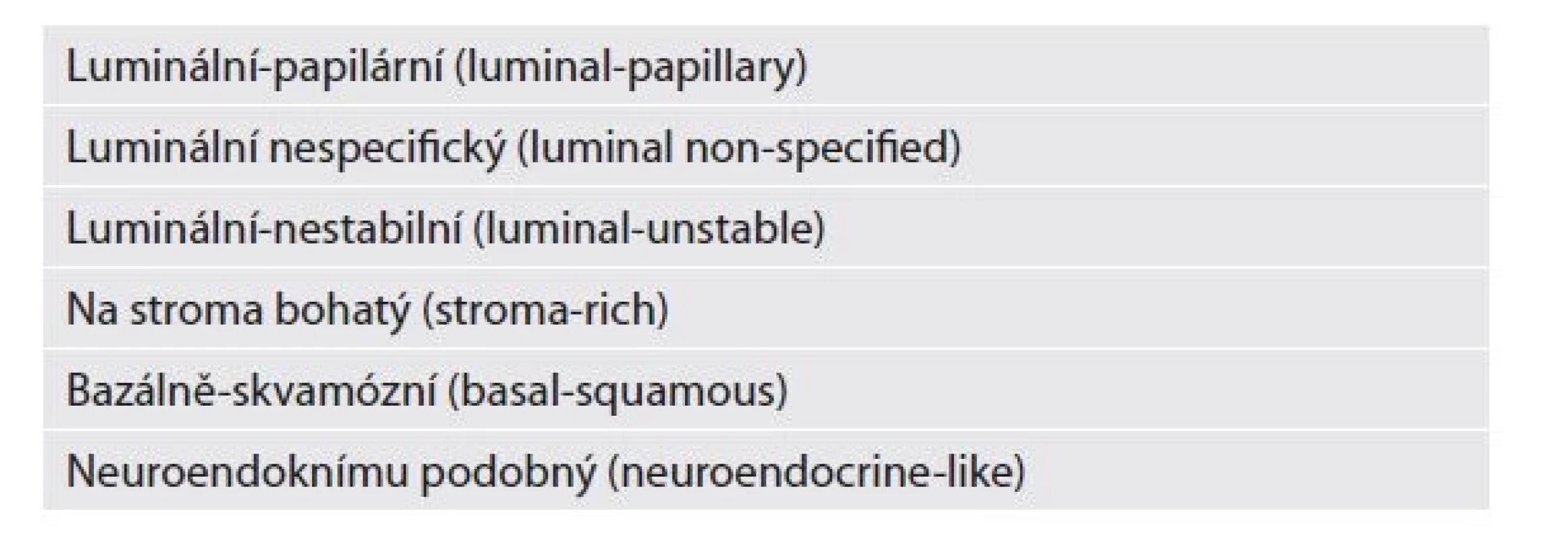
Kladným stanoviskem WHO ohodnotila a podpořila v současné době používanou Pařížskou klasifikaci močových cytologií (4), sloužící k záchytu uroteliálního karcinomu s vysokou klinickou relevancí (tedy high-grade tumorů, tj. high-grade neinvazivní papilární uroteliální karcinom, high-grade invazivní uroteliální karcinom, uroteliální carcinoma in situ). Problematika Pařížské klasifikace močových cytologií již byla v Československé patologii rozsáhle zpracována dříve a nebude tak dále komentována (5).
Nově jsou ve WHO 2022 adresně komentovány neinvazivní papilární uroteliální tumory s převažující invertovanou morfologií. Současná WHO uvádí jako samostatnou jednotku invertovaný uroteliální papilom, vzácnou lézi s endofytickým růstem. Přítomnost pouze minimální papilární exofytické komponenty je kompatibilní s touto jednotkou (2). Zbytek neinvazivních papilárních uroteliálních tumorů s převažující invertovanou morfologií (neinvazivní papilární UC a papilární uroteliální neoplázie nízkého maligního potenciálu) pak nejsou WHO udávány jako samostatná jednotka, ale jsou komentovány vždy v příslušné sekci. Označení „invertovaný“ by mělo figurovat v popisu tumorů s převažujícím endofytickým růstem ze zcela racionálního důvodu - z klinického hlediska mohou během cystoskopie tyto tumory vypadat velmi neobvykle.
Léze v předchozí WHO uváděné jako samostatné jednotky „uroteliální proliferace nejistého maligního potenciálu“ (léze dříve označovaná jako uroteliální hyperplázie) a uroteliální dysplázie (1) nově nebyly jako samostatné jednotky uznány (2). Uroteliální dysplázie je komentována v rámci kapitoly „uroteliální carcinoma in situ“ jako léze, která sice vykazuje atypie (které věříme, že jsou preneoplastické), ty však nesplňují kritéria pro diagnózu uroteliální carcinoma ni situ. Vzhledem k vágní definici a nedobré reprodukovatelnosti patně nebyla tato jednotka samostatně ve WHO 2022 zahrnuta. U uroteliální proliferace nejistého maligního potenciálu pak její plochá verze (dříve plochá hyperplázie) byla pozorována u plejády stavů (6), je patrně benigní lézí s velmi otazným vztahem k rozvoji UC, vlastní kategorii tak nezasluhuje. Naopak papilární podtyp (dříve papilární hyperplázie), která byla WHO 2016 považována spíše pouze za prekurzor low-grade neinvazivního UC, je dnes již považována za časný low-grade neinvazivní UC, či „shoulder“ papilárního karcinomu nacházejícího se v okolí (laterální extenze) (7).
Uroteliální karcinomy jsou dobře známy svou heterogenitou, a to nikoli a pouze heterogenitou morfologickou (tj. přítomnost divergentních diferenciací a různých subtypů), ale též svou heterogenitou v rámci diferenciace (grade). Páté vydání WHO se snaží do gradingu UC zavést řád a snížit interobservační variabilitu - zavádí tak pravidlo pro grading neinvazivního papilárního karcinomu, kdy jako high grade mají být diagnostikovány karcinomy, u nichž high-grade složka tvoří ≥ 5% tumoru. Tumory s <5% zastoupením high-grade komponenty by měly být explicitně reportovány jako „low grade s <5% high-grade komponenty“. High-grade komponenta je definována high-grade cytologickými atypiemi (2).
Drobnou změnou v nomenklatuře je nahrazení termínu „infiltrativní uroteliální karcinom/infiltrating urothelial carcinoma“ z WHO 2016 patrně modernějším termínem „invazivní uroteliální karcinom/invasive urothelial carcinoma“. Zároveň WHO v rámci nomenklatury invazivních uroteliálních karcinomů (v souladu s ostatními svazky 5. vydání WHO jiných systémů) provedla i další lehkou změnu - užíván by měl být termín „subtyp“ spíše než „varianta“. Mikropapilární UC, „nested“ UC, tubulární a mikrocystický UC, „large nested“ UC, plasmocytoidní UC, sarkomatoidní UC, „lipid-rich“ UC, „lymphoepithelioma-like UC, světlobuněčný (na glykogen bohatý) UC, obrovskobuněčný UC a špatně diferencovaný UC by tak měli být nově označovány jako histologické subtypy UC. U UC se smíšenou morfologií (tj. u nádorů s divergentní diferenciací a přítomností subtypů) by měli být popsány jednotlivé komponenty UC společně se snahou o jejich kvantifikaci.
I s novou WHO klasifikací zůstává v platnosti nutnost gradingu invazivního UC. Ačkoliv drtivá většina invazivních UC je morfologicky high-grade, malé množství invazivních UC může vykazovat low-grade morfologii a u těchto případů lze očekávat lehce odlišnou prognózu. Všechny UC s divergentní diferenciací a subtypy UC jsou automaticky považovány za high-grade UC. WHO i nadále neudává diagnostická kritéria pro low-grade invazivní UC.
U invazivních karcinomů by i v materiálu z transuretrální resekce (TURB) měl být prováděn substaging pro pT1 kategorii, WHO však direktivně nestanovuje jak toto hodnotit. Doporučuje buď měření hloubky invaze (s rozlišováním mikroskopické versus extenzivní invaze – dvoustupňová subklasifikace), či substaging na základě orientace v základních anatomických bodech (záchytné body jako muscularis mucosae a vaskulární plexus lamina propria – třístupňová subklasifikace) (8, 9). Dobře známou věcí je však fakt, že existuje morfologická variabilita stěny močového měchýře v různých oblastech. V atopografickém materiálu, kterým materiál z TURB je, pak situaci často stěžuje možnost hyperplastické muscularis mucosae (10) (která dokáže často zmást patologa dokonce i do té míry, že je tumor „upstageován“ až na pT2). Jako prostatická stromální invaze (pT4a) by měli být i nadále hodnoceny pouze případy, u nichž se prokáže per continuitatem transmurální invaze z močového měchýře (11) (v případech bez prokázaného kontinuálního transvezikálního šíření by měl být staging prováděn jako u separátního tumoru vycházejícího z uretry). Při hodnocení lymfatických uzlin by měla být zmiňována přítomnost či absence extranodální extenze (2).
U UC s vysokou expresí PDL1 prokázaly klinické studie dobré výsledky při léčbě „immune checkpoint“ inhibitory. V současné době je dostupné spektrum těchto léčiv, každé z léčiv má svou specifickou imunohistochemickou protilátku (klon) a skóringový systém. Proto při žádosti klinického lékaře o vyšetření exprese PDL1 by jsme se vždy měli zajímat o to, jakým léčivem se chystá pacienta léčit a najít si v literatuře tomuto záměru adekvátní klon a způsob hodnocení barvení. Seznam preparátů, jím odpovídajících klonů protilátek a způsob hodnocení je shrnut v doporučených postupech Genitourinární Patologické Společnosti (The Genitourinary Pathology Society/GUPS) z roku 2021 (12).
Skvamózní neoplázie močového traktu
Čistý uroteliální dlaždicobuněčný karcinom (SCC) a uroteliální dlaždicobuněčný papilom prakticky kromě lehké změny v názvu (přidání přívlastku „uroteliální“, který jasně z názvu značí původ dlaždicobuněčné neoplázie v urotelu, tedy stejně jako jsme na to zvyklí např. u endometriálního karcinomu) neprošly výraznější změnou, stejně tak verrukózní karcinom (2).
Snad konkrétněji by mělo být komentováno, že u SCC v rámci močového ústrojí není jasně definován gradingový systém - doporučováno je na základě stupně keratinizace a jaderného pleomorfizmu rozlišovat dobře/středně/špatně diferencovaný SCC.
Glandulární neoplázie močového traktu
V rámci adenokarcinomů WHO 2022 rozlišuje enterický (kolonický) typ, mucinózní (koloidní) typ, adenokarcinom z prstenčitých buněk, smíšený typ a blíže nespecifikovaný typ (NOS) (2). Stejně jako v rámci gastrointestinálního traktu je mucinózní typ adenokarcinomu v močovém měchýři charakterizován přítomností objemné složky hlenu, která v tumorózní mase tvoří >50% celkového objemu.
Adenokarcinom močových cest nemá všeobecně akceptovaný gradingový sytém, doporučováno je rozlišovat tumory na dobře, středně a špatně diferencové podle cytologických charakteristik.
Koncept vilózního adenomu (a zcela raritního tubulárního a tubulovilózního adenomu) zůstává beze změn.
Karcinom urachu
Karcinom urachu je souhrnný název pro skupinu neoplázií vznikajících v pozůstatcích urachu, vždy se jedná o diagnózou per exclusionem. Tyto tumory představují histologické spektrum různých jednotek (v tabulce 1 kompletní přehled jednotek), z nichž nejčastější je enterický necystický adenokarcinom.
Stejně jako WHO 2016 i aktuální klasifikace upřednostňuje Sheldonův stagingový systém (z roku 1984) (13) před TNM klasifikací.
Divertikulární karcinom
Jedná se o WHO nově vyčleněnou jednotku tumorů vznikajících v divertiklech močových cest. Opět se jedná o histologické spektrum tumorů, z nichž nejčastějším tumorem je tentokrát UC. Při diagnostice divertikulárních karcinomů je třeba pamatovat na fakt, že divertikly typicky neobsahují ve své stěně vrstvu muscularis propria (přítomna bývá jen hypertrofická muscularis mucosae) a to je důvod proč u nádorů vznikajících v divertiklech nelze stanovit stage pT2 (11). To patrně vedlo autory WHO k vyčlenění této kategorie neoplázií do samostatné kapitoly.
Neoplázie akcesorních žlázek uretry
Karcinom z Littrého žlázek a karcinom z Cowperových žlázek jsou tumory vznikající u mužů z parauretrálních žlázek analogického názvu, karcinom ze Skeneho žlázek pak vzniká u žen ze Skeneho žlázek, které jsou analogen mužské prostaty (včetně pozitivity prostatických markerů – PSA, NKX3.1). Věda u těchto velice vzácných tumorů příliš nepokročila, proto i WHO 2022 toho oproti předchozí klasifikaci příliš nového nepřináší. Za zmínku však rozhodně stojí, že u karcinomu z Cowperových žlázek (vykazujícího obdobnou morfologii jako adenoidně cystický karcinom) byla prokázána přítomnost genetické fúze MYB-NFIB (14), která je i nejčastěji detekovanou fúzí právě u adenoidně cystického adenokarcinomu (15).
Neuroendokrinní neoplázie
Koncept kapitoly a vlastní zahrnuté jednotky zůstávají, celá kapitola je však vysunuta mimo neoplázie vylučovacího traktu mezi hlavní kapitoly a pojednává souhrnně o neuroendokrinních neopláziích v rámci celého urotraktu. Přehled členění a dělení na jednotlivé kapitoly kopíruje neuroendokriníí neoplázie jiných lokalit, přehled v tabulce 3 (2).
Tab. 3. Klasifikace neuroendokrinních neoplázií dle WHO 2022 (2). 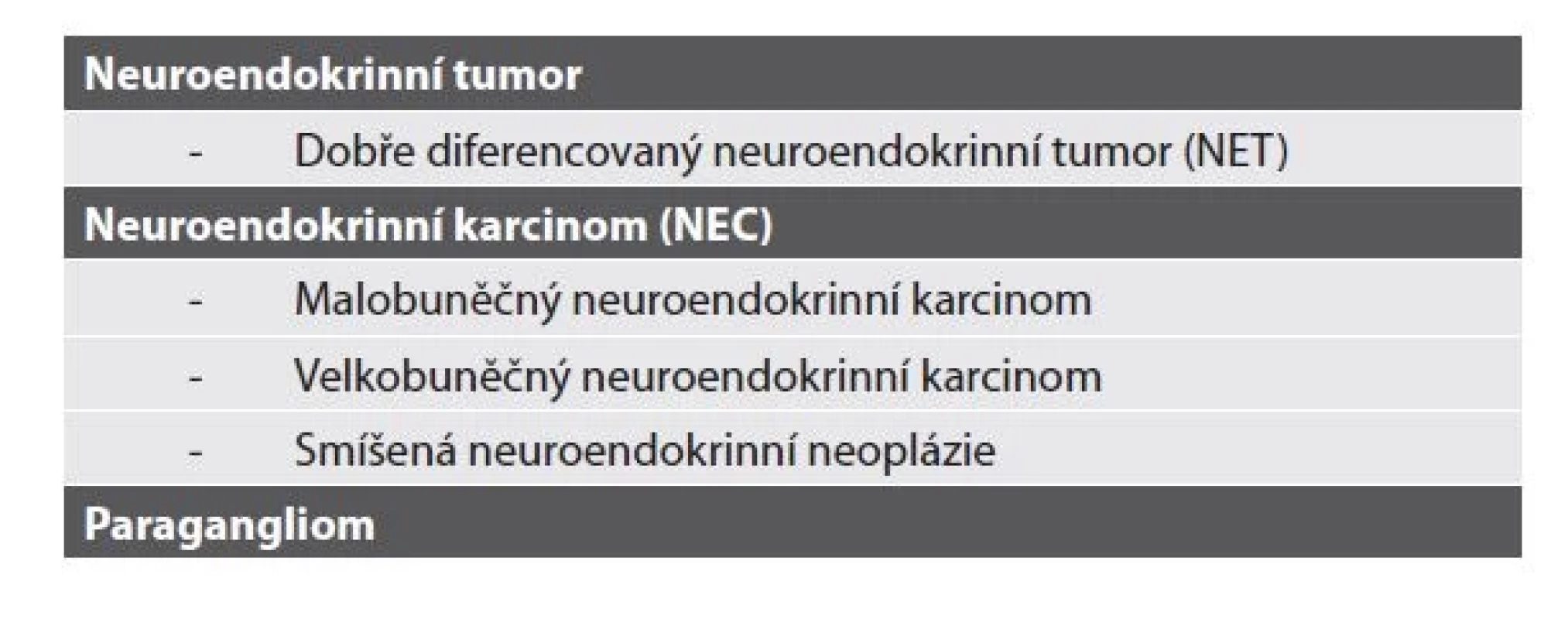
Konkrétní komentář si zaslouží zejména dvě skutečnosti. Patrně vzhledem k raritě výskytu dobře diferencovaných neuroendokrinních tumorů (NET) v urotraktu nebyl WHO definitivně stanoven gradingový systém pro tyto tumory, doporučují však používat gradingový systém gastrointestinálních a pankreatických NET (16).
Nově WHO zavádí pojem „smíšené neuroendokrinní neoplázie“, který je definován jako tumor tvořený neuroendokroinní a non-endokrinní komponentou (u high grade uroteliálních karcinomů relativně častější jev, někteří autoři NEC považují za divergentní diferenciaci). Doporučováno je udávat procentuální zastoupení obou komponent v tumoru, údaj má mít prognostický význam.
Mezenchymální tumory
Jak už bylo zmíněno v úvodu, skupina mezenchymálních tumorů již nefiguruje jako podkapitola nádorů vývodných močových cest, ale byla zařazena jako jedna z hlavních kapitol a komentuje souhrnně nejčastější měkkotkáňové tumory vyskytující se v urotraktu jako celku. Z vybraných mezenchymálních tumorů častěji se vyskytujících v dutém močovém traktu stojí za zmínku změny týkající se např. inflamatorního myofibroblastického tumoru (IMT). IMT je neoplastickou myofibroblastickou proliferací se specifickým molekulárně genetickým pozadím, kdy velká část tumorů je asociována s rearanžemi ALK genu. Pseudosarkomatoidní myofibroblastická proliferace má diskutabilní vztah k IMT a v souladu s dřívějšími názory některých autorů WHO tento termín vyčlenila pro morfologicky identické tumory jako IMT, avšak konkurentně s negativním výsledkem v průkazu ALK rearanží (17, 18).
Leiomyosarkom je v rámci močového měchýře členěn na low-grade a high-grade a to na základě hodnocení mitotické aktivity (≥ 1 mitóza/mm2), jaderných atypií (mírné až střední) a přítomnosti intratumorální nekrózy (< 25%) (19). U lézí jako angiosarkom či rhabdomyosarkom tkví hlavní změny oproti předchozí WHO zejména v komentáři genetického pozadí těchto lézí.
ZÁVĚR
Tím nejdůležitějším konstatováním je, že v rámci dutých vývodných cest močových přináší nová WHO jen lehké „kosmetické“ změny oproti 4. vydání z roku 2016. Hned druhou důležitou informací by pak mělo být připomenutí faktu, že vzhledem k nepoddajnosti doporučených postupů Evropské asociace urologů (EAU), histologická WHO klasifikace uroteliálních lézí i nadále nereflektuje klasifikace urologické (resp. EAU doporučené postupy nereflektují WHO klasifikaci) (20). To může vést k lehkým kolizím mezi světem patologa a urologa, kterým je třeba předcházet - podvolit se našim klinickým kolegům a stále ještě ovládat a reportovat i klasifikaci výrazně starší (WHO klasifikaci z roku 1973).
PODĚKOVÁNÍ
Karlova Universita Praha, Lékařská fakulta Plzeň (Cooperation Program, SURG), Institucionální výzkum Fakultní nemocnice Plzeň (FNPl 00669806).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Kristýna Pivovarčíková, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Alej Svobody 80, 30460 Plzeň
tel. +420377404633
e-mail: pivovarcikovak@fnplzen.cz
Zdroje
1. Moch H, Humphrey PA, Ulbright TM, Reuter VE. WHO classification of tumours of the urinary system and male genital organs. Lyon: International Agency for Research on Cancer (IARC); 2016.
2. Tsuzuki M, Compérat EM, Netto NR, et al. Tumours of the urinary tract. In: WHO Classification of Tumours Editorial Board. Urinary and male genital tumours. Lyon (France): International Agency for Research on Cancer; 2022. (WHO classification of tumours series, 5th ed.; vol. 8). https://publications.iarc.fr.
3. Kamoun A, de Reynies A, Allory Y, et al. A Consensus molecular classification of muscle - invasive bladder cancer. Eur Urol 2020; 77(4): 420-433.
4. Rosenthal DL, Wojcik EM, Kurtycz DFI. The Paris system for reporting urinary cytology. Switzerland: Springer; 2016.
5. Pivovarcikova K, Pitra T, Hes O. Aktuální pohled na močovou cytologii: Co přináší Pařížská klasifikace? Cesk Patol 2019; 55(1): 34-41.
6. Lopez-Beltran A, Cheng L, Andersson L, et al. Preneoplastic non-papillary lesions and conditions of the urinary bladder: an update based on the Ancona International Consultation. Virchows Arch 2002; 440(1): 3-11.
7. Amin MB, Comperat E, Epstein JI, et al. The Genitourinary Pathology Society update on classification and grading of flat and papillary urothelial neoplasia with new reporting recommendations and approach to lesions with mixed and early patterns of neoplasia. Adv Anat Pathol 2021; 28(4): 179-195.
8. Fransen van de Putte EE, Otto W, Hartmann A, et al. Metric substage according to micro and extensive lamina propria invasion improves prognostics in T1 bladder cancer. Urol Oncol 2018; 36(8): 361 e7 - e13.
9. van Rhijn BW, van der Kwast TH, Alkhateeb SS, et al. A new and highly prognostic system to discern T1 bladder cancer substage. Eur Urol 2012; 61(2): 378-384.
10. Raspollini MR, Montironi R, Mazzucchelli R, Cimadamore A, Cheng L, Lopez-Beltran A. pT1 high-grade bladder cancer: histologic criteria, pitfalls in the assessment of invasion, and substaging. Virchows Arch 2020; 477(1): 3-16.
11. Amin MB, Edge SB, Greene FL, Byrd DR, Brookland RK, Washington MK. AJCC Cancer Staging Manual (Eighth edition). Chicago: Amerian Joint Committee on Cancer (AJCC); 2017.
12. Comperat E, Amin MB, Epstein JI, et al. The Genitourinary Pathology Society update on classification of variant histologies, T1 substaging, molecular taxonomy, and immunotherapy and PD-L1 testing implications of urothelial cancers. Adv Anat Pathol 2021; 28(4): 196-208.
13. Sheldon CA, Clayman RV, Gonzalez R, Williams RD, Fraley EE. Malignant urachal lesions. J Urol 1984; 131(1): 1-8.
14. Myers CE, Gatalica Z, Spinelli A, et al. Metastatic cancer of Cowper‘s gland: a rare cancer managed successfully by molecular profiling. Case Rep Oncol 2014; 7(1): 52-57.
15. Persson M, Andren Y, Mark J, Horlings HM, Persson F, Stenman G. Recurrent fusion of MYB and NFIB transcription factor genes in carcinomas of the breast and head and neck. Proc Natl Acad Sci U S A 2009; 106(44): 18740 - 18744.
16. Lloyd RV, Osamura RY, Kloppel G, Rosai J. WHO Classification of Tumours of Endocrine Organs (4th Edition). Lyon: International Agency for Research on Cancer (IARC); 2017.
17. Jebastin JAS, Smith SC, Perry KD, et al. Pseudosarcomatous myofibroblastic proliferations of the genitourinary tract are genetically different from nodular fasciitis and lack USP6, ROS1 and ETV6 gene rearrangements. Histopathology 2018; 73(2): 321-326.
18. Acosta AM, Demicco EG, Dal Cin P, Hirsch MS, Fletcher CDM, Jo VY. Pseudosarcomatous myofibroblastic proliferations of the urinary bladder are neoplasms characterized by recurrent FN1-ALK fusions. Mod Pathol 2021; 34(2): 469-477.
19. Martin SA, Sears DL, Sebo TJ, Lohse CM, Cheville JC. Smooth muscle neoplasms of the urinary bladder: a clinicopathologic comparison of leiomyoma and leiomyosarcoma. Am J Surg Pathol 2002; 26(3): 292-300.
20. Babjuk M, Burger M, Compérat EM, et al. EAU Guidelines on non-muscle-invasive bladder cancer (TaT1 and CIS). Arnhem: European Association of Urology (EAU) Guidelines Office; 2022.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článek ONDŘEJ HES, 1968-2022Článek 'PULMOPATOLOGIEČlánek 'CYTODIAGNOSTIKAČlánek 'HEPATOPATOLOGIEČlánek 'GYNEKOPATOLOGIEČlánek 'PATOLOGIE CNSČlánek 'PATOLOGIE GITČlánek 'KARDIOPATOLOGIEČlánek 'HEMATOPATOLOGIEČlánek 'PATOLOGIE GITČlánek 'PATOLOGIE ORL OBLASTIČlánek 'HISTORIE PATOLOGIE
Článok vyšiel v časopiseČesko-slovenská patologie

2022 Číslo 4-
Všetky články tohto čísla
- Ondřej Hes, 21. 7. 1968 – 2. 7. 2022
- ONDŘEJ HES, 1968-2022
- 'PULMOPATOLOGIE
- 'CYTODIAGNOSTIKA
- 'HEPATOPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'PATOLOGIE CNS
- 'PATOLOGIE GIT
- 'KARDIOPATOLOGIE
- 'HEMATOPATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'HISTORIE PATOLOGIE
- Novinky ve WHO klasifikaci renálních nádorů 2022
- Nádorové léze penisu a skróta dle WHO klasifikace 2022
- Hlavní změny ve WHO klasifikaci 2022 testikulárních tumorů
- Zmeny a novinky vo WHO klasifikácii nádorov prostaty z roku 2022
- Novinky 5. vydání WHO klasifikace nádorů vylučovacího a mužského genitálního traktu - vývodné močové cesty
- Cystický trofoblastický tumor semenníka: kazuistika
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Novinky ve WHO klasifikaci renálních nádorů 2022
- Nádorové léze penisu a skróta dle WHO klasifikace 2022
- Hlavní změny ve WHO klasifikaci 2022 testikulárních tumorů
- Zmeny a novinky vo WHO klasifikácii nádorov prostaty z roku 2022
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



