-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
Skeletal dysplasias of the fetus and infant: comprehensive review and our experience over a 10-year period
We present a comprehensive review dealing with rare genetic skeletal disorders. More than 400 entities are included in the latest classification. The most severe or lethal phenotypes are identifiable in the prenatal period and the pregnancy can be terminated. Perinatal autopsy and posmortem X-rays are crucial in providing a definitive diagnosis. The number of cases confirmed by genetic testing is increasing. We report our own experience with genetic skeletal disorders based on 41 illustrative fetal and neonatal cases which we encountered over a 10-year period. Thanatophoric dysplasia and osteogenesis imperfecta represent approximately half of the cases coming to autopsy. Achondrogenesis type 2 and hypochondrogenesis, short-rib dysplasia, chondrodysplasia punctata, campomelic dysplasia and achondroplasia are less common. Skeletal dysplasias with autosomal recessive inheritance are the least frequent, e.g. perinatally lethal hypophophatasia, achondrogenesis type 1A, diastrophic dysplasia/atelosteogenesis type 2 or mucolipidosis type 2 (I cell disease).
Keywords:
osteogenesis imperfecta – prenatal diagnosis – fetus – skeletal dysplasia – thanatophoric dysplasia – achondrogenesis
Autori: Marta Ježová 1; Denisa Pavlovská 2
; Ilga Grochová 3; Andrea Michenková 3; Pavel Vlašín 3
Pôsobisko autorov: Ústav patologie, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy Univerzity, Brno 1; Klinika dětské radiologie, Fakultní nemocnice Brno 2; Centrum prenatální diagnostiky s. r. o, Brno 3
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 2, p. 68-79
Kategória: Původní práce
Súhrn
Kostní dysplázie, kterých je známo více než čtyři sta, patří mezi vzácná onemocnění. Ty nejzávažnější a letální je možné diagnostikovat prenatálně a indikovat k umělému ukončení těhotenství. Konečná diagnóza je formulována na základě pitvy a postmortálního RTG, které ve stále větší míře doplňuje genetické vyšetření. Přibližně polovinu případů vyšetřených patologem tvoří thanatoforní dysplázie a osteogenesis imperfecta; k méně častým patří achondrogeneze 2. typu a hypochondrogeneze, syndromy krátkých žeber, chondrodysplasia punctata, kampomelická dysplázie a achondroplázie. Zřídka jsou diagnostikovány kostní dysplázie s autosomálně recesivní dědičností jako perinatální letální hypofosfatázie, achondrogeneze typu 1A, diastrofická dysplázie/atelosteogeneze 2. typu nebo mukolipidóza 2. typu. V následujícím textu přinášíme přehled problematiky a praktické zkušenosti, které jsme získali během deseti let na souboru 41 případů.
Klíčová slova:
osteogenesis imperfecta – pitva – prenatální diagnóza – plod – kostní dysplázie – thanatoforní dysplázie – achondrogeneze
Kostní dysplázie se tradičně dělí na dvě velké skupiny. Osteochondrodysplázie, dříve trpaslictví, jsou dědičné poruchy vývoje chrupavčité a kostní tkáně, které jsou generalizované a progresivní. Dysostózy jsou lokalizované malformace jednotlivých kostí nebo jejich skupin, které jsou statické. Podle postiženého segmentu rozeznáváme dysostózy kraniofaciální, vertebrální a končetinové. Rozdíl mezi oběma skupinami není tak propastný, jak by se na první pohled zdálo, protože např. mutace genu pro receptor 3 fibroblastového růstového faktoru odpovídají jak za největší skupinu osteochondrodysplázií, tak za některé kraniosynostózy. Klasifikace kostních dysplázií prošla od svého prvního zveřejnění v roce 1970 mnoha obměnami. Poslední verze z roku 2015 rozpoznává 436 nozologických jednotek. Převládá trend ke zjednodušení a snižování počtu jednotek navzdory přibývajícím informacím z oblasti genetiky. Jednotlivé choroby jsou rozděleny do 42 rodin, a to buď podle kauzální genové mutace (skupiny 1 – 8, např. FGFR3 dysplázie) nebo podle radiologické lokalizace abnormality (sk. 9 – 17, např. metafyzární dysplázie) či fenotypu (sk.18 – 20, např. dysplázie s ohnutými kostmi). Následují skupiny s poruchou mineralizace (sk. 21 – 26, 28), lysozomální střádavé choroby s deformacemi skeletu (sk. 27, např. mukopolysacharidóza), nádorovité choroby kostí (sk. 29, např. exostózová choroba), poruchy z nadměrného růstu (sk. 30, např. Sotosův syndrom), geneticky podmíněné zánětlivé a revmatoidní osteoartropatie (sk. 31, např. hyalinní fibromatóza) a dysostózy (sk. 32 – 42, např. kraniosynostózy). (1). Přibližně 50 z celkového počtu lze detekovat prenatálně před dosažením viability. Diagnostiku opíráme o čtyři základní pilíře, kterými jsou zevní ohledání, pitva vnitřních orgánů, radiologické vyšetření a mikroskopický obraz (2). Přehled problematiky lze najít ve speciálních monografiích a učebnicích pediatrické patologie (3-6).
MATERIÁL A METODIKA
Náš vlastní soubor představuje 41 případů osteochondrodysplázií, které byly vyšetřeny v Ústavu patologie FN Brno v posledních deseti letech. Vyšetření standardně zahrnovalo předozadní a boční RTG snímek (výjimečně i CT), pitvu a histologické vyšetření vybraných kostí. Geneticky byly došetřovány pouze některé případy. Přehled diagnóz uvádí tabulka (tab. 1). Vyloučili jsme ty, které postrádaly úplnou dokumentaci a nálezy z různých důvodů nezařaditelné. Také opomíjíme širokou skupinu geneticky podmíněných dysostóz. Hypoplázii plic definujeme poměrem hmotnosti plic ke hmotnosti těla menším než 0,012 po 28. týdnu gravidity a poměrem menším než 0,015 u plodů menších (7). Jemnější hodnocení růstu plic umožňují percentilové hodnoty v odpovídajících gestačních týdnech (8). Za letální vady jsou považovány ty, které způsobují hypoplázii plic nebo přirozeně vedou k úmrtí většiny postižených intrauterinně nebo časně po porodu (9).
Tab. 1. Přehled kostních dysplázií v souboru. 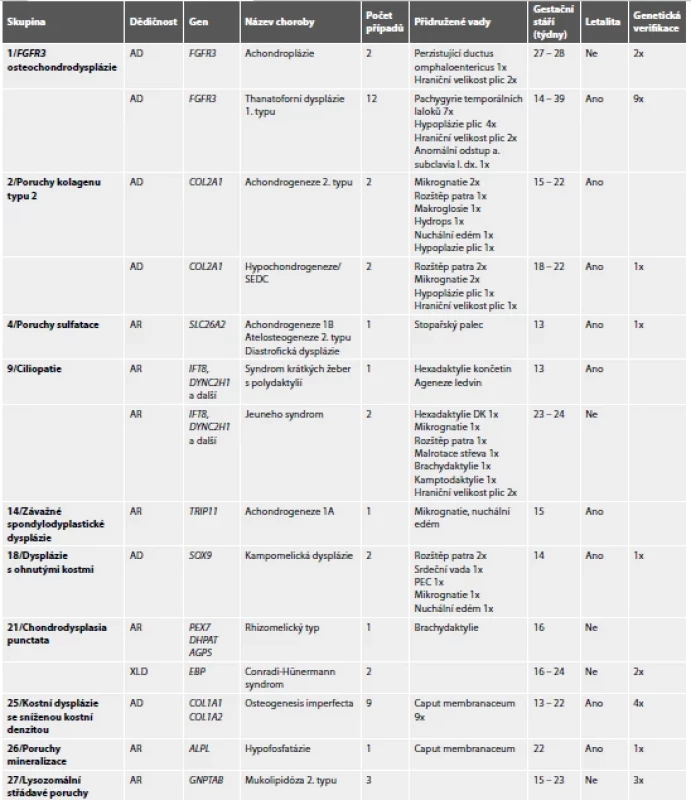
AD – autosomálně dominantní, AR – autosomálně recesivní, FGFR3 – fibroblast growth factor receptor 3, PEC – pes equinovarus congenitus, SEDC – vrozená spondyloepifyzární dysplázie, XLD – X-vázaná dominantní KLASIFIKACE KOSTNÍCH DYSPLÁZIÍ A VLASTNÍ POZOROVÁNÍ
Skupina 1: Kostní dysplázie s mutací genu FGFR3
Heterozygotní achondroplázie je nejčastější neletální kostní dysplázií s četností cca 1 : 25 000 – 30 000 narozených. Průměrná porodní délka 47 cm se zásadně neliší od zdravé populace. Prenatální diagnóza je možná až ve 3. trimestru, protože do 22. – 24. týdne není růst dlouhých kostí významně narušen. Osoby s achondroplázií jsou nízké postavy (průměrná výška žen 125 cm, mužů 130 cm) s velkou hruškovitou hlavou, vyklenutým čelem a sedlovitým nosem. Trup má normální délku a končetiny jsou rhizomelicky zkrácené. Ruka má tvar trojzubce s krátkými prsty („trident hand“). Hrudník je pouze mírně zmenšený. Onemocnění je v 99 % způsobeno bodovou mutací genu pro receptor 3 fibroblastového růstového faktoru (FGFR3) v nukleotidu 1138 (c.1138G>A nebo c.1138G>C). Ta vzniká v 80 % nově, riziko představuje vysoký věk otce. Průměrná délka života se blíží běžné populaci. Rodiče s achondroplázií mohou počít dítě s homozygotní formou achondroplazie, která se podobá thanatoforické dysplázii a je považována za letální (10). My jsme zaznamenali dva plody s heterozygotní achondroplázií porozené ve 27. – 28. týdnu (obr. 1). Zdůrazňujeme, že jsme se nesetkali s žádným případem potvrzené achondroplazie před 24. týdnem.
Obr. 1. Achondroplázie, plod 28. týden. Vpáčený kořen nosu, mírné rhizomelické zkrácení končetin. 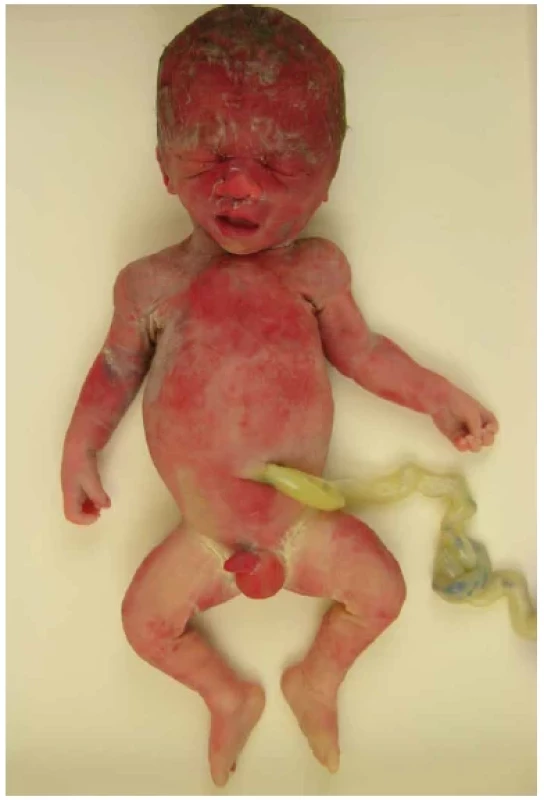
Thanatoforická dysplázie (TD, z řečtiny přinášející smrt) je nejčastější letální kostní dysplázie, jejíž incidence 1 : 20 000 – 50 000 se blíží achondroplázii. Malý hrudník podmiňuje hypoplázii plic, která neumožňuje postnatální přežití bez agresivní ventilační podpory. Ve zcela výjimečných případech žijí pacienti několik let. Podrobně byl zdokumentován zdravotní stav ženy staré 28 let s hlubokým mentálním deficitem, acanthosis nigricans a kvadruparézou při progresivní cervikomedulární kompresi. Závislost na ventilátoru se postupně stala trvalou (11). U TD se kombinuje mikromelie s normální délkou trupu. Donošený novorozenec měří asi 40 cm. Hlava bývá velká s vypouklým čelem a malou obličejovou částí. Kořen nosu je vkleslý. Hrudník je plochý a krátký, bříško vyklenuté. Končetiny jsou silné a zkrácené ve všech segmentech, nadbytečné měkké tkáně se skládají v hluboké záhyby (obr. 2). Ruka s krátkými prsty má tvar trojzubce (12). Zvýšený poměr hmotnosti mozku ke hmotnosti těla svědčí o megalencefalii. Pachygyrie temporálních laloků je cenným diagnostickým znakem, který se objevuje u všech postižených a umožňuje odlišit TD od jiných osteochondrodysplázií (13). TD se dle radiologických kritérií rozděluje na častější typ 1 s femury zakřivenými do tvaru telefonního sluchátka (obr. 3A, 3B) a vzácný typ 2 s rovnými femury. U typu 2 vždy dochází k předčasnému uzávěru lebečních švů (tzv. jetelíčkovitá lebka, „cloverleaf skull“), u typu 1 je kraniosynostóza vzácná. Genotyp těchto variant je odlišný. TD 1. typu je způsobena bodovou mutací genu FGFR3 c.742C>T nebo c.1118A>G, pro typ 2 je specifická mutace c.1948A>G. Dominantní mutace vzniká de novo, riziko výskytu u sourozenců je zanedbatelné. Prenatálně je možné TD rozpoznat UZ skríningem od 12. – 14. týdne. My jsme vyšetřili 12 plodů a novorozenců s TD 1. typu (obr. 4), ale neviděli jsme žádný případ TD typu 2, ani jetelíčkovitou deformaci lebky. Pachygyrii temporálních laloků jsme zaznamenali počínaje 19. týdnem, u menších plodů se nám mozek nedařilo podrobně vyšetřit.
Obr. 2. Donošený novorozenec s thanatoforickou dysplázií. Makrocefalie se širokým klenutým čelem a vkleslým kořenem nosu. Krátký plochý hrudník. Krátké končetiny s nadbytečnými kožními řasami a brachydaktylií. 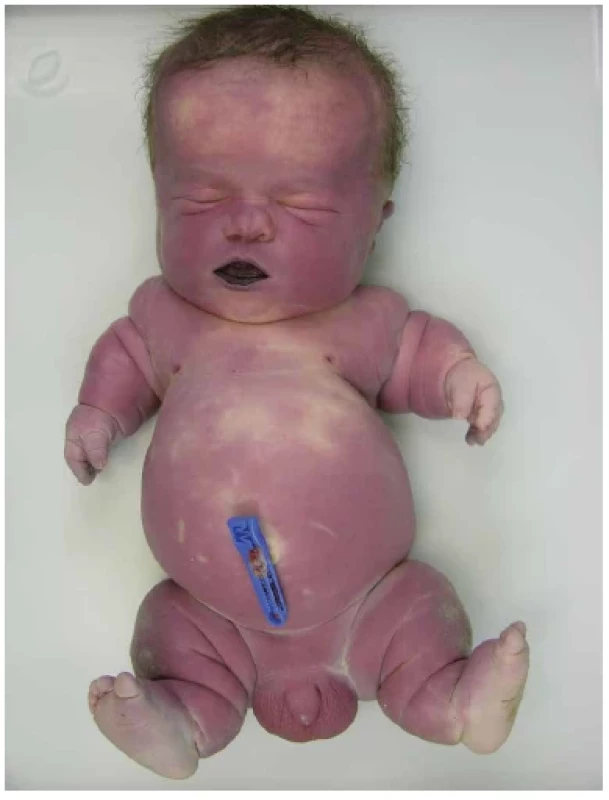
Obr. 3. A: Thanatoforická dysplázie typu 1, novorozenec 39. týden, RTG předozadní projekce. Platyspondylie. Úzký hrudník. Krátké a široké dlouhé tubulární kosti. Ohyb femurů ve tvaru telefonního sluchátka. B: RTG bočná projekce. Vyniká platyspondylie tj. snížená obratlová těla s relativním rozšířením meziobratlových prostor. 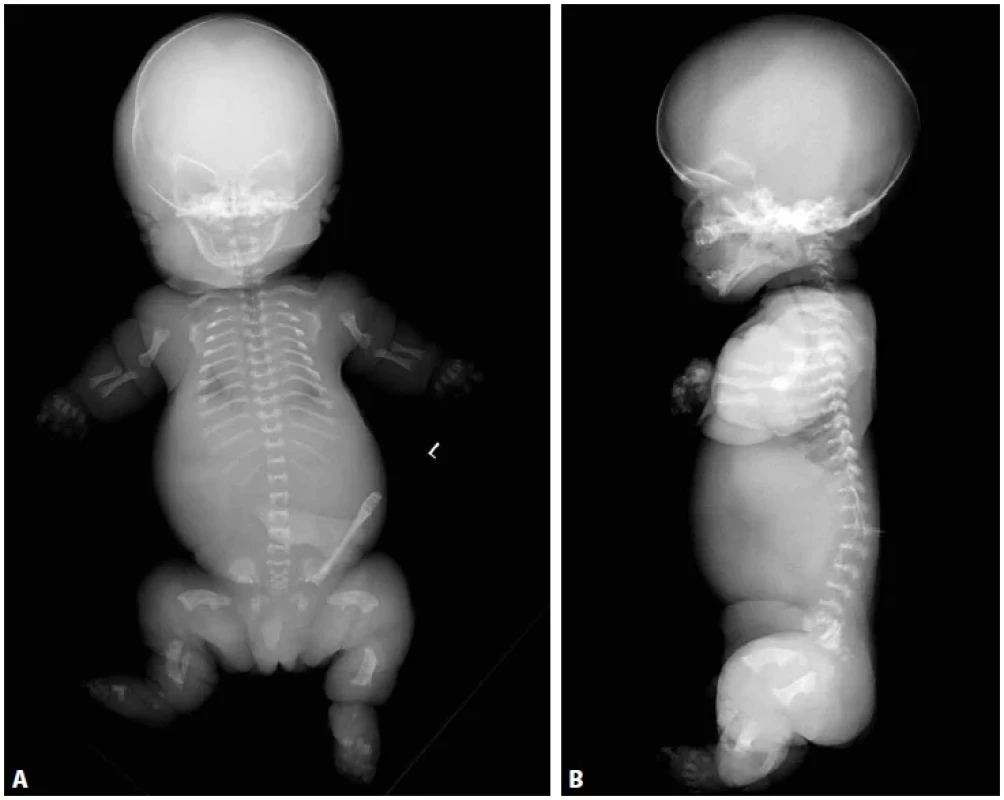
Obr. 4. A: Thanatoforická dysplázie, plod 20. týden. Relativně velké neurokranium, krátký úzký hrudník a rhizomelické zkrácení končetin. Ruka tvaru trojzubce. B: Pachygyrie temporálních laloků mozku, plod 22. týden. 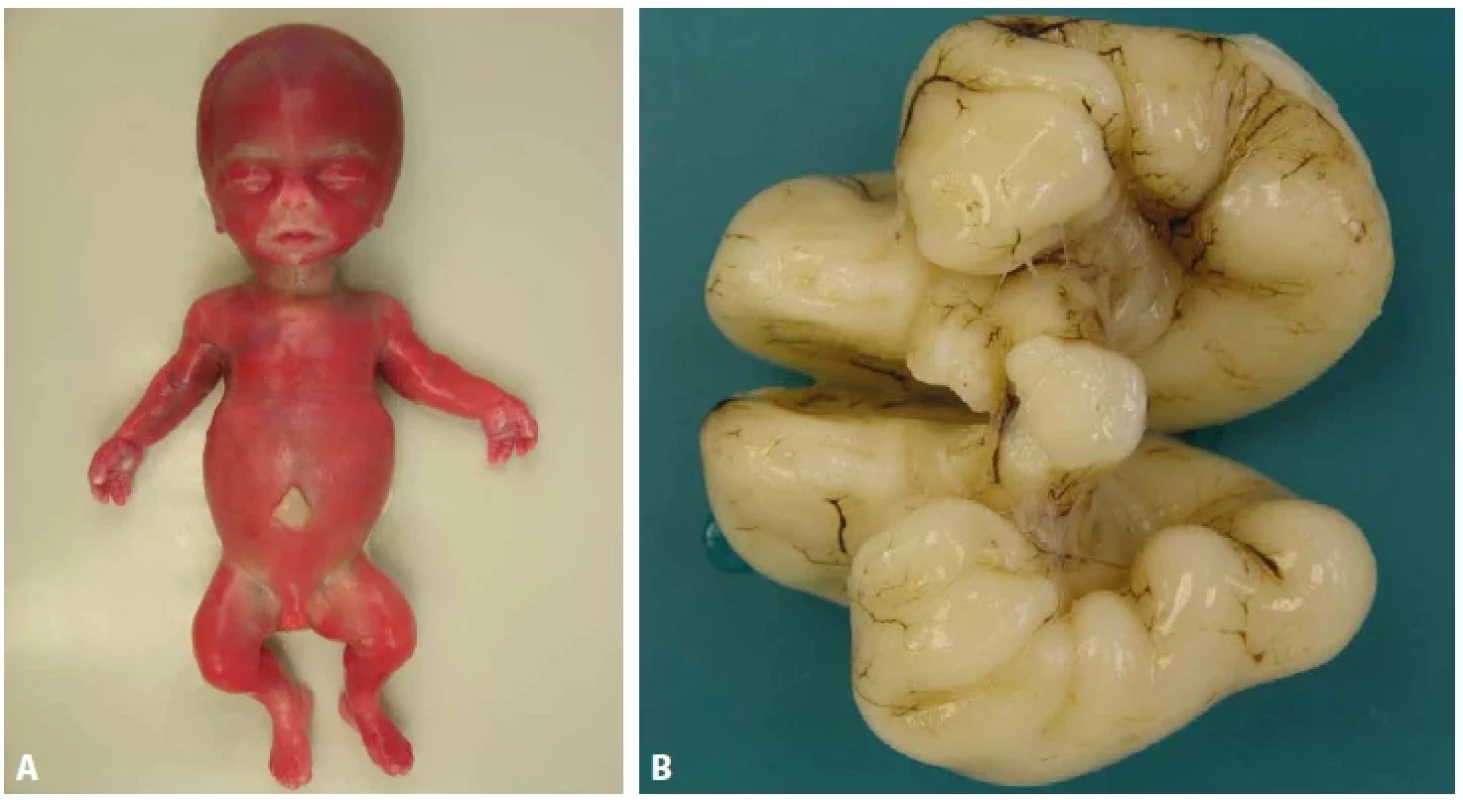
Histologie: Je narušena enchondrální osifikace. Klidová chrupavka má normální stavbu, ale vertikální sloupce chondrocytů v zóně proliferace jsou zkrácené až rudimentární. Převažuje periostální osifikace, která přesahuje za hranici osteochondrální junkce vysoko do epifýzy. Periostální vazivový proužek nepravidelně penetruje růstovou chrupavku, což někdy vede k tvorbě příčných kostních trámců na hranici chrupavky a kosti.
Vlastní pozorování: TD 1. typu byla zjištěna u 4 novorozenců mužského pohlaví gestačního stáří 33, 34, 35 a 39 týdnů. Kostní dysplázie byla vždy rozpoznána prenatálním skríningem 2. trimestru, ale matky se rozhodly pokračovat v graviditě. Těhotenství komplikoval polyhydramnion, častá byla i patologická poloha plodu (zejména čelní). Tělesná délka byla 36 – 41 cm a porodní hmotnost 1660 – 3500 g. Děti se narodily živé, ale kardiorespirační selhání nastupovalo prakticky ihned po porodu. Novorozencům byla se souhlasem rodičů poskytnuta jen komfortně-paliativní péče, exitus letalis nastal za 20 – 75 minut. U dvou pitvaných jsme nalezli hypoplázii plic a abnormální gyrifikaci temporálních laloků mozku. Ve třech rodinách se narodili zdraví sourozenci.
Skupina 2: Kolagenopatie 2. typu
Tato rodina vad vzniká de novo mutací genu pro kolagen 2 (COL2A1), který je produkován chondroblasty hyalinní a elastické chrupavky. Achondrogeneze typu 2 (Langer-Saldino), hypochondrogeneze a vrozená spondyloepifyzární dysplázie (SEDC) nejsou vyhraněnými jednotkami, ale tvoří kontinuální spektrum, jehož krajní varianty achondrogeneze a většinou i hypochondrogeneze jsou letální. U přežívajících jedinců se přikláníme k diagnóze SEDC. U achondrogeneze se kombinuje extrémní mikromelie s krátkým trupem. Novorozenci dosahují konečné délky 25 – 38 cm. Nápadně velká hlava nasedá na krátký krk, obličej má plochý profil s ustupující bradou. Vyskytuje se Pierre-Robinova sekvence (mikrognatie, glossoptóza, rozštěp patra) nebo izolovaný rozštěp patra. Hrudník je krátký a bříško vyklenuté. Plod je často hydropický. Hypochodrogeneze je mírnější variantou achondrogeneze. Fenotyp je obdobný, ale končetiny jsou delší. Malý hrudník vede k hypoplázii plic. Novorozenci se SEDC mají výrazně disproporční krátkou postavu, přičemž horní končetiny se zdají relativně dlouhé v poměru k trupu a krátkým nohám. Hrudník je soudkovitý a obličej má hrubé rysy. Novorozenci trpí po porodu respirační insuficiencí (14-16). My jsme vyšetřili dva hydropické plody se závažnějším fenotypem achondrogeneze (obr. 5, 6) a dva plody s méně závažným fenotypem hypochondrogeneze/SEDC (obr. 7).
Obr. 5. Achondrogeneze typu 2 (Langer-Saldino), plod 22. týden. Hlava vzhledem ke zbytku těla nepoměrně velká. Dolní čelist zmenšená a nos plochý. Končetiny extrémně zkrácené. Nadbytek měkkých tkání budí dojem hydropsu. 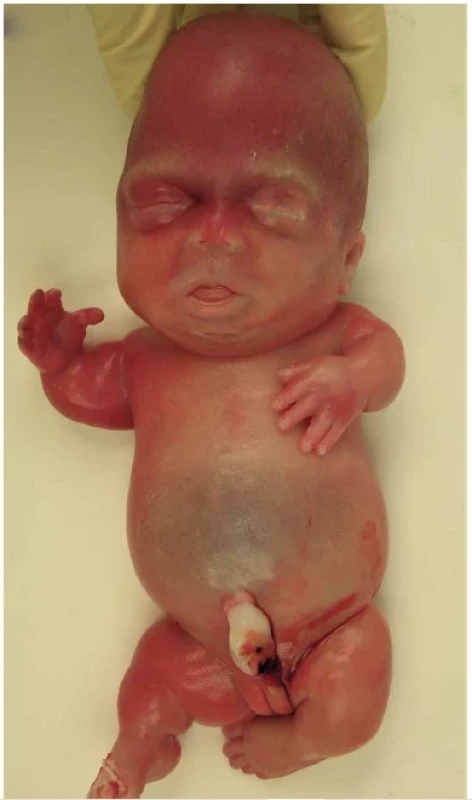
Obr. 6. Achondrogeneze typu 2, plod 22. týden, RTG předozadní projekce. Absence nebo těžce opožděná osifikace obratlových těl a os sacrum, dále os ischii a os pubis. Soudkovitý hrudník s krátkými žebry. Extrémně krátké tubulární kosti s konkávními konci. 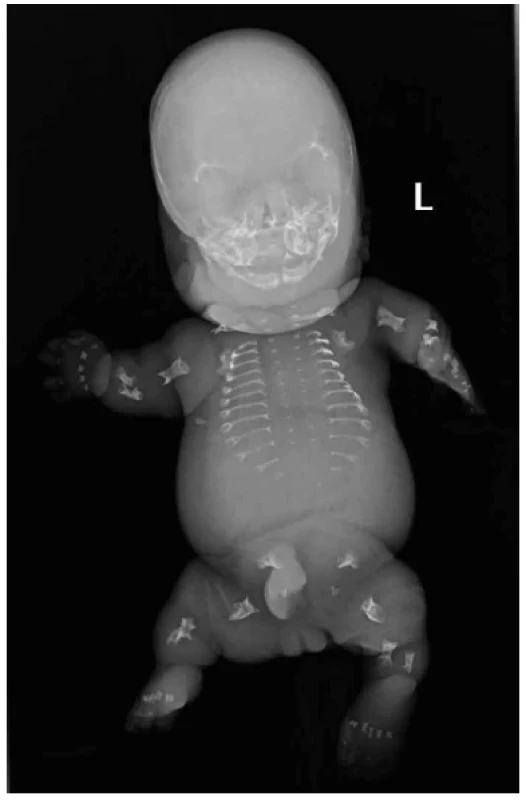
Obr. 7. Plod s hypochondrogenezí/SEDC, 22. týden. Makrocefalie a hrubé rysy obličeje. Horní končetiny jsou delší než končetiny dolní. Zúžený hrudník vede k hypoplázii plic. 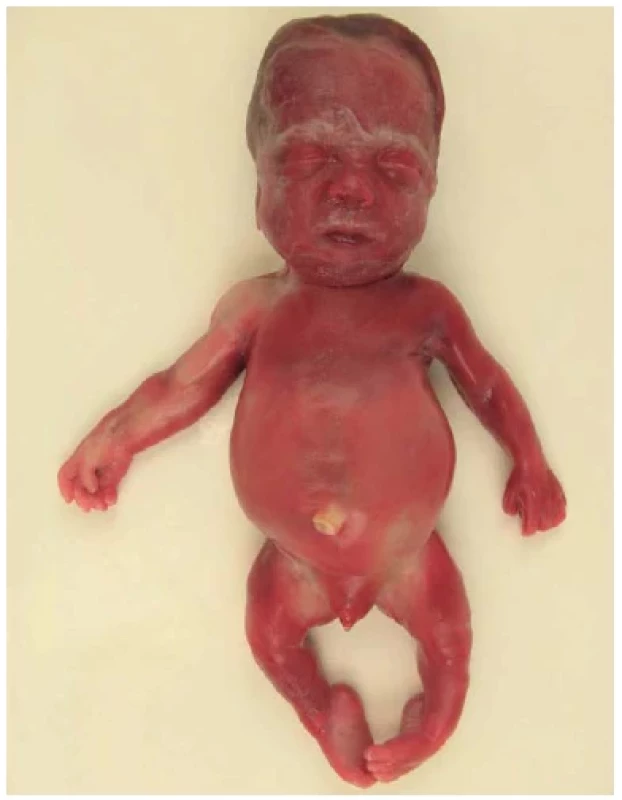
Histologie: Je hrubě narušená enchondrální osifikace. Klidová zóna je je hypercelulární a hypervaskularizovaná. Cévy jsou obklopené vazivovými lemy, v nichž se bohatě větví. U hypochondrogeneze a SEDC nalézáme i nečetné PAS+ cytoplazmatické inkluze.
Skupina 4: Poruchy sulfatace
Jedná se o skupinu velmi vzácných AR dědičných kostních dysplázií, které jsou způsobeny poruchou sulfatace mezibuněčné hmoty chrupavky při mutaci genu pro sulfátový transportér DTDST (diastrophic dysplasia sulfate transporter; gen SLC26A2). Do této rodiny se řadí letální achondrogeneze typu 1B (Parenti - Fraccaro), letální atelosteogeneze typu 2 a jí velmi blízká diastrofická dysplázie (DD, diastrofismus v geologiii označuje deformaci), která je zpravidla slučitelná se životem. Individuální prognózu postiženého jedince je obtížné odhadnout, protože podobně jako u kolagenopatií 2. typu neexistuje mezi jednotkami ostrá dělící hranice. U achondrogeneze 1B je makroskopický nález neodlišitelný od jiných forem achondrogeneze, tj. jedná se o plody s krátkým trupem a extrémní mikromelií, nuchálním edémem či hydropsem. Plody s atelosteogenezí typu 2 a DD mají zkrácené končetiny a equinovarózní deformitu nohou. Patognomickým nálezem je abdukční držení palců na rukou, tzv. stopařský palec („hitchhiker thumb“). Obdobně jsou deformovány i palce na nohou. Běžná je mikrognatie a rozštěp patra. U přeživších se v dětství zhoršuje skolióza hrudní a bederní páteře a kontraktury velkých i malých kloubů. Konečná výška se pohybuje mezi 110 – 130 cm, intelekt je normální (5). Během deseti let jsme se setkali pouze s jediným případem, který spadá do této skupiny.
Histologie: U achondrogeneze 1B je klidová chrupavka hypercelulární s řídkou nehomogenní matrix, v níž jsou patrné koncentrické prstence obkružující chondrocyty. Ty lze zvýraznit speciálním barvením (trichrom, PAS). U DD jsou v klidové chrupavce mnohočetná ložiska rozvláknění a cystické degenerace. U atelosteogeneze 2. typu se oba fenomény kombinují (17).
Vlastní pozorování: Vyšetřili jsme tělesné fragmenty plodu potraceného ve 13+2 týdnu gravidity pro letální kostní dysplázii. Pár kvůli neplodnosti podstoupil in vitro fertilizaci. Na UZ vyšetření bylo popsáno anomální držení palců končetin a hypoplazie čelisti (obr. 8A, 8B). Při pitvě byly omezeně hodnotitelné jen dolní končetiny, jejichž palce byly vychýleny mediálně. Při histologickém hodnocení bylo vysloveno silné podezření na poruchu sulfatace. Cílené vyšetření genu SLC26A2 potvrdilo dvě patogenní sekvenční varianty, z nichž jedna byla již popsána v asociaci s atelosteogenezí typu 2, druhá nebyla dosud popsána. Další graviditu bylo doporučeno plánovat formou asistované reprodukce s preimplantanční diagnostikou embryí.
Obr. 8. A: Atelosteogeneze typu 2, plod 13+0 týden, UZ. Hypoplázie dolní čelisti, hydrops. B: Stopařský palec. 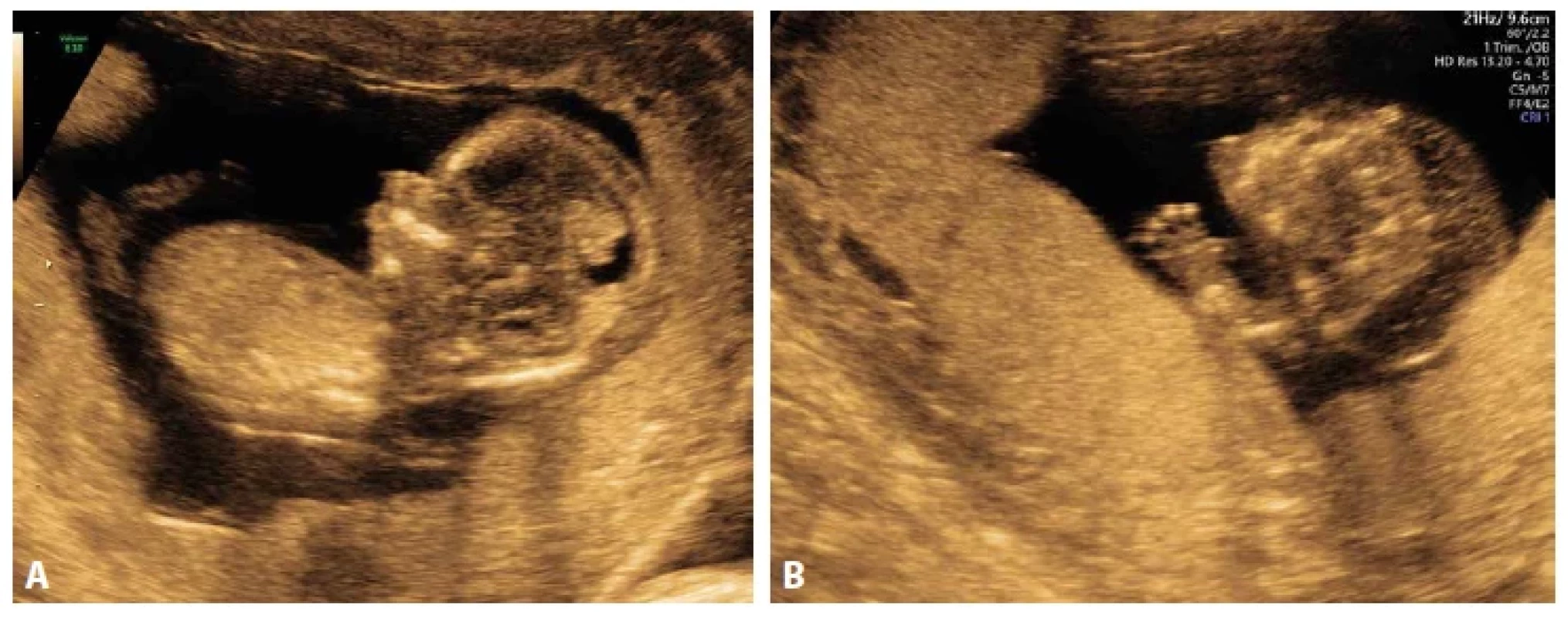
Skupina 14: Závažné spondylodysplastické dysplázie
Tato skupina zahrnuje vzácnou achondrogenezi typu 1A a další jednotky, které jsou autosomálně recesivně dědičné. Achondrogeneze 1A (Houston-Harris) je podle posledních poznatků způsobena mutací genu TRIP11 a je vždy letální. Fenotyp se shoduje s ostatními typy achondrogeneze, ale chybí makrocefalie (18). Setkali jsme se pouze s jediným případem achondrogeneze 1A u 15týdenního plodu (obr. 9).
Obr. 9. Achondrogeneze typu 1A, plod 15. týden. Mikromelie, krátký trup a malý hrudník se podobají jiným typům achondrogeneze, ale hlava není makrocefalická. 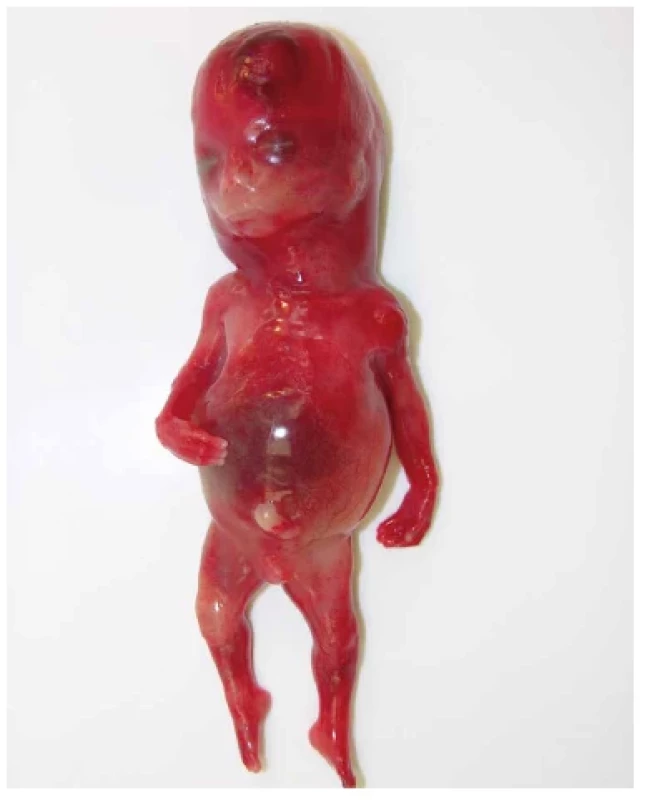
Histologie: Je hrubě dezorganizovaná enchondrální osifikace, v zóně proliferace chybí sloupce a hranice mezi chrupavkou a primární spongiózou je chaotická. Chrupavčitá matrix je normální, homogenní. Ve vakuolizovaných chondrocytech (zejména v klidové zóně) pozorujeme četné PAS+ cytoplazmatické inkluze.
Skupina 9: Ciliopatie s postižením skeletu (dříve syndromy krátkých žeber s polydaktylií)
Tato rodina kostních dysplázií zahrnuje šest základních jednotek, jejichž společným rysem je úzký hrudník s krátkými žebry. Dědí se autosomálně recesivně a jsou geneticky nesourodé. V recentní klasifikaci byly přejmenovány na ciliopatie, protože vznikají poruchou růstu nebo funkce primárních cilií, které vyčnívají z povrchu každé buňky včetně chondrocytu. Z toho vyplývá, že může být postižen jakýkoliv orgán. Časté jsou VVV urogenitálního ústrojí, atrézie GIT, VVV mozku, srdeční vady, mediální rozštěp patra, polycystóza ledvin či nefronoftýza, kongenitální jaterní fibróza, degenerace sítnice, cysty pankreatu, malabsorpční syndrom nebo malrotace střeva. Syndromy krátkých žeber s polydaktylií typu 1 – 4 (short-rib polydactyly syndrome, SRPS) jsou letální kvůli extrémně malému hrudníku. Polydaktylie je konstantním nálezem u typů 1 – 3. Odlišují se podle radiologických detailů. Asfyktická hrudní dysplázie (ATD, Jeuneho syndrom) s incidencí 1 : 100 000 – 130 000 je navzdory svému názvu se životem slučitelná, ale dětská úmrtnost je zvýšená v důsledku respirační insuficience a recidivujících respiračních infekcí. Hrudník je úzký a dlouhý, dole se může zvonovitě rozšiřovat. Tělesná výška je spíše podprůměrná. Postava je disproporční se zkrácenými končetinami a brachydaktylií. Postaxiální polydaktylii na nohou má pouze pětina pacientů. Nepříznivou prognózu lze zvrátit chirurgickou expanzí hrudníku. U přežívajících se dechové problémy s věkem zmenšují a do popředí vystupuje postižení ledvin, které může skončit renálním selháním. Psychomotorický vývoj je normální. V dnešní době je známo více než 12 kauzálních genů a další přibývají (IFT80, DYNC2H1 etc.). Děti s chondroektodermální dysplázií (Ellisův-van-Creveldův syndrom, EVC) mají jen mírně zmenšený hrudník, nicméně polovina postižených má srdeční vadu, která určuje prognózu. Charakteristické jsou ektodermální defekty (dentální anomálie, hypoplazie prstů a nehtů) a hexadaktylie na rukou. Syndrom je způsoben mutací v genech EVC a EVC2. Všechna jmenovaná onemocnění mohou být diagnostikována prenatálně (19-22). Vyšetřili jsme dva plody s ATD a jeden plod se SRPS, u nějž RTG obraz vzhledem k nízkému gestačnímu stáří nedovolil podrobnější subklasifikaci, ale nejspíše se jednalo o SRPS typu 1/3.
Histologie: Nespecifické změny zahrnují mírnou dezorganizaci růstové ploténky se zkrácením zóny proliferace a hypertrofie s mírně nepravidelnými sloupci. Odchylky mohou být minimální.
Vlastní pozorování: 23týdenní plod s úzkým hrudníkem a menší velikostí plic aniž splňoval kritéria pro hypoplazii (10. percentil, index plicní hypoplazie 0,022). Na pravé noze byla postaxiální polydaktylie, na rukou brachydaktylie (obr. 10). Vedlejším nálezem byla malrotace střeva. V následujícím těhotenství byla od 16. týdne opět pozorována hypoplázie hrudníku a zkrácení dlouhých kostí s polydaktylií. V termínu se narodil eutrofický chlapec s porodní hmotností 3370 g a délkou 50 cm. Poporodní adaptace byla standardní. Byly odstraněny nadpočetné prsty na obou dolních a levé horní končetině. Dnes je chlapci 6 let a s výjimkou menšího asymetrického hrudníku nejsou pozorovány žádné odchylky od fyziologického vývoje ani vyšší nemocnost. Pacient dochází na pravidelnou dechovou rehabilitaci a je preventivně sledován na nefrologii a pneumologii. Genetické vyšetření panelu genů pro ATD bylo negativní, ale nezahrnovalo geny nově objevené. Další sourozenci, dvojčata, jsou zdraví. Tento případ ilustruje latentní formu ATD s velmi příznivým klinickým průběhem.
Obr. 10. Asfyktická hrudní dysplázie, plod 23. týden. Hrudník je úzký a protáhlý. Na pravé noze postaxiální polydaktylie. 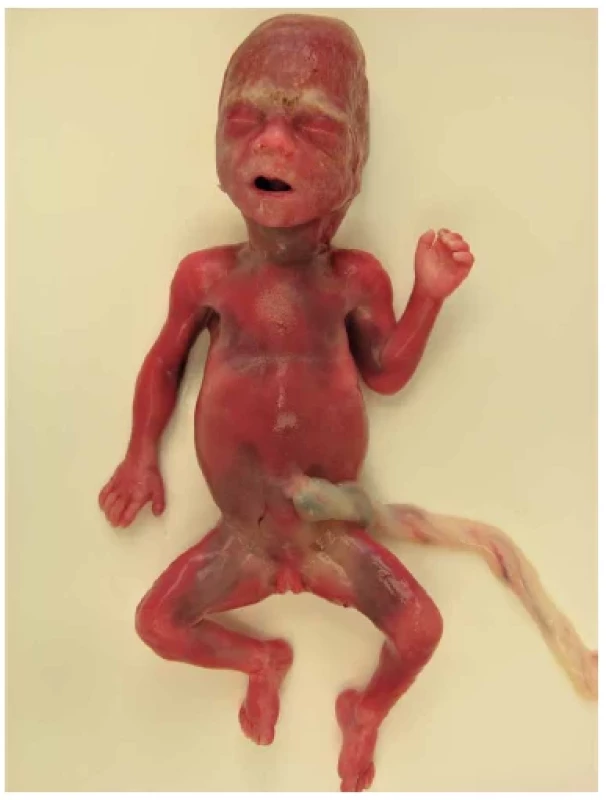
Skupina 21: Chondrodysplasia punctata
Skupinu tvoří několik jednotek s variabilním typem dědičnosti a závažnosti. Na RTG je rozpoznáme podle ektopických ložisek zvápenatění v epifyzárních chrupavkách. Bodovité kalcifikace mohou být i v chrupavkách hrtanu. Chondrodysplasia punctata rhizomelického typu (CDP) je AR dědičná a dělí se na 3 typy dle kauzální mutace (geny PEX7, DHPAT, AGPS). Je způsobena generalizovaným postižením funkce peroxisomů. Vyznačuje se symetrickým zkrácením proximálních segmentů končetin. Nos je plochý a krk krátký. Projevuje se těžkou mentální retardací, neprospíváním a spastickou tetraplegií. K úmrtí dochází v dětském věku, terapie je pouze symptomatická. Nejčastější nerhizomelická forma čili syndrom Conradi-Hünermann (Conradiho nemoc) je X-dominantní a postihuje pouze dívky, protože u mužských embryí je letální. Mutace se nachází v genu EBP. Zkrácení horních a dolních končetin je stranově asymetrické, také obličej je nesouměrný se sedlovitým nosem. Později se objevuje kyfoskolióza. K dalším komplikacím se řadí ichtyóza, strukturální změny vlasů a katarakta. Míra postižení je ovlivněna inaktivací X chromozomu. Těžké formy mohou končit fatálně, ale většina dívek přežívá a má normální intelekt (23). Konečná výška je asi 130 cm. Zaznamenali jsme dva plody se syndromem Conradi-Hünermann a jeden případ rhizomelické formy CDP.
Histologie: Pozorujeme ložiska myxoidní degenerace a dystrofického zvápenatění v chrupavkách. U velmi malých plodů mohou kalcifikace chybět.
Vlastní pozorování: Vyšetřili jsme dva plody s verifikovaným syndromem Conradi-Hünermann od stejně postižených matek. 16týdenní plod nebyl ničím nápadný a na RTG bylo popsáno nevýrazné zkrácení horních končetin bez kalcifikací. Matka byla operována pro skoliózu a je sledována s ichtyózou a inkontinencí pigmentu. U většího plodu stáří 24 týdnů byl fenotyp i RTG nález typický s bodovitými kalcifikacemi (obr. 11).
Obr. 11. Syndrom Conradi-Hünermann, plod 24. týden, RTG. Tečkovité kalcifikace na koncích dlouhých končetinových kostí, v oblasti carpu a tarzu, ve spinózních a transverzálních výběžcích obratlových těl, os ischium a os pubis. 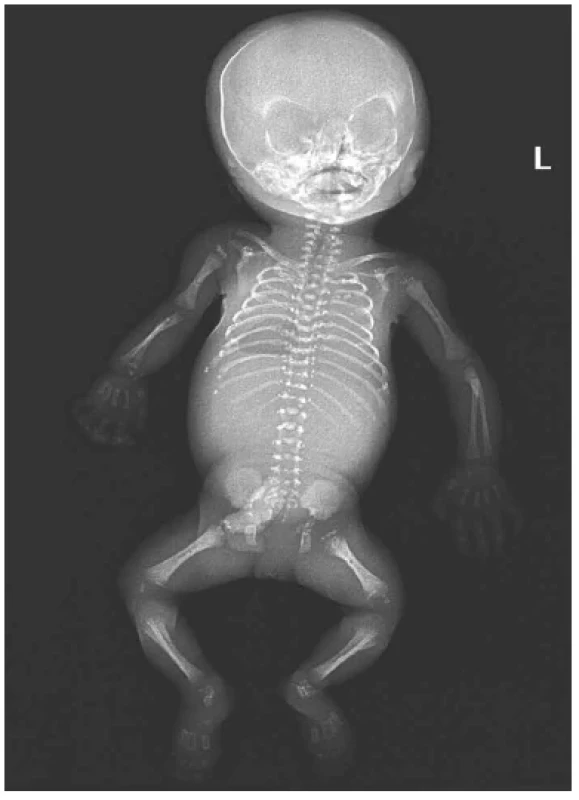
Skupina 18: Kostní dysplázie s ohnutými kostmi
Nejdůležitější jednotkou je kampomelická dysplázie (z řečtiny ohyb), která je způsobena mutací genu SOX9. Gen zásadně ovlivňuje nejen diferenciaci chondrocytů, ale i vývoj fetálního varlete. Dědí se autosomálně dominantně a mutace vzniká de novo. Incidence je odhadována na 1 : 200 000 narozených. Choroba má velmi nepříznivý průběh s mortalitou až 90 % v prvních dvou letech života. Příčinou smrti bývá chronická respirační insuficience při tracheobronchomalácii. Častý je i stridor při hypoplázii laryngu, epizody apnoe a respirační infekce. Malé procento pacientů přežívá do dospělosti. Postižení jsou malého vzrůstu se zkrácením a angulací dlouhých kostí, zejména femuru a tibie. Dolní končetiny jsou kratší než horní. Tibie jsou ventrálně ohnuty v ostrém úhlu, zevně je patrná ostruha nebo vtažení kůže. Častý je pes equinovarus a kongenitální luxace kyčlí. U plodů mužského pohlaví se objevuje pseudohermafroditismus, v krajním případě i „ sex-reversal“ syndrom. Běžná je kraniofaciální stigmatizace s makrocefalií, plochým profilem obličeje, mikrognatií a rozštěpem patra. Přidruženy mohou být srdeční vady (24,25). Tzv. kyfomelická dysplázie není skutečnou nosologickou jednotkou. Podle současných poznatků se jedná o heterogenní skupinu kostních dysplázií s ohnutými femury, jejichž odlišující znaky se vyvíjejí až postnatálně. V našem souboru jsme vyšetřili dva 14týdenní plody ženského pohlaví s kampomelickou dysplázií (obr. 12).
Obr. 12. Kampomelická dysplázie, plod 14. týden, CT. Ohyb femurů a tibií. Hypoplázie lopatek. Hypoplastické krční obratle. Hypoplazie mandibuly. Úzké a vertikálně probíhající lopaty kostní kyčelních. Hrudník malý zvonovitý s 11 páry žeber. 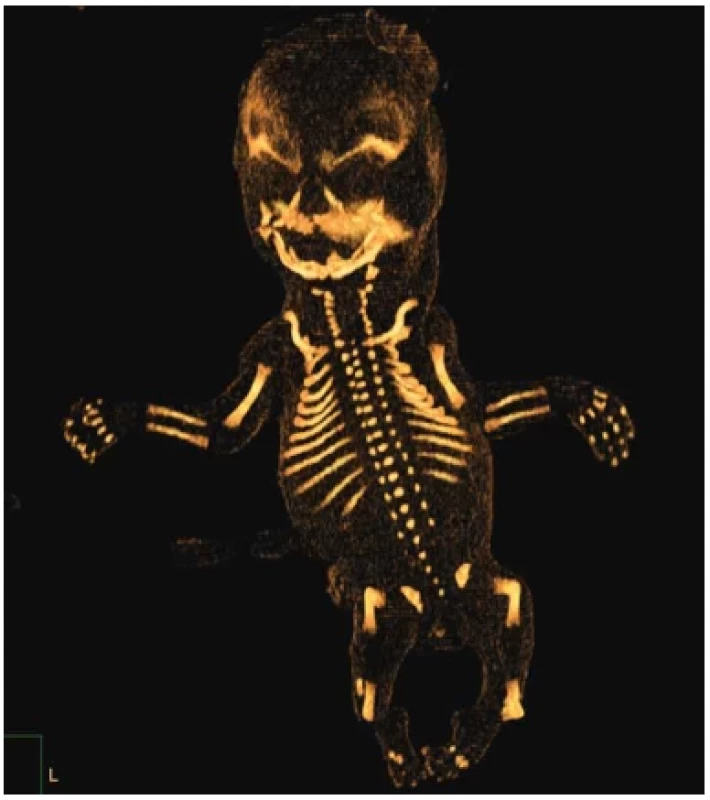
Histologie: Nenacházíme významné odchylky od normy.
Skupina 25: Kostní dysplázie s nízkou kostní denzitou
Osteogenesis imperfecta (OI) s četností 1 : 15 000 – 20 000 narozených je druhou nejčastější letální kostní dysplazií v praxi patologa. Současná klasifikace opouští molekulárně-genetické hledisko a vrací se k původnímu klasifikačnímu schématu podle Sillence z r. 1979, které rozeznává 4 typy dle závažnosti. Typ 2 (Vrolikova nemoc) je perinatálně letální, protože děti se rodí mrtvé následkem porodního poranění nebo umírají brzy po porodu na respirační selhání. Prenatálně ji lze rozpoznat od 14. týdne. Podrobněji jsou podle RTG nálezu rozpoznávány typy 2A, 2B a 2C (obr. 13). Plody s OI typu 2 mají kulatou hlavu a blanitou lebku (caput membranaceum). Horní i dolní končetiny jsou nepravidelně deformované, ohnuté a sekundárně zkrácené v důsledku mnohočetných zlomenin. Na žebrech jsou svalky jako korálky růžence. Skléry plodu nejsou modré. OI typu 3 s progresivními deformitami je velmi závažná, ale zpravidla slučitelná se životem. Prenatální diagnóza je možná od 18. – 20. týdne. OI je nejčastěji způsobena mutacemi genů COL1A1 nebo COL1A2 pro kolagen typu 1. Většina mutací vzniká de novo. Opakovaný výskyt v rodině bývá výjimečně způsoben gonádovým mozaicismem. Riziko postižení dítěte je teoreticky až 50 %, ale v praxi je pozorováno riziko nižší (27 %). Rodič s gonádovým mozaicismem bývá asymptomatický, při současné somatické mozaice může mít subklinické projevy (26). Velmi vzácné jsou nekolagenní typy OI, u nichž převládá AR dědičnost (27,28). My jsme viděli 9 případů OI počínaje 13. týdnem (obr. 14). Během potratu a manipulace s křehkými ostatky snadno docházelo k čerstvým frakturám a ruptuře lebky. Povrchní pozorovatel může tento artefakt zaměnit s anencefalií.
Obr. 13. Osteogenesis imperfecta (vs. 2C dle Sillence), plod 13. týden, RTG. Generalizovaná demineralizace skeletu, defektní osifikace neurokrania. Vícečetné fraktury kostí, mikromelie. 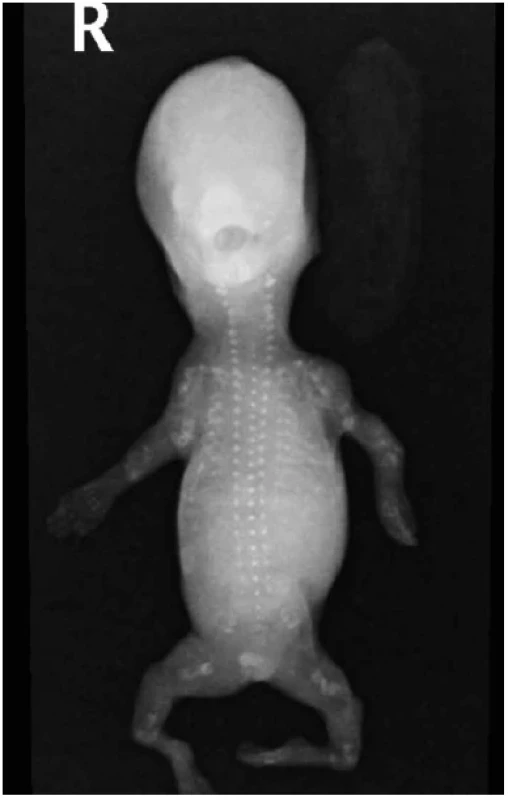
Obr. 14. Osteogenesis imperfecta, plod 14. týden. V důsledku zlomenin jsou končetiny sekundárně deformované a zkrácené. Hlava je měkká, obličej triangulární se špičatou bradou. 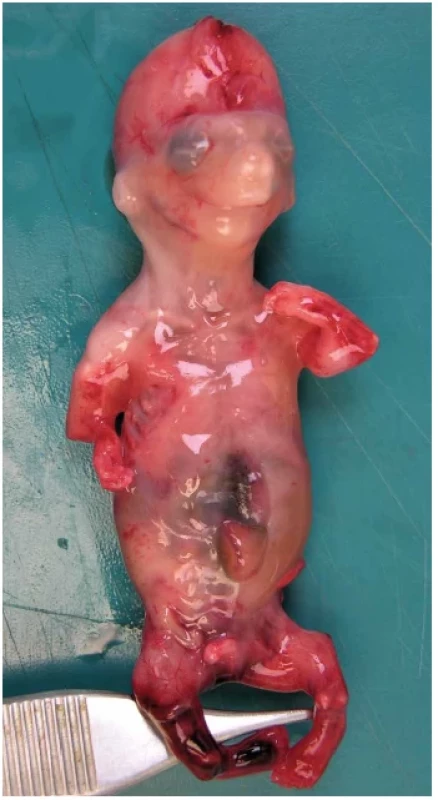
Histologie: Růstová chrupavka má relativně normální vzhled. Kortex je tenký až neznatelný, kostní trámce úzké a hypercelulární. Zlomeniny se hojí chrupavčitým svalkem.
Vlastní pozorování: V jediné rodině jsme se setkali s opakovaným výskytem perinatální letální OI. Rodiče byli zdraví bez příbuzenských vazeb a měli z první gravidity zdravou dceru. Následující čtyři těhotenství skončila časným potratem. V šesté a sedmé graviditě byla zjištěna letální kostní dysplázie. OI byla potvrzena pitvou i radiologickým vyšetřením obou plodů. Genetické vyšetření identifikovalo heterozygotní mutaci v genu COL1A2. U rodičů tato mutace zjištěna nebyla. Tento fenomén lze vysvětlit gonádovým mozaicismem, při němž dominantní mutace vzniká v zárodečných buňkách a je přenosná na potomky.
Skupina 26: Poruchy mineralizace
Do skupiny řadíme onemocnění, která vedou ke vzniku hypofosfatemické křivice. Nejvýznamnější je hypofosfatázie (HPP), která vzniká mutací genu ALPL pro alkalickou fosfatázu (ALP) a projevuje se postižením skeletu, extraskeletálními symptomy a nízkou koncentrací ALP v séru. Podle závažnosti ji dělíme na perinatální, infantilní, dětskou a adultní formu. Incidence závažných forem je v Evropě 1 : 300 000. Perinatální HPP je letální a její dědičnost je autosomálně recesivní. Prenatální diagnóza je možná počínaje 2. trimestrem. Končetiny jsou zkrácené, kosti se ohýbají nebo lámou. Na fibule a ulně mohou vyrůstat exostózy („Bowdler spurs“). Lebka je brachycefalická a měkká. Skelet je demineralizovaný, ovšem distribuce změn je nerovnoměrná a liší se pacient od pacienta (obr. 15). Respirační úsilí je kvůli měkkému hrudníku málo účinné a to vede k dechové nedostatečnosti. Novorozenci jsou dráždiví a mívají křeče. Bez léčby umírají v prvních týdnech či měsících života. Neméně závažná infantilní HPP je diagnostikována do 6 měsíců po porodu. Od roku 2015 je v ČR pro děti dostupná substituční enzymatická terapie pomocí rekombinantní ALP. Léčba zásadně zlepšuje životní prognózu pacientů a její výsledky jsou velmi povzbudivé, i když někteří pacienti s klinicky nejtěžšími formami zůstávají polymorbidní (29,30). Za posledních 10 let jsme diagnostikovali perinatální letální HPP u jednoho plodu.
Obr. 15. Hypofosfatázie, plod 22. týden, RTG. Caput membranaceum. Krátká tenká žebra a tubulární kosti. Absence osifikace celých kostí - nejčastěji krátké tubulární, calcaneus. Defektní osifikace metafýz, oblouků obratlových těl, kostí kyčelních a lopatek. Femury a tibie jsou ohnuty. 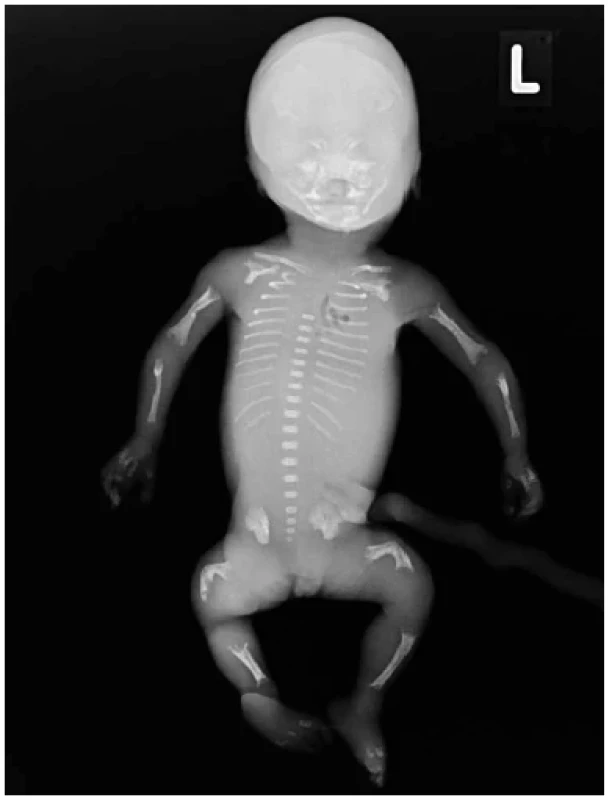
Histologie: Nález se shoduje s těžkou rachitidou. Sloupce jsou nepravidelné. Zóna hypertrofické chrupavky je mohutně prodloužena a zasahuje v podobě jazykovitých výběžků až do diafýzy, protože její resorpce, zvápenatění a primární osifikace neprobíhají adekvátně. Osteoid zůstává nemineralizovaný.
Skupina 27: Lysozomální střádavé choroby s postižením skeletu
Existuje řada metabolických poruch, které mají vliv na skelet, ale většina se během intrauterinního vývoje neprojeví. Výjimkou je mukolipidóza 2. typu. Je to historický název pro autosomálně recesivně dědičné onemocnění způsobené deficitem N-acetylglukosaminylfosfotransferázy. To vede k poruše transportu prekurzorů lysozomálních enzymů do nitra této organely, což má za následek mnohočetnou poruchu aktivity lysozomálních enzymů a hromadění nedegradovaného materiálu (oligosacharidů, lipidů i mukopolysacharidů). Manifestuje se faciální dysmorfií připomínající syndrom Hurlerové, ztuhnutím kloubů, mírnou hepatosplenomegalií a psychomotorickou retardací (31). U novorozenců byly popsány přechodné změny na skeletu, které odpovídají křivici či hyperparathyreóze. Generalizovaná osteopenie může vést k frakturám, zkrácení a ohnutí dlouhých kostí. Tyto projevy se časem mění v typický RTG obraz dysostosis multiplex (32). Průběh choroby je progresivní a prognóza špatná, protože většina postižených umírá okolo poloviny prvního decenia na marasmus a respirační infekce. Cílená terapie neexistuje.
Vlastní pozorování: Familiární případ mukolipidózy 2. typu jsme rozpoznali u dvou plodů potracených ve 23. a 20. týdnu pro neletální kostní dysplázii. Rodiče, dosud bezdětní, byli v příbuzenském vztahu. Plody měly mírně zkrácené končetiny, brachycefalii a plochý nos se širokým kořenem (obr. 16). Kosti byly křehké a při vyšetření se snadno lámaly, proto jsme u prvního postiženého učinili chybnou diagnózu osteogenesis imperfecta. RTG nález odpovídal osteoporóze s nečetnými zlomeninami a deformitami, prořídlá struktura připomínala hyperparathyroidismus. Tomu odpovídal mikroskopický nález tenkých kostních trámců s fibrózou dřeněa vystupňovanou aktivitou osteoklastů. Střádání jsme viděli v podocytech glomerulů a placentě, jíž dominovala vakuolizace syncytiotrofoblastu. Ve třetí graviditě byla provedena biopsie choriových klků a cílená DNA analýza, která potvrdila postižení plodu. Těhotenství bylo přerušeno v 15. týdnu. Páru bylo doporučeno umělé oplodnění a preimplantační genetické testování na monogenní choroby u embryí. Ve čtvrté graviditě se narodilo zdravé dítě.
Obr. 16. Mukolipidóza 2. typu, plod 20. týden. Stigmatizovaný plod s brachycefalií, hrubšími rysy obličeje a širokým kořenem nosu. Končetiny jsou mírně zkrácené v důsledku osteoporózy. 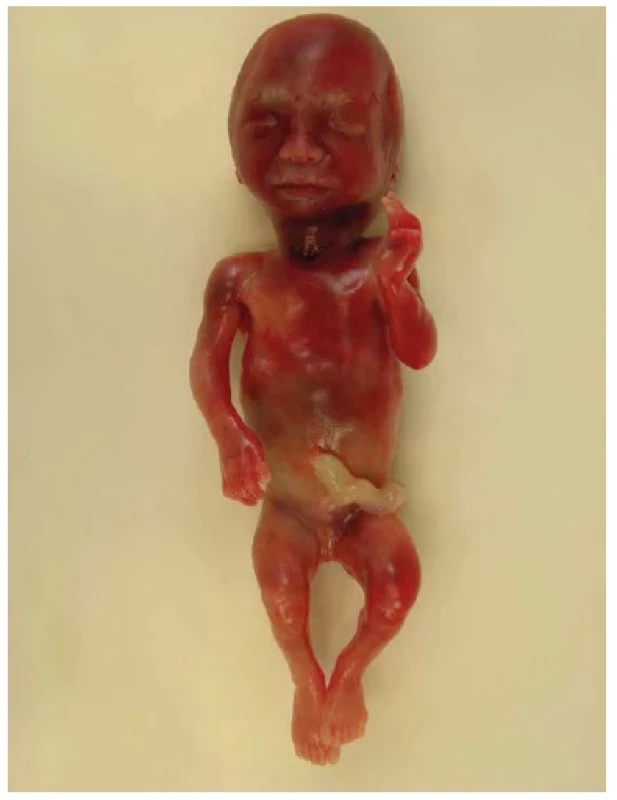
DISKUZE
Stále časnější ultrazvuková diagnostika, která detekuje mnohé letální kostní dysplázie již na konci 1. trimestru, klade na patologa a radiologa značné nároky. Genetické vyšetření panelu genů metodou NGS je dostupné, ale zůstává časově i finančně náročné. Patomorfologické vyšetření a rentgenový snímek proto zůstávají stěžejními diagnostickými metodami.
Vypozorovali jsme, že ve 2. trimestru je zevní nález pro jednotlivé rodiny kostních dysplázií poměrně charakteristický. Obtížnější je hodnocení plodů menších, fragmentovaných nebo pokročile macerovaných. Některé kostní dysplázie jsou provázeny typickými stigmaty a extraskeletálními malformacemi: pachygyrie temporálních laloků mozku u TD, rozštěp patra a hydrops u achondrogeneze 2. typu; srdeční vady a rozštěp patra u kampomelické dysplázie, stopařský palec u diastrofické dysplázie, polydaktylie u ciliopatií a caput membranaceum u OI a hypofosfatázie.
V našem souboru jsme většinu vad (31 ze 41) hodnotili jako letální. Míra plicní hypoplazie závisela na gestačním stáří, takže ani u letálních osteochondrodysplázií s úzkým hrudníkem jsme ji nepozorovali před 19. týdnem, při jemnějším hodnocení podle percentilových tabulek jsme viděli abnormální velikost plic nejdříve v 18. týdnu. U plodů s ATD a achondroplázií se velikost plic pohybovala pod 10. percentilem, ale nesplňovala přísnější kritérium plicní hypoplázie. Kostní dysplázie s nízkou kostní denzitou a poruchou mineralizace se nepojily s hypoplázií plic. K respirační insuficienci vede nedostatečná mineralizace hrudního koše, hypotonie a někdy i centrální příčiny. Tracheobronchomalácie zhoršuje dýchání u pacientů s kampomelickou dysplázií.
Histologické vyšetření kostí je pouze pomocné. Největším přínosem byla typizace achondrogeneze (typy 1A, 1B a 2), diagnostika poruch sulfatace a odlišení OI od hypofosfatázie a mukolipidózy. Radiologické vyšetření má velkou váhu a důrazně upozorňujeme, že stanovení diagnózy bez řádně provedeného RTG vyšetření vede k řadě omylů.
ZÁVĚR
K nejčastějším osteochondrodyspláziím, které jsme diagnostikovali v našem souboru 41 případů, patří thanatoforická dysplázie 1. typu (12 případů) a osteogenesis imperfecta typu 2 dle Sillence (9 případů), které reprezentovaly polovinu z celkového počtu (graf 1). Třetí nejčastější byly poruchy kolagenu typu 2 (4 případy). Vesměs se jedná o letální kostní dysplázie, které se v rodině neopakují, pokud vznikají čerstvou dominantní mutací; výjimkou je gonádální mozaicismus u osteogenesis imperfecta. Autosomálně recesivně dědičné kostní dysplázie jsou natolik vzácné, že i na fakultním pracovišti uvidíme nejvýše jeden případ za 10 let. Jejich diagnóza je velkou výzvou, do níž se musí zapojit všechny odbornosti (prenatální specialista, patolog, radiolog a genetik).
Graf 1. Zastoupení kostních dysplázií v souboru. 
TD – thanatoforická dysplázie, OI – osteogenesis imperfecta, CDP – chondrodysplasia punctata Správné určení diagnózy umožňuje rodičům plánovat další těhotenství s ohledem na způsob dědičnosti, prognózu a preventivně léčebné možnosti, které v dnešní době zahrnují nejen umělé ukončení těhotenství, ale i preimplantační genetické testování, postnatální enzymatickou substituční terapii nebo chirurgickou expanzi hrudníku.
PODĚKOVÁNÍ
Autoři děkují kolegům patologům, kteří se podíleli na pitvě některých případů, jmenovitě lékařkám I. Babánkové, J. Hausnerové, M. Chovancové a A. Nazarčukové. Poděkování za spolupráci na některých případech směrujeme i ke klinickým genetičkám MUDr. R. Gaillyové, Ph.D., MUDr. V. Hořínové a MUDr. D. Leznarové. V případu familiární mukolipidózy poskytl cenné rady a potvrdil naši diagnózu prof. MUDr. M. Elleder, DrSc., in memoriam.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Marta Ježová, Ph.D.
Ústav patologie FN Brno
Jihlavská 20
625 00, Brno
tel.: +420 531 231 946
e-mail: Jezova.Marta@fnbrno.czCesk Patol 2023; 59(2): 68–79
Zdroje
1. Bonafe L, Cormier-Daire V, Hall C et al. Nosology and classification of genetic skeletal disorders: 2015 revision. Am J Med Genet Part A 2015; 167A: 2869–2892.
2. Konstantinidou AE, Agrogiannis G, Sifakis S et al. Genetic skeletal disorders of the fetus and infant: pathologic and molecular findings in a series of 41 cases. Birth Defects Res A Clin Mol Teratol 2009; 85(10): 811–821.
3. Spranger JW, Brill PW, Nishimura G, Superti - Furga A, Unger S. Bone dysplasias. An atlas of genetic disorders of skeletal developement. New York: Oxford University Press; 2012.
4. Nikkels PGJ. The skeletal system. In: Keeling JW, Khong TY, eds. Fetal and neonatal pathology (4th ed). London: Springer-Verlag; 2007 : 770–794.
5. Mařík I, Maříková A, Povýšil C. Kostní genetické choroby. In: Povýšil C, ed. Patomorfologie chorob kostí a kloubů. Praha: Galén; 2017, 17–101.
6. Sillence DO, Horton WA, Rimoin DL. Morphologic studies in the skeletal dysplasias. Am J Pathol 1979; 96(3): 813–870.
7. Wiggelsworth JS, Desai R, Guerrini P. Fetal lung hypoplasia: biochemical and structural variations and their possible significance. Arch Dis Child 1981; 56 : 606–615.
8. De Paepe ME, Friedman RM, Gundogan F, Pinar H. Postmortem lung weight/body weight standards for term and preterm infants. Pediatr Pulm 2005; 40 : 445–448.
9. Wilkinson D, de Crespigny L, Xafis V. Ethical language and decision-making for prenatally diagnosed lethal malformations. Semin Fetal Neonatal Med 2014; 19(5): 306–311.
10. Pauli RM. Achondroplasia: a comprehensive clinical review. Orphanet J Rare Dis 2019; 14(1): 1.
11. Nikkel SM, Major N, King JW. Growth and development in thanatophoric dysplasia - an update 25 years later. Clin Case Rep 2013; 1(2): 75–77.
12. Pokrývková M, Poláčková R. Thanatoforická dysplázie. Pediatr Praxi 2013; 14(6), 386-388.
13. Vogt C, Blaas HG. Thanatophoric dysplasia: autopsy findings over a 25-year period. Pediatr Dev Pathol 2013; 16(3): 160–167.
14. Gregersen PA, Savarirayan R. Type II Collagen Disorders Overview. In: Adam MP, Ardinger HH, Pagon RA et al, eds. GeneReviews ® [Internet]. Seattle (WA): University of Washington; 2008 [updated 2019 Apr 25].
15. Krakow D. Skeletal dysplasias. Clin Perinatol 2015; 42(2): 301–319.
16. Saldino RM. Lethal short-limbed dwarfism: achondrogenesis and thanatophoric dwarfism. Am J Roentgenol Radium Ther Nucl Med 1971; 112(1): 185–197.
17. Quereshi F, Johnson SF, Johnson MP, Hume RF, Evans MI, Yang SS. Histopathology of Fetal Diastrophic Dysplasia. Am J Med Genet 1995; 56 : 300-303.
18. Borochowitz Z, Lachman R, Adomian GE et al. Achondrogenesis type I: Delineation of further heterogeneity and identification of two distinct subgroups. J Pediatr 1988; 112 : 23–31.
19. Huber C, Cormier-Daire V. Ciliary disorder of the skeleton. Am J Med Genet C Semin Med Genet 2012; 160C(3): 165–174.
20. Chen H. Asphyxiating Thoracic Dystrophy. In: Chen H, ed. Atlas of Genetic Diagnosis and Counseling. New York: Springer-Verlag; 2012 : 157–166.
21. Keppler-Noreuil KM, Adam MP, Welch J, Muilenburg A, Willing MC. Clinical insights gained from eight new cases and review of reported cases with Jeune syndrome (asphyxiating thoracic dystrophy). Am J Med Genet Part A 2011; 155A(5): 1021–1032.
22. Victoria T, Zhu X, Lachman R et al. What Is New in Prenatal Skeletal Dysplasias? Am J Roentgenol 2018; 210 : 1022–1033.
23. Lefebvre M, Dufernez F, Bruel AL et al. Severe X-linked chondrodysplasia punctata in nine new female fetuses. Prenat Diagn 2015; 35(7): 675–684.
24. Bendová K, Poláčková R, Gřegořová A, Šilhánová E. Kampomelická dysplázie. Pediatr praxi 2015; 16(4): 264–266.
25. Unger S, Scherer G, Superti-Furga A. Campomelic dysplasia In: Adam MP, Ardinger HH, Pagon RA et al, eds. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 2008 [updated 2021 Mar 18].
26. Pyott SM, Pepin MG, Schwarze U et al. Reccurence of perinatal lethal osteogenesis imperfecta in sibships: Parsing the risk between parental mosaicism for dominant mutations and autosomal recessive inheritance. Genet Med 2011; 13(2): 125-130.
27. Valadares ER, Carneiro TB, Santos PM, Oliveira AC, Zabel B. What is new in genetics and osteogenesis imperfecta classification? J Pediatr 2014; 90 : 536–541.
28. Byers PH, Krakow D, Nunes ME, Pepin M. Genetic evaluation of suspected osteogenesis imperfecta. Genet Med 2006; 8(6): 383–388.
29. Shohat M, Rimoin DL, Gruber HE, Lachman RS. Perinatal lethal hypophosphatasia; clinical, radiologic and morphologic findings. Pediatr Radiol 1991; 21(6): 421–427.
30. Šumník Z, Souček O, Lebl J. Hypofosfatázie: Kdy na ni myslet a jak ji léčit. Pediatr praxi 2016; 17(3): 146–149.
31. Elleder M, Poupětová H, Zeman J et al. Mukolipidóza II (I cell disease). Popis prvého případu v České republice a prenatální diagnóza v rodině. Čas Lék čes 1997; 136(22): 702–703.
32. Unger S, Paul DA, Nino MC et al. Mucolipidosis II presenting as severe neonatal hyperparathyroidism. Eur J Pediatr 2005; 164(4): 236–243.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2023 Číslo 2-
Všetky články tohto čísla
- Mola či nemola, toť otázka
- Na patologii mě baví, jak to dohromady pasuje a když nepasuje, tak člověk musí přemýšlet proč
- Monitor aneb nemělo by vám uniknout, že...
- Mola hydatidosa
- Krvácení po porodu / potratu – praktické poznámky k vyšetření bioptického materiálu
- Spontánní potrat v prvním trimestru gravidity
- Molekulární diagnostika kompletní a parciální hydatidózní moly
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Kazuistika: Akutní poškození ledvin s progresí do chronicity u starší pacientky
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Mola hydatidosa
- Spontánní potrat v prvním trimestru gravidity
- Kostní dysplázie: přehled problematiky a deset let zkušeností s diagnostikou u plodů a novorozenců
- Molekulární diagnostika kompletní a parciální hydatidózní moly
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



