-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Intrauterinní růstová retardace a fetální původ chorob v dospělosti
Intrauterine Growth Retardation and Fetal Origin of Diseases at the Adult Age
The reasons for fetal growth restriction are heterogeneous. It was postulated that low birthweight together with postnatal environmental factors might increase the risk for number of diseases in adulthood, i.e. hypertension, ischaemic heart disease or diabetes mellitus type 2. Pathophysiology of this relationship is not fully understood, but it is evident, that pre - and postnatal growth and subsequent risks are modulated by different metabolic changes and genetic factors. According to programming hypothesis intrauterine adaptation to disadvantageous influences leads to long-term metabolic and endocrine alterations. IGF-I, IGF-II and their binding proteins (IGFBP) system as well as certain polymorphisms in IGF-I promotor gene might be possible candidates in explaining the link between intrauterine growth retardation and some of the diseases in adulthood.
Key words:
intrauterine growth retardation, low birthweight, IGF-I, IGF-II, IGF binding proteins, IGF-I gene polymorphism
Autori: J. Kytnarová 1; B. Zlatohlávková 3; M. Fedorová 3; G. Malošková 3; M. Kršek 2
Pôsobisko autorov: Klinika dětského a dorostového lékařství VFN a UK 1. LF, Praha přednosta prof. MUDr. J. Zeman, DrSc. 1; III. interní klinika VFN a UK 1. LF, Praha přednosta prof. MUDr. Š. Svačina, DrSc., MBA 2; Gynekologicko-porodnická klinika VFN a UK 1. LF, Praha přednosta prof. MUDr. A. Martan, DrSc. 3
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (6): 320-326.
Kategória: Přehledový článek
Súhrn
Příčiny intrauterinní poruchy fetálního růstu mohou být heterogenní. Předpokládá se, že nižší porodní hmotnost může být ve spojení s postnatálními vlivy prostředí rizikovým faktorem pro vznik řady chorob v dospělosti, např. hypertenze, ischemické choroby srdeční nebo diabetes mellitus 2. typu. Etiopatogeneze tohoto vztahu sice není zatím zcela objasněna, je ale zřejmé, že pre - i postnatální růst a budoucí rizika jsou modulována řadou metabolických změn i genetických faktorů. Podle teorie programmingu díky intrauterinní adaptaci na nepříznivé vlivy dochází k dlouhodobým metabolickým a endokrinním změnám. Zdá se, že vhodným kandidátním systémem pro spojení mezi intrauterinní růstovou poruchou a některými chorobami v dospělosti by mohl být systém IGF-I, IGF-II a jejich vazebných bílkovin (IGFBP), stejně jako některé polymorfismy v promotoru genu pro IGF-I.
Klíčová slova:
intrauterinní růstová retardace, nízká porodní hmotnost, IGF-I, IGF-II, IGF vazebné bílkoviny, polymorfismus genu pro IGF-IÚvod
U řady onemocnění, mezi která patří hypertenze, ischemická choroba srdeční nebo diabetes mellitus 2. typu, se předpokládá, že jejich vznik, průběh i prognóza u konkrétního pacienta závisí na společném působení faktorů zevního prostředí a genetických vloh. Mezi rizikové faktory patří i intrauterinní porucha fetálního růstu následně vedoucí k nižší porodní hmotnosti a délce dítěte při narození [1].
Intrauterinní růstová retardace (IUGR) a nízká porodní hmotnost a délka vzhledem ke gestačnímu věku (SGA) se vyskytují přibližně u 3% dětí. Intrauterinní růst je ovlivňován řadou faktorů fetálních, maternálních, placentárních i demografických. Děti, které se narodily s SGA/IUGR, mívají v postnatálním období celou řadu zdravotních obtíží nejen psychosociálních a behaviorálních. Asi 85–90 % dětí s IUGR má po narození fázi zrychleného růstu (catch-up growth), takže se do dvou let svými antropometrickými parametry vyrovnají vrstevníkům [2]. U zbývajících dětí však trvá růstová porucha i v postnatálním období. Příčiny postnatální růstové poruchy nejsou dosud zcela objasněny. Děti, které se narodí s nízkou porodní hmotností vzhledem ke gestačnímu věku, mohou mít i zvýšené riziko dalších morbidit v dospělosti.
Zdá se, že nedostatečný růst ve fetálním období pravděpodobně vede k trvalým změnám v metabolismu. Existuje řada hypotéz, které genetické, metabolické a nutriční faktory mohou ovlivnit fetální růst i postnatální rizika. Podle hypotézy programmingu je plod velmi vnímavý a adaptuje se na nepříznivé vlivy, kterým je vystaven při dlouhodobé intrauterinní podvýživě nebo hypoxii. Tím si zajišťuje bezprostřední přežití. Adaptace plodu na faktory vedoucí k IUGR může mít z dlouhodobého hlediska závažný dopad na zdravotní stav jedince i mnohem později, dokonce až v dospělosti.
Definice SGA/IUGR
Kritéria ani terminologie hodnocení intrauterinní růstové retardace nejsou jednotné. Přesná definice dětí, které se narodí s nízkou porodní hmotností vzhledem ke gestačnímu věku je přitom velmi důležitá pro prenatální i následnou postnatální péči, protože nízká porodní hmotnost je spojována s významnou antenatální i postnatální patologií. Termínem „děti malé vzhledem ke gestačnímu věku“ (SGA, small for gestational age) byly na základě doporučení expertní komise WHO z roku 1995 označovány děti, které se narodily s hmotností a/nebo délkou pod 10. percentilem vzhledem k průměru pro daný gestační věk. Další autoři považují za hranici SGA hmotnost/délku pod 5. či 3. percentilem vzhledem ke gestačnímu věku. V současné době jsou termínem SGA označovány děti, které mají při narození délku či váhu nižší více než –2 SD (tj. 2,3 percentil) vzhledem k průměru pro daný gestační věk [2].
Označení „dítě malé vzhledem ke gestačnímu věku“ však vypovídá pouze o mírách dítěte při narození. Termín „intrauterinní růstová retardace“ není totožný a znamená snížení intrauterinního růstového tempa, které bylo dokumentováno nejméně dvěma prenatálními ultrazvukovými vyšetřeními. To znamená, že dítě, které se narodilo s nízkou porodní hmotností, nemuselo nutně prodělat prenatálně fázi sníženého růstového tempa, naopak dítě s krátkou anamnézou intrauterinně dokumentovaného snížení růstového tempa nemusí být při narození malé vzhledem ke gestačnímu věku. Do skupiny dětí s SGA navíc spadají děti s konstitučním malým vzrůstem a je nezbytné je odlišit od dětí, které jsou patologicky malé. Antropometrické parametry dítěte při narození jsou ovlivněny řadou faktorů, například váhou a výškou matky, pořadím těhotenství, etnickým původem a pohlavím dítěte. Tyto proměnné by měly být zahrnuty do výpočtu pravého růstového potenciálu. Jen tak je ve skutečnosti možné odlišit novorozence s intrauterinní růstovou retardací od „small – normal“ dětí (tj. dětí sice malých, ale zdravých), které nemají zvýšené riziko dalších chorob [3].
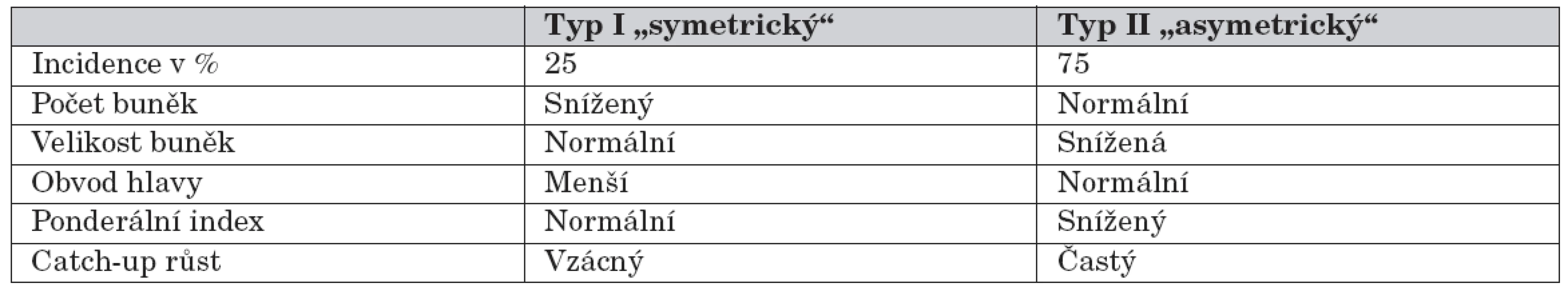
Děti s nízkou porodní hmotností bývají často rozdělovány do podskupin podle tělesných proporcí, které byly definovány Rohrerovým ponderálním indexem (porodní váha/délka3). Novorozenci s nízkým ponderálním indexem jsou označováni jako disproporční (nebo také asymetričtí) – tab. 1 [4]. Symetrická intrauterinní růstová retardace vzniká v časné fázi těhotenství (například při genetických chorobách, fetálních infekcích, toxických vlivech apod.). Asymetrická růstová retardace se zpravidla rozvíjí v posledním trimestru těhotenství a může být způsobena sníženým přívodem kyslíku nebo živin. Kojenci s nízkým ponderálním indexem trpí vysokou novorozeneckou úmrtností, na druhou stranu však mají lepší prognózu dlouhodobého růstu a vývoje než proporční děti s SGA/IUGR [4].
Příčiny intrauterinní růstové retardace
Důvody, proč se dítě narodí s nízkou porodní hmotností vzhledem ke gestačnímu věku, mohou být velmi rozmanité [2]. Příčinou intrauterinní růstové poruchy může být celá řada vlivů ze strany matky, plodu, placenty, ale roli hrají i některé demografické faktory (tab. 2). Přibližně u jedné třetiny SGA dětí se předpokládá genetická příčina (tj. fetální faktor), za dvě třetiny jsou odpovědné maternální a placentární vlivy. Z maternálních příčin je v rozvinutých zemích nejvýznamnějším etiologickým faktorem hypertenze matky, zejména je-li spojena s proteinurií a/nebo pre-eklampsií. Hypertenze totiž vede ke snížení průtoku krve placentou.
Tab. 2. Některé z faktorů vedoucích k nízké porodní hmotnosti/délce (ovlivňující fetální růst). 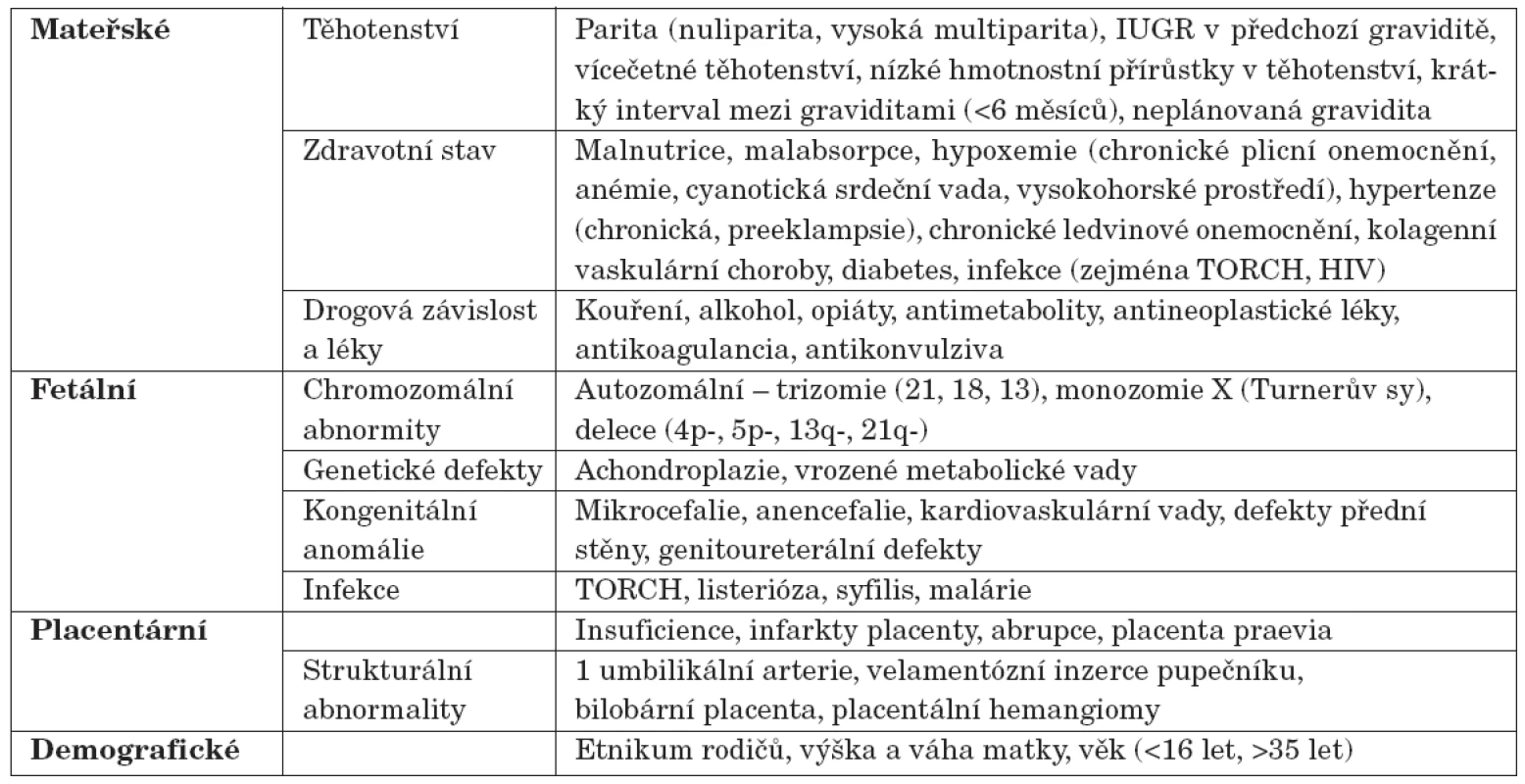
Z dalších maternálních faktorů v rozvoji IUGR hraje roli nedostatečná výživa matky v době koncepce a neadekvátní výživa v průběhu těhotenství. Orientačním indikátorem stavu maternální výživy může být například přírůstek hmotnosti matky v těhotenství.
Existuje také korelace mezi paritou a porodní hmotností. Primigravidám se s větší pravděpodobností narodí dítě s nízkou porodní hmotností. Tato skutečnost však pravděpodobně souvisí spíše s váhou matky před těhotenstvím než s tím, o kolikáté těhotenství se jedná.
Placenta je aktivním endokrinním orgánem s řadou funkcí, které jsou důležité pro normální fetální růst. Placentární vlivy představují všechny stavy, kdy z jakéhokoliv důvodu dochází k nesouladu mezi placentární perfuzí a fetálním okysličením.
Postnatální růst dětí s SGA
U většiny SGA dětí dochází po narození k růstovému zrychlení (tj. postnatálnímu catch-up růstu), takže v určitém časovém horizontu dosáhnou výšky nad minus 2 SD pod průměrem pro daný věk. Toto růstové zrychlení SGA dětí je tedy definováno jako růstová rychlost (cm/rok) větší než medián pro chronologický věk a pohlaví. Catch-up růst je časným postnatálním procesem, který se u více než 80 % SGA dětí projeví již v prvních šesti měsících života a je zpravidla dokončen do dvou let věku. U dětí, které se narodily předčasně (před 37. gestačním týdnem), může toto období trvat déle. Dítě, které se narodilo s SGA a je starší 3 let a má stále nízkou postavu, pravděpodobně již catch-up růst mít nebude.
Fetální původ metabolických chorob
Změny intrauterinního vnitřního prostředí (nedostatečná výživa, hypertenze matky, infekce apod.) kladou na plod řadu nároků. Organismus plodu reaguje hormonálními změnami, změnami hladin růstových faktorů, cytokinů apod. [5]. Tato odpověď naopak pozměňuje dlouhodobě řadu systémů plodu, například imunitního, cévního, renálního, ale dochází i k změnám metabolickým a hemodynamickým. Mění se růstové a mitochondriální parametry [6]. Výsledkem je spolu s postnatálními vlivy prostředí (životním stylem a charakterem výživy) zvýšené riziko diabetes mellitus 2. typu, hypertenze, inzulinové rezistence a kardiovaskulárních chorob.
I když došlo v posledních letech k významnému posunu v poznání mechanismu vztahu mezi nízkou porodní hmotností a riziky onemocnění v dospělém věku, není etiopatogeneze stále zcela objasněna. Existuje však řada teorií.
Nutriční teorie („thrifty phenotype“hypothesis)
Tato teorie byla postulována Halesem a Barkerem v roce 1992 [7]. Rostoucí plod je vystaven nedostatečnému přívodu živin a jejich omezené množství „přerozděluje“. Redistribuce probíhá na úkor tělesného růstu a vývoje některých orgánů (např. pankreatu, jater, svaloviny). Tento metabolický „reprogramming“ zajištuje přežití v podmínkách intrauterinní malnutrice. Ve chvíli, kdy se novorozenec dostává do podmínek dostatečné nebo dokonce nadměrné výživy, začíná být reprogramming nevýhodný a vede k rozvoji inzulinové rezistence a poruchy glukózové tolerance. Reprogramming se rozvíjí v kritickém období vývoje plodu, které je charakterizováno vysokou proliferací buněk.
Předpoklad, že ústředním podnětem pro programování vnímavosti k některých chorobám v dospělosti je výživa ve fetálním období, se opírá o celou řadu experimentálních i epidemiologických studií [8, 9, 10, 11]. U pokusných zvířat je velikost při narození ovlivňována výživou matky v době těhotenství [9]. Snížení příjmu bílkoviny u gravidních zvířat vede u mláďat k nižší porodní hmotnosti, vyššímu krevnímu tlaku a glukózové intoleranci v dospělosti. Dalším dokladem je skutečnost, že ženám, které byly během války vystaveny hladovění, se narodily děti s nižší porodní hmotností a zvýšeným rizikem glukózové intolerance a obezity v dospělosti [8]. Snížený přívod glukózy vede u plodu současně ke snížení cirkulujících hladin inzulinu, insulin-like growth faktoru I a II (IGF-I a II) a ke sníženému fetálnímu růstu. Vzhledem k tomu, že výživa zaujímá tak významnou roli v regulaci fetálního růstu a je vhodným stimulem pro „programming“, mohla by být pojítkem ve vztahu porodní hmotnosti a délky a následných rizik chorob v dospělosti.
„Záchranná“ teorie („Fetal salvage“hypothesis)
Podle této teorie se u plodu, který trpí nedostatečným přívodem živin, rozvíjí periferní inzulinová rezistence, která umožní redistribuci živin směrem k životně důležitým orgánům. Porucha periferní senzitivity k inzulinu je spojena s trvalým snížením počtu a funkce svalového glukózového přenašeče a stimuluje â buňky pankreatu k tvorbě vyššího množství inzulinu, aby byla zachována normoglykémie [12].
Fetální inzulinová teorie („Fetal insulin“ hypothesis)
Tento model předpokládá, že geneticky determinovaná inzulinová rezistence vede k růstové poruše a inzulinové rezistenci v dětství a dospělosti [13].
Teorie „catch-up“ růstu
Děti s SGA mají při narození nízké hladiny inzulinu, IGF-I, IGF-binding proteinu 3 (IGFBP-3) a vysoké hladiny růstového hormonu (GH), IGF-binding proteinu 1 a 2 (IGFBP-1 a IGFBP-2). Hladiny se normalizují zpravidla v prvních třech měsících života. Zvýšením přívodu živin v časném postnatálním období jsou periferní tkáně náhle vystaveny zvýšeným hladinám těchto hormonů. Tkáně se brání zvýšenému účinku inzulinu a IGFs rozvojem inzulinové rezistence [14].
Hypotéza kmenové buňky („Stem cell“ hypothesis)
Tkáně v postnatálním období obsahují kmenové buňky, které si zachovávají schopnost sebeobnovení a regenerace tkání. Intrauterinní malnutrice by mohla vést ke snížení počtu kmenových buněk ve tkáních. Nižší počet kmenových buněk by pak v dospělosti pravděpodobně vedl k „vyčerpání“ funkce orgánů zejména při jejich zvýšených nárocích [4].
Fetální růst a systém IGF-I a II (IGFs) a jeho vazebných bílkovin (IGFBPs)
Systém IGF-I a II a jeho vazebných bílkovin je jedním z nejdůležitějších endokrinních a parakrinních růstových systémů, které regulují fetální a placentární růst. Předpokládá se, že jedním z potenciálních kandidátních mechanismů, které by mohly vysvětlovat vztah mezi nízkou porodní hmotností a chorobami v dospělosti, je fetální „programming“ osy růstového hormonu – insulin-like růstového faktoru (GH – IGF). Hladiny IGFs a IGFBPs jsou totiž u plodu významně ovlivňovány úrovní výživy a fetální růstová retardace naopak vede k poruchám GH – IGF osy. Zvířecí (myší) modely s IGF-I a IGF-II deficiencí mají fenotyp obdobný dětem narozeným s SGA. Děti s mutací IGF-I genu se rodí s nízkou porodní hmotností, trpí postnatální růstovou poruchou, mentální retardací a inzulinorezistencí [15, 16].
V průběhu nitroděložního života se u rostoucího plodu hladiny IGF-I postupně zvyšují od 18. do 40. týdne gestace. U dětí, které se narodily s nízkou porodní hmotností, je již v v pupečníkové krvi signifikantně nižší hladina IGF-I a IGFPB-3 oproti dětem s hmotností přiměřenou věku (AGA, appropriate for gestational age), zatímco hladiny IGFBP-1 jsou u těchto dětí významně vyšší. U dětí s SGA bez postnatálního catch-up růstu pak zůstávají nižší hladiny IGF-I i v postnatálním období ve srovnání s dětmi, u kterých se zrychlení růstového tempa projeví [17]. Oproti tomu byly hladiny IGFBP-1 u dětí s SGA naopak vyšší [18, 19]. Děti, které se narodily s SGA, mají nižší hladiny IGF-I, IGFBP-3 i v dospělosti [20]. Rychlý růst v průběhu kojeneckého věku u dětí s nižší porodní hmotností je provázen vyššími hladinami IGF-I, IGFBP-3 a nižšími hladinami IGFBP-1 [21].
Úloha dalších IGFBPs je dokumentována na zvířecím modelu. Zvýšená exprese IGFBP-5 u transgenních myší vedla například také k prenatální růstové retardaci [22]. IGFBP-6 inhibuje proliferaci mnoha buněčných řad a je exprimován v centrálním nervovém systému. Má také nejsilnější afinitu k IGF-II. U IGFBP-6 transgenních myší byla významně snížená hmotnost mozečku, v prvním měsíci věku byly vysoké hladiny IGFBP-6 provázeny nízkými hladinami IGF-I a významně sníženou hmotností [23].
Změny systému IGF a jeho vazebných proteinů v dospělosti
V dospělosti je IGF-I důležitým anabolickým hormonem, který je nezbytný kromě jiného k udržení kostní integrity a „beztukové“ svalové hmoty. V průběhu života klesají hladiny IGF-I, volného IGF-I a IGFBP-3, hladiny IGF-I jsou přitom nižší u obézních než u neobézních dospělých [24]. Nízké hladiny IGF-I mohou hrát podle některých autorů úlohu v patogenezi diabetes mellitus, rozvoji vaskulárních komplikací diabetu a kardiovaskulárních chorob [25].
Účinek cirkulujícího IGF-I je inhibován hladinami IGFBP-1, přitom hlavním regulátorem produkce IGFBP-1 v játrech jsou hladiny inzulinu v portálním řečišti, které tvorbu IGFBP-1 inhibují. Vyšší hladiny IGFBP-1 korelují rovněž se zvýšeným rizikem kardiovaskulárních chorob a poruchy glukózové tolerance v dospělosti [26, 27].
Genetické determinanty časného postnatálního růstu a rizika chorob v dospělosti
Vliv genetických faktorů na porodní hmotnost a délku byl znám řadu let, ale až v poslední době jsou odhalovány specifické geny a chromozomální oblasti, které růst ovlivňují. Prostředí ovlivňuje asi 25 % variace porodní hmotnosti, genetické vlivy představují asi 38–80 % [28]. Důležitou úlohu ve fetálním růstu mají geny, kódující inzulin, IGFs (IGF-I a IGF-II), jejich receptory a regulační proteiny. Bylo popsáno několik polymorfismů v promotoru IGF-I genu. Tyto polymorfismy podle některých autorů korelují s porodní hmotností a délkou i postnatálním růstem [29], výsledky různých studií jsou však kontroverzní. Současně polymorfismy IGF-I genu korelují s hladinami IGF-I u zdravých dospělých, hladiny IGF-I byly optimální u osob, které jsou homozygotními nositeli alely 192 bp a 194 bp, zatímco alely kratší i delší měly nižší hladiny IGF-I [30]. I zde jsou však výsledky kontroverzní [31].
Polymorfismus 192 bp v regulační oblasti IGF-I genu například koreluje s hladinou sérového IGF-I, porodní hmotností i délkou. Tento polymorfismus by mohl přímo ovlivňovat expresi IGF-I. U homozygotních nosičů 192 bp alely byl zjištěn významný pokles sérových hladin IGF-I s věkem. Tento pokles je obdobný jako pokles IGF-I v populaci. Naopak, klesající hladiny IGF-I s věkem nebyly pozorovány u heterozygotů a osob, které nejsou nosiči tohoto polymorfismu. Pouze u homozygotních nositelů 192 bp alely jsou tedy pravděpodobně cirkulující hladiny IGF-I ovlivněny sekrecí růstového hormonu, u osob, které tuto alelu nemají, se zdá, že je hladina IGF-I méně závislá na sekreci růstového hormonu a více závislá na dalších faktorech, například výživě, jaterních funkcích, pohlavních hormonech a hladině inzulinu [32].
Nepřítomnost wild-typu (192 bp) alely polymorfismu v regulační oblasti IGF-I genu významně korelovala s nízkými hladinami IGF-I i se zvýšeným rizikem diabetu 2. typu a rizikem infarktu myokardu [33, 34]. U osob s diabetes mellitus 2. typu pak byla její nepřítomnost spojena i s rizikem rozvoje diabetické retinopatie [35].
Závěr
Mnohé epidemiologické studie prokázaly vztah mezi nízkou porodní hmotností a rizikem rozvoje inzulinorezistence, diabetu 2. typu a kardiovaskulárními chorobami v dospělém věku. Etiopatogeneze tohoto vztahu sice není zatím zcela objasněna, je ale zřejmé, že pre - i postnatální růst a budoucí rizika jsou modulována řadou metabolických změn i genetických faktorů.
V současné době však neexistuje žádný přesvědčivý metabolický ukazatel zvýšeného rizika uvedených chorob v dospělosti, který by bylo možné určit a monitorovat v průběhu dětského věku. Nezbývá tedy než u dětí s nízkou porodní hmotností a genetickými predispozicemi k rozvoji některých chorob v dospělosti pečlivě monitorovat metabolické parametry.
Podpora grantu IGA NR9374-3/2007.
Došlo: 21. 1. 2008
Přijato: 24. 3. 2008
MUDr. Jitka Kytnarová
Klinika dětského a dorostového lékařství
UK 1. LF a VFN
Ke Karlovu 2
120 00 Praha 2
e-mail: jkytn@lf1.cuni.cz
Zdroje
1. Barker, Osmond C, Kajantie E, Forsen TJ, Erricsson JG, Barker DJP. Infant growth and stroke in adult life. The Helsinki Birth Cohort Study. Stroke 2007;38 : 264–270.
2. Lee Peter A, Chernausek D, Hokken-Koelega ACS, Chernichow P. International Small for Gestational Age Advisory Board Consensus Development Conference Statement: Management of Short Children Born Small for Gestational Age, April 24–October 1, 2001. Pediatrics 2003;111 : 1253–1261.
3. Gardosi J. New definition of small for gestational age based on fetal growth potential. Horm. Res. 2006;65(Suppl 3): 15–18. Epub 2006 Apr 10.
4. Geremina C, Cianfarani S. Laboratory tests and measurements in children born small for gestational age (SGA). Clinica Chimica Acta 2006;364(1–2): 113–123.
5. Laskowska M, Laskowska K, Leszczynsa, Gerrelak B, Oleszcuk J. Comparative analysis of the maternal and umbilical interleukin-8 levels in normal pregnancies and in pregnancies complicated by preeklampsia with intrauterine normal growth and intrauterine growth retardation. J. Matern. Fetal Neonatal. Med. 2007;20(7): 527–532.
6. Lee HK, Park KS, Cho YM, Lee YY, Pak YK. Mitochondria-based model for fetal origin of adult disease and insulin resistence. Am. N.Y. Acad. Sci. 2005;1042 : 1–18.
7. Hales CN, Barker JP. Type 2 (non-insulin-dependent) diabetes mellitus: the thrifthy phenotype hypothesis. Diabetologie 1992;35 : 595–601.
8. Ravelli ACJ, van der Meulen JHP, Michels RPJ, et al. Glucose tolerance in adults after prenatal exposure to famine. Lancet 1998;351 : 173–177.
9. Garofano A, Czernichow P, Breant B. In utero undernutrition impairs rat beta-cell development. Diabetologie 1997;40 : 1231–1234.
10. Harding JE. The nutritional basis of the fetal origins of adult disease. Int. J. Epidemiology 2001;30 : 15–23.
11. Szitanyi P, Pistulkova H, Hubaček JA, Stuchliková H, Poledne R. APOE/intrauterine undernutrition interaction and hypercholesterolemia in children. Physiol. Res. 2007;Nov 30 /Epub aheas of print/.
12. Hofman PL, Cutfield WS, Robinson EM, et al. Insulin resistance in short children with intrauterine growth retardation. J. Clin. Endocrinol. Metab. 1997;82 : 402–406.
13. Hattersley AT, Tooke JE. The fetal insulin hypothesis: and alternative explanation of the association of low birth weight with diabetes and vascular disease. Lancet 1999;353 : 1789–1792.
14. Cianfarani S, Germani D, Branca F. Low birth weight and adult insulin resistence: „the catch-up growth“ hypothesis. Arch. Dis. Child. 1999;81: F71–F73.
15. Woods KA, Camacho-Hubner C, Savage MO, Clark AJL. Intrauterine growth retardation and postnatal growth failure associated with deletion of the insulin-like growth factor I gene. New Engl. J. Med. 1999;335(18): 1363–1367.
16. Camacho-Hubner C, Woods KA, Clark AJ, Savage MO. Insuline-like growth factor (IGF)-I gene deletion. Rev. Endocr. Metab. Disord. 2002;3(4): 357–361.
17. Ozkan H, Aydin A, Demir N, Erci T, Buyukgebiz A. Association of IGF-I, IGFBP-1 and IGFBP-3 on intrauterine growth and early catch-up growth. Biol. Neonate 1999;76(5): 274–282.
18. Vatten LJ, Nilsen ST, Odegard RA, Romundstad PR, Austgulen R. Insulin-like growth factor I and leptin in cord plasma and infant birth size at term. Pediatrics 2002;109(6): 1131–1135.
19. Vatten LJ, Odegard RA, Nilsen ST, Salvesen KA, Austgulen R. Relationship of insulin-like growth factor-I and insulin-like growth factor binding proteins in umbilical cord plasma to preeclampsia and infant birth weight. Obstet. Gynecol. 2002;99(1): 85–90.
20. Verkauskiene R, Jaquet D, Deghmoun S, Chevenne D, Czernichow P, Levy-Marchal C. Smallness for gestational age is associated with persistent change in insulin-like growth factor-I (IGF-I) and the ratio IGF-I/IGF binding protein-3 in adulthood. J. Clin. Endocrinol. Metab. 2005;Jul 10 /Epub ahead of print/.
21. Ong KK, Elmlinger M, Jones R, Emmett P, ALSPAC Study Team, Holly J, et al. Growth hormone binding protein levels in children are associated with birth weight, postnatal weight gain, and insulin secretion. Metabolism 2007;56(10): 1412–1417.
22. Salih DA, Tripathi G, Holding C, Szestak TA, Gonzalez MI, et al. Insulin-like growth factor-binding protein 5 (IGFBP5) compromise survival, growth, muscle development, and fertility in mice. Proc. Natl. Acad. Sci. USA 2004;1001(12): 4314–4319.
23. Bienvenu G, Seurin D, Grellier P, Froment P, Baudrimont M, et al. IGFBP-6 transgenic mice: postnatal growth, brain development and reproduction abnormalities. Endocrinology. 2004; 28 /Epub ahead of print).
24. Gomez JM, Maraval FJ, Gomez N, Navarro MA, Casamitjana R, Soler J. The IGF-I system component concentrations that decrease with ageing are lower in obesity in relationship to body mass index and body fat. Growth Horm. IGF Res. 2004;14(2): 91–96.
25. Hunt KJ, Lukanova A, Rinald S, Lundin E, Norat T, et al. A potential inverse association between insulin-like growth factor I and hypertension in a cross-sectional study. Ann. Epidemiol. 2006; Jan 20 /Epub ahead of print/.
26. Kajantie E, Fall CHD, Seppala M, Koistinen R, Dunkel L, et al. Serum insulin-like growth factor (IGF)-I and IGF-binding protein-1 in elderly people: Relationships with cardiovascular risk factors, body composition, size at birth, and childhood growth. J. Clin. Endocrinol. Metab. 2003;88 : 1059–1065.
27. Kalme T, Seppala M, Qiao Q, Koistinen R, Nissinen A, et al. Sex hormone-binding globulin and insulin-like growth factor-binding protein-1 as indicators of metabolic syndrome, cardiovascular risk, and mortality in elderly men. J. Clin. Endocrinol. Metab. 2005;90 : 1550–1556.
28. Johnston LB, Clark AJ, Savage MO. Genetic factors contributing to birth weight. Arch. Dis. Child. Fetal. Neonatal. Ed. 2002;86(1): F2–F3.
29. Arends N, Johnston L, Hokken-Koelega A, Van Diujn C, de Ridder M, et al. Polymorphism in the IGF-I gene: Clinical relevance for short children born small for gestational age (SGA). J. Clin. Endocrinol. Metab. 2002;87(6): 2720–2724.
30. Rietveld I, Janssen JA, van Rossum EF, Houwing Duistemaat JJ, Rivadeneira F, et al. A polymorphic CA repeat in the IGF-I gene is associated with gender specific differences in body weight, but has no effect on the secular trend in body height. Clin. Endocrinol. (Oxf) 2004;61(2): 195–203.
31. Jensen RB, Chellakooty M, Vielwerth S, Vaag A, Larsen T, et al. Intrauterine growth retardation and consequences for endocrine and cardiovascular diseases in adult life: does insulin-like growth factor-I play a role? Horm. Res. 2003;60(Suppl 3): 136–148.
32. Rietveld I, Janssen AMJL, Hofman A, Pols HAP, van Duijn CM, Lamberts SWJ. A polymorphism in the IGF-I gene influences the age-related decline in circulating total IGF-I levels. Eur. J. Endocrinol. 2003;148 : 171–175.
33. Vaessen N, Heutink P, Janssen JA, Witteman JCM, Testers L, et al. A polymorphism in the gene for IGF-I. Functional properties and risk for type 2 diabetes and myocardial infarction. Diabetes 2001;50 : 637–642.
34. Hart LM, Fritsche A, Rietveld I, Dekker JM, Nijpels G, et al. Genetic factors and insulin secretion. Gene variants in the IGF genes. Diabetes 2004;53(Suppl 1): S26–S30.
35. Rietveld I, Ikram MK, Vingerling JR, Hofman A, Pols HAP, et al. An IGF-I gene polymorphism modifies the risk of diabetic retinopathy. Diabetes 2006;55 : 2387–2391.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2008 Číslo 6- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Léčení vrozených deformit páteře
- Spinální epidurální absces u šestnáctiletého chlapce Popis případu a přehled literatury
- Kašeľ u detí s ochorením nosovej dutiny a prínosových dutín
- Intrauterinní růstová retardace a fetální původ chorob v dospělosti
- Vyšetrovací postup u dieťaťa s proteinúriou
- Seznam čtenářů se správnou odpovědí na doškolovací článek z č. 11/2007 (Hrdlička M., Dudová I.: Dětský autismus jako modelová porucha se sociálním deficitem)
- História starostlivosti o pacientov s cystickou fibrózou na Slovensku
- IX. Teyschlův pediatrický den
- Profesor MUDr. Ján Birčák, CSc. – 85-ročný
- Neprávem (velmi) opominuté jubileum MUDr. Zdeňka Misařová, CSc. – 80 let
- Významné výročí primáře MUDr. Tomáše Valouška
- VIII. ČESKÝ PEDIATRICKÝ KONGRES S MEZINÁRODNÍ ÚČASTÍ
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vyšetrovací postup u dieťaťa s proteinúriou
- Intrauterinní růstová retardace a fetální původ chorob v dospělosti
- Léčení vrozených deformit páteře
- Spinální epidurální absces u šestnáctiletého chlapce Popis případu a přehled literatury
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy