-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Enzymová substituční terapie u lysosomálních onemocnění
Enzyme replacement therapy in lysosomal storage diseases
Lysosomal storage diseases (LSDs) form a group of more than 70 rare inherited metabolic diseases, usually caused by a malfunction of some of the lysosomal enzymes. The aim of this review is to introduce enzyme replacement therapy (ERT) which gained an indispensable role in the therapy of LSDs. ERT is based upon replacement of the defective enzyme by a recombinant protein administred in a 2–4 hour infusion once a week or once a fortnight. This therapy is currently available for seven LSDs: Gaucher disease, Fabry disease, Pompe disease and mucopolysaccharidoses I, II, IVA and VI. ERT significantly affects visceral manifestations of the diseases (hepatomegaly, splenomegaly, vital lung capacity, muscle weakness, anaemia, gastrointestinal disorders etc.), yet it is not effective in treating the central nervous system (CNS) involvement and only a small effect is observed in treating disease manifestations in bones, cartilage and heart valves. An immune reaction with clinical presentation of an allergic reaction and therapy effectiveness decrease can occur with a portion of patients. Other modalities for LSDs therapy are concisely mentioned: haematopoietic stem cell transplantation, substrate reduction therapy, chaperons and gene therapy.
Conclusion:
ERT slows the progression of the disease and markedly alters its natural course, improves quality of life and prolongs patients’ lifespan. The limitations include insufficient effect in some tissues, possible allergic reactions and great financial demands. An essential presumption for effectiveness and success of ERT is its early initiation following quick diagnosis of the disease.Key words:
lysosomal storage diseases, enzyme replacement therapy
Autori: J. Kulhánek; V. Malinová; T. Honzík; M. Magner
Pôsobisko autorov: Klinika dětského a dorostového lékařství 1. LF UK a VFN, Praha, přednosta prof. MUDr. J. Zeman, DrSc.
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (4): 224-231.
Kategória: Přehledový článek
Súhrn
Lysosomální střádavá onemocnění (LSDs, Lysosomal Storage Diseases) tvoří skupinu více než 70 vzácných dědičných metabolických onemocnění, jejichž příčinou je nejčastěji porucha funkce některého z lysosomálních enzymů. Cílem přehledového sdělení je představení enzymové substituční terapie (ERT, Enzyme Replacement Therapy), která si našla v terapii LSDs zásadní místo. ERT je založena na náhradě defektního enzymu pomocí rekombinantního proteinu podávaného v 2–4hodinové intravenózní infuzi jednou za 1 či 2 týdny. Tato léčba je v současné době k dispozici pro sedm LSDs – Gaucherovu chorobu, Fabryho chorobu, Pompeho chorobu a mukopolysacharidózu typu I, II, IVA a VI. ERT významně ovlivňuje viscerální manifestaci onemocnění (hepatomegalie, splenomegalie, vitální kapacita plic, svalová slabost, anémie, gastrointestinální obtíže aj.), není ovšem účinná v terapii postižení centrálního nervového systému (CNS) a pouze malý efekt je pozorován u postižení kosti, chrupavky a srdečních chlopní. Časně zahájená ERT je schopna zamezit manifestaci téměř všech symptomů onemocnění, vyjma postižení CNS. U části pacientů se na podávaný enzym může rozvinout imunitní reakce s klinickými projevy alergie a sníženého efektu terapie. Stručně jsou zmíněny i další modality léčby LSDs: transplantace hematopoetických kmenových buněk, substrát redukující terapie, použití chaperonů a genová terapie.
Závěr:
ERT zpomaluje progresi onemocnění a výrazně mění jeho přirozený průběh, zlepšuje kvalitu života a prodlužuje přežití pacientů. Omezení jsou daná špatným průnikem do některých tkání, možnými alergickými reakcemi a vysokou finanční náročností. Zásadním předpokladem pro úspěch ERT je její časné zahájení při rychlé diagnostice onemocnění.Klíčová slova:
lysosomální onemocnění, enzymová substituční terapieÚvod
Lysosomální střádavá onemocnění (LSDs, Lysosomal Storage Diseases) jsou skupinou více než 70 vzácných dědičných multisystémových metabolických onemocnění postihujících lysosomální degradaci makromolekulárních sloučenin. Příčinou jsou nejčastěji mutace v genu kódujícím některý z lysosomálních enzymů [1, 2]. Podkladem však může být rovněž porucha některého z lysosomálních membránových proteinů (Danonova choroba), porucha aktivátorů lysosomálních enzymů (defekty saposinů), či defekt transportu enzymů do lysosomu (mukolipidóza typu II) [1]. Oproti původní představě, že akumulace nedegradovatelných makromolekul je sama o sobě dominujícím patofyziologickým mechanismem, je dnes zřejmé, že zásadní roli hrají indukované sekundární patofyziologické kaskády [3, 4]. Střádání makromolekulárních látek nejenom v lysosomech, ale i v dalších buněčných kompartmentech a v extracelulární matrix vede k aberantní genové expresi, indukci prozánětlivého stavu a oxidativního stresu, aberantní autofagocytóze vedoucí k nahromadění poškozených mitochondrií a k indukci buněčné smrti [1, 5]. Střádané makromolekuly aktivují či inhibují přenos signálu, mění lokalizaci receptorů a modifikují jejich odpověď. Defektní je homeostáza vápníkových iontů, dochází k poruše syntetické funkce buňky, maturace proteinů a buněčného transportu [3].
Incidence jednotlivých onemocnění se výrazně liší. Nejčastější je Gaucherova nemoc s incidencí 1 : 88 500, naopak některé mukolipidózy či neuronální ceroid lipofuscinózy se vyskytují s incidencí pouze zhruba 1 : 5 000 000 [6]. Vzhledem k počtu všech LSDs je ovšem jejich úhrnná incidence poměrně vysoká. Pohybuje se v rozmezí 1 : 5000–7700 [5]. V ČR je pak udáván sumární výskyt LSDs přibližně 1 : 8160 živě narozených dětí [6].
Klinická manifestace LSDs je extrémně variabilní. Onemocnění se mohou projevit již v novorozeneckém věku závažným postižením spojeným s nepříznivou prognózou. Zejména poslední dobou jsou však popisovány oligosymptomatické formy manifestující se až v dospělém věku. Dědičnost a orgánová manifestace závisí na konkrétním onemocnění (tab. 1). Stran bližšího popisu klinické manifestace LSDs, která není předmětem tohoto sdělení, odkazujeme na recentní přehledy publikované v české literatuře [7–11].
Tab. 1. Přehled incidence, dědičnosti a klinické manifestace u LSDs s ERT dostupnou v ČR včetně přehledu jejího podávání a efektu. 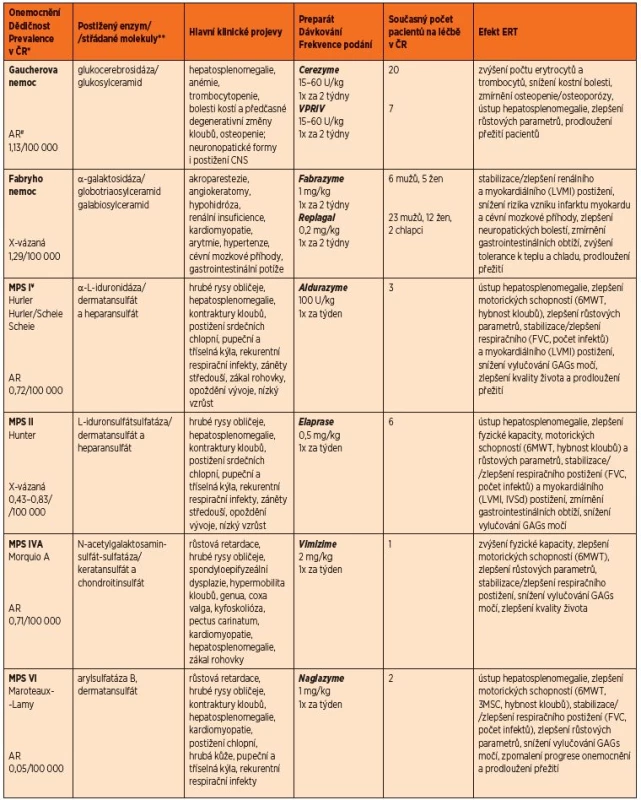
*Incidence dle Poupětová a kol. 2010 **Uvedeny jsou pouze hlavní substráty střádání. Globotriaosylceramid a galabiosylceramid patří mezi sfingolipidy; dermatansulfát, heparansulfát, keratansulfát a chondroitinsulfát patří mezi glykosaminoglykany, dříve mukopolysacharidy. <sup>#</sup>AR – autosomálně recesivní <sup>¥</sup>Pro mukopolysacharidózy je typický rozvoj charakteristických rentgenových změn charakteru dysostosis multiplex – sedlo hypofýzy ve tvaru J, rybí obratle, veslovitá žebra, srdčitá pánev, dysplazie kyčelního kloubu <br><i>Zkratky: LVMI – index hmotnosti levé komory, 6MWT – šestiminutový test chůze, 3MSC – tříminutový test chůze do schodů, FVC – forsírovaná vitální kapacita, IVSd – tloušťka interventrikulárního septa v diastole, GAGs – glykosaminoglykany</i> 
V současné době je dostupných několik modalit léčby LSDs (obr. 1). Kromě transplantace hematopoetických kmenových buněk (HSCT, Haematopoietic Stem Cell Transplantation) a substrát redukující terapie (SRT, Substrate Reduction Therapy) se jedná především o enzymovou substituční terapii (ERT, Enzyme Replacement Therapy), kterou je v současné době úspěšně léčena řada pacientů. Výjimkou není ani Česká republika, kde jsou dětští i dospělí pacienti sledováni a léčeni ve specializovaných centrech na Klinice dětského a dorostového lékařství a na II. interní klinice 1. LF UK a VFN v Praze. Terapie probíhá ve spolupráci s řadou oddělení v místech bydliště pacientů.
Cílem této přehledové práce je proto blíže obeznámit odbornou pediatrickou veřejnost s touto formou terapie, její historií, mechanismem působení, efektem, možnými nežádoucími účinky a omezeními. V závěru práce se pro úplnost zmíníme o ostatních modalitách a budoucnosti terapie LSDs.
Obr. 1. Přehled hlavních léčebných modalit LSDs. 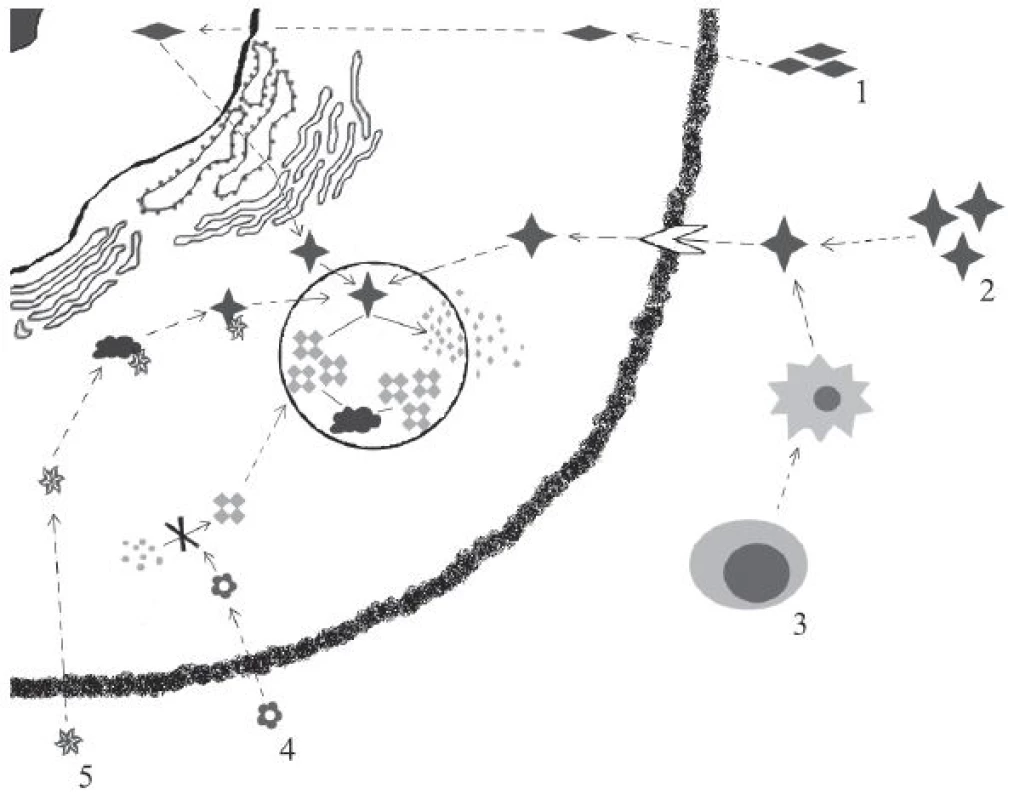
1) Genová terapie: in vivo genová terapie využívá virového vektoru aplikovaného do organismu v systémové či lokální formě. Transkripcí příslušných genů virového vektoru je následně umožněna produkce funkčního enzymu. 2) ERT: i.v. podávaný enzym je buňkami internalizován pomocí M6PR (manóza-6-fosfátového receptoru) a následně transportován do lysosomu, kde plní svou funkci. 3) HSCT: hematopoetické kmenové buňky transplantované pacientovi se diferencují a následně sekretují funkční enzym. (Ex vivo genová terapie představuje transplantaci autologních hematopoetických kmenových buněk geneticky modifikovaných pro expresi funkčního enzymu.) 4) SRT: p.o. podávaný inhibitor syntézy střádané makromolekuly redukuje množství střádané substance. 5) Chaperony: p.o. či i.v. podávaný chaperon stabilizuje defektní enzym a pomáhá mu zaujmout správnou terciární a kvartérní strukturu a umožnit tak jeho alespoň reziduální aktivitu. Historie a principy fungování ERT
Zásadní roli lysosomu v enzymatické degradaci makromolekul popsal v roce 1955 de Duve [12]. S konceptem LSDs jakožto onemocnění způsobených deficitem degradačních enzymů pak přišel Hers v roce 1963 a hned rok poté se objevila první myšlenka náhrady deficitního enzymu funkčním proteinem. Klíčovým pro další vývoj v této oblasti však byl až objev tzv. cross-correction fenoménu v roce 1968. Tak jako již několikrát v historii medicíny, i zde pomohla náhoda. Fratantoni neúmyslně smíchal buněčné kultury fibroblastů od pacientů s Hunterovým (mukopolysacharidóza typu II) a Hurleové syndromem (mukopolysacharidóza typu I). výsledkem byla téměř normální buněčná linie, kdy lysosomální střádání u obou linií prakticky vymizelo [13]. Byl vysloven předpoklad, že buňky jsou schopny si vzájemně poskytnout chybějící či defektní genový produkt označený jako „corrective factor“. Další práce ukázaly, že buňky do růstového média „corrective factors“, identifikované jako enzymy, vylučují a že pro fungování cross-correction není nezbytné, aby buněčné linie byly v přímém kontaktu. Pro korekci defektního metabolismu překvapivě stačilo velmi malé množství enzymu, představující v některých případech pouze 1–5 % normální enzymové aktivity. Korekce cross-correction fenoménem byla následně prokázána u buněčných kultur celé řady lysosomálních onemocnění, např. u metachromatické leukodystrofie, mukopolysacharidózy typu IIIB či u Sandhoffovy choroby (GM2 gangliosidózy) [13]. Význam sekrece lysosomálních enzymů byl objasněn teprve nedávno a jeví se být velmi důležitým pro metabolismus extracelulární tkáně [14]. Částečná extracelulární sekrece enzymu a schopnost buněk tento enzym opět internalizovat a využívat je nezbytným předpokladem pro fungování ERT.
Dalším velice podstatným zjištěním, které umožnilo přivést ERT do praxe, bylo objasnění mechanismu transportu enzymů do lysosomů. Specifickým signálem, kterým jsou proteiny pro lysosom označeny, je manóza a manóza-6-fosfát [15]. Pro tyto specifické signály existují receptory i na plazmatické membráně. Tak je umožněno vychytávání daného enzymu buňkou a jeho následný transport do lysosomu, kde může plnit svou funkci [16]. Význam buněčné signalizace pro výrobu enzymů použitelných v ERT byl prokázán u Gaucherovy choroby. Enzym ošetřený exoglykosidázami a exponující tak manózu měl vyšší efektivitu než nativní forma enzymu manózu neexponující, a to jak na zvířecích modelech, tak později i v klinických studiích [17].
První pokusy o použití ERT u některých LSDs se datují již do počátku 70. let, kdy byla dvěma pacientům s Fabryho chorobou podána plazma zdravých jedinců [18]. Prvním schváleným preparátem ERT byla ovšem až v roce 1991 glukocerebrosidáza pro léčbu pacientů s Gaucherovou nemocí. Byla získávána purifikací z lidských placent a následně upravována pro expozici manózového zbytku [17]. Úroveň purifikace enzymu z lidských placent však nebyla dostatečná, navíc hrozilo riziko infekčních komplikací. Oba problémy byly vyřešeny produkcí rekombinantního enzymu v buněčné linii ovarií čínských křečků (CHO, Chinese Hamster Ovary cells), opět glukocerebrosidázy a opět posléze ošetřené exoglykosidázami pro expozici manózového zbytku [19]. Tato metoda znamenala zásadní posun ve vývoji a produkci preparátů pro ERT. Linie CHO umožnila produkci enzymů v potřebné kvantitě i kvalitě, a to i pro řadu dalších onemocnění: alfa-galaktosidázy pro Fabryho nemoc [20], alfa-1-iduronidázy pro mukopolysacharidózu typu I [21] a alfa-glukosidázy pro Pompeho nemoc [22]. Kromě linie CHO jsou dnes rekombinantní enzymy produkovány např. v buněčných kulturách lidských fibroblastů či jiných savčích buněk, na platformách bakteriálních či kvasinkových a nověji rovněž v modifikovaných rostlinných buněčných liniích [23–25].
Efekt terapie
O efektu ERT u LSDs v různé tíži onemocnění a u různých věkových skupin existuje celá řada důkazů na experimentální i klinické úrovni. Hlavní parametry pozitivního efektu ERT u jednotlivých LSDs a přehled preparátů jsou shrnuty v tabulce 1.
Všeobecně dochází k pozitivnímu ovlivnění parenchymatózních orgánů: hepatomegalie a splenomegalie u Gaucherovy nemoci i mukopolysacharidóz. Proti přirozenému průběhu onemocnění se zlepšují parametry růstu a kostního metabolismu. Zlepšuje se svalová síla a výdrž, která se testuje 6minutovým testem chůze, 12minutovým testem chůze či 3minutovým testem chůze do schodů (Pompeho nemoc, mukopolysacharidózy). Lepší se parametry funkcí srdce (Left Ventricular Mass Index), léčba však nemá vliv na vady chlopenního aparátu. Stabilizace nebo zlepšení je rovněž patrno v parametrech respiračních funkcí (forsírovaná vitální kapacita). U všech onemocnění bylo prokázáno zlepšení kvality života [4, 26, 27].
U Gaucherovy nemoci se zvyšuje hladina hemoglobinu a trombocytů, ustupují bolesti kostí (kostní krize). U Fabryho nemoci klesá riziko infarktu myokardu a cévní mozkové příhody, ustupují neuropatické bolesti. Zlepšuje se periferní neuropatie, tolerance k teplotním změnám, hypohidróza. U mukopolysacharidóz dochází k poklesu vylučování glykosaminoglykanů v moči. U Pompeho nemoci je léčba účinná zejména u infantilní formy, kde zásadně prodloužila přežití a snížila riziko úmrtí. U adultní formy však není zlepšení natolik výrazné, přičemž pozitivní výsledky jsou pozorovány přibližně u 2/3 dospělých pacientů [26, 28, 29].
Souhrnem tedy ERT celkově zpomaluje progresi jednotlivých onemocnění, výrazně zlepšuje funkci postižených orgánů a zvyšuje kvalitu života pacientů [30, 31].
Omezení terapie
Zatímco určité oblasti postižení odpovídají na terapii velmi dobře, některé nejsou ERT výrazněji ovlivněny. Přes zásadní zlom, který ERT do terapie LSDs přinesla, nelze opomenout její omezení a nedostatky:
- Intravenózní infuzí podávaná ERT nemá vliv na postižení CNS.
- Nedostatečný efekt ERT na skelet, chrupavku a srdeční chlopně.
- Vznik imunitní reakce vůči podávanému proteinu.
- Komplikované ukončení terapie.
- Finanční náročnost terapie.
1. Vliv ERT na postižení CNS
Molekuly preparátu nepřestupují přes hematoencefalickou bariéru receptorově zprostředkovanou cestou z důvodu absence manóza-6-fosfátových receptorů na buňkách nefenestrovaného endotelu hematoencefalické bariéry [32]. Na klinické úrovni proto neexistují přesvědčivé důkazy o efektu intravenózně podávané ERT na postižení CNS [4]. Vzhledem k závažnosti klinických důsledků postižení CNS u řady LSDs je preklinickému a v současné době již i klinickému výzkumu této problematiky věnována značná pozornost. První oblast výzkumu se věnuje efektu aplikace ERT přímo do mozkomíšního moku. V současné době probíhají klinické studie na intratekální aplikaci enzymu u pacientů s mukopolysachridózou typu I, II a IIIA a neuronální ceroidlipofuscinózou typu II (www.clinicaltrials.gov) [33]. I naše pracoviště se přímo podílelo na dosud nepublikované studii s intratekálním podáváním rekombinantního enzymu u pacientů s metachromatickou leukodystrofií.
Druhá oblast výzkumu přinesla poznatky o efektu ERT na CNS při vyšší biologické dostupnosti preparátu. Fyziologickým podkladem je přestup molekul preparátu přes hematoencefalickou bariéru nespecifickou pinocytózou. Tento proces probíhá i při terapeuticky užívaných dávkách preparátu, ovšem ve velmi malé míře. Při zvýšené biologické dostupnosti léčiva docílené navýšením podávané dávky či použitím modifikovaných molekul preparátu s vyšším biologickým poločasem či chimerických enzymových molekul [33] se množství enzymu přestupujícího do CNS významně zvyšuje a je spojeno s částečnou laboratorní úpravou a zřejmě i klinickým zlepšením [32].
2. Efekt ERT na skelet, chrupavku a srdeční chlopně
ERT je špatně účinná v oblasti postižení srdečních chlopní, chrupavky a skeletu [4, 34]. Již přítomné postižení chlopní i kosterního aparátu (dysostosis multiplex) je zřejmě ireverzibilní a efekt ERT je nanejvýše stabilizující [34]. Ukazuje se proto význam časně zahájené presymptomatické terapie, která může rozvoji těchto příznaků zcela předcházet [4, 34]. Vyvíjeny jsou nové aplikační cesty (např. intraartikulární aplikace) a biochemicky upravené preparáty s delším biologickým poločasem. Perspektivní cestu ukazuje i práce Hsu et al. [35], kteří v experimentu u Pompeho nemoci zvýšili dostupnost preparátu tvorbou nanopartikulí nesoucích rekombinantní enzym a protilátky proti ICAM-1 molekule. Tento systém se již ukázal být efektivní u Fabryho a Niemannovy-Pickovy choroby typu A-B [35].
3. Vznik imunitní reakce vůči podávanému proteinu
Organismus pacienta postiženého LSD defektní enzym často vůbec nevyrábí nebo produkovaný protein může mít změněnou strukturu. Exogenně podávaná molekula proteinu v rámci ERT tak může v organismu vyvolat imunitní reakci. Míra této reakce je individuální a závislá mimo jiné na antigenicitě daného proteinu, vlastnostech imunitního systému jedince či genotypu jedince pro dané onemocnění [26]. I když se u většiny pacientů s postupem terapie objevuje sestupná tendence titru protilátek a u části pacientů dokonce i následná séronegativita, u části pacientů představuje přítom-nost protilátek zásadní problém. Kromě vzniku alergických reakcí se objevuje rovněž i snížení účinnosti léčby [26, 36]. V těchto situacích lze využít desenzitizační postupy dilucí infuze, zpomalení rychlosti podání či farmakoterapii pomocí rituximabu, methotrexátu, kortikosteroidů či intravenózních imunoglobulinů [37].
4. Následky ukončení terapie
Náhlé přerušení ERT, jež může nastat z řady příčin (např. finanční omezení, problémy s výrobou enzymu aj.), přináší nejen ztrátu pozitivních účinků ERT, ale zejména i výrazné klinické i laboratorní zhoršení [38]. Toto zhoršení bylo pozorováno u Gaucherovy či Pompeho choroby, u mukopolysacharidózy typu II či VI. U pacientů s mukopolysacharidózou dochází k brzké manifestaci závažných pneumonií, často s respiračním selháním, regresu mentálních a motorických funkcí, rozvoji hydrocefalu, zhoršení očního a sluchového kontaktu, je přítomna svalová slabost, problémy s polykáním, retence hlenu v dýchacích cestách, otoky, zhoršení fyzické výdrže, změny na kůži či hepatomegalie [38, 39]. Mechanismus výrazného zhoršení stavu pacienta po přerušení ERT není doposud spolehlivě objasněn. Vysvětlením může být utlumení reziduální enzymové aktivity podávanou ERT či alterace procesu zpětné inhibice syntézy střádané makromolekuly v důsledku jejího hromadění, který se vyskytuje při přirozeném průběhu onemocnění. Rozhodnutí o nasazení ERT musí být tedy vždy pečlivě zváženo, zejména u pacientů se závažným fenotypem onemocnění [39].
5. Finanční náročnost terapie
I když se princip ERT blíží terapii kauzální, stále se jedná o terapii symptomatickou, substituční. Nutnost jejího celoživotního podávání je nezanedbatelnou zátěží pro pacienty, ale po všech stránkách i pro celý zdravotnický systém. ERT patří mezi mimořádně finančně náročné léčebné postupy. Léčba jednoho pacienta stojí od 1 do 22 milionů korun ročně podle preparátu a hmotnosti pacienta [7]. I vzhledem k výše uvedeným omezením terapie, která není všemocná a dokáže u některých onemocnění ovlivnit pouze některé příznaky choroby, je proto potřeba stanovit přesná kritéria indikace k terapii.
Návod k ERT
Ampule enzymu lze ve většině případů naředit do 100 ml fyziologického roztoku, který se podává nitrožilně ve 2–3 hodiny trvající infuzi. Začíná se s nižší rychlostí, která se postupně zvyšuje podle připraveného protokolu. Při aplikaci je nutno použít bakteriální filtr. Zejména u prvních aplikací a u pacientů s anamnézou alergické reakce je vhodné hodinu před podáním infuze podat antihistaminika v odpovídající dávce. Prvních deset aplikací ERT se u dětí podává během hospitalizace na KDDL pro zvýšené riziko nežádoucích, zejména alergických reakcí. Pro případ závažné nežádoucí reakce je však potřebné být připraven účinně zvládnout po celou dobu trvání terapie (viz níže). Kontraindikací podání preparátu je infekt doprovázený horečkou. Při doznívajících respiračních infektech bez teplot lze preparát podat. Nutno zvážit podání při afekcích, které mohou zastřít nežádoucí reakci, např. při nově vzniklé vyrážce. Zajištění žilního vstupu může být zejména u dětí s mukopolysacharidózou problematické. Ve většině případů proto indikujeme zavedení venózního podkožního portu.
V průběhu infuze se mohou vyskytnout všechny stupně nežádoucí alergické reakce. Přítomen může být exantém, hypotenze, otok dýchacích cest, dušnost, anafylaktický šok, horečka. Horečka může být i důsledkem bakteriální kontaminace (může se jednat i o dlouhodobou infekci portkatétru, která se projeví teplotami po podání léčby).
V případě nežádoucí alergické reakce:
- zastavit infuzi s lékem, zahájit infuzi fyziologického roztoku;
- zajistit a monitorovat vitální funkce;
- podat antihistaminika I. generace;
- podle tíže podat i.v. kortikoidy;
- při rozvíjející se anafylaxi podat adrenalin.
V případě, že se bude jednat o reakci lehkou (mírná hypotenze, exantém), je možné v aplikaci pokračovat sníženou rychlostí při zachování zvýšeného dohledu. Další aplikace je nutno konzultovat s lékařem Centra pro léčbu lysosomálních onemocnění.
Ostatní modality terapie LSDs
1. Transplantace hematopoetických kmenových buněk (HSCT)
HSCT je principiálně založená na existenci cross-correction fenoménu. Dárcovské buňky migrují do tkání příjemce a stávají se zdrojem produkce funkčního enzymu. Efekt terapie je prokazatelný a lze jej demonstrovat např. na zlepšení viscerálních manifestací onemocnění, jako je snížení hepatomegalie a splenomegalie, zlepšení obstruktivních symptomů dýchacích cest, zlepšení mobility kloubů, sluchu, kardiopulmonálních funkcí či rapidní snížení vylučování glykosaminoglykanů močí [1, 40]. Kmenové buňky mohou rovněž přestupovat přes hematoencefalickou bariéru do CNS, kde se diferencují v mikrogliální elementy, a např. u Hurlerové syndromu (nejtěžší formy mukopolysacharidózy typu I), pokud je transplantace provedena včasně, dokáží postižení CNS stabilizovat [1]. U některých dalších onemocnění, např. mukopolysacharidózy typu II, ale ani časně provedená HSCT žádoucí efekt nepřináší.
2. Substrát redukující terapie (SRT)
Principem SRT je inhibice syntézy střádané makromolekulární sloučeniny. U SRT se užívají malé molekuly, které mohou prostupovat přes hematoencefalickou bariéru, nevyvolávají imunitní reakci a preparáty mohou být podávány perorálně [5]. V současné době je SRT schválena pro Gaucherovu chorobu typu I a Niemannovu-Pickovu chorobu typu C. U Gaucherovy choroby typu I dochází k ústupu hepatomegalie a splenomegalie a zlepšení hodnot hemoglobinu a počtu trombocytů [41]. U Niemannovy-Pickovy choroby typu C SRT zlepšila či stabilizovala horizontální sakadické oční pohyby, bylo popsáno zlepšení dysartrie, ataxie, hypotonie, ptózy či epileptických záchvatů [42]. Pro mukopolysacharidózu typu III a Fabryho chorobu je preparát ve specifickém režimu tzv. sirotčího léku – „orphan drug“ (ODD). Jedná se o speciální režim schvalování léku, který ulehčuje zavedení léčiva pro vzácné onemocnění např. požadavkem nižšího množství pacientů pro klinické testování, delší patentovou ochranou, daňovými úlevami apod. U Gaucherovy a Fabryho nemoci se SRT využívá pouze zcela ojediněle pro dobrý efekt ERT [5].
3. Chaperony
Chaperony jsou malé molekuly, které dopomáhají nativním mutovaným proteinům k vytvoření správné terciární a kvartérní struktury. Lze tak docílit prodloužení biologického poločasu jinak rychle degradovaného enzymu a zachování jeho reziduální funkce [43]. Nevýhodou této terapeutické strategie je skutečnost, že k jejímu teoretickému účinku je nezbytná přítomnost jisté reziduální syntézy enzymu, tedy přítomnost missense, nikoli nonsense mutace v genu pro daný enzym. Terapie je tedy mutačně specifická [1]. Dalším úskalím může být fakt, že chaperony se váží do oblasti aktivního místa enzymu. Proto je potřeba nalézt jemnou rovnováhu mezi koncentrací, která funkci enzymu inhibuje a která naopak facilituje. Efekt byl prokázán u Fabryho a u Gaucherovy choroby [5]; slibný se zdá být vývoj mimo jiné také u Krabbeho choroby či GM2 gangliosidózy [44].
4. Genová terapie
Cesta administrace genové terapie do organismu může být provedena metodou in vivo či metodou ex vivo. In vivo administrace se provádí inzercí funkčního genu pro defektní enzym nejčastěji do virového vektoru a jeho aplikací do organismu v systémové nebo lokální formě [40]. Jsou užívány adenoasociované, retrovirové či např. lentivirové vektory. Pro zacílení CNS patologie byly vyvinuty specifické systémy, např. přímá aplikace do různých oblastí CNS, jejichž efekt byl prokázán nejen na preklinické, ale již i na klinické úrovni [33, 45, 46].
Ex vivo administrace je metodou transplantace autologních hematopoetických kmenových buněk, které byly geneticky modifikovány pro expresi funkčního enzymu [40]. Tímto postupem je oproti HSCT výrazně sníženo riziko reakce štěpu proti hostiteli a zároveň je řešena problematika nedostatku vhodných dárců [1, 40]. Účinnost ex vivo genové terapie byla pozorována opět jak na preklinické, tak již na klinické úrovni [33]. V současné době je genová terapie na úrovni I./II. fáze klinického zkoušení v režimu ODD pro mukopolysacharidózu typu IIIA, IIB a VI, metachromatickou leukodystrofii a Pompeho chorobu [5]. Přes pozitivní výsledky v této oblasti je nicméně nutno zmínit, že otázce bezpečnosti a převedení genové terapie do běžné klinické praxe je ještě třeba věnovat mnoho pozornosti.
5. Časná iniciace ERT
Studie na sourozencích demonstrují jednoznačně pozitivní efekt časně, ještě presymptomaticky zahájené ERT. Takto léčení jedinci nevykazují téměř žádné známky typického postižení, pomineme-li případné postižení CNS [47–49]. Časná iniciace ERT však vyžaduje diagnózu před samotnou manifestací onemocnění, což lze ve větším měřítku splnit jedině novorozeneckým screeningem. Kromě etických, technických a finančních problémů, které by takový screening obnášel, je největším problémem nízká genotypově-fenotypová korelace. Průběh onemocnění tak často nelze odhadnout ani při znalosti patogenní mutace. Řada mutací může mít nízkou penetranci, či řada pacientů může být postižena různě výrazně atenuovanou formou onemocnění projevující se minimálními příznaky až v dospělosti.
6. Další přístupy
Kromě již zmíněných modalit se rovněž zkoumají zcela nové léčebné přístupy. Příkladem je použití inhibitorů histonové deacetylázy, které zvyšují stabilitu defektního enzymu a snižují jeho degradaci. U Niemannovy-Pickovy choroby typu C byl testován cyklodextrin, sloučenina, která zprostředkovává eflux střádaného cholesterolu z buňky [5]. Dalším pozoruhodným postupem je užití látek se schopností indukce tzv. read-through – pokračování translace mRNA přes mutací vzniklý terminační kodón. Příkladem takové látky je gentamicin. Jeho efekt byl již s pozitivním výsledkem testován v experimentu na fibroblastech s mukopolysacharidózou typu I a ukazuje se, že by mohl být účinný i pro řadu dalších, nejen lysosomálních onemocnění (cystická fibróza, Duchennova muskulární dystrofie, ataxia teleangiectasia aj.) [1]. Zkouší se rovněž kombinace jednotlivých terapeutických modalit k dosažení aditivního terapeutického efektu. Příkladem je ERT u dítěte s mukopolysacharidózou typu I před provedením HSCT [33]. Aditivní účinek ERT a chaperonů dokládají v experimentu Porto a kol. [50].
Závěr
Enzymová substituční terapie přinesla zcela zásadní zlom do terapie lysosomálních střádavých onemocnění. Mění výrazně přirozený obraz a průběh choroby, zlepšuje kvalitu života a zpomaluje progresi onemocnění. Při presymptomatické iniciaci terapie může být zabráněno manifestaci velké většiny symptomů nemoci. Časná diagnostika onemocnění a zahájení terapie jsou tak klíčové. I přes významný posun kupředu má ovšem enzymová substituční terapie svá zásadní omezení a potenciální přínos a rizika je potřeba před každým zahájením léčby pečlivě diskutovat.
Došlo: 8. 4. 2015
Přijato: 27. 5. 2015
Korespondující autor:
MUDr. Martin Magner, Ph.D.
Klinika dětského a dorostového lékařství
1. LF UK a VFN
Ke Karlovu 2
128 08 Praha 2
e-mail: martin.magner@vfn.cz
Zdroje
1. Beck M. Therapy for lysosomal storage disorders. IUBMB Life 2010; 62 (1): 33–40.
2. te Vruchte D, Wallom KL, Platt FM. Measuring relative lysosomal volume for monitoring lysosomal storage diseases. Methods Cell Biol 2015; 126 : 331–347.
3. Ballabio A, Giesermann V. Lysosomal disorders: From storage to cellular damage. Biochim Biophys Acta 2009; 1793 (4): 684–696.
4. Muenzer J. Early initiation of enzyme replacement therapy for mucopolysaccharidoses. Mol Genet Metab 2014; 111 (2): 63–72.
5. Hollak CEM, Wijburg FA. Treatment of lysosomal storage disorders: successes and challanges. J Inherit Metab Dis 2014; 37 (4): 587–598.
6. Poupětová H, Ledvinová J, Berná L, et al. The birth prevalence of lysosomal storage disorders in the Czech Republic: comparison with data in different populations. J Inherit Metab Dis 2010; 33 (4): 387–396.
7. Malinova V, Honzík T. Lysosomální onemocnění – současné možnosti diagnostiky a terapie. Pediatr praxi 2013; 14 (2): 99–103.
8. Malinová V, Ješina P, Linhart A, et al. Lyzosomální onemocnění – současné možnosti diagnostiky a terapie. Postgrad Med 2014; 16 (příloha č. 2): 51–63.
9. Ješina P, Magner M, Poupětová H, et al. Mukopolysacharidóza I – klinické projevy u 24 dětí z České republiky a Slovenska. Čes-slov Pediat 2011; 66 (4): 6–11.
10. Magner M, Buganová M, Asfaw B, et al. Klinické projevy a výsledky laboratorních vyšetření u čtyř pacientů s alfa-manosidózou. Čes-slov Pediat 2008; 63 (12): 677–682.
11. Magner M, Hrubá E., Poupětová H, et al. Klinická manifestace Hunterovy nemoci u 22 českých pacientů. Čes-slov Pediat 2014; 69 (S1): 56.
12. de Duve C, Pressman BC, Gianetto R, et al. Tissue fractionation studies. 6. Intracellular distribution patterns of enzymes in rat-liver tissue. Biochem J 1955; 60 (4): 604–617.
13. Coutinho MF, Matos L, Alves S. From bedside to cell biology: a century of history on lysosomal dysfunction. Gene 2015; 555 (1): 50–58.
14. Batzios SP, Zafeiriou DI, Papakonstantinou E. Extracellular matrix components: An intricate network of possible biomarkers for lysosomal storage disorders? FEBS Lett 2013; 587 (7): 1258–1267.
15. Neufeld EF. Enzyme replacement therapy – a brief history. In: Mehta A, Beck M, Sunder-Plassmann G (eds). Fabry Disease: Perspectives from 5 Years of FOS. Oxford: Oxford Pharmagenesis, 2006: Chapter 10.
16. Ghosh P, Dahms NM, Korngeld S. Mannose 6-phosphate receptors: new twist in the tale. Nat Rev Mol Cell Biol 2003; 4 (3): 202–212.
17. Barton NW, Brady RO, Dambrosia JM, et al. Replacement therapy for inherited enzyme deficiency – macrophage-targeted glucocerebrosidase for Gaucher’s disease. N Engl J Med 1991; 324 (21): 1464–1470.
18. Mapes CA, Anderson RL, Sweeley CC, et al. Enzyme replacement in Fabry’s disease, an inborn error of metabolism. Science 1970; 169 (3949): 987–989.
19. Grabowski GA, Barton NW, Pastores G, et al. Enzyme therapy in type 1 Gaucher disease: comparative efficacy of mannose-terminated glucocerebrosidase from natural and recombinant sources. Ann Intern Med 1995; 122 (1): 33–39.
20. Ioannou YA, Bishop DF, Desnick RJ. Overexpression of human α-galactosidase A results in its intracellular aggregation, crystallization in lysosomes, and selective secretion. J Cell Biol 1992; 119 (5): 1137–1150.
21. Kakkis ED, Matynia A, Jonas AJ, et al. Overexpression of the human lysosomal enzyme α-l-iduronidase in Chinese hamster ovary cells. Protein Expr Purif 1994; 5 (3): 225–232
22. Van Hove JL, Yang HW, Wu JY, et al. High-level production of recombinant human lysosomal acid α-glucosidase in Chinese hamster ovary cells which targets to heart muscle and corrects glycogen accumulation in fibroblasts from patients with Pompe disease. Proc Natl Acad Sci USA 1996; 93 (1): 65–70.
23. Grabowski GA, Golembo M, Shaaltiel Y. Taliglucerase alfa: an enzyme replacement therapy using plant cell expression technology. Mol Genet Metab 2014; 112 (1): 1–8.
24. He X, Galpin JD, Tropak MB, et al. Production of active human glucocerebrosidase in seeds of Arabidopsis thaliana complex-glycan-deficient (cgl) plants. Glycobiology 2012; 22 (4): 492–503.
25. Martiniuk F, Reggi S, Tchou-Wong KM, et al. Production of a functional human acid maltase in tobacco seeds: biochemical analysis, uptake by human GSDII cells, and in vivo studies in GAA knockout mice. Appl Biochem Biotechnol 2013; 171 (4): 916–926.
26. Augustine EF, Mink JW. Enzyme replacement in neuronal storage disorders in the pediatric population. Curr Treat Options Neurol 2013; 15 (5): 634–651.
27. Park JS, Kim HG, Shin JH, et al. Effect of enzyme replacement therapy in late onset Pompe disease: open pilot study of 48 weeks follow-up. Neurol Sci 2015; 36 (4): 559–560.
28. Anderson LJ, Henley W, Wyatt KM, et al. Effectiveness of enzyme replacement therapy in adults with late-onset Pompe disease: results from the NCS-LSD cohort study. J Inherit Metab Dis 2014; 37 (6): 945––952.
29. Anderson LJ, Wyatt KM, Henley W, et al. Long-term effectiveness of enzyme replacement therapy in Fabry disease: results from the NCS--LSD cohort study. J Inherit Metab Dis 2014; 37 (6): 969–978.
30. Ratko TA, Marbella A, Godfrey S, et al. Enzyme-Replacement Therapies for Lysosomal Storage Diseases Technical Brief. No. 12. Rockville, MD: Agency for Healthcare Research and Quality, 2013.
31. Wyatt K, Henley W, Anderson LJ, et al. The effectiveness and cost-effectiveness of enzyme and substrate replacement therapies: a longitudinal cohort study of people with lysosomal storage disorders. Health Technol Assess 2012; 16 (39): 1–543.
32. Baldo G, Guiglani R, Matte U. Lysosomal enzymes may cross the blood-brain-barrier by pinocytosis: implications for enzyme replacement therapy. Med Hypotheses 2014; 82 (4): 478–480.
33. Ortolano S, Viéitez I, Navarro C, et al. Treatment of lysosomal storage diseases: recent patents and future strategies. Recent Pat Endocr Metab Immune Drug Discov 2014; 8 (1): 9–25.
34. Braunlin E, Rosenfeld H, Kampmann C, et al. Enzyme replacement therapy for mucopolysaccharidosis VI: long-term cardiac effects of galsulfase (Naglazyme®) therapy. J Inherit Metab Dis 2013; 36 (2): 385–394.
35. Hsu J, Northrup L, Bhowmick T, et al. Enhanced delivery of α-glucosidase for Pompe disease by ICAM-1-targeted nanocarriers: comparative performance of a strategy for three distinct lysosomal storage disorders. Nanomedicine 2012; 8 (5): 731–739.
36. Banugaria SG, Prater SN, Ng YK, et al. The impact of antibodies on clinical outcomes in diseases treated with therapeutic protein: lessons learned from infantile Pompe disease. Genet Med 2011; 13 (8): 729–736.
37. Baruteau J, Broomfield A, Crook V, et al. Successful desensitisation in a patient with CRIM-positive infantile-onset Pompe disease. JIMD Rep 2014; 12 : 99–102.
38. Jurecka A, Malinova V, Tylki-Szymańska A. Effect of rapid cessation of enzyme replacement therapy: a report of 5 more cases. Mol Genet Metab 2014; 111 (2): 212–213.
39. Jurecka A, Żuberuber Z, Opoka-Winiarska V, et al. Effect of rapid cessation of enzyme replacement therapy: a report of 5 cases and a review of the literature. Mol Genet Metab 2012; 107 (3): 508–512.
40. Noh H, Lee JI. Current and potential therapeutic strategies for mucopolysaccharidoses. J Clin Pharm Ther 2014; 39 (3): 215–224.
41. Mistry PK, Lukina E, Ben Turkia H, et al. Effect of oral eliglustat on splenomegaly in patients with Gaucher disease type 1: the ENGAGE randomized clinical trial. JAMA 2015; 695–706.
42. Santos ML, Raskin S, Telles DS, et al. Treatment of a child diagno-sed with Niemann-Pick disease type C with miglustat: a case report in Brazil. J Inherit Metab Dis 2008; 31 (S2): S357–361.
43. Wang YJ, Di XJ, Mu TW. Using pharmacological chaperones to restore proteostasis. Pharmacol Res 2014; 83 : 3–9.
44. Chiricozzi E, Niemir N, Aureli M, et al. Chaperone therapy for GM2 gangliosidosis: effects of pyrimethamine on β-hexosaminidase activity in Sandhoff fibroblasts. Mol Neurobiol 2014; 50 (1): 159–167.
45. McIntyre C, Derrick-Roberts AL, Byers S, et al. Correction of murine mucopolysaccharidosis type IIIA central nervous system pathology by intracerebroventricular lentiviral-mediated gene delivery. J Gene Med 2014; 16 (11–12): 374–387.
46. Tomatsu S, Alméciga-Díaz CJ, Barbosa H, et al. Therapies of mucopolysaccharidosis IVA (Morquio A syndrome). Expert Opin Orphan Drugs 2013; 1 (10): 805–818.
47. Laraway S, Breen C, Mercer J, et al. Does early use of enzyme replacement therapy alter the natural history of mucopolysaccharidosis I? Experience in three siblings. Mol Genet Metab 2013; 109 (3): 315–316.
48. Tajima G, Sakura N, Kosuga M, et al. Effects of idursulfase enzyme replacement therapy for mucopolysaccharidosis type II when started in early infancy: comparison in two siblings. Mol Genet Metab 2013; 108 (3): 172–177.
49. Tylki-Szymańska A, Jurecka A, Zuber Z, et al. Enzyme replacement therapy for mucopolysaccharidosis II from 3 months of age: a 3-year follow-up. Acta Paediatr 2012; 101 (1): e42–47.
50. Porto C, Ferrara MC, Meli M, et al. Pharmacological enhancement of α-glucosidase by the allosteric chaperone N-acetylcysteine. Mol Ther 2012; 20 (12): 2201–2211.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek EdémyČlánek Arteriální hypertenze
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2015 Číslo 4- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Screening sluchu novorozenců ve FN Brno
- Hyperbarická oxygenoterapie u pediatrických pacientů v Centru hyperbarické medicíny Ostrava v letech 2007–2011
- Matematické modelovanie infekčných ochorení detského veku
- Gastrointestinálne nežiaduce účinky metotrexátu v liečbe pacientov s juvenilnou idiopatickou artritídou – vieme ich správne hodnotiť?
- Vodní dýmka není bezpečnou alternativou klasických cigaret!
- XVII. Hradecké pediatrické dny
- Enzymová substituční terapie u lysosomálních onemocnění
- Možnosti zmierňovania detskej bolesti na psychosociálnej úrovni
- XXI. Luhačovické pediatrické dny
- Specifika bolestivého chování u dětí s těžkým kombinovaným postižením
- Edémy
- Arteriální hypertenze
- Úskalia diagnostiky a liečby feochromocytómu u detí
- XI. Hradecké vakcinologické dny
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Edémy
- Enzymová substituční terapie u lysosomálních onemocnění
- Úskalia diagnostiky a liečby feochromocytómu u detí
- Gastrointestinálne nežiaduce účinky metotrexátu v liečbe pacientov s juvenilnou idiopatickou artritídou – vieme ich správne hodnotiť?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



