-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Osteoporóza u mladých dospělých osob
Osteoporosis in young adults
Low-trauma fractures in young adults are most often the result of secondary osteoporosis. Less frequently, the cause of fractures or low bone mineral density (BMD) is a monogenic disease with delayed manifestation in adulthood (e.g. osteogenesis imperfecta) or idiopathic osteoporosis. Low BMD alone may reflect a physiologically low peak bone mass in otherwise healthy individuals and does not mean an increased risk of fractures. For clinical practice, it is important to rule out the secondary causes of osteoporosis and other metabolic or cancer induced bone diseases. Treatment should be causal. Anti-osteoporotic treatment is indicated if causal measures are insufficient or cannot be provided, e.g., in osteoporosis induced by chemotherapy or long-term treatment with glucocorticoids.
Keywords:
Young adults – fractures – osteoporosis – low bone mineral density
Autori: Zikán Vít
Pôsobisko autorov: Osteocentrum, III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Clinical Osteology 2022; 27(4): 135-146
Kategória: Přehledové články
Súhrn
Nízkotraumatické zlomeniny u mladých dospělých osob jsou nejčastěji důsledkem sekundární osteoporózy. Méně často je příčinou zlomenin nebo nízké denzity kostního minerálu (BMD) monogenní onemocnění s opožděnou manifestací v dospělosti (např. osteogenesis imperfecta) nebo idiopatická osteoporóza. Samotná nízká BMD může souviset také s nedosažením vrcholové kostní hmoty u jinak zdravých osob a neznamená vždy zvýšené riziko zlomenin. Pro klinickou praxi je důležité vyloučit sekundární etiologii osteoporózy a jiná metabolická nebo nádorová onemocnění skeletu. Léčba má být kauzální. Antiosteoporotická léčba je indikována, pokud nejsou dostačující kauzální opatření nebo je nelze zajistit, např. při osteoporóze navozené chemoterapií nebo dlouhodobou léčbou glukokortikoidy.
Klíčová slova:
osteoporóza – zlomeniny – mladí dospelí – nízká denzita kostního minerálu
Úvod
Osteoporóza je systémové metabolické onemocnění skeletu charakterizované sníženou pevností kostí a zvýšeným rizikem zlomenin. Porucha mechanické odolnosti kosti vzniká v důsledku úbytku kostní hmoty anebo zhoršení její kvality. Osteoporotické zlomeniny vznikají typicky po nepřiměřeně malém traumatu. Nízkotraumatické zlomeniny u mladých dospělých osob jsou nejčastěji důsledkem sekundární osteoporózy. Pokud není prokázána sekundární příčina, jedná se o idiopatickou osteoporózu nebo o vzácná monogenní onemocnění, která se mohou manifestovat až dospělém věku. Prevalence osteoporózy u mladých dospělých osob podle publikovaných studií kolísá v závislosti na rizikových faktorech a použité definici osteoporózy. Podle definice T-skóre ≤ −2,5 SD by teoreticky splňovalo kritéria osteoporózy 0,5 % mladých zdravých žen ve věku 30–40 let a dalších 15 % by bylo považováno za osteopenické (T-skóre v rozmezí mezi −2,5 až −1) [1]. Naproti tomu u mladých osob se známými příčinami sekundární osteoporózy je prevalence nízké BMD (Z-skóre ≤ −2 SD) vysoká a kolísá od 7,3 % u revmatoidní artritidy [2] do 45 % u Cushingova syndromu nebo cystické fibrózy [3,4]. Sekundární osteoporóza u mladých osob je spojena se zvýšeným rizikem zlomenin [5]. Premenopauzální žena s prodělanou nízkotraumatickou zlomeninou má o 35–75 % vyšší riziko, že v období po menopauze prodělá osteoporotickou zlomeninu [6]. Naproti tomu klinický význam izolované nízké BMD (bez zlomenin a známé sekundární etiologie) není znám. Cílem článku je poskytnout aktuální přehled týkající se diagnostiky a léčby osteoporózy u mladých dospělých osob (premenopauzálních žen a mužů mladších 50 let věku s výjimkou dětí a mladistvých).
Etiologie a patogeneze
Vývoj kostní hmoty a její determinanty jsou znázorněny na obrázku (graf). Obsah kostního minerálu ve skeletu se během puberty a dospívání více než zdvojnásobuje, zatímco skutečná objemová kostní denzita (v g/cm3) se mění minimálně. V důsledku periostální apozice (modelace) narůstá velikost (průměr) a tloušťka zejména kortikální kosti a současně se modelují a remodelují i endosteální kostní povrchy, tak aby bylo dosaženo geneticky determinovaného maxima kostní hmoty (PBM – Peak Bone Mass) s odpovídající geometrií a mikrostrukturou. Vrcholová kostní hmota je významnou determinantou pevnosti kostí po celý život a je obvykle definována jako maximum kostní hmoty ve věku 30 let. Rychlost dosažení PBM se liší podle hodnocené oblasti skeletu, pohlaví, etnického původu a tělesné konstituce. Ženy dosahují PBM v proximálním femuru přibližně ve 20 letech a v páteři a předloktí kolem 30 let. U mužů dochází k nárůstu kostní hmoty přibližně stejným tempem jako u žen, ale růst kostní hmoty trvá déle, což vede k vyššímu PBM o 10–15 %. Ačkoli 40–80 % variability BMD a kostní mikroarchitektury je geneticky podmíněno, tak pro dosažení geneticky determinované PBM je klíčový především normální hormonální vývoj, zdravé nutriční vzory a přiměřená fyzická aktivita, a to již od velmi raného života [7]. Svalová hmota a síla je významným prediktorem BMD a spolu s androgeny zodpovídá za větší průměr kostí u mužů než u žen (asi o 40 %). Dosažení PBM u žen může negativně ovlivnit i hormonální antikoncepce, zejména v době dospívání. Mladé ženy (< 30 let) s dlouhodobou expozicí depotnímu medroxyprogesteron - acetátu (≥ 10 receptů) mají vyšší riziko zlomenin [8]. Úbytek kortikální i trámčité kosti začíná brzy po dosažení PBM u obou pohlaví (0,5–1 % ročně v závislosti na oblasti skeletu). Rychlost a stupeň úbytku kostní hmoty ovlivňuje řada faktorů – věk, změny tělesné hmotnosti, příjem vápníku a vitaminu D, fyzická aktivita, konzumace alkoholu, kouření, rodinná anamnéza osteoporózy a u žen také těhotenství a délka laktace. U žen dochází k urychlení kostní ztráty již v perimenopauzálním období, ve kterém významně stoupají hladiny FSH, které predikují úbytek BMD v páteři i v kyčli [9].
Graf 1. Vývoj kostní hmoty s věkem. Upraveno podle [7] ![Vývoj kostní hmoty s věkem. Upraveno podle [7]](https://pl-master.mdcdn.cz/media/image_pdf/9ce67a05bc746d08d6187df8857bbe74.jpg?version=1674302041)
determinanty vrcholové kostní hmoty: polygenní dědičnost, tedy aditivní účinky více genů a jejich polymorfizmů vysvětluje 50–80 % interindividuální variability vrcholové kostní hmoty; hormony (zejména gonadální steroidy a růstový hormon); nutrice (vápník, vitamin D, bílkoviny, dietní vzory); fyzická aktivita a svalová hmota a síla; škodlivé životní návyky (nikotinizmus, abúzus alkoholu); chronická onemocnění nebo jejich léčba (např. glukokortikoidy). Sekundární osteoporóza
Sekundární příčiny osteoporózy jsou uvedeny v tab. 1. Objasnění sekundárních příčin osteoporózy je klíčové pro volbu kauzálních léčebných opatření, která mohou významně snížit riziko zlomenin. Důležité je zvažovat i subklinické formy onemocnění, např. subklinický hyperkortizolizmus, asymptomatická primární hyperparatyreóza nebo celiakie. U řady onemocnění, jako jsou např. revmatické a gastrointestinální zánětlivé choroby, je etiopatogeneze osteoporózy komplexní (kombinace systémového zánětu, deficitu estrogenů a vitaminu D, léčba glukokortikoidy a další).
Tab. 1. Sekundární příčiny osteoporózy a zlomenin u mladých osob 
GnRH – hormon uvolňující gonadotropin HIV – virus lidské imunodeficience SSRI – selektivní inhibitor zpětného vychytávání serotoninu Osteoporóza spojená s karcinomem prsu je spojena hlavně s deprivací estrogenů navozenou chemoterapií a hormonální terapií, resp. s použitím nesteroidních inhibitorů aromatázy (AI) [10]. Adjuvantní terapie, včetně chemoterapie a analogů hormonu uvolňujícího gonadotropin (GnRH) vyvolává sekundární amenoreu a předčasnou menopauzu. Předčasná menopauza v důsledku chemoterapie vyvolává rychlou roční ztrátu BMD (4–8 % v páteři a 2–4 % v proximálním femuru). S významným úbytkem BMD a se zvýšeným rizikem zlomenin je spojena i androgen deprivační terapie u mužů. U pacientů s maligními hematologickými onemocněními, kteří podstupují autologní nebo alogenní transplantaci hematopoetických kmenových buněk, patří mezi hlavní komplikace ztráta kostní hmoty a zvýšená četnost zlomenin [11].
Osteoporóza vyvolaná glukokortikoidy (GIO) je obvykle pozorována u dospělých osob s autoimunitními/ zánětlivými poruchami a revmatologickými onemocněními, která samy o sobě způsobují osteoporózu. I když glukokortikoidy mají mnohonásobné negativní účinky na zdraví kostí [12], jsou také schopny do určité míry kontrolovat aktivitu základního onemocnění, což může mít naopak příznivé účinky na zachování kostní hmoty a její kvality. Tyto aspekty zatím nebyly u mladých dospělých osob dostatečně studovány. Dvouenergiová rentgenová absorpciometrie (DXA) se běžně používá pro hodnocení rizika zlomenin u postmenopauzální osteoporózy, ale má špatnou rozlišovací schopnost při predikci zlomenin u GIO. Téměř polovina premenopauzálních žen se zlomeninami v důsledku GIO má normální BMD [13].
Osteoporóza spojená s těhotenstvím a laktací
Během těhotenství a laktace vedou změny metabolizmu vápníku k přechodnému úbytku BMD zejména v oblastech s převahou trámčité kostní hmoty. Longitudinální studie dokumentovaly úbytek BMD v bederní páteři během těhotenství 3–5 % a během 6měsíční laktace 3–10 %. Ke zlepšení BMD dochází většinou za 6–12 měsíců po ukončení laktace. Fyziologicky se během těhotenství a laktace uplatňuje zvýšená produkce PTHrP (peptidu odvozeného od parathormonu) z prsní žlázy a placenty, který zvyšuje resorpci kosti a zpětnou resorpci kalcia v ledvinách. K vyšší osteoresorpci přispívá i hypoestrogenní stav při zvýšených hladinách prolaktinu. Během těhotenství se zvyšuje střevní absorpce kalcia, ale po porodu se vrací k normálním hodnotám. Samotná suplementace vápníkem u zdravých žen po porodu nebrání úbytku BMD během laktace a po jejím ukončení vedla pouze k mírnému nárůstu BMD oproti placebu. Opakované gravidity a laktace (déle než 6 měsíců), zejména pokud navazují brzy po sobě, nemusí vést k úplnému obnovení kostní hmoty. Regulační mechanizmy zprostředkovávající obnovu kosti po ukončení laktace nebyly detailně definovány. Longitudinální studie u žen po porodu ukazují, že úprava BMD může pokračovat po dobu 18 měsíců nebo déle [14].
Osteoporóza spojená s těhotenstvím a laktací je vzácný stav, který se může projevovat ve formě spinální osteoporózy nebo tranzientní osteoporózy v oblasti kyčle [15]. Osteoporóza v oblasti proximálního femuru bývá spojena s bolestí kyčle a může být komplikována zlomeninou, někdy spontánní. Zlomeniny obratlů (i vícečetné) se manifestují silnými bolestmi zad a ztrátou tělesné výšky (nejčastěji ve 3. trimestru nebo během laktace). Etiologie zůstává neznámá a nebylo dosud objasněno, zda je osteoporóza způsobena samotným těhotenstvím nebo zda těhotenství a laktace urychlí rozvoj osteoporózy u geneticky disponovaných osob [15]. K vyloučení sekundární etiologie osteoporózy by mělo vždy být provedeno diferenciálně diagnostické vyšetření. Mezi uváděné rizikové faktory osteoporózy a zlomenin patří anamnéza nízké pohybové aktivity a chronická onemocnění zejména v období puberty a dospívání a nedosažení maxima kostní hmoty, a také imobilizace během těhotenství nebo léčba heparinem. U některých žen byl dokumentován nízký kostní obrat po 12 měsících od ukončení laktace a pomocí vysoko rozlišujícího pQCT byla dokumentována menší tloušťka trámčité i kortikální kosti. Genetická analýza odhalila u některých žen heterozygotní mutace v genech COL1A2 a COL1A1 nebo mutace v genu LRP5 [16].
Idiopatická osteoporóza
Diagnóza idiopatické osteoporózy (IOP) je stanovena per exclusionem až po vyloučení známých sekundárních nebo genetických příčin osteoporózy [5,17,18]. Zlomeniny mohou být opakované, častěji byly dokumentovány zlomeniny obratlů. U mladých žen s křehkostí kostí, které postrádají sekundární příčiny a poruchy metabolizmu vápníku, se říká, že mají „idiopatickou osteoporózu“ (IOP). Nízkou BMD u konstitučně štíhlých osob, ale bez prevalentních zlomenin nelze automaticky považovat za IOP, jelikož samotná nízká BMD může být důsledkem nedosažené vrcholové kostní hmoty u jinak zdravých osob a souvisí s genetickou predispozicí a životosprávou nebo nemocemi během vývoje skeletu. U mužů byla dokumentována nižší tělesná hmotnost a snížená BMD v oblasti bederní páteře a také tenčí kortikální kost v oblasti dlouhých kostí. Zlomeniny obratlů, které jsou běžné u mužské IOP, byly spojeny se zvýšenou kortikální porozitou v oblasti lopaty kosti kyčelní. Nízká kostní novotvorba může u mužů souviset s nízkými cirkulujícími hladinami IGF1 a volného estradiolu a vyššími koncentracemi sexuálních hormonů vázajících globulin (SHBG). U mužů se může uplatňovat nízká PBM a genetická predispozice (byly zjištěny např. polymorfizmy genu pro LRP5). Kostní biopsie z lopaty kosti kyčelní u premenopauzálních žen s IOP dokumentovaly nedostatečnou kostní novotvorbu a významně tenčí kortikální kost i kostní trámce. Nízká kostní novotvorba asociovala s vyššími cirkulujícími koncentracemi IGF1, a tedy s možnou rezistencí osteoblastů na IGF1 [19]. Byl ale také dokumentován zvýšený kostní obrat a snížené sérové koncentrace volného estradiolu.
Genetické (monogenní) příčiny osteoporózy a zlomenin
Nízkotraumatické zlomeniny u mladých dospělých osob mohou ve vzácných případech představovat pozdější projev monogenního onemocnění [20,21]. Bylo popsáno již více než 400 monogenních poruch s kosterními projevy, včetně mutací souvisejících s vyšší lomivostí kostí [22]. Častější monogenní choroby, které se manifestují zlomeninou, jsou uvedeny v tab. 2. U osob s opakovanými nízkotraumatickými zlomeninami (bez ohledu na BMD) a bez zjištěných sekundárních příčin by měly být vyloučeny zejména mírné formy osteogenesis imperfecta a další vzácnější onemocnění, jako je hypofosfatázie, syndrom osteoporózy s pseudogliomem, Marfanův syndrom a Ehlers-Danlosův syndrom, Gaucherova a Pompeho choroba nebo endokrinní syndromy (včetně hypogonadotropního hypogonadizmu, mutací estrogenových receptorů nebo aromatázy) [5].
Tab. 2. Vybrané monogenní choroby, které se manifestují zlomeninou 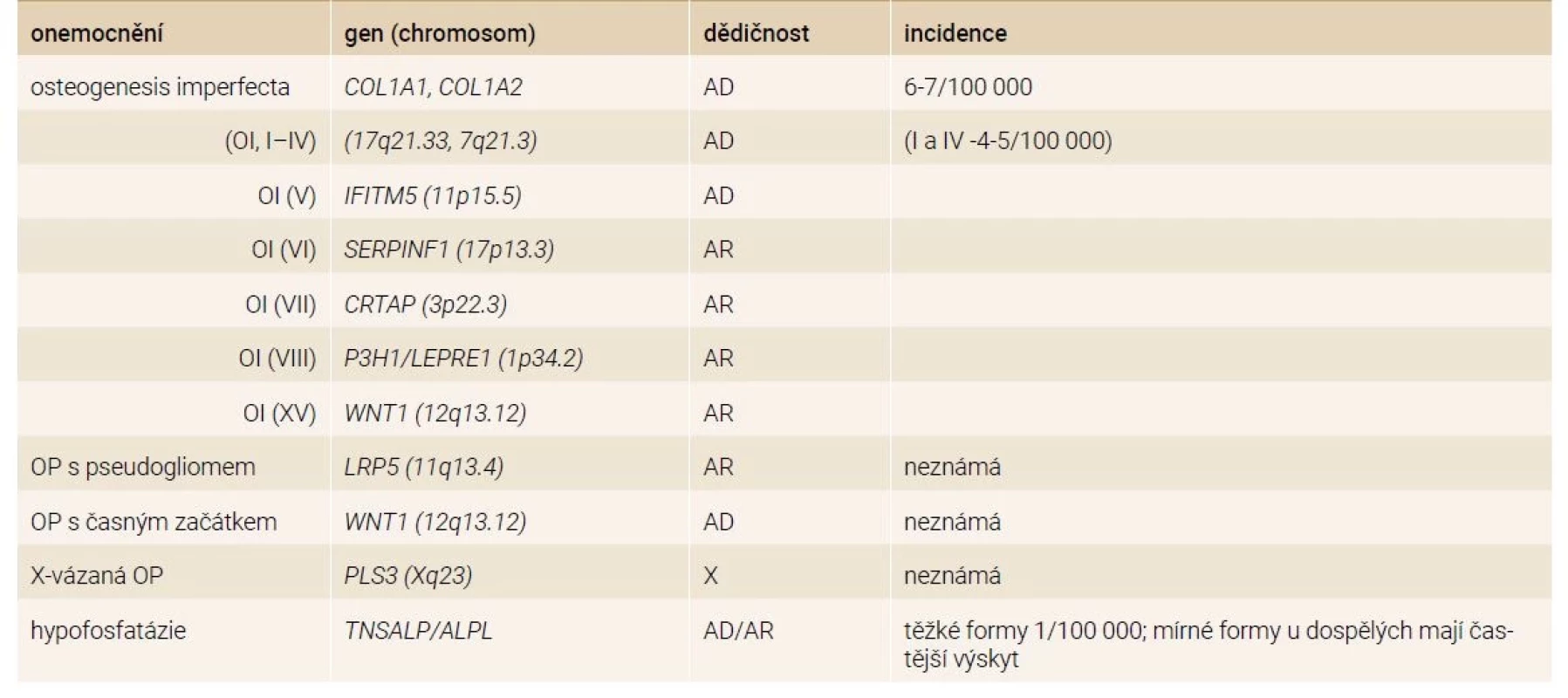
AD – autosomálně dominantní AR – autosomálně recesivní OI – osteogenesis imperfecta OP – osteoporóza Diagnostika a diferenciální diagnostika
Osteologické vyšetření včetně dvouenergiové rentgenové absorpciometrie (DXA) je doporučeno provést u osob s prodělanou nízkotraumatickou zlomeninou (zejména obratle, femuru a humeru nebo u vícečetných zlomenin) nebo u chronických onemocnění a dalších stavů, které jsou spojeny s úbytkem a zhoršením kvality kostní hmoty (tab. 1). Mezinárodní společnost pro klinickou denzitometrii (ISCD – International Society for Clinical Densitometry) doporučuje u premenopauzálních žen a u mužů (≤ 50 let) pro hodnocení plošné BMD pomocí DXA užívat Z-skóre (srovnání s populací stejného pohlaví a odpovídajícího kalendářního věku) [23]. Hodnoty Z-skóre ≤ -2,0 se považují za „významně snížené vzhledem ke kalendářnímu věku“. U mladých osob s dosaženou vrcholovou kostní hmotou (kdy je T - a Z-skóre prakticky identické) je podle Mezinárodní nadace pro osteoporózu (IOF – International Osteoporosis Foundation) možné k hodnocení BMD užívat i T-skóre, podobně jako u žen po menopauze (srovnání s populací mladých zdravých dospělých osob) [5]. U osob, které trpí známým onemocněním, které vede k osteoporóze (tab. 1), je pak hodnota T-skóre ≤ -2,5 považována za diagnostickou hranici pro osteoporózu. Vztah mezi BMD a rizikem zlomenin ale není u mladých dospělých osob známý a nástroje pro predikci zlomenin, např. FRAX®, nejsou v této populaci validovány. U osob s nízkou BMD (Z-skóre ≤ -2 nebo T-skóre ≤ -2,5) ale bez zlomenin je obtížné rozlišit mezi zdravými jedinci, jejichž nízká BMD je důsledkem nedosažení maxima kostní hmoty, což nemusí v době vyšetřování představovat patologický stav, a těmi, kteří mají vysoké riziko zlomenin. Pro spolehlivou diagnózu osteoporózy u mladých dospělých osob je vyžadována jak nízká BMD, tak současná přítomnost nízkotraumatických zlomenin nebo sekundárních faktorů a klinických stavů, které vedou k úbytku kostní hmoty nebo zhoršování její kvality. V indikovaných případech je důležité zhodnocení přítomnosti zlomenin obratlů, které mohou být minimálně symptomatické (RTG nebo VFA-semikvantitativní morfometrie obratlů pomocí DXA), tab. 3.
Tab. 3. Indikace kostní denzitometrie a morfometrie obratlů 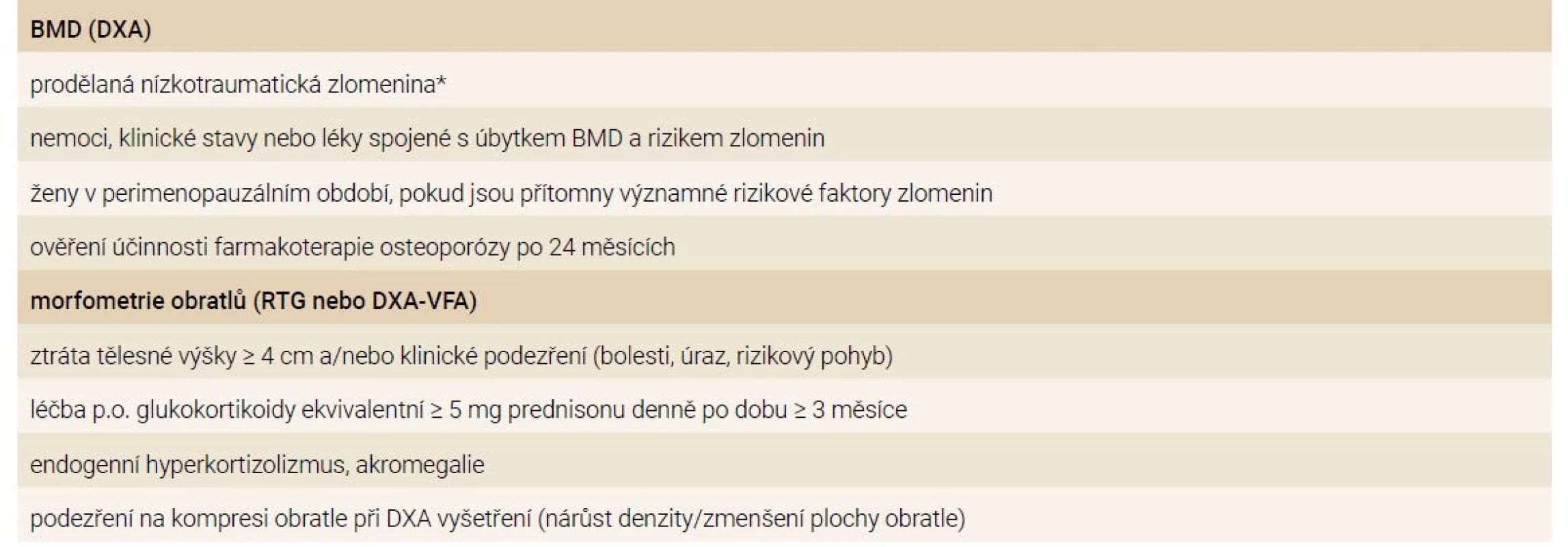
* Zlomeniny v dětství a dospívání jsou běžné a obvykle traumatické, samotná anamnéza takové zlomeniny nepředstavuje indikaci pro DXA a další vyšetření. Na druhé straně mladí dospělí, kteří utrpěli zlomeninu obratle nebo mnohočetné zlomeniny nebo trpí chronickým onemocněním, které poškozuje skelet, by měly absolvovat osteologické vyšetření včetně DXA.
DXA – dvouenergiová rentgenová absorpciometrie/denzitometrie RTG – rentgenové vyšetření VFA – hodnocení zlomenin obratlů/Vertebral Fracture AssessmentV praxi by osteologické vyšetření mělo zahrnovat úplnou osobní, rodinnou a pracovní anamnézu a pečlivé fyzikální (tab. 4) a laboratorní diferenciálně diagnostické vyšetření (tab. 5). Klinický obraz u pacientů bez zlomenin je většinou bez specifických nálezů. Důležité je hledat projevy onemocnění, které mohou sekundárně přispívat k úbytku kostní hmoty (tab. 1) a nezapomenout na subklinické formy onemocnění např. u celiakie, idiopatických střevních zánětů, Cushingova syndromu, primární hyperparatyreózy nebo systémové mastocytózy. Při absenci známé sekundární etiologie osteoporózy je nutné zvažovat i vzácná genetická (monogenní) onemocnění (tab. 2) nebo IOP. Diferenciálně diagnostický přístup u mladých dospělých osob s nízkou BMD anebo zlomeninou znázorňuje schéma. Opakované měření BMD je vhodné k vyloučení pokračující ztráty kostní hmoty a k identifikaci osob s vyšším rizikem zlomeniny. Biochemické markery kostního obratu ( BTM – B one Turnover M arkers) – j sou n ápomocné při hodnocení aktivity kostního procesu a v diferenciální diagnostice, ale mají řadu úskalí v interpretaci [24]. Prediktivní význam BTM pro riziko zlomenin nebyl u mladých osob stanoven a BTM se mění v závislosti na povaze onemocnění a jeho závažnosti a aktivitě, terapii, stejně jako na fyzické aktivitě a výživě. Nízký kostní obrat, zejména nízké koncentrace plazmatického osteokalcinu mohou svědčit pro hyperkortizolizmus. U pacientů s osteogenesis imperfecta se zjišťují normální nebo snížené koncentrace N-terminálního propeptidu prokolagenu I (PINP) a C-terminálního telopeptidu kolagenu I (ß-CTX) v séru, zatímco plazmatický osteokalcin bývá zvýšený. Nízká BMD a zvýšené BTM mohou svědčit pro zrychlený úbytek kostní hmoty. Zvýšené hodnoty BTM přetrvávají i několik měsíců po zlomenině. V případě chronických onemocnění v dětství nebo dospívání může být opožděno dosažení vrcholu kostní hmoty (do 30 let věku) a kostní obrat bude zvýšený v důsledku pokračující fyziologické modelace a remodelace skeletu. Zobrazovací vyšetření (scintigrafie skeletu, CT nebo MRI-vyšetření) jsou indikována za účelem objasnění etiologie kostního procesu. Kostní biopsie je indikována k objasnění lokalizovaného kostního procesu nebo k vyloučení osteomalacie a různých typů renální osteodystrofie u pacientů s chronickým selháváním ledvin.
Tab. 4. Anamnéza a fyzikální vyšetření při podezření na metabolické onemocnění skeletu 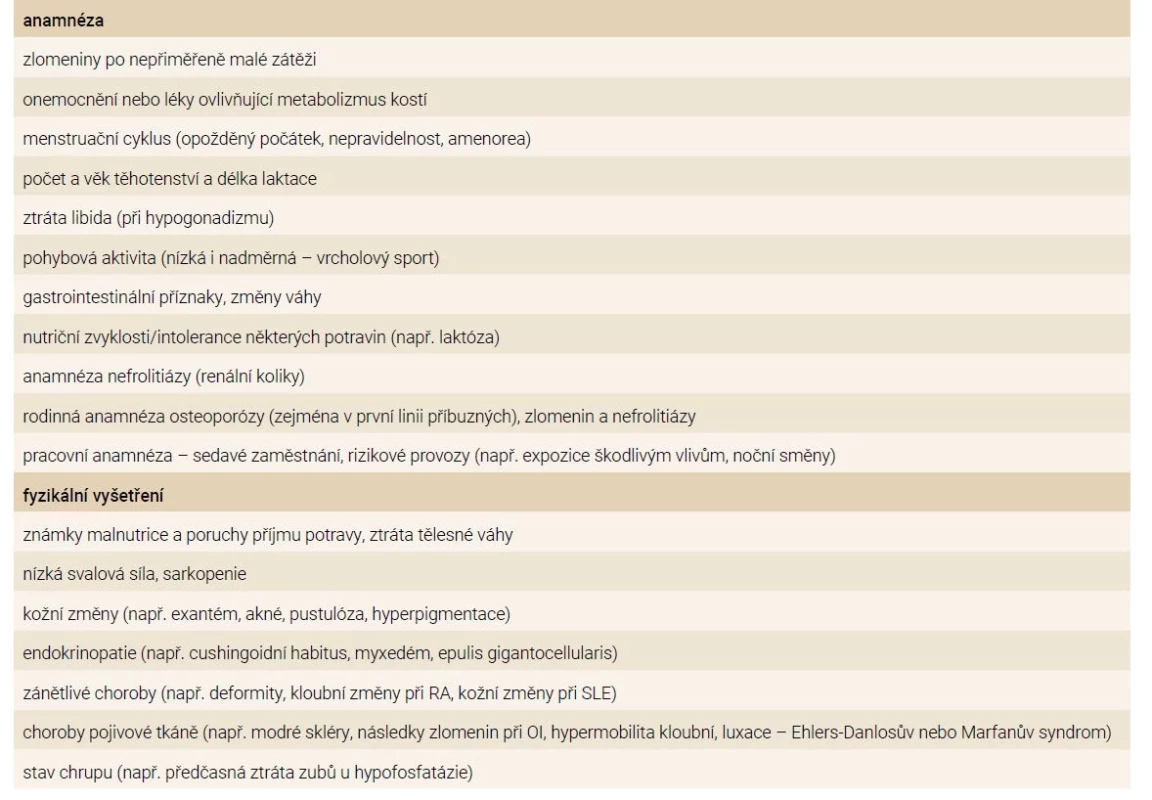
OI – osteogenesis imperfecta RA – revmatoidní artritida SLE – systémový lupus erythematodes Tab. 5. Základní a doplňující laboratorní vyšetření u žen s nízkou BMD nebo nízkotraumatickou zlomeninou 
ALP – alkalická fosfatáza FGF23 – fibroblastový růstový faktor 23 FSH – folikuly stimulující hormon TSH – hormon stimulující štítnou žlázu LH – luteinizační hormon PTH – parathormon TIBC – celková vazebná kapacita pro železo v séru Schéma | Postup vyšetření u mladých dospělých osob s nízkou BMD nebo s anamnézou nízkotraumatické zlomeniny 
BMD – Bone Mineral Density/hustota kostního minerálu BMI – Body Mass Index/index tělesné hmotnosti BTM – Bone Turnover Markers/markery kostní remodelace RF – rizikové faktory Preventivní opatření
Pro zajištění geneticky determinovaného maxima kostní hmoty během dětství a dospívání a udržení zdravé kostní hmoty je nezbytná pravidelná a přiměřená fyzická aktivita a zdravá výživa s udržením normální tělesné hmotnosti (udržení svalové síly, normální poměr tukové a svalové tkáně), normální hormonální stav a vyloučení škodlivých návyků, jako je nikotinizmus nebo abúzus alkoholu, a toxických vlivů prostředí.
Nutriční opatření – adekvátní příjem vápníku (800–1 000 mg vápníku ze stravy a doplňků, zejména fermentované mléčné výrobky, které mají příznivý vliv na střevní mikrobiotu – nízký obsah laktózy, probiotika a prebiotika). Nedostatek vitaminu D u mladých dospělých osob byl pozorován v různých geografických oblastech. Vyšší riziko nedostatku vitaminu D je mj. u osob s obezitou nebo hybným deficitem a u malabsorpčních syndromů. V klinické praxi jsou doporučené postupy pro suplementaci vitaminem D s cílovou hladinou 25-hydroxyvitaminu D3 (25OHD) alespoň 50 nmol/l [25]. Suplementace cholekalciferolem v dávce 800–1 000 IU denně je nezbytná zejména v zimních a jarních měsících, stejně jako dostatek kvalitních bílkovin (živočišné i rostlinné) a zdravé nutriční vzory s dostatkem ovoce, zeleniny a vlákniny (antioxidační a protizánětlivé působení, příznivý vliv na střevní mikrobiotu). Vhodné je omezit zpracované potraviny a nadměrný příjem fosfátů (kolové nápoje, instantní polévky, uzeniny atd) a nadbytečný příjem kuchyňské soli. Pravidelná fyzická aktivita, která zatěžuje skelet, je nezbytná pro kostní novotvorbu a udržení vyrovnané kostní remodelace. Nedostatečná fyzická aktivita vede k obezitě, ztrátě svalové hmoty a síly a navozuje negativní nerovnováhu v kostní remodelaci (k útlumu osteoblastogeneze dochází již na úrovni mezenchymálních kmenových buněk). Nadměrná fyzická aktivita (např. u vrcholových sportů) vede k nedosažení maxima kostní hmoty nebo ke ztrátě kostní hmoty v důsledku úbytku tělesné hmotnosti a hypotalamické amenorey.
Léčba
Léčba má být kauzální, tedy cílená podle etiologie kostního procesu. U premenopauzálních žen s amenoreou je doporučeno užít kombinovanou hormonální substituci (estrogen-progestin) nebo antikoncepci při respektování kontraindikací. Podobně u mladých mužů s hypogonadizmem je na místě zvážení substituční léčby testosteronem. Řada studií potvrzuje, že léčba základního onemocnění významně zlepšuje BMD u mladých osob se sekundární osteoporózou [26,27]. Další farmakologickou intervenci antiosteoresorpčními nebo osteoanabolickými léky je vhodné zvažovat u osob s vysokým rizikem zlomenin, pokud kauzální opatření nejsou dostačující nebo je nelze zajistit (např. zhoršující se kvalita kosti při léčbě glukokortikoidy nebo ztráta kosti při hormonální ablační léčbě). U osob s nízkou BMD, ale bez zlomenin či známých sekundárních příčin osteoporózy a bez zrychleného úbytku BMD není farmakoterapie téměř nikdy indikována. Naopak recentní nízkotraumatické zlomeniny by měly být považovány za vysoce rizikové pro další zlomeniny v krátkodobém až střednědobém horizontu. Longitudinální studie s antiosteoporotickou léčbou u mladých osob s osteoporózou jsou limitované malým počtem pacientů a údaje o dlouhodobé účinnosti (prevence zlomenin) a bezpečnosti chybí. Rozhodnutí o zahájení léčby a jejím trvání musí být vždy individuální s přihlédnutím k rizikovým faktorům zlomenin a možným výhodám a nežádoucím účinkům léčby. Před zahájením každé farmakologické léčby je nezbytné zajistit dostatečný příjem vápníku a vitaminu D.
Antiosteoresorpční léčba
Léčba aminobisfosfonáty (BP) brání úbytku BMD v případě sekundární etiologie osteoporózy, zejména pokud je zvýšena kostní resorpce, např. u amenorey indukované chemoterapií, u ovariálního selhání po alogenní transplantaci kmenových buněk, při adjuvantní léčbě inhibitory aromatázy nebo u androgen-deprivační terapie u mužů. U pacientek s časným stadiem karcinomu prsu a adjuvantní chemoterapií, u kterých se rozvinulo ovariální selhání, zabránila léčba kyselinou zoledronovou v dávce 4 mg každé 3 měsíce úbytku BMD během 2 let léčby [28]. Přerušení dvouleté léčby kyselinou zoledronovou (4 mg každé 3 měsíce) nevedlo k úbytku BMD v kyčli ani v páteři po dobu dalších 3 let [29]. V prevenci úbytku BMD navozenému ovariální supresní terapií (goserelin) a tamoxifenem nebo anastrozolem u premenopauzálních žen s endokrinně senzitivním karcinomem prsu byla účinná aplikace kyseliny zoledronové i v nižší dávce 4 mg každých 6 měsíců po dobu 3 let [30]. Studie hodnotící nižší dávkování (v dávce 5 mg po 12 měsících) podobně jako u postmenopauzální osteoporózy zatím nebyly publikovány. Pro prevenci úbytku kostní hmoty u premenopauzálních žen s karcinomem prsu a hormonální ablační terapií je doporučováno užití BP již při Z-skóre ≤ -2 SD v bederní páteři nebo v kyčli nebo při dokumentovaném významném úbytku BMD již při Z-skóre < -1 SD. V ČR je ale úhrada léčby BP možná až při T-skóre ≤ -2,5 SD nebo po prodělané nízkotraumatické zlomenině.
Léčba BP měla pozitivní vliv na BMD u mužů a žen postižených cystickou fibrózou [31] a betatalasemií [32]. Metaanalýza u pacientů se zánětlivým onemocněním střev, která zahrnovala 13 randomizovaných studií a (923 pacientů: muži i ženy ve věkovém rozmezí 30–47 let), prokázala zlepšení BMD a snížení rizika zlomenin po léčbě BP [33]. U pacientů s mentální anorexií je nárůst hmotnosti klíčovým faktorem pro úpravu kostní hmoty. Léčba BP ale může přispívat k nárůstu BMD [34].
Bezpečnost léčby BP je nutné zvažovat u žen ve fertilním věku vzhledem k potenciálním teratogenním účinkům BP během těhotenství [35], byť většina publikovaných kazuistik týkajících se léčby BP u těhotných žen neuvádí závažné nežádoucí účinky na plod [36]. Podle doporučení by léčba BP neměla být zahájena, pokud žena plánuje těhotenství v příštích 12 měsících [37]. Denosumab má ve srovnání s BP reverzibilní účinek a nemá toxické účinky pro osteoblasty, ale jeho účinnost a bezpečnost u mladých osob zatím nebyla dostatečně hodnocena. Riziko představuje i přerušení léčby vzhledem k následnému zrychlenému úbytku kostní hmoty a riziku zlomenin obratlů [38]. Studie na zvířatech naznačují, že denosumab podobně jako BP může způsobit poškození plodu [39].
Osteoanabolická léčba
Léčba teriparatidem (PTH 1–34) zlepšuje kvalitu kosti a jeho účinnost a bezpečnost byla dokumentována u premenopauzálních žen léčených glukokortikoidy, při léčbě agonisty GnRH pro endometriózu, u idiopatické osteoporózy (muži i ženy) i u osteoporózy spojené s těhotenstvím a laktací nebo u žen s mentální anorexií. V pilotní studii zahrnující 41 premenopauzálních žen s IOP (s nízkotraumatickými zlomeninami nebo velmi nízkou BMD) vedla léčba teriparatidem v dávce 20 μg denně po dobu 18–24 měsíců k významnému nárůstu BMD v oblasti páteře i proximálního femuru a ke zlepšení mikroarchitektury a pevnosti kosti [40]. Ve velké retrospektivní multicentrické studii zahrnující 52 žen s osteoporózou diagnostikovanou v období těhotenství a laktace bylo dokumentováno, že ženy bez jakékoli léčby měly roční průměrný nárůst BMD v páteři o 6,6 % a v kyčli o 2,3 %, zatímco ženy léčené BP měly nárůst BMD v páteři o 10,2 % a v krčku femuru o 2,6 % [41]. Ženy léčené teriparatidem měly roční průměrný přírůstek BMD 14,9 % v bederní páteři a 5,6 % v krčku femuru. Obdobné zvýšení BMD v páteři bylo dokumentováno i v jiné retrospektivní studii u 32 žen osteoporózou v těhotenství s mnohočetnými zlomeninami, které byly léčeny teriparatidem po dobu 12 měsíců (15,5 % ± 6,6 vs 7,5 % ± 7,1 u žen bez léčby) [42].
V případě nízké kostní novotvorby u glukokortikoidy indukované osteoporózy (GIO) je účinnost dlouhodobé antiresorpční léčby BP limitována, nedochází ke zlepšení kostní kvality a riziko zlomenin při trvající kortikoterapii neklesá. Pokles rizika zlomenin obratlů u GIO je dokumentován při léčbě teriparatidem [43]. V randomizované studii u pacientů s GIO, která srovnávala účinnost teriparatidu oproti alendronátu, vedla léčba teriparatidem k významně většímu nárůstu BMD v bederní páteři i u premenopauzálních žen [44]. Léčba teriparatidem je v ČR hrazena u pacientů, kteří mají denzitometricky prokázanou osteoporózu (BMD – T-skóre ≤ -2,5 v oblasti páteře nebo kyčle) a jsou dlouhodobě léčení glukokortikoidy v dávce ≥ 5 mg prednisonu nebo jeho ekvivalentu denně po dobu ≥ 6 měsíců. U pacientů, kteří neužívají dlouhodobě kortikoidy, je léčba hrazena pouze v případě selhání minimálně 2leté antiresorpční léčby (alespoň 2 zlomeniny obratlů/zhoršení BMD) u nemocných s T-skóre bederní páteře nebo proximálního femuru či krčku femuru (při nemožnosti měření v oblasti bederní páteře) ≤ -2,5 SD a zároveň s více než jednou zlomeninou obratle v anamnéze. Po ukončení léčby teriparatidem je nezbytné navázat antiresorpční léčbou, aby nedošlo ke ztrátě vytvořené kostní hmoty. U mladých dospělých osob doporučujeme BP.
Teriparatid byl ve studiích na hlodavcích spojován s výskytem osteosarkomu a léčba je proto kontraindikována u pacientů s jeho zvýšeným rizikem (Pagetova kostní choroba, předchozí ozařování skeletu, v době růstu kostí nebo při nevysvětlitelném zvýšení ALP). Neexistují žádné zprávy o teratogenních účincích teriparatidu na plod, ale při nedostatku údajů je léčba teriparatidem u těhotných žen kontraindikována.
Další metabolická onemocnění skeletu
Osteogenesis imperfecta (OI) – byť je většina pacientů diagnostikována v dětství, tak se zlomeniny mohou objevit až v mladé dospělosti. Kauzální léčba není. U dospělých osob se zlomeninami je možné užít off-label teriparatid nebo BP [45].
Hypofosfatázie je vrozená porucha metabolizmu způsobená mutací genu kódujícího tkáňovou nespecifickou ALP. U dospělých se může projevovat jako osteomalacie, chondrokalcinóza nebo opakované „stresové“ nebo atypické zlomeniny, ale i typické osteoporotické zlomeniny. Kauzální léčbou je rekombinantní ALP [46]. Léčba BP nebo denosumabem je kontraindikována.
Závěr
Diagnóza osteoporózy u mladých dospělých osob vyžaduje nejen přítomnost nízké BMD, ale také průkaz kostní fragility, která odráží abnormální kostní kvalitu (prodělaná zlomenina nebo známé sekundární příčiny, které zvyšují riziko zlomenin). To je v klinické praxi obtížné, pokud nejsou přítomny zlomeniny nebo známé sekundární příčiny osteoporózy. Kostní obrat u mladých osob s idiopatickou osteoporózou nebývá zvýšený (pokud není současně deficit estrogenů). Klinický význam pokročilejších zobrazovacích technik, jako je vysoce rozlišující pQCT/MRI, je zatím omezený, a proto v běžné klinické praxi zůstává klíčové hodnocení rizikových faktorů osteoporózy a zlomenin (včetně posouzení přítomnosti zlomenin obratlů). Léčba základních příčin sekundární osteoporózy je přínosná nejen s ohledem na BMD, ale i na kvalitu (mikrostrukturu) kosti. V případě, že léčba základní příčiny není úspěšná a/nebo v přítomnosti těžké osteoporózy, lze užít antiresorpční nebo osteoanabolické léky. Přístup k léčbě musí být individuální se zvážením výhod a rizik dlouhodobé léčby a léčba vyžaduje pečlivé monitorování.
Doporučení pro klinickou praxi
• DXA vyšetření je doporučeno u osob s nízkotraumatickou zlomeninou (zejména obratle, femuru, humeru nebo u vícečetných zlomenin) a u onemocnění a klinických stavů nebo léků, které vedou k sekundárnímu úbytku nebo zhoršení kvality kosti.
• Při interpretaci nízké BMD u mladých osob je nutné vzít v úvahu i nedosažení vrcholové kostní hmoty a u premenopauzálních žen ztráty BMD v období gravidity a laktace.
• Léčba má být kauzální (cílená podle etiologie kostního procesu). Diferenciálně diagnostické vyšetření má vyloučit sekundární a vzácné genetické příčiny osteoporózy a jiné metabolické nebo nádorové osteopatie.
• Při nálezu samotné nízké BMD bez zlomenin u jinak zdravých jedinců nedoporučujeme farmakologickou antiosteoporotickou léčbu, ale preventivní opatření a opakování měření BMD za 2 roky k vyloučení pokračující ztráty kostní hmoty.
• U žen ve fertilním věku léčených p.o. glukokortikoidy s amenoreou doporučujeme HT estrogeny/gestageny za respektování kontraindikací této léčby.
• U pacientů s nízkou BMD (T-skóre ≤ -2,5) anebo prevalentní zlomeninou obratle a dlouhodobou léčbou glukokortikoidy v dávce ≥ 5 mg prednisonu nebo jeho ekvivalentu denně po dobu ≥ 6 měsíců je doporučeno zvažovat osteoanabolickou léčbu teriparatidem v první volbě s navazující antiresorpční léčbou.
• Před zahájením léčby u premenopauzálních žen je vždy nezbytné zvážit i rizika farmakologické léčby v případě gravidity (BP, denosumab).
• U žen s předčasnou menopauzou vyvolanou chemoterapií a s nízkou BMD (T-skóre ≤ -2,5) nebo s prevalentní nízkotraumatickou zlomeninou je doporučena léčba BP.
• Pokud preventivní nebo léčebná opatření nemají očekávaný účinek, je nezbytné opakovat diferenciálně diagnostické vyšetření a revidovat diagnózu osteoporózy.
• Idiopatická osteoporóza s opakujícími se zlomeninami nebo s pokračujícím úbytkem BMD je vzácná. U těchto osob je vhodné komplexní vyšetření klinickým osteologem včetně indikace genetického vyšetření.
Publikace podpořena MZ ČR – RVO VFN64165
doc. MUDr. Vít Zikán, Ph.D.
www.vfn.cz
Received | Doručeno do redakce | Doručené do redakcie 7. 9. 2022
Accepted | Přijato po recenzi | Prijaté po recenzii 30. 10. 2022
Zdroje
1. Kanis JA, Delmas P, Burckhardt P et al. Guidelines for diagnosis and management of osteoporosis. The European Foundation for Osteoporosis and Bone Disease. Osteoporos Int 1997; 7(4): 390–406. Dostupné z DOI: <http://dx.doi.org/10.1007/BF01623782>.
2. Sharma M, Dhakad U, Wakhlu A et al. Lean Mass and Disease Activity are the Best Predictors of Bone Mineral Loss in the Premenopausal Women with Rheumatoid Arthritis. Indian J Endocrinol Metab 2018; 22(2): 236–243. Dostupné z DOI: <http://dx.,doi.org/10.4103/ijem.IJEM_665_17>.
3. Rahaman SH, Jyotsna VP, Kandasamy D et al. Bone health in patients with Cushing’s syndrome. Indian J Endocrinol Metab 2018; 22(6): 766–769. Dostupné z DOI: <http://dx.doi.org/10.4103/ijem.IJEM_160_18>.
4. Cairoli E, Eller-Vainicher C, Morlacchi LC et al. Bone involvement in young adults with cystic fbrosis awaiting lung transplantation for end-stage respiratory failure. Osteoporos Int 2019; 30(6): 1255–1263. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–019–04893-z>.
5. Ferrari S, Bianchi ML, Eisman JA et al. IOF Committee of Scientific Advisors Working Group on Osteoporosis Pathophysiology. Osteoporosis in young adults: pathophysiology, diagnosis, and management. Osteoporos Int 2 012; 2 3(12): 2 735–2748. Dostupné z DOI: < http://dx.doi.org/10.1007/s00198–012–2030-x>.
6. Hosmer WD, Genant HK, Browner WS. Fractures before menopause: a red flag for physicians. Osteoporos Int 2002; 13(4): 3 37–341. Dostupné z DOI: <http://dx.doi.org/10.1007/s001980200035>.
7. Weaver CM, Gordon CM, Janz KF et al. The National Osteoporosis Foundation’s position statement on peak bone mass development and lifestyle factors: a systematic review and implementation recommendations. Osteoporos Int 2016; 27(4): 1281–1386. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–015–3440–3>.
8. Guilbert ER, Brown JP, Kaunitz AM et al. The use of depot-medroxyprogesterone acetate in contraception and its potential impact on skeletal health Contraception 2009; 79(3): 167–177. Dostupné z DOI: <http://dx.doi.org/10.1016/j.contraception.2008.10.016>.
9. Taneja C, Gera S, Kim SM et al. FSH-metabolic circuitry and menopause. J Mol Endocrinol 2019; 63(3): R73-R80. Dostupné z DOI: <http://dx.doi.org/10.1530/JME-19–0152>.
10. Waqas K, Lima Ferreira J et al. Updated guidance on the management of cancer treatment-induced bone loss (CTIBL) in pre - and postmenopausal women with early-stage breast cancer. J Bone Oncol 2021; 1 8(28): 1 00355. Dostupné z DOI: < http://dx.doi.org/10.1016/j.jbo.2021.100355>.
11. Kendler DL, Body JJ, Brandi ML et al. International Osteoporosis Foundation Committee of Scientific Advisors Working Group on Cancer and Bone Disease. Bone management in hematologic stem cell transplant recipients. Osteoporos Int 2018; 29(12): 2597–2610. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–018–4669–4>.
12. Buckley L, Humphrey MB. Glucocorticoid-induced osteoporosis. N Engl J Med 2 018; 3 79(26): 2 547–2556. Dostupné z DOI: < http://dx.doi.org/10.1056/NEJMcp1800214>.
13. Hayashi K, Yamamoto M, Murakawa Y et al. Bone fragility in male glucocorticoid-induced osteoporosis is not defined by bone mineral density. Osteoporos Int 2009; 20(11): 1889–1894. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–009–0901–6>.
14. Grizzo FM, Alarcão AC, Dell’ Agnolo CM et al How does women’s bone health recover after lactation? A systematic review and meta-analysis. Osteoporos Int 2020; 31(3): 413–427. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–019–05236–8>.
15. Hardcastle SA. Pregnancy and Lactation Associated Osteoporosis. Calcif Tissue Int 2022; 110(5): 531–545. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–021–00815–6>.
16. Butscheidt S, Delsmann A, Rolvien T et al. Mutational analysis uncovers monogenic bone disorders in women with pregnancy-associated osteoporosis: three novel mutations in LRP5, COL1A1, and COL1A2. Osteoporos Int 2018; 29(7): 1643–1651. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–018–4499–4>.
17. Rozenberg S, Bruyère O, Bergmann P et al. How to manage osteoporosis before the age of 50. Maturitas 2020; 138 : 14–25. Dostupné z DOI: <http://dx.doi.org/10.1016/j.maturitas.2020.05.004>.
18. Pepe J, Body JJ, Hadji P et al. Osteoporosis in Premenopausal Women: A Clinical Narrative Review by the ECTS and the IOF. J Clin Endocrinol Metab 2020; 105(8): dgaa306. Dostupné z DOI: <http://dx.doi.org/10.1210/clinem/dgaa306>.
19. Goetz TG, Nair N, Shiau S et al. In premenopausal women with idiopathic osteoporosis, lower bone formation rate is associated with higher body fat and higher IGF-1.Osteoporos Int. 2022; 33(3): 659–672. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–021–06196–8>.
20. Cohen A, Hostyk J, Baugh EH et al. Whole exome sequencing reveals potentially pathogenic variants in a small subset of premenopausal women with idiopathic osteoporosis. B one 2 022; 1 54 : 1 16253. Dostupné z DOI: <http://dx.doi.org/116253.10.1016/j.bone.2021.116253>.
21. Stürznickel J, Rolvien T, Delsmann A et al. Clinical Phenotype and Relevance of LRP5 and LRP6 Variants in Patients With Early-Onset Osteoporosis (EOOP). J Bone Miner Res 2021; 36(2): 271–282. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.4197>.
22. Mortier GR, Cohn DH, Cormier-Daire V et al. Nosology and classification of genetic skeletal disorders: 2019 revision. Am J Med Genet A . 2 019; 1 79(12): 2 393–2419. Dostupné z DOI: < http://dx.doi.org/10.1002/ajmg.a.61366>.
23. The International Society for Clinical Densitometry (ISCD) official-positions 2019. Dostupné z WWW: <https://www.iscd.org/official-positions/2019-iscd-official-positions-adult>.
24. Pikner R, Palička V, Rosa J et al. Markery kostního obratu u osteoporózy: společné stanovisko k jejich využití Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně (SMOS ČLS JEP) a České společnosti klinické biochemie České lékařské společnosti J. E. Purkyně (ČSKB ČLS JEP). Clin Osteol 2020; 25(2): 65–82.
25. Lips P, Cashman KD, Lamberg-Allardt C et al. Current vitamin D status in European and Middle East countries and strategies to prevent vitamin D deficiency; a position statement of the European Calcified Tissue Society. Eur J Endocrinol 2019; 180(4): 23–54. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-18–0736>.
26. Vodopivec DM, Silva AM, Garcia-Banigan DC et al. Gender differences in bone mineral density in patients with sporadic primary hyperparathyroidism. Endocrinol Diabetes Metab 2018; 1(4) :e00037. Dostupné z DOI: <http://dx.doi.org/10.1002/edm2.37>.
27. Frei R, Fournier N, Zeitz J et al. [Swiss IBD Cohort Study Group]. Early initiation of anti-TNF is associated with favourable long-term outcome in Crohn’s disease: 10-year-follow-up data from the Swiss IBD Cohort Study. J Crohns Colitis 2019; 13(10): 1292–1301. Dostupné z DOI: <http://dx.doi.org/10.1093/ecco-jcc/jjz057>.
28. Shapiro CL, Halabi S, Hars V et al. Zoledronic acid preserves bone mineral density in premenopausal women who develop ovarian failure due to adjuvant chemotherapy: final results from CALGB trial 79809. Eur J Cancer 2011; 47(5): 683–689. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ejca.2010.11.024>.
29. Kyvernitakis I, Kann PH, Thomasius F et al. Prevention of breast cancer treatment-induced bone loss in premenopausal women treated with zoledronic acid: Final 5-year results from the randomized, double-blind, placebo-controlled ProBONE II trial. Bone 2018; 114 : 109–115. Dostupné z DOI: http://dx.doi.org/10.1016/j.bone.2018.06.007>.
30. Gnant M, Mlineritsch B, Stoeger H et al. Austrian Breast and Colorectal Cancer Study Group. Adjuvant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer: 62-month follow-up from the ABCSG-12 randomised trial. Lancet Oncol 2011; 1 2(7): 6 31–641. Dostupné z DOI: < http://dx.doi.org/10.1016/S1470–2045(11)70122-X>.
31. Conwell LS, Chang AB. Bisphosphonates for osteoporosis in people with cystic fibrosis. Cochrane Database Syst Rev 2014; (3): CD002010. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD002010.pub4>-
32. Bhardwaj A, Swe KM, Sinha NK et al. Treatment for osteoporosis in people with ß-thalassaemia. Cochrane Database Syst Rev 2016; (3): CD010429. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD010429.pub2>.
33. Yao L, Wang H, Dong W et al. Efficacy and safety of bisphosphonates in management of low bone density in inflammatory bowel disease: a meta-analysis. Medicine (Baltimore) 2017; 96(3): e5861. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0000000000005861>.
34. Robinson L, Aldridge V, Clark EM et al. Pharmacological treatment options for low bone mineral density and secondary osteoporosis in anorexia nervosa: a systematic review of the literature. J Psychosom Res 2017; 98 : 87–97. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jpsychores.2017.05.011>.
35. Minsker DH, Manson JM, Peter CP. Effects of the bisphosphonate, alendronate, on parturition in the rat. Toxicol Appl Pharmacol 1993; 1 21(2): 2 17–223. Dostupné z DOI: < http://dx.doi.org/10.1006/taap.1993.1148>.
36. Machairiotis N, Ntali G, Kouroutou P et al. Clinical evidence of the effect of bisphosphonates on pregnancy and the infant. Horm Mol Biol Clin Investig 2019; 40(2): /j/hmbci.2019.40.issue-2/hmbci-2019–0021/hmbci-2019–0021.xml. Dostupné z DOI: <http://dx.doi.org/10.1515/hmbci-2019–0021>.
37. Langdahl BL. Osteoporosis in premenopausal women. Curr Opin Rheumatol 2017; 29(4): 410–415. Dostupné z DOI: <http://dx.doi.org/10.1097/BOR.0000000000000400>.
38. Tsourdi E, Zillikens MC, Meier C et al. Fracture Risk and Management of Discontinuation of Denosumab Therapy: A Systematic Review and Position Statement by ECTS. J Clin Endocrinol Metab 2020; dgaa756.Dostupné z DOI: <http://dx.doi.org/10.1210/clinem/dgaa75>.
39. Boyce RW, Varela A, Chouinard L et al. Infant cynomolgus monkeys exposed to denosumab in utero exhibit an osteoclast-poor osteopetrotic-like skeletal phenotype at birth and in the early postnatal period. Bone 2 014; 6 4 : 314–325.Dostupné z DOI: < http://dx.doi.org/10.1016/j.bone.2014.04.002>.
40. Cohen A, Shiau S, Nair N et al. Effect of Teriparatide on Bone Remodeling and Density in Premenopausal Idiopathic Osteoporosis: A Phase II Trial. J Clin Endocrinol Metab 2020; 105(10): e3540–56. Dostupné z DOI: <http://dx.doi.org/10.1210/clinem/dgaa489>.
41. Laroche M, Talibart M, Cormier C et al. Pregnancy-related fractures: a retrospective study of a French cohort of 52 patients and review of the literature. Osteoporos Int 2017; 28(11): 3135–3142. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–017–4165–2>.
42. Hong N, Kim JE, Lee SJ et al. Changes in bone mineral density and bone turnover markers during treatment with teriparatide in pregnancy-and lactation-associated osteoporosis. Clin Endocrinol (Oxf) 2018; 8 8(5): 6 52–658. Dostupné z DOI: < http://dx.doi.org/10.1111/cen.13557>.
43. Liu ZM, Zhang M, Zong Y et al. The efficiency and safety of alendronate versus teriparatide for treatment glucocorticoid-induced osteoporosis: A meta-analysis and systematic review of randomized controlled t rials. P LoS One 2 022; 1 7(5): e 0267706. < http://dx.doi.org/10.1371/journal.pone.0267706>.
44. Saag KG, Shane E, Boonen S et al. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med 2007; 357(20): 2028–2039. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa071408>.
45. Ralston SH, Gaston MS. Management of Osteogenesis Imperfecta. Front Endocrinol (Lausanne) 2020; 10 : 924. Dostupné z DOI:<http://dx.doi.org/10.3389/fendo.2019.00924>.
46. Bianchi ML, Bishop NJ, Guañabens N, et al. [Rare Bone Disease Action Group of the European Calcified Tissue Society]. Hypophosphatasia in adolescents and adults: overview of diagnosis and treatment. Osteoporos Int 2020; 31(8): 1445–1460. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–020–05345–9>.
Štítky
Biochémia Detská gynekológia Detská rádiológia Detská reumatológia Endokrinológia Gynekológia a pôrodníctvo Interné lekárstvo Ortopédia Praktické lekárstvo pre dospelých Rádiodiagnostika Rehabilitácia Reumatológia Traumatológia Osteologie
Článek Slovo úvodem
Článok vyšiel v časopiseClinical Osteology
Najčítanejšie tento týždeň
2022 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Slovo úvodem
- Cirkadiální rytmy a kostní metabolizmus
- Chondrogenic potential of intramembranous skeletal bones
- Má hormonální substituční terapie své místo v prevenci osteoporózy?
- Osteoporóza u mladých dospělých osob
- Use of PRP for treatment of tibia fracture with delayed consolidation: case report
- Výber z najnovších vedeckých informácií v osteológii
- Clinical Osteology
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteoporóza u mladých dospělých osob
- Má hormonální substituční terapie své místo v prevenci osteoporózy?
- Chondrogenic potential of intramembranous skeletal bones
- Cirkadiální rytmy a kostní metabolizmus
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



