-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Opomíjené virové infekce přenášené hematofágními členovci v České republice
Neglected Arthropod-Borne Viral Infections in the Czech Republic
Central European encephalitis is the most common arthropod-borne virus disease in the Czech Republic, with the mean annual incidence of 6 cases per 100 000 population. However, seven less known arboviruses (Flavivirus West Nile, Bunyavirus Ťahyňa, Bunyavirus Batai, Bunyavirus Sedlec, Bunyavirus Lednice, Orbivirus Tribeč, Uukuvirus Uukuniemi) also circulate in this country, of which West Nile, Ťahyňa, Tribeč and possibly Batai have been reported to cause human disease. Moreover, antibodies against two other pathogenic viruses found in Europe, i.e. Alphavirus Sindbis and Coltivirus Eyach, have been detected in the Czech Republic. The aim of this study is to review briefly the less known arboviruses found in the Czech Republic with emphasis on the taxonomic status, identification of their hosts and vectors, and pathogenicity to humans. These arboviruses can cause febrile illness to aseptic (meningo)encephalitis of unclear etiology. The review points out the possible emergence of these neglected arboviruses in the foreseeable future and provides diagnostic guidance.
Key words:
arboviruses – ticks – mosquitoes – emerging diseases – surveillance.
Autori: I. Rudolf 1
; Z. Hubálek 1
; S. Šikutová 1
; P. Švec 2
Pôsobisko autorov: Ústav biologie obratlovců AV ČR, v. v. i., Brno 1; Česká sbírka mikroorganizmů ÚEB PřF MU, Brno 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 79, 2008, č. 3, s. 80-89
Súhrn
Nejčastějším onemocněním způsobeným arboviry v České republice je středoevropská klíšťová encefalitida (s průměrnou roční incidencí 6 případů/100 000 obyvatel). Na našem území se však občas vyskytuje dalších sedm méně známých arbovirů (Flavivirus West Nile, Bunyavirus Ťahyňa, Bunyavirus Batai, Bunyavirus Sedlec, Bunyavirus Lednice, Orbivirus Tribeč, Uukuvirus Uukuniemi), z nichž onemocnění člověka prokazatelně způsobují viry West Nile, Ťahyňa, Tribeč, a pravděpodobně také Batai. Navíc byly u nás prokázány protilátky k dalším dvěma patogenním arbovirům vyskytujícím se na evropském kontinentu (Alphavirus Sindbis, Coltivirus Eyach). Cílem předkládané práce je podat ucelený, stručný přehled méně známých arbovirů vyskytujících se na území ČR s důrazem na jejich taxonomické zařazení, určení vektorů a hostitelů, a patogenitu pro člověka. Zmíněné arboviry mohou vyvolávat horečnaté stavy až aseptické (meningo)encefalitidy s tzv. nejasnou etiologií. Přehled zdůrazňuje problém možné emergence těchto opomíjených arbovirů v blízké budoucnosti, a uvádí diagnostické postupy.
Klíčová slova:
arboviry – klíšťata – komáři – emergentní nákazy – surveillance.Motto: V tomto roce si připomínáme 50. výročí události, kdy dva naši badatelé, Vojtech Bárdoš a Vlasta Danielová, izolovali na východním Slovensku první evropský arbovirus přenášený komáry a nazvali jej podle místa objevu Ťahyňa. Tento přehled je věnován nejen jim, ale i mnoha dalším vědcům, kteří se zasloužili o rozkvět české a slovenské arbovirologie v evropském a snad i ve světovém měřítku.
Úvod
Virové nákazy přenášené hematofágními členovci (arbovirózy) patří mezi nejdůležitější emergentní infekční nemoci, kterým čelí lidstvo na začátku třetího tisíciletí, a stávají se (vedle malárie, malnutrice a helmintóz) největším zdravotnickým problémem zejména v zemích třetího světa [23]. Celosvětově je podle International Catalogue of Arboviruses registrováno téměř 500 arbovirů [48]: pomineme-li duplikátní viry a nearboviry typu hantavirů, v katalogu rovněž zařazené. Arboviry nejsou taxonomickou, ale ekologickou skupinou a její příslušníci náležejí do 7 čeledí: Bunyaviridae (51% arbovirů), Reoviridae (14%), Flaviviridae (12%), Rhabdoviridae (10%), Togaviridae (8%), Orthomyxoviridae (<1%) a Poxviridae (<1%) [37]. Asi u 134 arbovirů byla prokázána souvislost s lidským onemocněním [22], mnohé z nich jsou původci lokálních epidemií na všech kontinentech s výjimkou Antarktidy (Tabulka 1). V Evropě se v současnosti vyskytuje asi 50 arbovirů náležejících do 6 čeledí RNA virů, některé z nich však s efemérním výskytem (např. Flavivirus dengue, nebo veterinárně významné viry africké nemoci koní a africké horečky prasat), mnohé pak cirkulují v pobřežních ekosystémech mezi mořským ptactvem (např. Flavivirus Tyuleniy, Uukuvirus Zaliv Terpenija a další). Mezi arboviry významné pro humánní medicínu vyskytující se v Evropě řadíme především tyto zástupce: Alphavirus Sindbis, flaviviry West Nile, dengue, louping ill, středoevropské klíšťové encefalitidy a ruské jaro-letní encefalitidy, bunyaviry Ťahyňa, Inkoo, Batai a Bhanja, fleboviry horeček papatači (Sandfly – Naples, Sandfly – Sicily) a Toscana, nairovirus krymsko-konžské hemoragické horečky, orbivirus Tribeč a také orthomyxoviry Dhori a Thogoto [29]. Pro úplnost je třeba zmínit, že veterinárně významnými arboviry jsou: West Nile, způsobující encefalomyelitidu u koní [75], louping ill, původce encefalitidy u ovcí [18], Bhanja, původce encefalitidy u ovcí [36], Thogoto, dále původce africké nemoci koní a africké horečky prasat, a v neposlední řadě Orbivirus bluetongue, způsobující vážné onemocnění ovcí i skotu – nyní v centru pozornosti epizootologů v důsledku lavinovitého šíření napříč evropským kontinentem; první onemocnění horečkou bluetongue bylo nedávno hlášeno i v západních Čechách [74].
Arboviry jsou přenášeny hematofágními členovci řádů roztoči (Acarina) a dvoukřídlí (Diptera) - nejčastěji však zástupci čeledí klíšťatovití (Ixodidae) a komárovití (Culicidae). V České republice se kromě viru středoevropské klíšťové encefalitidy vyskytuje dalších 7 arbovirů (Flavivirus West Nile, Bunyavirus Ťahyňa, Bunyavirus Sedlec, Bunyavirus Lednice, Bunyavirus Batai, Orbivirus Tribeč, Uukuvirus Uukuniemi), z nichž však onemocnění člověka prokazatelně způsobují pouze viry West Nile, Ťahyňa, Tribeč a pravděpodobně i Batai. Navíc byly u nás detegovány protilátky k dalším dvěma pro člověka patogenním arbovirům vyskytujícím se na evropském kontinentu (Alphavirus Sindbis a Coltivirus Eyach), aniž však tyto viry byly izolovány [37].
Jako základ pro tento přehled sloužily 3 anglicky psané práce [29, 64, 73], které jsme doplnili o nejnovější poznatky. V nich nalezne zvídavý čtenář mnohé další podrobnosti o pojednávaných „českých“ arbovirech. Pro přehlednost budou v textu arboviry rozděleny na agens přenosná klíšťaty a komáry. Virus středoevropské klíšťové encefalitidy není součástí tohoto přehledu.
Tab. 1. Přehled významných arbovirů včetně onemocnění, jež způsobují ve světě Table 1. Review of important arboviruses and diseases caused by these agents in the world 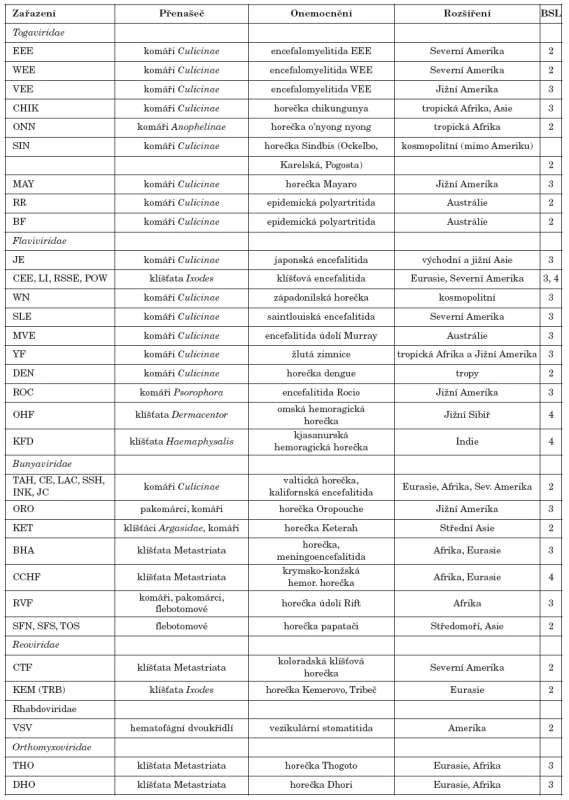
Vysvětlivky: BSL–úroveň zabezpečení laboratoře pro práci s patogenními mikroorganismy, EEE–východoamerická encefalomyelitida koní, WEE–západoamerická encefalomyelitida koní, VEE–venezuelská encefalomyelitida koní, CHIK–chikungunya, ONN–o’nyong nyong, SIN–Sindbis, MAY–Mayoro, RR–Ross River, BF–Barmah Forest, JE– japonská encefalitida, CEE–středoevropská klíšťová encefalitida, LI–louping ill, RSSE–ruská jaro-letní encefalitida, POW–Powassan, WN–West Nile, SLE– saintlouiská encefalitida, MVE–encefalitida údolí Murray, YF–žlutá zimnice, DEN–dengue, ROC–Roccio, OHF–omská hemoragická horečka, KFD–nemoc kjasanurského pralesa, TAH–Ťahyňa, CE–kalifornská encefalitida, LAC–LaCrosse, SSH – Snowshoe hare, INK–Inkoo, JC–Jamestown Canyon, ORO – Oropouche, KET–Keterah, BHA–Bhanja, CCHF–krymsko-konžská hemoragická horečka, RVF–horečka údolí Rift, SFN–Sandfly-Naples, SFS–Sandfly-Sicily, TOS–Toscana, CTF–koloradská klíšťová horečka, KEM (TRB)–Kemerovo, Tribeč, VSV–virus vezikulární stomatitidy, THO–Thogoto, DHO–Dhori Explanations: BSL-biosafety level for handling with pathogenic microorganisms, EEE–Eastern equine encephalomyelitis, WEE–Western equine encephalomyelitis, VEE–Venezuelan equine encephalomyelitis, CHIK–Chikungunya, ONN–O’nyong nyong, SIN–Sindbis, MAY–Mayoro, RR–Ross River, BF–Barmah Forest, JE– Japanese encephalitis, CEE–Central european encephalitis, LI–Louping ill, RSSE–Russian spring-summer encephalitis, POW–Powassan,WN–West Nile, SLE–St. Louis encephalitis, MVE–Murray Valley encephalitis, YF–yellow fever, DEN–dengue, ROC–Roccio, OHF–Omsk hemorrhagic fever, KFD–Kyasanur Forest disease, TAH–Ťahyňa, CE–California encephalitis, LAC–LaCrosse, SSH – Snowshoe hare, INK–Inkoo, JC–Jamestown Canyon, ORO – Oropouche, KET–Keterah, BHA–Bhanja, CCHF–Crimean-Congo hemorrhagic fever, RVF–Rift Valley fever, SFN–Sandfly-Naples, SFS–Sandfly-Sicily, TOS–Toscana, CTF–Colorado tick fever, KEM (TRB)–Kemerovo, Tribeč, VSV–Vesicular stomatitis virus, THO–Thogoto, DHO–Dhori Arboviry přenášené klíšťaty
Virus Eyach
Poprvé byl izolován z nenasátého klíštěte Ixodes ricinus poblíž obce Eyach u města Tűbingen v Německu v roce 1972 (prototypový kmen Eyach-38) [70]. Jde o segmentovaný dsRNA virus rodu Coltivirus čeledi Reoviridae patřící do antigenní skupiny viru koloradské klíšťové horečky [1]. Jeho přenašečem jsou klíštata Ixodes ricinus a I. ventalloi [43]. Hostiteli viru jsou pravděpodobně některé druhy hlodavců a zajíci [29].
Charakteristickým ekosystémem cirkulace viru jsou smíšené lesy. Virus je rozšířen v západní a střední Evropě (Francie, Německo); byl dokonce reizolován z klíšťat po 25 letech v Německu [25]. Protilátky k viru byly nalezeny i u pacientů s encefalitidou a polyradikulineuritidou v Čechách. Arbovirus Eyach je pravděpodobně původcem některých neuropatií a meningoencefalitid s tzv. nejasnou etiologií [65]. Průkaz možné příčinné souvislosti s lidským onemocněním v ČR by však vyžadoval další výzkum. Dosud se nepodařilo kultivovat virus na savčích buněčných liniích (izolace viru se daří jen při intracerebrální inokulaci sajících myší) a to ztěžuje jeho diagnostiku pomocí neutralizačního nebo komplement fixačního testu [42]. Taxonomicky velmi blízký až identický virus koloradské klíšťové horečky způsobuje v USA horečnaté onemocnění s bolestmi hlavy, svalů, fotofobií, nauzeou, celkovou slabostí a někdy i vyrážkou a je přenášen klíštětem Dermacentor andersoni. Podle domněnky jednoho z autorů (Z.H.) mohl být tento virus importován ze Severní Ameriky s armádními psy a klíšťaty je parazitujícími na vojenskou základnu USA v Německu.
Virus Tribeč
Virus byl poprvé izolován z klíštěte I. ricinus současně ve třech regionech Slovenska (Malé Karpaty, Tribeč, Slovenský kras) v roce 1963 (prototypový kmen: Tribeč, západní Slovensko, 1963; topotypový kmen: LIP-91 Lipovník, východní Slovensko, 1963) [20, 59]. Jde o dsRNA segmentovaný virus náležející do rodu Orbivirus čeledi Reoviridae antigenní skupiny Kemerovo [1]. V Česku byl virus izolován na severní Moravě pod odlišným názvem Cvilín [57]. Principiálním přenašečem je klíště I. ricinus, méně často Haemaphysalis punctata. Hostiteli jsou hlodavci (Myodes glareolus, Microtus subterraneus), zajíci [15], koza a ptáci (Sturnus vulgaris, Fringilla coelebs). Protilátky k viru byly v endemických oblastech nalezeny u pasených přežvýkavců. Typickým biotopem jsou boskematické (pastorální) a teriodické (lesní se zvěří) ekosystémy. Geografické rozšíření viru pokrývá střední, východní, jižní i severní Evropu včetně Ruska, mimo Evropu se virus vyskytuje také v Ázerbajdžánu. Stěhovaví ptáci mohou hrát významnou roli v šíření virů skupiny Kemerovo na velké vzdálenosti [29]. Virus Tribeč způsobuje horečnaté onemocnění [19], někdy s aseptickou meningitidou, sérokonverze byla prokázána u pacientů v Čechách [17, 65] i na Moravě [32], kde byla navíc zjištěna akutní nákaza virem Tribeč u 14 osob na Znojemsku: převažující klinickou manifestací byla serózní meningitida. Na východní Moravě byly zjištěny protilátky k viru Tribeč u 16 % pacientů s diagnózou meningoencefalitidy [58]. Navíc při experimentální inokulaci opic Macaca mulatta virem Tribeč se u nich po 11 dnech vyvinula lymfocytární meningitida [60]. U arboviru Tribeč platí podobný závěr jako u viru Eyach: žádoucí by byl další výzkum, např. studium sérokonverze k viru Tribeč u pacientů s výskytem aseptické meningitidy s nejasnou etiologií.
Virus Uukuniemi
Poprvé byl tento virus izolován z klíštěte I. ricinus sbíraného z paseného dobytka u obce Uukuniemi (jihovýchodní Finsko) v roce 1959 (prototypový kmen: S-23; topotypový kmen: Poteplí PO-63, I. ricinus, Čechy 1963) [48, 51]. Jde o RNA virus rodu Uukuvirus čeledi Bunyaviridae náležející do antigenní skupiny Uukuniemi [47]. Hlavním přenašečem jsou klíšťata I. ricinus, méně pak I. persulcatus. Možným mechanickým vektorem jsou také komáři čeledi Culicidae (Aedes vexans, Ochlerotatus. punctor, Oc. communis a další). Hostiteli jsou lesní hlodavci (Myodes glareolus, Apodemus flavicolis), ještěrky a ptáci (Turdus merula, Erithacus rubecula, Sylvia communis), kteří mohou hrát významnou roli v zánosu viru na velké vzdálenosti [29, 64].
Typickým ekosystémem viru Uukuniemi jsou lesní biotopy, nelze ovšem vyloučit ani urbánní ohniska [63]. Virus je rozšířen především v severní, střední a východní Evropě, mimo Evropu v Ázerbajdžánu a asijské části Ruska [29]. Infekce zapříčiněné virem Uukuniemi manifestující se klinicky nejsou známé [19, 64], s výjimkou ojedinělých případů hlášených z jižního Ruska, kde virus údajně způsobil horečnaté onemocnění s náhlým nástupem horečky, bolestmi hlavy, svalů, kloubů, hyperémií v obličeji a někdy s vyrážkou po celém těle [10]. Toto sdělení vyžaduje ovšem verifikaci, neboť klinické příznaky ukazují spíše na infekci virem Sindbis nebo West Nile. V České republice byl virus Uukuniemi opakovaně izolován z klíšťat I. ricinus, avšak protilátky k viru byly u lidí detegovány jen výjimečně nebo vůbec ne [32, 38, 50].
Arboviry přenášené komáry
Virus Sindbis
Poprvé byl izolován ze směsi komárů Culex pipiens a Cx. univittatus ve vesnici Sindbis v deltě řeky Nilu v roce 1952 (prototypový kmen: EgAr-399) [82], v Evropě poprvé z mozku rákosníka obecného (Acrocephalus scirpaceus) u Malacek v roce 1971 (topotypový kmen: R-33) [16]. Nejvíce studií týkajících se viru Sindbis bylo uskutečněno ve Skandinávii, kde se vyskytuje epidemicky a periodicky od roku 1974. Virus Sindbis patří do antigenní skupiny západní koňské encefalomyelitidy rodu Alphavirus čeledi Togaviridae [79]. Je přenášen převážně ornitofilními komáry Cx. univittatus, Cx. pipiens, Cx. modestus [29]; vzácně byly zaznamenány izolace z klíšťat rodu Hyalomma [21]. Typickým stanovištěm jsou mokřady, kde se uskutečňuje enzootický cyklus mezi komáry a ptáky. Přirozeným hostitelem viru jsou převážně ptáci (Corvus corone, Motacilla alba, A. scirpaceus a další), méně často hlodavci, netopýři, žáby [29]. Stěhovaví ptáci mohou hrát významnou roli v přenosu viru Sindbis na velké vzdálenosti (fylogenetické studie naznačují zános viru z místa původního výskytu v Africe do Skandinávie). Virus byl izolován v Africe i Evropě (Itálie, Slovensko, Maďarsko, nejvíce však Finsko, Švédsko a ruská Karélie), dále v Asii i Austrálii. Protilátky k viru byly detegovány i v Česku u ptáků [46] a také ojediněle u lidí, aniž byl virus zachycen [41]. Je původcem horečky Sindbis – s bolestmi hlavy, myalgií, artralgií, polyartritidou, únavou, konjunktivitidou, faryngitidou, svěděním a vyrážkou [53]. Jsou zaznamenány i trvalé následky spojené s postižením kloubů po infekci tímto virem [54]. Od roku 1974 se opakují epidemie ve Finsku s periodicitou 7 let (1974, 1981, 1988, 1995, 2002) [55]. To pravděpodobně souvisí s 6-7letým populačním cyklem tetřívků, kteří jsou společně s některými pěvci považováni za hostitele amplifikátory [9]. Podle místa výskytu se onemocnění liší svým názvem – ‘Ockelbo’ ve Švédsku, ‘Pogosta’ ve Finsku a karelská horečka v severozápadním Rusku [47]. Rozšíření viru v České republice je možné při zánosu agens infikovanými stěhovavými ptáky a etablováním viru v místní komáří populaci, pravděpodobně podobným způsobem jako u virového kmene Rabensburg (třetí genomické linie viru West Nile), který byl izolován opakovaně z komárů Cx. pipiens v letech 1997 a 1999 na jižní Moravě [30, 39].
Virus West Nile
Poprvé byl tento virus izolován z krve nemocné ženy v ugandské provincii West Nile v roce 1937 (prototypový kmen: B-956), později také v Egyptě z dítěte (neotypový kmen: Eg-101) [67, 78]. V Evropě byl poprvé izolován z klíštěte Hyalomma marginatum v jižním Rusku, ale také z komárů a pacientů při epidemii západonilské horečky v jihofrancouzském Camargue v roce 1964 [29]. Virus West Nile patří do antigenní skupiny japonské encefalitidy čeledi Flaviviridae a dělí se do několika genomických linií: linie 1 zahrnuje kmeny ze Severní Ameriky, Evropy, Afriky, Asie a Austrálie (subtyp Kunjin), zatímco linii 2 tvoří kmeny původem ze subsaharské Afriky a Madagaskaru [26], linii 3 tvoří Rabensburg [2]. V současnosti se však uvažuje ještě o dalších dvou liniích (Indie, Jižní Rusko) [8]. Jeho přenašečem jsou zejména ornitofilní komáři rodu Culex (např. Cx. pipiens, Cx. univittatus, Cx. modestus), méně často Oc. cantans nebo Anopheles maculipennis. Výjimečně mohou virus přenášet také některá klíšťata rodu Hyalomma nebo klíšťáci rodů Ornithodoros a Argas, kteří slouží jako alternativní vektor viru především v suchých a teplých oblastech [29]. Hostitelem viru jsou vodní i terestričtí ptáci, hlodavci, člověk, netopýři, velbloudi, koně, ovce, vlci, obojživelníci, aligátoři a hadi [29, 83]. Cirkulace viru v Evropě je charakterizována dvěma cykly a ekosystémy: exoantropním (sylvatickým) zahrnujícím převážně vodní a mokřadní ptáky jako hostitele a amplifikátory viru a ornitofilní komáry (Cx. pipiens pipiens, Cx. modestus, Coquillettidia richiardii) jako vektory, a synantropní (urbánní) cyklus zahrnující synantropní ptáky jako hostitele a komáry sající na ptácích i savcích jako vektory (Cx. pipens molestus) [28, 34]. Virus způsobuje západonilskou horečku, mezi jejíž hlavní příznaky patří dále bolesti hlavy, zad a kloubů, laryngitida, myalgie, konjunktivitida, nitrooční tlak, nechutenství, nevolnost, zvracení, nespavost, makulopapulární vyrážka, lymfadenopatie, někdy však s výskytem hepatitidy, pankreatitidy, myokarditidy, meningitidy nebo encefalitidy [34]. Až 80 % lidských infekcí probíhá asymptomaticky. Letalita onemocnění se pohybuje kolem 5-10 % a ohrožuje zejména pacienty starší 60 let [27]. West Nile virus je typickou reemergentní nákazou, na konci 20. století byly zaznamenány lokální epidemie nebo případy západonilské horečky v Alžírsku (1994), Maroku (1996), Tunisku (1997 a 2003), Rumunsku (1996-2000), České republice (1997), Izraeli (1999-2000), Rusku (1999-2001), Francii (2003) a rozsáhlá epidemie ve Spojených státech (1999-2004) [27]. Na jižní Moravě bylo po povodních v roce 1997 dokumentováno pět případů klinického onemocnění tímto virem [39].
Virus Ťahyňa
Virus byl poprvé izolován ze směsi komárů Ae. vexans a Oc. caspius z obcí Ťahyňa a Križany na východním Slovensku v roce 1958. Šlo o první arbovirus teplokrevných obratlovců izolovaný v Evropě (prototypový kmen: Ť-92) [5]. Jedná se o Orthobunyavirus kalifornské antigenní skupiny z čeledi Bunyaviridae. Přenašečem viru jsou komáři Ae. vexans: prokázán dokonce transovariální přenos [13], dále Oc. caspius, Ae. cinereus, Oc. cantans, Oc. communis a další [29, 73]. Hostitelem viru je především zajíc (Lepus europaeus), králík, hlodavci, netopýři, ježek, sysel, Oc., ondatra, veverka, kuna, tchoř, liška, jezevec, netopýři, protilátky k viru byly detegovány u šelem, koní, skotu, prasat, a mokřadních druhů ptáků.
Preferovaným místem výskytu je záplavový ekosystém v inundačních oblastech řek včetně urbánních ekosystémů [19, 73].
Nemoc způsobená virem Ťahyňa se nazývá valtická horečka. Jde o chřipkovité onemocnění vyskytující se v letních a časně podzimních měsících převážně u dětí. Mezi příznaky patří náhlý nástup horečky, bolesti hlavy a končetin, únava, konjunktivitida, faryngitida, myalgie, nauzea, střevní potíže, anorexie, artralgie, meningitida, vzácněji bronchopneumonie [29]. Podobné onemocnění vyskytující se v Severní Americe a pojmenované kalifornská encefalitida nebo encefalitida LaCrosse má za následek i letalitu a s vysokou prevalencí se objevuje hlavně u dětí [24]. V České republice byla cirkulace viru Ťahyňa v přírodním ohnisku intenzívně zkoumána především v minulých desetiletích [64, 73]. Protilátky k viru byly prokázány u většiny dospělé populace v endemických oblastech, především na jižní Moravě [31], ale i jinde – např. ve středních Čechách [41, 49] v záplavových oblastech velkých řek, kde dochází k pravidelnému přemnožení lokální komáří populace. Virus byl opakovaně izolován z krve febrilních dětí [6] i dospělých [80]. Desítky kmenů viru byly izolovány také z komárů při monitorování aktivity ohniska v posledních desetiletích [39]. Při přemnožení komáří populace, převážně po povodních nebo při umělén jarním povodňování lužních lesů, stoupá i riziko nákazy valtickou horečkou. Určité procento febrilních stavů dětí v letních měsících, stejně tak dospělých, kteří se s infekcí dosud nesetkali, může být způsobeno valtickou horečkou, avšak onemocnění běžně uniká pozornosti infektologů i epidemiologů.
Virus Batai (Čalovo)
Poprvé byl izolován z komára Cx. gelidus na pastvinách v oblasti Kuala Lumpur v Malajsii v roce 1955 (prototypový kmen: AMM-2222) [48], v Evropě byl antigenně identický kmen ‘Čalovo’ izolován z komára An. maculipennis sensu lato u obce Trstená blízko Čalova na jižním Slovensku v roce 1960 (evropský topotypový kmen: Čalovo-184) [4]. Virus je přenášen převážně zoofilními komáry An. maculipennis [77], dále An. claviger, Oc. punctor, Oc. communis, Ae. vexans. Cirkuluje v agroekosystémech převážně v enzootickém cyklu mezi zoofilními komáry a domácími přežvýkavci. Hostitelem viru jsou prase domácí a ptáci (Corvus corone, Fulica atra, Perdix perdix) [29].
Virus Batai způsobuje u člověka horečnaté onemocnění provázené únavou, myalgií a anorexií [7, 29, 76]. Horečnaté onemocnění způsobené virem Batai bylo pozorováno u pacientů v Thajsku, virus byl izolován z febrilní krve pacientů v Súdánu [29]. Protilátky k viru Batai u lidí byly detegovány jak v Čechách [41], tak i na Moravě u pacientů s horečnatým onemocněním [32]. Pro studium epidemiologie viru Batai v České republice by byl žádoucí také veterinární monitoring domácích přežvýkavců společně se sérologickými přehledy lidské populace na specifické protilátky včetně monitoringu lokální komáří populace (především anofelů).
Další arboviry s možným výskytem na našem území
Existuje několik dalších arbovirů, které by se mohly potenciálně vyskytovat nebo v budoucnu rozšířit na naše území. Jedná se o Bunyavirus Inkoo z čeledi Bunyaviridae, který je přenášen komáry Ae. communis a způsobuje chřipkovité onemocnění, někdy až aseptickou meningitidu, faryngitidu, konjunktivitidu, závrať, a někdy i vyrážku [69]. Virus byl dosud izolován převážně na severu Evropy [47]. Samostatnou kapitolou je emergence Flaviviru Usutu (původně arbovirus endemický na africkém kontinentu) v Rakousku v letech 2001-2002, který zapříčinil masivní hynutí některých pěvců, zejména kosů (Turdus merula) v dolním Rakousku a protilátky k viru jsou v populaci přítomny dosud, i když ptáci jsou na virus pravděpodobně již adaptováni [66, 85]. Virus byl také později prokázán u kosů v okolí Budapešti v Maďarsku [3] a protilátky byly nalezeny dokonce u racka chechtavého (Larus ridibundus) v Polsku [40]. Patogenita viru pro člověka je sporná, i když 52 pacientů s horečnatým onemocněním v endemické oblasti výskytu viru vykazovalo protilátky v hemaglutinačně inhibičních titrech 1 : 20 až >1 : 160 a v jednom případě byla dokonce detegována nukleová kyselina viru pomocí RT-PCR [84].
Diagnostické postupy při průkazu arbovirů
Diagnostika arboviróz spočívá převážně v sérologii, optimálně ve vyšetření párových vzorků krevního séra, odebraných s odstupem 2-3 týdnů; za průkaz recentní infekce se považuje sérokonverze nebo minimálně čtyřnásobný vzestup titru protilátek mezi prvním a druhým vzorkem v enzymové imunoanalýze, hemaglutinačně inhibičním testu, komplement fixační reakci, virus neutralizačním testu, nepřímé imunofluorescenci či jiných testech [11, 33, 34, 44, 45, 56, 62]. Je-li k dispozici jediný vzorek rekonvalescentního séra pacienta, pomůže mnohdy k odlišení paralelní vyšetření na protilátky IgG a IgM – u recentních infekcí převažují IgM nad IgG. U flavivirů je nutná obezřetnost při interpretaci výsledků testů v důsledku možné zkřížené reaktivity sér. Velmi průkazná, avšak obtížná, je izolace viru z krve, séra, likvoru nebo bioptických vzorků pacienta metodou inokulace sajících myší, buněčných kultur (nejčastěji VERO, XTC-2, SPEV, BHK-21, CV-1, GMK) nebo kuřecích embryí, a také molekulární detekce viru v krvi, CNS a tkáních pacienta [29, 37, 45, 72]. Možnost záchytu (detekce) viru v krvi je totiž nadějná jen v prvních dnech akutní fáze. V poslední době jsou do virologické diagnostiky intenzivně zaváděny molekulárně biologické techniky (PCR, RT-PCR, nested RT-PCR, reverse-line blotting, real-time PCR, sekvencování, a další, které jsou využitelné pro detekci a typizaci většiny známých patogenů [37, 52]. Především detekce virové RNA v reálném čase spolu s kvantifikací nukleové kyseliny nahrazuje dnes již klasické molekulární metody díky vyšší specificitě i citlivosti, která je při diagnostice arbovirů rozhodující [61]. Pro detekci viru ve tkáních obratlovců se také využívá vysoce specifických imunohistochemických metod [44].
Terapie a prevence arboviróz
Specifická terapie arboviróz neexistuje, doporučuje se symptomatická léčba, klid na lůžku, příjem tekutin, podávání antipyretik; v kritických případech někdy pomáhá antisérum (specifický imunoglobulin), pokud je podáno bezprostředně po infekci. U některých virových nákaz však mohou být relativně účinná analoga nukleotidů, např. ribavirin u RNA virů. Jediným efektivním specifickým opatřením proti virózám je však očkování, u zoonotických nákaz přenášených hematofágními členovci bohužel omezené jen na nevelký počet virových infekcí (tj. pokud existuje vakcína: klíšťová encefalitida, žlutá zimnice, japonská encefalitida, západní koňská encefalomyelitida, východní koňská encefalomyelitida, venezuelská koňská encefalomyelitida, horečka údolí Rift). U virů pokrytých tímto přehledem bohužel žádná vakcína neexistuje.
Při pobytu v přírodním ohnisku nákazy je vhodným preventivním opatřením použití repelentů (na oděv i pokožku) proti vektorům, a účinnou prevencí je samozřejmě také vyhýbání se kontaktu s vektory (např. v případě komárů sítě v oknech, moskytiéry nad lůžkem atp.) [37].
Surveillance arbovirálních infekcí přenášených hematofágními členovci v České republice
Povodně v roce 1997 na Moravě [31] a v roce 2002 v Čechách [41] nám nastavily zrcadlo v problematice monitorování přírodních ohnisek nákaz. V roce 1997 byly zjištěny protilátky proti viru Ťahyňa u 53,8 % sér z počtu 619 vyšetřovaných osob z oblasti Břeclavska a byla zaznamenána jedna subklinická infekce valtickou horečkou. Dále bylo dokumentováno pět případů onemocnění kompatibilních se západonilskou horečkou včetně dvou dětí (byla zaznamenána sérokonverze mezi časným a rekonvalescentním sérem) s horečkou, vyrážkou a encefalitidou a to poprvé ve střední Evropě [31]. Při pozdějších povodních v Čechách roku 2002 bylo v Polabí v širším okolí Mělníka vyšetřeno 497 obyvatel na komáry přenosné nákazy: séroprevalence k viru Ťahyňa u místní vyšetřované populace dosahovala až 14 % (a byla prokázána i 1 sérokonverze), dále byly nalezeny v omezené míře protilátky k viru Sindbis (1%) a Batai (0,2%) [41].
Nesmí se ovšem opomenout ani monitorování importovaných případů arboviróz především u turistů vracejících se z endemických oblastí výskytu exotických virů. Za zmínku stojí např. první import západonilské horečky z USA do ČR v období její epidemie na severoamerickém kontinentu [35] nebo importovaná infekce horečky chikungunya u turistky vracející se z dovolené na ostrově Mauritius v Indickém oceánu, kde právě probíhala rozsáhlá epidemie tohoto horečnatého onemocnění [86].
Mezi metody surveillance řadíme především periodické vyšetřování vektorů v endemické oblasti výskytu viru (s jejich následným hubením v případě přemnožení), sérologické přehledy hostitelů (hlodavci, volně žijící zvěř, stálí i stěhovaví ptáci), monitoring domácích sentinelů (slepic a kachen) na specifickou sérokonverzi, vyšetřování lokální lidské populace na protilátky k virům přenosným hematofágními členovci (zvláštní pozornost by měla být soustředěna při zjišťování etiologie letních chřipkovitých stavů, spalničkového exantému, aseptických meningitid nebo meningoencefalitid nejasného původu) a důsledný monitoring importovaných nákaz [14]. Při šetření v přírodním ohnisku nákazy v epidemickém období je pak více než žádoucí spolupráce širokého týmu odborníků z řad epidemiologů, medicínských akaroentomologů, zoologů, veterinářů, terénních i klinických mikrobiologů a infektologů [34, 37].
Perspektivy výzkumu arbovirů u nás
Nové studie přinášejí nejen zprávy o rozšíření některých arbovirů a jejich příbuzných do míst, o nichž se dosud nevědělo, ale ukazují, že je nutno počítat i se vznikem kombinací virů s novými vlastnostmi, které mohou kdykoli přinést velká překvapení. Viry, které jsou dnes málo významné, se mohou stát velkými patogeny, mohou měnit svá působiště, hostitele i přenašeče. Je na místě skromnost a smíření se s tím, že všechny vědecké poznatky mohou platit jen dočasně, protože příroda a přírodní ohniska se vyvíjejí a mění dál, i když velmi pomalu [12]. Tato slova významného českého virologa nelze jistě brát na lehkou váhu a lze si jen přát, aby se komplexní výzkum arbovirů a onemocnění, jež přenášejí, nadále rozvíjel. Výzkum ekologie arbovirů u nás má jistě na co navazovat. Studium jejich biologie a ekologie, které intenzivně probíhalo v 50. až 80. letech 20. století v bývalém Československu, posunulo tuto vědní disciplínu významně vpřed. Mnozí čeští a slovenští virologové (abecedně: Vojtech Bárdoš, Rudolf Benda, Dionýz Blaškovič, Luděk Daneš, Vlasta Danielová, Elo Ernek, Milota Grešíková, Jaroslava Holubová, Jiří Januška, Jan Mária Kolman, Otto Kožuch, Milan Labuda, Helena Libíková, Doubravka Málková, Josef Nosek, a mnozí další) patří k průkopníkům arbovirologie jak v evropském, tak i světovém měřítku, a některé jejich práce jsou stále pro svou platnost hojně citovány.
V budoucnu nás jistě čekají nové hrozby, kterým budeme muset čelit a na které bychom měli být připraveni (import exotických arbovirů z tropických oblastí v důsledku migrace obyvatel a zvířat [81], posun vektorů do vyšších zeměpisných šířek v důsledku změn klimatu). Evropská unie si uvědomuje tato reálná rizika, a proto posílila svoji podporu financováním projektů 6. a 7. rámcového programu se zaměřením na reemergentní nákazy včetně přenášených hematofágními členovci. Historie nedávných epidemií západonilské horečky v Americe [68] a horečky chikungunya na ostrovech Indického oceánu (Mauritius, Seychelly, Mayotte a Reunion) včetně první evropské autochtonní epidemie horečky chikungunya v Itálii v okolí Ravenny (asi 200 laboratorně potvrzených případů) [71] budiž nám varováním, že boj s arboviry zdaleka nekončí.
Poděkování.
Autoři děkují za podporu Grantové agentuře Akademie věd České republiky za financování projektů IAA600930611 a KJB600930613 zabývajících se výzkumem ekologie a diverzity mikroorganismů přenášených hematofágními členovci v České republice.
Do redakce došlo 23. 4. 2008
Mgr. Ivo Rudolf, Ph.D.
Klášterní 212
691 42 Valtice
e-mail: rudolf@ivb.cz
Zdroje
1. Attoui, H., Jaafar, F. M., Biagini, P., Cantaloube, J. F. et al. Genus Coltivirus (family Reoviridae): genomic and morphological characterization of Old World and New World viruses. Arch Virol, 2002, 147, 533-561.
2. Bakonyi, T., Hubálek, Z., Rudolf, I., Nowotny, N. Novel flavivirus or new lineage of West Nile virus, Central Europe. Emerg Infect Dis, 2005, 11, 225-231.
3. Bakonyi, T., Erdelyi, K., Ursu, K., Ferenczi E. et al. Emergence of Usutu virus in Hungary. J Clin Microbiol, 2007, 45, 3870-3874.
4. Bárdoš, V., Čupková, E. The Čalovo virus - the second virus isolated from mosquitoes in Czechoslovakia. J Hyg Epid, 1962, 6, 186-192.
5. Bárdoš, V., Danielová, V. The Ťahyňa virus – the virus isolated from mosquitoes in Czechoslovakia. J Hyg Epidem, 1959, 3, 264-276.
6. Bárdoš, V., Medek, M., Kania, V., Hubálek, Z. Isolation of Ťahyňa virus from the blood of sick children. Acta Virol, 1975, 19, 447.
7. Bárdoš, V., Sluka, F., Čupková, E. Serological study on the medical importance of Čalovo virus. In Bárdoš, V. et al. Arboviruses of the California complex and the Bunyamwera group. Bratislava: Publ House Slov Acad Sci, 1969. 333-335.
8. Bondre, V. P., Jadi, R. S., Mishra, A. C., Yergolkar, P. N. et al. West Nile isolates from India: evidence for a distinct genetic lineage. J Gen Virol, 2007, 88, 875-884.
9. Brummer-Konverkontio, M., Vapalahti, O., Kuusisto, P., Saikku, P. et al. Epidemiology of Sindbis virus infections in Finland 1981-96: possible factors explaining a peculiar disease pattern. Epidem Infect, 2002, 129, 335-345.
10. Butenko, A. M., Rubakhova, Yu. V., Lavrova, N. A., Khutoretskaya, N. V. et al. Uukuniemi fever: first diagnosed cases of human infections. Arbovirus Inf Exch, 1995, June, 49.
11. Clarke, D. H., Casals, J. Techniques for hemagglutination and hemagglutination-inhibition test with arthropod-borne viruses. Am J Trop Med Hyg, 1958, 7, 561-573.
12. Daneš, L. Přírodně ohniskové nákazy. Praha: Karolinum, 2003. 168 s.
13. Danielová, V., Ryba, J. Laboratory demonstration of transovarial transmission of Ťahyňa virus in Aedes vexans and role of this mechanism in overwintering of this arbovirus. Folia parasitol., 1979, 26, 361-368.
14. Dlhý, J., Beneš, Č. Notifikované importované přenosné nákazy v České republice. Epidemiol Mikrobiol Imunol, 2007, 56, 23-32.
15. Dobler, G., Wölfel, R., Schműser, H., Essbauer, S. et al. Seroprevalence of tick-borne and mosquito-borne arboviruses in European brown hares in Northern and Western Germany. Int J Med Microbiol, 2006, 296, 80-83.
16. Ernek, E., Kožuch, O., Grešíková, M., Nosek, J. et al. Isolation of Sindbis virus from the reed warbler (Acrocephalus scirpaceus) in Slovakia. Acta Virol, 1973, 17, 359-361.
17. Fraňková, V. Meningoencephalitis caused by orbivirus infections in Czechoslovakia. Sbor Lék Čes, 1981, 83, 234-235.
18. Gould, E. A., Higgs, S., Buckley, A., Gritsun, T. S. Potential arbovirus emergence and implications for the United Kingdom. Emerg Infect Dis, 2006, 12, 549-555.
19. Grešíková, M., Nosek, J. Arbovírusy v Československu. Bratislava: Vydav. SAV. 1981. 140 s.
20. Grešíková, M., Kožuch, O., Ernek, E., Nosek, J. “Tribeč“ – a newly isolated virus from ticks Ixodes ricinus and small rodents. In Rosický, B., Heyberger, K. Theoretical Questions of Natural Foci of Diseases. Prague: Publ House Czech Acad Sci, 1965. 439-440.
21. Grešíková, M., Sekeyová, M., Tempera, G., Guglielmino, S. et al. Identification of a Sindbis virus strain isolated from Hyalomma marginatum ticks in Sicily. Acta Virol, 1978, 22, 213-232.
22. Gubler, D. J. Human arbovirus infections worldwide. West Nile virus: detection, surveillance, and control. Annals N. Y. Acad Sci, 2001, 951, 13-24.
23. Gubler, D. J. The global emergence/resurgence of arboviral diseases as public health problems. Arch Med Res, 2002, 33, 330-342.
24. Hardin, S. G., Erwin, P. C., Patterson, L., New, D. et al. Clinical comparisons of LaCrosse encephalitis and enteroviral central nervous infections in a pediatric population: 2001 surveillance in East Tennessee. Am J Infect Contr, 2003, 31, 508-510.
25. Hassler, D., Oehme, R., Kimmig, P., Dobler, G. Eyach virus: first detection from ticks after more than 25 years in south-western Germany. Dtsch Med Wochenschr, 2003, 128, 1874.
26. Hayes, E. B., Komar, N., Nasci, R. S., Montgomery S. P. et al. Epidemiology and transmission dynamics of West Nile virus disease. Emerg Infect Dis, 2005, 11, 1167-1173.
27. Hayes, E. B., Sejvar, J. J., Zaki, S. R., Lanciotti R. S. et al. Virology, pathology, and clinical manifestations of West Nile virus disease. Emerg Infect Dis, 2005, 11, 1174-1179.
28. Hubálek, Z. European experience with the West Nile virus ecology and epidemiology: could it be relevant for the New World? Viral Immunol, 2000, 13, 415-426.
29. Hubálek, Z., Halouzka, J. Arthropod-borne viruses of vertebrates in Europe. Acta Sci Nat Brno, 1996, 30, 4-5, 1-95.
30. Hubálek, Z., Halouzka, J., Juřicová, Z. West Nile fever in Czechland. Emerg Infect Dis, 1999, 5, 594-595.
31. Hubálek, Z., Halouzka, J., Juřicová, Z., Příkazský, Z. et al. Surveillance virů přenosných komáry na Břeclavsku v povodňovém roce 1997. Epidemiol Mikrobiol Imunol, 1999, 48, 91-96.
32. Hubálek, Z., Havelka, I., Bárdoš, V., Halouzka, J. et al. Arbovirové infekce na Znojemsku. Českosl Epidem Mikrobiol Imunol, 1987, 36, 337-344.
33. Hubálek, Z., Chanas, A. C., Johnson, B. K., Simpson, D. I. Cross-neutralization study of seven California group (Bunyaviridae) strains in homoiothermous (PS) and poikilothermous (XTC-2) vertebrate cells. J Gen Virol, 1979, 42, 357-62.
34. Hubálek, Z., Kříž, J. Západonilská horečka. Klin Mikrob Inf Lék, 2003, 2, 59-67.
35. Hubálek, Z., Lukáčová, L., Halouzka, J., Širůček, P. et al. Import of West Nile virus infection in the Czech Republic. Eur J Epidem, 2006, 21, 323-324.
36. Hubálek, Z., Mittermayer, T., Halouzka, J., Černý, V. Isolation of exotic Bhanja virus (Bunyaviridae) from ticks in the temperate zone. Arch Virol, 1988, 101, 191-197.
37. Hubálek, Z., Rudolf, I. Mikrobiální zoonózy a sapronózy. 2. vyd. Učební text. Brno: Masarykova univerzita, 2007, 176 s.
38. Hubálek, Z., Ryba, J., Bárdoš, V., Juřicová, Z. Izolace virů klíšťové encefalitidy a Uukuniemi z klíšťat v oblasti Vranovské přehrady. Českosl Epidem Mikrobiol Imunol, 1978, 27, 321-326.
39. Hubálek, Z., Savage, H. M., Halouzka, J., Juřicová, Z. et al. West Nile virus investigations in South Moravia, Czechland. Viral Immunol, 2000, 13, 427-433.
40. Hubálek, Z., Wegner, E., Halouzka, J., Tryjanowski, P. et al. Serologic survey of potential vertebrate hosts for West Nile virus in Poland. Viral Immunol, 2008, 21, 2.
41. Hubálek, Z., Zeman, P., Halouzka, J., Juřicová, Z. et al. Mosquitoborne viruses, Czech Republic, 2002. Emerg Infect Dis, 2005, 11, 116-118.
42. Charrel, R. N., Attoui, H., Butenko, A. M., Clegg, J. C. et al. Tick-borne virus diseases of human interest in Europe. Clin Microbiol Infect, 2004, 10, 1040-1055.
43. Chastel, C., Main, A. J., Couatarmanach, A., Le Lay, G. et al. Isolation of Eyach virus (Reoviridae, Colorado tick fever group) from I. ricinus and I. ventalloi ticks in France. Arch Virol, 1984, 82, 161-171.
44. Chvala, S., Bakonyi, T., Hackl, R., Hess, M. et al. Limited pathogenicity of Usutu virus for the domestic chicken. Avian Pathol, 2005, 34, 392-395.
45. Januška, J., Daneš, L., Heinz, F. Laboratorní vyšetřovací metody arbovirových nákaz a nákaz šířených hlodavci. Praha: Avicenum, 1990. 143 s.
46. Juřicová, Z., Literák, I., Pinowski, J. Antibodies to arboviruses in house sparrows (Passer domesticus) in the Czech Republic. Acta Vet Brno, 2000, 69, 213-215.
47. Kallio-Kokko, H., Uzcategui, N., Vapalahti, O., Vaheri, A. Viral zoonoses in Europe. FEMS Microbiol Rev, 2005, 29, 1051-1077.
48. Karabatsos, N. (ed.) International catalogue of arthropod-borne viruses, including certain other viruses of vertebrates. 1985-95. 3rd edition. USA: Am Soc Trop Med Hyg San Antonio, 1985.
49. Kolman, J. M., Kopecký, K., Minář, J., Hausenblasová, M. Výskyt protilátek proti virům Ťahyňa, Čalovo a klíšťové encefalitidy u obyvatelstva na území Čech. I. Polabí. Českosl Epidem Mikrobiol Imunol, 1972, 21, 79-85.
50. Kolman, J. M., Kopecký, K., Wokounová, D. Sérologické vyšetření obyvatelstva z endemické oblasti výskytu viru klíšťové encefalitidy a viru Uukuniemi. Českosl Epidem Imunol, 1973, 22, 153-159.
51. Kolman, J. M., Málková, D., Smetana, K. Isolation of a presumably new virus from unengorged Ixodes ricinus ticks. Acta Virol, 1966, 10, 171-172.
52. Kuno, G. Universal diagnostic RT-PCR protocol for arboviruses. J Virol Meth, 1998, 72, 27-41.
53. Kurkela, S., Manni, T., Myllynen, J., Vaheri, A. et al. Clinical and laboratory manifestations of Sindbis virus infection: prospective study, Finland, 2002-2003. J Infect Dis, 2005, 191, 1820-1829.
54. Kurkela, S., Manni, T., Vaheri, A., Vapalahti, O. Causative agent of Pogosta disease isolated from blood and skin lesions. Emerg Infect Dis, 2004, 10, 889-894.
55. Kurkela, S., Raetti, O., Huhtamo, E., Uzcategui, O. et al. Sindbis virus infection in resident birds, and humans, Finland. Emerg Infect Dis, 2008, 14, 41-47.
56. Lennette, E. H., Schmidt, N. J. (eds.). Diagnostic Procedures for Viral, Rickettsial and Chlamydial Infections. 5th ed. Washington: Am Publ Hlth Ass, 1979. 590 pp.
57. Libíková, H., Ašmera, J., Heinz, F. Izolace orbiviru z komplexu Kemerovo (kmen Cvilín) z klíšťat v Severomoravském kraji (SMK). Českosl Epidem Mikrobiol Imunol, 1977, 26, 135-138.
58. Libíková, H., Heinz, F., Ujházyová, D., Stünzner, D. Orbiviruses of the Kemerovo complex and neurological diseases. Med Microbiol Immunol, 1978, 166, 255-263.
59. Libíková, H., Řeháček, J., Somogyová, J. Viruses related to the Kemerovo virus in Ixodes ricinus ticks in Czechoslovakia. Acta Virol, 1965, 9, 76-82.
60. Libíková, H., Tesařová, J., Rajčáni, J. Experimental infection of monkeys with Kemerovo virus. Acta Virol, 1970, 14, 64-69.
61. Linke, S., Ellerbrok, H., Niedrig, M., Nitsche, A. et al. Detection of West Nile virus lineages 1 and 2 by real-time PCR. J Virol Meth, 2007, 146, 355-358.
62. Madrid, A. T., Porterfield, J. S. The flaviviruses (group B arboviruses): a cross-neutralization study. J Gen Virol, 1974, 23, 91-96.
63. Málková, D., Danielová, V., Holubová, J., Marhoul, Z. et al. Izolace virů klíšťové encefalitidy a Uukuniemi z klíšťat pražských parků. Českosl Epidem Mikrobiol Imunol, 1983, 32, 138-142.
64. Málková, D., Danielová, V., Holubová, J., Marhoul, Z. Less known arboviruses of Central Europe. Rozpr. ČSAV, ř. mat. přír. věd, 1986, 96, 5, 1-75.
65. Málková, D., Holubová, J., Kolman, J. M. Antibodies against some arboviruses in persons with various neuropathies. Acta virol, 1980, 24, 298.
66. Meister, T., Lussy, H., Bakonyi, T., Šikutová, S. et al. Serological evidence of continuing high Usutu virus activity and establishment of herd immunity in wild birds in Austria. Vet Microbiol, 2008, 127, 237-248.
67. Melnick, J. L., Paul, J. R., Riordan, J. F., Barnett, V. H. H. et al. Isolation from human sera in Egypt of a virus apparently identical to West Nile virus. Proc Soc Exp Biol Med, 1951, 77, 661-665.
68. Nasci, R. S., White, D. J., Stirling, H., Oliver, J. et al. West Nile virus isolates from mosquitoes in New York and New Jersey, 1999. Emerg Infect Dis, 2001, 7, 626-630.
69. Putkurin, N., Vaheri, A., Vapalahti, O. Human infections caused by Inkoo virus in Finland. J Clin Virol, 2006, 36, 49-50.
70. Rehse-Küpper, B., Casals, J., Rehse, E., Ackermann, R. Eyach virus, an arthropod-borne virus related to Colorado tick fever virus in the Federal Republic of Germany. Acta Virol, 1976, 20, 339-342.
71. Rezza, G., Nicoletti, L., Angelini, R., Romi, R. et al. Infection with Chikungunya virus in Italy: an outbreak in a temperate region. Lancet, 2007, 370, 1840-1846.
72. Romero, J. R., Newgland, J. G. Diagnosis of viral encephalitides: zoonotic-associated viruses. Pediat Infect Dis J, 2006, 25, 741-742.
73. Rosický, B., Málková, D. (eds.) Ťahyňa virus natural focus in southern Moravia. Rozpr. ČSAV, ř. mat. přír. věd, 1980, 90, 7, 1-107.
74. Saegerman, C., Berkvens, D., Mellor, P. S. Bluetongue epidemiology in European Union. Emerg Infect Dis, 2008, 14, 539-544.
75. Schuler, L. A., Khaitsa, M. L., Dyer, N. W., Stoltenow, C. L. Evaluation of an outbreak of West Nile virus infection in horses: 569 cases (2002). J Am Vet Med Ass, 2004, 225, 1084-1089.
76. Sluka, F. The clinical picture of the Čalovo virus infection. In Bárdoš, V. et al. (eds.) Arboviruses of the California complex and the Bunyamwera group. Bratislava: Publ. House Slov. Acad Sci, 1969. 337-339.
77. Smetana, A., Danielová, V., Kolman, J. M., Málková, D. et al. The isolation of the Čalovo virus from the mosquitoes of the group Anopheles maculipennis in southern Moravia. J Hyg Epid, 1967, 11, 55-59.
78. Smithburn, K. C., Hughes, T. P., Burke, A. W., Paul, J. H. A neurotropic virus isolated from the blood of a native of Uganda. Am J Trop Med, 1940, 20, 471-472.
79. Strauss, E. G., Rice, C. M., Strauss, J. H. Complete nucleotide sequence of the genomic RNA of Sindbis virus. Virology, 1984, 133, 92-110.
80. Šimková, A., Sluka, F. Isolation of Ťahyňa virus from the blood of a case of influenza-like disease. Acta Virol, 1973, 17, 94.
81. Tatem, A. J., Hay, S. I., Rogers, D. J. Global traffic and disease vector dispersal. Proc Nat Acad Sci, 2006, 103, 6242-6247.
82. Taylor, R. M., Hurlbut, H. S., Work, T. H., Kingston, J. R. et al. Sindbis virus: a newly recognized arthropodtransmitted virus. Am J Trop Med Hyg, 1955, 4, 844-862.
83. Van der Meulen, K. M., Pensaert, M. B., Nauwynck H. J. West Nile virus in the vertebrate world. Arch Virol, 2005, 150, 637-657.
84. Weissenböck, H., Chvala–Mannsberger, S., Bakonyi, T., Nowotny, N. Emergence of Usutu virus in Central Europe: diagnosis, surveillance and epizootology. In Takken, W., Knols, B. G. J. (eds.) Emerging pests and vector-borne diseases in Europe. Wageningen: Wageningen Academic Publishers, 2007. 499 pp.
85. Weissenböck, H., Kolodziejek, J., Url, A., Lussy, H. et al. Emergence of Usutu virus, an African mosquito-borne flavivirus of Japanese encephalitis virus group, central Europe. Emerg Infect Dis, 2002, 8, 652-656.
86. Zelená, H., Januška, J., Raszka, J., Manďáková, Z. První průkaz importované infekce virem Chikungunya v České republice. Klin Mikrobiol Inf Lék, 2006, 6, 238-239.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek TEST
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2008 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Aminoglykozidy a kolistín potláčajú tvorbu biofilmu u Klebsiella pneumoniae
- Micromodification of Virus-neutralisation Assay with Vital Staining in 96-well Plate and its Use in Diagnostics of Ťahyňa Virus Infections
- Profesor Ivo Hána osmdesátníkem
- Spomienka na profesora MUDr. Emila Kmetyho, DrSc
- MUDr. Eduard Sajdák, * 6.5.1934 - † 4.5.2008
- TEST
- Časopis Epidemiologie, mikrobiologie, imunologie zařazen do Seznamu recenzovaných neimpaktovaných periodik vydávaných v České republice
- Opomíjené virové infekce přenášené hematofágními členovci v České republice
- Od historických poznatkov a názorov až po súčasné úlohy na poli celiakie
- Reccurent Erythema Migrans as a Persistent Infection
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Opomíjené virové infekce přenášené hematofágními členovci v České republice
- Aminoglykozidy a kolistín potláčajú tvorbu biofilmu u Klebsiella pneumoniae
- Od historických poznatkov a názorov až po súčasné úlohy na poli celiakie
- Reccurent Erythema Migrans as a Persistent Infection
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



