-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zastoupení různých genotypů glykoproteinu gB u pacientů s vysokým rizikem symptomatické infekce lidským cytomegalovirem (CMV)
Prevalence of Glycoprotein B (gB) Genotypes in the Patients with High Risk of Symptomatic Cytomegalovirus Infection
Objectives:
Based on genetic variability of the dominant envelope glycoprotein (gB), human cytomegalovirus is classified into four major genotypes. The aims were to determine the prevalence of particular gB genotypes in Czech CMV-infected patients and to compare three groups of the patients with high risk of symptomatic CMV infection, i.e. haematopoietic stem cell transplant (HSCT) recipients, HIV-positive persons and infants.Material and methods:
The study was performed on 134 archived CMV-positive DNA isolates from the patients tested in the National Reference Laboratory for Herpesviruses in 2004-2007. For genotyping, the variable part of gB was amplified and analysed using the restriction fragment length polymorphism (RFLP) method.Results:
The most frequently detected genotype was gB1 (33%), followed by gB2 (29%), gB3 (18%) and gB4 (7%). However, the distribution of gB genotypes varied between groups of high-risk patients: gB2 dominated in HIV-positives (55%, p= 0.004), while gB3 was most common in HSCT recipients (26%, p=0.03) and gB4 was relatively more frequent in infants (20%, p=0.03). In HSCT recipients, we found increased frequency of gB3 (26%, p=0.03) and co-infection with two or more gB genotypes (17%, p=0.016).Conclusions:
The distribution of CMV gB genotypes from Czech CMV-infected patients is similar to that reported in other European countries or in the United States. Differences in the prevalence of CMV gB genotypes between groups of high-risk patients indicate variation in biological properties of particular gB genotypes, possibly resulting in distinct virulence, immunogenicity or epidemiological characteristics of circulating strains.Key words:
Human cytomegalovirus – glycoprotein B – genotype – molecular epidemiology.
Autori: K. Roubalová 1
; S. Žufanová 1; A. Vítek 2; M. Staňková 3
Pôsobisko autorov: Centrum laboratorních činností, Státní zdravotní ústav, Praha 1; Ústav hematologie a krevní transfuze, Praha 2; Klinika infekčních nemocí, II. LF UK, Nemocnice Bulovka, Praha. 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 58, 2009, č. 4, s. 148-153
Súhrn
Cíl práce:
Na základě genetické variability hlavního obalového glykoproteinu (gB) lze kmeny cytomegaloviru (CMV) rozdělit do 4 hlavních genotypů. Cílem práce bylo zjistit výskyt jednotlivých genotypů CMV v naší populaci a porovnat jejich zastoupení u tří skupin pacientů s vysokým rizikem symptomatické infekce: u příjemců transplantátu kmenových buněk krvetvorby (HSCT), u HIV - pozitivních pacientů a dětí do 3 let.Materiál a metody:
Do studie bylo zahrnuto 134 archivovaných CMV-pozitivních izolátů DNA od pacientů, kteří byli vyšetřeni v Národní referenční laboratoři pro herpetické viry v letech 2004-2007. Genotypizace byla prováděna pomocí amplifikace a analýzy produktů štěpení restrikčními endonukleázami (RFLP) variabilního úseku genu pro gB.Výsledky:
V celém souboru byl nejčastěji nalezen genotyp gB1 (33 %), dále gB2 (29 %), gB3 (18 %) a nejméně častý byl gB4 (7 %). U jednotlivých rizikových skupin se však zastoupení jednotlivých genotypů lišilo: U HIV - pozitivních pacientů byl prokázán vysoký podíl gB2 v porovnání se zbytkem populace (55 %, p=0,004). U dětských pacientů byl relativně častěji přítomen gB4 (20 %, p=0,03).Ve skupině příjemců HSCT byl zvýšen výskyt gB3 (26 %, p=0,03), a záchyt koinfekce více genotypy (17 %, p=0,016).Závěry:
Distribuce jednotlivých genotypů CMV v naší populaci je podobná, jako v jiných regionech střední a západní Evropy a ve Spojených státech. Odlišné zastoupení jednotlivých genotypů u různých skupin rizikových pacientů svědčí o rozdílech v biologických vlastnostech, které mohou ovlivnit virulenci, imunogenitu i epidemiologické charakteristiky cirkulujících kmenů.Klíčová slova:
lidský cytomegalovirus – glykoprotein B – genotypy – molekulární epidemiologie.Specifické biologické vlastnosti herpetických virů a jejich dlouhodobý vývoj souběžně s hostitelskými organismy jsou příčinou jejich vysoké genetické stability v porovnání s jinými skupinami virů. Přesto genetické analýzy lidských zástupců této skupiny ukázaly, že jednotlivé druhy jsou ve skutečnosti směsí různých genetických variant (genotypů), které mohou souběžně nebo následně infikovat stejného jedince [1,22], liší se často svojí geografickou distribucí a v některých případech i biologickými vlastnostmi (přehled – viz 21). Genetická variabilita je, spolu se schopností unikat hostitelskému imunitnímu systému, příčinou toho, že u infikovaného jedince během života běžně dochází nejen k reaktivaci latentní infekce, ale i k reinfekci dalšími divokými kmeny. U cytomegaloviru je, v porovnání s ostatními lidskými herpetickými viry, genetická variabilita poměrně vysoká. Bodové mutace, nebo vzácněji i rozsáhlejší přestavby nukleotidových sekvencí postihují jak strukturální, tak nestrukturální geny. V prvním případě se jedná hlavně o geny pro virové obalové glykoproteiny, příkladem druhé skupiny genů je např. gen pro bezprostředně časný transaktivační protein (IE), nebo gen UL144, kódující membránový receptor typu rTNFα. V některých genech jsou mutace soustředěny do určitých klastrů a umožńují rozlišení několika genotypů (např. v genu pro glykoprotein B, glykoprotein H či IE), v jiných genech (např. glykoprotein O, N) jsou mutace lokalizovány náhodně a liší se u jednotlivých kmenů CMV [21]. Glykoprotein B (gB) je hlavní komponentou virového obalu, odpovídá za vazbu virionů na jeden z buněčných receptorů (heparan sulfát) a představuje imunodominantní antigen, který vyvolává jak buněčnou imunitní odpověď, tak tvorbu neutralizačních protilátek. V infikované buňce je gB syntetizován ve formě prekursoru 150 kDal který je v průběhu maturace štěpen na subjednotky 116 a 55 kDal. Maturovaný gB (označovaný též jako virový glykoproteinový komplex I) je homodimerem, složeným ze dvou kovalentně spojených komplexů transmembránové subjednotky (55 kDal) a povrchové subjednotky1(116 kDal) [7]. Genetická variabilita gB je soustředěna v centrální oblasti genu v okolí štěpného místa, a umožňuje rozlišení čtyř základních genotypů CMV (gB1,gB2, gB3,gB4 [9]) a tří vzácných neprototypových variant (5,6,7, [22,25,28]). Protože variabilní oblast gB zahrnuje i doménu, která se účastní vazby na receptor [7], nelze vyloučit, že jednotlivé genotypy se budou lišit ve schopnosti infikovat některé typy buněk. Součástí variabilní oblasti je i hlavní antigenní [19,23]. Tyto rozdíly mohou mít dopad na hodnocení laboratorních testů, na účinnost imunoterapie nebo na protektivní účinek budoucí vakcíny proti CMV. Cílem této studie proto bylo zmapovat zastoupení jednotlivých genotypů CMV v naší populaci a zjistit jejich výskyt u některých skupin rizikových pacientů.
Materiál a metody
Pacienti: Pro studii byly použity archivované izoláty DNA od pacientů, kteří byli vyšetřováni v Národní referenční laboratoři pro herpetické viry. Jednalo se o 54 dospělých příjemců transplantátu kmenových buněk krvetvorby, léčených v letech 2004-5 v Ústavu hematologie a krevní transfuze v Praze, u nichž byla cytomegalovirová infekce prokázána při pravidelném monitorování hladin virové DNA v periferní krvi, dále o 20 HIV-pozitivních pacientů, u nichž byla v rámci pravidelného monitoringu zachycena DNA CMV v moči, 20 dětí ve věku do 3 let se symptomatickou infekcí CMV (diagnózy – viz tabulka 1) a pozitivitou CMV DNA v moči, nebo v krvi. Dále bylo do studie zahrnuto 11 dospělých netransplantovaných jedinců s aktivní cytomegalovirovou infekcí, rovněž prokázanou na základě přítomnosti CMV DNA v periferní krvi nebo u jednoho pacienta s konjunktivitidou ve stěru ze spojivkového vaku.
Tab. 1. Charakteristika vyšetřované skupiny pacientů Table 1. Characteristics of study patients 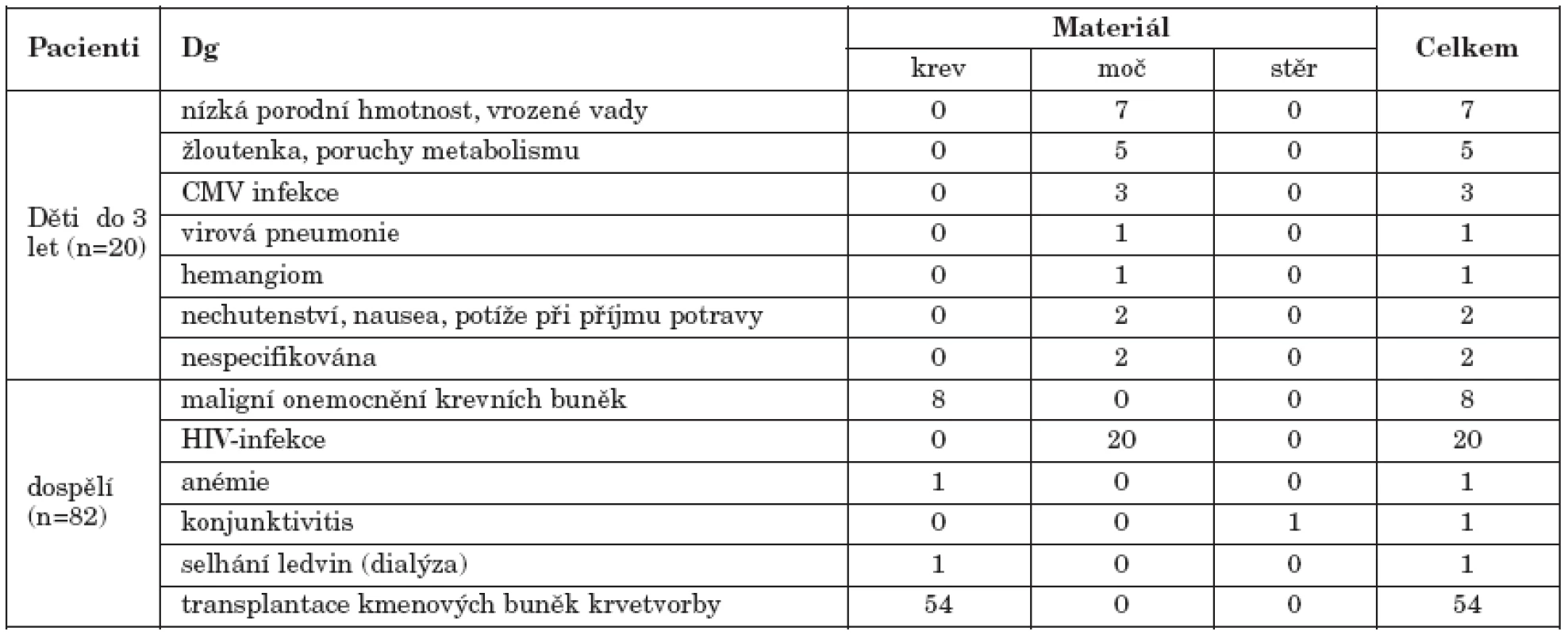
Izolace DNA: DNA byla izolována pro účely rutinního vyšetření z 200 μl moče nebo nesrážlivé periferní krve, odebrané do odběrových zkumavek s EDTA. Izolace byla provedena buď manuálně na kolonkách (QiaAmp Blood Mini Kit, Qiagen, Parsley, UK) nebo pomocí LC DNA Isolation Kitu na automatu MagnaPure (Roche). Stěr ze spojivkového vaku byl vytřepán do 0,5 ml sterilního PBS a 200 μl takto připraveného vzorku pak bylo použito pro izolaci DNA na kolonkách (viz výše). Vyčištěná DNA byla eluována do 50 μl elučního pufru (Qiagen nebo Roche) a skladována při -70 °C. Před vyšetřením byly vzorky zahřáty 3 min. na 95°C a krátce zcentrifugovány (1 min., 8000 rpm).
Genotypizace gB: Pro účely genotypizace byl amplifikován 293-6 pb dlouhý úsek, zahrnující centrální variabilní oblast genu pro glykoprotein B (UL55, kodon 439-535) pomocí nested PCR [9,27]. Reakce byla prováděna v 50 μl reakční směsi, obsahující 0,25 U Fast-Start Taq DNA polymerázy (Roche), reakční pufr pro amplifikaci GC - rich DNA fragmentů (Roche) a 25 pmol primerů. Primery a amplifikační podmínky jsou popsány v tabulce 2. Produkt reakce byl následně štěpen restrikčními endonukleázami Hinf I a Rsa I (Promega). Reakční směs obsahovala 15 μl produktu PCR, 2 μl pufru (Promega), 2 μl Acyl - BSA (1 μg/ml, Promega) a 10U enzymu. Produkty štěpení byly analyzovány pomocí elektroforezy v 12% akrylamidovém gelu po obarvení ethidium bromidem.
Tab. 2. Použité primery a amplifikační podmínky Table 2. Primers and amplification conditions used in the study 
Statistické vyhodnocení: Pro vyhodnocení statistické významnosti rozdílů v záchytu jednotlivých genotypů byl použit Mantel - Haenszelův χ2 test (EpiInfo 6.04).
Výsledky
Čtyři prototypové genotypy gB CMV byly rozlišovány na základně charakteristického vzorce produktů štěpení restrikčními endonukleázami Hinf I a Rsa I (obr. 1). Četnost záchytu jednotlivých genotypů u vyšetřovaného souboru pacientů a jednotlivých podskupin znázorňuje tabulka 3. Celkově nejčastěji identifikovaným genotypem byl gB1 (33,3 %), následoval gB2 (28,6 %), gB3 byl přítomen u 18,1 % a nejméně častý gB4 u 7,4 % všech pacientů. Směs více genotypů byla zachycena u 9,5 % pacientů a jednalo se výhradně o imunodeficientní jedince. Mezi vyšetřovanými skupinami byly nalezeny rozdíly v zastoupení některých genotypů CMV: Pro skupinu HIV - pozitivních pacientů byl charakteristický vysoký podíl gB2 v porovnání se zbytkem populace (55 %, p=0,004). U dětských pacientů byl relativně častěji přítomen gB4 (p=0,03). Ve skupině příjemců HSCT byl zvýšen výskyt gB3 (26 % p=0,03). Významně vyšší zde byl záchyt smíšené infekce více genotypy (16,6 %, p= 0,016). U tří transplantovaných pacientů neodpovídal vzorec fragmentů restrikčního štěpení žádnému ze čtyř základních genotypů.
Obr. 1. Vzorec produktů RFLP u jednotlivých genotypů gB Fig. 1. RFLP patterns of different gB genotypes 
Tab. 3. Výskyt jednotlivých genotypů gB Table 3. Distribution of gB genotypes 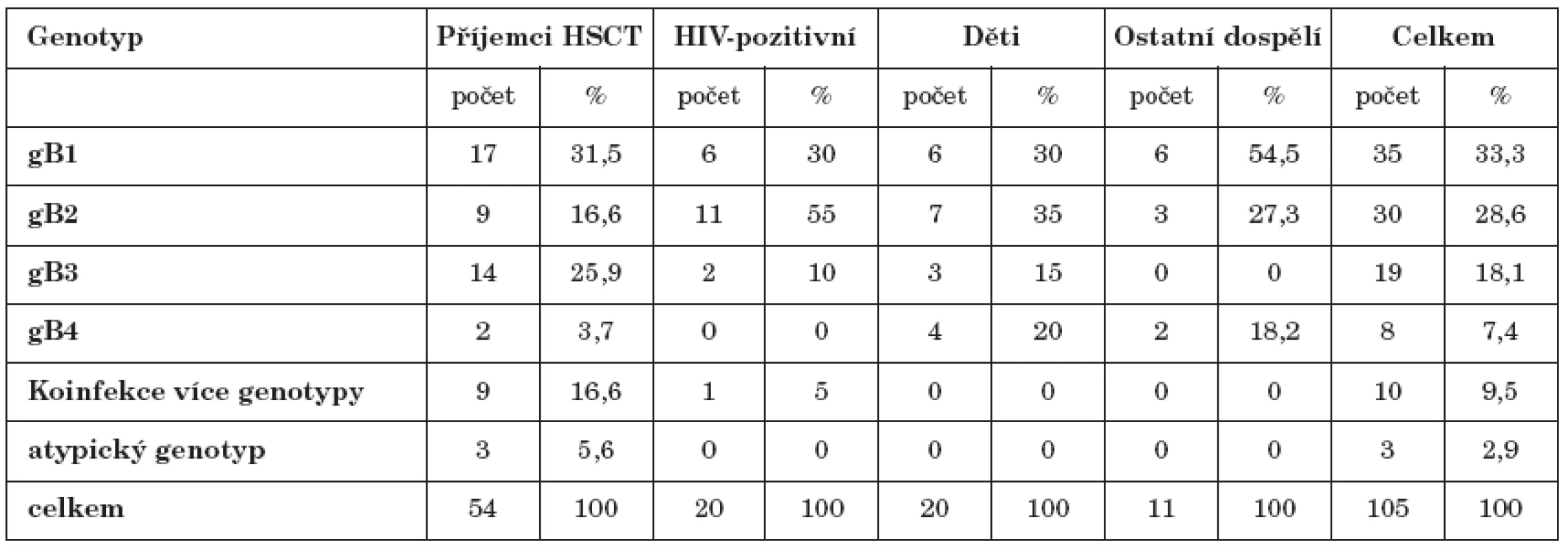
Diskuse
Zastoupení jednotlivých genotypů CMV v našem regionu dosud nebylo dostatečně zkoumáno. Studie omezeného rozsahu byly prováděny v Maďarsku a Polsku, Rakousku a Německu [3,6,14,16], byly však zaměřeny pouze na určitou skupinu pacientů. Stanovení prevalence jednotlivých genotypů CMV v běžné populaci je problematické, neboť získání dostatečného množství materiálu od bezpříznakově infikovaných zdravých jedinců je velmi obtížné. Proto jsme v naší studii použili materiál ze screeningových nebo diagnostických vyšetření od pacientů s vysokým rizikem nebo klinickými příznaky infekce CMV. Do studie jsme zahrnuli hlavní skupiny pacientů, u nichž je cytomegalovirová infekce nejčastěji diagnostikována: transplantované pacienty, HIV-pozitivní a malé děti ve věku do 3 let, zahrnující i případy kongenitální infekce. Celkové zastoupení jednotlivých genotypů gB v našem souboru bylo velmi podobné údajům, publikovaným ve výše zmíněných studiích. Nejvíce byly zastoupeny genotypy gB1 a gB2, naopak nejméně četný byl genotyp gB4. Nicméně, mezi jednotlivými skupinami pacientů byly nalezeny pozoruhodné rozdíly. Statisticky nejvýznamnější byla převaha gB2 u HIV - pozitivních pacientů, která nebyla spojena s typem vyšetřovaného vzorku, neboť v močích dětských pacientů gB2 nepřevládal. Výsledky genotypizace gB u publikovaných studií, zaměřených na HIV - pozitivní pacienty, jsou značně nekonzistentní: některé studie souhlasně s našimi výsledky dokumentují převahu gB2,a to jak v moči pacientů [22], tak v krvi [11,13,24], oční tekutině [8] mozkomíšním moku [26], nebo slinách [12], jiné ji nepotvrdily [6,20,29]. Některé z těchto studií nalezly rozdílné zastoupení jednotlivých genotypů v různých vzorcích od téhož pacienta [22,26], jiné nikoliv [6,20]. Zipeto et al.[33], porovnával zastoupení jednotlivých genotypů gB u tří souborů HIV - pozitivních pacientů s odlišnými epidemiologickými charakteristikami a naznačil možnou souvislost převahy gB2 s homosexuálním přenosem infekce: gB2 dominoval u italských mužů, kteří měli sex s muži, kdežto u intravenózních narkomanů a afrických heterosexuálních pacientů nikoliv. Homosexuální přenos infekce převažoval i v našem souboru pacientů.
Studie, které se zabývaly genotypizací CMV u kojenců včetně kongenitálně infikovaných souhlasně s našimi výsledky prokázaly nejvyšší četnost gB1 a následně pak gB3 [4,5,15,28]. Zvýšený výskyt gB4 u této skupiny pacientů však pozorovali pouze italští autoři [2] a v některých geografických lokalitách nebyl tento genotyp zastoupen vůbec (Brazílie –[30];Čína - [31]). Lze jen spekulovat, proč je výskyt gB4 v této skupině pacientů našeho souboru vyšší, než v ostatních skupinách. Jedním z možných vysvětlení by mohl být vyšší podíl primárních infekcí.
U příjemců HSCT je zdrojem aktivní cytomegalovirové infekce nejčastěji virus, přenesený štěpem [18]. V naší skupině převažovali pacienti, kteří získali kmenové buňky od nepříbuzného dárce, pocházející často ze zahraničního registru . Bylo proto důležité zjistit, zda se zastoupení jednotlivých genotypů CMV v této skupině bude lišit od rozložení v běžné populaci. Nejčastěji zastoupeným genotypem byl u transplantovaných pacientů, stejně jako u dětí a onkologických pacientů, gB1, gB 3 však byl u této skupiny 3krát častější než u ostatních pacientů. Tento genotyp je obecně častěji nacházen u pacientů s virémií a zdá se, že má v porovnání s ostatními genotypy lepší schopnost šířit se krví [17,22,26] . Spolu s gB2 je častěji nacházen u pacientů s těžším průběhem infekce [5,27,32]. Významně zvýšen byl záchyt koinfekce více genotypy. Tento fenomén je pro silně imunosuprimované pacienty typický a je spojen se špatnou prognózou infekce [10]. V našem případě se nejednalo o kontrolovanou studii, a proto nebylo možné zhodnotit vliv jednotlivých genotypů na klinický průběh infekce, či prognózu onemocnění.
Použité zkratky:
BSA – bovinní sérumalbumin
CMV – lidský cytomegalovirus
gB – glykoprotein B
HLA – hlavní histokompatibilitní komplex
HSCT – transplantace kmenových buněk krvetvorby
IE – bezprostředně časný protein CMV (UL123)
PBS – izotonický fosfátový pufr pH 7,2
PCR – polymerázová řetězová reakce
RFLP – polymorfismus restrikčních fragmentů
rTNFα – receptor pro tumor-nekrosis faktor α
Poděkování: Tato práce byla sponzorována grantem IGA MZ ČR NR 9418-3
Do redakce došlo 15.4.2009
MUDr. K. Roubalová
Vidia s.r.o.
Nad Safinou II/365
251 42 Jilemnice u Prahy
e-mail: kroubalova@vidia.cz
Zdroje
1. Aquino, V., Figueiredo, L.T. High prevalence of renal transplant recipients infected with more than one cytomegalovirus glycoprotein B genotype. J Med Virol 2000, 61, 138-142.
2. Arista, S., De Grazia, S., Giammanco, G., Di Carlo, P., Iannitto, E. Human cytomegalovirus glycoprotein B genotypes in immunocompetent, immunocompromised, and congenitally infected Italian populations. Arch Virol 2003,148, 547-554.
3. Augutynowicz, E., Gzyl, A., Dzierzanowska, D. Epidemiological studies of HCMV infection in children by restriction analysis of long-PCR products. Acta Microbiol Pol 1999, 48, 341-348.
4. Bale, J.J., Murph, H. J., Demmler, G., Dawson, J., Miller, J., Petheram, S.J. Intrauterine cytomegalovirus infection and glycoprotein B genotypes. J Infect Dis 2000, 182, 933-936.
5. Barbi, M., Corbetta, C., Primache, V., Binda, S., Caroppo, S. et al. CMV gB genotypes and outcome of vertical transmission: study on dried blood spots of congenitally infected babies. J Clin Virol 2001, 21, 75-79.
6. Bongarts, A. ,Von Laer, .D. , Vogelberg, C., Ebert, K.,Van Lunzen, J. et al. Glycoprotein B genotype of human cytomegalovirus: distribution in HIV-infected patients. Scand J Infect Dis 1996, 28, 447-449.
7. Britt, W., Mach, M. Human cytomegalovirus glycoproteins. Intervirology 1996, 39, 401-412.
8. Chern, K., Chandler, D., Martin, D., Kuppermann B., Wolitz R., Margolis, T.P. Glycoprotein B subtyping of cytomegalovirus (CMV) in the vitreous of patients with AIDS and CMV retinitis. J Infect Dis 1998, 178, 1149-1153.
9. Chou, S., Dennison, K.M. Analysis of interstrain variation in cytomegalovirus glycoprotein B sequences encoding neutralization-related epitopes. J Infect Dis 1991, 163, 1229-1234.
10. Coaquette, A., Bourgeois, A., Dirand, C., Varin, A., Chen, W., Herbein, G. Mixed cytomegalovirus glycoprotein B genotypes in immunocompromised patients. Clin Infect Dis 2004, 39, 155-161.
11. Drew, W.L., Chou, S., Miner, R.C., Mohr, B.A., Busch, M.P. et al. Cytomegalovirus glycoprotein B groups in human immunodeficiency virus-infected patients with incident retinitis. J Infect Dis 2002, 186, 114-117.
12. Fidouh-Houhou, N., Duval, X., Bissuel, F., Bourbonneux, V., Flandre, P. et al. Salivary cytomegalovirus (CMV) shedding, glycoprotein B genotype distribution, and CMV disease in human immunodeficiency virus-seropositive patients. Clin Infect Dis 2001, 33, 1406-1411.
13. Gilbert, C., Handfield, J., Toma, E., Lalonde, R., Bergeron, M., Boivin, G. Human cytomegalovirus glycoprotein B genotypes in blood of AIDS patients: lack of association with either the viral DNA load in leukocytes or presence of retinitis. J Med Virol 1999, 59, 98-103.
14. Görzer, I., Kerschner, H., Jaksch, P., Seebacher, G. et al. Virus load dynamics of individual CMV-genotypes in lung transplant recipients with mixed-genotype infections. J Med Virol 2008, 80, 1405-1414.
15. Jin, H., Wang, X., Li S. Human cytomegalovirus glycoprotein B genotype correlates with different symptoms of infected infants. Intervirology 2007, 50, 219-223.
16. Lukácsi, A., Taródi, B., Endreffy, E., Bábinsziki, A., Pál, A., Pusztai, R. Human cytomegalovirus gB genotype 1 is dominant in congenital infections in South Hungary. J Med Virol 2001, 65, 537-542.
17. Meyer-König, U., Vogelberg, C., Bongarts, A., Kampa, D., Delbrück, R. et al. Glycoprotein B genotype correlates with cell tropism in vivo of human cytomegalovirus infection. J Med Virol 1998, 55, 75-81.
18. Meyers, J.D.,Fluornoy, N.,Thomas, E.D. Risc factors for cytomegalovirus infection after human marrow transplantation. J Infect Dis, 1986, 153,478-488.
19. Navarro, D., Lennette, E., Tugizov, S., Pereira, L. Humoral immune response to functional regions of human cytomegalovirus glycoprotein B. J Med Virol 1997, 52, 451-459.
20. Peek, R., Verbraak, F., Bruinenberg, M., Van Der Lelij, A., Van Den Horn, G., Kijlstra, A. Cytomegalovirus glycoprotein B genotyping in ocular fluids and blood of AIDS patients with cytomegalovirus retinitis. Invest Ophthalmol Vis Sci.1998, 39, 1183-7.
21. Pignatelli, S., Dal Monte, P., Rossini, G., Landini, M. Genetic polymorphisms among human cytomegalovirus (HCMV) wild-type strains. Rev Med Virol 2004,14, 383-410.
22. Rasmussen, L., Hong, C., Zipeto D., Morris, S., Sherman, D. et al. Cytomegalovirus gB genotype distribution differs in human immunodeficiencyvirus-infected patients and immunocompromised allograft recipients. J Infect Dis 1997, 175, 179-184.
23. Retiére, C., Lesimple, B., Lepelletier, D., Bignon, J.D., Hallet et al. Association of glycoprotein B and immediate early-1 genotypes with human leukocyte antigen alleles in renal transplant recipients with cytomegalovirus infection. Transplantation 2003, 75, 161-165.
24. Shepp, D., Match, M., Ashraf, A., Lipson, S., Millan, C., Pergollizi, R. Cytomegalovirus glycoprotein B groups associated with retinitis in AIDS. J Infect Dis 1996,174, 184-187.
25. Shepp, D., Match, M., Lipson, S., Pergolizzi, R.G. A fifth human cytomegalovirus glycoprotein B genotype. Res Virol 1998, 149, 109-114.
26. Tarragó, D., Quereda, C., Tenorio, A. Different cytomegalovirus glycoprotein B genotype distribution in serum and cerebrospinal fluid specimens determined by a novel multiplex nested PCR. J Clin Microbiol 2003, 41, 2872-2877.
27. Torok-Storb, B., Boeckh, M., Hoy, C., Leisenring, W., Myerson, D., Gooley, T. Association of specific cytomegalovirus genotypes with death from myelosuppression after marrow transplantation. Blood 1997, 90, 2097-2102.
28. Trincado, D., Scott, G., White, P., Hunt, C., Rasmussen, L., Rawlinson, W.D. Human cytomegalovirus strains associated with congenital and perinatal infections. J Med Virol 2000, 61, 481-487.
29. Vilas Boas, L.S., De Souza, V.A., Penalva De Oliveira, A.C., Rodriguez Viso, A.T., Nascimento Filho, A.M. et al. Cytomegalovirus glycoprotein B genotypes and central nervous system disease in AIDS patients. J Med Virol 2003,71, 404-407.
30. Yamamoto, A.Y., Mussi-Pinhata, M.M., De Deus Wagatsuma, V.M., Marin, L.J., Duarte, G., Figuereido, L.T. Human cytomegalovirus glycoprotein B genotypes in Brazilian mothers and their congenitally infected infants. J Med Virol 2007,79, 1164-1168.
31. Yu, Z.S., Zheng, J.Y., Wu, J.B. Association between clinical manifestations of infants with human cytomegalovirus infection and glycoprotein B genotype. Zhonghua Yi Xue Za Zhi 2007, 87, 259-261.
32. Zhou,U L., Fan, J., Zheng, S.S., Ma, W.H. Genetic variation within the glycoprotein B and H genes of human cytomegalovirus in solid organ transplant recipients. Transpl Infect Dis 2007, 8, 73-77.
33. Zipeto, D., Hong, C., Gerna, G., Zavattoni M., Katzenstein, D. et al. Geographic and demographic differences in the frequency of human cytomegalovirus gB genotypes 1-4 in immunocompromised patients. AIDS Res Hum Retroviruses 1998, 14, 533-536.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2009 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- ÚVODNÍ SLOVO
- K šedesátinám Společnosti pro epidemiologii a mikrobiologii České lékařské společnosti J. E. Purkyně
- Zastoupení různých genotypů glykoproteinu gB u pacientů s vysokým rizikem symptomatické infekce lidským cytomegalovirem (CMV)
- Pseudomonas aeruginosa, její rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných od pacientů s infekcí močových cest
- Epidemiologický prehľad hepatitídy C na Klinike infektológie a cestovnej medicíny v Košiciach
- Sérové protilátky proti endomýziu (AEA) v diagnostickom algoritme celiakie
- Diagnostika novovirových infekcí u hospitalizovaných dětí a mladistvých s akutní gastroenteritidou. Plzeňská studie
- Dynamika výskytu Creutzfeldtovej -Jakobovej choroby na Slovensku v rokoch 1975-2008
- Změny meteorologických faktorů a výskyt klíšťové encefalitidy v České republice
- Studium hypervirulentních komplexů Neisseria meningitidis metodami molekulární biologie a možnosti prevence jejich výskytu v České republice vakcinací
- A Day to Focus; and Act; on Pneumonia
- Vzpomínky na prof. MUDr. Karla Rašku
- In memoriam Miloš Rýc 1938 – 1989
- Životní jubileum prof. Daniely Kotulové
- Přínos stanovení core antigenu v diagnostice infekce hepatitidy C testem firmy Abbott Laboratories
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pseudomonas aeruginosa, její rezistence k vybraným antibiotikům a tvorba biofilmu u kmenů izolovaných od pacientů s infekcí močových cest
- Dynamika výskytu Creutzfeldtovej -Jakobovej choroby na Slovensku v rokoch 1975-2008
- Sérové protilátky proti endomýziu (AEA) v diagnostickom algoritme celiakie
- Přínos stanovení core antigenu v diagnostice infekce hepatitidy C testem firmy Abbott Laboratories
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



