-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Očkování proti virové hepatitidě A a B u dospělých starších 40 let věku – sledování přetrvávání protilátek a imunitní paměti
Vaccination against Viral Hepatitis A and B in Adults Aged over 40 Years – Antibody Persistence and Immune Memory
Study objective:
Primary vaccination with combined vaccine against viral hepatitis A (VHA) and viral hepatitis B (VHB) induces higher anti-hepatitis B surface (anti-HBs) antibody responses and similar anti-hepatitis A virus (anti-HAV) antibody responses in adults aged over 40 years in comparison with concomitant monovalent vaccines against VHA and VHB. The objectives were to assess, in a clinical study, persistence of anti-HAV and anti-HBs antibodies in adults aged over 40 years four years after primary VHA/VHB vaccination and antibody response following a booster dose of the vaccine.Material and Methods:
Five hundred and ninety-six subjects aged > 40 years were vaccinated with three doses of the combined VHA/VHB vaccine at Months 0, 1, 6 (HAB group) or with concomitant VHA and VHB vaccines at Months 0, 6 and 0, 1, 6 (ENG+HAV and HBVX+VAQ, respectively). Blood samples were collected one month following primary vaccination (Month 7) and then at one-year intervals for four years after the booster dose with the same vaccine as used for the primary vaccination. The anti-HBs and anti-HAV antibody levels were determined prior to the booster dose and at days 14 and 30 after the booster dose.Results:
At Month 7, > 97 % of study subjects were seropositive for anti-HAV antibodies in all groups analyzed. Four years after primary vaccination, anti-HAV antibody seropositivity persisted in > 93 % of study subjects, increasing to > 99 % after the booster dose. At Month 7, the highest proportion of study subjects with anti-HBs antibody levels > 10 mIU/ml was found in the HAB group (91.7 % versus 79.7 % in the ENG+HAV group versus 71.0 % in the HBVX+VAQ group). Four years after vaccination, anti-HBs antibody levels of 10 mIU/ml persisted in 57.1 % of the HAB study subjects in comparison with 40.1 % and 26.6 % of the study subjects in the ENG+HAV and HBVX+VAQ groups, respectively. One month after the booster dose, anti-HBs antibody levels increased and antibody levels > 10 mIU/ml was achived in 95.2 % of study subjects in the HAB group, 90.5 % in the ENG+HAV group and 85.3 % in the HBVX+VAQ group.Conclusion:
In the adults aged over 40 years, an adequate anti-HAV antibody response persisted for at least four years after vaccination and was higher and more sustained in those who received the combined HAB vaccine. A strong antibody response to the booster dose indicative of the presence of immune memory was seen in all study groups.Key words:
vaccination – hepatitis – booster dose – immune memory – protection
Autori: R. Chlíbek
; J. Smetana
; V. Boštíková
; M. Špliňo
Pôsobisko autorov: Fakulta vojenského zdravotnictví Univerzity obrany, Hradec Králové
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 60, 2011, č. 3, s. 99-108
Súhrn
Cíl práce:
Primovakcinace kombinovanou vakcínou proti virové hepatitidě A (VHA) a virové hepatitidě B (VHB) vyvolává u dospělých osob ve věku > 40 let vyšší hladiny protilátek proti viru hepatitidy B (anti-HBs) a podobné hladiny protilátek proti viru hepatitidy A (anti-HAV) v porovnání se simultánním očkováním monovakcínami proti VHA a VHB. Cílem práce bylo v klinické studii zhodnotit dlouhodobé přetrvávání anti-HAV a anti-HBs protilátek u osob > 40 let za 4 roky po primovakcinaci proti VHA/VHB a zhodnotit anamnestickou protilátkovou odpověď po booster dávce vakcíny.Materiál a metody:
596 subjektů > 40 let bylo očkováno kombinovanou VHA/VHB vakcínou ve třech dávkách v Měsíci 0, 1, 6 (HAB skupina) nebo jim byla simultánně aplikována monovakcína proti VHA a zároveň proti VHB v Měsíci 0, 6 a 0, 1, 6 (ENG + HAV a HBVX + VAQ skupina). Vzorky krve byly subjektům odebírány 1 měsíc po primovakcinaci (Měsíc 7) a dále v ročním intervalu po dobu 4 let, kdy byla všem subjektům aplikována booster dávka té samé vakcíny, která jim byla aplikována při primovakcinaci. Koncentrace anti-HBs a anti-HAV protilátek byla dále vyšetřována před aplikací booster dávky, 14 dní po ní a 1 měsíc po její aplikaci.Výsledky:
V Měsíci 7 bylo > 97 % subjektů séropozitivních na anti-HAV protilátky ve všech hodnocených skupinách. Čtyři roky po primovakcinaci u > 93 % subjektů přetrvávala séropozitivita na anti-HAV protilátky, po aplikaci booster dávky došlo k vzestupu séropozitivity na > 99 %. V Měsíci 7 byl podíl subjektů s koncentrací anti-HBs protilátek > 10 mIU/ml nejvyšší v HAB skupině (91,7 % versus 79,7 % a 71,0 % v ENG+HAV a HBVX+VAQ skupinách). Čtyři roky po očkování přetrvávaly koncentrace anti-HBs protilátek > 10 mIU/ml u 57,1 % subjektů v HAB skupině v porovnání se 40,1 % a 26,6 % subjektů v ENG+HAV a HBVX+VAQ skupině. Jeden měsíc po aplikaci booster dávky došlo k vzestupu koncentrací protilátek a anti-HBs 10 mIU/ml bylo dosaženo u 95,2 % subjektů v HAB skupině, u 90,5 % v ENG+HAV skupině a 85,3 % v HBVX+VAQ skupině.Závěr:
U dospělých osob starších 40 let přetrvává dostatečná anti-HAV protilátková odpověď po dobu minimálně 4 let od očkování. Anti-HBs protilátková odpověď byla vyšší a dlouhodobější u subjektů očkovaných kombinovanou vakcínou. Ve všech skupinách subjektů byla zaznamenána vysoká protilátková odpověď na booster dávku, což potvrzuje přítomnost imunitní paměti.Klíčová slova:
očkování – hepatitida – booster dávka – imunitní paměť – protekceÚvod
Virové hepatitidy představují významnou zátěž zdravotnictví a výrazně ovlivňují zdravotní stav jedince na celém světě. Předpokládá se, že každoročně se celosvětově vyskytne 1,5 milionu nových klinických manifestací virové hepatitidy A. Skutečná incidence je však daleko vyšší, odhaduje se minimálně 10krát vyšší morbidita, než je skutečně hlášená [25]. Celosvětově jsou minimálně 2 miliardy osob infikovány virem hepatitidy B (HBV) a ve světové populaci se nachází více než 350 milionů chronických nosičů HBV [29]. Každoročně je ve světě zaznamenáno 4,5 milionů nových případů VHB a kolem 620 000 osob ročně na VHB umírá [29]. Virové hepatitidy A a B tak tvoří významný podíl na akutních virových onemocněních jater. Jejich klinická závažnost, zejména virové hepatitidy A, stoupá s věkem [1, 2, 27]. Podobně výskyt závažnějších komplikací VHA a mortalita je u starších osob vyšší v porovnání s mladšími osobami [2].
Přibližně polovina nových akutních případů VHB probíhá symptomaticky a v 1–2 % případů mívá fulminantní průběh [7]. Nejvyšší riziko fulminantních průběhů je u starších dospělých [16]. Vyšší riziko morbidity a mortality virových hepatitid u starších dospělých je jeden z důvodů, proč očkování starších osob nabývá na významu i v rozvinutých zemích s dobrým hygienickým standardem. Dalším důvodem významu očkování je stoupající podíl starších dospělých cestovatelů mezi cestovateli, zejména do oblastí zvýšeného výskytu VHA a VHB [4, 6, 12]. U starších dospělých tím vzrůstá riziko expozice virovým hepatitidám a právě VHA/VHB patří mezi nejčastější onemocnění cestovatelů ovlivnitelná vakcinací [18]. Až 50 % diagnostikovaných případů VHA/VHB v Evropě má tedy souvislost s cestováním a vyskytuje se u cestovatelů [13, 15]. Populace v rozvinutých zemích postupně stárne a přibývá starších osob, proto je důležité sledovat imunitní odpověď na očkování a přetrvávání protekce také v této věkové kategorii očkovaných. K preexpoziční prevenci můžeme použít jednak kombinovanou vakcínu proti VHA/VHB nebo monovalentní vakcíny proti oběma hepatitidám. Jejich imunogenita a účinnost byla prokázána v řadě klinických studií [14, 23, 29]. Věk hraje důležitou roli v imunitní odpovědi na očkování, proto u starších dospělých může docházet k oslabení protilátkové odpovědi po očkování [9]. V předchozích studiích byla prokázána nejvyšší séroprotekce proti VHB a séropozitivita proti VHA po primovakcinaci kombinovanou vakcínou v porovnání s monovakcínami u osob starších 40 let [10]. Toto sledování hodnotí přetrvávání imunitní odpovědi na očkování proti VHA a VHB čtyři roky po primovakcinaci u starších dospělých. Současně byla hodnocena anamnestická odpověď na posilující (booster) dávku u osob primovakcinovaných k posouzení stavu imunitní paměti.
Materiál a metody
Charakteristika klinické studie a subjektů hodnocení
Hodnocení probíhalo v rámci klinické studie. Tato studie byla prospektivní, otevřená, s dlouhodobým sledováním. Do studie byly zařazeny subjekty starší 40 let, které byly randomizované v poměru 1 : 1 : 1 do tří očkovacích skupin podle aplikovaných vakcín. Jedna skupina byla očkována kombinovanou vakcínou proti VHA/VHB (Twinrix™; GSK Biologicals) ve schématu 0., 1. a 6. měsíc (HAB skupina) nebo vakcínou proti VHB (Engerix-B™; GSK Biologicals) ve schématu 0., 1. a 6. měsíc simultánně s vakcínou proti VHA (Havrix™; GSK Biologicals) v Měsíci 0 a 6 (ENG + HAV skupina) nebo vakcínou proti VHB (HBVAXPRO™; Sanofi Pasteur) ve schématu 0., 1. a 6. měsíc aplikovanou simultánně s vakcínou proti VHA (Vaqta™; Merck & Co.) v Měsíci 0 a 6 (HBVX+VAQ skupina) [10, 22]. Všechny vakcíny byly aplikované intramuskulárně do deltového svalu paže. Podmínkou zařazení subjektu do studie byl podepsaný informovaný souhlas a séronegativita anti-HBs, anti-HBc a anti-HAV protilátek a nepřítomnost antigenu HBsAg před zahájením očkování. Subjekty byly dále rozděleny podle věku do tří skupin (41–50 let, 51–60 let, > 60 let), podle pohlaví, podle BMI na jedince s normální hmotností (BMI < 25 kg/m2), s nadváhou (BMI ≥ 25 a < 30 kg/m2) a s obezitou (BMI ≥ 30 kg/m2) podle CDC klasifikace [3].
Do dlouhodobého sledování byly zařazeny všechny subjekty, které dokončily primovakcinaci proti VHA/VHB a v průběhu sledování jim nebyla aplikovaná žádná jiná vakcína proti VHA nebo VHB. Po dobu 4 let od očkování pak bylo hodnoceno přetrvávaní imunitní odpovědi. Ve 4. roce sledování byla všem subjektům aplikována jedna booster dávka stejné vakcíny, kterou byly očkovány při primovakcinaci a následně 1 měsíc po aplikaci vyhodnocen stav imunitní paměti na virus VHA a VHB.
Každý zařazený subjekt podepsal informovaný souhlas. Studie probíhala v souladu s Helsinskou deklarací a podle zásad správné klinické praxe.
Hodnocení imunogenity
Odběry krve byly provedeny v Měsíci 7 (1 měsíc po poslední dávce primovakcinace), dále každoročně po dobu 4 let. Další odběr krve byl proveden před aplikací booster dávky, 14 a 30 dní po booster dávce. Určení koncentrací anti-HAV a anti-HBs protilátek bylo provedeno metodou enzymové imunoeseje (ELISA) s hraniční hodnotou 15 mIU/ml pro anti-HAV (Enzygnost™, DADE Behring) a 3,3 mIU/ml pro anti-HBs (AUSAB™, Abbott Laboratories).
Jako séropozitivní byly označeny subjekty s hodnotou koncentrací anti-HAV protilátek nad hraniční hodnotu imunoeseje a séroprotektivita pro anti-HBs protilátky byla stanovena jako koncentrace ≥ 10 mIU/ml. Anamnestická protilátková odpověď proti HAV po booster dávce byla stanovena jako koncentrace anti-HAV protilátek ≥ 15 mIU/ml 30 dní po přeočkování u subjektů, které byly séronegativní před booster dávkou, nebo jako minimálně dvojnásobný vzestup koncentrací 30 dní po přeočkování u subjektů s koncentrací anti-HAV protilátek < 100 mIU/ml před booster dávkou nebo minimálně čtyřnásobný vzestup koncentrací 30 dní po přeočkování u subjektů s koncentrací anti-HAV protilátek < 100 mIU/ml před booster dávkou. Anamnestická protilátková odpověď proti HBV po booster dávce byla stanovena jako koncentrace anti-HBs protilátek ≥ 10 mIU/ml 30 dní po přeočkování u subjektů, které byly séronegativní před booster dávkou, nebo jako minimálně čtyřnásobný vzestup koncentrací 30 dní po přeočkování u subjektů, které byly anti-HBs séropozitivní před booster dávkou.
Hodnocení reaktogenity a bezpečnosti
Nežádoucí účinky po očkování v podobě dotazovaných místních (bolest, zarudnutí a otok) a celkových (únava, horečka [axilárně ≥ 37,5 °C], gastrointestinální symptomy a bolest hlavy) příznaků byly subjekty zaznamenávány po dobu 4 dnů po aplikaci booster dávky do denních karet. Intenzita těchto příznaků byla hodnocena podle bodové stupnice 0–3, kde stupeň 3 byl definován jako zarudnutí nebo otok > 50 mm v průměru, horečka > 39,5 °C, u ostatních symptomů jako takové, které vylučovaly běžnou, každodenní aktivitu subjektu. Po dobu 31 dnů po aplikaci booster dávky byl sledován výskyt všech dalších nedotazovaných nežádoucích účinků, místních i celkových. Závažné nežádoucí účinky byly zaznamenávány po celou dobu studie.
Statistická analýza
Dlouhodobé přetrvávání protilátek bylo hodnoceno u skupiny subjektů, u kterých nedošlo po celou dobu sledování od primovakcinace k odchýlení od stanoveného protokolu – kohorta „dlouhodobě v souladu s protokolem“ (D VSP). Hodnocení protilátkové odpovědi po booster dávce bylo prováděno u skupiny subjektů, u kterých nedošlo k odchýlení od protokolu od zahájení přeočkování – kohorta „v souladu s protokolem“ (VSP). Všechny hodnoty séroprotekce nebo séropozitivity, geometrické průměry koncentrací protilátek (GMC) a procento subjektů s anti-HAV a anti-HBs anamnestickými protilátkami byly počítány v rámci 95% intervalu spolehlivosti (95% IS). K porovnání rozdílů hodnot anti-HBs séroprotektivity mezi skupinami subjektů v dlouhodobém hodnocení, včetně hodnocení rozdílů před aplikací, 14 a 30 dní po aplikaci booster dávky byla použita metoda explorativní analýzy. Rozdíly v procentuálním počtu subjektů s anti-HBs protilátkami ≥ 10 mIU/ml mezi očkovanými skupinami v jednotlivých časových bodech hodnocení byly počítány v rozsahu dvoustranného 95% intervalu spolehlivosti a pro výpočet p-hodnot byl použit Fisherův exaktní test. Stejný test byl použit pro hodnocení rozdílů v procentuálním počtu subjektů, u kterých došlo k tvorbě anamnestických protilátek po aplikaci booster dávky. Protilátková odpověď na aplikaci booster dávky proti VHB byla hodnocena také podle koncentrací anti-HBs protilátek po primovakcinaci a před booster vakcinací. Reaktogenita a bezpečnost booster dávky byla hodnocena u všech očkovaných. Procento subjektů, které hlásily nežádoucí účinky po očkování bylo počítáno v rozmezí 95% IS. Statistické analýzy byly prováděny pomocí Statistického analytického software (SAS) verze 9.1.
Výsledky
Demografie
Základní rozdělení zařazených subjektů je uvedeno v grafu 1.
Graf 1. Rozdělení subjektů ve studii Fig. 1. Distribution of study subjects 
Primovakcinace byla provedena celkem u 596 subjektů (199 v HAB skupině, 200 v ENG + HAV skupině a 197 v HBVX + VAQ skupině). Z tohoto počtu se 506 subjektů dostavilo k aplikaci booster dávky 4 roky po primovakcinaci (172 v HAB skupině, 170 v ENG + HAV skupině a 164 v HBVX + VAQ skupině). Všechny tři skupiny subjektů byly demograficky vyvážené (tab. 1). Průměrný věk zařazených subjektů byl 59,0 let (SD 9,38), 50,2 % subjektů bylo mužského pohlaví a převažovala bílá rasa (99,8 %). V kohortě zařazených subjektů převažovali nekuřáci (74,7 %), abstinenti či mírní konzumenti alkoholu (59,4 %). Vzhledem k průměrnému věku zařazených subjektů, 92,4 % z nich užívalo trvale nějakou medikaci a 78,7 % mělo přidružená chronická onemocnění.
Tab. 1. Demografie subjektů očkovaných booster dávkou Table 1. Demographic data of boosted subjects 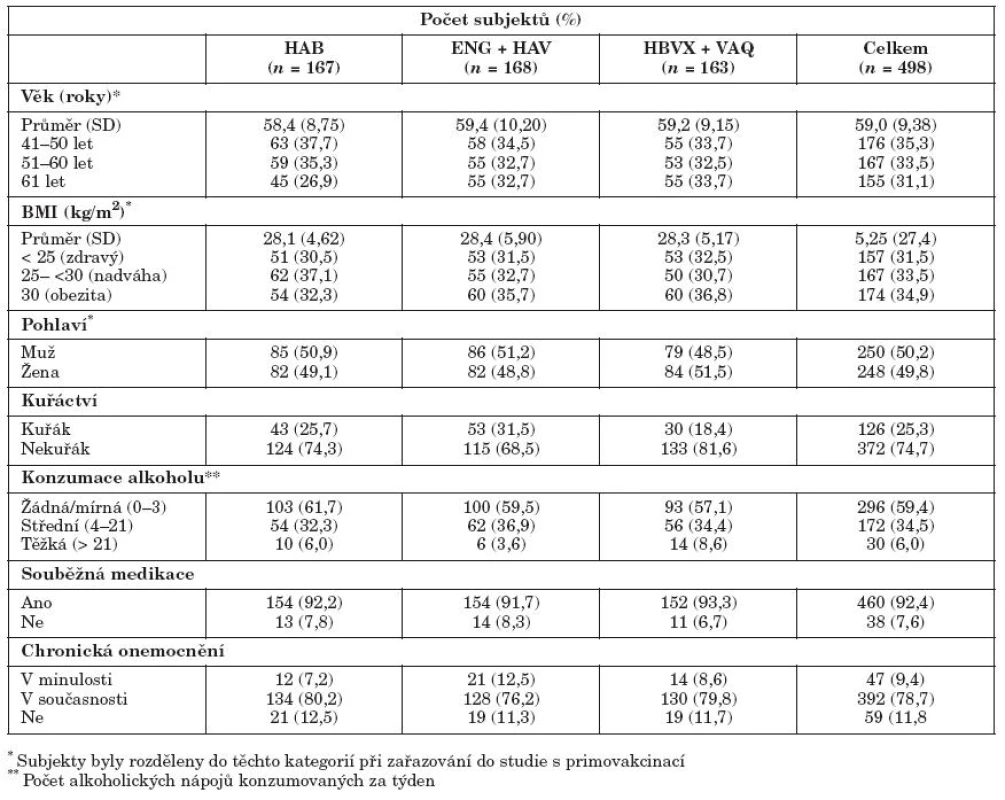
Přetrvávání protilátkové odpovědi
Jeden měsíc po primovakcinaci (Měsíc 7) bylo > 97 % subjektů séropozitivních na anti-HAV protilátky ve všech očkovaných skupinách. Po 4 letech přetrvávala anti-HAV séropozitivita u 97,3 % subjektů v HAB skupině, u 93,9 % v ENG + HAV skupině a u 96,0 % v HBVX + VAQ skupině. Geometrické průměry koncentrací anti-HAV protilátek byly 212,9; 165,7 a 277,4 mIU/ml v třech hodnocených skupinách.
V Měsíci 7 bylo subjektů s koncentrací anti-HBs protilátek ≥ 10 mIU/ml 91,7 % v HAB skupině, 79,7 % v ENG + HAV skupině a 71,0 % v HBVX + VAQ skupině (graf 2a). Podobný rozdíl v séroprotekci jednotlivých skupin byl pozorován po celé čtyřleté sledování. Ve čtvrtém roce sledování 57,1 % subjektů v HAB skupině mělo koncentrace anti-HBs protilátek ≥ 10 mIU/ml v porovnání s 40,1 % a 26,6 % v ENG + HAV a HBVX + VAQ skupinách. Rozdíl v séroprotektivitě mezi jednotlivými skupinami byl statisticky významný (p ≤ 0,005 pro HAB skupinu porovnávanou s ENG + HAV skupinou a p < 0,0001 pro HAB skupinu versus HBVX + VAQ skupina). Byl zaznamenán prudký pokles geometrických průměrů koncentrací anti-HBs protilátek v průběhu prvních 2 let po očkování u všech skupin. V následujících dvou letech pokračoval pokles koncentrací protilátek, který ale již nebyl tak prudký (graf 2b). Čtyři roky po očkování byly geometrické průměry koncentrací anti-HBs protilátek 42,3; 23,6 a 13,7 mIU/ml ve třech hodnocených skupinách.
Graf 2. Procento subjektů s koncentrací anti-HBs protilátek ≥ 10mIU/ml (a) a (b) odpovídající geometrické průměry koncentrací po dobu 4 let od očkování *p ≤ 0,005 pro HAB skupinu versus ENG + HAV skupina **p < 0,0001 pro HAB skupinu versus HBVX + VAQ skupina Fig. 2. Rates of subjects with anti-HBs antibody ≥ levels 10mIU/ml (a) and (b) corresponding geometric means for four post-vaccination years 
Anamnestická odpověď na booster dávku
Po aplikaci booster dávky vakcíny proti VHA bylo séropozitivních na anti-HAV protilátky celkově ve všech skupinách 99,4 % subjektů. Anamnestická odpověď na přeočkování byla zaznamenána u 98,2 % subjektů v HAB skupině, 97,6 % subjektů v ENG+HAV skupině a 99,4 % v HBVX+VAQ skupině. Čtrnáct dní po aplikaci booster dávky proti VHB 95,8 % subjektů dosáhlo koncentrace anti-HBs protilátek ≥ 10 mIU/ml v HAB skupině, 89,3 % subjektů v ENG + HAV skupině a 85,9 % v HBVX + VAQ skupině (p = 0,0358 pro HAB skupinu versus ENG+HAV skupina a p = 0,0019 pro HAB skupinu versus HBVX+VAQ skupina) (graf 3a). Odpovídající geometrické průměry koncentrací anti-HBs protilátek byly 8936,9; 1521,0 a 1222,4 mIU/ml ve třech hodnocených skupinách (graf 3b). Za jeden měsíc po aplikaci booster dávky 95,2 % subjektů v HAB skupině mělo koncentrace anti-HBs protilátek ≥ 10 mIU/ml v porovnání s 90,5 % subjektů a 85,3 % subjektů v ENG+HAV a HBVX+VAQ skupině respektive (p = 0,1367 pro HAB skupinu versus ENG + HAV skupinu a p = 0,0026 pro HAB skupinu versus HBVX + VAQ skupina) (graf 3a). Odpovídající geometrické průměry koncentrací anti-HBs protilátek byly 7233,7; 1242,5 a 1075,1 mIU/ml (graf 3b). Podíl subjektů s koncentrací anti-HBs protilátek ≥ 100 mIU/ml jeden měsíc po aplikaci booster dávky byl 90,4 % v HAB skupině v porovnání s 76,8 % a 68,7 % v ENG + HAV a HBVX + VAQ skupinách (graf 3c). U většiny subjektů ve všech skupinách byla zaznamenána silná a rychlá anamnestická protilátková odpověď na booster dávku (93,4 %, 88,1 % a 83,4 % subjektů ve jednotlivých skupinách). Nicméně, tato anamnestická odpověď byla nejvýraznější v HAB skupině (p = 0,1305 pro HAB skupinu versus ENG+HAV skupinu a p = 0,0054 pro HAB skupinu versus HBVX+VAQ skupinu).
Graf 3. Procento subjektů s koncentrací anti-HBs protilátek 10 mIU/ml (a), (b) odpovídající geometrické průměry koncentrací protilátek a (c) procento subjektů s koncentrací anti-HBs protilátek 100 mIU/ml před a po aplikaci booster dávky *p = 0,0358 pro HAB skupinu versus ENG+HAV skupiny; **p = 0,0019 pro HAB skupinu versus HBVX+VAQ skupina; ***p = 0,0026 pro HAB skupinu versus HBVX+VAQ skupina Fig. 3. Rates of subjects with anti-HBs antibody levels 10mIU/ml (a), (b) corresponding geometric means of the antibody levels, and (c) rates of subjects with pre-booster and post-booster anti-HBs antibody levels 100 mIU/ml *p = 0.0358 for HAB versus ENG+HAV; **p = 0.0019 for HAB versus HBVX+VAQ; ***p = 0.0026 for HAB versus HBVX+VAQ 
Explorační analýza
Ve všech očkovaných skupinách byla zaznamenána silná korelace mezi koncentrací anti-HBs protilátek v době 1 měsíc po primovakcinaci (Měsíc 7) a protilátkovou odpovědí v době 1 měsíc po booster dávce v roce 4 (korelační koeficient = 0,71–0,77) (graf 4). Podíl subjektů, u kterých došlo 4 roky po očkování k poklesu koncentrací anti-HBs protilátek pod ochrannou mez (anti-HBs < 3,3 mIU/ml) a u kterých po aplikaci booster dávky v roce 4 došlo k tvorbě anamnestických protilátek (anti-HBs ≥ 10 mIU/ml) byl 82,1 % subjektů v HAB skupině, 82,0 % v ENG + HAV skupině a 72,6 % v HBVX + VAQ skupině (tab. 2). Podíl subjektů, které dosáhly po přeočkování hodnot koncentrací protilátek ≥ 100 mIU/ml byl nejvyšší v HAB skupině (66,7 % subjektů v porovnání s 57,4 % a 47,9 % v ENG+HAV a HBVX+VAQ skupinách). Podíl subjektů, u kterých došlo k vymizení anti-HBs protilátek za 4 roky po očkování (anti-HBs < 3,3 mIU/ml) a které neodpověděly na booster dávku tvorbou anamnestických protilátek byl 17,9 %, 18 % a 27,4 % v jednotlivých skupinách.
Graf 4. Korelace mezi koncentrací anti-HBs protilátek (log titry) po primovakcinaci (Měsíc 7) a po aplikaci booster dávky (Den 30) Fig. 4. Correlation between the anti-HBs antibody levels (log titres) after the primary vaccination (Month 7) and after the booster dose (day 30) 
Tab. 2. Koncentrace anti-HBs protilátek před aplikaci booster dávky a po aplikaci Table 2. Pre-booster and post-booster anti-HBs antibody levels 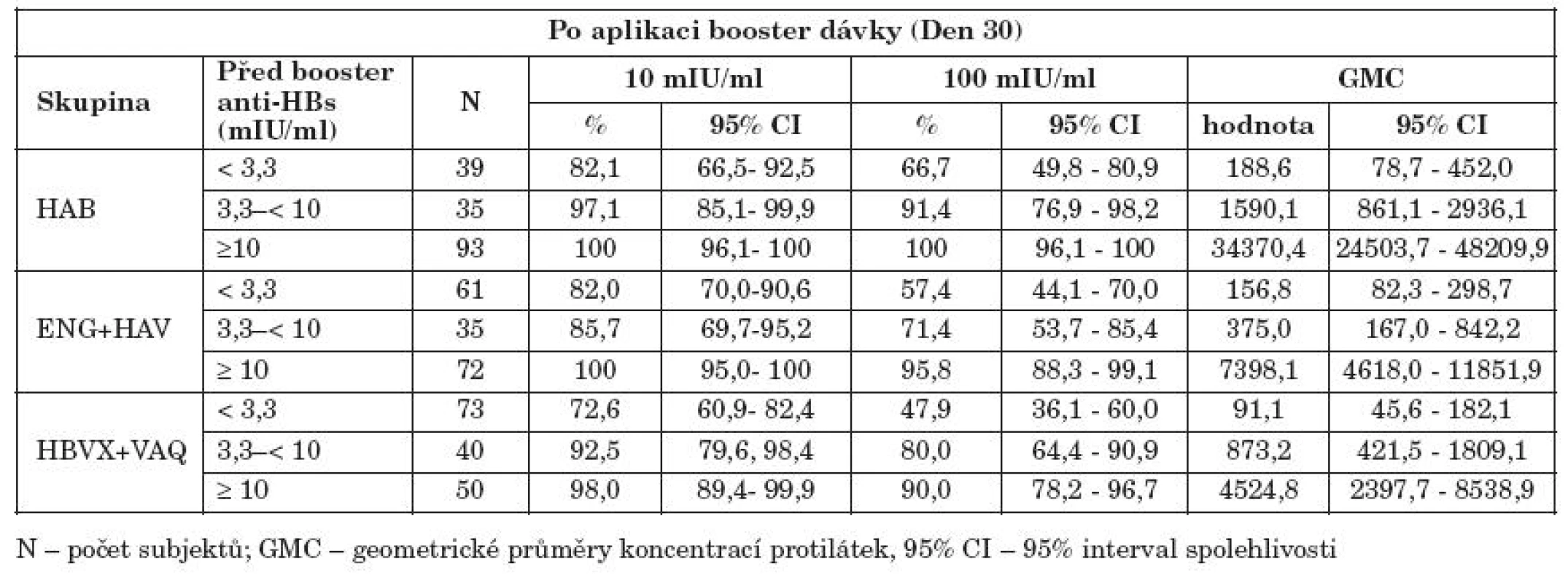
Reaktogenita a bezpečnost
Výskyt nežádoucích reakcí po očkování, po aplikaci booster dávky byl hlášen u 44,2 %, 34,1 % a 47,0 % subjektů v HAB, ENG + HAV a HBVX + VAQ skupině. Tyto reakce byly mírné nebo střední intenzity. Symptomy stupně intenzity 3 byly hlášeny u 2,4 % subjektů v HAB a HBVX + VAQ skupinách. Ve skupině ENG + HAV nebyl hlášen žádný symptom intenzity 3. Závažné nežádoucí účinky se vyskytly u 3 subjektů. U jednoho subjektu v HAB skupině se 14 dní po aplikaci booster dávky objevila intersticiální nefritida. Subjekt měl v anamnéze hantavirou infekci. U dvou subjektů v ENG+HAV skupině se objevily protruze intervertebrálního disku, které byly vyhodnoceny jako účinky bez vztahu k očkování.
Diskuse
V předchozích provedených studiích primovakcinace třemi dávkami kombinované vakcíny TwinrixTM proti virovým hepatitidám A a B vyvolala nejvyšší séroprotekci proti virové hepatitidě B v porovnání s ostatními dostupnými monovalentními vakcínami Engerix-BTM plus HavrixTM, nebo HB VAX PROTM plus VaqtaTM u osob starších 40 let. Také nejvyšší koncentrace protilátek bylo dosaženo u osob, které byly vakcinovány kombinovanou vakcínou [10, 22].
Tato studie dlouhodobého sledování hodnotila přetrvávání humorální odpovědi a imunitní paměti u starších dospělých čtyři roky po primovakcinaci proti VHA/VHB. Hodnocená kohorta zahrnovala 596 osob v průměrném věku 59 let (41–81 let) s odpovídajícím podílem osob s obezitou, s chronickým onemocněním a souběžnou medikací, které představují reprezentativní vzorek běžné populace osob starších 40 let. Rozdíly v imunitní odpovědi mezi kombinovanou vakcínou a monovakcínami pozorované po primární vakcinaci přetrvávaly v čase. Podobné výsledky byly dosaženy v jiných studiích s kombinovanou vakcínou u starších dospělých [8], kde vysoká séropozitivita anti-HAV přetrvávala dlouho v čase, zatímco podíl subjektů s anti-HBs séroprotekcí postupně v čase klesal. Čtyři roky po primovakcinaci byl podíl subjektů s koncentrací anti-HBs protilátek ≥ 10 mIU/ml nejvyšší ve skupině očkované kombinovanou vakcínou. Podobně geometrické průměry koncentrací anti-HBs protilátek v roce 4 byly také nejvyšší u subjektů očkovaných kombinovanou vakcínou. Nicméně tyto hodnoty byly nižší, než bylo pozorováno u mladých dospělých po 10 letech od očkování [24]. Nejnižší anti-HBs protilátková odpověď byla po celou dobu sledování, včetně čtvrtého roku po očkování pozorována u subjektů v HBVX + VAQ skupině, což může být vysvětleno nižším obsahem antigenu ve vakcíně HBVaxPro, která se aplikovala subjektům v této skupině.
Dlouhodobé přetrvávání imunitní paměti proti oběma virovým hepatitidám A a B bylo prokázáno rychlou a silnou anamnestickou protilátkovou odpovědí již do 14 dní po aplikaci booster dávky u většiny subjektů ve všech očkovaných skupinách. Podobně jako ve výsledcích po primovakcinaci [10, 22], podíl subjektů s anamnestickou odpovědí byl nejvyšší ve skupině subjektů očkovaných kombinovanou vakcínou. V této skupině byl také nejvyšší podíl subjektů, u kterých v průběhu 4 let po očkování došlo k postupnému vymizení detekovatelných anti-HBs protilátek a po aplikaci booster dávky byla zaznamenána dostatečná séroprotektivní odpověď. Nejvyšší anamnestická odpověď po aplikaci kombinované vakcíny může být způsobena silnější stimulací imunitního systému v průběhu primovakcinace nebo silnější imunogenitou booster dávky u osob s dostatečnou séroprotekcí po primovakcinaci nebo kombinací obou faktorů. Provedené studie potvrzují dostatečnou imunitní odpověď na očkování kombinovanou vakcínou u osob, které vytvořily protilátky po primovakcinaci a v průběhu času u nich došlo k poklesu protilátek pod detekovatelnou hranici [8, 20, 21]. Tyto výsledky potvrzují myšlenku, že pokles koncentrací anti-HBs protilátek pod 10 mIU/ml u osob, které adekvátně odpověděly na primovakcinaci, nemusí nutně znamenat ztrátu protekce proti VHB [19].
Zjištěná reaktogenita a bezpečnost kombinované vakcíny byla plně v souladu s výsledky jiných studií u starších dospělých [8, 20, 21]. Všechny vakcíny byly dobře tolerované při aplikaci booster dávky s nízkým výskytem nežádoucích účinků nejvyššího stupně intenzity 3.
Závěr
Vzhledem ke stárnutí populace, zvyšujícímu se počtu registrovaných i vyvíjených vakcín pro dospělé a narůstajícímu počtu cestovatelů vyššího věku nabývá na významu očkování dospělé populace. Starší dospělí jsou v možném riziku vzniku komplikací při klinickém onemocnění virovou hepatitidou A nebo B, spojeném s věkem a možným poklesem protilátkové odpovědi na aktivní imunizaci. U dospělé populace také dochází k posunu vnímavosti, zejména k VHA do vyšších věkových kategorií. Očkování proti VHA/VHB je proto také v podmínkách ČR důležité i u starších dospělých osob.
Kombinovaná vakcína proti VHA/VHB je dostatečně imunogenní a velmi dobře tolerovaná u starších dospělých ve věku > 40 let, vyvolává vyšší a déle přetrvávající protilátkovou odpověď proti VHB v porovnání s monovakcínami. Používání kombinované vakcíny u starších dospělých zajistí dostatečnou ochranu také v této věkové populaci.
Některé z výsledků této multicentrické studie byly již publikovány v časopise Journal of Travel Medicine, 2011 [11].
Poděkování: Autoři by rádi poděkovali všem osobám, které se podílely na průběhu a plnění dílčích úkolů klinického hodnocení (Dr. Eva Kalíšková a Dr. Petr Tichý), všem ostatním výzkumníkům z dalších podílejících se center (Dr. Pierre Van Damme, Dr. Frank von Sonnenburg) včetně poděkování laboratorním pracovníkům a zdravotnickému personálu. Za statistické zpracování patří díky Priya Diana Crasta.
Tato studie byla podporována grantem GSK Biologicals, Rixensart, Belgie.
Adresa pro korespondenci:
Doc. MUDr. Roman Chlíbek, Ph.D.
Katedra epidemiologie
Fakulta vojenského zdravotnictví Univerzity obrany
Třebešská 1575
500 01 Hradec Králové
e-mail: chlibek@pmfhk.cz
Zdroje
1. Advisory Committee on Immunization Practices (ACIP), Fiore, A. E., Wasley, A., Bell, B. P. Prevention of hepatitis A through active or passive immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep., 2006, 55, p. 1–23.
2. Brown, G. R., Persley, K. Hepatitis A epidemic in the elderly. South Med. J., 2002, 95, p. 826–833.
3. Centers for Disease Control and Prevention (CDC). Defining overweight and obesity. Dostupné na www: http://www.cdc.gov/nccdphp/dnpa/obesity/defining.htm. Accessed January 2010.
4. Cooper, M. C. The elderly travellers. Travel Med. Infect. Dis., 2006, 4, p. 218–222.
5. European Consensus Group on hepatitis B Immunity. Are booster immunisation needed for lifelong hepatitis B imunity? Lancet, 2000, 355, p. 561–565.
6. Genton, B., D’Acremont, V., Furrer, H. J. et al. Hepatitis A vaccines and the elderly. Travel Med. Infect. Dis., 2006, 4, p. 303–312.
7. Hepatitis B. Dostupné na www: http://www.cdc.gov/ vaccines/pubs/pinkbook/downloads/hepb.pdf. Accessed February 2011.
8. Höhler, T., Groeger-Bicanic, G., Hoet, B. et al. Antibody persistence and immune memory elicited by combined hepatitis A and B vaccination in older adults. Vaccine, 2007, 25, p. 1503–1508.
9. Chen, W. H., Kozlovsky, B. F., Effros, R. B. et al. Vaccination in the elderly: an immunological perspective. Trends Immunol., 2009, 30, p. 351–359.
10. Chlíbek, R., Smetana, J., Šindelář, R. et al. Imunogenita vakcín proti virovým hepatitidám A a B u osob starších 40 let – vliv rizikových faktorů. Epidemiologie, mikrobiologie, imunologie, 2007, 56, 3, p. 119–128.
11. Chlíbek, R., Von Sonnenburg, F., Van Damme, P. et al. Antibody Persistence and Immune Memory 4 Years Post-Vaccination With Combined Hepatitis A and B Vaccine in Adults Aged Over 40 Years. J. Travel Med., 2011, 8, 2, p. 145–148.
12. Leder, K., Weller, P. F., Wilson, M. E. Travel vaccines and elderly persons: review of vaccines available in the United States. Clin. Infect. Dis., 2001, 33, p. 1553–1566.
13. Mutsch, M., Spicher, V. M., Gut, C. et al. Hepatitis A virus infections in travelers, 1988 –2004. Clin. Infect. Dis., 2006, 42, p. 490–497.
14. Nothdurft, H. D. Hepatitis A vaccines. Expert Rev. Vaccines, 2008, 7, p. 535–545.
15. Nothdurft, H. D., Zuckerman, J., Stoffel, M. et al. Accelerated vaccination schedules provide protection against hepatitis A and B in last-minute travelers. Travel Med., 2004, 11, p. 260–262.
16. Sawabe, M., Arai, T., Esaki, Y. et al. Fulminant hepatic failure in the elderly: a clinicopathological study of autopsy cases aged over 65 years. Pathol. Int., 2000, 50, p. 98–105.
17. Sonder, G. J. Hepatitis B vaccination in travellers. Expert Rev. Vaccines, 2008, 7, p. 673–677.
18. Spira, A. M. A review of combined hepatitis A and hepatitis B vaccination for travellers. Clin. Ther., 2003, 25, p. 2337–2351.
19. Stoffel, M., Lievens, M., Dieussaert, I. et al. Immunogenicity of Twinrix™ in older adults: a critical analysis. Expert Rev. Vaccines, 2003, 2, p. 9–14.
20. Van Damme, P., Van Herck, K. A review of the efficacy, immunogenicity and tolerability of a combined hepatitis A and B vaccine. Expert Rev. Vaccines, 2004, 3, p. 249–267.
21. Van Damme, P., Van Herck, K. A review of the long--term protection after hepatitis A and B vaccination. Travel Med. Infect. Dis., 2007, 5, p. 79–84.
22. Van der Wielen, M., Van Damme, P., Chlibek, R. et al. Hepatitis A/B vaccination of adults over 40 years old: comparison of three vaccine regimens and effect of influencing factors. Vaccine, 2006, 24, p. 5509–5515.
23. Van Damme, P., Van Herck, K. A review of the efficacy, immunogenicity and tolerability of a combined hepatitis A and B vaccine. Expert Rev. Vaccines, 2004, 3, p. 249–267.
24. Van Herck, K., Leroux-Roels, G., Van Damme, P. et al. Ten-year antibody persistence induced by hepatitis A and B vaccine (Twinrix™) in adults. Travel Med. Infect. Dis., 2007, 5, p. 171–175.
25. Wasley, A., Fiore, A., Bell, B. P. Hepatitis A in the era of vaccination. Epidemiol. Rev., 2006, 28, p. 101–111.
26. World Health Organization. International travel and health 2010. Dostupné na www: http://www.who.int/ith/ ITH2010.pdf. Accessed January 2011. Accessed January 2011.
27. World Health Organization International travel and health: situation as on 1 January 2009. Dostupné na www: http://www.who.int/ith/ITH_2009.pdf. Accessed January 2010.
28. Wolters, B., Müller, T., Ross, S. et al. Comparative evaluation of the immunogenicity of combined hepatitis A and B vaccine by a prospective and retrospective trial. Hum. Vaccines, 2009, 5, p. 248–253.
29. Zanetti, A. R., Van Damme, P., Shouval, D. The global impact of vaccination against hepatitis B: a historical overview. Vaccine, 2008, 26, p. 6266–6273.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2011 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Prevence klíšťové meningoencefalitidy – souhrnné sdělení
- Využití testů avidity IgG protilátek v diagnostice cytomegalovirové infekce
- Meňavky rodu Acanthamoeba – pôvodcovia infekcií človeka
- Mimoriadne udalosti vo verejnom zdravotníctve
- MUDr. Luděk Bajgar (15. 3. 1952–24. 5. 2011)
- Očkování proti virové hepatitidě A a B u dospělých starších 40 let věku – sledování přetrvávání protilátek a imunitní paměti
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Využití testů avidity IgG protilátek v diagnostice cytomegalovirové infekce
- Meňavky rodu Acanthamoeba – pôvodcovia infekcií človeka
- Očkování proti virové hepatitidě A a B u dospělých starších 40 let věku – sledování přetrvávání protilátek a imunitní paměti
- Prevence klíšťové meningoencefalitidy – souhrnné sdělení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



