Výskyt gramnegativních nefermentujících bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
The Incidence of Nonfermentative Gram-Negative Bacilli in the Environment of the Transplant Unit, Department of Hemato-Oncology, University Hospital Olomouc
A study entitled „Surveillance of Infectious Complications in Hemato-oncological Patients“ was conducted at the Department of Hemato-Oncology, University Hospital Olomouc from 1 July 2010 to 31 August 2011. During the study period, a total of 63 patients were hospitalized at that department and 33 stem cell transplants were performed, 21 autologous and 12 allogeneic.
Microbial contamination was monitored in indoor air, on selected surfaces, and in health care providers (right hand smear, left and right nostril swabs and scalp hair smear). Gram-negative bacteria detected by culture were identified biochemically. Special attention was paid to nonfermentative Gram-negative bacilli which, based on the recent literature, should be considered as emerging causative agents of hospital infections.
Key words:
nonfermentative Gram-negative bacilli – hemato-oncology patient – resistance to antibiotics and biocides
Autoři:
Matoušková Ivanka 1; Raida Luděk 2; Holý Ondřej 1
Působiště autorů:
Hemato-onkologická klinika, Fakultní nemocnice Olomouc
; Ústav preventivního lékařství, Lékařská fakulta Univerzity Palackého v Olomouci
Vyšlo v časopise:
Epidemiol. Mikrobiol. Imunol. 61, 2012, č. 4, s. 110-115
Souhrn
V době od 1. srpna 2010 do 31. července 2011 probíhala v prostorách oddělení 5C Hemato-onkologické kliniky FN Olomouc epidemiologická studie s názvem „Surveillance of Infectious Complications in Hemato-Oncological Patients“. V této době bylo na oddělení hospitalizováno celkem 63 pacientů, z toho byla u 33 pacientů provedena transplantace kmenových buněk. Ve 21 případech se jednalo o autologní transplantaci, u 12 pacientů byla provedena alogenní transplantace.
Během této doby na výše uvedeném oddělení byla sledována mikrobiální kontaminace vnitřního vzduchu, vybraných povrchů a mikrobiální osídlení aktuálně přítomného zdravotnického personálu (stěr pravé ruky, výtěr z obou nosních dírek a stěr vlasové kštice). Kultivací prokázané gramnegativní bakterie byly biochemicky identifikovány. Zvýšená pozornost byla věnována gramnegativním nefermentujícím bakteriím, které podle současné literatury je nutné považovat za nastupující původce nemocničních infekcí.
Klíčová slova:
gramnegativní nefermentující bakterie – hemato-onkologický pacient – rezistence na antibiotika a biocidy
ÚVOD
Transplantace dřeně nebo kmenových buněk je život zachraňující léčba u mnohých zhoubných nádorů a geneticky podmíněných nebo hematologických onemocnění. V roce 2009 bylo na celém světě uskutečněno více než 25 000 alogenních a 30 000 autologních transplantací kmenových buněk [1]. Všechny podpůrné postupy stavebně-technického i léčebného charakteru zatím nedokáží eliminovat vznik infekčních komplikací u pacientů po transplantaci dřeně nebo kmenových buněk. V současné době se objevují odborná sdělení, která jsou na pomezí klinicko-epidemiologicko-mikrobiální surveillance, která je zaměřena na bakteriální infekce vyvolané aerobními gramnegativními nefermentujícími bakteriemi se zvýšenou rezistencí vůči antibiotikům a rezistencí na dezinfekční prostředky [2, 3, 4, 5].
V roce 1973 Palletoni et al. upozornili na taxonomickou heterogenitu rodu Pseudomonas a následně jej rozdělili do pěti hlavních druhových seskupení, kdy se odkazovali na rRNA homologní skupiny. Hybridizace DNA-rRNA přispěla k dalšímu rozdělení během následujících let. Nové nomenklaturní uspořádání vedlo k vytvoření nových bakteriálních druhů. Poslední přesné rozdělení bylo realizováno srovnávací 16S rRNA genetickou sekvencí a byly popsány nové bakteriální rody jako Burholderia, Stenotrophomonas, Cupriavidus, Comamonas, Delftia a některé další.
Jedná se o aerobní gramnegativní nefermentující bakterie, které se vyvinuly ve vodním prostředí. V současné době se nalézají v různých typech vod, včetně mořské, popř. odpadní. Rovněž jsou detekovány v půdě, na rostlinách, ovoci a zelenině. Některé z nich jsou patogenní nebo podmíněně patogenní pro lidi, zvířata a rostliny. Mají minimální růstové požadavky a značně se liší svou virulencí. Mnohé z nich se nalézají v různém prostředí zdravotnických zařízení, jsou označovány za podmíněné patogeny, které se uplatňují jako původci nemocničních infekcí a vykazují zvýšenou rezistenci na antibiotika a biocidy [1].
V našem sdělení chceme upozornit na některé z výše uvedených, méně známých aerobních gramnegativních nefermentujících bakterií, které byly kultivačně prokázány v průběhu monitorování mikrobiální kontaminace zdravotnického personálu a prostředí oddělení 5C Hemato-onkologické kliniky FN Olomouc.
SOUBOR A METODIKA
Během epidemiologického šetření bylo sledováno mikrobiální osídlení aktuálně přítomného zdravotnického personálu (stěr pravé ruky, výtěr z obou nosních dírek a stěr vlasové kštice) a mikrobiální kontaminace vnitřního vzduchu a vybraných povrchů na výše uvedeném oddělení. Šetření probíhalo v době srpen 2010 až duben 2011 formou monitorování v měsíčních intervalech. Stručný stavebně-technický popis tohoto oddělení je uveden v práci Holý et al.: Výskyt gramnegativních bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc (s. 103–109). V tomto sdělení je také uvedena použitá technika kontroly mikrobiálního osídlení zdravotnického personálu, mikrobiální kontaminace prostředí a následný mikrobiologický kultivační a identifikační postup.
VÝSLEDKY
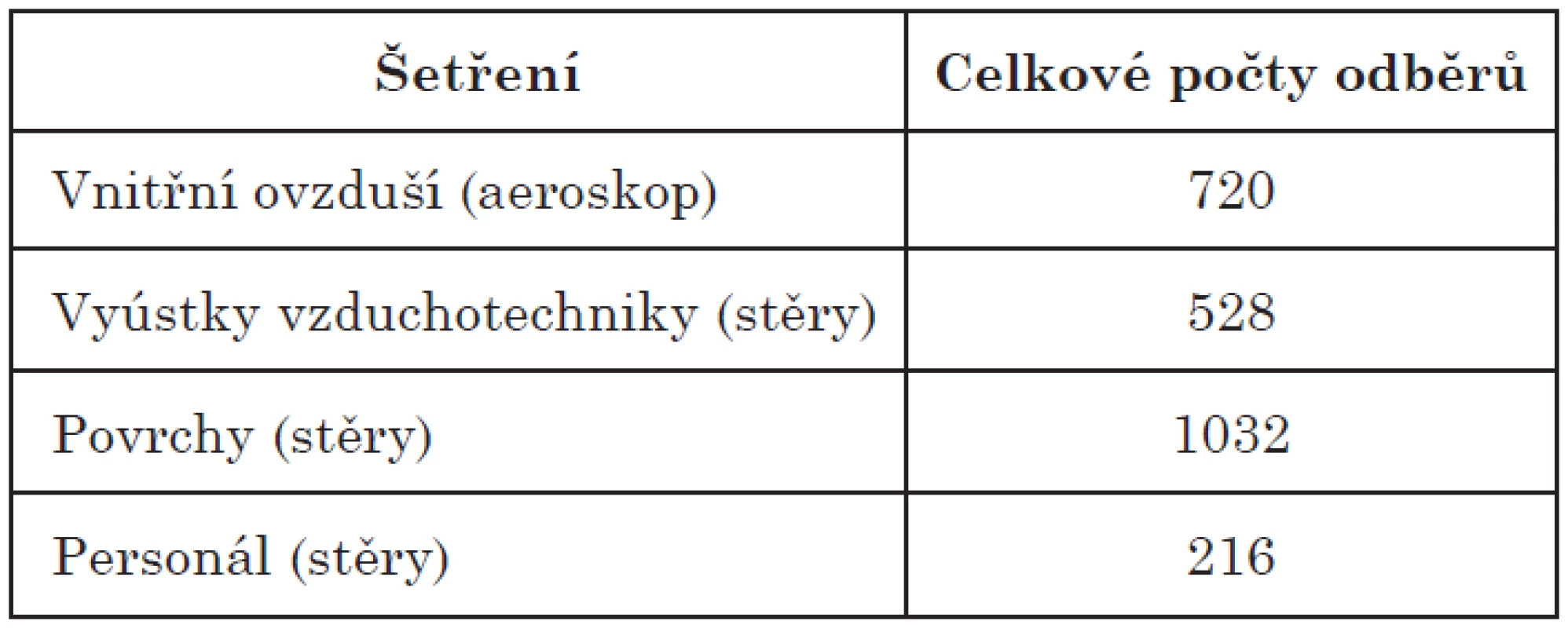
Celkové počty provedených odběrů v jednotlivých typech šetření jsou uvedeny v tabulce 1.
Ze skupiny aerobních gramnegativních nefermentujících bakterií byly od zdravotnického personálu a z prostředí (povrchy) Oddělení 5C Hemato-onkologické kliniky FN Olomouc kultivačně prokázány a biochemicky identifikovány následující bakteriální kmeny: Stenotrophomonas maltophilia (4krát), Ochrobactrum (Achromobacter sp.) – 6krát, z toho Ochrobactrum anthropii 2krát, Kluyvera ascorbata (3krát) a Acinetobacter baumanii (2krát). Jedenkrát se vyskytly tyto bakteriální kmeny: Delftia acidovorans, Alcaligenes faecalis, Kingella denitrificans, Cupriavidus pauculs, Chromobacterium violaceum a Acinetobacter lwoffii.
V jednom případě byla nefermentující gramnegativní bakterie izolována ze zdravotnického personálu (pravá ruka bez jednorázové rukavice).
Vnitřní ovzduší nebylo v žádném případě kontaminováno aerobní gramnegativní nefermentující bakterií.
Stenotrophomonas maltophilia byla původně popsána pod označením Bacterium bookeri v roce 1943, v roce 1961 přeřazena do rodu Pseudomonas, následovalo rozdělení a vznik rodu Xanthomonas a následně podle rRNA hybridizace reklasifikována do rodu Stenotrophomonas [7]. V životním prostředí se nachází ve vodě a na vlhkých místech. V prostředí zdravotnických zařízení kontaminuje různá technická zařízení, infuzní roztoky, sterilní vodu a dezinfekční prostředky [8, 9]. Není považována za součást fyziologické mikroflóry lidí. Ve zdravotnických zařízeních často kolonizuje dýchací cesty a trávicí trakt pacientů [10]. U imunosuprimovaných pacientů (hemato-onkologičtí, po orgánové transplantaci atd.) se podílí na infekčních komplikacích s vysokou mortalitou [11]. Je řazena mezi bakteriální kmeny, které mohou vyvolávat široké spektrum nemocničních infekcí. Bakterie je označována za nastupující multirezistentní globální oportunní patogen. Zvýšená incidence infekcí charakteru jak nemocničních, tak komunitních je spojená se signifikantní fatalitou. To představuje varování pro imunosuprimované jedince [12]. Bakteriémie byly známé jen u pacientů s hematologickými malignitami. V následujícím století se objevují sdělení o rizikových faktorech vzniku bakteriémie a vysoké mortalitě u těchto pacientů napříč světadíly. Yeshurun et al. v roce 2010 upozorňují na tento bakteriální kmen jako na původce invazivních bakteriálních infekcí komplikujících transplantace kmenových buněk spojených s vysokou morbiditou i mortalitou. Rovněž tito autoři za dva hlavní rizikové faktory pro vznik bakteriémie vyvolané tímto bakteriálním kmenem považují prolongovanou neutropenii a poškození slizničních bariér v časné post-transplantační fázi [13]. Tento bakteriální kmen bývá nejčastěji izolován z klinického materiálu ze skupiny méně známých gramnegativních nefermentujících bakterií [14].
V naší studii Stenotrophomonas maltophilia byla detekovaná ve 4 případech, 3 krát ve výpusti umývadla v různých místnostech oddělení 5C. V jednom případě byla prokázána stěrem pravé ruky zdravotnického personálu.
Druh Delftia acidovorans byl dříve označován jako Comamonas acidovorans nebo Pseudomonas acidovorans. Patří mezi gramnegativní nefermentující bakterie, s širokým geografickým rozšířením. Nachází se běžně v půdě a vodě. Je považována za nepatogenní bakterii. Nicméně již v roce 1976 Weinstein et al. upozorňují na tuto bakterii jako na možného původce nemocničních infekcí [15]. V současnosti je považována za možného původce endokarditidy, očních infekcí [16] a nemocničních bakteriémií v souvislosti s centrálními venózními katétry především u imunosuprimovaných pacientů [17, 18].
Bakteriální kmen Delftia acidovorans jsme prokázali ve výpusti sprchy sociálního zařízení izolačního pokoje pacienta.
Označení tohoto druhu pochází až z roku 2004. Předtím byl bakteriální kmen Cupriavidus pauculus řazen do CDC skupiny IVc-2. Jedná se o gramnegativní nefermentující pohyblivou tyčku ubikvitérního rozšíření, nachází se v půdě, vodě a také na rostlinách. Bývá izolována z vody, vody ošetřené UV systémem a lahví s minerální vodou. Vzácně považována za patogena. Nicméně je původcem významných onemocnění, především u imunosuprimovaných pacientů, především hemato-onkologických a pacientů s AIDS. U nich vyvolává bakteriémie, septikémie, peritonitidy a abscesy [19]. V mnoha případech zdroj nebo vehikulum této bakterie není identifikováno, pokud ano, pak se jedná o kontaminovanou vodu. Do konce roku 2010 bylo dokumentováno 19 případů nemocničních infekcí (bakteriémie, ventilátorová pneumonie) [20].
V naší studii jsme bakteriální kmen Cupriavidus pauculus prokázaly na vnitřní stěně skříně.
Ochrobactrum anthropi je gramnegativní nefermentující, oxidáza pozitivní aerobní tyčka. Dříve označovaná jako Achromobacter sp. nebo CDC skupina Vd. Je izolována jak z prostředí, především vody, tak z klinického materiálu. V posledních 20 letech je řazena mezi potenciální lidské patogeny, je označována jako původce nemocničních infekcí – bakteriémie v souvislosti s imunosupresivní léčbou nebo centrálními venózními katétry. Dobře adheruje k silikonovému materiálu. Duran et al. ve sdělení z roku 2009 již tuto bakterii označují za patogenní mikroorganismus poslední dekády [21]. Nicméně upozornění na tuto bakterii jako původce vážných nemocničních infekcí u hemato-onkologických pacientů a jedinců po orgánové transplantaci se objevují již počátkem 90. let minulého století [22, 23].
Bakteriální kmen Ochrobactrum anthropi jsme prokázali ve dvou případech, jednalo se o výpusť sprchy na sociálním zařízení pacienta a výpusť dřezu na kuchyňce.
Alcaligenes faecalis je gramnegativní nefermentujcí aerobní tyčka, ubikvitérně rozšířena v půdě a vodě. Bývá izolována ze stolice, sputa a moči. U 5–19 % zdravé populace může být nacházena jako neškodný saprofyt [24]. Může být součástí kožní flóry, nicméně jsou popsány případy sepse, meningitidy, peritonitidy, apendicitidy, endokorditidy, které mohou končit fatálně, protože je rezistentní na běžná antibiotika [25]. Ve zdravotnických zařízeních lze izolovat tento kmen z respirátorů a hemodialyzačních přístrojů. Může být původcem nemocničních infekcí, nebezpečný může být pro imunosuprimované pacienty.
Během epidemiologické studie byl bakteriální kmen Alcaligenes faecalis prokázán na úklidové molitanové stěrce.
Chromobacterium violaceum je gramnegativní pohyblivá bakterie, která vyvolává jen lidská onemocnění. V přírodě se vyskytuje v půdě a vodě tropického a subtropického pásma. Je rezistentní na četná antibiotika [26].
Rod Kingella je gramnegativní nefermentující bakterie, dříve označovaná jako Moraxella. Označení tohoto bakteriálního kmene navrhli v roce 1976 Snell a Lapage. Existují 3 druhy. Nejčastěji bývá izolován druh Kingella kingae. Vyskytuje se jako komensál lidského respiračního traktu, nazofaryngeální nosičství se popisuje asi u 1 % zdravých jedinců. Nebyla známa jeho patogenita. Od roku 1980, kdy byla popsána první endokarditida vyvolaná touto bakterií, existuje ještě několik dokumentovaných případů endokarditidy. Může vyvolat až život ohrožující onemocnění srdce [27, 28]. Invazivní infekce vyvolané touto bakterií se objevují u zdravých dětí, většinou v prvních dvou letech života.
Kingella denitrificans je uváděna jako původce infekce očí a retrofaryngeálního abscesu. U těchto jedinců byla snížena obranyschopnosti – věk nad 70 let nebo aplikace chemoterapeutika [29, 30].
V naší studii byl kultivačně prokázán bakteriální kmen Kingella denitrificans na molitanové úklidové stěrce.
Rod Acinetobacter je striktně aerobní gramnegativní kokobacil, někdy tvoří tyčky až vlákna. Je značně rozšířen v prostředí, zdravotnická zařízení jsou často kontaminována endemickými kmeny. Je charakterizován nízkou virulencí, přesto je spojován s nemocničními infekcemi – pneumonie, bakteriémie, infekce močového a dýchacího traktu. Je uváděn jako původce ventilátorové pneumonie u pacientů na řízeném dýchání [31]. Léčba infekcí je komplikovaná, protože tento kmen je řazen mezi multirezistentní bakterie. V literatuře je uváděna jeho zvyšující se rezistence na antibiotika [32]. V naší studii jsme izolovali v jednom případě bakteriální kmen Acinetobacter lwoffii z výpusti umývadla na kuchyňce.
Závěrem výsledků chceme upozornit na bakteriální kmen, který sice patří do čeledi Enterobacteriaceae, ale v posledních dvou dekádách se změnil jeho význam, je považován za významného původce klinicky závažných onemocnění – je to rod Kluyvera.
Rod Kluyvera spp. je gramnegativní malá, pohyblivá tyčka, kataláza pozitivní, oxidáza negativní z čeledi Enterobacteriaceae. Při prvním jeho popisu z roku 1936 je charakterizován jako benigní saprofyt zažívacího traktu. V životním prostředí se nachází ve vodě, odpadních vodách a půdě. Ve zdravotnických zařízeních bývá izolována. Zahrnuje 4 druhy, ale pouze 2 z nich byly kultivací prokázány v lidském klinickém materiálu: K. ascorbata a K. cryocrescens. Byly prokázány ve vzorcích stolice, sputa, moče atd.
Ke změně pohledu na tuto bakterii došlo v posledních 25 letech, v současnosti je označována za původce klinicky významných onemocnění – bakteriémie a infekce měkkých tkání [33]. Infekce močového traktu u dětí jsou vzácné, nicméně mají stoupající tendenci a měla by jim být věnována pozornost v dětské populaci [34]. Není přesně zřejmé, zda infekce jsou převážně endogenního původu, či se jedná o infekce získané z prostředí, tj. nemocniční infekce. Onemocnění vyvolané tímto bakteriálním kmenem se vyskytují jak u imunosuprimovaných, tak imunokompetentních jedinců.
Bakteriální kmen Kluyvera ascorbata byl izolován ve 3 případech, ve dvou případech se jednalo o výpusť umývadla, jedenkrát byl izolován z výpusti kuchyňského dřezu.
DISKUSE
Před samotnou transplantací je pacient připravován, profylakticky je redukována mikroflóra zažívacího traktu a jsou sanovány možné zánětlivé fokusy. Následuje eliminace buněk kostní dřeně příjemce, snižují se počty leukocytů a nakonec je příjemce granulocytopenický. Počty periferních neutrofilů jsou minimální. Během přípravné a časné postransplantační fáze jsou pacienti hospitalizováni. Engraftment zpravidla trvá 2–4 týdny, délka závisí na mnoha faktorech. Nejvážnější komplikací alogenních transplantací je reakce štěpu proti hostiteli (graft versus host disease = GVHD). V profylaxi GVHD jsou zastoupena jak cytostatika, tak glukokortikoidy. Ty představují léčiva, která jsou řazena mezi exogenní rizikové faktory vzniku infekce. Do této skupiny rizikových faktorů také patří prostředí zdravotnického zařízení, ve kterém se příjemce nachází. Rizikové faktory endogenní jsou vázány na příjemce. Pacient (příjemce) je umístěn do prostředí, kde je minimalizován výskyt jak patogenních, tak podmíněně patogenních mikroorganismů. Jedná se o speciální jednotky intenzivní péče s reverzní izolací. Zde pacient pobývá v době, kdy je nejvyšší riziko vzniku infekce. Jedná se především o prolongovanou neutropenii či poškození sliznic, které představují důležitou bariéru. V souvislosti s léčbou a péčí o tyto pacienty jsou realizovány četné nefyziologické vstupy do organismu, např. centrální venózní nebo močové katétry, které ještě zvyšují riziko vzniku bakteriální infekce. Hygienicko-epidemiologická doporučení pro dekontaminaci a dezinfekci zdravotnických zařízení pro pacienty po transplantaci kmenových buněk jsou obecného charakteru [2].
Každé zdravotnické zařízení, každé oddělení v něm lokalizované má svá mikrobiální osídlení daného prostředí. Kvalitativní i kvantitativní složení mikroorganismů se odvíjí od skladby pacientů, antibiotické politiky, používaných dezinfekčních prostředků, přístrojového a technického vybavení. V současnosti přístrojové vybavení specializovaných oddělení představuje velmi složité prostředí s řadou míst, kde se mohou vyskytovat mikroorganismy nenáročné na živiny a velmi dobře přizpůsobivé atypickým životním podmínkám. Zde je nutná dobrá znalost všech rizikových míst ve spojitosti s technickým vybavením a rovněž znalost mikroorganismů a jejich životních požadavků, které by se v těchto místech mohly vyskytovat. Současným velkým problémem je schopnost tvorby biofilmu u gramnegativních nefermentujících bakterií. V těchto případech se stávají četné dezinfekční přípravky neúčinné [35]. Modelovou bakterií při řešení těchto problémů je nejčastěji kmen Pseudomonas aeruginosa a získané poznatky jsou následně používané i pro jiné bakterie této skupiny. Jak velký problém představuje skupina gramnegativních nefermentujících bakterií v problematice nemocničních infekcí, dokládá samostatná kapitola v knize hlavního autora Mayhall et al. [1].
V úvodu již bylo řečeno, že cílem naší studie bylo upozornit na riziková místa v prostředí zdravotnického zařízení, která mohou být „nikami“ pro přežívání infekčních agens. Jak významné jsou tyto kultivací prokázané bakteriální kmeny jsme se snažili upozornit přímo v souvislosti s jednotlivými nálezy.
Místo závěru si dovolujeme použít slova velmi často citované práce autorů Enoch, Birkett a Ludlam: „Nefermentující gramnegativní bakterie jsou široce rozšířené v prostředí a způsobují zvýšený počet případů těžkých infekcí v nemocnicích, primárně postihují rozrůstající se populaci imunokompromitovaných pacientů po léčebných či chirugických výkonech. Mnohé z nich vykazují multirezistenci na antibiotika. Získání rezistence může pak podporovat jejich rozšíření v nemocnicích. Tyto skutečnosti vyžadují pouze cílenou antibiotickou léčbu a cílenou práci při hygienicko-epidemiologických šetřeních v prostředí“ [3].
Do redakce došlo dne 13. 8. 2012.
Kontaktní adresa:
Doc. RNDr. Ivanka Matoušková
Ústav preventivního lékařství
Lékařská fakulta Univerzity Palackého v Olomouci
Hněvotínská 3
77515 Olomouc
e-mail: matouski@tunw.upol.cz
Zdroje
1. Paitoonpong, L., Neofytos, D., Cosgrove, S. E., Perl., T. M. Infection, Prevention and Control in Hematopoietic Stem Cell – chapter 59; Stosor, V., Hauser, A. R., Flaherty, J. P. Nonfermentative Gram-Negative Bacilli – chapter 35. In Mayhall, C. G. Hospital epidemiology and infection control. Philadelphia: Wolters Kluwer, Lippincott Williams and Wilkins, 2012, Fourt ed., p. 836–872, 520–534.
2. Mackal, C., Fry, T., Gress, R., Peggs, K. et al. Background to hematopoietic cell transplantation, including post transplant immune recovery. Bone Marrow Transplantation, 2009, 44, p. 457–462.
3. Enoch, D. A., Birkett, C. I., Ludlam, H. A. Non-fermentative Gram-negative bacteria. Inter. J. Antimicrobial. Agents, 2007, 29, Suppl. 3, S33–S41.
4. Bieri, S., Roosnek, E., Ozsahin, H., Huguet, S. et al. Outcome and risk factors for late-onset complications 24 months beyond allogeneic hematopoietic stem cell transplantation. Europ. J. Haematol., 2011, 87, p. 138–147.
5. Magauran, C. E., Salgado, C. D. Challenges and Advances in Infection Control of Hematopoietic Stem Cell Transplant Recipients. Infect. Dis – Drug Targets, 2011, 11, p. 18–26.
6. Nagao, M., Iinuma, Y., Igawa, J., Saito, T. et al. Control of an outbreak of carbapenem-resistant Pseudomonas aeruginosa in a haematol-oncology unit. J. Hosp. Infect., 2011,79, p. 49–53.
7. Nyč, O., Matějková, J. Stenotrophomonas maltophilia: Significant contemporary hospital pathogen – review. Folia Microbiol., 2010, 55, 3, p. 286–294.
8. Wilkinson, F. H., Kerr, K. G. Bottled water as a source of multi-resistant Stenotrophomonas and Pseudomonas species for neutropenic patients. Eur. J. Cancer Care, 1998, 7, p. 12–14.
9. Thomas, L., Maillard, J. Y., Lambert, R. J. W., Russell, A. D. Development of resistance to chlorhexidine diacetate in Pseudomonas aeruginosa and the effect of a “residual” concentration. J. Hosp. Infect., 2000, 46, p. 297–303.
10. Spencer, R. C. The emergence of epidemic, multiple-antibiotic-resistant Stenotrophomonas (Xanthomonas) maltophilia and Burkholderia (Pseudomonas) cepacia. J. Hosp. Infect., 1995, 30, p. 453–464.
11. Tada, K., Kurosawa, S., Hiramoto, N., Okinaka, K. et al. Stenotrophomonas maltophilia infection in hematopoietic SCT recipients: high mortality due to pulmonary hemorrhage. Bone Marrow Transplant., 2012 May 28. doi. 10.1038/bmt.2012.87. [Epub ahead of print].
12. Brooke, J. S. Stenotrophomonas maltophilia: an emerging global opportunistic pathogen. Clin. Microbiol. Rev., 2012, 25, 1, p. 2–41.
13. Yeshurun, M., Gafter-Gvili, A., Thelr, M., Keller, N. et al. Clinical characteristics of Stenotrophomonas maltophilia infection in hematopoietic stem cell transplantation recipients: a single center experience. Infection, 2010, 38, p. 211–215.
14. Fihman, V., Le Monnier, A., Corvec, S., Jaureguy, F. et al. Stenotrophomonas maltophilia – The most worrisome threat among unsual non-fermentative gram-negative bacilli from hospitalized patients: A prospective multicenter study. J. Infect., 2012, 64, p. 391–398.
15. Weinstein, R. A., Stamm, W. E., Kramer, L., Corey, L. Pressure monitoring devices. Overlooked source of nosocomial infection. JAMA, 1976, 236, p. 936–938.
16. Ray, M., Lim, D. K. A rare polymicrobial keratitis involving Chryseobacterium meningosepticum and Delftia acidovorans in a cosmetic contact lens wearer. Eye Contact. Lens., 2012 Jan 4. [Epub ahead of print].
17. Chotikanatis, K., Bäcker, M., Rosas-Garcia, G., Hammerschlag, M. R. Recurrent intravascular-catheter-related bacteriemia caused by Delftia acidovorans in a hemodialysis patient. J. Clin. Microbiol., 2011, 49, 9, p. 3418–3421.
18. Kawamura, I, Yagi, T., Hatakeyama, K., Ohkura, T., Ohkura, K., Takahashi, Y., Kojima, S., Hasegawa, Y. Recurrent vascular catheter-related bacteremia caused by Delftia acidovorans with different antimicrobial susceptibility profiles. J. Infect. Chemoter., 2011, 17, p. 111–113.
19. Musso, D., Drancourt, M., Bardot, J., Legre, R. Human infection due to the CDC group IV c-2 bacterium: case report and review. Clin. Infect. Dis., 1994, 18, p. 482–484.
20. Tasbakan, M. S., Yamazhan, T., Aydemir, S., Bacakoglu, F. A case of ventilator-associated pneumonia caused by Cupriavidus pauculus. Mikrobiyol. BUL. 2010, 44, 1, p. 127–131.
21. Duran, R., Vatansever, Ü., Acunas, B., Basaran, Ü. N. Ochrobacterum anthropi bacteremia in a preterm infant with meconium peritonitis. Int. J. Infect. Dis., 2009, 13, e61–e63.
22. Kern, W. V., Oethingerm, M., Kaufhold, A., Rozdzinski, E., Marre, R. Ochrobactrum anthropi bacteriemia: report of four cases and short review. Infection, 1993, 21, 5, p. 306–310.
23. Ezzedine, H., Mourad, M., Van Ossel, C., Logghe, C., Squifflet, J. P., Renault, F., Wauters, G., Gigi, J., Wilmitte, L., Haxhe, J. J. An outbreak of Ochrobactrum anthropi in five organ transplant patients. J. Hosp. Infect., 1994, 27, 1, p. 35–42.
24. Sachdeva, L. D., Bardhan, P. N. Bacteriological study of an Alcaligenes faecalis strain: a food poisoning epidemic. Indian. J. Pathol. Bacteriol., 1963, 37, p. 513–514.
25. Tai, T. Y., Chin, W. T., Wang, F., Hsi, M. S. Bacillus Alcaligenes infections. A clinical analysis of 33 cases. Chin. Med. J. (Engl), 1963, 82, p. 423–431.
26. Zbinden, R., von Grevenitz, A. Actinobacillus, Capnocytophaga, Eikenella, Kingella, Pasteurella, and Other Fastidiuos Rods – chapter 33. In Versalovic J. ed. Manual of Clinical Microbiology. Washington, DC: ASM PRESS, 2011, 10th ed., p. 574–584.
27. Slonim, A., Steiner, M., Yagupsky, P. Immune Response to Invasive Kingella kingae Infections, Age-Related Incidence of Disease, and Levels of Antibody to Outer-Membrane Proteins. CID 2003, 15, p. 521–527.
28. Dubnov-Raz, G., Scheuerman, O., Chodick, G., Finkelstein, Y., Samra, Z., Ben-Zion, G. Invasive Kingella kingae Infections in Children: Clinical and Laboratory Characteristics. Pediatrics, 2008, 122, p. 1305–1309.
29. Kim, Y. H., Panday, V., Reilly, C. Isolation of Kingella denitrificans a corneal ulcer. Cornea, 2011, 30, 4, p. 472–473.
30. Rajanna, D. M., Manickavasagam, J., Jewes, L., Capper, R. Retropharyngeal abscess from an unsual organism-Kingella denitrificans-in a patient on low-dose methotrexate. Ear Nose Throat. J., 2011, 90, 7, E15–17.
31. Playford, E. G., Craig, J. C., Iredell, J. R. Carbapenem-resistant Acinetobacter baumanii in intensive care unit patients: risk factors for acquisition, infection and their consequences. J. Hosp. Infect., 2007, 65, p. 204–211.
32. Bassetti, M., Ginocchio, F., Mikulska, M. New treatment options against gram-negative organism. Critical Care, 2011, 15 : 215. http://ccforum.com/content/15/2/215.
33. Carter, J. E., Evans, T. N. Clinically Significant Kluyvera Infections. Am. J. Clin. Pathol., 2005, 123, p. 334–338.
34. Isozaki, A., Shiraim, K., Mimura, S., Takahashi, M., Furushima, W., Kawano, Y. A case of urinary tract infection caused by Kluyvera ascorbata in an infant: case report and review of the literature. J. Infect. Chemother., 2010, 16, p. 436–438.
35. Simöes, L. C., Lemos, M., Pereira, A. M., Abreu, A. C. et al. Persister cells in a biofilm treated with a biocide. Biofouling 2011, 27, p. 403-11.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo MikrobiológiaČlánok vyšiel v časopise
Epidemiologie, mikrobiologie, imunologie

2012 Číslo 4
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
Najčítanejšie v tomto čísle
- Mikrobiálna dekontaminácia koreňových kanálikov devitálnych zubov
- Vrozený zarděnkový syndrom – kazuistika
- Výskyt gramnegativních nefermentujících bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
- Výskyt gramnegativních bakterií v prostředí transplantační jednotky Hemato-onkologické kliniky FN Olomouc
