-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Séroprevalence Anaplasma phagocytophilum u pacientů se suspektní lymeskou borreliózou
Seroprevalence of Anaplasma phagocytophilum in patients with suspected Lyme borreliosis
Human granulocytic anaplasmosis (HGA) is an emerging tick-borne zoonotic disease caused by an obligate intracellular bacterium, Anaplasma phagocytophilum. In Europe, A. phagocytophilum is transmitted by Ixodes ricinus ticks. After Lyme borreliosis and European tick-borne encephalitis, HGA is the third most common tick-borne infection in the USA and Europe. The clinical symptoms of anaplasmosis are non-specific and include malaise, fever, headache, myalgia, and arthralgia. In more severe cases, the gastrointestinal or respiratory tract may be affected. However, most infections are asymptomatic.
The aim of our study
was to determine the seroprevalence of A. phagocytophilum in patients with suspected Lyme borreliosis.
A total of 314 sera from patients with suspected Lyme borreliosis were screened for IgG and IgM antibodies against A. phagocytophilum. The immunoblot assay was used to detect the antibodies.
Anti-A. phagocytophilum antibodies were detected in 34 patients, i.e. in 10.82 %. IgM antibodies were positive in 19 cases and IgG antibodies in 10 cases. Positivity to both IgM and IgG antibodies was revealed in five patients.
Antibodies against Borrelia burgdorferi sensu lato were detected in 181 patients (57.64 %). Co-seroprevalence of Borrelia burgdorferi s. l. and A. phagocytophilum was found in 26 patients (8.3 %).
Positivity for anti-A. phagocytophilum antibodies was most often seen in samples from the age group 60–69 years.
Our results show that A. phagocytophilum infection is not uncommon in the Czech Republic and should be considered in patients with a history of a tick bite.Keywords:
human granulocytic anaplasmosis – Anaplasma phagocytophilum – seroprevalence – immunoblot – Lyme disease
Autori: M. Dvořáková Heroldová; M. Dvořáčková
Pôsobisko autorov: Mikrobiologický ústav LF MU a FN u sv. Anny
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 4, s. 297-302
Kategória: Souhrnná sdělení, původní práce, kazuistiky
Súhrn
Lidská granulocytární anaplazmóza je emergentní zoonóza vyvolaná obligátní intracelulární bakterií Anaplasma phagocytophilum. A. phagocytophilum je v Evropě přenášena klíštětem obecným (Ixodes ricinus). Anaplazmóza je po lymeské borrelióze a evropské klíšťové encefalitidě třetím nejčastějším onemocněním přenášeným I. ricinus. Anaplazmóza se projevuje nespecifickými příznaky: únavou, teplotou, bolestmi hlavy, svalů a kloubů. Při těžším průběhu může být postižen zažívací nebo dýchací trakt. Průběh infekce je však většinou asymptomatický.
Cílem naší práce bylo zjistit séroprevalenci A. phagocytophilum u pacientů se suspektní lymeskou borreliózou.
Celkem bylo na protilátky proti A. phagocytophilum vyšetřeno 314 sér od pacientů s podezřením na lymeskou borreliózu. Ke stanovení protilátek ve třídách IgM a IgG byla použita metoda imunoblot. Pozitivita anaplazmových protilátek byla zjištěna u 34 vyšetřovaných (10,82 %). Protilátky třídy IgM byly pozitivní v 19 případech a protilátky třídy IgG v 10 případech. U pěti pacientů byla zjištěna pozitivita v obou třídách protilátek. Protilátky proti Borrelia burgdorferi sensu lato byly detekovány u 181 pacientů (57,64 %). Ko-séroprevalence A. phagocytophilum a B. burgdorferi s. l. byla zjištěna ve 26 případech (8,3 %). Nejvíce pozitivních vzorků na anaplazmové protilátky bylo u pacientů ve věkové kategorii 60–69 let.
Naše výsledky ukazují, že nákaza A. phagocytophilum v České republice není vzácností a je na ni třeba pomýšlet v souvislosti s přisátím klíštěte.Klíčová slova:
lidská granulocytární anaplazmóza – Anaplasma phagocytophilum – séroprevalence – imunoblot – lymeská borreliózaÚVOD
Anaplazmóza (lidská granulocytární ehrlichióza) je emergentní zoonóza způsobená bakterií Anaplasma phagocytophilum, která je obligátní intracelulární bakterie náležející do rodu Anaplasma čeledi Anaplasmataceae řádu Rickettsiales [1]. Jejím hlavním přenašečem jsou klíšťata rodu Ixodes. V Evropě je to klíště obecné I. ricinus, které je klíčovým přenašečem dalších závažných zoonóz lymeské borreliózy (LB) a evropské klíšťové encefalitidy (TBE), které se vyskytují i v České republice [2, 3].
Dlouhou dobu byla anaplazmóza, respektive granulocytární ehrlichióza, považována pouze za veterinární problém. U koní byla zaznamenána již ve 30. letech 20. století [4].
První klinické případy humánní anaplazmózy byly popsány až v r. 1994 ve Spojených státech amerických [5], v Evropě pak o 3 roky později ve Slovinsku [6]. V Evropě bylo dosud potvrzeno jen několik klinických případů humánní anaplazmózy [7, 8, 9, 10].
V ČR byla anaplazmóza poprvé diagnostikována u psa [11]. První případy klinicky potvrzené humánní anaplazmózy byly popsány v r. 2002 [12]. Anaplazma infikuje celou řadu domácích i divokých zvířat: kozy, ovce, skot, koně, psy, kočky, vysokou zvěř, drobné hlodavce a hmyzožravce. V Evropě zřejmě představují hlavní rezervoár drobní hlodavci a hmyzožravci [13]. V některých oblastech mohou být hlavním rezervoárem domácí zvířata, např. ovce ve Velké Británii [14, 15]. Úloha vysoké zvěře jako rezervoárových hostitelů zatím není zcela jasná [16].
A. phagocytophilum byla detekována v klíštěti I. ricinus v řadě evropských zemí. Prevalence se pohybuje od 0,3 % až do 33,9 % [13]. Rozdíly v prevalenci souvisí s geografickými podmínkami a vývojovým stadiem klíštěte. U klíšťat nebyl prokázán transovariální přenos anaplazmy [17, 18, 19].
Prací, které se zabývají prevalencí A. phagocytophilum u I. ricinus v České republice, není mnoho. Šikutová et al. [20] uvádějí minimální prevalenci 14,7 %, v tomto případě však byla prokázána pouze 91% homologie s A. phagocytophilum. U klíšťat v pražských parcích byla prokázána prevalence 11,8 % [21]. V další práci byla minimální míra infekce klíšťat sbíraných v parcích 9,4 % a v přírodním lesním ekosystému 1,9 % [22]. Studie byly dělány i s klíšťaty sejmutými z hostitele. Z klíšťat sejmutých z lidí bylo infikováno 1,5 % [21]. Dubská et al. [23] uvádějí 1% prevalenci u klíšťat sbíraných na slavících obecných (Luscinia megarhynchosus).
Inkubační doba anaplazmózy je 5–21 dní [2, 24]. Projevy infekce člověka jsou málo specifické. Symptomy zahrnují vysokou horečku (> 38,5 °C), zimnici, bolesti hlavy, myalgie, nevolnost. Méně obvyklé je nechutenství, artralgie, postižení trávicího traktu (průjem, zvracení, nechutenství), hepatomegalie, splenomegalie, malátnost a neproduktivní kašel. Vzácně je popisovaná vyrážka, není však jasné, zda souvisí s anaplazmózou, přisátím klíštěte nebo koinfekcí s Borrelia burgdorferi sensu lato [4, 7, 18, 25].
Onemocnění je doprovázeno i změnami v laboratorním nálezu. Běžně je popisována leukopenie, neutropenie a trombocytopenie. Anémie není častá. Zvýšené jsou hladiny jaterních enzymů (asparát a alanin aminotransferáz), C-reaktivního proteinu a sedimentace [4, 7]. Nespecifický nález činí diagnostiku anaplazmózy velmi obtížnou a vyžaduje diferenciální diagnostiku zejména s ohledem na možnou klíšťovou encefalitidu (TBE) a lymeskou borreliózu, které se v první fázi projevují stejnými nespecifickými příznaky [7, 26, 27].
Anaplazmóza má rozmanitý průběh od asymptomatického až po fatální. Naprostá většina případů probíhá bezpříznakově. Na druhé straně asi 36 % osob musí být hospitalizováno, 7 % vyžaduje intenzivní nemocniční péči a asi 0,6 % postižených zemře [25, 28, 29]. Mezi komplikace patří meningitidy, gastritidy a atypické pneumonie [2, 18, 25, 30].
Závažnými komplikacemi jsou syndrom septického šoku, akutní respirační selhání, rhabdomyolýza, myokarditida, akutní renální selhání a oportunní mykotické a virové infekce, které souvisí s oslabením imunitního systému [2, 25]. Fatální případy anaplazmózy byly zaznamenány ve Spojených státech amerických. V Evropě má infekce mnohem mírnější průběh. Ve většině případů onemocnění samo odezní během jednoho až dvou týdnů i bez specifické antibiotické terapie [28].
Lékem volby je doxycyklin. Zlepšení stavu pacienta se dostaví už za 24–48 h po zahájení terapie. U těhotných žen a malých dětí lze použít rifampicin [28]. Anaplasma je rezistentní k beta-laktamům, aminoglykosidům a makrolidům [31].
A. phagocytophilum je malá gramnegativní pleomorfní tyčinka (o velikosti 0,2–1,0 µm). Je to obligátní intracelulární bakterie, která napadá granulocyty [1]. Její buněčná stěna nemá typické gramnegativní složení, obsahuje jen malé množství peptidoglykanu a lipopolysacharidu [25, 32]. Neobvyklá stavba buněčné stěny může být příčinou dalších vlastností anaplazmy, pleomorfnosti a citlivosti k mechanickému poškození [32]. Podle Grama se barví špatně, lépe se barví např. podle Giemsy nebo Wrighta [15, 25].
V hostitelských buňkách se množí binárním dělením ve fagozómu, kde vytváří shluky nazývané moruly. Z napadených buněk se uvolňuje exocytozou nebo při jejich lýze [1, 25].
Jak bylo uvedeno výše diagnostika anaplazmózy je poměrně problematická. Důležité jsou anamnestické údaje, zejména přisátí klíštěte před 1–2 týdny. Je několik možností laboratorního průkazu. Nález typických útvarů, morul, v cytoplazmě granulocytů v krevní roztěru barveném podle Giemsy nebo Wrighta. Tato metoda je rychlá, není však příliš spolehlivá. Moruly jsou popisovány v krevním roztěru u 25–75 % akutně nemocných. Jejich záchyt je největší v prvním týdnu infekce. Výsledek mikroskopie rovněž závisí na zkušenosti odečítajícího [2, 33].
Anaplazmy lze jako obligátní intracelulární bakterie kultivovat pouze na buněčných kulturách. K nejpoužívanějším patří lidské promyelocytické leukemické buňky HL 60. Případně je lze kultivovat na buněčných kulturách odvozených z klíšťat [25, 34]. Kultivace se neprovádí v rutinní mikrobiologické laboratoři. Další možností přímého průkazu je metoda PCR, která představuje nejcitlivější metodu přímého průkazu A. phagcytophilum v akutní fázi infekce [7, 24, 28].
Dostupnější je průkaz protilátek, nejčastěji metodou nepřímé imunofluorescence. Vždy je třeba vyšetřovat párové vzorky séra a stanovit vzestup titru protilátek. I v případě stanovení protilátek IgM, protože ty mohou přetrvávat v séru v detekovatelných hladinách až 2 roky po infekci [4]. Protilátky IgG přetrvávají i několik let po prodělané infekci [2]. Důkazem akutní anaplazmózy je čtyřnásobný vzestup titru protilátek [7]. Pro účely laboratorní diagnostiky anaplazmózy bylo vyvinuto i několik ELISA metod. Využití našly hlavně ve veterinární medicíně [35, 36, 37, 38, 39]. Pro průkaz protilátek je možné využít i metodu Western blot [39, 40, 41].
MATERIÁL A METODY
Od dubna 2013 do konce prosince 2013 jsme vyšetřili 314 sér od pacientů s podezřením na lymeskou borreliózu. Z toho 175 sér bylo od žen a 139 od mužů. Vzorky pocházely od pacientů Fakultní nemocnice u sv. Anny v Brně, převážně z neurologické, interní a dermatovenerologické kliniky. Vyšetření bylo provedeno z důvodu vyloučení infekce Borrelia burgdorferi sensu lato. Pacienti zahrnutí do souboru pocházeli z Brna a blízkého okolí. S ohledem na zaměření nemocnice nejsou ve vyšetřeném souboru děti a mladí dospělí. Podle věku jsme pacienty rozdělili do šesti věkových kategorií: < 29, 30–39, 40–49, 50–59, 60–69 a 70 <. Séra byla vyšetřována na pozitivitu protilátek třídy IgM i IgG proti B. burgdorferi s. l. a A. phagocytophilum.
Séra byla testována komerčně dostupnými soupravami Blot-Line Borrelia/HGA IgM a Blot-Line Borrelia/HGA IgG (TestLine Clinical Diagnostics, s. r. o., ČR). Jde o metodu imunoblot, která detekuje protilátky třídy IgM nebo IgG proti rekombinantním antigenům B. burgdorferi s. l. a proti rekombinantnímu vysoce specifickému antigenu p44 A. phagocytophilum (příbalový leták výrobce: TestLine Clinical Diagnostics, s. r. o., ČR). Antigen p44 je hlavní povrchový imunodominantní protein A. phagocytophilum a je hlavním indikátorem protilátkové odpovědi u anaplazmózy [42, 43, 44]. Test byl proveden podle návodu uváděného výrobcem. Ke každé sadě testovaných vzorků byla zařazena pozitivní a negativní kontrola, které jsou součástí každé soupravy. K hodnocení výsledků imunoblotu byl použit analytický software Immunoblot Software verze 1.0.0 (TestLine Clinical Diagnostics, s. r. o., ČR). Tento program hodnotí validitu testu a pozitivitu jednotlivých linií stripu. Pozitivita se hodnotí porovnáním kontrolní tzv. cut-off linie a intenzity testovaných antigenních linií. Program rovněž provádí celkové vyhodnocení testu. Pokud byl výsledek reakce na protilátky proti anaplazmě slabě pozitivní (hraniční), byl vzorek testován opakovaně. V případě opakované hraniční pozitivity byl zařazen do kategorie pozitivních vzorků, protože výrobce uvádí, že citlivost testu Blot-Line Borrelia/HGA odpovídá u protilátek proti anaplazmě silné pozitivitě vzorků v nepřímé imunofluorescenci (příbalový leták TestLine Clinical Diagnostics, s. r. o., ČR).
VÝSLEDKY
Metodou imunoblot jsme stanovili protilátky proti A. phagocytophilum u 314 pacientů se suspektní lymeskou borrelió-zou. Z vyšetřených vzorků bylo 280 (89,17 %) negativních. Pozitivita protilátek IgM byla zjištěna u 19 vzorků (6,05 %), IgG u 10 vzorků (3,18 %) a IgM i IgG u 5 vzorků (1,59 %). Celkem tedy bylo pozitivních 34 testovaných vzorků, což odpovídá 10,82 % (graf 1).
Graf 1. Počet vzorků vyšetřených metodou imunoblot na protilátky IgM a IgG proti <i>A. phagocytophilum</i> Fig. 1. The number of samples assayed by immunoblot for IgM and IgG antibodies to<i>A. phagocytophilum</i> 
Z 34 pozitivních vzorků pocházelo 19 od žen a 15 od mužů. Protilátky IgM byly prokázány u 7 mužů a 12 žen, protilátky IgG u 4 mužů a 6 žen, obě třídy protilátek byly pozitivní u čtyř mužů a jedné ženy. Prevalence protilátek proti A. phagocytophilum činila u mužů 10,79 % a u žen 10,86 %. Není tedy významný rozdíl v séroprevalenci A. phagocytophilum u mužů a žen.
U 26 vzorků byla současně zjištěna pozitivita protilátek proti B. burgdorferi s. l. Ko-séroprevalence A. phagocytophilum a B. burgdorferi s. l. u celého vyšetřovaného souboru 314 pacientů tedy byla 8,3 %. Protilátky jen proti A. phagocytophilum byly zachyceny v osmi případech (2,55 %), ve čtyřech byly pozitivní protilátky IgM, ve dvou IgG a ve dvou IgG i IgM. Pět vzorků pocházelo od žen a tři od mužů.
Protilátky proti B. burgdorferi s. l. byly zjištěny u 181 pacientů z 314 vyšetřovaných, tj. u 57,64 %. Z těchto 181 pacientů s pozitivními protilátkami proti B. burgdorferi s. l. mělo 26 (14,36 %) pozitivní protilátky i proti A. phagocytophilum. Údaje jsou shrnuty v tabulce 1. Séroprevalence A. phagocytophilum u 133 pacientů s negativními protilátkami proti B. burgdorferi s. l. byla 6,02 %.
Tab. 1. Výsledky vyšetření protilátek proti B. burgdorferi s. l.* Table 1. Results of the screening for anti-B. burgdorferi s. l. antibodies* 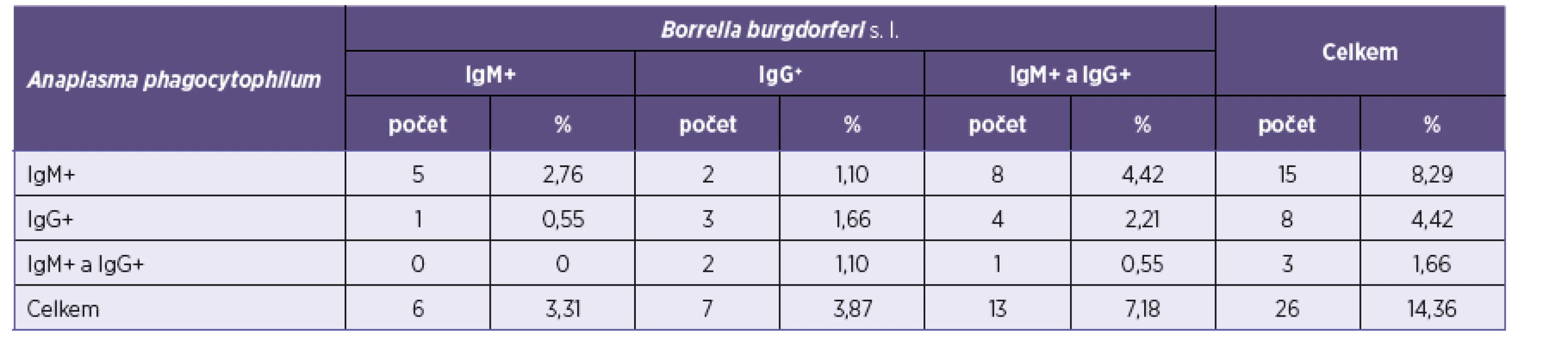
*U pacientů, kteří měli současně pozitivní protilátky proti A. phagocytophilum (celkem mělo pozitivní antiborreliové protilátky 181 pacientů). *In patients positive for antibodies to A. phagocytophilum (181 patients were positive for anti-Borrelia antibodies). Porovnání výsledků přítomnosti protilátek proti A. phagocytophilum v závislosti na věku je uvedeno v tabulce 2. Nejvíce pozitivních vzorků bylo zachyceno ve věkové kategorii 60 až69 let – 11 (16,92 %), následně v kategorii 70 < let – 6 (15,79 %), 50–59 let – 10 (13,7 %), 30–39 let – 4 (6,78 %) a 40–49 let – 2 (4,17 %). Nejméně pozitivních vzorků bylo v kategorii < 29 – jeden (3,23 %).
Tab. 2. Počet pozitivních vzorků na protilátky proti <i>A. phagocytophilum</i> (AP) v jednotlivých věkových kategoriích Table 2. Positivity for anti-<i>A. phagocytophilum</i> (AP) antibodies by age category 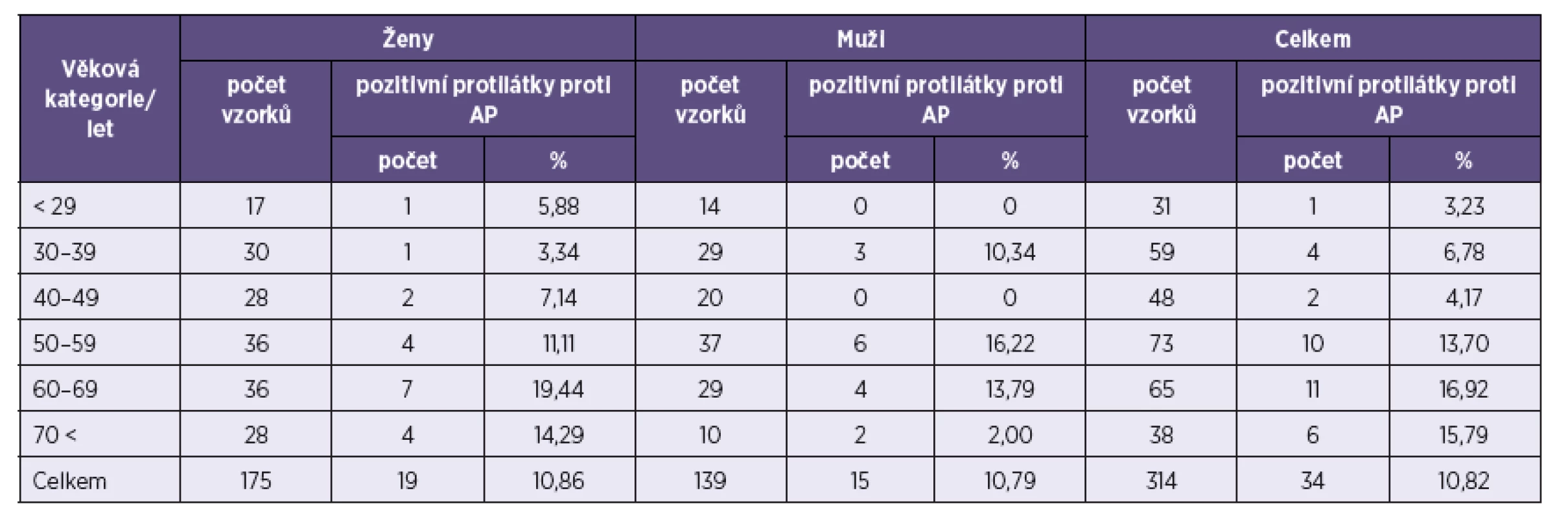
DISKUSE
Lymeská borrelióza a evropská klíšťová encefalitida, zoonózy přenášené klíšťaty, jsou v našich klimatických a geografických podmínkách poměrně běžné. Další infekcí přenášenou klíšťaty, se kterou se můžeme setkat, je anaplazmóza. V USA a v Evropě je dokonce třetí nejčastější infekcí přenášenou klíšťaty rodu Ixodes [29]. A. phagocytophilum byla detekována u klíšťat I. ricinus téměř po celé Evropě [13].
Protilátky proti A. phagocytophilum byly zjištěny u obyvatel řady evropských států, séroprevalence se pohybuje od nízkých hodnot až k 28 % [45]. Ve Španělsku byly detekovány protilátky IgG proti A. phagocytophilum u 1,4 % testovaných v regionu La Rioja [46]. V Polsku byla zjištěna séroprevalence u lesníků 20,6 % [47], v další studii u lesníků 11,8 %, u farmářů 5,1 % a u zdravých dárců krve 9,4 % [48]. U rakouských dárců krve byla prevalence 9 % [49]. V Německu byly protilátky proti A. phagocytophilum zjištěny v jedné studii u 11,4 % a ve druhé 10,8 % vyšetřovaných [50, 51]. Z 361 mladých německých vojáků mělo 14,9 % protilátky proti A. phagocytophilum [52]. Vysoká séroprevalence 21,4 % byla u dárců krve na Krétě [53]. Santino et al. [54] uvádějí v Itálii séroprevalenci 5,7 % u lesníků. U anglických farmářů byla zjištěna séropozitivita 1,5 % [55]. Ve Švédsku byla séropozitivita 28 % [56]. Na středním Slovensku byla zjištěna 25% séroprevalence u osob udávajících přisátí klíštěte [57] a na východním Slovensku pozitivita IgG u 7 % pacientů se suspektní lymeskou borreliózou [58]. Z výsledků studií je patrné, že prevalence protilátek proti A. phagocytophilum je v Evropě u rizikových skupin, jako jsou lesní dělníci, pacienti s podezřením na lymeskou borreliózu, TBE a lidé uvádějící v anamnéze přisátí klíštěte, poměrně vysoká.
V našem studovaném souboru 314 pacientů z Brna a blízkého okolí, u kterých bylo podezření na lymeskou borreliózu, jsme zjistili celkovou séropozitivitu IgM/IgG 10,82 %. Balátová et al. [59] uvádějí u podobného souboru testovaných 21,8 % pozitivních vzorků, 14,5 % ve třídě IgM a 7,8 % ve třídě IgG, pouze jednou zaznamenali pozitivitu IgG i IgM. V našem souboru bylo také nejvíce pozitivních vzorků ve třídě IgM 6,05 %. Zeman et al. [60] zjistili v r. 2002 pozitivitu IgG proti A. phagocytophilum u 8,9 % pacientů s podezřením na TBE a v r. 2007 u 9,9 % [41].
Ze 181 pacientů s pozitivními protilátkami proti B. burgdorferi s. l. jsme protilátky proti A. phagocytophilum detekovali u 14,36 %. Hulínská et al. [61] prokázali přítomnost protilátek IgM proti A. phagocytophilum u 10,6 % českých pacientů s erythema migrans. Lásiková et al. [62] testovali protilátky proti A. phagocytophilum u pacientů s neuroborreliózou z FN Bulovka. Pozitivitu protilátek zjistili u 19,6 % pacientů, 14,2 % IgM pozitivních, 8,9 % IgG pozitivních, a IgM a IgG 3,5 % pozitivních. Ve studii z roku 2011 byly protilátky proti A. phagocytophilum prokázány u 18,5 % s pozitivními protilátkami proti B. burgdorferi s. l. [59]. Je ovšem nutné poznamenat, že z pouhé současné detekce protilátek proti oběma agens nelze říci, zda jde o koinfekci nebo následnou infekci [47].
Naše výsledky jsou srovnatelné s daty ostatních evropských autorů. Nejvíce se blíží výsledkům získaným v Německu a Polsku [48, 50, 51]. Z hlediska ČR jsme zjistili o něco nižší séropozitivitu, než uvádějí další autoři. Rozdíly v séroepidemiologických studiích mohou být dány tím, že metody nepřímé imunofluorescence, které pro průkaz protilátek proti A. phagycytophilum převažují, nejsou standardizovány. Používají se různé antigeny a její interpretace je navíc do jisté míry subjektivní [45]. My jsme použili komerčně dostupný imunoblot se specifickým antigenem p44. K rozdílným výsledkům mohou částečně přispívat i odlišné geografické lokality a klimatické podmínky. Výsledky jednotlivých studií mohou být také ovlivněny různou prevalencí A. phagocytophilum v klíšťatech v různých letech [63].
Naše výsledky týkající se pozitivity protilátek proti A. phagocytophilum s ohledem na věk pacientů odpovídají údajům uváděným v literatuře. Séropozitivita se zvyšuje s přibývajícím věkem [45]. Nejvíce pozitivních vzorků jsme zjistili ve vyšších věkových kategoriích. Kociánová et al. [57] prokázali nejvíce pozitivních vzorků u pacientů ve věku 20–56 let (38,7 %) a druhou nejpočetnější skupinou byly pacienti ve věku nad 56 let (31,7 %). Kalinová et al. [58] měli nejvíce pozitivních vzorků od pacientů ve věku 20–29 let (15,6 %) a pak ve věku 50–59 let (10,6 %).
Naše práce přispívá ke studiu humánní granulocytární anaplazmózy v ČR. Stejně jako výsledky dalších českých autorů ukazuje, že výskyt anaplazmózy není vzácností a je na ni třeba pomýšlet u rizikových skupin osob, zejména pokud pacienti uvádějí v anamnéze přisátí klíštěte.
Práce byla podpořena projektem specifického výzkum LF MU v Brně MUNI/A/0924/2013.
Do redakce došlo dne 20. 4. 2014.
Adresa pro korespondenci:
Mgr. Monika Dvořáková Heroldová, Ph.D.
Mikrobiologický ústav LF MU a FNUSA
Pekařská 53
Brno 656 91
e-mail: monika.heroldova@fnusa.cz
Zdroje
1. Dumler JS, Barbet AF, Broker CP, Dasch GA, et al. Reorganization of genera in the families Rickettsiaceae and Anaplasmataceae in the order Rickettsiales: unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with Neorickettsia, descriptions of six new species combinations and designation of Ehrlichia equi and „HGE agent“ as subjective synonyms of Ehrlichia phagocytophila. Int. J. Syst. Evol. Microbiol., 2001;51 : 2145–2165.
2. Dumler JS, Madigan JE, Pusterla N, Bakken JS. Ehrlichioses in Humans: Epidemiology, clinical presentation, diagnosis, and treatment. Clin Infect Dis, 2007;45:S45–51.
3. Infekce v ČR - EPIDAT. Vybrané infekční nemoci v ČR v letech 2004–2013 [on line]. [cit. 2014-03-13] Dostupné z http://www.szu.cz/publikace/data/infekce-v-cr-v-letech-2004-2013-absolutne.
4. Blanco JR, Oteo JA. Human granulocytic ehrlichiosis in Europe. Clin Microb Infect Dis, 2002;8 : 763–772.
5. Chen SM, Dumler JS, Bakken JS, Walker DH. Identification of granulocytotropic Ehrlichia species as the etiologic agent of human disease, J Clin Microbiol, 1994;32 : 589–595.
6. Petrovec M, Lotric-Furlan S, Zupanc TA, Strle F, et al. Human disease in Europe caused by a granulocytic Ehrlichia species. J Clin Microbiol, 1997;35 : 1156–1159.
7. Brouqui P, Bacellar F, Baranton G, Birtles RJ, et al. Guidelines for the diagnosis of tick-borne bacterial diseases in Europe. Clin Microbiol Infect, 2005;10 : 1108–1132.
8. Mastrandrea S, Mura MS, Tola S, Patta C, et al. Two cases of human granulocytic ehrlichiosis in Sardinia, Italy confirmed by PCR. Ann N Y Acad Sci, 2006;1078 : 548–551.
9. Nováková M, Víchová B, Majláthová V, Lesňáková A, et al. First case of human granylocytic anaplasmosis from Slovakia. Ann Agric Environ Med, 2010;17 : 173–175.
10. Vogl UM, Presterl E, Stanek G, Ramharter M, et al. First described case of human granulocytic anaplasmosis in patient in Eastern Austria. Wien Med Wochenschr, 2010;160 : 91–93.
11. Melter O, Stehlík I, Kinská H, Volfová I, et al. Infection with Anaplasma phagocytophilum in a young dog: a case report. Veterinární medicína, 2007;52 : 207–212.
12. Hulínská D, Votypka J, Plch J, Vlček E, et al. Molecular and microscopical evidence of Ehrlichia spp. and Borrelia burgdorferi sensu lato in patients, animals and ticks in the Czech republic. Microbiologica, 2002;25 : 437–448.
13. Stuen S, Granquist EG, Silaghi C. Anaplasma phagocytophilum – a widespread multi-host pathogen with highly adaptive strategie Frontiers in cellular and infection mikrobiology, 2013;3 : 1–33.
14. Ogden NH, Bown K, Horrocks BK, Woldehiwet Z, et al. Granulocytic Ehrlichia infection in ixodid ticks and mammals in woodlands and uplands of the U.K. Med Vet Entomol, 1998;12 : 423–429.
15. Ogden NH, Woldehiwet Z, Hart CA. Granulocytic ehrlichiosis: an emerging or rediscovered tick-borne disease? J Med Microbiol, 1998;47 : 475–482.
16. Scharf W, Schauer S, Freyburger F, Petrovec M, et al. Distinct host species correlate with Anaplasma phagocytophilum ankA gene clusters. J Clin Microbiol, 2011;49 : 790–796.
17. Parola P, Davoust B, Raoult D. Tick - and flea-borne rickettsial emerging zoonoses, Vet Res, 2005;36 : 469–492.
18. Bakken JS, Dumler JS. Human granulocytic ehrlichiosis. Clin Infect Dis, 2000;31 : 554–560.
19. Smrdel KS, Serdt M, Duh D, Knap N, et al. A. Anaplasma phagocytophilum in ticks in Slovenia. Parasit. Vectors, 2010;3: doi10.1186/1756-3305-3-102.
20. Šikutová S, Rudolf I, Golovchenko M, Rudenko N, et al. Detection of Anaplasma DNA in Ixodes ricinus ticks: Pitfalls. Folia Parasitologova, 2007;54 : 210–312.
21. Hulínská D, Votýpka JA, Holinková N, Kurzová Z, et al. Průkaz Borrelia, Anaplasma, Bartonella a Rickettsia sp. v klíšťatech Ixodes ricinus v roce 2007 a 2008 v pražských parcích. Zprávy CEM, 2009;18 : 167–171.
22. Venclíková K, Rudolf I, Mendel J, Betasova L, et al. Rickettsie in Ixodes ricinus ticks in the Czech Republic. Ticks Tick Borne Dis, 2014;5 : 135–138.
23. Dubská L, Literák I, Kverek P, Roubalová E, Kociánová E, Taragelová V. Tick-borne zoonotic pathogens in ticks feeding on the common ninghtingale including a novel strain of Rickettsia sp. Ticks Tick Borne Dis, 2012;3 : 265–268.
24. Thomas RJ, Dumler JS, Carlyon JA. Current managment of human granulocytic anaplasmosis, human monocytic ehrlichiosis and Ehrlichia ewingii ehrlichiosis. Expert. Rev. Anti Infect Ther, 2009;7 : 709–722.
25. Dumler JS, Choi KS, Garcia-Garcia JC, Barat NS, et al. Human granulocytic anaplasmosis and Anapalsma phagocytophilum, Emerg Infect Dis, 2005;11(12):1828–1834.
26. Lotric-Furlan S, Strle F. Thrombocytopenia - a common finding in the initial phase of tick-borne encephalitis. Infection, 1995;23 : 203–206.
27. Lotric-Furlan S, Petrovec M, Avsic-Zupanc T, Strle F. Concomitant tick-borne encephalitis and human granulocytic ehrlichiosis. Emerg Infect Dis, 2005;11 : 485–488.
28. Bakken JS, Dumler JS. Clinical diagnosis and treatment of human granulocytotropic anaplasmosis. Ann NY Acad Sci, 2006;1078 : 236–247.
29. Dumler JS. The biological basis of severe outcomes in Anaplasma phagocytophilum infection. FEMS Immunol Med Microbiol, 2012;64 : 13–20.
30. Remy V, Hansmann Y, De Martino S, Christmann D, et al. Human anaplasmosis presenting as atypical pneumonitis in France. Clin Infect Dis, 2003;37 : 846–848.
31. Swanson SJ, Neitzel D, Reed KD, Belongia EA. Coinfections acquired from Ixodes ticks. Clin Microbiol Reviews, 2006;19 : 708–727.
32. Lin M, Rikihisa Y. Ehrlichia chaffeensis and Anaplasma phagocytophilum lack genes for lipid A biosynthesis and incorporate cholesterol for their survival. Infect Immun, 2003;71 : 5324–5331.
33. Bakken JS, Haller I, Riddell D, Walls JJ, et al. The serological response of patiens infected with the agent of human granulocytic ehrlichiosis. Clin Infect Dis, 2002;34 : 22–27.
34. Aureli S, Foley JE, Galuppi R, Rejmanek D, et al. Anaplasma phagocytophilum in ticks from parks in the Emilia-Romagna region of northern Italy. Veterinaria Italiana, 2012;48 : 413–423.
35. Alleman AR, Barbet AF, Sorenson HL, Strik NI, et al. Cloning and expression of the gene encoding the major surface protein 5 (MPSP5) of Anaplasma phagocytophilum and potential application for serodiagnosis. Vet Clin Pathol, 2006;35 : 418–425.
36. Magnarelli LA, Jdo JW, Ramakrishnan U, Henderson DW, Stafford III KC, Fikrig E. Use of recombinant antigens of Borrelia burgdorferi and Anaplasma phagocytophilum in enzyme-linked immunosorbent assay to detect antibodies in white-tailed deer. J Wildlife Dis, 2004;40 : 249–258.
37. Hansen MG, Christoffersen M, Thuesen LR, Petersen MR, et al. Seroprevalence of Borrelia burgdorferi and Anaplasma phagocytophilum in Danish horses. Acta Vet Scand, 2010;52:doi: 10.1186/1751-0147-52-3.
38. Woldehiwet Z, Yavari C. Evaluation of an indirect enzyme-linked immunosorbent assay (ELISA) for detection of antibodies against Anaplasma phagocytophilum in sheep. J Comp Pathol, 2012; 146 : 116–121.
39. Graf PCF, Chretien JP, Ung L, Gaydos JC, et al. Prevalence of seropositivity to spoted fever group rickettsiae and Anaplasma phagocytophilum in a large, demographically diverse US Sample. Clin Infect Dis, 2008;46 : 70–77.
40. Heo EJ, Park JH, Koo RJ, Park MS, et al. S. Serologic and molecular detection of Ehrlichia chaffeensis and Anaplasma phagocytophilum (human granulocytic ehrlichiosis agent) in Korean patiens. J Clin Microbiol, 2002;40 : 3082–3085.
41. Zeman P, Pazdiora P, Chmelík V, Januska J, et al. Epidemiological survey of tick-borne encephalitis virus and Anaplasma phagocytophilum co-infections in patiens from regions of the Czech republic endemic for tick-borne diseases. Wien Klin Wochenschr, 2007;119/17-18 : 538–543.
42. IJdo JW, Zhang Y, Hodzic E, Magnarelli LA, et al. The early hukotal response in human granuocytic ehrlichiosis. J Infect Dis, 1997;176 : 687–692.
43. Zhi N, Ohashi N, Rikihisa Y, Horowitz HW, et al. Cloning and expres-sion of the 44-kilodalton major outer membráně protein gene of the human granulocytic ehrlichiosis agent and application of the recombinant protein to serodiagnosis. J Clin Microbiol, 1998;36 : 1666–1673.
44. Magnarelli L, IJdo J, Wu C, Fikrig E. Recombinant protein-44-based class-specific enzyme-linked immunosorbent assay for serologic diagnosis of human granulocytic ehrlichiosis. Eur J Clin microbiol Infect Dis, 2001;20 : 482–485.
45. Strle F. Human granulocytic ehrlichiosis in Europe. Int J Med Microbiol, 2004;293 suppl. 37 : 27–35.
46. Oteo JA, Gil H, Barral M, Perez A, et al. Presence of granulocytic ehrlichia in ticks and serological evidence of human infection in La Rioja, Spain. Epidemiol Infect, 2001;127 : 353–358.
47. Tomasiewicz K, Modrzewska R, Buczek A, Stańczak J, et al. The risk of exposure to Anaplasma phagocytophilum infection in mid-eastern Poland. Ann Agric Environ Med, 2004;11 : 261–264.
48. Chmielewska-Badora J, Moniuszko A, Żukiewicz-Sobczak W, Zwoliński J, et al. Serological survey in persons occupationally exposed to tick-borne pathogens in cases of co-infections with Borrelia burgdorferi, Anaplasma phagocytophilum, Bartonella spp. and Babesia microti. Ann Agric Environ Med, 2012;19 : 271–274.
49. Walder G, Tiwald G, Dietrich MP, Würzner R. Serological evidence for human granulocytic ehrlichiosis in Western Austria. Eur J Clin Microbiol Infect Dis, 2003;22 : 543–547.
50. Fingerle V, Goodman JL, Johnson RC, Kurtti TJ, et al. Human granulocytic ehrlichiosis in southern Germany: increased seroprevalence in high-risk groups. J Clin Microbiol, 1997;35 : 3244–3247.
51. Hunfeld KP, Brade V. Prevalence of antibodies against the human granulocytic ehrlichiosis agent in Lyme borreliosis patiens from Germany. Eur J Clin Microbiol Infect Dis, 1999;18 : 221–224.
52. Woessner R, Gaertner BC, Grauer MT, Weber K, et al. Incidence and prevalence of infection with human granulocytic ehrlichiosis agent in Germany. A prospective study in young healthy subjects. Infection, 2001;29 : 271–273.
53. Chochlakis D, Papaeustathious A, Minadakis G, Osaroulaki A, et al. A serosurvey of Anaplasma phagocytophilum in blood donors in Crete, Greece. Eur J Clin Microbiol Infect Dis, 2008;27 : 473–475.
54. Santino I, Cammarata E, Franco S, Galdiero F, et al. Multicentric study of seroprevalence of Borrelia burgdorferi and Anaplasma phagocytophilum in high-risk groups in regions of central and southern Italy. Int J Immunopathol Pharmacol, 2004;17 : 219–223.
55. Thomas DR, Sillis M, Coleman TJ, Kench SM, et al. Low rates of ehrlichiosis and Lyme borreliosis in English farmworkers. Epidemiol Infect, 1998;121 : 609–614.
56. Wittesjö B, Bjöersdorff A, Eliasson I, Berglund J. First long-term study of the seroresponse to the agent of human granulocytic ehrlichiosis aminy resident sof a tick-endemic area of Sweden. Eur J Clin Microbiol Infect Dis, 2001;20 : 173–178.
57. Kociánová E, Košťanová Z, Štefanidesová K, Špitálská E, Boldiš V, Hučková D, Stanek G. Serologic evidence of Anaplasma phgocytophilum infections in patiens with a history of tick bite in central Slovakia. Wien Klin Wochenschr, 2008;120/13-14 : 427–431.
58. Kalinová Z, Halánová M, Čisláková L, Sulinová Z, et al. Occurence of IgG antibodies to Anaplasma phagocytophilum in humans suspected of Lyme borreliosis in eastern Slovakia. Ann Agric Environ Med, 2009;16 : 285–288.
59. Balátová P, Kurzová Z, Hulínská D. Sérologie lymeské borreliózy a humánní granulocytární ehrlichiózy v letech 2005–2010. Epidemiol Mikrobiol Imunol, 2011;60 : 74–76.
60. Zeman P, Pazdiora P, Cintal J. HGE antibodies in sera of patiens with TBE in the Czech Republic. Int J Med Microbiol, 2002;291 Suppl. 33 : 190–193.
61. Hulínská D, Votýpka JA, Vaňousová D, Hercogová J, et al. Identification of Anaplasma phagocytophilum and Borrelia burgdorferi sensu lato in Patiens with Erythema Migrans. Folia Microbiol, 2009;54 : 246–256.
62. Lásiková Š, Pícha D, Moravcová L. Sérové HGE (human granulocytic ehrlichiosis) protilátky u pacientů s lymeskou boréliózou v České republice. Klin Mikrobiol Inf Lék, 2000;6 : 112–115.
63. Horowitz HW, Aguero-Rosenfeld ME, Holmgren D, McKenna D, et al. Lyme disease and human granulocytic anaplasmosis coinfection: Impact of case definition on coinfection rates and illness severity. Clin Infect Dis, 2013;56 : 93–99.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek Rejstříky
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2014 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Prevalenční studie nozokomiálních nákaz ve fakultních nemocnicích v České republice
- Epidémia vírusových hepatitíd B a C u hospitalizovaných onkologických pacientov
- Vstup do léčby a adherence k léčbě VHC u injekčních uživatelů drog v ČR
- Trend pertuse u dětí do jednoho roku života v České republice v letech 1997–2013
- Současnost klinických studií očkovacích látek v České republice
- Epidemiologie a rizikové faktory u legionelózy
-
Infekce způsobené netyfovými sérovary salmonel na Klinice infekčních chorob
Fakultní nemocnice Brno v letech 2011–2013 – retrospektivní studie - Séroprevalence Anaplasma phagocytophilum u pacientů se suspektní lymeskou borreliózou
- Ojedinělý případ izolovaného výskytu Mycobacterium tuberculosis v perikardiálním výpotku
- Surveillance západonilské horečky u koní v České republice v letech 2011–2013
- 26. Pečenkovy epidemiologické dny Luhačovice 16.–18. září 2014
- Rejstříky
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Prevalenční studie nozokomiálních nákaz ve fakultních nemocnicích v České republice
- Séroprevalence Anaplasma phagocytophilum u pacientů se suspektní lymeskou borreliózou
- Současnost klinických studií očkovacích látek v České republice
-
Infekce způsobené netyfovými sérovary salmonel na Klinice infekčních chorob
Fakultní nemocnice Brno v letech 2011–2013 – retrospektivní studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



