-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sekvenace enterovirů jako nový přístup k laboratorní diagnostice pro klinické i epidemiologické účely
Enterovirus sequencing as a new approach to the laboratory diagnosis for clinical and epidemiological purposes
Objective:
Introducing enterovirus sequencing as an advanced approach to classify the viruses isolated according to the novel nomenclature and to characterize isolates in detail.Material and methods:
Seventy-five specimens collected from 64 patients in two hospitals, Liberec Regional Hospital, and Plzeň University Hospital, were analyzed. The study patients' age ranged from four to 54 years, with a median of 15 years in males and 16 years in females. In most patients, the reasons for admission were intense headache, fever, vomiting, tiredness, meningeal symptoms, intestinal symptoms (in two patients), and skin symptoms (in one patient). The speci-mens collected were rectal and throat swabs, cerebrospinal fluid (CSF) and stool specimens. Molecular detection and typing were performed using the RT-PCR method. A segment of the 5´non-coding RNA was selected for typing. Specimens were amplified using single-step PCR with external primers and with the same primers extended to include M13 sequen-ces (Generi-Biotech). The LASERGENE software (DIASTAR) was used in sequence editing, alignment, and quality check. The sequences obtained were checked against the central GenBank sequence database using the BLAST algorithm.Results:
The identification of the study isolates resulted in 61 ECHO viruses 30, three coxsackie viruses B1, one coxsackie virus B3, one coxsackie virus A9, one enterovirus 86, one enterovirus 71, Two ECHO viruses 13/coxsackie virus B5, one ECHO virus 7/30/coxsackie virus B4, one coxsackie virus B4/enterovirus B, one enterovirus 87/ECHO virus 30/enterovirus B, and one ECHO virus 3. All viruses isolated, except enterovirus 71 classified into group A, were of group B.Conclusion:
The enteroviruses were identified unambigously, although the sequencing only targeted a short, conserved segment that showed considerable variability. The sequencing was an effective alternative to enterovirus identification by the neutralisation test and allowed for detailed characterization of the isolates. The predominance of ECHO 30 as the cause of aseptic meningitis is in accordance with the literature data.Keywords:
sequencing – enteroviruses – aseptic meningitis
Autori: P. Rainetová 1; H. Jiřincová 1; M. Musílek 1
; Lucie Nováková 1; I. Vodičková 1; V. Štruncová 2; M. Švecová 2; P. Pazdiora 3
; N. Piskunová 4; P. Trubač 4; T. Zajíc 3; M. Havlíčková 1
Pôsobisko autorov: Státní zdravotní ústav Praha, Centrum pro epidemiologii a mikrobiologii 1; Fakultní nemocnice, Plzeň, Ústav mikrobiologie, Infekční klinika 2; Lékařská fakulta UK v Plzni, Ústav epidemiologie 3; Krajská nemocnice Liberec a. s., Centrum laboratorní medicíny 4; Nemocnice v Českých Budějovicích, Laboratoř molekulární biologie a genetiky 5
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 2, s. 102-106
Kategória: Původní práce
Súhrn
Cíl práce:
Zavedení sekvenace enterovirů jako progresivní metody umožňující zařazení izolovaných virů podle nové nomenklatury a detailní posouzení charakteru izolátu.Materiál a metody:
Bylo analyzováno 75 vzorků pocházejících od 64 pacientů ze 2 pracovišť – Krajské nemocnice v Liberci a Fakultní nemocnice Plzeň. Věk sledovaných pacientů se pohyboval v intervalu od 4 do 54 let, medián věku byl 15 let u mužů a 16 let u žen. Důvodem hospitalizace byly u převažujícího počtu pacientů intenzivní bolesti hlavy, horečky, zvracení, únava, meningeální příznaky, u dvou pacientů byly příznaky střevní a u jednoho kožní. Vyšetřované vzorky byly výtěry z rekta, krku, mozkomíšní moky a stolice. Molekulární detekce a typizace byla provedena s využitím metody RT-PCR. Pro typizaci byl vybrán úsek z nekódující oblasti 5´RNA. Vzorky byly amplifikovány jednokrokovou PCR s vnějšími primery a se stejnými primery prodlouženými o M13 sekvence (Generi-Biotech). Editace, sestava a kvalitativní analýza sekvencí byla provedena pomocí programu LASERGENE (DIASTAR). Získané sekvence byly vyhodnoceny centrální databází sekvencí GenBank pomocí algoritmu BLAST.Výsledky:
V izolátech jsme identifikovali 61 ECHO virů 30, 3 coxsackieviry B1, 1 coxsackievirus B3, 1 coxsackievirus A9, 1 enterovirus 86, 1 enterovirus 71, 2 ECHO virus 13/ coxsackievirus B5, 1 ECHO virus 7/30/coxsackievirus B4, 1 coxsackievirus B4/enterovirus B, 1 enterovirus 87/ECHO virus 30/enterovirus B a 1 ECHO virus 3. Všechny izolované viry, mimo enteroviru 71 patřícího do skupiny A, spadají do skupiny B.Závěr:
Enteroviry bylo možné jednoznačně identifikovat, ačkoliv byl sekvenován krátký konzervativní úsek se značnou variabilitou. Sekvenace v plné míře nahradila bližší určování enterovirů virusneutralizací a umožnila detailní posouzení izolátů. Převaha ECHO 30 jako kauzálního agens vyvolávajícího aseptické meningitidy je ve shodě s literárními údaji.Klíčová slova:
sekvence – enteroviry – aseptické meningitidyÚVOD
Enteroviry odvozují své označení od schopnosti replikovat se v epiteliálních buňkách zažívacího traktu a patří mezi hlavní vyvolavatele virových neuroinfekcí v dětském věku. Jejich virová RNA obsahuje přibližně 7 400 párů bazí a genom kóduje 11 proteinů. V současnosti mají enteroviry již více než 100 různých zástupců, kteří jsou začleněni do čeledi Picornaviridae. Enteroviry byly původně rozděleny do 5 skupin: coxsackieviry A (CAV – 23 sérotypů) a coxsackie viry B (CVB – 6 sérotypů), polioviry (PV – 3 sérotypy), ECHO viry (E – 28 sérotypů) a enteroviry (EV) 68–71. Tato klasifikace byla vytvořena na základě virové struktury, typu permisivní tkáňové kultury a spektru vyvolávaných onemocnění a klinických příznaků. V současnosti je klasifikace založena na struktuře genomu viru a enteroviry se dělí do 4 skupin: A, B, C a D.
- Skupina A: EV71, CVA16, CVA2-8, CVA10, CVA12, CVA16 EV89-92
- Skupina B: CVA9, CVB1-6, většina echovirů a některé nové EV
- Skupina C: PV1-3, většina CVA a některé nové EV
- Skupina D: EV68, EV70 a EV94
Enteroviry jsou zařazeny do téže skupiny (téhož sérotypu) za předpokladu, že v proteinu VP1 (zevní, imunodominantní kapsidový protein) je dosaženo minimálně 75% nukleotidové shody. Právě molekulární typování otevřelo cestu k objevu řady nových enterovirů. Projevy enterovirových infekcí mají široký rozptyl – od benigního krátkého horečnatého onemocnění (více než 90 % infekcí) až po závažné, život ohrožující stavy. Enteroviry vyvolávají řadu klinických obrazů a syndromů (syndrom ruka-noha-ústa, herpangína, myokarditida, kardiomyopatie, pleurodynie, hepatitida atd). Patří k neurotropním virům, proto jsou téměř vždy zaznamenány neurologické komplikace onemocnění. Jejich škála je poměrně široká – od aseptických meningitid přes paretická onemocnění až po vzácné fatální encefalitidy. Nejzávažnější neurologické komplikace byly popsány u poliovirů 1–3.
V ČR byl v letním období roku 2013 zaznamenán nárůst pacientů hospitalizovaných s bolestmi hlavy, horečkou, meningeálními příznaky, nauzeou a zvracením. Podle údajů z databáze EPIDAT bylo v roce 2013 zachyceno nejvíce případů virové meningitidy způsobené enteroviry od roku 2004.
MATERIÁL A METODY
1. Klinický materiál: sběr probíhal od června do listopadu 2013 a byl podmíněn relativně vysokým výskytem enterovirových aseptických meningitid. Materiály byly do SZÚ zaslány ze 2 pracovišť – z Krajské nemocnice, a. s., Liberec a z Fakultní nemocnice Plzeň. Jednalo o mozkomíšní moky, výtěry z rekta, výtěry z krku a stolice. Všichni pacienti z liberecké nemocnice měli bydliště v okrese Liberec, biologický materiál byl zaslán jednorázově. Pacienti z Plzně byli ze 4 okresů Plzeňského kraje; jejich onemocnění probíhala v celém sledovaném období.
2. Zpracování materiálu: U libereckých pacientů byl k vyšetření použit materiál bez předchozí izolace na tkáňových kulturách. Jednalo se o 11 mozkomíšních moků (MM) a 1 stolici. Z FN Plzeň bylo zasláno celkem 63 vzorků od 53 pacientů – 46 výtěrů z rekta, 11 MM, 2 stolice a 4 výtěry z krku. U 44 pacientů byl vyšetřen pouze jeden vzorek – výtěr z rekta, MM nebo stolice. U 8 pacientů byly vyšetřeny 2 vzorky – z toho u 6 výtěry z rekta a MM, u 2 výtěry z krku a rekta. U jednoho pacienta se podařily vyšetřit dokonce 3 materiály – MM, výtěr z krku a rekta. U všech těchto materiálů proběhla na pracovišti Ústavu mikrobiologie FN v Plzni izolace viru na tkáňových kulturách – LEP a VERO. Mimo jednoho materiálu byl u všech cytopatický efekt na tkáňových kulturách LEP. U 51 vzorků byl objeven cytopatický efekt již v 1. pasáži, u 11 vzorků až v 2. pasáži. Jen u jednoho vzorku byl cytopatický efekt pozorován i v 2. pasáži na tkáňových kulturách VERO a u jednoho jen v 1. pasáži VERO 3. Molekulární detekce a typizace byla provedena v NRL pro enteroviry (SZU) s využitím metody RT-PCR [1,3]. Pro typizaci byl vybrán úsek z nekódující oblasti 5´RNA. Vzorky byly amplifikovány jednokrokovou PCR s vnějšími primery vycházejícími z publikace [1] a se stejnými primery prodlouženými o M13 sekvence (Generi-Biotech). Vzorky z Liberce byly vyšetřovány přímo bez kultivace, vzorky z Plzně byly nejdříve kultivovány v buněčném systému LEP [2]. Celková RNA byla extrahována přímo z 200 ml moku, suspenze stolice nebo tkáňového izolátu. Pět mikrolitrů tohoto izolátu RNA bylo použito pro amplifikaci v celkovém objemu 25 µl [1]. Následně byly jednotlivé vzorky zkontrolovány elektroforézou, zda obsahují amplifikační produkt o 197 bp. Po prvním pročistění byly provedeny další amplifikace se stejnými primery a následovalo druhé čistění. Získané izoláty byly podrobeny parciálnímu sekvenování na přístroji ABI PRISM 3130 xL (APPLIED BIOSYSTEMS). Editace, sestava a kvalitativní analýza sekvencí byly provedenya pomocí programu LASERGENE (DIASTAR). Získané sekvence byly vyhodnoceny centrální databází sekvencí GenBank pomocí algoritmu BLAST.
VÝSLEDKY
V naší studii bylo analyzováno 75 vzorků pocházejících od 64 pacientů ze 2 pracovišť – z Liberce a Plzni. Věk sledovaných pacientů se pohyboval v intervalu od 4 do 54 let, medián věku byl 15 let u mužů a 16 let u žen. Důvodem hospitalizace 11 pacientů z Liberce byly intenzivní bolesti hlavy, horečky, zvracení, únava, meningeální příznaky. Lékaři diagnózu všech těchto pacientů uzavřeli jako aseptickou meningitidu. U 10 pacientů onemocnění způsobil ECHO virus 30. Pouze u 1 pacienta byl výsledek sekvenace ECHO virus 3. ECHO virus 30 i 3 patří do klasifikační skupiny B.
Z 53 plzeňských pacientů byly u 50 pacientů důvodem hospitalizace neurologické potíže, u dvou pacientů střevní a u jednoho kožní potíže. Pouze jeden z pacientů měl jak neurologické, tak střevní příznaky. Jako aseptická meningitida bylo onemocnění označeno u 22 pacientů, v jednom případě jako encefalitida a v dalším případě jako meningitida s gastroenteritidou. U 2 pacientů byla diagnózou gastroenteritida, u 1 kožní vyrážka. U 20 pacientů nebyla splněna kritéria diagnózy aseptická meningitida, neboť v mozkomíšním moku nebyl odpovídající laboratorní nález, tzn. pleocytóza s převahou mononukleárů (řádově desítky až stovky/mm3), mírně zvýšená nebo normální bílkovina a normální množství glukózy. Jejich závěrečnými diagnózami byla bolest hlavy, meningismus, horečka, nauzea, zvracení, virové onemocnění nervové soustavy či virové infekční onemocnění. V izolátech jsme identifikovali 51 ECHO virů 30, 3 coxsackieviry B1, 1 coxsackievirus B3, 1 coxsackievirus A9, 1 enterovirus 86, 1 enterovirus 71, 2 ECHO virus 13/ coxsackievirus B5, 1 ECHO virus 7/30/coxsackie virus B4, 1 coxsackievirus B4/enterovirus B, 1 enterovirus 87/ECHO virus 30/enterovirus B. Všechny izolované viry, mimo enteroviru 71 patřícího do skupiny A, spadají do skupiny B.
Skupina enterovirů patří k velmi variabilním virům, což potvrzuje i vysoká proměnlivost izolátů. Na základě námi získané sekvence bylo možné enteroviry jednoznačně identifikovat. Přestože se jednalo o krátký konzervativní úsek, byla zde pozorována vysoká variabilita, a proto jsme se pokusili o fylogenetickou analýzu. Ačkoliv se jednalo o nekódující oblast, bylo možné na jejím základě všechny izoláty převažujícího enteroviru ECHO virus 30 přiřadit do genotypu IV–VI bez dalšího rozlišení [4]. V současné době je popisováno 7 genotypů ECHO viru 30 (v roce 2009 to byly pouze 4 genotypy), ale jednotná klasifikace zatím neexistuje [4, 10]. Pro další upřesnění je třeba sekvenovat úsek VP1, VP4.
Základní údaje o pacientech jsou shrnuty v tabulkách 1–4.
Tab. 1. Základní údaje o vyšetřených pacientech (muži) s prokázanou infekcím ECHO virem 30 (lokalita Plzeň) Table 1. Basic data on male patients diagnosed with ECHO virus 30 (Plzeň hospital) 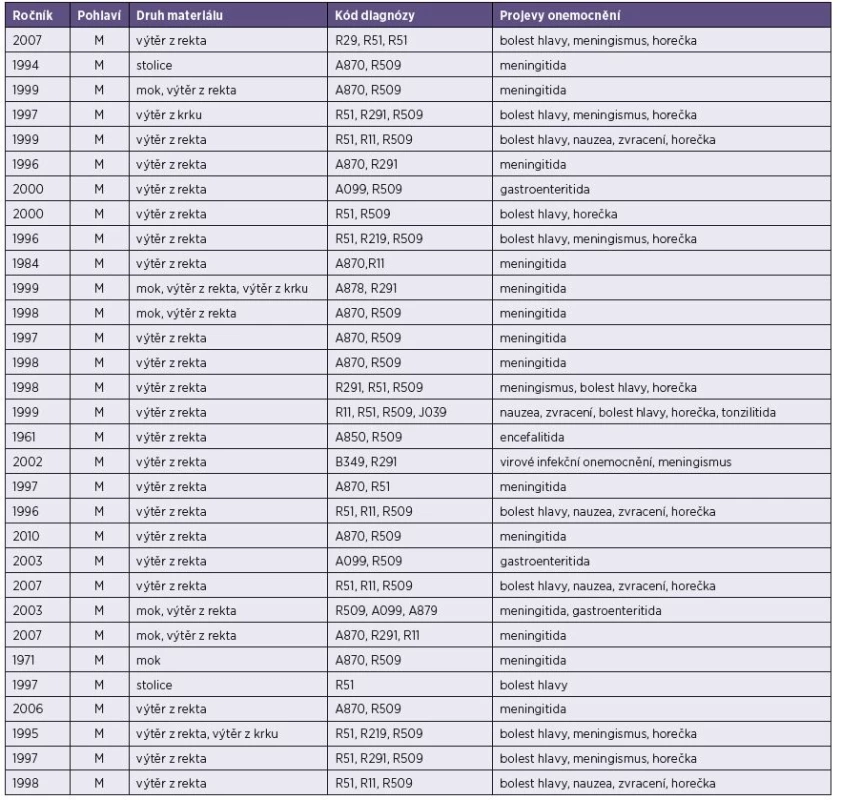
Tab. 2. Základní údaje o vyšetřených pacientech (ženy) s prokázanou infekcím ECHO virem 30 (lokalita Plzeň) Table 2. Basic data on female patients diagnosed with ECHO virus 30 (Plzeň hospital) 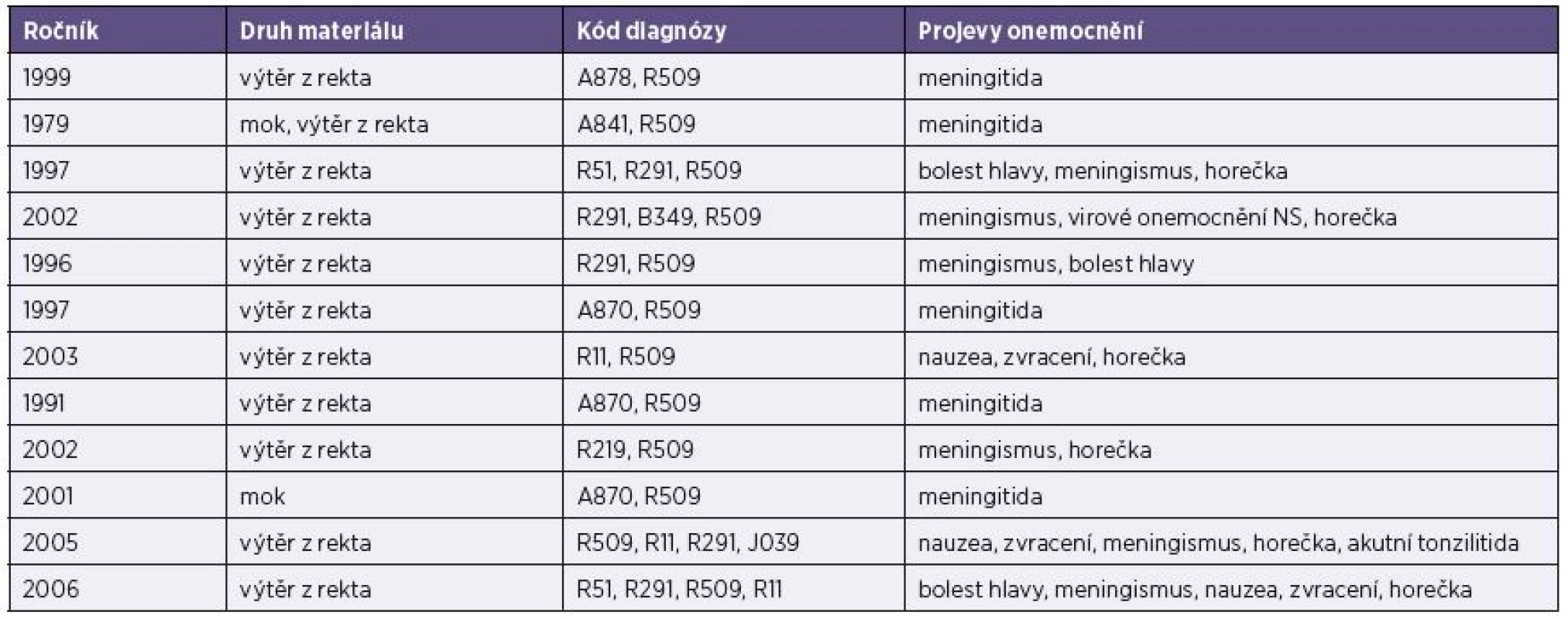
Tab. 3. Základní údaje o vyšetřených pacientech (muži i ženy) s prokázanou infekcí ECHO virem 30 (lokalita Liberec) Table 3. Basic data on male and female patients diagnosed with ECHO virus 30 (Liberec hospital) 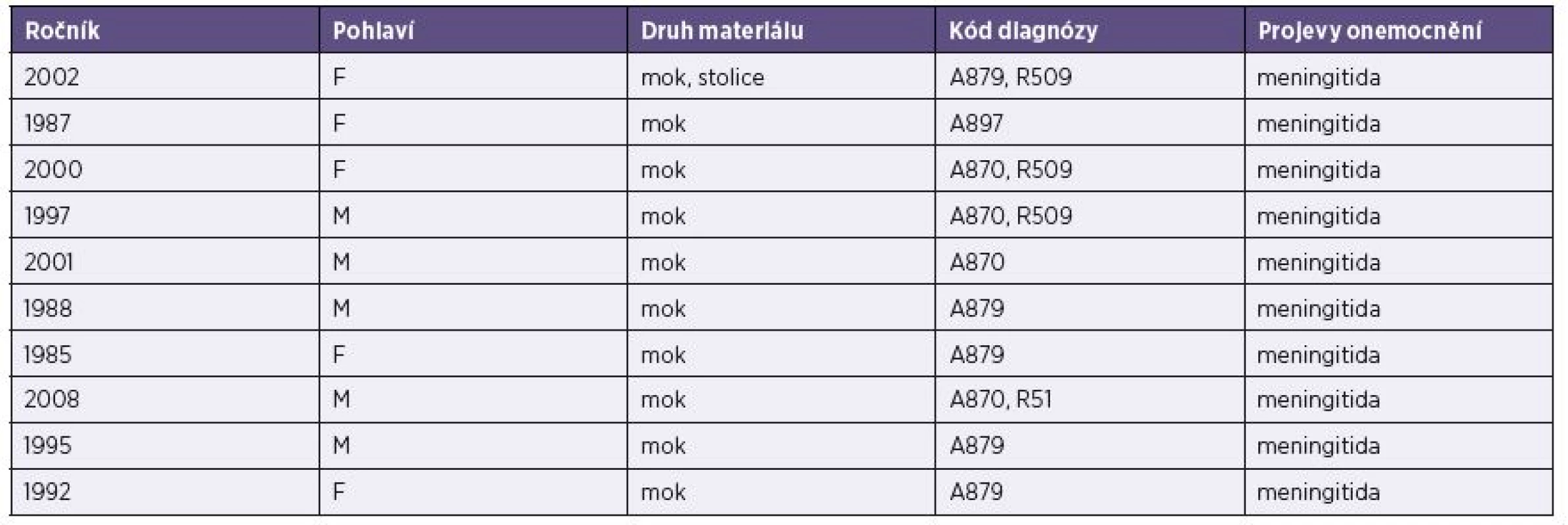
Tab. 4. Základní údaje o vyšetřených pacientech (muži i ženy) s prokázanou infekcí ostatními enteroviry Table 4. Basic data on male and female patients diagnosed with other enteroviruses 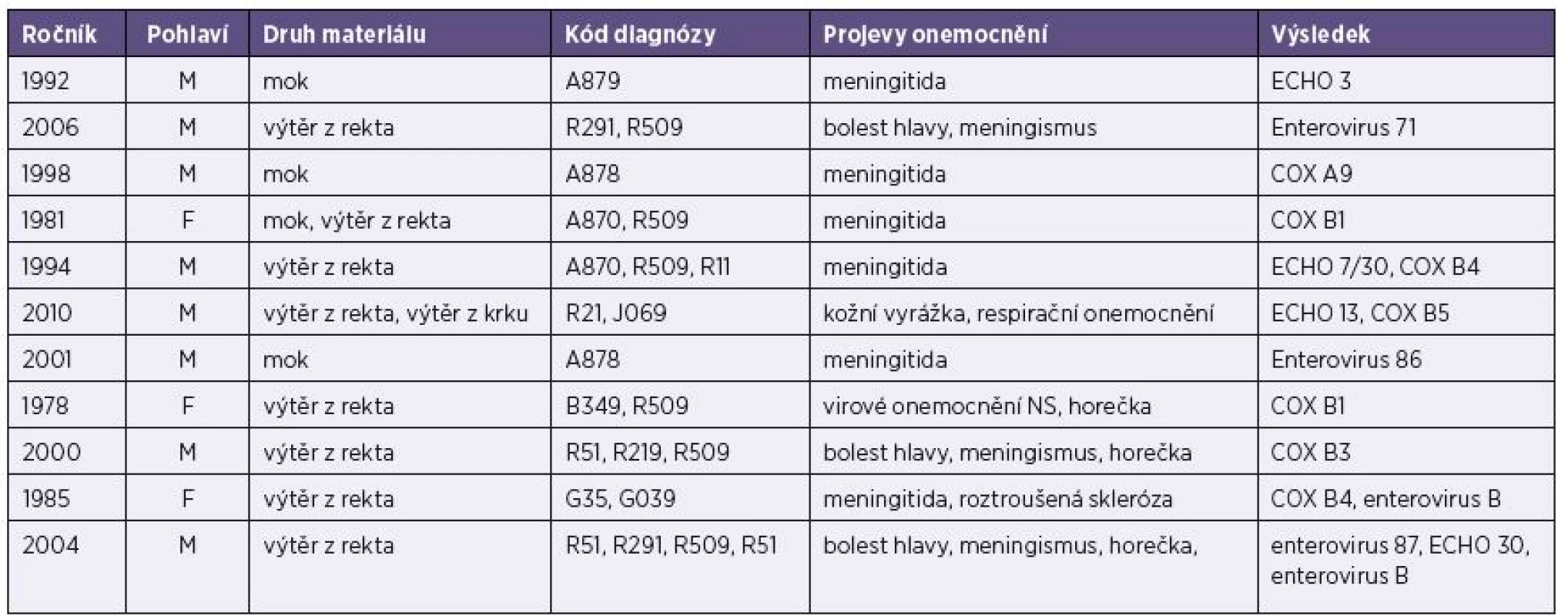
DISKUSE
V minulosti se pro základní vyšetřování enterovirů používala pouze klasická virologická metoda – izolace na tkáňových kulturách. Izolační metoda je samozřejmě stále vhodná, ale jen 65–70 % enterovirů lze vykultivovat [5]. Identifikace sérotypu (taxonomická jednotka, která byla založena na schopnosti mikroorganismu reagovat s protilátkami zaměřenými proti sérotyp specifickým neutralizačním místům na proteinech) enterovirů se následně prováděla virus neutralizačním testem se zvířecími antiséry. U enterovirů se předpokládalo, že je nejdůležitější VP1 protein – hlavní zevní, imunodominantní kapsidový protein, který obsahuje množství neutralizačních oblastí. Předpokládalo se rovněž, že sekvence VP1 proteinu korespondují se sérotypy. Později však bylo zjištěno, že stejný sérotyp mají např. coxsackieviry A11 a A15 nebo coxsackieviry A13 a A18, tzn. že jejich protilátky reagují se stejnými neutralizačními místy [6]. Sérotypy enterovirů 68-71 nebylo možno vůbec klasickým schématem při neutralizaci antiséry jednoznačně zachytit. Tradiční metody neutralizace pomocí zvířecích antisér tedy postrádají takovou citlivost, kterou enteroviry vyžadují. Neutralizační reakce jsou nepřesné, časově a laboratorně náročné, a proto jsou postupně nahrazovány sekvenací [7]. Pro určení izolátů je běžně užíván především VP1 protein a jeho sekvence [1, 6], určení lze provést i podle sekvencí VP4 proteinu [7, 8]. Pro další upřesnění je však třeba sekvenovat úsek VP4.
Vyšetřovanými materiály v naší práci byly mozkomíšní moky, stolice, výtěry z rekta a krku. U vzorků z gastrointestinálního traktu (GIT) byla prokázána vyšší záchytnost virové RNA nežli v mozkomíšních mocích. Možným důvodem nižšího množství enterovirové RNA v MM může být i doba odběru. Mok by měl být odebrán do 2 dnů od začátku onemocnění, což může představovat problém, neboť se onemocnění v tak krátké době nemusí jednoznačně manifestovat a odběr je pak proveden relativně pozdě – naproti tomu vzorky z GIT mohou být odebírány od 5.–16. dne od začátku prvních příznaků [9]. U skupiny pacientů s negativním nálezem v moku, ale s pozitivním průkazem ve stolici lze do určité míry polemizovat o tom, zda etiologickým agens byl opravdu právě určený enterovirus. Na podkladě klinických projevů těchto pacientů a vzhledem k epidemiologickým souvislostem se domníváme, že ze stolice izolovaný enterovirus původcem onemocnění byl, avšak mírnější průběh infekce nebyl provázen změnami v mozkomíšním moku. Z tohoto úhlu pohledu je vyšetření stolice u pacientů s uvedenými příznaky velmi důležité. Z hlediska pohlaví v námi analyzovaném souboru převládali muži na rozdíl od jiných sledování [9], kde bylo onemocnění rozděleno mezi pohlaví víceméně rovnoměrně. Tento fenomén bude pravděpodobně náhodný, ačkoliv se o podobném věkovém rozdělení u nás psalo už roce 2010 [11]. Pro úspěšnou sekvenaci se jako vhodnější osvědčily izoláty z tkáňové kultury, což jednoznačně potvrzuje přetrvávající význam izolace viru v buněčném kultivačním systému. Rozborem prezentovaného souboru bylo dále zjištěno, že více než 85 % onemocnění bylo způsobeno ECHO virem 30. Tento virus byl a je velmi častou příčinou epidemií aseptických meningitid v mnoha oblastech světa [8, 10, 11], v tomto smyslu byly naše výsledky ve shodě s literárními údaji. Důvodem opakujících se epidemií jsou pak bodové mutace v genech kódujících především VP1 protein.
Enteroviry jsou nejčastějším původcem aseptických meningitid. Jejich detailní analýza, kterou sekvenování umožňuje, významně přispívá jak k upřesnění laboratorní a klinické diagnózy, tak i k epidemiologickému sledování.
Podpořeno MZ ČR – RVO (Státní zdravotní ústav – SZÚ, IČ 75010330).
Do redakce došlo dne 26. 1. 2015.
Adresa pro korespondenci:
MUDr. Petra Rainetová
Státní zdravotní ústav Praha
Centrum pro epidemiologii a mikrobiologii
Šrobárova 48
100 42 Praha 10
e-mail: rainetova@szu.cz , Rainetova@seznam.cz
Zdroje
1. Takami T, Kawashima H, Takei Y, et al. Usefulness of nested PCR and sequence analysis in a nosocomial outbreak of neonatal enterovirus infection. J Clin Virol, 1998;11(1):67–75.
2. Votava M, Obdržálek V, Ondrovčík P, et al. Lékařská mikrobiologie II. Přehled vyšetřovacích metod v lékařské mikrobiologii. Brno: Masarykova univerzita. Lékařská fakulta;2000.
3. Oberste MS, Maher K, Kilpatrick DR, et al. Typing of human enteroviruses by partial sequencing of VP1. J Clin Microbiol, 1999;37(5):1288–1293.
4. Milia MG, Cerutti F, Gregori G, et al. Recent outbreak of aseptic menin-gitis in Italy due Echovirus 30 and phylogenetic relationship with other European circulating strains. J Clin Virol, 2013 : 58(3):579–583.
5. Polio laboratory manual. 4th ed. Geneva: World Health Organization, 2004.
6. Oberste MS, Maher K, Kilpatrick DR, et al. Molecular evolution of the human enteroviruses: correlation of serotype with VP1 sequence and application to picornavirus classification. J Virol, 1999;73(3):1941–1948.
7. Kubo H, Iritani N, Seto Y. Molecular classification of Enteroviruses not identified by neutralization tests. Emerg Infect Dis, 2002;8(3):298–304.
8. Logotheti M1, Pogka V, Horefti E, et al. Laboratory investigation and phylogenetic analysis of enteroviruses involved in an aseptic menin-gitis outbreak in Greece during the summer of 2007. J Clin Virol, 2009;46(3):270–274.
9. Xiao H, Guan D, Chen R, et al. Molecular characterization of echovirus 30-associated outbreak of aseptic meningitis in Guangdong in 2012. Virol J, 2013;10 : 263–267.
10. Castro, CMO de, OliveiraI DS, MacedoI O, et al. Echovirus 30 associated with cases of aseptic meningitis in state of Pará, Northern Brazil. Mem Inst Oswaldo Cruz, 2009;104(3):444–450.
11. Tkadlecová H. Výskyt enterovirových meningitid v kolektivu. In: 24. Pečenkovy epidemiologické dny: 15.–17. 9. 2010, České Budějovice. Jihlava: Zdeněk Hajn;2010 : 43. ISBN 978-80-904667-0-8.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek MUDr. Gustav Walter
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2015 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Sekvenace enterovirů jako nový přístup k laboratorní diagnostice pro klinické i epidemiologické účely
- Profesor Zdeněk Hubálek, nový nositel Patočkovy medaile
- Významné životní výročí MUDr. Vladimíra Zikmunda, CSc.
- MUDr. Gustav Walter
- Toxoplasmóza u imunokompromitovaných pacientů
- Možnosti zoonotického přenosu rotavirových infekcí
- Hepatitida E – přehled současných poznatků
- Rizika šíření viru západonilské horečky v České republice
- Prevalenční studie kmenů Escherichia coli a Klebsiella pneumoniae produkujících karbapenemázu v českých nemocnicích – výsledky české části studie EuSCAPE (European Survey on Carbapenemase-Producing Enterobacteriaceae)
- Diagnostika infekcí vyvolaných Clostridium difficile v České republice – dostupnost, možnosti, interpretace laboratorních nálezů
- Prevalence výskytu nosního nosičství kmenů Staphylococcus aureus a meticilin rezistentních kmenů S. aureus (MRSA) u studentů všeobecného lékařství LF UP v Olomouci
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti zoonotického přenosu rotavirových infekcí
- Hepatitida E – přehled současných poznatků
- Prevalence výskytu nosního nosičství kmenů Staphylococcus aureus a meticilin rezistentních kmenů S. aureus (MRSA) u studentů všeobecného lékařství LF UP v Olomouci
- Toxoplasmóza u imunokompromitovaných pacientů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



