-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika infekcí vyvolaných Clostridium difficile v České republice – dostupnost, možnosti, interpretace laboratorních nálezů
Diagnosis of infections caused by Clostridium difficile in the Czech Republic: availability, possibilities, and interpretation of laboratory results
Objective:
To assess the availability of the laboratory diagnosis of infections caused by C. difficile in the Czech Republic (CR), including the range of tests used, possible combinations, and adequate interpretation of model results.Material and methods:
Data were collected through a web questionnaire survey with the participation of representatives of 61 public and private microbiological laboratories. The questionnaire addressed the use of diagnostic test kits and culture media in the diagnosis of C. difficile infection (CDI). In addition, the respondents were asked to interpret a glutamate dehydrogenase (GDH) positive and, at the same time, toxin A/B negative result, without or with laboratory confirmation if available.Results:
In the CR, the most commonly used test in the diagnosis of CDI is the C. DIFF Quik Chek Complete® test (Alere) for the detection of GDH and A/B toxins, as reported by 50 (82 %) laboratories. Anaerobic culture is performed by 43 (70.5 %) laboratories, 21 (48.8 %) of which use selective agar (Oxoid). Direct detection of DNA of toxigenic C. difficile is feasible in 17 (27.9 %) laboratories, with most of them (15 laboratories) using the closed system Xpert® C. difficile (Cepheid).
The diagnosis based only on the detection of GDH and A/B toxins is used by 13 (21.3 %) laboratories. Two (3.3 %) laboratories detect A/B toxins alone and three (4.9 %) laboratories carry out the detection of A/B toxins followed by anaerobic culture. A three step scheme: detection of GDH and A/B toxins with subsequent anaerobic culture is used by 26 (42.6 %) laboratories. The detection of GDH and A/B toxins along with a PCR assay are provided by three (4.9 %) laboratories. A complete diagnostic scheme for CDI (detection of GDH and A/B toxins, direct detection of DNA, and aerobic culture) is feasible in 14 (23 %) laboratories.Conclusion:
This questionnaire survey study identified 24 different testing algorithms to be in use within the study period (April to July 2014) in the CR. Five (8.2 %) laboratories have no highly sensitive screening test such as the detection of GDH or nucleic acid amplification test (NAAT) included in their testing algorithm. Thirteen (21.3 %) laboratories perform the detection of GDH and A/B toxins but have no confirmation method to be used if only one test turns out positive. In the case of GDH positivity and A/B toxin negativity, the result should be provided with a supplementary comment on further possibilities for the laboratory detection of CDI and the claimed sensitivity of the test used. If no confirmation test is available, the result should be considered as epidemiolo-gically and clinically significant, once other possible causes of diarrhoea are ruled out.Keywords:
Clostridium difficile – diagnosis – testing algorithm – glutamate dehydrogenase – A/B toxins
Autoři: M. Krůtová 1,2; O. Nyč 1
Působiště autorů: Ústav lékařské mikrobiologie, Univerzita Karlova, 2. lékařská fakulta a Fakultní nemocnice v Motole 1; DNA laboratoř kliniky dětské neurologie, Univerzita Karlova, 2. lékařská fakulta a Fakultní nemocnice v Motole 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 2, s. 92-97
Kategorie: Původní práce
Souhrn
Cíl práce:
Posouzení dostupnosti a laboratorní diagnostiky infekcí vyvolaných C. difficile v České republice (ČR) včetně spektra používaných testů, jejich využití v kombinacích a odpovídající interpretace modelových nálezů.Materiál a metodika:
Data byla získána na základě vyplnění webového dotazníku zástupci 61 státních i soukromých mikrobiologických laboratoří. Dotazník byl zaměřen na používané diagnostické soupravy a kultivační média v rámci diagnostiky CDI (C. difficile infection). Dále byla požadována interpretace laboratorního nálezu GDH (glutamátdehydrogenáza) pozitivní, toxin A/B negativní bez konfirmace nebo s konfirmací podle možnosti laboratoře.Výsledky:
V ČR je nejčastěji v prvním diagnostickém kroku u CDI používán test C. diff Quik Chek Complete® (Alere) pro průkaz GDH a toxinů A/B, jak uvedlo 50 laboratoří (82 %). Anaerobní kultivaci provádí 43 laboratoří (70,5 %), z toho 21 laboratoří (48,8 %) používá selektivní agar (Oxoid). Možnost přímého průkazu DNA toxigenních C. difficile má k dispozici 17 laboratoří (27,9 %) a většina z nich (15 laboratoří) používá uzavřený systém Xpert® C. difficile (Cepheid).
Diagnostiku založenou pouze na průkazu GDH a toxinů A/B uvedlo 13 laboratoří (21,3 %). Dvě laboratoře (3,3 %) prokazují jen toxiny A/B a tři laboratoře (4,9 %) průkaz toxinů A/B doplňují anaerobní kultivací. Třístupňové schéma: průkaz GDH a toxinů A/B doplněné o anaerobní kultivaci provádí 26 laboratoří (42,6 %). Průkaz GDH, toxinů A/B a PCR nabízejí tři laboratoře (4,9 %). Kompletní diagnostické schéma CDI (průkaz GDH, toxinů, přímý průkaz DNA anaerobní kultivaci) má k dispozici 14 laboratoří (23 %).Závěr:
V naší dotazníkové studii jsme identifikovali 24 různých testovacích algoritmů používaných v době studie (duben až červenec 2014) v ČR. Pět laboratoří (8,2 %) nemá ve svém testovacím algoritmu zahrnut citlivý screeningový test, jako je průkaz GDH nebo NAAT (Nucleic Acid Amplification Test). Třináct laboratoří (21,3 %) stanovuje GDH a toxiny a v případě izolované pozitivity jednoho testu nemá k dispozici konfirmační metodu. U GDH pozitivních a toxin A/B negativních vzorků by každý výsledek měl být opatřen doplňujícím komentářem o dalších možnostech laboratorního průkazu CDI a o uváděné senzitivitě použitého testu. V případě, že není možnost konfirmace dalším testem, by po vyloučení jiné příčiny průjmu, měl být výsledek hodnocen jako epidemiologicky i klinicky významný.Klíčová slova:
Clostridium difficile – diagnostika – testovací algoritmus – glutamátdehydrogenáza – toxiny A/BÚVOD
Clostridium difficile je významným nozokomiálním patogenem, který je zodpovědný za vznik kolitid s mnohdy závažným průběhem, zpravidla v souvislosti s předchozí nebo souběžnou antibiotickou léčbou [1]. Podle výsledků plošné ribotypizace v roce 2013 se na současné epidemiologické situaci v ČR výrazně podílí ribotyp 176 [2]. Výskyt C. difficile ribotypu 176 je hlášen v Polsku současně s ribotypem 027 [3], který byl identifikován i na území ČR jako importovaná infekce [4].
Infekce vyvolané C. difficile podléhají v ČR povinnému hlášení do systému EPIDAT, programu evidence a analýzy výskytu infekčních nemocí v České republice. Kód pro hlášení infekcí vyvolaných C. difficile je A04, a tyto infekce spadají pod diagnózu: Jiné bakteriální střevní infekce. Kontinuální surveillance s validními daty o epidemiologické situaci tohoto onemocnění na našem území prozatím chybí. V rámci řešení grantového projektu Interní grantové agentury Ministerstva zdravotnictví (NT 14209-3) je v Ústavu lékařské mikrobiologie v Praze v Motole zajišťována ribotypizace klinicky významných izolátů C. difficile, která je v Evropě nejrozšířenější typizační metodou [5]. Průběžná data získaná z výše uvedených zdrojů svědčí o tom, že ČR se výskytem CDI nevymyká většině evropských zemí. Tedy i u nás se jedná o významný epidemiologický problém, který se doposud nedaří účinně zvládnout.
Včasná a správně provedená laboratorní diagnostika infekcí vyvolaných C. difficile je zásadní nejen pro zvolení adekvátní terapie, ale i pro zahájení protiepidemických opatření, která vedou k zamezení přenosu infekce na další vnímavé jedince [6]. Diagnostika a terapie infekcí vyvolaných C. difficile by v Evropě měla vycházet z doporučení Evropské společnosti klinické mikrobiologie a infekčních nemocí (ESCMID) [7]. V návaznosti na tento dokument byl vydán národní doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile [8].
Mikrobiologická laboratoř je zodpovědná za zvolení dostatečně citlivé a specifické metody, nastavení testovacího algoritmu a odpovídající interpretaci laboratorních nálezů. Současná nabídka diagnostických souprav na českém trhu je široká. Testy se dělí do několika kategorií, podle toho, na jakém jsou založeny principu a jaké cíle v souvislosti s klostridiovou infekcí detekují. Jednotný testovací algoritmus není stanoven, a tudíž může v diagnostice CDI nastat jistý druh nejistoty [9]. Cílem práce bylo posoudit aktuální úroveň diagnostiky CDI v ČR včetně spektra používaných laboratorních testů a schopnosti adekvátně interpretovat modelové výsledky klíčových testů.
MATERIÁL A METODY
Do studie se vyplněním webového dotazníku zapojilo 61 laboratoří (7 soukromých, 54 státních). Odpovědi byly obdrženy v období duben až červenec 2014. Dotazník byl zaměřen na používané testy na stanovení GDH a toxinů A/B, na možnosti využití molekulárně-biologických metod pro průkaz DNA toxigenních C. difficile ve stolici a jejich zařazení do diagnostického schématu laboratoře, na provádění anaerobní kultivace a na interpretaci laboratorního nálezu GDH pozitivní, toxin A/B negativní bez konfirmace nebo s konfirmací podle možnosti laboratoře.
VÝSLEDKY
Souhrnné výsledky o používaných diagnostických soupravách a kultivačních médiích, rozdělené podle testovacích algoritmů používaných v jednotlivých laboratořích, obsahuje tabulka 1. Podrobné výsledky k jednotlivým otázkám z dotazníku jsou uvedeny v následujícím textu.
Tab. 1. Testovací algoritmy se specifikací používaných diagnostických souprav a kultivačních médií Table 1. The test algorithms with specifications of the diagnostic test kits and culture media 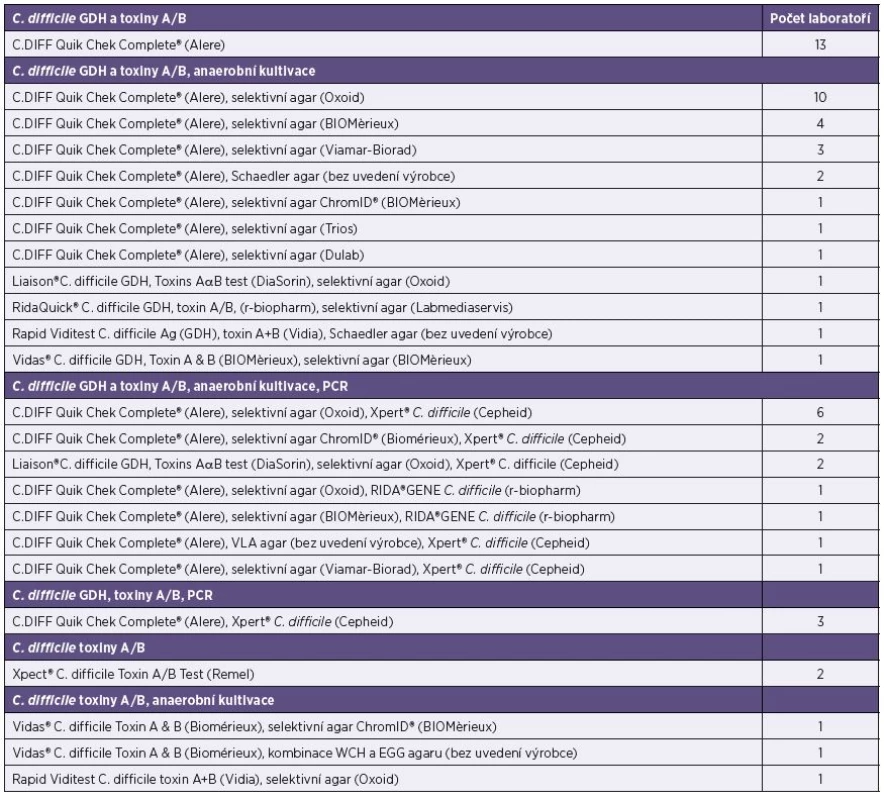
Jaký test používáte na stanovení GDH?
Pět laboratoří (8,2 %) nabízející diagnostiku CDI test na průkaz GDH neprovádí. Z ostatních 56 laboratoří (91,8 %), které GDH stanovují, uvedlo 50 laboratoří (89,3 %) používání testu C.DIFF Quik Chek Complete® (Alere). Tři laboratoře (5,3 %) používají Liaison C. difficile GDH test® (DiaSorin), jedna laboratoř (1,8 %) uvedla test Vidas® C. difficile GDH (Biomérieux), jedna laboratoř (1,8 %) používá Rapid Viditest C. difficile Ag (GDH) (Vidia), a jedna laboratoř (1,8 %) uvedla test Rida Quick® C. difficile GDH (r-biopharm).
Jaký test používáte na stanovení toxinů A/B?
Všechny laboratoře, které nabízejí stanovení GDH používají ke stanovení toxinů A/B shodný test. Laboratoře, které GDH nestanovují, používají následující testy: dvě laboratoře (3,3 %) uvedly test Xpect® C. difficile Toxin A/B (Remel), dvě laboratoře (3,3 %) používají test Vidas® C. difficile Toxin A&B (Biomérieux) a jedna laboratoř (1,6 %) uvedla Rapid Viditest C. difficile toxin A+B (Vidia).
Provádí vaše pracoviště kultivaci C. difficile?
Anaerobní kultivaci zaměřenou na průkaz C. difficile ze stolice provádí 43 laboratoří (70,5 %). Pět z těchto laboratoří (11,6 %) používá pro primokultivaci neselektivní agar. Všechny GDH pozitivní vzorky kultivuje 26 laboratoří (60,5 %). Kultivaci pouze toxin A/B pozitivních vzorků uvedlo 8 laboratoří (18,6 %). Kultivaci všech stolic uvedla jedna laboratoř (2,3 %). Ostatní laboratoře, které kultivaci provádějí, blíže nespecifikovaly kritéria, které vzorky jsou kultivovány.
Provádíte před kultivací tzv. alkoholový šok?
Alkoholový šok provádí před kultivací 32 laboratoří (74,4 %) ze 43 laboratoří, které provádějí anaerobní kultivaci na průkaz C. difficile. Z 11 laboratoří (25,6 %), které neprovádějí alkoholový šok, 9 jich (81,8 %) kultivuje na selektivním médiu a 2 laboratoře (18,2 %) používají neselektivní kultivační médium.
Jaké používáte kultivační médium?
Použití selektivního média pro C. difficile (Oxoid) uvedlo 21 laboratoří (48,8 %) ze 43, které provádějí anaerobní kultivaci. Další kultivační půdou je selektivní agar (Biomèrieux), který používá šest laboratoří (14 %). Čtyři laboratoře (9,3 %) uvedly použití chromogenního agaru chromID™ C. difficile (Biomèrieux). Čtyři laboratoře (9,3 %) kultivují na selektivní půdě CD agar (Viamar-Bio-Rad). Jedna laboratoř (2,3 %) uvedla kultivaci na agaru pro kultivaci C. difficile (Trios), jedna laboratoř (2,3 %) kultivuje na CLDA/Clostridium difficile agar + suplement CaC (Dulab) a jedna laboratoř (2,3 %) používá C. difficile krevní agar (Labmediaservis). Neselektivní Schaedlerův agar používají tři laboratoře (7 %). Jedna laboratoř (2,3 %) uvedla kombinaci půd WCH, EGG. Jedna laboratoř (2,3 %) kultivuje na VLA agaru.
Nabízí Vaše pracoviště přímý průkaz DNA toxigenních C. difficile?
Přímý průkaz toxigenních C. difficile pomocí molekulárních metod je k dispozici v 17 laboratořích (27,9 %). Test Xpert® C. difficile (Cepheid) uvedlo 15 laboratoří (88,2 %), které PCR provádějí. Ve zbývajících dvou laboratořích (11,8 %) je diagnostika prováděna pomocí testu Rida®Gene Clostridium difficile (r-biopharm).
Přímý průkaz DNA toxigenních C. difficile používá 12 laboratoří (70,6 %) pro konfirmaci GDH pozitivních a toxin negativních vzorků. Tři laboratoře (17,6 %) provádějí PCR test na požadavek ošetřujícího lékaře. Dvě laboratoře (11,8 %) mají PCR test pro statimové účely.
Používané diagnostické algoritmy v ČR
V naší dotazníkové studii jsme identifikovali 24 různých testovacích algoritmů. Diagnostiku založenou na průkazu GDH a toxinů A/B uvedlo 13 laboratoří (21,3 %). Dvě laboratoře (3,3 %) prokazují pouze toxiny A/B a tři laboratoře (4,9 %) průkaz toxinů A/B doplňují anaerobní kultivací. Třístupňové schéma: průkaz GDH a toxinů A/B doplněné o anaerobní kultivaci provádí 26 laboratoří (42,6 %). Třístupňové schéma: průkaz GDH, toxinů a PCR nabízejí tři laboratoře (4,9 %). Kompletní diagnostické schéma CDI (průkaz GDH, toxinů, přímý průkaz DNA a anaerobní kultivaci) má k dispozici 14 laboratoří (23 %).
Interpretace nálezu GDH pozitivní a toxin negativní (bez možnosti kultivace a PCR)
Šestnáct laboratoří (69,6 %) z celkem 23, které mají diagnostiku založenou pouze na průkazu GDH a toxinů A/B nebo pouze na průkazu toxinů či provádí kultivaci pouze toxin pozitivních vzorků, interpretaci výsledků nepřipojuje. Interpretaci o možné falešné negativitě toxinů připojuje pouze jedna laboratoř (4,3 %). Dvě laboratoře (8,7 %) v tomto případě doporučují opakovat odběr, jedna laboratoř (4,3 %) hodnotí tento nález jako: „C. difficile pozitivní“, dvě laboratoře (8,6 %) jako: „C. difficile negativní“ a jedna laboratoř (4,3 %) vydává výsledek: „prokázán netoxigenní kmen C. difficile.
Interpretace nálezu GDH pozitivní, toxin A/B negativní a anaerobní kultivace pro průkaz C. difficile pozitivní
Osm laboratoří (30,8 %) nepřipojuje k výsledkům žádný komentář, z toho pět laboratoří (19,2 %) uvedlo, že kultivuje pouze toxin pozitivní vzorky, takže v diagnostice GDH pozitivních toxin negativních vzorků nepokračuje. Deset laboratoří (38,4 %) uvedlo, že v případě pozitivní kultivace se pokusí o průkaz toxinů přímo z narostlé kultury C. difficile. Zbylých osm laboratoří (30,8 %), které kultivují všechny GDH pozitivní vzorky a při pozitivitě kultivace bez dodatečného průkazu toxinů interpretují výsledky následovně: pět laboratoří (19,2 %): „C. difficile pozitivní“; dvě laboratoře (7,7 %): „Potvrzen kmen bez produkce toxinu“. Jedna laboratoř (3,9 %) připojuje k výsledku komentář o senzitivitě použitých metod a pravděpodobnosti toxigenity kmene na základě zkušeností v laboratoři.
Interpretace nálezu GDH pozitivní, toxin A/B negativní, PCR pozitivní
Všech 17 laboratoří (100 %), které mají k dispozici přímý průkaz DNA toxigenních C. difficile ve stolici uvedlo interpretaci „C. difficile pozitivní“.
DISKUSE
Spektrum nabízených komerčních souprav určených pro diagnostiku CDI v ČR je široké. Jednotné optimální diagnostické schéma není v současnosti doporučené [7]. Před zařazením testu do diagnostického algoritmu je především nutné si uvědomit, co zvolená metoda prokazuje, zda se jedná o volné antigeny ve stolici, či bakterii jako takovou nebo její potenciální schopnost produkovat toxin.
Pro diagnostiku CDI je doporučován dvou - nebo třístupňový testovací algoritmus, kdy první pozitivní test by měl být konfirmován dalším testem nebo pomocí referenční metody [7]. Jako referenční metody jsou v diagnostice CDI považovány neutralizační cytotoxický test pro průkaz C. difficile toxinu ve stolici a toxigenní kultivace, která potvrzuje schopnost izolátu C. difficile produkovat toxin in vitro.
Jako první krok dvoustupňového testovacího algoritmu je doporučeno použít senzitivního screeningového testu s vysokou negativní prediktivní hodnotou pro rychlé vyloučení pacientů bez CDI. Toto kritérium splňuje imunoenzymatické stanovení GDH nebo NAAT [10, 11]. Podle výsledků naší studie pět laboratoří (8,2 %) toto kritérium nesplňuje.
Dalšími kroky testovacího algoritmu jsou buď imunoenzymatický průkaz volných toxinů ve stolici, nebo NAAT pro detekci toxigenních kmenů C. difficile (pokud tento test nebyl použit jako screeningový). Pozitivní NAAT s negativním průkazem toxinů neumožní odlišit kolonizaci pacienta od probíhající infekce. Pacienti s pozitivním průkazem toxinů ve stolici mají signifikantně vyšší riziko mortality [12].
Komerční diagnostické soupravy na průkaz GDH a toxinů detekují shodný cíl, ale vzhledem k rozdílnému principu metody a rozdílnému způsobu detekce nelze vyloučit i rozdílnou senzitivitu či specificitu testu. Většina laboratoří (82%) používá v prvním diagnostickém kroku test C.diff Quik Chek Complete® (Alere), rychlý membránový imunoenzymatický test detekující GDH a toxiny A/B v jednom kroku. Senzitivita tohoto testu pro průkaz toxinů v porovnání s cytotoxickou kultivací se pohybuje od 59,6 % ve studii autorů Sharp et al. [13], do 74,4 % ve studii autorů Eastwood et al. [14].
Na principu automatizované chemiluminiscenční imunoanalýzy jsou založeny testy Liaison®C. difficile GDH, toxins AαB (DiaSorin, USA). Porovnávací studie s výše uvedeným testem autorů Krůtová et al. [15] prokázala o 7 % vyšší senzitivitu pro detekci C. difficile toxinů A/B [15]. Limitací této studie ovšem byl poměrně malý soubor provedených vyšetření (86) přičemž téměř polovina z nich (36) byla negativních.
Princip imunochromatografie využívají testy Rapid-Viditest C. difficile Ag (GDH) nebo C. difficile toxin A+B (Vidia), RidaQuick® C. difficile GDH ,Toxins A/B (r-biopharm) a Xpect® C. difficile Toxin A/B (Remel). Senzitivita testu Xpect® C. difficile Toxin A/B se v porovnání s cytotoxickou kultivací pohybuje od 48 % ve studii Sloan et al. [16] do 68,8 % ve studii Eastwood et al. [14].
Testy Vidas® C. difficile GDH a C. difficile Toxin A&B (Biomèrieux) jsou založeny na technologii ELFA (Enzyme-Linked Fluorescence Asay). Senzitivita testu pro stanovení toxinů A/B se pohybuje od 58,8 % ve studii de Jong et al. [17] do 80 % ve studii Eastwood et al. [14].
Alkoholový šok před anaerobní kultivací pro kultivační průkaz C. difficile selektivně dekontaminuje stolici usmrcením vegetativních forem bakterií a podporuje germinaci spór C. difficile. Provedení alkoholového šoku s použitím selektivního média zvyšuje výtěžnost anaerobní kultivace pro průkaz C. difficile ve stolici [18].
Pro anaerobní kultivaci cílené na průkaz C. difficile je doporučeno použít selektivní kultivační média [19]. V případě použití neselektivní kultivační půdy, ve studii uvedlo pět laboratoří (11,6 %) ze 43, které provádějí anaerobní kultivaci, může dojít z důvodu pomalejšího růstu C. difficile k jeho překrytí průvodní flórou ze stolice. Oproti tomu neselektivní agary podporují sporulaci C. difficile. Izolace kmene C difficile z klinického materiálu je nezastupitelná pro stanovení antibiogramu a možnosti určení dalších molekulárních charakteristik, jako je např. ribotypizace. Pozitivní průkaz C. difficile pomocí anaerobní kultivace na selektivním agaru bez pozitivity testu na průkaz C. difficile toxinů A/B nebo genů pro produkci toxinů nelze považovat jako potvrzení infekce, protože kultivací lze izolovat i netoxigenní kmeny C. difficile.
Metody amplifikace nukleových kyselin založené na PCR v reálném čase (Real-Time PCR) jsou metodami dosahujícími téměř 100 % senzitivitu a specificitu [20, 21]. Molekulární test Xpert® C. difficile (Cepheid) je nejčastěji používaným molekulárním testem v laboratořích v ČR, které nabízejí molekulární diagnostiku C. difficile. Jedná se o uzavřený systém, který je schopen detekovat přítomnost genu pro tvorbu toxinu B (tcdB) binárního toxinu (cdtB) a delece v pozici 117 regulačního genu tcdC [22, 23]. Pozitivita všech tří cílových úseků je však shodně detekována jak u C. difficile ribotypu 027, tak i u ribotypu 176, a pro spolehlivé ověření konkrétního ribotypu je nezbytná ribotypizace založená na kapilární elektroforéze [24].
Interpretace laboratorního nálezu GDH pozitivní, toxin A/B, negativní bez konfirmace nebo s konfirmací podle možnosti laboratoře se ukázala pro některé laboratoře jako problematická. Ve většině případů laboratoře interpretaci neprovádějí. V uvedených interpretacích se vyskytla i neodpovídající hodnocení.
Podle autorů Wilcox et al. [11] je výsledek GDH pozitivní, toxin negativní určen pouze lokálnímu hlášení, vzhledem k možnému vylučování C. difficile do prostředí. Tomuto výsledku je tedy připisován spíše epidemiologický než klinický význam, zejména pokud se podaří vyloučit jinou příčinu střevních obtíží [11]. Jak uvádí autoři Planche et al. [12], jedná se o novou diagnostickou kategorii pacientů s průjmem, který nemusí být vyvolán C. difficile, ale který může být příčinou cross infekce, přenosu C. difficile na vnímavého jedince [12]. Na druhou stranu je třeba brát v úvahu limitovanou senzitivitu testů na průkaz toxinů A/B ve stolici, tudíž i značné procento falešně negativních výsledků.
Laboratoře, které nabízejí pouze průkaz GDH a toxinů A/B by při pozitivitě GDH a negativitě toxinů A/B měly připojit komentář o senzitivitě používané metody a přítomnosti GHD jak u toxigenních, tak i netoxigenních C. difficile.
U pozitivních kultivačních nálezů GDH pozitivních a toxin A/B negativních vzorků bez další konfirmace toxigenity kmene by měl být výsledek minimálně doplněn komentářem, že vykultivovaný kmen C. difficile může být toxigenní i netoxigenní.
Každý výsledek GDH pozitivní, toxin A/B negativní by měl být neprodleně hlášen ošetřujícímu lékaři a konzultován s aktuálním klinickým stavem pacienta.
ZÁVĚR
Diagnostické možnosti a přístupy u infekcí vyvolaných C. difficile se v jednotlivých mikrobiologických laboratořích v ČR liší. V naší dotazníkové studii jsme identifikovali 24 různých testovacích algoritmů používaných v době studie (duben až červenec 2014 v ČR). Pět laboratoří (8,2 %) nemá ve svém testovacím algoritmu zahrnut citlivý screeningový test, jako je průkaz C. difficile GDH nebo NAAT. Třináct laboratoří (21,3 %) stanovuje C. difficile GDH a toxiny a v případě izolované pozitivity jednoho testu nemá k dispozici konfirmační metodu. Překvapivě velké procento laboratoří 70,5 % (43) provádí anaerobní kultivaci. Pět z těchto laboratoří (11,6 %) používá pro primární kultivaci neselektivní kultivační médium a 11 laboratoří (25,6 %) neprovádí před kultivací tzv. alkoholový šok.
S možnostmi laboratorní diagnostiky koreluje i interpretace laboratorních výsledků. Každý nejednoznačný výsledek by měl být opatřen doplňujícím komentářem o dalších možnostech laboratorního průkazu, o uváděné senzitivitě testu a patřičnou interpretací výsledků testů, a to hlavně v případě GDH pozitivních a toxin A/B negativních vzorků. To platí zejména v případech, kdy není možná konzultace klinického stavu pacienta přímo s ošetřujícím lékařem.
Poděkování: Děkujeme všem zúčastněným laboratořím za vyplnění dotazníku a tím poskytnutí velmi zajímavých dat o diagnostice CDI v ČR.
Podpora:
Studie byla provedena v rámci řešení grantu MZ ČR IGA NT/14209-3.
Do redakce došlo dne 10. 10. 2014.
Adresa pro korespondenci:
Mgr. Marcela Krůtová
Ústav lékařské mikrobiologie, 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: marcela.krutova@seznam.cz
Zdroje
1. Freeman J, Bauer MP, Baines SD, et al. The changing epidemiology of Clostridium difficile infections. Clin Microbiol Revm, 2010;23(3):529–549.
2. Krůtová M, Matějková J, Nyč O. První výsledky molekulární typizace C. difficile v ČR. Zprávy CEM (SZÚ, Praha), 2013;22(12):399–401.
3. Obuch-Woszczatynski P, Lachowitzd D, Schneidera et al. Occurrence of Clostridium difficile PCR-ribotype 027 and it’s closely related PCR-ribotype 176 in hospitals in Poland in 2008–2010. Anaerobe, 2014;28 : 13–17.
4. Krutova M, Nyc O, Kuijper EJ, et al. A case of imported Clostridium difficile PCR-ribotype 027 infection within the Czech Republic which has a high prevalence of Clostridium difficile ribotype 176. Anaerobe, 2014;30 : 153–155.
5. Knetsch CW1, Lawley TD, Hensgens MP, et al. Current application and future perspectives of molecular typing methods to study Clostridium difficile infections. Euro Surveill, 2013;18(4):20381.
6. Rupnik M, Wilcox MH, Gerding DN. Clostridium difficile infec-tion: new developments in epidemiology and pathogenesis. Nat Rev Microbiol, 2009;7(7):526–536.
7. Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect, 2014;20(Suppl 2):1–26.
8. Beneš J, Husa P, Nyč O, et al. Doporučený postup diagnostiky a léčby kolitidy vyvolané Clostridium difficile. Klin Mikrobiol Infekc Lek, 2014;20(2):56–66.
9. Wilcox MH, Planche T, Fang FC, et al. What is the current role of algorithmic approaches for diagnosis of Clostridium difficile infection? J Clin Microbiol, 2010;48(12):4347–4353.
10. Crobach MJ, Dekkers OM, Wilcox MH, et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): data review and recommendations for diagnosing Clostridium difficile-infection (CDI). Clin Microbiol Infect, 2009;15(12):1053–1066.
11. Wilcox MH. Overcoming barriers to effective recognition and diagnosis of Clostridium difficile infection. Clin Microbiol Infect, 2012;18(Suppl 6):13–20.
12. Planche TD, Davies KA, Coen PG, et al. Differences in outcome according to Clostridium difficile testing method: a prospective multicentre diagnostic validation study of C. difficile infection. Lancet Infect Dis, 2013;13(11):936–945.
13. Sharp SE, Ruden LO, Pohl JC, et al. Evaluation of the C.Diff Quik Chek Complete Assay, a new glutamate dehydrogenase and A/B toxin combination lateral flow assay for use in rapid, simple diagnosis of Clostridium difficile disease. J Clin Microbiol, 2010;48(6):2082–2086.
14. Eastwood K, Else P, Charlett A, et al. Comparison of nine commercially available Clostridium difficile toxin detection assays, a real-time PCR assay for C. difficile tcdB, and a glutamate dehydrogenase detection assay to cytotoxin testing and cytotoxigenic culture methods. J Clin Microbiol, 2009;47(10):3211–3217.
15. Krůtová M, Matějková J, Zajac M, et al. Diagnostika Clostridium difficile infekcí – porovnávací studie dvou imunoenzymatických metod s konfirmací pomocí PCR a kultivace s následnou ribotypizací kmene. Epidemiol Mikrobiol Imunol, 2014;63(2):99–102.
16. Sloan LM, Duresko BJ, Gustafson DR, et al. Comparison of real-time PCR for detection of the tcdC gene with four toxin immunoassays and culture in diagnosis of Clostridium difficile infection. J Clin Microbiol, 2008;46(6):1996–2001.
17. de Jong E, de Jong AS, Bartels CJ, et al. Clinical and laboratory evaluation of a real-time PCR for Clostridium difficile toxin A and B genes. Eur J Clin Microbiol Infect Dis, 2012;31(9):2219–2225.
18. Riley TV, Brazier JS, Hassan H, et al. Comparison of alkohol shock enrichment and selective enrichment for the isolation of Clostridium difficile. Epidemiol Infect, 1987;99(2):355–359.
19. Wilcox MH, Fawley WN, Parnell P. Value of lysozyme agar incorporation and alkaline thioglycollate exposure for the environmental recovery of Clostridium difficile. J Hosp Infect, 2000;44(1):65–69.
20. Belanger SD, Boissinot M, Clairoux N, et al. Rapid detection of Clostridium difficile in feces by real-time PCR. J Clin Microbiol, 2003;41(2):730–734.
21. Barbut F, Braun M, Burghoffer B, et al. Rapid detection of toxigenit strains of Clostridium difficile in diarrheal stools by real-time PCR. J Clin Microbiol, 2009;47(4):1276–1277.
22. Babady NE, Stiles J, Ruggiero P, et al. Evaluation of the Cepheid Xpert Clostridium difficile Epi assay for diagnosis of Clostridium difficile infection and typing of the NAP1 strain at a cancer hospital. J Clin Microbiol, 2010;48(12):4519–4524.
23. Shin S, Kim M, Kim M, et al. Evaluation of the Xpert Clostridium difficile assay for the diagnosis of Clostridium difficile infection. Ann Lab Med, 2012;32(5):355–358.
24. Krutova M, Matejkova J, Nyc O. C. difficile ribotype 027 or 176? Folia Microbiol (Praha), 2014;59(6):523–526.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek MUDr. Gustav Walter
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2015 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Sekvenace enterovirů jako nový přístup k laboratorní diagnostice pro klinické i epidemiologické účely
- Profesor Zdeněk Hubálek, nový nositel Patočkovy medaile
- Významné životní výročí MUDr. Vladimíra Zikmunda, CSc.
- MUDr. Gustav Walter
- Toxoplasmóza u imunokompromitovaných pacientů
- Možnosti zoonotického přenosu rotavirových infekcí
- Hepatitida E – přehled současných poznatků
- Rizika šíření viru západonilské horečky v České republice
- Prevalenční studie kmenů Escherichia coli a Klebsiella pneumoniae produkujících karbapenemázu v českých nemocnicích – výsledky české části studie EuSCAPE (European Survey on Carbapenemase-Producing Enterobacteriaceae)
- Diagnostika infekcí vyvolaných Clostridium difficile v České republice – dostupnost, možnosti, interpretace laboratorních nálezů
- Prevalence výskytu nosního nosičství kmenů Staphylococcus aureus a meticilin rezistentních kmenů S. aureus (MRSA) u studentů všeobecného lékařství LF UP v Olomouci
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti zoonotického přenosu rotavirových infekcí
- Hepatitida E – přehled současných poznatků
- Prevalence výskytu nosního nosičství kmenů Staphylococcus aureus a meticilin rezistentních kmenů S. aureus (MRSA) u studentů všeobecného lékařství LF UP v Olomouci
- Toxoplasmóza u imunokompromitovaných pacientů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



