-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Prevalence Candida pelliculosa, Candida utilis a Candida fabianii ve Fakultní nemocnici Olomouc – epidemiologická studie
The prevalence of Candida pelliculosa, Candida utilis, and Candida fabianii in the Olomouc University Hospital: epidemiological study
Background:
The aims of this study were to determine the prevalence of C. pelliculosa, C. utilis, and C. fabianii in clinical samples collected from patients hospitalized in the Olomouc University Hospital and compare their minimum inhibitory concentrations (MICs ) to nine systemic antifungals with respect to yeast species, patient age, gender, and site of infection.Material and Methods:
Identification was performed biochemically and using mass spectrometry (MALDI-TOF MS). MICs were determined by the broth dilution method.Results:
Of a total of 163 clinical isolates, 119 were biochemically identified as C. pelliculosa and 44 as C. utilis. Using MALDI-TOF MS, 152 isolates were identified as C. fabianii, six as C. pelliculosa, three as C. utilis, and one as Ogataea polymorpha. The highest mean MICs were found in C. fabianii and in yeasts isolated from blood cultures and central venous catheters.Conclusions:
The MALDI-TOF MS found C. fabianii to be most prevalent in clinical samples as compared with the other studied species. The probable cause of discordant results between the two methods was the absence of C. fabianii in the database of the biochemical test kit which led to misidentification of this species. Higher MIC values in C. fabianii demonstrate the importance of the precise identification of this species.Keywords:
Candida fabianii – epidemiology – identification – MALDI-TOF – antifungals
Autori: L. Svobodová 1; D. Bednářová 2; P. Hamal 1
Pôsobisko autorov: Ústav mikrobiologie Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 1; GeneProof, a. s., Brno 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 1, s. 34-38
Kategória: Původní práce
Súhrn
Cíl práce:
Cílem studie bylo zjistit prevalenci Candida pelliculosa, Candida utilis a Candida fabianii v klinickém materiálu získaném od pacientů Fakultní nemocnice Olomouc a porovnat minimální inhibiční koncentrace (MIC) devíti systémových antimykotik s ohledem na druh kvasinky, pohlaví a věk pacientů a typ klinického materiálu, ze kterého byly kandidy vykultivovány.Materiál a metody:
Identifikace byla provedena biochemicky a pomocí hmotnostní spektrometrie (MALDI-TOF MS). MIC byly stanoveny mikrodiluční metodou.Výsledky:
Z celkového počtu 163 klinických izolátů bylo 119 biochemicky určeno jako C. pelliculosa a 44 jako C. utilis. S využitím MALDI-TOF MS bylo 152 kvasinek identifikováno jako C. fabianii, 6 jako C. pelliculosa, 3 jako C. utilis a 1 jako Ogataea polymorpha. Nejvyšší průměrné hodnoty MIC byly nalezeny u C. fabianii a obecně u izolátů z hemokultur a centrálních venózních katétrů.Závěry:
Pravděpodobnou příčinou nesouladu výsledků obou metod byla absence C. fabianii v druhové databázi biochemické soupravy. Byla zjištěna vyšší prevalence C. fabianii v klinickém materiálu v porovnání s ostatními dvěma druhy. Vyšší hodnoty MIC zaznamenané u C. fabianii demonstrují důležitost přesné identifikace tohoto druhu.Klíčová slova:
Candida fabianii – epidemiologie – identifikace – MALDI-TOF – antimykotikaÚVOD
Candida albicans zaujímá z hlediska četnosti stále první pozici v etiologii mykotických onemocnění, přesto počet případů vyvolaných non-albicans druhy a ostatními vzácně se vyskytujícími kvasinkami neustále narůstá [1, 2, 3]. Tento trend by mohl být způsoben profylaktickým podáváním flukonazolu hospitalizovaným jedincům, ohroženým systémovou mykotickou infekcí [4]. Další riziko představuje zavedený venózní katétr, který bývá nejčastěji asociován se záchytem Candida parapsilosis [5]. Neméně významně se na incidenci mykóz, způsobených non-albicans druhy, podílí i zvyšující se počet pacientů s manifestní formou AIDS [6, 7]. Z dalších rizikových faktorů lze uvést terapeutické intervence, vedoucí k porušení integrity přirozených ochranných bariér, např. cytostatická léčba nebo radioterapie [8]. Důležitou roli hraje i dlouhodobý pobyt v nemocnici a charakter základního onemocnění včetně způsobu jeho léčby [9]. V důsledku terapie širokospektrými antibiotiky dochází ke změnám v intestinální mikroflóře a následně k pomnožení kvasinek, které se pak mohou snadno dostat přes střevní sliznici do krevního oběhu. Kumulace uvedených predispozičních faktorů může vést, zejména u imunokompromitovaných jedinců, k rozvoji závažných systémových mykóz. Na etiologii se může podílet široké spektrum non-albicans druhů, mezi něž lze řadit i Candida pelliculosa, Candida utilis a Candida fabianii. Zmíněné kandidy jsou pomocí běžně používaných biochemických identifikačních postupů velmi obtížně rozlišitelné.
Hlavním cílem této studie bylo určení prevalence C. fabianii, C. pelliculosa a C. utilis v klinických vzorcích a stanovení minimálních inhibičních koncentrací (MIC) izolátů uvedených druhů k systémovým antimykotikům.
MATERIÁL A METODY
Studovaný soubor zahrnoval 163 kmenů kvasinek, určených na základě morfologie a biochemických vlastností jako C. pelliculosa nebo C. utilis. Sběr probíhal prospektivně v letech 2007–2013 izolací uvedených druhů kandid z klinického materiálu od pacientů z Fakultní nemocnice Olomouc. Počet kultur kvasinek, zahrnutých do studie, byl v jednotlivých letech následující: 2007 – 20, 2008 – 16, 2009 – 26, 2010 – 44, 2011 – 17, 2012 – 17 a 2013 – 23. V případě, že došlo u některého pacienta k opakovanému kultivačnímu záchytu téhož druhu mikromycety, byl do studie započítán pouze první izolovaný kmen. Doplňující informace o pacientech (věk, pohlaví, diagnóza) byly získány v laboratorním informačním systému.
Pro konfirmaci výsledků byly použity typové kmeny Candida fabianii (Lindnera fabianii CBS 5481), Candida pelliculosa (Wickerhamomyces anomalus CBS 605) a Candida utilis (Lindnera jadinii CBS 841).
Biochemická identifikace byla provedena pomocí soupravy ID 32C (bioMérieux, Francie). Metodický postup vycházel z pokynů výrobce. Testy se odečítaly vizuálně po 48 hodinách a získaný desetimístný kódový profil byl vyhodnocen pomocí identifikačního softwaru apiweb™ (bioMérieux, Francie).
K verifikaci výsledků získaných předchozí metodou byl celý soubor později identifikován s využitím hmotnostního spektrometru MALDI-TOF Microflex LT (Bruker Daltonics, Německo). Kvasinky byly nejprve inkubovány 18–24 hodin při 37 °C na Sabouraudově agaru (Trios, Česká republika), přičemž ke kontrole čistoty kultur byly inokulovány i na chromogenní půdu COLOREX Candida (Trios, Česká republika). Poté byla provedena extrakce pomocí etanolu a kyseliny mravenčí. Několik izolovaných kolonií bylo nejprve přeneseno do 1,5 ml mikrocentrifugační zkumavky (Eppendorf AG, Německo) a homogenizováno s 300 µl destilované vody. Ke vzniklé suspenzi bylo přidáno 900 µl absolutního etanolu (≥ 99,8 %) a celá směs byla centrifugována 2 minuty při maximálních otáčkách. Po odstranění supernatantu se vzorek znovu centrifugoval a po následném odsátí zbytkového etanolu se sediment nechal několik minut schnout při laboratorní teplotě. V dalším kroku bylo v závislosti na množství sedimentu přidáno 5–50 µl 70 % kyseliny mravenčí, směs byla promíchána, vortexována a poté doplněna stejným množstvím acetonitrilu. Na závěr byl vzorek opět centrifugován 2 minuty při maximálních otáčkách a supernatant byl přenesen v množství 1 µl na terčík MALDI destičky, kde byl po zaschnutí překryt 1 µl matrice. K identifikaci kvasinek byl využit software MALDI Biotyper, verze Flex Control 3.4 a RTC 3.1 (Bruker Daltonics, Německo). Měření hmotnostních spekter bylo prováděno v rozmezí 2,000–20,137 Da. Každý vzorek byl měřen minimálně třikrát ve třech nezávislých experimentech a pro vyhodnocení identifikace bylo použito pouze nejvyšší naměřené skóre.
K sekvenaci bylo vybráno 22 izolátů, u nichž bylo pomocí hmotnostního spektrometru opakovaně naměřeno nízké skóre. DNA kvasinek byla izolována s využitím soupravy GeneProof PathogenFree DNA Isolation Kit (GeneProof, a. s., Česká republika). PCR byla provedena amplifikace variabilní sekvence ITS2 na přístroji GeneAmp PCR System 9700 (Applied Biosystem, USA) pomocí univerzálních primerů UNF1/UNF2 [10]. Produkty byly přečištěny pomocí kolonkové soupravy DyeEx 2.0 Spin Kit (Qiagen, USA) a následně sekvenovány na analyzátoru ABI 3130. Zjištěné sekvence DNA byly vyhodnoceny v programu Sequencing Analysis 5.2 a MEGA 5.10 a porovnány s databází BLAST.
Testování citlivosti k antimykotikům (amfotericin B, flucytozin, flukonazol, itrakonazol, vorikonazol, posakonazol, kaspofungin, anidulafungin a mikafungin) bylo provedeno kolorimetrickou mikrodiluční soupravou Sensititre YeastOne (TREK Diagnostic Systems, USA). Metodický postup vycházel z pokynů výrobce. Ke kontrole kvality byly použity kmeny Candida krusei ATCC®6258 a Candida parapsilosis ATCC®22019. Výsledky byly hodnoceny vizuálně po 48 hodinách a průměrné MIC byly porovnány s ohledem na druh mikromycety, pohlaví a věk pacientů a typ klinického materiálu, ze kterého byly kandidy izolovány.
VÝSLEDKY
Z celkového počtu 163 kmenů kvasinek bylo za použití ID 32C určeno 119 jako C. pelliculosa (73 %) a 44 C. utilis (27 %). Celkem bylo zaznamenáno 34 různých numerických profilů, z nichž 25 bylo přiřazeno ke C. pelliculosa a 9 ke C. utilis. Pravděpodobnost správného určení podle programu apiweb™ se pohybovala mezi 54,2-99,9 %.
Na základě analýzy hmotnostním spektrometrem bylo 152 kultur určeno jako C. fabianii (93,3 %), 6 C. pelliculosa (3,7 %), 3 C. utilis (1,8 %), 1 Ogataea polymorpha (0,6 %) a 1 izolát (0,6 %) se identifikovat nepodařilo. Skóre kmenů označených jako C. fabianii se nacházelo v rozmezí 2,003–2,521 (průměr 2,185), C. pelliculosa 1,815–2,329 (2,087), C. utilis 2,037–2,142 (2,072), skóre O. polymorpha bylo 2,034 a neurčeného izolátu 1,294.
Následně byly porovnány výsledky získané biochemicky a hmotnostní spektrometrií. Všech šest kultur, určených prostřednictvím MALDI-TOF MS jako C. pelliculosa, se shodovalo s výsledky biochemické identifikace. Izoláty určené hmotnostním spektrometrem jako C. utilis (n = 3) byly ve dvou případech biochemicky určeny jako C. utilis a v jednom jako C. pelliculosa. Kvasinky, definované hmotnostním spektrometrem jako C. fabianii (n = 152), byly s využitím ID 32C v 110 případech (72,4 %) označeny jako C. pelliculosa a 42 C. utilis (27,6 %).
Z celkového počtu 22 kmenů kvasinek vybraných pro sekvencování, došlo u 21 z nich ke shodě s výsledky získanými pomocí MALDI-TOF MS. Izolát, který nebyl hmotnostním spektrometrem určen, byl na základě molekulární genetiky přiřazen ke druhu O. polymorpha.
Výsledné průměrné hodnoty MIC systémových antimykotik testovaného souboru kvasinek včetně porovnání mezi jednotlivými druhy jsou shrnuty v tabulce 1. Vyplývá z ní, že s výjimkou flucytozinu byly nejvyšší MIC zaznamenány u C. fabianii.
Tab. 1. Mezidruhové porovnání průměrných MIC antimykotik Table 1. Interspecies comparison of the mean MICs of antifungals 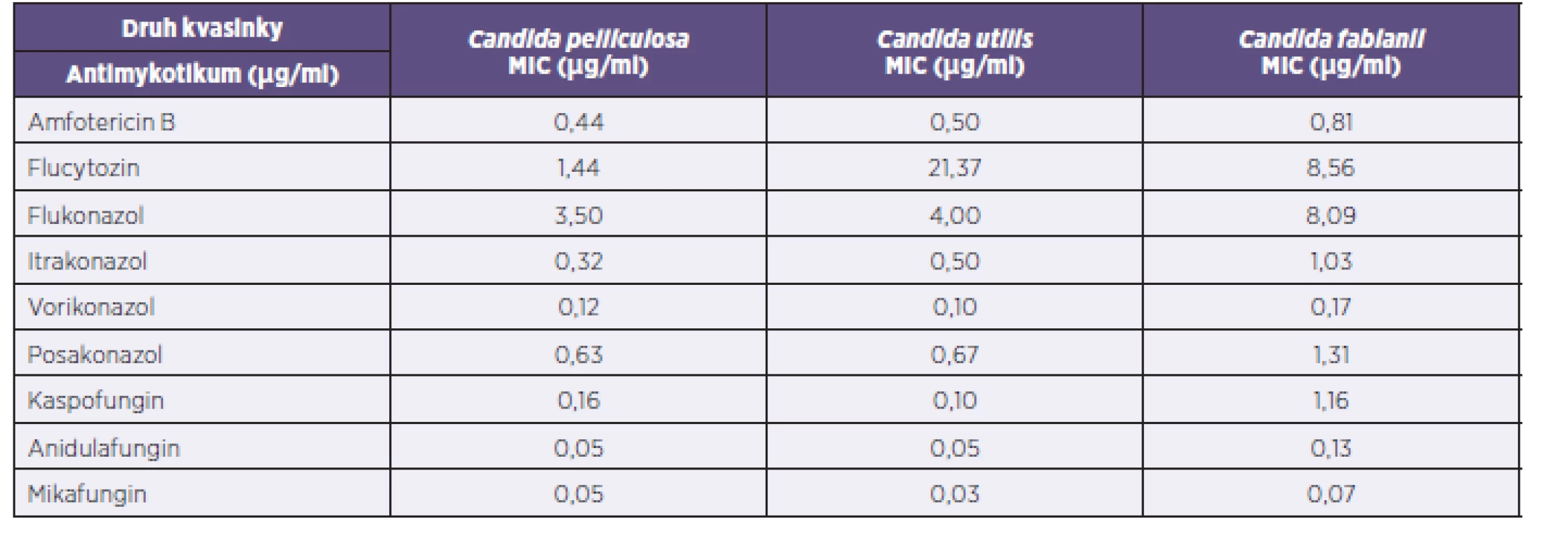
V tabulce 2 jsou uvedeny MIC izolátů podle pohlaví pacientů. Kandidy, zahrnuté do studie byly získány celkem od 163 pacientů, z nichž 88 byli muži a 75 ženy. Kvasinky izolované od nemocných mužského pohlaví měly u všech antimykotik v průměru vyšší MIC.
Tab. 2. Porovnání průměrných MIC antimykotik (v μg/ml) u studovaného souboru kvasinkových izolátů podle pohlaví pacientů Table 2. Mean MICs of antifungals (in μg/ml) in the study panel of yeast isolates by patient gender 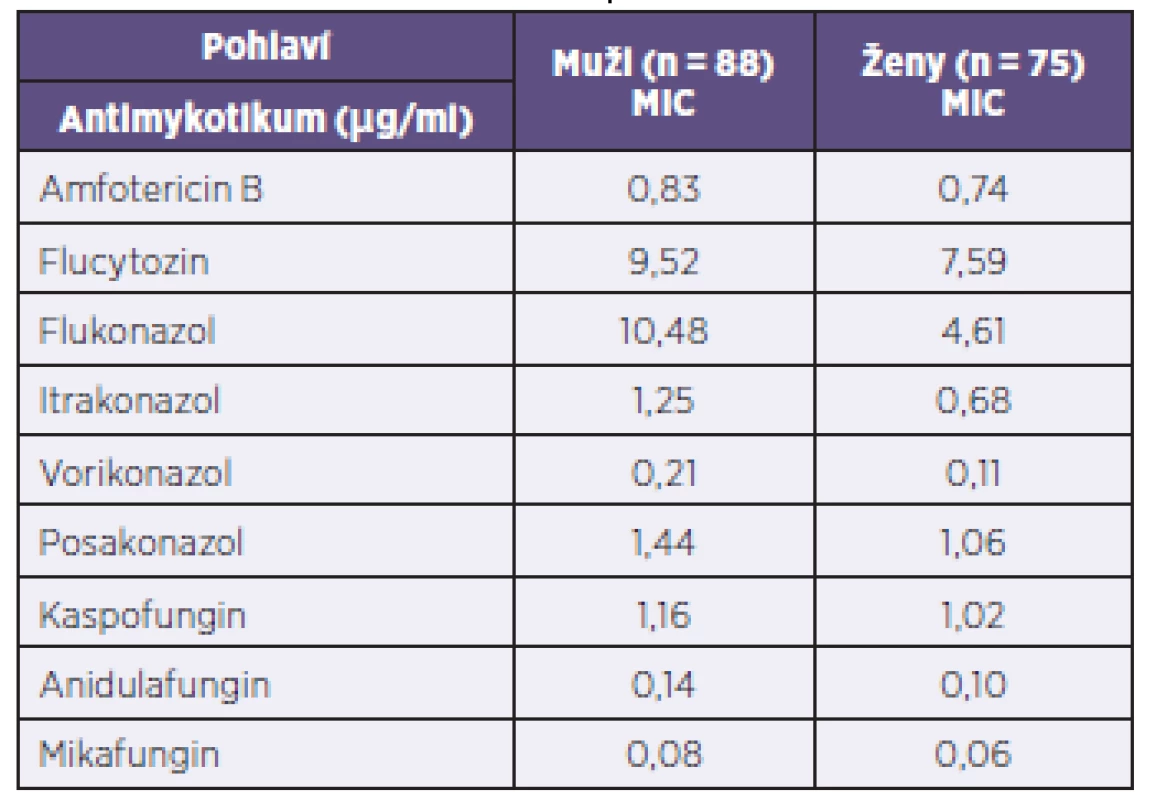
V grafu 1 je demonstrován počet izolovaných kandid v závislosti na věku pacientů. Nejnižší průměrné hodnoty MIC byly zjištěny u věkových skupin 11–30 let, naopak nejvyšší byly nalezeny ve skupině 0–10 let a poté u osob starších 50 let.
Graf 1. Počet izolovaných kvasinek v závislosti na věku pacientů Figure 1. Distribution of yeast isolates by patient age 
Dále byly porovnávány průměrné MIC s ohledem na klinický materiál, ze kterého byly kvasinky vykultivovány. Počty izolovaných kandid byly následující: 62 z materiálu z dolních dýchacích cest (bronchoalveolární laváž, endosekret, sputum), 41 z výtěru z krku nebo dutiny ústní, 37 z moči, 8 z hemokultur, respektive centrálních žilních katétrů, 5 ze sekretu z drénu nebo punktátu, 4 ze stolice nebo perianálního stěru a tři z kůže nebo kožních adnex. Zbylé tři kultury nebyly z tohoto hlediska posuzovány, jelikož byly izolovány z klinických materiálů, které nebylo možno zařadit do žádné z výše uvedených skupin. MIC ve vztahu k typu klinického materiálu jsou shrnuty v tabulce 3. Nejvyšší hodnoty, zejména azolových antimykotik, byly zaznamenány u kvasinek získaných z hemokultur a cévních kanyl a dále u izolátů z moči, naopak nejnižší vykazovaly kandidy z kůže a kožních adnex. Poměrně nízké MIC, zejména azolových antimykotik, byly zaznamenány také u kvasinek izolovaných ze stolice, respektive perianálního stěru.
Tab. 3. Porovnání průměrných MIC antimykotik (v μg/ml) u studovaného souboru kvasinkových izolátů podle druhu klinického materiálu Table 3. The mean MICs of antifungals (in μg/ml) in the study panel of yeast isolates by clinical specimen type 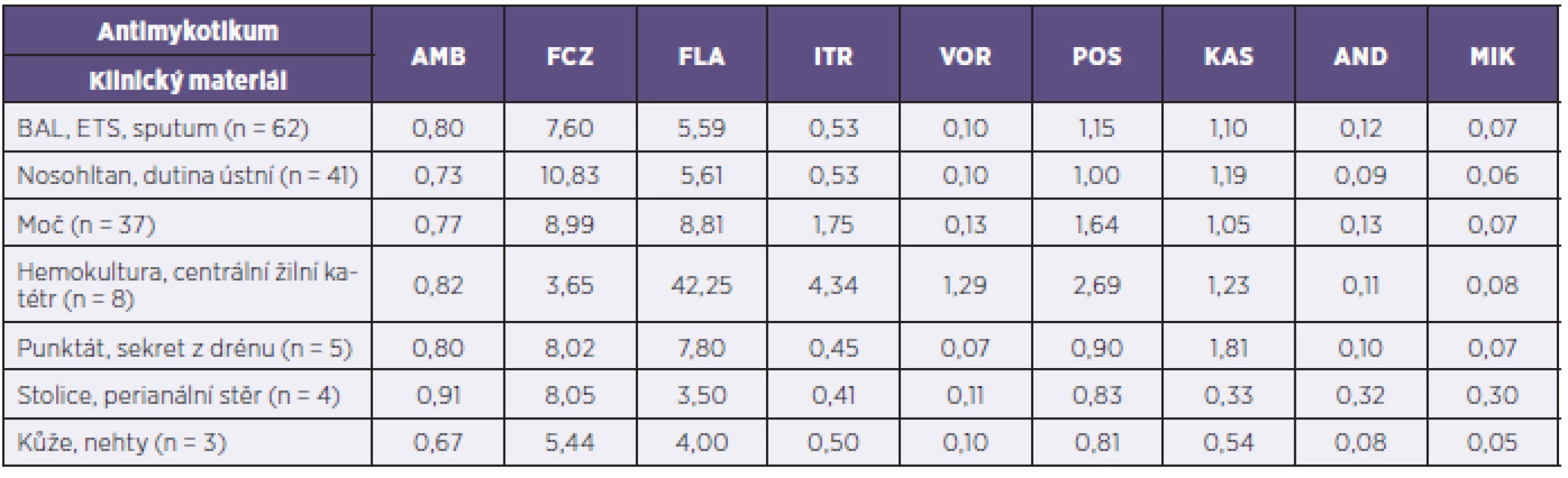
AMB – amfotericin B, FCZ – flucytozin, FLA – flukonazol, ITR – itrakonazol, VOR – vorikonazol, POS – posakonazol, KAS – kaspofungin, AND – anidulafungin, MIK – mikafungin AMB – amphotericin B, FCZ – flucytosine, FLA – fluconazolum, ITR – itraconazolum, VOR – voriconazolum, POS – posaconazole, KAS – caspofungin, AND – anidulafungin, MIK – micafungin DISKUSE
Candida fabianii byla kromě různých lokalit lidského organismu izolována také z půdy, cukrové třtiny, oliv, nálevky brouka Xylion adustus, rýžového fermentátu získaného metabolickou činností vláknité houby Aspergillus oryzae a zařízení, sloužícího k výrobě butylglykolu za účasti bakterie Enterobacter aerogenes [11, 12, 13]. Zmíněný druh nebyl a dosud stále není součástí žádné z kvasinkových databází běžně používaných biochemických identifikačních souprav. Uvedená skutečnost je pravděpodobně hlavní příčinou toho, že v dostupných literárních zdrojích je zatím zařazeno pouze osm případů lidských infekcí vyvolaných tímto kvasinkovým druhem, v porovnání s 42 kazuistikami, v nichž byla za etiologické agens považována C. pelliculosa [14–21]. S ohledem na výsledky této studie nelze vyloučit, že některé z kvasinek, v publikacích původně deklarovaných jako C. pelliculosa, byly ve skutečnosti C. fabianii. Pravděpodobnost nesprávné identifikace je vysoká, zvláště v případech, kde byly k druhovému určení použity biochemické soupravy. Dá se však předpokládat, že se zavedením hmotnostní spektrometrie jako prostředku pro rutinní mykologickou diagnostiku, se počet prokázaných případů způsobených C. fabianii velmi rychle zvýší. Většina hmotnostních spektrometrů má v současné době C. fabianii již zahrnutou ve svých identifikačních databázích, čímž je umožněna její snadná a rychlá identifikace přímo v laboratoři klinické mykologie.
Při hodnocení biochemických vlastností soupravou ID 32C byl u šesti izolátů pozorován nápadně zvýšený růst v jamce obsahující methyl-D-glukopyranosid (MDG). Všechny tyto kmeny byly určeny jako C. pelliculosa s pravděpodobností 99,9 %, zatímco kandidy, u kterých byl růst v jamce s tímto substrátem méně výrazný, byly označeny jako C. pelliculosa s pravděpodobností spadající do rozmezí 54,2–99,7 %. Jak již bylo zmíněno výše, C. fabianii nemohla být pomocí ID 32C diferencována, jelikož její profil není v databázi apiweb zahrnut.
Z hlediska hmotnostní spektrometrie se podle našich zkušeností jeví jako nejproblematičtější analýza druhu C. pelliculosa, u něhož musel být v mnoha případech celý postup měření vícekrát zopakován (> 3 standardní měření), aby bylo dosaženo přijatelné hodnoty skóre (nad 2,000). Spektrum C. fabianii muselo být při zahájení studie do databáze aktivně vloženo opakovaným měřením referenčního kmene (L. fabianii CBS 5481), jelikož při zahájení této studie v ní ještě nebylo zahrnuto. Následnou identifikací klinických izolátů C. fabianii ale bylo dosaženo v průměru vyššího skóre než u C. pelliculosa a C. utilis, což naznačuje možnost využití hmotnostního spektrometru ke spolehlivé identifikaci uvedeného druhu v rutinní praxi mykologických laboratoří. Zajímavým zjištěním bylo, že se u kvasinek, určených hmotnostním spektrometrem jako C. fabianii a soupravou ID 32C jako C. pelliculosa, pohybovala pravděpodobnost správné biochemické identifikace v rozmezí 54,2–99,7 %. Naproti tomu kandidy, které byly označené oběma metodami jako C. pelliculosa (n = 6), byly zmíněnou soupravou identifikovány s pravděpodobností 99,9 %. Současně byl u nich v porovnání se zbytkem souboru shledán již zmíněný fenomén masivního růstu v jamce s MDG. Pokud by zjištěná skutečnost platila obecně, daly by se tímto způsobem definovat numerické profily, specifické pro druh C. fabianii i C. pelliculosa.
Na základě získaných hodnot MIC lze usoudit, že aspekty jako jsou věk nebo výskyt v určitých tělních lokalitách, mohou mít vliv na citlivost/rezistenci studovaných druhů kandid k systémovým antimykotikům. Vyšší hodnoty MIC u izolátů získaných z hemokultur a centrálních venózních katétrů mohou být odrazem těžkého celkového zdravotního stavu pacienta, u něhož lze předpokládat řadu rizikových faktorů. Ty pak mohou vést k rozvoji systémových mykóz a při nevhodně zvolené antifungální terapii i k postupné selekci rezistentních kmenů kandid. Zjištěný vyšší počet izolovaných kvasinek u dětí mladších 10 let může být rovněž důsledkem kumulace predispozičních faktorů, specifických pro nižší věk, např. nízká porodní hmotnost či parenterální výživa.
Vyšší hodnoty MIC zaznamenané u C. fabianii demonstrují důležitost nalezení způsobu přesné identifikace tohoto druhu. Zmíněné vyjádření lze navíc podpořit nálezem 14 izolátů C. fabianii, které byly rezistentní ke dvěma a více antimykotikům.
ZÁVĚR
Absence C. fabianii v softwarových databázích běžně používaných biochemických testů je příčinou chybné identifikace tohoto druhu. Pomocí komerčního setu ID 32C je tato kvasinka nesprávně určována buď jako C. pelliculosa, nebo jako C. utilis. Na základě výsledků získaných pomocí hmotnostního spektrometru bylo zjištěno, že se C. fabianii vyskytuje v klinickém materiálu v porovnání s ostatními dvěma druhy mnohem častěji, než bylo původně předpokládáno. Vzhledem k výše uvedeným okolnostem je pro rutinní diferenciaci C. pelliculosa, C. utilis a C. fabianii v současnosti nejvhodnější použití hmotnostní spektrometrie. Vzájemným porovnáním výsledků obou metod byly nalezeny numerické profily, specifické pro C. fabianii. Aktualizací softwarové databáze apiweb™ by mohla být umožněna identifikace C. fabianii i pomocí jinak velmi spolehlivé biochemické soupravy ID 32C. V souvislosti s testováním citlivosti k antimykotikům byly zjištěny zajímavé skutečnosti, zejména poměrně vysoké hodnoty MIC u C. fabianii a dále obecně u kvasinek studovaných druhů, izolovaných z hemokultur a centrálních venózních katétrů.
Poděkování
Práce byla podpořena vnitřním grantem IGA_LF_2015_035.
Do redakce došlo dne 17. 6. 2015.
Adresa pro korespondenci:
MDDr. Lucie Svobodová
Ústav mikrobiologie Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc
Hněvotínská 3
775 15 Olomouc
e-mail: luciettasv@seznam.cz
Zdroje
1. Nguyen MH, Peacock JE, Morris AJ, et al. The changing face of candidemia: emergence of non-Candida albicans species and antifungal resistance. Am J Med, 1996;100(6):617–623.
2. Chow JK, Golan Y, Ruthazer R, et al. Factors associated with candidemia caused by non-albicans Candida species versus Candida albicans in the intensive care unit. Clin Infect Dis, 2008;46(8):1206–1213.
3. Krcmery V, Barnes AJ. Non-albicans Candida spp. causing fungaemia: pathogenicity and antifungal resistance. J Hosp Infect, 2002;50(4):243–260.
4. Hachem R, Hanna H, Kontoyiannis D, et al. The changing epidemiology of invasive candidiasis. Cancer, 2008;112(11):2493–2499.
5. Trofa D, Gácser A, Nosanchuk JD. Candida parapsilosis, an emerging fungal pathogen. Clin Microbiol Rev, 2008;21(4):606–625.
6. Enwuru CA, Ogunledun A, Idika N, et al. Fluconazole resistant opportunistic oropharyngeal Candida and non-Candida yeast-like isolates from HIV infected patients attending ARV clinics in Lagos, Nigeria. Afr Health Sci, 2008;8(3):142–148.
7. Redding SW, Kirkpatrick WR, Dib O, et al. The epidemiology of non-albicans Candida in oropharyngeal candidiasis in HIV patients. Spec Care Dentist, 2000;20(5):178–181.
8. Nicolatou-Galitis O, Velegraki A, Sotiropoulou-Lontou A, et al. Effect of fluconazole antifungal prophylaxis on oral mucositis in head and neck cancer patients receiving radiotherapy. Support Care Cancer, 2006;14(1):44–51.
9. Haber J, Jesenská Z, Krčméry V, et al. Systémové mykózy a jejich léčba. Praha: Galén; 1995.
10. Dendis M, Horváth R, Michálek J, et al. PCR-RFLP detection and species identification of fungal pathogens in patients with febrile neutropenia. Clin Microbiol Infect, 2003;9(12):1191–1202.
11. Kurtzman CP, Fell JW. The yeasts, a taxonomic study. Amsterdam: Elsevier Science BV; 1998.
12. Limtong S, Kaewwichian R, Yongmanitchai W, et al. Diversity of culturable yeasts in phylloplane of sugarcane in Thailand and their capability to produce indole-3-acetic acid. World J Microbiol Biotechnol, 2014;30(6):1785–1796.
13. Romo-Sánchez S, Alves-Baffi M, Arévalo-Villena M, et al. Yeast biodiversity from oleic ecosystems: study of their biotechnological properties. Food Microbiol, 2010;27(4):487–492.
14. Dooley DP, Beckius ML, McAllister CK, et al. Prostatitis caused by Hansenula fabianii. J Infect Dis, 1990;161(5):1040–1041.
15. Bhally HS, Jain S, Shields C, et al. Infection in a neonate caused by Pichia fabianii: importance of molecular identification. Med Mycol, 2006;44(2):185–187.
16. Valenza G, Valenza R, Brederlau J, et al. Identification of Candida fabianii as a cause of lethal septicaemia. Mycoses, 2006;49(4):331–334.
17. Hamal P, Ostransky J, Dendis M, et al. A case of endocarditis caused by the yeast Pichia fabianii with biofilm production and developed in vitro resistance to azoles in the course of antifungal treatment. Med Mycol, 2008;46(6):601–605.
18. Grenouillet F, Millon L, Chamouine A, et al. Pichia fabianii fungemia in a neonate. Pediatr Infect Dis J, 2010;29(2):191.
19. Gabriel F, Noel T, Accoceberry I. Lindnera (Pichia) fabianii blood infection after mesenteric ischemia. Med Mycol, 2012;50(3):310–314.
20. Yun JW, Park KS, Ki CS, et al. Catheter-related bloodstream infection by Lindnera fabianii in a neutropenic patient. J Med Microbiol, 2013;62(6):922–925.
21. Wu Y, Wang J, Li W, et al. Pichia fabianii blood infection in a premature infant in China: case report. BMC Research Notes, 2013;6 : 77.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2016 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Antibiotická léčba klostridiové kolitidy
- Prevalence infekčních komplikací u popálených pacientů vyžadujících intenzivní péči: data z panevropské studie
- Úvodník
- Prevalence Candida pelliculosa, Candida utilis a Candida fabianii ve Fakultní nemocnici Olomouc – epidemiologická studie
- Přínos avidity IgG protilátek u příušnic ve vysoce proočkované populaci v kontextu s ostatními sérologickými metodami laboratorní diagnostiky příušnic a současnou epidemiologickou situací
- Virus hepatitidy E
- Chřipka u dětské populace v Istanbulu – zkušenosti jednoho centra 2009–2014
- Posuzování invalidity u infekčních onemocnění
- Infekční a další somatická komorbidita problémových uživatelů drog – výsledky průřezové studie s lékařským vyšetřením
- XXV. Tomáškovy dny mladých mikrobiologů
- PhMr. Jaroslav Švec
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Antibiotická léčba klostridiové kolitidy
- Infekční a další somatická komorbidita problémových uživatelů drog – výsledky průřezové studie s lékařským vyšetřením
- Virus hepatitidy E
- Posuzování invalidity u infekčních onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



