-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
IGRA metody v rutinním provozu – QuantiFERON®-TB Gold nebo T-SPOT®.TB?
IGRA methods in the routine operation – QuantiFERON®-TB Gold or T-SPOT.TB?
For indirect diagnosis of tuberculosis, two commercial IGRA (Interferon Gamma Release Assay) assays are available – primal QuantiFERON®-TB Gold test, new version QuantiFERON®-TB Gold Plus test (four tube, differentiation in activity CD4+ a CD8+) and T-SPOT®.TB test. Both methods are based on the same principle, but their workflows are different. In this article, both assays are compared on the collection of 284 patients. Inter-rate agreement measure showed 81.3% consistency and Cohen’s kappa index was calculated as 0.72. In case of discrepancy between IGRA and other methods (clinical aspects, X-ray diagnostic, etc.), results should be confirmed by second IGRA assay for correct interpretation.
KEYWORDS:
IGRA – Mycobacterium tuberculosis – Quantiferon – T-SPOT®.TB
Autori: J. Amlerová; J. Hrabák
Pôsobisko autorov: Ústav mikrobiologie a Biomedicínské centrum, Lékařská fakulta a Fakultní nemocnice v Plzni, Univerzita Karlova
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 65, 2016, č. 4, s. 246-248
Kategória: Krátké sdělení
Súhrn
V současné době jsou pro nepřímou diagnostiku tuberkulózy k rutinnímu použití dostupné dvě komerční IGRA (Interferon Gamma Release Assay) metody – starší QuantiFERON®-TB Gold, nově na trhu dostupná verze QuantiFERON®-TB Gold Plus (čtyřzkumavková, s diferenciací aktivity CD4+ a CD8+) a T-SPOT ®.TB. Obě využívají podobný princip, ale liší se v provedení. Ve sdělení jsou porovnány výsledky vyšetření 284 pacientů, u nichž byly provedeny obě metody. Shoda ve výsledcích obou metod byla v 81,3 %, což odpovídá hodnocení indexem Cohenovým kappa 0,72. Pro správnou interpretaci IGRA je při rozporu výsledku jedné z metod s dalšími nálezy u pacienta (klinický stav, zobrazovací metody apod.) vhodné výsledek konfirmovat provedením druhé metody.
KLÍČOVÁ SLOVA:
IGRA – Mycobacterium tuberculosis – Quantiferon – T-SPOT®.TBÚVOD
IGRA (Interferon Gamma Release Assay) metody jsou již zařazeny do rutinních postupů nepřímé diagnostiky tuberkulózy, zejména její latentní formy (LTBI). V současné době jsou v ČR dostupné dvě metody: QuantiFERON®-TB Gold (QFT), respektive nová varianta QuantiFERON®-TB Gold Plus (QFT Plus), se stejným postupem, ale vyšší citlivostí (Qiagen, Germany) a T-SPOT®.TB (Oxford Immunotec Ltd, UK). Obě metody využívají podobný princip – produkci interferonu gama (IF-γ) efektorovými T-lymfocyty (CD4+ a CD8+) po jejich stimulaci in vitro antigeny specifickými pro Mycobacterium tuberculosis. Tyto antigeny nejsou přítomny u všech kmenů BCG a u většiny netuberkulózních mykobakterií s výjimkou M. kansasii, M. szulgai a M. marinum [1]. Vyšetření se provádí u obou metod z nesrážlivé krve za použití heparinu nebo případně u metody T-SPOT.TB i citrátu sodného. Základním předpokladem správného provedení metody je šetrná manipulace se vzorky krve a jejich včasný transport do laboratoře tak, aby nedošlo k poškození lymfocytů a jejich funkce.
Metoda QFT používá specifické tuberkulózní peptidové antigeny ESAT-6, CFP-10 a TB-7.7. Inkubace odebrané krve (16–24 hod v 37 °C) probíhá ve zkumavce s antigeny TB Ag, ve zkumavce s mitogenem MIT a v negativní kontrole NIL (stanovení hladiny nespecifického IF-γ v krvi, tzv. pozadí reakce). Ve zkumavce MIT je fytohemaglutinin – polyklonální stimulant T-lymfocytů, který slouží jako pozitivní kontrola imunitní odpovědi pacienta a současně jako kontrola správné manipulace s krví a inkubace [2]. Po inkubaci je oddělena plazma z jednotlivých zkumavek. Plazmu je možné uchovat 28 dní při teplotě 2–8 °C nebo 3 měsíce při teplotě nižší než -20 °C.
Produkce IF-γ je stanovena metodou ELISA, výsledek je kvantifikován porovnáním množství IF-γ ve zkumavkách s antigenem vůči zkumavkám NIL a MIT. Za cut-off je považována hodnota rozdílu TB Ag a NIL 0,35 IU/ml při zachování rozdílu mezi MIT a NIL ≥ 0,5 IU/ml a dalších kritérií podle výrobce.
V současné době je již na trhu dostupná nová varianta QFT – QuantiFERON®-TB Gold Plus, která stimuluje lymfocyty se specifickými antigeny ve dvou zkumavkách TB1 a TB2. Obě zkumavky obsahují stejné antigeny (ESAT-6 a CFP-10). Zkumavka TB1 obsahuje peptidy z těchto antigenů navržené ke zjištění buněčné imunitní odpovědi z populace lymfocytů CD4+ (pomocné lymfocyty), zkumavka TB2 pak sadu peptidů ke zjištění odpovědi CD8+ (cytotoxické lymfocyty). Použití zkumavek MIT a NIL je totožné jako v předchozí verzi, hodnocení je obdobné.
Principem metody T-SPOT.TB je in vitro detekce efektorových T-lymfocytů senzibilizovaných opět specifickými tuberkulózními antigeny (ESAT6 a CFP10). Tato metoda je variantou spotové (otiskové) analýzy skvrn (ELISPOT) umožňující zjišťovat počet takto senzibilizovaných lymfocytů, přičemž každý z antigenů je analyzován zvlášť. Před provedením reakce se periferní krevní mononukleární buňky (PBMC) separují z periferní krve, promyjí, stanoví se jejich počet a do reakce se použije jejich standardizované množství. Reakce je prováděna v mikrotitrační destičce, ve čtyřech jamkách – negativní kontrola (zjištění aktivity nespecifických buněk), TB specifické antigeny ve dvou jamkách (panel A – ESAT6 a panel B – CFP10) a pozitivní kontrola (fytohemaglutinin k potvrzení funkčnosti PBMC) [3]. Inkubace probíhá 16–20 hod v 37 °C ve zvlhčené atmosféře s 5 % CO2. Po inkubaci je provedena reakce ELISPOT. Po dokončení reakce je hodnocen počet spotů v jednotlivých jamkách, kdy každý spot představuje otisk jednoho T-lymfocytu vylučujícího cytokin IF-γ. Výsledek vychází z rozdílu počtu spotů v každé z jamek s antigenem a počtu spotů v negativní kontrole. Hranice pozitivity je stanovena na výsledek 6 spotů aspoň pro jednu z jamek za dodržení dalších kritérií hodnocení podle výrobce. Výsledný počet spotů 5–7 lze považovat za hraniční. Metoda ELISPOT má vyšší senzitivitu než ELISA, protože detekuje cílový cytokin (IF-γ) přímo u buňky, která ho vytváří, zatímco u metod ELISA může být IF-γ rozpuštěn v supernatantu, zachycen receptory ostatních buněk nebo zničen [4, 5].
Obě metody lze považovat za vysoce specifické a senzitivní při vědomí obtížné konfirmace přítomnosti TB antigenů v organismu, zejména při LTBI. Míra senzitivity závisí na formě tuberkulózy (latentní-aktivní), případně i na charakteristice stavu pacienta (věk, přidružená onemocnění apod.) [6].
Před klinikem i laboratorním pracovníkem stojí volba, kterou z těchto metod indikovat pro vyšetření v konkrétním případě a kterou zařadit do rutinního laboratorního provozu. V tomto sdělení jsou porovnány výsledky vyšetření oběma metodami u 284 nemocných.
MATERIÁL A METODY
Soubor pacientů
V období od 10. 5. 2012 do 31. 7. 2015 bylo vyšetřeno celkem 284 pacientů. U každého z nich byl proveden odběr krve na klinickém pracovišti ambulantního nebo lůžkového typu. Odběry vzorků pro obě metody byly provedeny z jedné venepunkce nebo v odstupu maximálně 14 dní (průměr 3,09 dne). Do souboru byli zařazeni pacienti s různými diagnózami, včetně pacientů před biologickou léčbou nebo na ní (n = 89), pacientů po kontaktu s tuberkulózou (TB), n = 42, pacientů s primární plicní malignitou (n = 9) a pacientů s bakteriologicky ověřenou tuberkulózou (n = 12). V souboru bylo 153 mužů a 131 žen. Ve věku 0–18 let bylo 8 pacientů, 19–50 let 108 pacientů, 51–70 let 120 a 71 a více let 48 pacientů.
Vyšetření
Vzorky tohoto souboru byly vyšetřeny metodou QuantiFERON®-TB Gold varianta In Tube.
Krev na QFT byla odebrána do odběrové soupravy tří zkumavek po 1 ml (TBAg, NIL a MIT), manipulace s krví proběhla podle doporučení výrobce (8–10krát promícháno). Odběr na T-SPOT.TB byl proveden do zkumavky s protisrážlivým přípravkem lithium-heparinem (8 ml, u dětí do 9 let 4 ml). V obou případech byla krev doručena do laboratoře do 5 hodin po odběru (limit metody je 16 hodin u QFT a 8 hodin u T-SPOT.TB). Krev pro QFT byla znovu promíchána a inkubována 16–24 hod při 37 °C.
Krev pro T-SPOT.TB byla zpracována maximálně 8 hodin po odběru. Lymfocyty byly separovány pomocí zkumavek Leucosep (Oxford Immunotec Ltd, UK), počet lymfocytů byl hodnocen po obarvení trypanovou modří v jednorázové plastové počítací mřížce. Lymfocyty byly do reakce naředěny na standardní množství 2,5 x 106 buněk/ml.
Hodnocení výsledků probíhalo podle doporučení výrobců jednotlivých souprav. Shoda obou metod byla vyhodnocena Cohenovým kappa po vyřazení neurčených výsledků v metodě QFT.
VÝSLEDKY
Shoda výsledků v obou metodách činila 81,3 % (tab. 1). Neurčených výsledků v QFT bylo 30, při provedení metodou T-SPOT.TB z nich bylo 27 negativních a 3 pozitivní (tab. 2). Výsledky byly rozděleny podle indikačních skupin, kde má stanovení IGRA významnou roli pro určení diagnózy nebo pro další vývoj onemocnění, tzn. pacienti před biologickou léčbou nebo na biologické léčbě, pa-cienti po kontaktu s TB, s primárním karcinomem plic a pacienti s následně kultivačně ověřenou TB (viz tab. 1).
Tab. 1. Výsledky vyšetření metodami QuantiFERON®-TB Gold a T-SPOT.TB (určené vzorky) Table 1. Results of the QuantiFERON®-TB Gold and T-SPOT®.TB tests (samples determined by QFT) 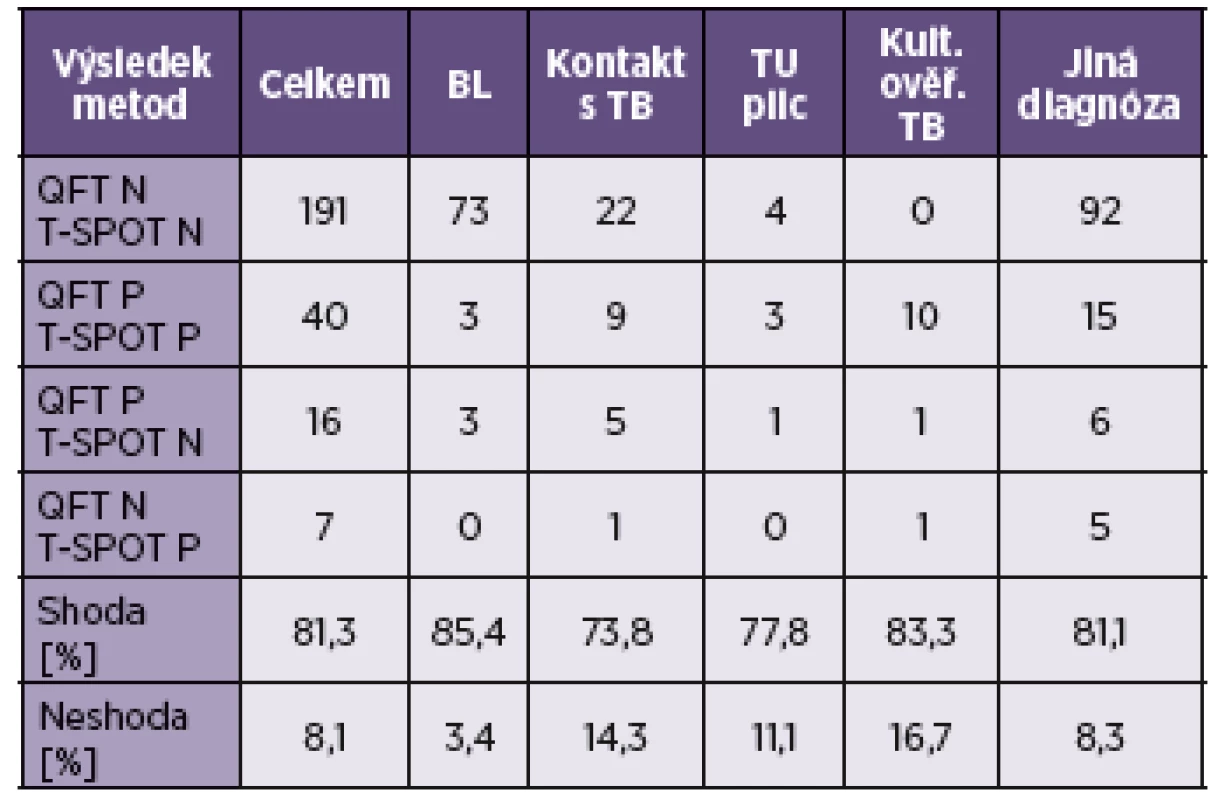
Pozn.: Vzorky s QFT neurčeno byly řazeny zvlášť (viz tab. 2) – tedy ani shoda, ani neshoda. Použité zkratky: N – negativní, P – pozitivní, BL – biologická léčba, TU – primární plicní tumor, kult. ověř. TB – kultivačně ověřená tuberkulóza. Note: Samples not determined by QFT were presented separately (see Table 2) – neither agreement nor disagreement. Abbreviations: N – negative, P – positive, BL – biological therapy, TU – primary lung tumour, cc TB – culture confirmed tuberculosis. Tab. 2. Výsledky vyšetření metodami QuantiFERON®-TB Gold a T-SPOT.TB – neurčené vzorky metodou QFT Table 2. Results of the QuantiFERON®-TB Gold and T-SPOT.TB tests (samples not determined by QFT) 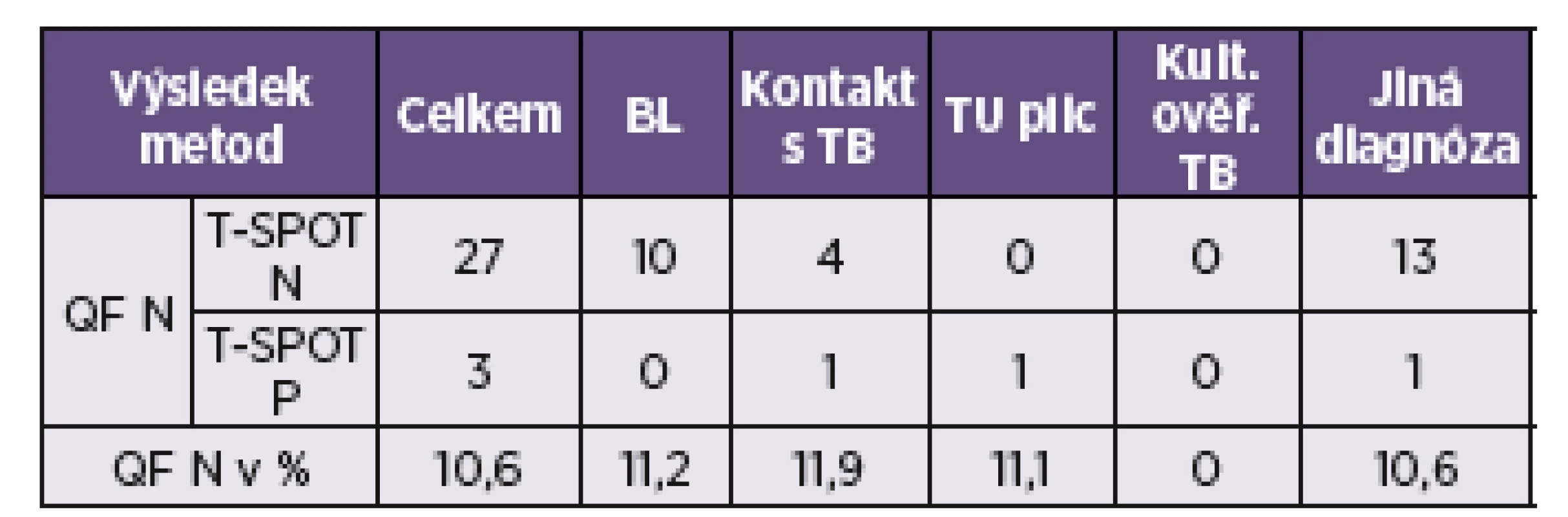
Použité zkratky: N – negativní, P – pozitivní, BL – biologická léčba, TU – primární plicní tumor, kult. ověř. TB – kultivačně ověřená tuberkulóza. Výsledný kappa index byl 0,72, což je podle Landise-Kocha [7] hodnoceno jako shoda značná.
DISKUSE
Výsledky této studie ukazují relativně vysokou shodu v obou metodách, podobné výsledky byly dosaženy i v jiných studiích, např. κ 0,83 – srovnávací studie u dětí [8].
Volba metody zařazené do rutinního provozu závisí na mnoha okolnostech. Je nezbytné brát v úvahu počet vyšetřovaných vzorků, provozní kapacitu laboratoře (personál, technické zázemí atd.). Metoda QFT je obecně méně náročná, jednoduše reprodukovatelná a opakovatelná. Existuje k ní EQA kontrola (systém externího hodnocení kvality). Plazmu po inkubaci je zde možné skladovat, vlastní test ELISA lze tak provádět plánovaně s větším počtem vzorků (vhodné pro automatizaci a zpracování analyzátory), manipulace se vzorkem i s plazmou je méně náročná na techniku a zkušenost laboratorního pracovníka. Metodu T-SPOT. TB je nutno provádět v den odběru, manipulace s lymfocyty vyžaduje větší erudici personálu, metoda je náročnější manuálně i na technické vybavení (separace lymfocytů, chlazená centrifuga, inkubátor CO2 apod.). Je obtížněji reprodukovatelná a opakovatelná. Kontrola EQA k této metodě není dostupná. Naproti tomu toto náročnější provedení umožňuje přesnější hodnocení jednotlivých fází metody – vědomí o kvalitě reagujících lymfocytů, vizuální zhodnocení inkubace (při chybné inkubaci změna barvy v destičce) atd. Podle našich zkušeností lze volit v rutinním provozu QFT jako metodu základní z důvodu snadnějšího provedení a důvodů ekonomických, metodu T-SPOT.TB pak jako metodu konfirmační u neurčených výsledků QFT, u výsledků hraničních nebo u výsledků nekorespondujících s dalšími nálezy u pacienta.
ZÁVĚR
Metody IGRA jednoznačně představují přínos v diagnostice tuberkulózy. Volba komerčně dostupných metod závisí na provozu provádějící laboratoře. Kvalita výsledku závisí na celém procesu, včetně manipulace se vzorkem v preanalytické fázi.
Interpretace výsledků obou dostupných metod musí probíhat vždy v souvislosti s klinickým stavem pacienta a s jeho dalšími nálezy. Je proto vhodné při rozporu výsledku IGRA s dalšími okolnostmi konfirmovat výsledek druhou metodou, při nedostupnosti druhé metody alespoň opakovat vyšetření. Vždy je nutné mít na paměti, že diagnóza aktivní tuberkulózy, respektive její vyloučení, nesmí být stanovena pouze na základě výsledku IGRA. Výsledek IGRA informuje klinika pouze o pravděpodobné nebo nepravděpodobné přítomnosti tuberkulózního antigenu v organismu.
Poděkování
Práce byla podpořena projektem PRVOUK P36 - Náhrada, podpora a regenerace funkce některých životně důležitých tkání a orgánů a Národního programu udržitelnosti č. LO1503 poskytovaného Ministerstvem školství, mládeže a tělovýchovy ČR.
Do redakce došlo dne 7. 6. 2016.
Adresa pro korespondenci:
MUDr. Jana Amlerová
Ústav mikrobiologie
Fakultní nemocnice v Plzni
Edvarda Beneše 13
305 99 Plzeň-Bory
e-mail: amlerova@fnplzen.cz
Zdroje
1. Andersen P, Munk ME, Pollock JM, et al. Specific immune-based diagnosis of tuberculosis. Lancet, 2000; 356(9235): 1099–1104.
2. Woo KS, Choi JL, Kim BR, et al. Significance of interferon-gamma response to mitogen in serial QuantiFERON-TB Gold In-Tube assay of routine laboratory practice. Clin Chim Acta, 2014; 430 : 79–83.
3. NCCLS Approved Guideline. Performance of single Cell Immune Response Assays I/LA26-A [online], [cit. 2016-04-25]. Dostupné na www: <http://shop.clsi.org/site/Sample_pdf/ILA26A2_sample.pdf>
4. Tanguay S, Killion JJ. Direct comparison of ELISPOT and ELISA--based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res, 1994; 13(4): 259–263.
5. Favre N, Bordmann G, Rudin W. Comparison of cytokine measurements using ELISA, ELISPOT and semi-quantitative RT-PCR. J Immunol Methods, 1997; 204(1): 57–66.
6. Chee CBE, Gan SH, KhinMark W, et al. Comparison of Sensitivities of Two Commercial Gamma Interferon Release Assays for Pulmonary Tuberculosis. J Clin Microbiol, 2008; 46(6): 1935–1940.
7. Landis JR, Koch GG. The measurement of observer agreement for categorical data. Biometrics, 1977; 33(1): 159–174.
8. Connell TG, Ritz N, Paxton GA, et al. Comparison of Tuberculin Skin Testing, QuantiFERON-TB Gold and T-SPOT.TB in Children. PLoS ONE, 2008; 3(7): e2624.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2016 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Incidence, mortalita a rizikové faktory karcinomu prostaty
- Epidemiologický význam metabolického syndromu
- Diferenciální diagnostika virové etiologie suspektních příušnic ve vysoce proočkované populaci
- Faktory modifikujúce koncentráciu IgE v pupočníkovej krvi – pilotná štúdia
- Výskyt Mycoplasma hominis a Ureaplasma urealyticum u žen s poruchou fertility
- Recidivující meningitidy a vrozený deficit komplementového systému
- Novinky v přístupu k virové hepatitidě E
- IGRA metody v rutinním provozu – QuantiFERON®-TB Gold nebo T-SPOT®.TB?
- Jmenný a věcný rejstřík
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Výskyt Mycoplasma hominis a Ureaplasma urealyticum u žen s poruchou fertility
- IGRA metody v rutinním provozu – QuantiFERON®-TB Gold nebo T-SPOT®.TB?
- Epidemiologický význam metabolického syndromu
- Diferenciální diagnostika virové etiologie suspektních příušnic ve vysoce proočkované populaci
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



