-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sérologická diagnostika dávivého kašle imunoblotovacími metodami
Serological diagnosis of whooping cough using immunoblot methods
The aim of study:
The aim of this study was to challenge the conclusion presented in the current recommendations of the EU Perstrain Group (European group of reference laboratories) [17] that immunoblotting methods are not appropriate serological methods for the diagnosis of pertussis because their results cannot be quantified. To consider benefits of these methods for the diagnosis of Bordetella infections was another aim of this work.Material and methods:
The residual sera from routine testing intended for disposal and results of routine tests for Bordetella infections performed in Spadia Lab in 2015 and 2016 were used in this study. The test samples were anonymized. Standard commercial ELISA and immunoblot kits were used for analyses.Results and conclusions:
Using the TestLine Clinical Diagnostics Company kits, we have shown that, contrary to the conclusion of the EU Perstrain Group, quantification of the immunoblot results is possible and that these methods can improve the diagnosis of Bordetella infections, ultimately making it more effective.KEYWORDS:
whooping cough – serological diagnosis – immunoblot
Autoři: I. Lochman 1,2; L. Pokorná 2; H. Mertová 2
Působiště autorů: Spadia Lab, a. s., Ostrava 1; Test Line Clinical Diagnostics, Brno 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 66, 2017, č. 3, s. 107-114
Kategorie: Původní práce
Souhrn
Cíl práce:
Primárním cílem této práce bylo ověřit tvrzení, že imunoblotovací metody nejsou vhodnými sérologickými metodami pro diagnostiku pertuse, poněvadž jejich výsledky nelze kvantifikovat, jak vyplývá z dosud platného doporučení skupiny evropských referenčních laboratoří EU Perstrain Group [17]. Ověření přínosu těchto metod pro diagnostiku bordetelových infekcí bylo dalším cílem této práce.Materiál a metody:
V této práci byly použity zbytky sér z rutinních vyšetření, určené k likvidaci, a výsledky z rutinních vyšetření na bordetelové infekce provedených v letech 2015 a 2016 v Spadia Lab. Vzorky použité k testování byly anonymizovány. K analýzám byly použity standardní komerční soupravy ELISA a imunoblot.Výsledky a závěry:
Pomocí diagnostik firmy TestLine Clinical Diagnostics jsme prokázali, že na rozdíl od tvrzení EU Perstrain Group je kvantifikace výsledků imunoblotovacích metod možná a že tyto metody mohou zkvalitňovat a v konečném důsledku i zefektivňovat diagnostiku bordetelových infekcí.KLÍČOVÁ SLOVA:
dávivý kašel – sérologická diagnostika – imunoblotovací metodyÚVOD
Laboratorní diagnostika dávivého kašle (pertuse) se dnes zakládá převážně na nepřímé diagnostice založené na stanovování sérových protilátek proti bordetelovým antigenům. Přímý průkaz infekčního agens kultivací nebo pomocí PCR je využíván jen zřídka. Kultivace i PCR vyžadují správný odběr materiálu v časných stadiích infekce, což, bohužel, ve většině rutinních klinických ambulantních zařízení, která o tuto diagnostiku žádají, není možné zajistit. Materiál pro kultivaci musí být odebrán bezpodmínečně před zahájením antibioterapie, což vyžaduje, aby laboratoř měla k dispozici vždy čerstvé speciální kultivační půdy a výsledek u negativních vzorků nebo vzorků s malou četností mikrobů je znám až za několik dní. PCR diagnostika, i když poskytuje relativně rychlé výsledky (teoreticky do několika hodin po odběru vzorku), je finančně zatím stále ještě dost náročná. Nevýhodou sérologických metod je, že tvorba protilátek má určitou dynamiku a setrvačnost, takže interpretace výsledků sérologických vyšetření u jedinců časně po infekci, několik měsíců po vakcinaci nebo pohybujících se v prostředí s vyšší prevalencí bordetel, je z jednoho vzorku obtížná až nemožná. Jednotlivé antigeny bordetel mají také různou imunogenitu, mohou se projevovat v různých fázích infekce, jsou asociovány s různým průběhem a závažností infekce [6, 18, 40], a tak nemusí být jejich specifičnost pro diagnostiku konkrétní pertusové infekce vždy výhodou. Znalost výsledku protilátkové imunitní odpovědi na několik, byť i méně specifických antigenů daných mikrobů, dává proto často komplexnější a lepší informaci o reakci postiženého jedince na případně proběhlou nebo probíhající infekci. Je proto také výhodné používat pro diagnostiku protilátek multiplexové metody, z nichž nejčastěji používané a dostupné v sérologické diagnostice bordetelových infekcí jsou dnes metody imunoblotovací. Jako cílové struktury navázané na vhodné nosiče ve formě linií (linebloty) nebo teček (dotbloty) jsou dnes v imunoblotech používány většinou vysoce purifikované nebo rekombinantní antigeny. Imunoblotovací metody můžeme dnes již řadit, v rozporu se závěry skupiny evropských referenčních laboratoří EU Perstrain Group [17], mezi kvantitativní metody. Vizuální hodnocení, které bylo v minulosti u těchto metod jedinou možností hodnocení, bylo v dnešní době téměř na všech pracovištích nahrazeno hodnocením pomoci skenerů ovládaných softwarem umožňujícím kvantifikaci testu.
ELISA stanovení protilátek proti pertusovému toxinu (PT) je dnes v diagnostice pertuse považováno za základní sérologické vyšetření při podezření na pertusovou infekci. Primárním cílem naší práce bylo zjistit, jak korelují výsledky imunoblotovací a klasické ELISA techniky pro stanovení těchto protilátek.
Ověření přínosu imunoblotových metod pro diagnostiku bordetelových infekcí bylo dalším cílem této práce. Využili jsme k tomu analýzu výsledků získaných z rutinních vyšetření provedených v laboratořích Spadia v letech 2015 a 2016 a diagnostiky firmy TestLine Clinical Diagnostics (dále jen TestLine). Firma TestLine pro diagnostiku bordetelových infekcí nabízí lineblotové soupravy obsahující čtyři antigeny charakterizující infekci B. pertussis a tři antigeny pro diagnostiku infekce způsobené B. parapertussis (tab. 1). Protilátky proti těmto cílovým antigenům lze stanovovat ve třídě IgG, IgA i IgM.
Tab. 1. Charakteristika specifických antigenů bordetel použitých v imunoblotovacích soupravách firmy Test Line Table 1. Characteristics of specific <i>Bordetella pertussis</i> antigens used in the Test Line immunoblot kits 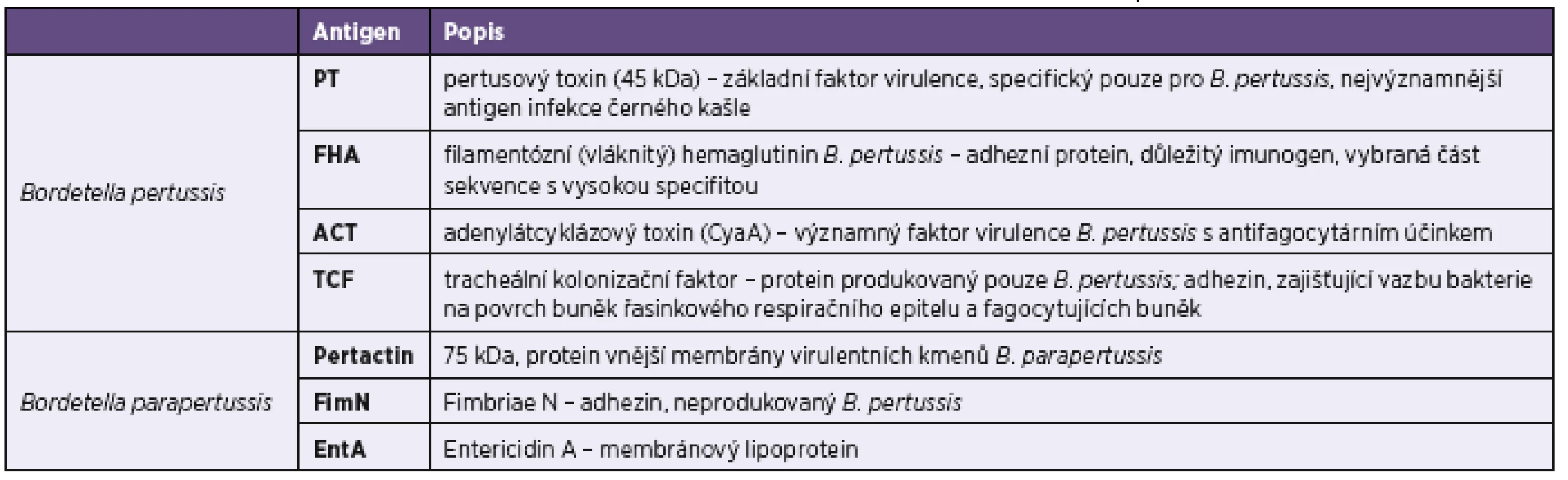
MATERIÁL A METODY
V experimentální části této práce byly použity zbytky vzorků sér dodaných k rutinním vyšetřením do laboratoří Spadia určené k likvidaci. Zbytky vzorků vybraných a použitých k testování v této studii byly anonymizovány a skladovány při -20 oC, pokud byly použity do 30 dnů po odběru krve, delší skladování pak probíhalo při -70 oC. Data pro tabulky 5–8 byla získaná z databáze výsledků rutinních vyšetření provedených v laboratořích Spadia. Sérologická diagnostika byla prováděna pomocí souprav firmy TestLine EIA Bordetella pertussis Toxin IgG (BpGT96), EIA Bordetella pertussis Toxin IgA (BpAT96), EIA Bordetella pertussis Toxin IgM (BpMT96), BLOT-LINE Bordetella IgG (BpGL20), BLOT-LINE Bordetella IgA (BpAL20), BLOT-LINE Bordetella IgM (BpML20). Dále byly pro srovnání a konfirmaci použity ELISA soupravy firmy Euroimmun AG (dále jen Euroimmun) Anti-Bordetella pertussis toxin EI 20509601 A, EI 20509601 G a imunobloty Bordetella pertusis DN 2050-1601 A a DN 2050-1601 G. Pro kalibraci stanovení pertusového toxinu v IU/ml soupravami BLOT-LINE byl použit mezinárodní standard WHO 06/142.
VÝSLEDKY
Koncentrace protilátek proti PT jsou v imunoblotovacích metodách vyjadřovány obvykle v indexech pozitivity (IP) nebo pracovních jednotkách (AU). Na obrázku 1 dokumentujeme, že i imunoblotovací metodu pro stanovení PT lze kalibrovat na WHO standard a výsledky vyjadřovat kvantitativně v IU/ml. Použitý WHO standard (kalibrátor) 06/142 má udány v IU/ml i koncentrace protilátek proti filamentóznímu hemaglutininu (FHA) a adenylát cyklázovému toxinu (ACT), takže je možné provést kalibrace i na tyto analyty v IU/ml. Jejich koncentrace ve standardu 06/142 jsou však příliš nízké, aby byly tyto kalibrace prakticky použitelné. Obrázek 2 zobrazuje poměrně dobrou korelaci mezi výsledky testů ELISA a imunoblotu pro pertusový toxin (PT), přestože byla použita diagnostika různých výrobců. Nicméně, v případě použití diagnostik různých výrobců, ale i různých technik s diagnostiky téhož výrobce, může dojít u některých vzorků k dosažení neshodných výsledků (obr. 3), poněvadž imunoanalytické techniky založené na reakci antigenů s protilátkami, mezi něž sérologické metody patří, nelze dnes ještě standardizovat. Přesto při srovnání výsledků dosažených imunobloty TestLine a Euroimmun bylo dosaženo pro srovnávané antigeny přítomné v obou soupravách statisticky překvapivě dobré shody jak ve třídě IgG, tak ve třídě IgA (tab. 2).
Obr. 1. Kalibrační křivky pro stanovení anti-PT protilátek pomocí soupravy BLOT LINE Kalibrace byly provedeny dvakrát, vynášeny jsou naměřené hodnoty v jednotlivých dnech a průměrné hodnoty obou měření. Pro sestrojení kalibračních křivek byly použity soupravy firmy TestLine Clinical Diagnostics. IP = index pozitivity Figure 1. Calibration curves for the determination of anti-PT antibodies using the BLOT LINE kit Calibrations were performed twice, plotted are the values measured on each day and means of both measurements. To construct the calibration curves, the TestLine Clinical Diagnostics kits were used. IP = positivity index 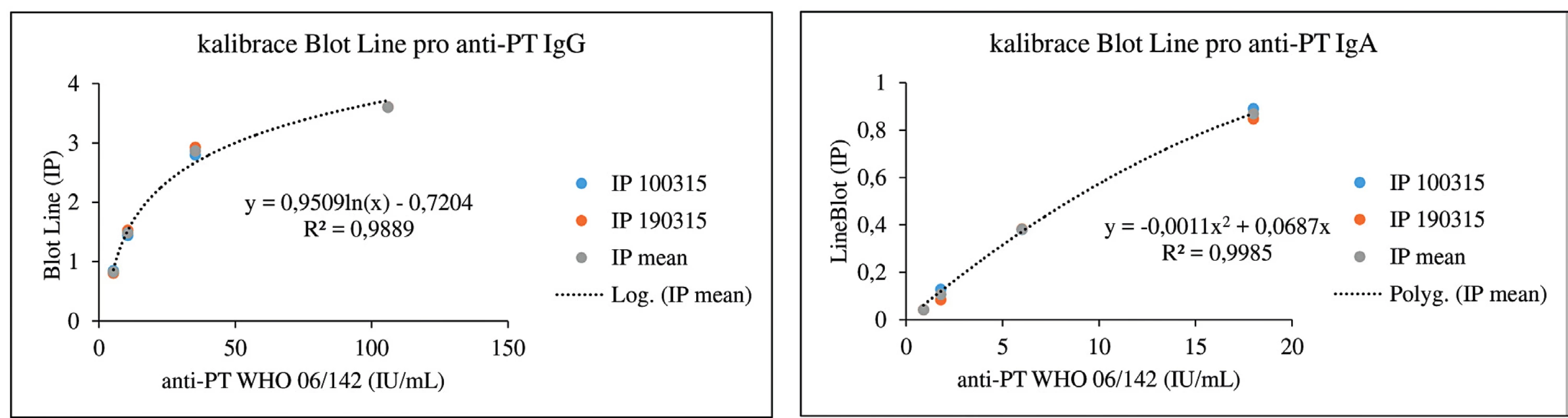
Obr. 2. Korelace stanovení anti-PT protilátek imunoblotem a ELISA Přerušovanými čarami jsou vymezeny hranice pozitivity a oblasti „šedé“ zóny. Pro stanovení protilátek proti PT byly použity ELISA soupravy firmy Euroimmun a imunoblotovací soupravy firmy TestLine Clinical Diagnostics. Figure 2. Correlation of the detection of anti-PT antibodies by immunoblot and ELISA Dashed lines outline the border of positivity and the grey zone areas. Anti-PT antibodies were detected using the Euroimmun ELISA kits and TestLine Clinical Diagnostics immunoblot kits. 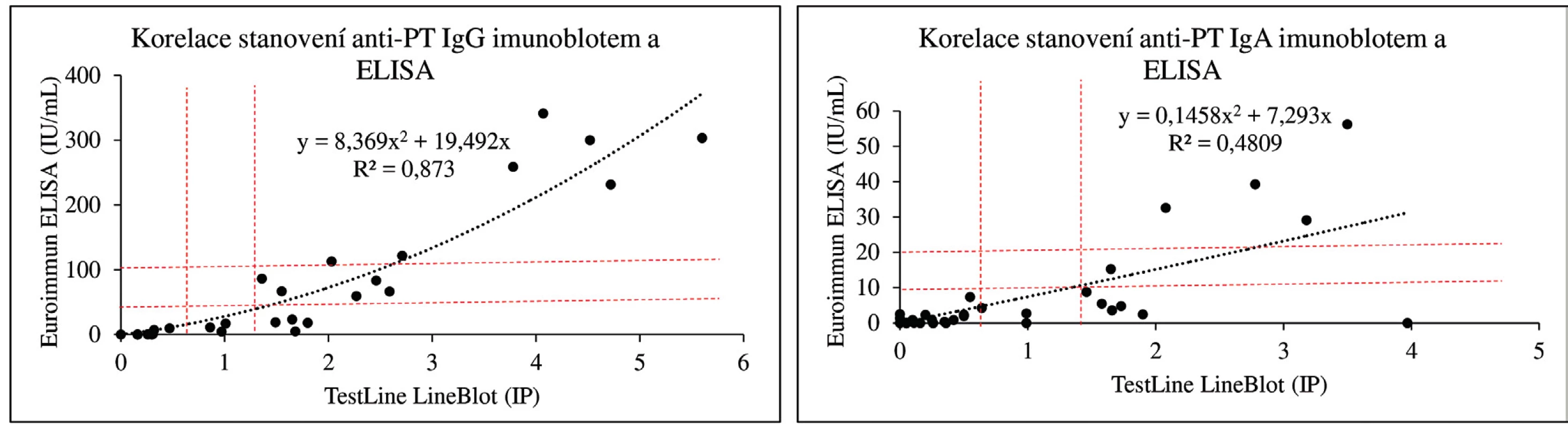
Obr. 3. Korelace stanovení protilátek proti pertusovým antigenům imunoblotovými soupravami TestLine a Euroimmun Přerušovanými čarami jsou vymezeny hranice pozitivity a oblasti „šedé“ zóny. Figure 3. Correlation of the detection of pertussis antigens by the TestLine immunoblot and Euroimmun ELISA kits Dashed lines outline the border of positivity and the grey zone areas. 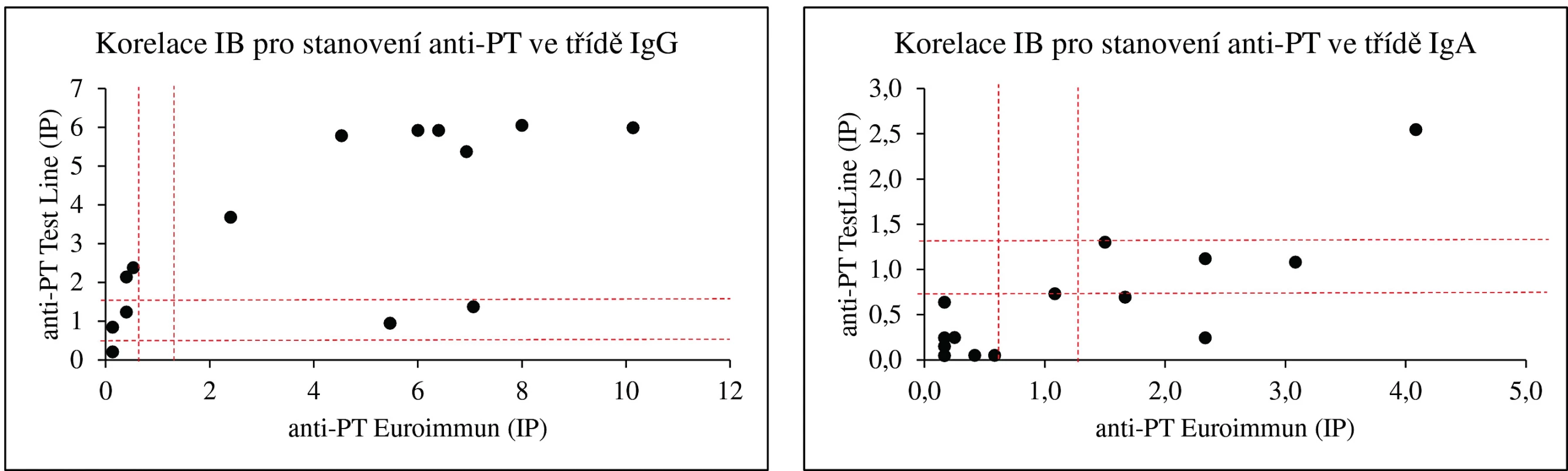
Tab. 2. Korelace výsledků stanovení protilátek proti PT, FHA a ACT imunobloty TestLine a Euroimmun Table 2. Correlation of results of the determination of antibodies against PT, FHA, and ACT by the TestLine and Euroimmun immunoblot kits 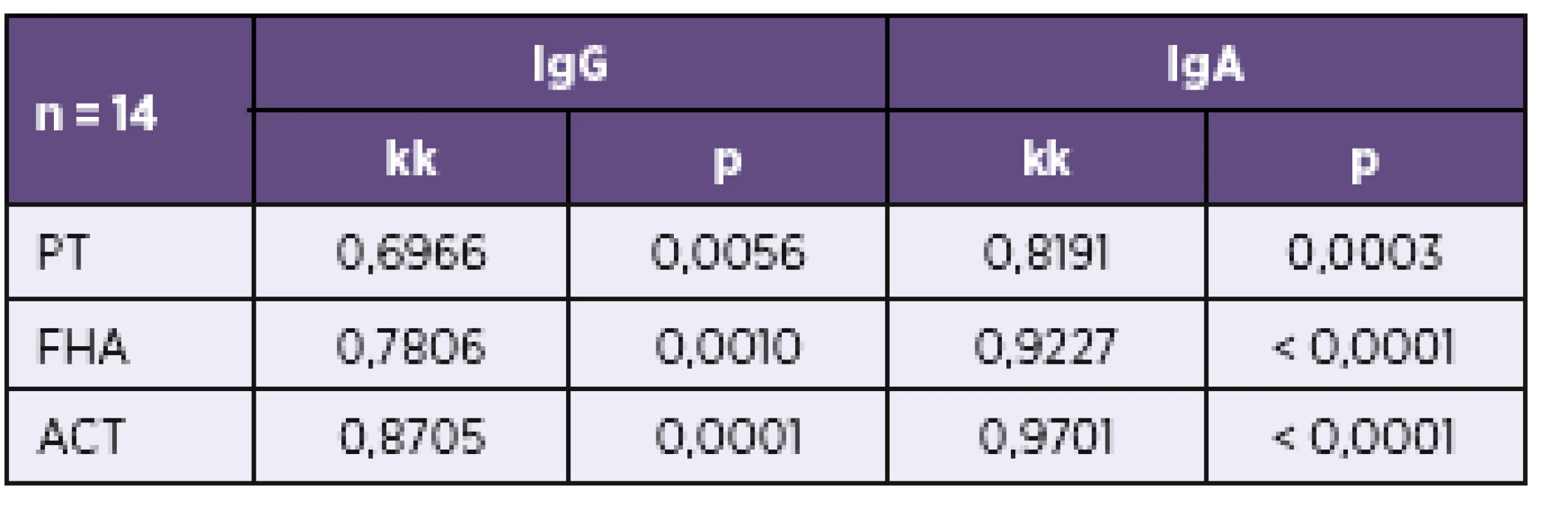
n – počet srovnávaných vzorků, kk – koeficient korelace, p – významnost korelace n – number of samples compared, kk – correlation coefficient, p – correlation significance V tabulce 3 a v tabulce 4 je uvedeno doporučení firmy TestLine, pro vyhodnocení souprav (IB) BLOT LINE Bordetella. Těmito soupravami bylo v námi vyhodnocovaném souboru rutinních vyšetření vyšetřeno 1 800 vzorků, z toho byly požadavky kliniků na vyšetření protilátek proti pertusi ve třídě IgG u 1 759 vzorků, ve třídě IgA u 1 744 vzorků a ve třídě IgM u 1 170 vzorků. Vyšetřit protilátky proti pertusi (BPE) ve všech třech imunoglobulinových třídách bylo požadováno u 1 121 vzorků. Přehled získaných výsledků u těchto vzorků je uveden v tabulkách 5–8. Potvrdilo se nám, což ukazují i tyto tabulky, že jen z údajů uvedených na žádankách o vyšetření je interpretace výsledků sérologických vyšetření na bordetelové infekce, pokud nejsou vzorky negativní, obtížná až nemožná. Aby bylo možné nález u vzorku hodnotit v dané imunoglobulinové třídě jako BPE-pozitivní, musí být podle kritérií uvedených v tabulce 3 anti-PT pozitivní. Všechny vzorky hodnocené jako IB BPE-pozitivní zařazené do studie byly proto také podle očekávání v příslušných imunoglobulinových třídách anti-PT pozitivní. Zajímavé tedy bylo zjistit, kolik vzorků bylo podle kritérií uvedených v tabulce 3 klasifikováno jako hraniční na základě pozitivity proti FHA, ACT a/nebo TCF při negativitě anti-PT. Ve třídě IgG to byla jen 4 % vzorků, ve třídě IgA 27 % vzorků a ve třídě IgM jen 0,6 % vzorků. Z toho je zřejmé, že při infekci se vytvářejí postupně i protilátky méně specifické pro B. pertussis, které však hrají zřejmě významnou úlohu při obraně proti jiným infekčním agens, popř. i při reinfekci B. pertussis, a to rozdílně v jednotlivých imunoglobulinových třídách. Ze vzorků, vykazujících pozitivitu v imunoblotu pro jednotlivé imunoglobulinové třídy bylo ve třídě IgG 62 % vzorků pouze anti-PT pozitivních, ve třídě IgA to bylo 15 % vzorků a ve třídě IgM pak 70 % vzorků. Ze vzorků zpracovaných ve sledovaném období bylo vyšetřeno 2krát 153 pacientů, 3krát 18 pacientů a 4krát 3 pacienti. Nejkratší interval mezi prvním a druhým vzorkem byl 2 dny, nejdelší 371 dní.
Tab. 3. Celkové hodnocení testů Blot-Line <i>Bordetella</i> firmy TestLine Table 3. General assessment of the TestLine BLOT-LINE <i>Bordetella</i> tests 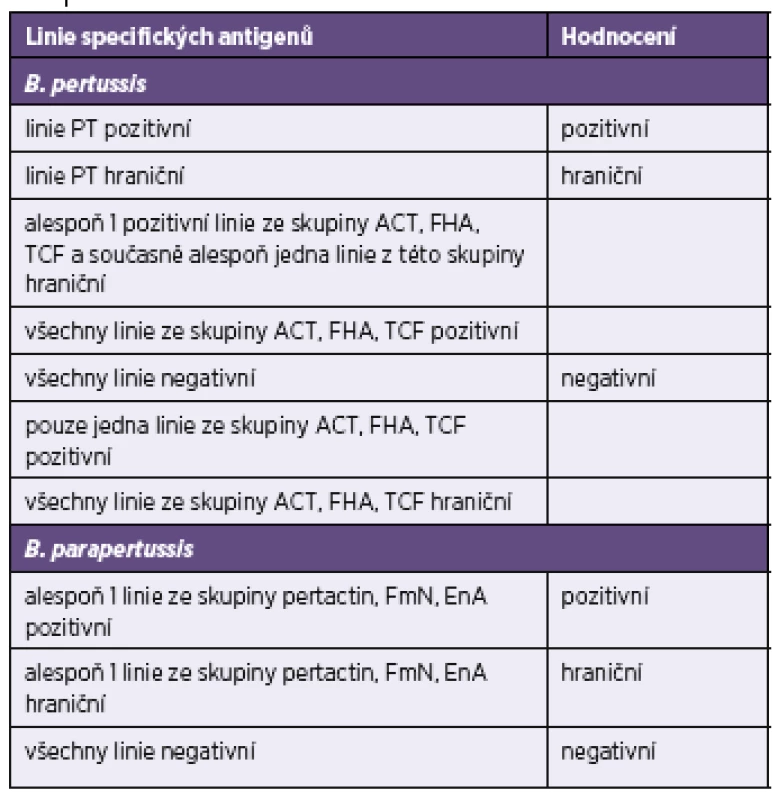
Tab. 4. Interpretace výsledků testů Blot-Line Bordetella firmy TestLine Table 4. Interpretation of the TestLine BLOT-LINE Bordetella tests 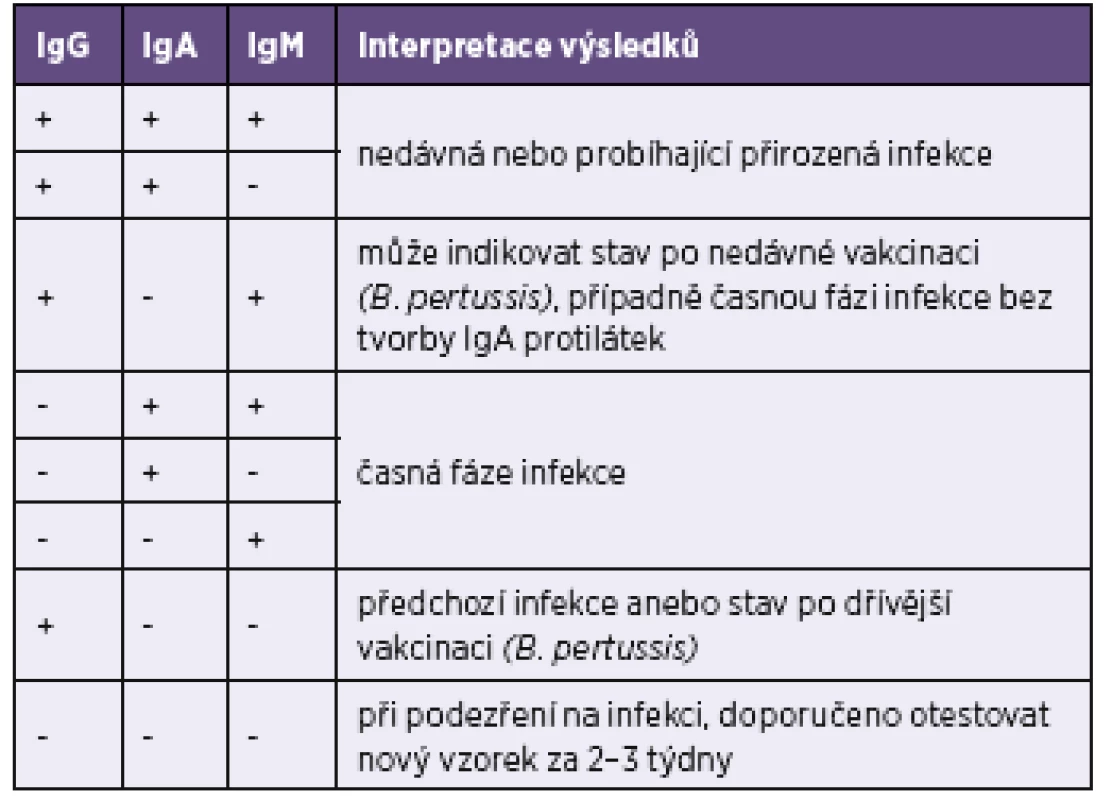
Aby byl vzorek hodnocen pro daný antigen jako negativní, musí mít hodnotu indexu pozitivity (IP) < 0,6, pro hraniční 0,6–1,4 a pro pozitivní > 1,4. IP = OD vzorku/OD cut-off. OD = optická denzita linie na blotu A positivity index (IP) of < 0.6 indicates that the sample is considered as negative for a given antigen, IP in a range of 0.6–1.4 indicates a borderline result, and IP of >1.4 indicates a positive result. IP = sample OD / cut-off OD. OD = blot optical density Tab. 5. Přehled výsledků imunoblotové analýzy protilátek proti bordetelám Table 5. Overview of results of the immunoblot assay for anti-Bordetella antibodies 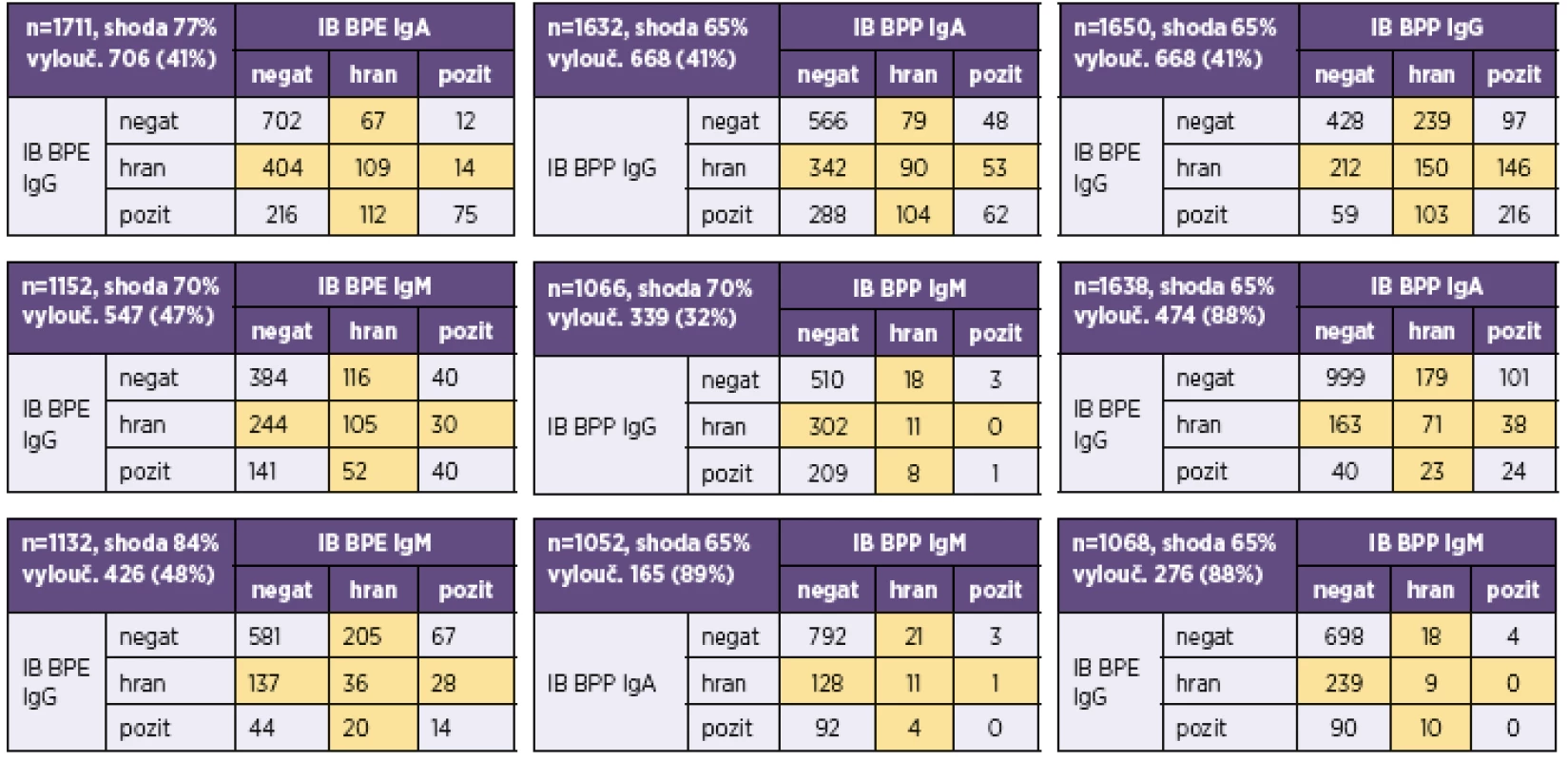
IB BPE – BLOT-LINE B.pertussis, IB BPP – BLOT-LINE B.parapertussis, negat – negativní, pozit – pozitivní, hran – hraniční. Hraniční hodnoty, které byly z analýzy shody vyloučeny, jsou podbarveny žlutě IB BPE – BLOT LINE B. pertussis, IB BPP – BLOT LINE B. parapertussis, negat – negative, pozit – positive, hran – borderline. Borderline values, which were excluded from the correlation analysis, are highlighted in yellow Tab. 6. Přehled výsledků imunoblotové analýzy B. pertussis u vzorků, u nichž byla analýza provedena ve všech třídách (IgG, IgA i IgM) Table 6. Overview of results of the immunoblot assay for B. pertussis in samples tested for all (IgG, IgA, and IgM) classes of antibodies 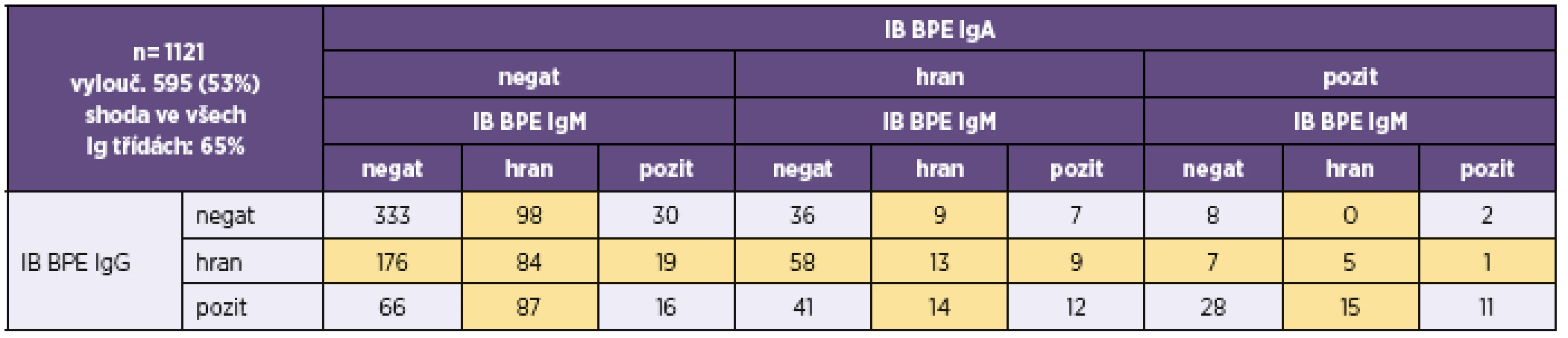
Popis tabulky a v ní použitých zkratek viz tabulka 5. For the legend and abbreviations used, see Table 5. Tab. 7. Přehled výsledků imunoblotové analýzy <i>B. pertussis</i> u párově vyšetřených vzorků Table 7. Overview of results of the immunoblot assay for <i>B. pertussis</i> in paired samples 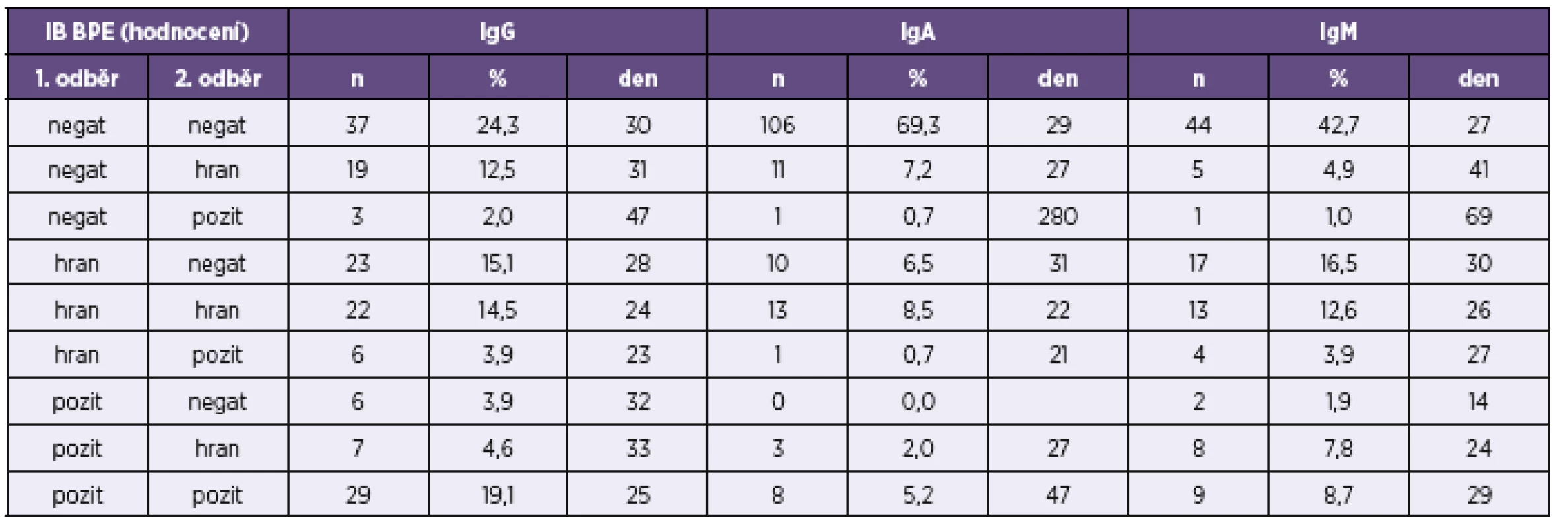
Pozitivita imunoblotu na anti-B. parapertussis (IB BPP) ve třídě IgG byla nejčastěji dána pozitivitou protilátek proti pertactinu (Per). Ze 191 vzorků v IB BPP pozitivních ve třídě IgG bylo 87 % anti-Per pozitivních. Z nich bylo 51 % pouze anti-Per pozitivních. Všechny anti-Per pozitivní vzorky byly pozitivní také v IB BPE. To však neplatí pro třídy IgA a IgM (viz tab. 8).
Tab. 8. Pertactin v diagnózách bordetelových infekcí Table 8. Pertactin in Bordetella infection diagnosis 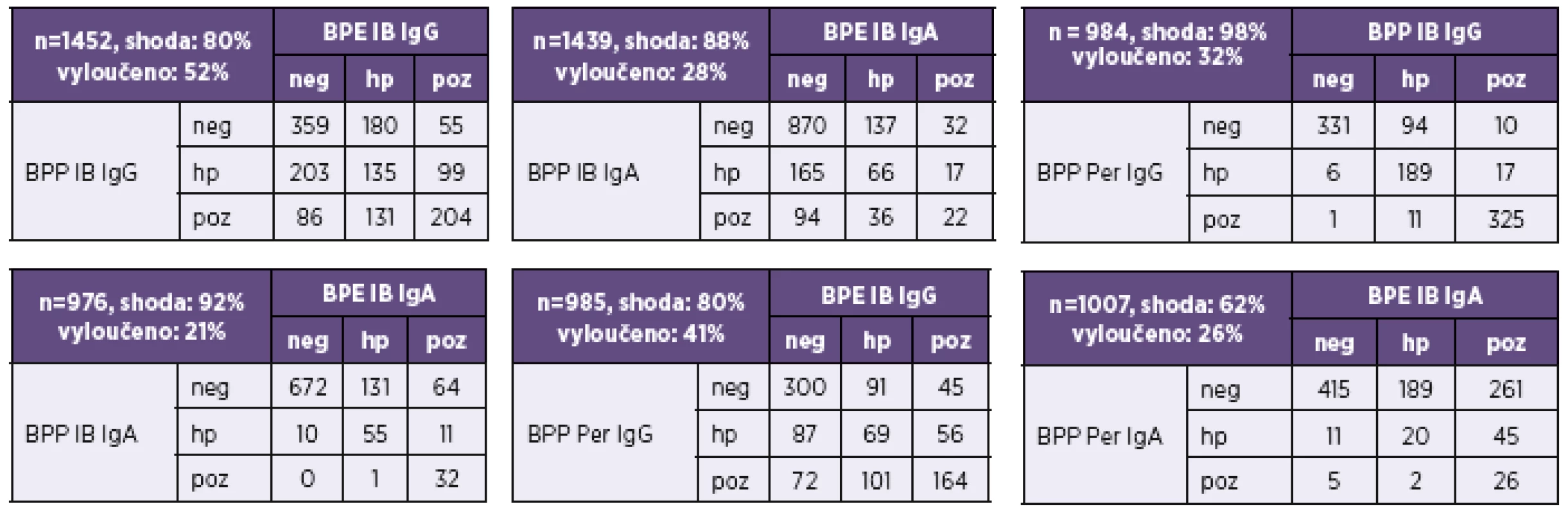
BPE – B. pertussis, BPP – B. parapertussis, IB – Line Blot, Per – pertactin, n – počet srovnávaných vzorků, hraniční hodnoty – vyloučeny z analýzy, výsledky hodnocené shodně v obou srovnávaných analýzách, výsledky hodnocené rozdílně ve srovnávaných analýzách BPE – B. pertussis, BPP – B. parapertussis, IB – Immunoblot (Blot Line), Per – pertactin, n – number of samples compared, borderline values – excluded from the analysis, results interpreted concordantly in both tests, results interpreted differently in each of the tests compared DISKUSE
Abychom mohli dále správně interpretovat nalezené výsledky, měli bychom si připomenout některá fakta. Musíme si uvědomit, že organismus člověka není tvořen jen jeho vlastními buňkami, ale je osídlen i buňkami jiných organismů a také viry. Bakteriální buňky osídlující jednotlivé orgány člověka tvoří jeho mikrobiom. Buněk mikrobiomu je přitom cca 10krát více než vlastních buněk člověka a dokážeme z nich blíže charakterizovat jen nepatrný zlomek. Mikrobiom [10], který se během života člověka neustále individuálně vyvíjí, se spolu s imunitním systémem výrazně podílí na udržování homeostázy. Imunitní systém při plnění své homeostatické funkce musí rozpoznávat všechny struktury, se kterými se setkává, včetně bakterií. Výkon jeho funkce, stejně jako jeho nástrojů, mezi které patří i protilátky, není založen na přísné specifičnosti [39] a řídí se pravděpodobnostní logikou [20]. Nepřekvapuje proto, že v sérologické diagnostice infekčních onemocnění se často nacházejí tzv. zkřížené reaktivity, tzn., že s antigeny izolovanými z jednoho druhu mikroba budou reagovat i protilátky namířené proti podobným antigenním strukturám jiných mikrobů. U respiračních infekcí je to např. známá zkřížená sérologická pozitivita bordetel s kmeny Haemophilus spp., které patří stejně jako Bordetelly mezi proteobakterie, Mycoplasma pneumoniae a Chlamydia pneumoniae [12, 19, 23, 36]. Bakterie mikrobiomu, které zatím nedokážeme blíže charakterizovat, budou mít bezpochyby podobné vlastnosti a prezentovat velmi podobné antigenní struktury s bakteriemi, které dnes již popsat dokážeme, které způsobují určitá onemocnění a k jejichž diagnostice pomocí protilátek používáme v sérologii z nich izolované antigeny.
Bordetella pertussis [1, 24] je aerobní nepohyblivý, gramnegativní kokobacil, který atakuje a množí se na epitelu respiračních cest počínaje nosohltanem a konče primárně v průduškách a průdušinkách. Přenos je možný jen z člověka na člověka prostřednictvím aerosolových kapiček. Onemocnění je velmi nakažlivé a rozvine se u přibližně 80–90 % vnímavých jedinců vystavených expozici mikroba. Většina onemocnění vypuká koncem léta a počátkem podzimu. V respiračním traktu se tvoří krvavý, hnisavý výpotek. Tento výpotek ohrožuje malé dýchací cesty – průdušinky a průdušky především u malých dětí a predisponuje postižené jedince k atelektáze, kašli, cyanóze (promodrání) a pneumonii. Plicní parenchym a krevní řečiště nejsou bordetelami narušeny, takže kultivace bordetel z krve jsou negativní. Frekvence, mortalita, morbidita a věkový výskyt dávivého kašle způsobeného B. pertussis zaleží na oblasti, ve které je onemocnění sledováno (proočkovanost, stav diagnostiky, životní styl, promořenost). Častěji bývají postiženy dívky než chlapci. Samo onemocnění nevytváří celoživotní imunitu. Tři injekce celulární nebo acelulární vakcíny chrání maximálně po dobu několika let. O tom svědčí i řada populačních studií výskytu onemocnění [5, 13, 32, 33, 35].
Jak již bylo řečeno, onemocnění je přenosné jen z člověka na člověka, tzn., že řada z nás musí být přenašeči bordetel bez jakýchkoliv nebo bez vážnějších známek onemocnění. K onemocnění u přenašečů dochází tenkrát, je-li porušena celková homeostáza zahrnující i homeostázu mikrobiomu. U dávivého kašle je to především mikrobiom dýchacích cest, u C. difficile a C. trachomatis to je zase mikrobiom zažívacího traktu [15, 16, 20, 27, 29, 38]. Je nasnadě, že s ohledem na tuto skutečnost především dlouhotrvající antibioterapie, i přes nesporně pozitivní účinek spočívající v chtěné eliminaci mikroba způsobujícího v daném čase dané onemocnění, narušuje nechtěně mikrobiom a činí superorganismus člověka náchylnější nejen k jiným, ale i k aktuálně zlikvidovanému kmeni bakterií. Tak lze vysvětlit příznivé účinky podávání probiotik kombinované se stimulací imunitního systému vakcinací, a skutečnost, že méně specifické celobuněčné vakcíny mají lepší protektivní účinky než specifičtější acelulární vakcíny složené jen z určitých definovaných purifikovaných antigenů konkrétního infekčního agens [7, 11, 14, 31, 32]. Primární, víceméně nespecifická obranná reakce imunitního systému spolu s ochranným působením mikrobiomu hraje zřejmě i v rezistenci vůči bordetelám klíčovou úlohu.
Vstupuje-li infekční agens do organismu člověka přes sliznice, nebo je-li na nich aktivováno, je převážná většina produkovaných protilátek i v časných fázích infekce ve třídě IgA. Tak je tomu i bordetelových infekcí. Je to způsobeno tím, že intraepiteliální lymfocyty transformující se na plazmatické buňky přepínají rychle tvorbu IgM na IgA protilátky, a proto je IgA také hlavním imunoglobulinem produkovaným na sliznicích. IgA protilátky se na sliznicích dimerizují pomocí sekreční komponenty a vytvářejí sekreční IgA (sIgA), které je stabilnější než monomerické IgA a realizuje svou informační činnost prostřednictvím jiných receptorů (polyIgR) než monomerní IgA. IgA odpověď je také podobně jako IgM odpověď méně specifická než později nastupující odpověď ve třídě IgG. Ukázalo se, že IgA protilátky hrají také významnou úlohu při udržování homeostázy mezi vnitřním prostředím organismu a jeho slizničním mikrobiomem [25]. Stanovovat IgM protilátky proti bordetelovým antigenům tak může být přínosné při sledování imunitní odpovědi na vakcíny, které jsou podávány parenterálně nebo u jedinců s IgA deficiencemi.
Interpretaci sérologických výsledků získaných v rámci diagnostiky dávivého kašle komplikuje fakt, že dodnes není znám přesný mechanismus a vztah mezi osídlením bordetelami a klinickými projevy onemocnění. Vakcinace snižuje počty vykazovaných případů pertuse, ale nemá vliv na kolonizaci B. pertussis. Je prokázáno, že celobuněčné vakcíny jsou účinnější a poskytují delší ochranu než vakcíny acelulární [14, 35]. Biologicky aktivní antigenní složky B. pertussis mají rozdílné úlohy při osidlování dýchacích cest a vyvolávání klinických příznaků onemocnění (viz tab. 1 a 9).
Tab. 9. Biologicky aktivní složky <i>Bordetella pertussis</i> Table 9. Biologically active components of <i>Bordetella pertussis</i> 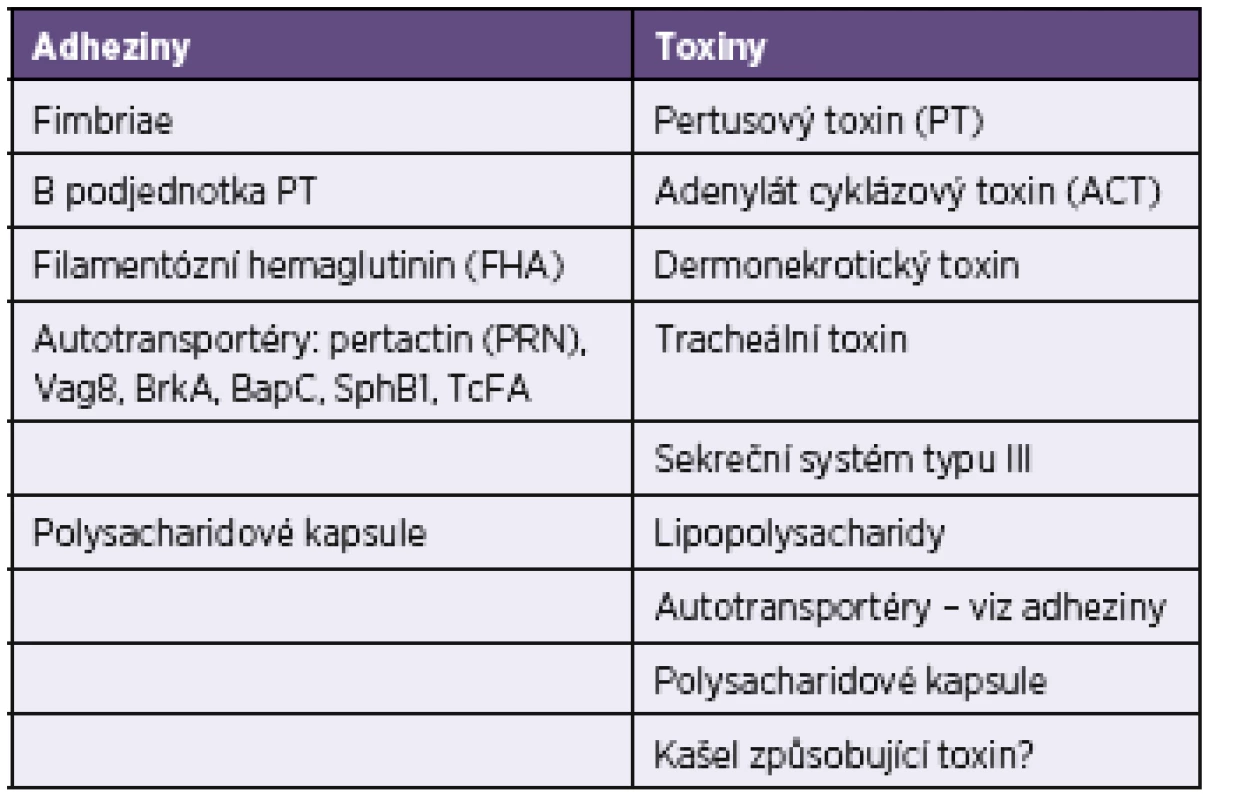
B. pertussis podobně jako řada dalších mikrobů se dokáže adaptovat na prostředí, v němž se vyskytuje, a měnit své vlastnosti [37]. Například se ukázalo, že v USA již téměř žádný z kmenů, izolovaných v současné době, neprodukuje pertactin [2, 26, 34]. Imunodominantní a imunoprotektivní epitopy pertactinu (PRN) zahrnují dvě opakující se oblasti I a II. Srovnání těchto dvou oblastí ukázalo, že pertactin B. parapertussis je invariantní, zatímco pertactin B. pertussis má řadu variant v oblasti I [3]. Pertactin, protein vnější membrány, je vysoce imunogenní virulentní faktor bordetel včetně B. pertussis, který podporuje jejich adhezi na tracheální epiteliální buňky. Je proto také součástí většiny acelulárních vakcín. Pro linebloty firmy TestLine byl použit jako antigen pertactin připravený z kmenů B. parapertussis. Většina vzorků v naší studii hodnocených jako pozitivní v lineblotu na B. parapertussis vykazovala reaktivitu většinou pouze proti pertactinu. Část vzorků pozitivních v lineblotu na B. pertussis reagovala pozitivně i na pertactin použitý jako diagnostický antigen pro B. parapertussis (viz tab. 8). To lze vysvětlit buď jako zkříženou reaktivitu pertactinů B. pertussis a B. parapertussis, nebo jako duální infekci způsobenou oběma typy bordetel. Toto zjištění je zajímavé spíše z epidemiologického než terapeutického hlediska.
Pertusový toxin (PT) je bezesporu významný virulentní faktor B. pertussis, který je pro tohoto mikroba specifický. Způsobuje leukocytózu s lymfocytózou charakteristickou pro toto onemocnění, ale není původcem paroxysmálního suchého kašle. Ten může vyvolávat i B. parapertussis, která PT neprodukuje. Tento kašel je vyvoláván zatím neznámým toxinem, který je zřejmě i málo imunogenní. Protilátky proti PT zabraňují vzniku leukocytózy s lymfocytózou tím, že zamezují inhibici G-proteinů [6]. Vysoké procento anti-PT hraničně pozitivních vzorků mezi IB BPE hraničně pozitivními vzorky v našem souboru (viz Výsledky) ukazuje na důležitost použití tohoto antigenu jako diagnostického markeru v sérologické diagnostice pertuse. Naproti tomu se ukazuje, že protilátky proti FHA, významnému adhesinu B. pertussis, nemají zřejmě význam v ochraně proti infekci tímto mikrobem [6, 30]. Jinak je tomu u adenylátcyklázového toxinu (ACT). ACT umožňuje B. pertussis, aby vstupovala jak do fagocytujících, tak do nefagocytujících buněk, chovala se jako intracelulární parazit a unikala dozoru imunitního systému [4, 8, 9, 18, 22, 28]. To vše podporuje naši domněnku, že používání multiplexových metod, mezi něž patří i imunoblotovací techniky, je pro sérologickou diagnostiku infekčních onemocnění včetně dávivého kašle nejen ekonomicky a pracovně výhodnější než používání jednotlivých jednoanalytových metod, jako je klasická ELISA, ale dává pro diagnostiku možné probíhající nebo proběhlé infekce i širší a spolehlivější podklady.
ZÁVĚRY
Bylo prokázáno, že pomocí imunoblotovací techniky lze protilátky proti pertusovému toxinu i protilátky proti dalším antigenům používaným v nepřímé diagnostice bordetelových infekcí kvantitativně stanovovat, nikoliv pouze detekovat jejich přítomnost. Stanovení těchto protilátek lze kalibrovat na dostupné standardy používané pro kalibraci ELISA technik, což umožňuje udávat koncentrace protilátek proti pertusovému toxinu v IU/ml i při použití imunoblotových technik. Oproti klasickým ELISA poskytují imunoblotovací techniky komplexnější a efektivněji pořízený obraz protilátkové odpovědi vyšetřovaného jedince v diagnostice nejen dávivého kašle, ale i dalších infekčních onemocnění. Analýza dat získaných z rutinních vyšetření provedených v našich laboratořích ukázala a potvrdila, že validní interpretace sérologických vyšetření na B. pertussis a B. parapertussis je u pozitivních vzorků jen z údajů, které laboratoř obdrží na žádankách pro tato vyšetření většinou nemožná.
Do redakce došlo dne 26. 10. 2016.
Adresa pro korespondenci:
RNDr. Ivo Lochman, CSc.
SPADIA LAB, a.s.
Dr. Martínka 7
700 30 Ostrava
e-mail: ivo.lochman@spadia.cz
Zdroje
1. Bordetella pertussis taxonomy. Dostupné na www: https://microbewiki.kenyon.edu/index.php/Bordetella_pertussis.
2. Breakwell L, Kelso P, Finley C, et al. Pertussis Vaccine Effectiveness in the Setting of Pertactin-Deficient Pertussis. Pediatrics, 2016;137(5). pii: e20153973. doi: 10.1542/peds.2015-3973. Epub 2016 Apr 12.
3. Boursaux-Eude C, Guiso N. Polymorphism of repeated regions of pertactin in Bordetella pertussis, Bordetella parapertussis, and Bordetella bronchiseptica. Infect Immun, 2000; 68(8): 4815–4817.
4. Carbonetti NH. Pertussis toxin and adenylate cyclase toxin: key virulence factors of Bordetella pertussis and cell biology tools. Future Microbiol, 2010;5 : 455–469.
5. Cherry JD. Adult pertussis in the pre - and post-vaccine eras: lifelong vaccine-induced immunity? Expert Rev Vaccines, 2014;13(9): 1073–1080.
6. Cherry JD, Paddock CD. Pathogenesis and histopathology of pertussis: implications for immunization. Expert Rev Vaccines, 2014;13(9): 1115–1123.
7. Cherry JD. Tetanus-diphtheria-pertussis immunization in pregnant women and the prevention of pertussis in young infants. Clin Infect Dis, 2015;60(3): 338–340.
8. Cherry JD, Xing DXL, Newland P, et al. Determination of Serum Antibody to Bordetella pertussis Adenylate Cyclase Toxin in Vaccinated and Unvaccinated Children and in Children and Adults with Pertussis. Clin Infect Dis, 2004;38 : 502–507.
9. Cundell DR, Kanthakumar K, Taylor GW, et al. Effect of Tracheal Cytotoxin from Bordetella pertussis on Human Neutrophil Function In Vitro. Infection and Immunity, 1994; 62(2): 639–643.
10. The human microbiome: Me, myself, us. The Economist, Aug 18th 2012, Print Edition. Dostupné na www: http://www.economist.com/node/21560523/print.
11. Edwards KM, Berbers GA. Immune responses to pertussis vaccines and disease. J Infect Dis, 2014;209(Suppl 1): S10–15.
12. Fabiánová K, Zavadilová J. Aktualizovaná doporučení pro laboratorní diagnostiku pertuse a parapertuse. Zprávy CEM (SZÚ, Praha), 2011;20(4): 142–144.
13. Fabiálnová K. Pertuse. Alergie, 2015;17(4): 249–254.
14. Fabiánová K. Polymorfismus Bordetella pertusis a vývoj nových očkovacích látek proti pertusi. Vakcinologie, 2016;10(4): 150–154.
15. Finney LJ, Ritchie A, Pollard E, et al. Lower airway colonization and inflammatory response in COPD: a focus on Haemophilus influenzae. International Journal of COPD, 2014;9 : 1119–1132.
16. Furuya-Kanamori L, Maarquess J, Yakob L, et al. Asymptomatic Clostridium difficile colonization: epidemiology and clinical implications. BMC Infectious Diseases, 2015;15 : 516–527.
17. Guiso N, Berbers G, Fry NK, et al. EU Pertstrain group. What to do and what not to do in serological diagnosis of pertussis: recommendations from EU reference laboratories. Eur J Clin Microbiol Infect Dis, 2011;30(3): 307–312.
18. Goodwin MStM, Weiss AA. Adenylate Cyclase Toxin Is Critical for Colonization and Pertussis Toxin Is Critical for Lethal Infection by Bordetella pertussis in Infant Mice. Infection and Immunity, 1990;58(10): 3445–3447.
19. Halperin SA. Serologic and Molecular Tools for Diagnosing Bordetella pertussis Infection. In Manual of Molecular and Clinical Laboratory Immunology, 7thEdition, Detrick B, Hamilton RG, Folds JD editors, ASM Press, 2006, p. 540–546.
20. Leng Q, Bentwich Z. Beyond self and nonself: fuzzy recognition of the immune system. Scand J Immunol, 2002;56(3): 224–232.
21. Long SS, Welkon CJ, Clark JL. Widespread silent transmission of pertussis in families: antibody correlates of infection and symptomatology. J Infect Dis, 1990;161(3): 480–486.
22. Martin C, Etxaniz A, Uribe KB, et al. Adenylate Cyclase Toxin promotes bacterial internalization into non phagocytic cells. Sci Rep, 2015;5 : 13774. doi: 10.1038/srep13774.
23. Mattoo S, Cherry JD. Molecular Pathogenesis, Epidemiology, and Clinical Manifestations of Respiratory Infections Due to Bordetella pertussis and Other Bordetella Subspecies. Clinical Microbiology Reviews, 2005;18(2): 326–382.
24. NCBI Taxonomy, Bordetella pertussis 18323. Dostupné na www: http://www.ncbi.nlm.nih.gov/taxonomy.
25. Pabst O, Cerovic V, Hornef M. Secretory IgA in the Coordination of Establishment and Maintenance of the Microbiota. Trends in Immunology, 2016;37(5): 287–296.
26. Pawloski LC, Queenan AM, Cassiday PK, et al. Prevalence and molecular characterization of pertactin-deficient Bordetella pertussis in the US in 2012. Clin. Vaccine Immunol, 2014;21(2): 119–125.
27. Riggs MM, Sethi AK, Zabarsky TF, et al. Asymptomatic Carriers Are a Potential Source for Transmission of Epidemic and Nonepidemic Clostridium difficile Strains among Long-Term Care Facility Residents. Clin Infect Dis, 2007;45 : 992–998.
28. Sebo P, Osicka R, Masin J. Adenylate cyclase toxin-hemolysis relevance for pertussis vaccines. Expert Rev Vaccines, 2014;13(10): 1215–1227.
29. Theriot CM, Young VB. Interactions between the Gastrointestinal Microbiome and Clostridium difficile. Annu Rev Microbiol, 2015;69 : 445–461.
30. Villarino RR, Hasan S, Faé K, et al. Bordetella pertussis filamentous hemagglutinin itself does not trigger anti-inflammatory interleukin-10 production by human dendritic cells. Int J Med Mictobiol, 2016;306(1): 38–47.
31. Warfel JM, Zimmerman LI, Merkel TJ. Comparison of Three Whole--Cell Pertussis Vaccines in the Baboon Model of Pertussis. Clinical and Vaccine Immunology, 2016;23(1): 47–54.
32. Warfel JM, Edwards KM. Pertussis vaccines and the challenge of inducing durable immunity. Curr Opin Immunol, 2015;35 : 48–54.
33. Wendelboe AM, Van Rie A, Salmaso S, Englund JA. Duration of immunity against pertussis after natural infection or vaccination. Pediatr Infect Dis J, 2005;25(5 Suppl): S58–61.
34. Williams MM, Sen K, Weigand MR, et al. CDC Pertussis Working Group: Bordetella pertussis Strain Lacking Pertactin and Pertussis Toxin. Emerg Infect Dis, 2016;22(2): 319–322.
35. Witt MA, Arias L, Katz PH, et al. Reduced risk of pertussis among persons ever vaccinated with whole cell pertussis vaccine compared to recipients of acellular pertussis vaccines in a large US cohort. Clin Infect Dis, 2013;56(9): 1248–1254.
36. Zavadilová J, Fabiánová K, Maixnerová M. Doporučení pro laboratorní diagnostiku dávivého kašle. Zprávy epidemiologie a mikrobiologie (SZÚ, Praha), 2009;18(1): 24–25.
37. Zavadilová J, Lžičařová D, Musílek M, Křížová P, Fabiánová K. Antigenic variability of Bordetella pertussis strains isolated in 1967–2010 in the Czech Republic-possible explanation for the rise in cases of pertussis? Epidemiol Mikrobiol Imunol, 2015;64(3): 130–138.
38. Ziklo N, Huston WM, Hockong JS, Timms P. Chlamydia trachomatis Genital Tract Infections: When Host Immune Response and the Microbiome Collide. Trends Microbiol, 2016;24(9): 750–765.
39. Zinkernagel RM. Uncertainties – discrepancies in immunology. Immunology Reviews, 2002;185 : 103–125.
40. Zlamy M. Rediscovering Pertussis. Frontiers in Pediatrics, 2016;4(Article 52): 1–10.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2017 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Sérologická diagnostika dávivého kašle imunoblotovacími metodami
- Neuroborrelióza u pacientů hospitalizovaných s Lymeskou borreliózou v České republice za období let 2003–2013
- Séronegativní Toxocara spp. u českých pacientů s časnou formou roztroušené sklerózy – klinicky izolovaný syndrom
- Fatální průběh multifokální infekce Aspergillus sp. a multirezistentní Pseudomonas aeruginosa u pacienta s toxickou epidermální nekrolýzou a renální malignitou
- Legionelózy a ich diagnostika
- Možnosti laboratórnej diagnostiky leptospiróz
- Molekulárně epidemiologická charakteristika a diverzita Listeria monocytogenes v humánní populaci České republiky v letech 2013–2016
- Hantavirus jako původce smrtelné hemoragické horečky v České republice
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hantavirus jako původce smrtelné hemoragické horečky v České republice
- Možnosti laboratórnej diagnostiky leptospiróz
- Sérologická diagnostika dávivého kašle imunoblotovacími metodami
- Legionelózy a ich diagnostika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



