-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Lékové stenty – mechanizmy účinku a současné indikace
Drug eluting stents – mechanisms of action and current indications
Restenosis is after the coronary angioplasty the main limiting factor for this method of myocardial revascularization. After the implantation of coronary stents the occurrence of restenosis went down to ½. To a significant decrease of restenosis finally comes now, after the use of drug eluting stents (DES). Drug eluting stents have both – a positive mechanical action of stents on recoil and artery remodelling with a local application of drugs which inhibit neointimal hyperproliferation. This way it influences all 3 parts of the restenosis process at the same time. Currently there are available results of a 3-year-long monitoring of patients after DES implantation. During this medium-term monitoring has been proved that the implantation of drug eluting stents is safe. A low occurrence of restenosis continues during the whole time of monitoring; this results in lowered need of repeated revascularization of intervened artery in approx. 80 % of all patients’ subgroups. DES potency has been so far proved in lesion up to 46 mm; in native coronary arteries greater than 2.5 mm. Ostial lesions, calcified lesions, bifurcation lesions and lesions in bypasses have so far been excluded from randomized studies. Studies to verify drug eluting stents applicability in these indications are being conducted at present. Until now a direct proof of a favourable influence of drug eluting stents in acute coronary syndromes is missing. According to the data from registers it seems that drug eluting stents significantly decrease the occurrence of cardiac events even during acute infarction and unstable angina pectoris. Higher potency of drug eluting stents is reflected in their price, which is 2-3 times higher than the price of metallic stents. From the price efficiency point of view it is most convenient to implant drug eluting stents in patients with high risk of restenosis, where the highest absolute decrease of restenosis risk can be expected. DES use is also suitable in lesions which have an extreme importance for the patient’s prognosis, for example when treating the last transit artery or when treating the stem of the left coronary artery. This is the source for indicating criteria for implantation of DES defined by the Czech Cardiology Society. With regard to the recent increase in payments for drug eluting stents by the General Health Insurance Company and with regard to their expected price decrease, the use of drug eluting stents will surely soon spread over the Czech republic.
Key words:
DES, drug eluting stents, coronary angioplasty, restenosis
Autori: S. Šimek; J. Horák; P. Kuchynka; M. Škvařilová; J. Humhal; V. Mrázek; V. Danzig; M. Aschermann
Pôsobisko autorov: Klinika kardiologie a angiologie l. LF a VFN, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2005, 7(3): 144-150
Súhrn
Restenóza je po koronární angioplastice hlavním limitujícím faktorem metody revaskularizace myokardu. Zavedením implantace koronárních stentů se výskyt restenózy snížil na 1/2. K dramatickému snížení restenózy však dochází až nyní při použití lékových stentů (DES = drug eluting stent). Lékové stenty v sobě spojují příznivé mechanické působení stentů na recoil a remodelaci tepny s lokální aplikací léků, které inhibují neointimální hyperproliferaci. Ovlivňují tak všechny 3 složky procesu restenózy současně. V současné době jsou k dispozici výsledky až 3letého sledování nemocných po implantaci DES. Během tohoto střednědobého sledování se ukázalo, že implantace lékových stentů je bezpečná. Nízký výskyt restenózy přetrvává po celou dobu sledování, což se projevuje ve snížené nutnosti opakované revaskularizace intervenované tepny cca o 80 % ve všech podskupinách nemocných. Účinnost DES je zatím ověřena u lézí do 46 mm, na nativních koronárních tepnách větších než 2,5 mm. Z randomizovaných studií byly dosud vyloučeny léze ostiální, kalcifikované, bifurkační a léze v bypassech. Studie k ověření použitelnosti lékových stentů v těchto indikacích teprve probíhají. Zatím chybí přímý důkaz o příznivém vlivu lékových stentů u akutních koronárních syndromů. Podle dat z registrů se ale zdá, že lékové stenty významně snižují výskyt kardiálních příhod i během akutního infarktu a nestabilní anginy pectoris. Vyšší účinnost lékových stentů se odráží v jejich ceně, která je 2-3násobná oproti běžným kovovým stentům. Z pohledu cenové efektivity je nejvýhodnější implantovat lékové stenty nemocným s vysokým rizikem restenózy, kde lze očekávat nejvyšší absolutní snížení rizika restenózy. Použití DES je také vhodné do lézí, které mají extrémní význam pro prognózu nemocného, např. při ošetření poslední průchodné tepny nebo při ošetření kmene levé věnčité tepny. Z toho vycházejí i indikační kritéria pro implantaci DES stanovené Českou kardiologickou společností. Vzhledem k recentnímu zvýšení úhrad za lékové stenty Všeobecnou zdravotní pojišťovnou a vzhledem k očekávanému poklesu jejich ceny se použití lékových stentů jistě brzy rozšíří i v České republice.
Klíčová slova:
DES, lékové stenty, koronární angioplastika, restenózaPerkutánní koronární intervence (PCI) patří v současné době celosvětově mezi nejčastější lékařské výkony. Přes obrovský pokrok ve vývoji používaného instrumentária a doprovodné farmakoterapie dosud nebyl zcela vyřešen problém restenózy, který provází tuto metodu jako stín od jejího vzniku.
Po balonkové koronární angioplastice se restenóza, tj. znovuzúžení ošetřeného úseku koronární tepny, vyskytovala u 30–60 % ošetřených pacientů. Prvním významným pokrokem v boji s restenózou bylo zavedení koronárních stentů, jejichž implantací se výskyt snížil na polovinu, tj. na 15–30 % [1]. Výskyt instant-restenózy vrcholil mezi 3.-6. měsícem po intervenci. Tzv. angiografická restenóza je zjistitelná jedině kontrolním koronarografickým vyšetřením a v symptomatologii nemocných se projeví jen asi v 1/2 případů. Mírou tzv. klinické restenózy je počet nežádoucích kardiovaskulárních příhod (MACE – major adverse cardiac events) a zejména nutnost opakované revaskularizace intervenované tepny (TLR – target lesion revascularization). Asi 1/2 angiografických restenóz se tedy neprojeví klinicky. Hlavními rizikovými faktory pro vznik restenózy jsou: délka stenózy, malý průměr intervenované tepny, chronický uzávěr, přítomnost diabetu, již dříve vzniklá restenóza, lokalizace v žilním bypassu a intervence ve větvení koronární tepny. V patogenezi vzniku restenózy se účastní 3 hlavní mechanizmy:
- časné elastické zúžení, tzv. „recoil”
- pozdní remodelace tepny
- neointimální hyperproliferace.
Zatímco recoil i pozdní remodelace jsou mechanickým působením implantovaného stentu prakticky eliminovány, tvorba neointimy není kovovým stentem pozitivně ovlivněna vůbec, spíše naopak [2]. Stent svou přítomností v koronární tepně vyvolává zánětlivou [3], resp. hojivou odpověď cévní stěny za účasti krevních destiček, bílých krvinek, cytokinů a růstových faktorů. Výsledkem je hyperproliferace a migrace buněk hladkého svalstva [4], které se mění na buňky syntetizující extracelulární matrix. Na tvorbě neointimální tkáně se podílí také přítomnost nástěnného trombu v místech dilatací poškozeného endotelu. Množství neointimální tkáně vrcholí mezi 3.-6. měsícem po intervenci, poté se mírně snižuje náhradou buněk hladkého svalu za extracelulární matrix [5].
Prevence a léčba restenózy
S cílem potlačit zánětlivou odpověď a proliferaci neointimy byla v léčbě instant-restenózy testována celá řada imunosupresivních, antiproliferativních a jiných látek, které by teoreticky mohly fázi hyperproliferace ovlivnit. Byly provedeny studie s cytostatiky (tranilast), s antikoagulačními látkami (heparin, enoxaparin, hirudin), antiagregačními (aspirin, tiklopidin, inhibitory tromboxanu, abciximab) a protizánětlivými (kortikosteroidy). Byla zkoušena léčba angiopeptinem, rybím tukem, estrogeny, inhibitory růstových faktorů (trapidil) i léčba hypolipidemiky včetně statinů. Výsledky byly vždy zklamáním, neboť i tam, kde byl v experimentu nalezen pokles výskytu restenózy, se v klinických studiích tento efekt nepotvrdil [6].
Všechny pokusy o ovlivnění restenózy systémovým podáním farmak tak selhaly. Koncentrace léků v cílové tkáni pravděpodobně nemohly být dostatečné, aniž by nevyvolávaly celkové nežádoucí účinky [7]. Vznikla proto idea lokální aplikace farmak přímo do místa intervence. Cílem bylo dodat selektivně k poraněnému místu cévní stěny relativně vysokou dávku farmaka k potlačení restenózy bez závažných toxických účinků. Byla testována řada systémů, kterými byla farmaka vstřikována po intervenci do cévní stěny. Ani tímto způsobem se nepodařilo omezit restenózu nejspíše proto, že po aplikaci farmak docházelo k jejich příliš rychlému vymývání z cílové oblasti.
Velmi nadějným se na počátku tohoto století jevilo lokální ozáření intervenované oblasti po PCI gama nebo beta zářením [8]. Intrakoronární brachyterapií se sice podařilo významně snížit restenózu do 6 měsíců po intervenci, ale dlouhodobá sledování ukázala, že proces hojení a vzniku restenózy byl pouze posunut do pozdější doby, kolem 1 roku.
Lékové stenty – (Drug Eluting Stents – DES)
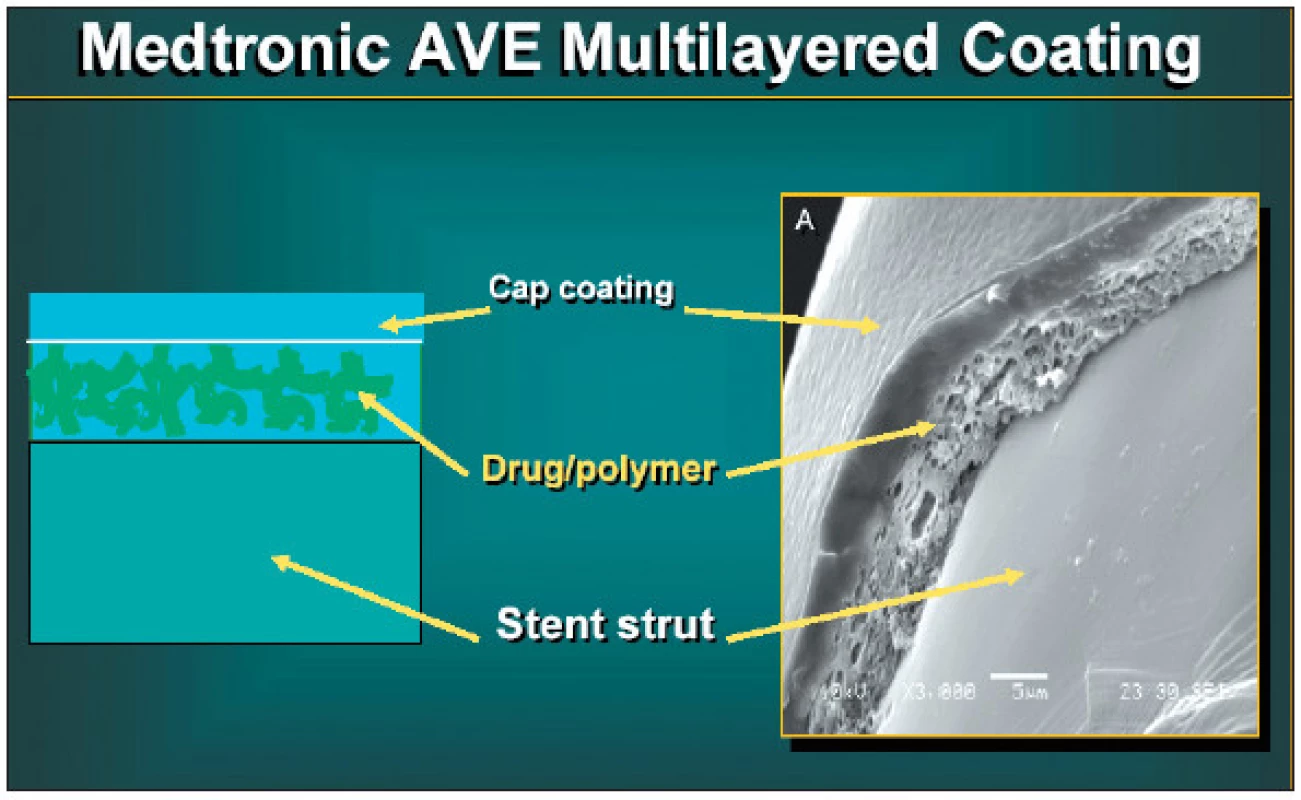
Lékové stenty tvoří další velmi významný krok v boji s restenózou. Spojují mechanické působení stentů na recoil a remodelaci tepny s aplikací léků, které inhibují neointimální hyperproliferaci. Ovlivňují tak všechny 3 složky procesu restenózy. Stent přitom dlouhodobě působí jako nosič a zdroj léku přesně v místě potřeby. Základem většiny současných DES je ocelový stent potažený polymerem, v němž je obsažen aktivní lék. Výhodou této formy aplikace aktivního léku je možnost dosažení vysoké dlouhodobé lokální koncentrace s minimálními systémovými účinky.
Stent: Kromě obvyklých vlastností stentů, jako je ohebnost, minimální tloušťka a dostatečná radiální síla, musí lékový stent poskytovat dostatečnou plochu pro nanesení farmaka. Stavba stentu musí zajistit optimální rozložení léku, aby jeho působení na okolní cévní stěnu bylo rovnoměrné.
Polymer: Polymer musí být biologicky inertní, elektroneutrální, odolný vůči mechanickému poškození při implantaci nebo sterilizaci, musí být dlouhodobě stabilní, nesmí vyvolávat agregaci destiček a zánětlivou reakci cévní stěny. Ideální pokrytí stentu podporuje reendotelizaci ošetřeného úseku tepny. Tzv. biokompatibilní pokrytí stentu napodobuje přesně povrch buněk.
Polymer musí pojmout dostatečné množství aktivního léku a svými vlastnostmi určuje farmakokinetiku jeho uvolňování. Kombinací několika různých vrstev polymeru lze dosáhnout přesně požadované rychlosti a délky uvolňování léku (obr.1).
Aktivní lék: V optimálním případě inhibuje neointimální hyperplazii potlačením zánětlivé odpovědi, potlačením aktivace destiček a potlačením proliferace buněk hladkého svalu. Pronikání léků do cévní stěny závisí na jejich lipofilních, resp. lipofobních vlastnostech a na molekulární hmotnosti. Některé léky se mohou přímo nanášet na povrch stentu. Většinou je však nutno stent pokrýt polymerem, který slouží jako nosič a rezervoár. Většina zkoušených léků se používá v chemoterapii a imunosupresivní léčbě. Měly by inhibovat co nejvíce složek procesu restenózy. Potenciálními kandidáty jsou: cytostatika (paclitaxel, actinomycin D, vincristin, methotrexat, angiopeptin, mitomycin, BCP 678, antisense C-myc, latrunculin-A, cytochalasin-D), antitrombiny (hirudin, iloprost, heparin, abciximab), imunosupresiva (sirolimus, takrolimus, everolimus, tranilast, dexamethason, methylprednisolon, interferon gamma 1b, leflunomide, cyklosporin), inhibitory migrace (halofuginon), inhibitory C-proteinázy a metaloproteinázy (batimastat) a modulátory endoteliální funkce (VEGF, 17 betaestradiol, statiny, BCP 671, NO).
Klinické použití lékových stentů
Z nepřeberné skupiny farmak teoreticky ovlivňujících jednotlivé fáze restenózy jich zatím byla s lékovými stenty použita jen malá část [9].
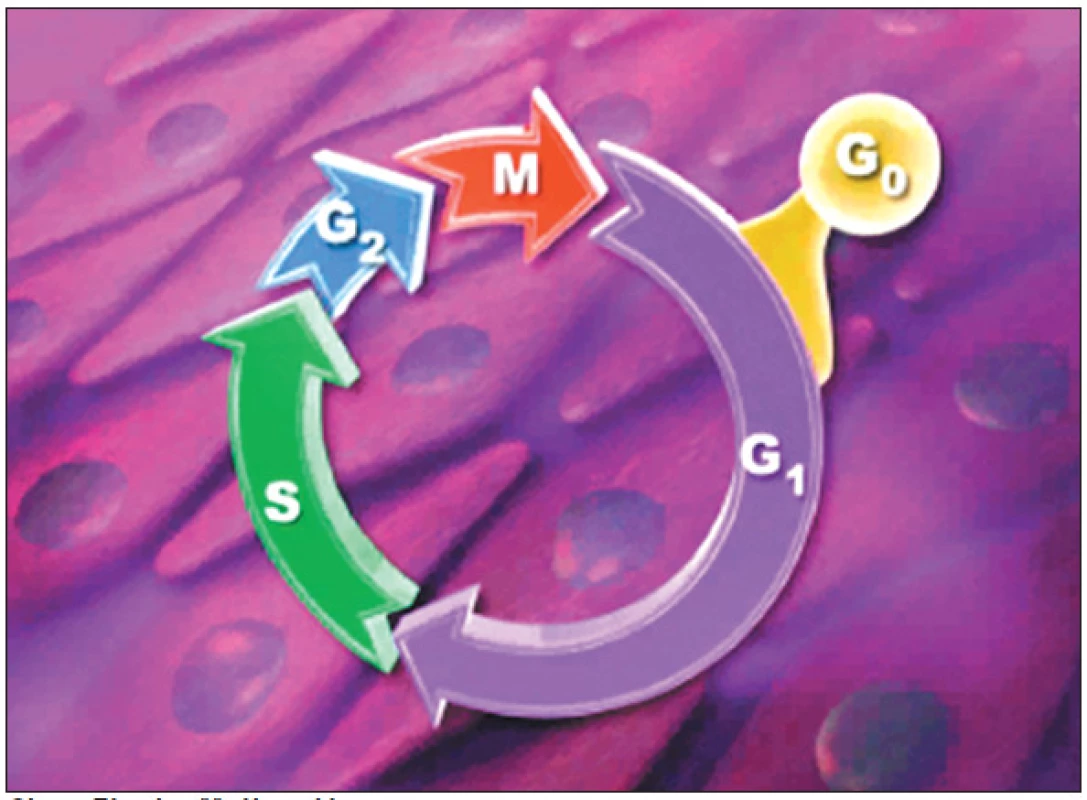
Sirolimus je makrolidové antibiotikum, produkované aktinomycetou Streptomyces hygroscopicus. Byl objeven v půdě na jednom z Velikonočních ostrovů – Rapa Nui, proto se nazývá též rapamycin. Rapamycin se začal v medicíně používat jako imunosupresivum po transplantacích. Jeho antimitotické působení blokací buněčného cyklu v G1 fázi (obr.2) jej činí výhodným pro potlačení proliferace hladkých svalových buněk [10]. Sirolimový lékový stent Cypher jako první prokázal pozitivní vliv na restenózu. V randomizované studii RAVEL došlo oproti kovovému stentu ke snížení instant-restenózy z 26,6 % na 0 %. Neointimální hyperplazie byla prakticky eliminována [11]. V další mnohem větší studii SIRIUS, do které bylo zařazeno 1 058 pacientů s více komplexními stenózami, byl výskyt angiografické restenózy do 6 měsíců při použití sirolimového stentu 3,2 %, zatímco při použití stentu kovového byla restenóza 35,4 %, (p < 0,001) [12]. Pokud byla do analýzy zavzata i oblast do 5 mm v okolí stentu, byla četnost restenózy 8,9 % vs 36,3 %, p < 0,001. Během 2letého sledování se příznivý efekt lékového stentu na vznik restenózy promítl do snížení nutnosti opakované revaskularizace intervenované tepny z 26,6 % na 5,1 % (p < 0,001), tj. snížení o 70-80 %. Zcela bez kardiovaskulárních příhod zůstává po implantaci sirolimového stentu po 2 letech 90 % nemocných (graf 1). U vysoce rizikových pacientů (přítomnost diabetu, dlouhé léze, malé tepny) bylo absolutní snížení klinické restenózy nejvýraznější. V současné době je již provedeno nebo probíhá cca 40 studií se sirolimovým stentem, které testují použítí sirolimového stentu u všech typů koronárních lézí, tj. u restenóz, bifurkací, u akutních koronárních syndromů, u diabetiků a u postižení žilních bypassů. Ukazuje se, že i u velmi rizikových intervencí z hlediska restenózy zůstává výskyt kardiovaskulárních příhod do 1 roku jednociferný.
Graf 1. 2leté přežívání pacientů bez kardiovaskulárních příhod ve studii E-SIRIUS, lékový vs holý stent. 
Druhým DES, který prokázal příznivý vliv na restenózu, je stent uvolňující cytostatikum - paclitaxel [13]. Paclitaxel pochází z tisu Taxus brevifolia. Používá se u řady nádorových onemocnění, např. vaječníku a prsu. Působí na organizaci mikrotubulů v buňkách s následnou zástavou dělení, migrace a sekrece buněk hladkého svalu [14]. Výhodou je selektivní účinek paklitaxelu na buňky hladkého svalu bez ovlivnění buněk endoteliálních. Randomizované studie řady TAXUS, v nichž byl použit paklitaxel vázaný na polymer, vykázaly podobné výsledky jako studie RAVEL a SIRIUS [15]. Ve studii TAXUS I byla u nízkorizikových stenóz pozorována opět nulová angiografická restenóza. Velká studie TAXUS II (536 nemocných) prokázala při použití DES snížení angiografické restenózy po 6 měsících (4,7 % vs 20,2 %, p < 0,0002) a snížení kardiovaskulárních příhod do 2 let (14,2 % vs 24,6 %, p = 0,0006) [16]. Do studie TAXUS IV bylo randomizováno 1 326 nemocných s vysokým rizikem restenózy. Při ročním sledování Taxus stent prokázal snížení angiografické restenózy o 70 %, snížení nutnosti opakované intervence o 73 %. Opakovanou intervenci do 1 roku po implantaci lékového stentu bylo nutno provést pouze u 3,8 % pacientů. U diabetiků bylo riziko restenózy sníženo o 80 %, takže byl výskyt restenózy stejný jako u nediabetiků [17]. Ve studiích ELUTES, ASPECT a DELIVER, které hodnotily paklitaxel přímo vázaný na stent bez použití polymeru, bylo ovlivnění restenózy méně příznivé a navíc bylo zvýšeno riziko subakutní trombózy stentu [18].
Třetí látkou, která prokázala pozitivní účinek na vznik restenózy při lokální aplikaci, je dexamethazon. Ve studii STRIDE snížil DES uvolňující dexamethazon restenózu na 1/2, s 6měsíční restenózou 13 %. U pacientů s nestabilními koronárními syndromy byl výskyt restenózy ve srovnání s konvenčním stentem snížen ještě mnohem výrazněji (2,8 % vs 38,4 %). Toto pozorování svědčí pro úlohu zánětu v akutních koronárních stavech [19]. Ve studii ENDEAVOR byla po použití DES s ABT-578 (analog sirolimu) zjištěna pouze 2,5% potřeba opakované revaskularizace ošetřené tepny do 6 měsíců. Velká studie ENDEAVOUR II tyto výsledky potvrdila a stent je v současné době již v registračním řízení na našem trhu.
Další farmaka k pokrytí stentů se zkoumají. Everolimus je analog rapamycinu s podobnými účinky. Pilotní studie ukázala jeho příznivý vliv na potlačení neointimální proliferace. Studie EASTER hodnotila stent uvolňující 17h-estradiol, který ovlivňuje hojení cévy. Restenóza po 6 měsících byla 6,6 % [20].
Ne všechny DES však mají výše uvedené pozitivní účinky. Aktinomycin-D je chemoterapeutikum, které blokuje buněčný cyklus ve fázi S. U zvířat snižoval prolifeci buněk hladkého svalu, ale studie ACTION musela být předčasně zastavena pro zvýšený výskyt restenózy při použití na lékovém stentu. Batimastat, který inhibuje migraci buněk hladkého svalu, snížil v pilotní studii restenózu o 25 %. Větší studie BRILIANT se stentem potaženým batimastatem musela být zastavena pro zvýšený výskyt restenózy.
Indikace lékových stentů
Studie Ravel a Taxus I+II prokázaly účinnost DES u jednoduchých lézí kratších než 15 mm na nativních koronárních tepnách větších než 2,5 mm. Studie SIRIUS a TAXUS IV testovaly použití DES na tepnách průměru 2,5 až 3,5 mm, u lézí o délce 15-30 mm, studie TAXUS VI až do délky 46 mm. Vyloučeny byly léze ostiální, kalcifikované, bifurkační, léze v bypassech. Studie k ověření účinnosti lékových stentů v těchto indikacích teprve probíhají. Zatím chybí přímý důkaz o příznivém vlivu lékových stentů u akutních koronárních syndromů (AKS). V registru WISDOM měli nemocní s AKS, kterým byl implantován sirolimový stent, výsledky srovnatelné jako nemocní s chronickými formami ICHS. V rotterdamském registru se ukázalo, že použití lékových stentů u akutního infarktu snižuje významně výskyt kardiálních příhod během 1. roku po intervenci. K definitivnímu zhodnocení účinnosti DES u akutního infarktu však musíme vyčkat výsledku probíhajících studií TYPHOON a HORIZONS.
Technické aspekty implantace lékových stentů
Z prvních studií vyplynulo, že pro vývoj restenózy po implantaci DES jsou nejrizikovější oblasti na koncích stentu, tj. v místech, kde koncentrace uvolněného farmaka již není dostatečná. V řadě případů bylo příčinou tohoto jevu nepřesné umístění stentu do místa predilatace, kdy část predilatovaného úseku zůstala nepokryta stentem. V dalších studiích se ukázalo, že lékové stenty je - na rozdíl od holých stentů - nutno implantovat stenty delší, tak aby začínaly a končily ve zdravém úseku tepny. V žádném případě by neměla být traumatizována cévní stěna v okolí stentu, tj. v místech, která nebudou pod vlivem farmaka. V tomto ohledu se zdá být výhodná přímá implantace stentů bez předchozí dilatace. Zatímco u běžných stentů je restenóza většinou difuzní v celém stentu, restenóza u DES je častěji fokální. Vyskytuje se nejčastěji v místech, kde je porušena kontinuita pokrytí stentem, např. v mezeře mezi stenty, v bifurkaci nebo v místě fraktury stentu. Po implantaci DES musí vzhledem k opožděné endotelizaci následovat dlouhodobá, nejlépe roční kombinovaná antiagregační léčba (aspirin, klopidogrel). Ukazuje se, že k trombóze DES může dojít i za více než 1 rok po implantaci, většinou v souvislosti s vysazením antiagregační léčby.
Cenová efektivita lékových stentů
DES jsou asi 2,5-3krát dražší než běžné stenty. Je tato vyšší cena DES úměrná jejich výhodám? Na populaci studie SIRIUS bylo v USA vypočítáno, že intervence s použitím DES je dražší o 2 850 USD (celková cena cca 14 500 USD). Snížením počtu rehospitalizací a reintervencí pro restenózu se ušetří průměrně 2 550 USD na pacienta [21]. Náklady na pacienta jsou tedy při použití DES vyšší pouze o 300 USD. To je považováno za cenu úměrnou zlepšení kvality života nemocných. V našich podmínkách jsou díky levnější práci zdravotnického personálu celkové náklady na rehospitalizace a reintervence nižší než v USA. Průměrná cenová efektivita je proto hraniční a bude se zvyšovat až s klesající cenou lékových stentů [22]. I v našem systému lze však jistě najít hranici rizika restenózy, od které se DES vyplatí [23].
Léčba nemocných s vícečetným postižením věnčitých tepen
Všechny dosud provedené studie, které srovnávaly CABG vs PCI v léčbě nemocných s postižením více koronárních tepen, prokazovaly výhody CABG v nižším počtu opakovaných revaskularizací. Na otázku, jak tyto závěry ovlivní použití lékových stentů, mají odpovědět studie ARTS II a SYNTAX, u diabetiků studie FREEDOM. Po ročním sledování nemocných s postižením 3 a více koronárních tepen v rámci studie ARTS II se ukazuje, že nemocní po implantaci lékových stentů mají ve srovnání s nemocnými randomizovanými k CABG ve studii ARTS I méně infarktů, méně cévních mozkových příhod a nižší mortalitu (tab. 1). Četnost opakovaných revaskularizací byla na rozdíl od všech předchozích podobných studií s holými stenty zvýšena po PCI jen mírně, takže celkový výskyt kardiovaskulárních příhod byl srovnatelný (graf 2). Na základě těchto výsledků lze již dnes doporučit provádění PCI s lékovými stenty i u nemocných s postižením více koronárních tepen, pokud je to technicky schůdné a pokud to umožňuje ekonomická situace [24]. Již v současné době dochází celosvětově k přesunu části nemocných z rukou kardiochirurgů do péče intervenčních kardiologů (graf 3). Přispívá k tomu i prodejní politika stentových firem v některých zemích, kde se u každé intervence platí pouze za první 2 použité lékové stenty a všechny další jsou již zdarma.
Tab. 1. 12měsíční sledování, výskyt kardiovaskulárních příhod ve studii ARTS I+II. 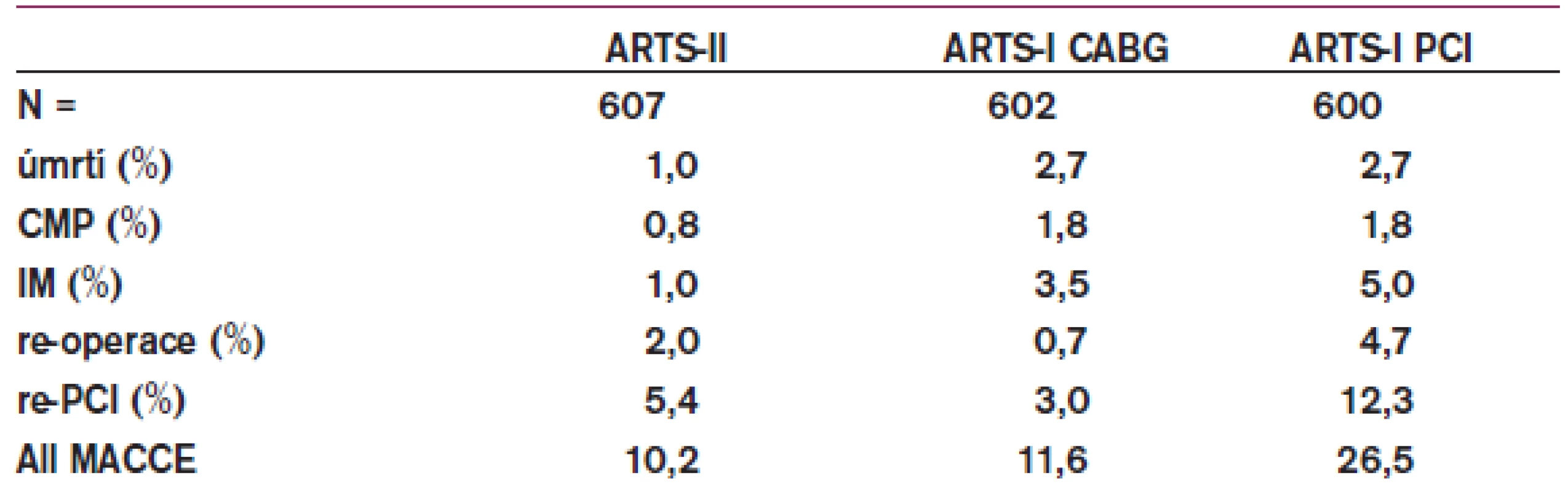
Graf 2. Přežívání pacientů bez kardiovaskulárních příhod ve studii ARTS II, PCI s použitím DES vs CABG vs PCI bez použití DES. 
Graf 3. Počty revaskularizací pomocí CABG a PCI provedených v Evropě za posledních 20 let. 
Srovnání stentů Cypher a Taxus
V současné době jsou ke klinickému užití k dispozici 2 lékové stenty – sirolimový stent Cypher a stent Taxus s paklitaxelem. Účinnost obou porovnávaly studie REALITY, SIRTAX a ISAR-diabetes. Vyplývá z nich, že oba stenty jsou výborné. Cypher je o něco málo lepší s lehce nižším výskytem angiografické restenózy [25].
Možná úskalí použití a hodnocení lékových stentů
Lékové stenty se sirolimem a paklitaxelem jsou nepochybně lepší než holé stenty. Na 2. straně si je třeba uvědomit některá omezení výsledků provedených studií:
- Výhoda lékových stentů oproti holým stentům spočívá pouze ve snížení počtu opakovaných reintervencí (TLR). Riziko infarktu myokardu ani smrti není ovlivněno. Někteří autoři považují potenciální dlouhodobé nežádoucí účinky lékových stentů za více nebezpečné než opakovanou revaskularizaci.
- Asi 1/2 angiografických restenóz je asymptomatická a pravděpodobně by neměla být léčena. Ve studiích, které srovnávaly DES a holé stenty byly počty opakovaných revaskularizací ve skupině nemocných léčených holými stenty jen o málo menší než výskyt angiografických restenóz. Ve studii RAVEL byl po implantaci holého stentu výskyt instant-restenózy 26,6 %, opakovaná revaskularizace intervenované léze byla provedena u 22 % nemocných. Znamená to, že téměř každá zjištěná restenóza byla intervenována, čímž byl uměle zvýšen počet TLR, a tak výrazně ovlivněn výsledek studií ve prospěch lékových stentů.
- Některé starší studie hodnotící účinek holých stentů prokazovaly podobné počty restenóz, jaké dnes vykazují stenty lékové [26].
- Na rozdíl od randomizovaných studií s DES, kde restenóza nepřesahuje 9 %, se její výskyt ve studiích s lékovými stenty z reálného světa pohybuje kolem 15 % [27].
- Nejdelší sledování pacientů ve studiích RAVEL, SIRIUS a TAXUS je něco přes 2 roky. Nebyl zaznamenán významný nárůst kardiovaskulárních příhod mezi 1. a 2. rokem, ke kterému by mohlo vést opožděné hojení intervenované cévy. 2leté sledování nemocných po implantaci lékových stentů však stále nemusí být dostatečně dlouhé a je nutno v něm dále pokračovat.
- Sirolimový a paklitaxelový stent zásadně snižují restenózu u diabetiků. Neplatí to však u diabetiků závislých na inzulinu. Zde nebyl pokles restenózy významný. Je možné, že jde o chybu malých čísel vlivem nízkého počtu těchto pacientů ve studiích. I ovlivnění neointimální hyperproliferace bylo však u inzulindependentních diabetiků nižší než u diabetiků na inzulinu nezávislých.
- Novým fenoménem pozorovaným u lékových stentů je pozdní malpozice stentu. Byla zjištěna ve studiích se sirolimovým stentem díky vyšetření intravaskulárním ultrazvukem. Znamená neúplné naléhání stentu k cévní stěně, které vzniká s určitým odstupem po implantaci (obr.3). Příčinou je pravděpodobně potlačení hojivého procesu po PCI a negativní remodelace tepny navozená cytostatikem. Mezi stentem a cévní stěnou tak vzniká volný prostor. Ve studii RAVEL byla po 6 měsících malpozice pozorována u 21 %, ve studii SIRIUS u 9 % nemocných. Po implantaci holých stentů se malpozice ve studii RAVEL vyskytla jen ve 4 %, ve studii SIRIUS se nevyskytla. Přes obavy z možné trombózy stentu překvapivě nebyl žádný klinický kolerát malpozice pozorován. Nepřímo však z tohoto pozorování vyplývá potřeba dlouhodobé kombinované antiagregační léčby. Je třeba teprve zjistit, zda se časem neúplná apozice upraví podobně jako v případě brachyterapie. Zajímavé je, že diabetes je protektivním mechanizmem vzniku tohoto fenoménu. Vyplývá to pravděpodobně ze zvýšené proliferativní odpovědi u diabetiků.
- Sirolimus zvýšuje agregabilitu destiček [28], což by teoreticky mohlo být příčinou trombózy stentu. V provedených studiích tato komplikace rozhodně nebyla pozorována, ale mohla by nastat v netestovaných indikacích, jako jsou například komplexní nestabilní léze.
- Neznámá je dlouhodobá stabilita polymeru lékových stentů. Nikdo neví, zda vydrží 3 roky, 5 let nebo 10 let.
Obr. 3. Malpozice stentu, intravaskulární ultrazvuk. 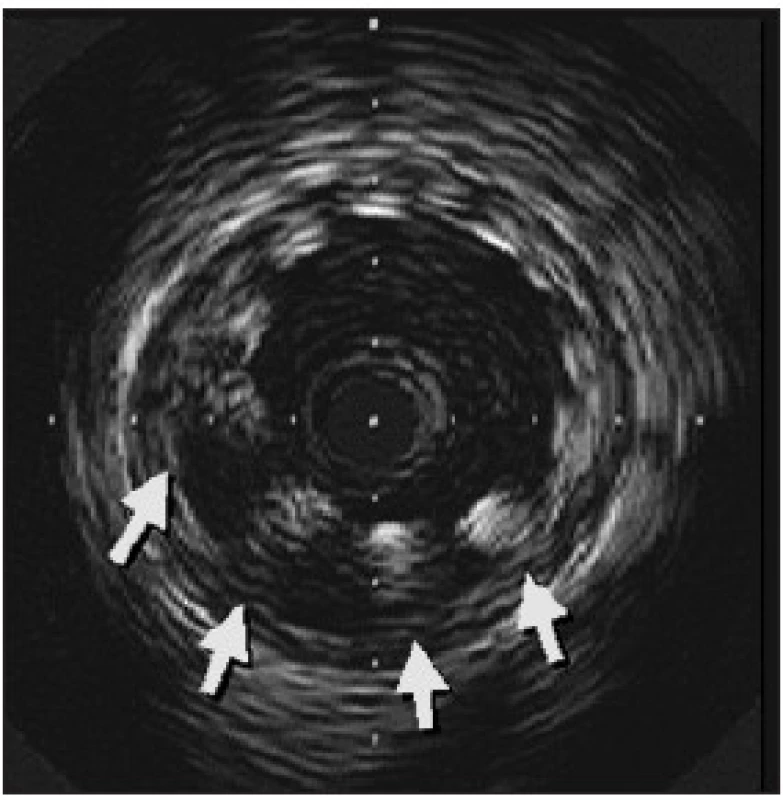
Výhledy do budoucnosti
V současné době slouží jako nosiče farmak běžně používané stenty. Nebyly vyvinuty pro tento účel a nemusí být optimální. Proto se vyvíjí speciální stent Conor, který ve svých stěnách obsahuje laserem vytvořené kapsy pro uskladnění relativně velkého množství aktivního léku (obr.4). Překrytí kapes polymerem a jejich směrová orientace umožní, aby uvolňování farmaka bylo časově i prostorově optimální [29].
Obr. 4. Stent vytvořený k uskladnění farmak. 
Další možností je použití biodegradabilních stentů, které se po určité době vstřebají. Vyloučí se tím možnost poškození cévy dlouhodobým působením stentu. Příkladem je stent magnéziový.
Rychlou reendotelizaci stentu a minimální zánětlivou odpověď po implantaci může usnadnit pokrytí stentu protilátkami proti CD34, které vychytají z krve progenitorové endoteliální kmenové buňky [30].
Situace v České republice
Na českých pracovištích je metodickým pokynem zdravotních pojišťoven použití lékových stentů vyhrazeno pro nemocné s diabetem, pro léčbu restenózy, pro komplexní léze s vysokým rizikem restenózy (tepna kalibru pod 3 mm, délka léze nad 15 mm, léze typu B2 nebo C dle klasifikace AHA) a pro prognosticky vysoce závažné nálezy (stenóza kmene indikovaná k PCI, vícečetné postižení věnčitých tepen s intervencí proximálního úseku ramus interventricularis anterior, PCI poslední průchodné tepny). Od ledna letošního roku jsou lékové stenty hrazeny do výše 30 % z celkového množství implantovaných stentů na pracovišti. Vzhledem k tomu, že však rozpočet zdravotnického zařízení není většinou o vyšší cenu lékových stentů navýšen, je úhrada spíše jen teoretická. Výjimkou jsou nově vznikající kardiocentra, která svůj rozpočet teprve nastavují.
Závěr
Lékové stenty tvoří průlom v revaskularizační léčbě nemocných s ICHS. Dramaticky snižují restenózu, snižují nutnost opakované intervence, neovlivňují riziko infarktu a mortalitu. Jejich účinnost je zatím ověřena pouze na určitých typech koronárních lézí. Na základě 2 až 3letého sledování nemocných je možné zatím říci, že implantace DES je bezpečná a že příznivé ovlivnění restenózy je dlouhodobé. Rozdíl ve výskytu kardiovaskulárních příhod mezi nemocnými léčenými DES a kontrolami se s časem zvětšuje. 90 % pacientů, kterým byl implantován sirolimový stent v rámci studie SIRIUS, je po 2 letech bez jakýchkoli kardiovaskulárních příhod [31] (graf 1). Relativní snížení rizika restenózy o 70-80 % je velmi podobné ve všech skupinách nemocných. Absolutní snížení rizika u nemocných s vysokou pravděpodobností restenózy je však mnohem vyšší a účinek DES je zde více zřetelný. Riziko trombózy stentu je zatím shodné jako u konvenčních stentů cca 0,6-1 %. Velmi pozdní trombózu stále nelze zcela vyloučit a dlouhodobá antiagregační terapie je nezbytně nutná.
Lékové stenty se stávají standardem při intrakoronárních intervencích. Frekvence použití DES se vzhledem k vyšší ceně liší podle ekonomických možností daného zdravotního systému, ale i mezi ekonomicky srovnatelnými systémy existují rozdíly dané zdravotní politikou (graf 4). Nemalou roli hraje jistě i různá cena lékových stentů v různých zemích, která je například v Británii poloviční. Pravděpodobně budou vyvinuty dokonalejší DES s účinnějšími farmaky a s dokonalejší farmakokinetikou. Časově a prostorově přesně cílená lokální léčba několika různými farmaky umožní ovlivnit všechna stadia a mechanizmy restenózy. Ke klinickému použití zatím zůstávají jen 2 stenty: TAXUS testovaný na více než 3 000 pacientů a Cypher testovaný na více než 1 800 pacientů. Velmi brzy bude k dispozici nový lékový stent uvolňující ABT-578. Pro hodnocení pozdní restenózy je třeba vyčkat 3-5 let.
Graf 4. Podíl DES mezi implantovanými stenty v různých zemích Evropy. 
Doručeno do redakce 17. 5. 05
Přijato k otištění po recenzi 25. 6. 05
MUDr. Stanislav Šimek, CSc.,
MUDr. Jan Horák, CSc.,
MUDr. Petr Kuchynka,
MUDr. Marcela Škvařilová, CSc.,
MUDr. Jiří Humhal,
MUDr. Vratislav Mrázek, CSc.,
MUDr. Vilém Danzig, Ph.D.,
prof. MUDr. Michael Aschermann, DrSc., FESC
Klinika kardiologie a angiologie l. LF a VFN, Praha
MUDr. Stanislav Šimek, CSc.
MUDr Stanislav Šimek, CSc. pracuje od r. 1987 na II. Interní klinice Všeobecné fakultní nemocnice a l. lékařské fakulty UK v Praze, nejprve jako vědecký aspirant, nyní jako kardiolog – učitel. Specializuje se na akutní a intervenční kardiologii. Ročně provádí přes 250 koronárních intervencí. Je nositelem primářské licence pro obor kardiologie. Absolvoval 3měsíční stáž na Texas Heart Inst. v Houstonu. V r. 2001 obhájil dizertační práci na téma Intervenční léčba akutního infarktu myokardu. V současné době se vědecky zabývá novými možnostmi prevence reperfuzního poškození a záchrany myokardu po infarktu včetně implantace kmenových buněk. Je autorem a spoluautorem 31 původních vědeckých prací a 21 přehledných článků v odborných časopisech. Je spoluautorem 2 monografií.
Zdroje
1. Lowe HC, Oesterle SN, Khachigian LM. Coronary in-stent restenosis: current status and future strategies. J Am Coll Cardiol 2002; 39(2): 183–93.
2. Grewe PH, Deneke T, Machraoui A, Barmeyer J, Muller KM. Acute and chronic tissue response to coronary stent implantation: pathologic findings in human specimen. J Am Coll Cardiol 2000; 35(1): 157–63.
3. Kornowski R, Hong MK, Tio FO, Bramwell O, Wu H, Leon MB. Instent restenosis: contributions of inflammatory responses and arterial injury to neointimal hyperplasia. J Am Coll Cardiol 1998; 31(1): 224–30.
4. Brasen JH, Kivela A, Roser K et al. Angiogenesis, vascular endothelial growth factor and platelet-derived growth factor-BB expression, iron deposition, and oxidation-specific epitopes in stented human coronary arteries. Arterioscler Thromb Vasc Biol 2001; 21(11): 1720–6.
5. Kuroda N, Kobayashi Y, Nameki M et al. Intimal hyperplasia regression from 6 to 12 months after stenting. Am J Cardiol 2002; 89(7): 869–72.
6. Aschermann M, Kovárník T, Aschermann O. Restenóza po koronární intervenci. Kapitoly z kardiologie 2000; 2 : 10-12.
7. Faxon DP. Systemic drug therapy for restenosis: ‘‘deja vu all over again’’. Circulation 2002; 106(18): 2296–8.
8. Waksman R. Radiation therapy for restenosis: from preclinical studies to human trials. Stent 1997; 1 : 9-13.
9. Kováč J. Použití stentů s místním uvolňováním léků (local drug delivery) v prevenci restenózy. Interv Akut Kardiol 2003; 2 : 73-81.
10. Curfman GD. Sirolimus-eluting coronary stent. N Engl J Med 2002; 346 : 1770-1.
11. Morice MC, Serruys PW, Sousa EJ. A randomised comparison of a sirolimus-eluting stent with standard stent for coronary revascularization. N Engl J Med 2002; 346 : 1773-80.
12. Moses JW, Leon MB, Popma JJ et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med 2003; 349(14): 1315–23.
13. Park SJ, Shim WH, Ho DS. A paclitaxel-eluting stent for the prevention of coronary restenosis. N Engl J Med 2003; 348 : 1537-45.
14. Rowinsky EK, Donehower RC. Paclitaxel (taxol). N Engl J Med 1995; 332(15): 1004–14.
15. Grube E, Silber S, Hauptmann KE. TAXUS I: six and twelve-month results from a randomised double-blind trial on a slow-release paclitacel-eluting stent for de novo coronary lesions. Circulation 2003; 107 : 38-42.
16. Colombo A, Drzewiecki J, Banning A. Randomized study to assess the effectiveness of slow - and moderate-release polymer-based paclitaxel-eluting stents for coronary artery lesions. Circulation. 2003; 108(7): 788-94.
17. Stone GW, Ellis SG, Cox DA. A polymer-based, Paclitaxel.eluting stent in patients with coronary artery disease. N Engl J Med 2004; 350 : 221-231.
18. Park SJ, Shim WH, Ho DS et al. A paclitaxel-eluting stent for the prevention of coronary restenosis. N Engl J Med 2003; 348(16): 1537–45.
19. De Schreerder I. Study of antirestenosis with the BioDivYsio dexamethazone eluting stent (STRIDE). 51th Annual scientific sessions of the ACC, Atlanta, March 17-20, 2002 (přednáška).
20. Abizaid AA, New G, Abizaid AS et al. First clinical experience with 17-estradiol-eluting BiodivYsio matrix stent to prevent restenosis in de-novo native coronary arteries: sixmonth clinical outcomes and angiographic follow-up from the EASTER trial. J Am College Cardiol 2003; 41(6): 56A.
21. Cohen DJ, Bakhai A, Shi CH. Cost-effectiveness of Sirolimus-eluting stents for treatment of complex coronary stenoses, results from the SIRIUS trial. Circulation 2004; 110 : 508-514.
22. Goláň L, Šimek S, Škvařilová M et al. The cost effectiveness of drug eluting stents in elective percutaneous coronary interventions. Intercath 2005.
23. Sharma S, Bhambi B. Sirolimus-eluting coronary stents. N Engl J Med 2002; 347 : 1285.
24. Widímský P. Koronární bypass, revaskularizační metoda minulého století? XII. Výroční sjezd ČKS, Brno, květen 9-12, 2004 (přednáška).
25. Groch L. Jsou všechny lékové stenty stejné? XII. Výroční sjezd ČKS, Brno, květen 9-12, 2004 (přednáška).
26. De Jaegere P, Mudra H, Figulla H et al. Intravascular ultrasound-guided optimized stent deployment. Immediate and 6 months clinical and angiographic results from the Multicenter Ultrasound Stenting in Coronaries Study (MUSIC Study). Eur Heart J 1998; 19(8): 1214–23.
27. Lemos PA, Saia F, Ligthart JM et al. Coronary restenosis after sirolimus-eluting stent implantation. Morphological description and mechanistic analysis from a consecutive series of cases. Circulation 2003; 108 : 257–60.
28. Babinska A, Markell MS, Salifu MO. Enhancement of human platelet aggregation and secretion induced by rapamycin. Nephrol Dial Transplant 1998; 13(12): 3153–9.
29. Finkelstein A, McClean D, Kar S et al. Local drug delivery via a coronary stent with programmable release pharmacokinetics. Circulation 2003; 107(5): 777–84.
30. Kutryk MJB, Kuliszewski MA. Progenitor cell capture for the accelerated endothelialization of endovascular devices. Am J Cardiol 2002; 90 (6A): TCT180.
31. Kereiakes DJ. Two-year SIRIUS trial follow-up. AHA meeting, Orlando, November 7-8, 2003.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článek Co nebylo v abstraktech
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2005 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Srdce v obrazech lidových rčení III.
- XIII. výroční sjezd České kardiologické společnosti
- Co nebylo v abstraktech
- Lékové stenty – mechanizmy účinku a současné indikace
- Poruchy mikrocirkulace u chronické žilní nedostatečnosti
- Ramipril v klinických studiích
- Hypertenze a stárnoucí srdce z pohledu geriatra
- Léčba hypertrofické kardiomyopatie
- Další novinky na sympoziu ACC v Orlandu 6.–9. 3. 2005
- 3. mezinárodní sympozium o novinkách při stanovování NT-pro BNP
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Lékové stenty – mechanizmy účinku a současné indikace
- Léčba hypertrofické kardiomyopatie
- Ramipril v klinických studiích
- Hypertenze a stárnoucí srdce z pohledu geriatra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy