-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Stručný průvodce putováním od nové přes novější k nejnovější léčbě DM2
Autori: Jan Kulhavý
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(5): 431-434
Kategória: Interní medicína
Moderní antidiabetika a možnosti personalizace léčby diabetu mellitu 2. typu (DM2) byly hlavním tématem setkání odborníků, které se uskutečnilo 15. září ve Vídni. Průvodci a hlavími moderátory této akce, která se uskutečnila díky podpoře společnosti AstraZeneca, se staly prof. Chantal Mathieuová z Katholieke Universiteit v belgickém Leuvenu a prof. Jiten Vora ze Spire Liverpool Hospital ve Velké Británii.
„Každý třetí z narozených v roce 2000 vyvine během svého života DM2. Je to ztracená generace odsouzená k mikro ‑ a makrovaskulárním komplikacím, slepotě, amputacím a kardiovaskulárním onemocněním?“ ptal se sám sebe v emocionálním úvodu prof. Vora. A odpověděl si, že tomu tak rozhodně být nemusí – i kdyby se nepodařilo příznivě ovlivnit epidemiologii DM2, účinná léčba, která je příslibem lepší budoucnosti, přichází již dnes. Možná až příliš překotně na to, aby všichni správně uchopili její možnosti a využili je ve prospěch svých pacientů.
Každý z léků umí něco skvěle
Prof. Tina Vilsbøllová z dánské Gentofte Hospital zrekapitulovala, že od počátku tohoto století se armamentarium diabetologů rozšířilo o tři třídy antidiabetických léků (agonisté GLP‑1, gliptiny, glifloziny) s různým mechanizmem účinku a dnes jsou k dispozici především:
- metformin, který je standardem 1. linie léčby, a k němu do kombinace
- sulfonylurea,
- thiazolidindiony,
- inzulin,
- agonisté receptoru pro glukagon‑like peptid 1 (GLP‑1),
- inhibitory enzymu dipeptyl peptidázy‑ 4 (DPP‑ 4) – gliptiny,
- inhibitory sodíkoglukózového kotransportéru‑ 2 (SGLT‑ 2) – glifloziny.
„DM2 ve své patofyziologii zahrnuje řadu signálních drah a tělesných orgánů,“ připomněla prof. Vilsbøllová. Každý z nových léků má proto více či méně jiný terapeutický cíl i mechanizmus účinku.
Agonisté receptoru pro GLP‑1 cílí na:
- Žaludek – krátkodobě působící agonisté GLP‑1 oddalují vyprázdnění žaludku účinněji než kontinuálně působící. Prokázaly to změny v absorbci acetaminofenu po 14 dnech léčby – 20 % plochy pod křivkou po 0– 5 hod (AUC0– 5) s exenatidem krátkodobě působícím vs 4 % AUC0– 5 s exenatidem kontinuálně působícím.
- Játra – podle hladiny krevního cukru se zde řídí produkce glukózy. Léčba atomisty receptoru GLP‑1 tedy ovlivňuje lačnou i postprandiální glykemii.
- Mozek – již řadu let je známo, že infuze nativního GLP‑1 zvyšuje pocit nasycení a plnosti.
- Krevní řečiště – agonisté receptoru GLP‑1 mohou mít pozitivní vliv na funkci cév a protizánětlivý účinek. Např. v jedné ze studií 12týdenní léčba exenatidem vedla k nižší tvorbě reaktivní formy kyslíku a tím i k nižší produkci souvisejících mediátorů zánětu, např. TNFα nebo IL‑18.
Inhibitory DPP ‑ 4 podle slov prof. Vilsbøllové snižují hyperglykemii prostřednictvím různých mechanizmů a mají příznivý vliv na vaskulární dysfunkce. Vzhledem k tomu, že pro použití v klinické praxi bylo paralelně schváleno hned několik gliptinů, nabízí se otázka, zda jsou všechny opravdu stejné. Jak se z dostupných dat jeví, rozsah inhibice plazmatické aktivity DPP ‑ 4 je u všech aktuálně předepisovaných gliptinů srovnatelný, všechny poskytují přibližně dvoj ‑ až trojnásobný nárůst koncentrace intaktního inkretinového hormonu. Předpokládá se tedy, že i glykemický efekt bude podobný.
Naprostou novinkou, která do klinické praxe v ČR oficiálně vstoupila krátce po konání vídeňského kongresu EASD, tzn. před necelým měsícem, jsou inhibitory sodíkoglukózového kotransportéru ‑ 2 (SGLT ‑ 2) v proximálních tubulech.
„Ledviny jsou v patofyziologii DM2 důležitým orgánem – glukózu vylučují, ale také vracejí zpět do organizmu. Renální glukoneogeneze přispívá k systémové koncentraci glukózy v postprandiální a postabsorbční fázi. V té postprandiální se renální glukoneogeneze zdvojnásobuje,“ uvedla prof. Vilsbøllová.
„U pacientů s DM2 je renální glukoneogeneze abnormálně vysoká ve srovnání se zdravými jedinci. V postabsorbční fázi je u nich uvolňování glukózy až trojnásobně vyšší oproti zdravým jedincům – 321 ± 36 vs 125 ± 15 mmol/ min.“
SGLT ‑ 2 inhibitory upravují jiný patofyziologický mechanizmus, který je u diabetiků 2. typu přítomen – a tím je zvýšený renální práh pro glukózu. Kontrola glykemie dosažená s inhibitory SGLT ‑ 2 je podle dostupných údajů účinná a setrvalá – po dvou letech podávání kombinace dapagliflozinu (Forxiga, AstraZeneca) s metforminem byla koncentrace HbA1c stále o 0,78 % nižší než výchozí hodnota.
Druhým účinkem dapagliflozinu je dlouhodobé příznivé ovlivnění tělesné hmotnosti. Po 102 týdnech sledování se jednalo o – 1,7 kg s kombinací metformin + dapagliflozin vs +1,4 kg s metforminem + placebem, čistý benefit dapagliflozinu tedy byl – 3,1 kg.
Za třetí glifloziny snižují krevní tlak – systolický ve studii v kombinaci s metforminem o – 4,4 mm Hg, diastolický o – 2,1 mm Hg. „Inhibice SGLT ‑ 2 také zvyšuje muskulární senzitivitu k inzulinu a zlepšuje funkci beta buněk,“ dodala prof. Vilsbøllová.
V řadě za sebou, nebo raději naráz a hned?
Má v managementu DM2 smysl časná kombinační léčba? Tuto otázku v dalším průběhu sympozia položil prof. Bernard Zinman z University of Toronto, Kanada. „Měli bychom přijmout dvě východiska. První, že hyperglykemie má u každého pacienta jinou příčinu. Důvodů, proč beta buňky selhávají, je více – glukotoxicita, lipotoxicita, adipokiny a cytokiny, např. IL‑6 či TNFα, dále procesy jako chronická hyperinzulinemie, oxidační stres a chronická hyperamylinemie, ale také ER stres či epigenetické faktory. Výsledkem je apoptóza nebo transformace beta buněk v alfa buňky. Druhým východiskem by mělo být poznání, že patofyziologie onemocnění se v čase horší,“ konstatoval prof. Zinman.
Tradičním konzervativním přístupem v případě DM2 je léčba do selhání – začíná se dietou, když absentují výsledky, nasadí se první perorální antidiabetikum v monoterapii, následuje titrace dávky, pak druhý lék do kombinace, přidání dalšího perorálního antidiabetika, poté bazálního inzulinu a nakonec dojde na kompletní inzulinový režim.
„Nové paradigma léčby DM2 říká začít co nejdříve s co nejintenzivnější kombinací,“ uvedl prof. Zinman a na podporu svého názoru uvedl citát z publikace Woodcocka et al v NEJM z r. 2011: „Buněčné signální dráhy fungují spíše jako internetová síť než jako dálnice. Je na nich mnoho rozboček a paralelních či alternativních cest, které mohou být aktivovány, pokud je hlavní dráha zablokována.“
„Z toho důvodu se kombinační, či ještě lépe řečeno časná kombinační léčba, již etablovala v onkologii, v terapii HIV/ AIDS, hypertenze, astmatu, revmatoidní artritidy či tuberkulózy,“ uvedl prof. Zinman a vzápětí dodal výčet specifických důvodů pro časnou kombinační léčbu DM2:
- rychlé, robustní a setrvalé snížení koncentrace HbA1c,
- eliminace tzv. klinické nečinnosti, tedy pasivního vyčkávání na zhoršení, které provází tradiční léčbu do dalšího selhání,
- zlepšení funkce beta buněk a jejich ochrana,
- zahájení intervence komplementárním mechanizmem účinku,
- možnost nasazení nižší než maximální dávky každého jednotlivého léku v kombinaci – minimalizace nežádoucích účinků.
„Klinická nečinnost při léčbě ,od selhání po selhání‘ není tak zřídkavým jevem, jak by se mohlo zdát,“ zdůraznil prof. Zinman. „Publikace Shaha et al v Diabetes Care již v r. 2005 poukázala na fakt, že jen 45,1 % pacientů v ordinaci specialisty a 37,4 % tam, kde je péče o diabetiky v rukou praktických lékařů, je včas identifikováno k intenzifikaci léčby.“ Při dlouhodobé koncentraci HbA1c vyšší než 8 % (DCCT) dochází, jak připomněl, k sekundárnímu selhání metforminu a ani jeho dvojkombinace se sulfonylureou není dlouhodobě prospěšná – je asociována s rizikem hypoglykemií i nárůstem hmotnosti. „Nic jiného než nízká cena není důvodem, proč je stále nejpředepisovanější kombinací,“ řekl doslova prof. Zinman.
Na podporu časných kombinací uvedl mj. následující zjištění klinických studií:
- počáteční kombinační terapie saxagliptinem s metforminem přinesla superiorní kontrolu glykemie oproti každému z nich v monoterapii,
- počáteční kombinační terapie sitagliptinem s metforminem přinesla vyšší kontrolu
- glykemie oproti každému z nich v monoterapii,
- sitagliptin + metformin vedly k nižší postprandiální glykemii než každý z nich v monoterapii,
- sitagliptin + metformin vedly k vyššímu postprandiálnímu uvolňování GLP‑1 než každý z nich v monoterapii,
- sitagliptin + metformin vedly k nižší produkci glukagonu než metformin v monoterapii,
- počáteční kombinační terapie dapagliflozinem s metforminem vedla k lepší kontrole glykemie oproti každému z nich v monoterapii,
- exenatid + metformin vedly k lepší kontrole glykemie oproti metforminu v monoterapii.
„Nevíme sice dosud, kterou kombinací je optimální začít, resp. zda jejich sekvence má vůbec nějaký klinický význam – na to nám pravděpodobně odpovědí až budoucí head ‑ to ‑ head studie. To, co ale víme naprosto bezpečně již dnes, je, že je vždy lepší začít s jakoukoli kombinací než s monoterapií,“ uzavřel prof. Zinman.
Mimochodem, jak po vystoupení prof. Zinmana oznámil moderující prof. Vora, „vzrušující okamžik se blíží“. Ve studii GRADE, která začala nabírat pacienty v květnu 2013, se tváří v tvář přímo utkají zástupci všech hlavních tříd antidiabetik – a bude zajímavé sledovat, co to kolem roku 2020, kdy budou zveřejněny výsledky, udělá s doporučenými postupy.
Na začátku studie GRADE je screening, z něhož vzejde vzorek vhodných pacientů – s délkou trvání DM < 5 let, koncentrací HbA1c ≥ 6,8 %, léčených metforminem v monoterapii. Jeho dávka bude ve startovací fázi titrována od 1 000 mg denně (minimum) do 2 000 mg denně (cíl). Pět tisíc pacientů, kteří na konci této fáze při poslední kontrole dosáhnou hodnoty glykovaného hemoglobinu 6,8 až 8,5 % bude randomizováno k podávání glimepiridu (sulfonylurea), sitagliptinu (inhibitor DPP ‑ 4), liraglutidu (analog GLP‑1) nebo inzulinu glargin.
Hledání optimálního partnera k metforminu
Ve druhé části sympozia došlo „na lámání chleba“ – absentují‑li evidence‑based data z přímých srovnávacích studií, nastupuje ars medicinae v pravém slova smyslu. A tak moderátoři odborného setkání prof. Mathieuová a prof. Vora položili auditoriu následující otázku:
Jaká je vaše preferovaná volba léku přidaného do kombinace k metforminu ve druhé linii?
Odpovědi, které doporučujeme zapamatovat si až do konce tohoto článku, zněly:
55 % – inhibitory DPP ‑ 4,
16 % – inhibitory SGLT ‑ 2,
12 % – agonisté receptoru pro GLP‑1,
12 % – sulfonylurea,
2 % – inzulin,
2 % – thiazolidindion.
Prof. Vora připomněl, že v roce 2012 přijaly americká i evropská diabetologická společnost, tedy ADA a EASD, společný poziční dokument, podle kterého má být léčba DM2 cílená a individualizovaná.
„Nová antidiabetika takový přístup umožňují. Inhibitory DPP ‑ 4 mohou být v kombinaci s metforminem vhodné zejména pro pacienty, u kterých je cílem zabránit nárůstu tělesné hmotnosti nebo hypoglykemii. Totéž platí pro agonisty receptoru pro GLP‑1. Užívání inhibitorů SGLT ‑ 2 je navíc podle dat ze studií spojeno se snižováním krevního tlaku a redukcí hmotnosti, ale teoreticky mají jistý, byť nízký hypoglykemický potenciál,“ uvedl prof. Vora – a poté dal prostor třem advokátům tří moderních modalit, aby obhájili svůj preferovaný lék druhé volby v kombinaci s metforminem.
Prof. MEIER: HLASUJI PRO GLIPTINY
„Inhibitory DPP ‑ 4 mohou být lékem druhé linie pro většinu pacientů,“ je přesvědčen prof. Juris J. Meier z Ruhr Universität Bochum, SRN. Ideální lék pro snižování hyperglykemie podle jeho názoru musí být dlouhodobě účinný, s co nejnižším rizikem vyvolání hypoglykemie, bez nežádoucího vlivu na tělesnou hmotnost, obecně dobře snášený, bezpečný pro kardiovaskulární systém, perorálně podávaný s jednoduchým dávkováním a dostupný ve fixní kombinaci pro zvýšení adherence pacientů.
„Metaanalýza osmi studií s pěti v současnosti dostupnými gliptiny prokázala u všech účinnost ve smyslu snižování koncentrace HbA1c oproti výchozí hodnotě i snížení BMI,“ uvedl prof. Meier. „Pokud jde o dlouhodobou kontrolu glykemie, saxagliptin prokázal podle publikace Gökeho et al z r. 2013 udržitelný efekt i po 104 týdnech užívání – v porovnání s glipizidem, u kterého byl sice až do 18. týdne pokles koncentrace HbA1c oproti výchozí hodnotě 7,65 % výraznější, pak však došlo k opětovnému růstu a od 78. týdne byla kontrola horší než setrvalý účinek saxagliptinu.“
Ve stejné Gökeho práci postihla během dvou let alespoň jedna hypoglykemická příhoda 38,4 % pacientů léčených kombinací glipizidu s metforminem, 22 z 430 nemocných dokonce reportovalo více než 10 těchto událostí. Oproti tomu ve skupině užívající saxagliptin s metforminem postihly hypoglykemie pouze 3,5 % pacientů, a to nejvýše 4× za dva roky sledování u jediného pacienta z celkových 428.
„Pokud jde o ovlivnění tělesné hmotnosti, v celkem šesti studiích s aktivním komparátorem – 4× sulfonylureou a 2× pioglitazonem – prokázaly inhibitory DPP ‑ 4 vždy příznivý vliv na snížení, resp. udržení tělesné hmotnosti, zatímco u komparátoru vždy došlo k jejímu nárůstu,“ konstatoval prof. Meier.
Inhibitory DPP ‑ 4 mají podle jeho názoru prokazatelně dobrou snášenlivost – míra relativního rizika vůči placebu 0,92. Také výskyt nežádoucích účinků je nízký – míra relativního rizika 1,02 v porovnání s placebem a jen 0,94 oproti jiným antidiabetikům. Evropská léková agentura EMA navíc, jak připomněl, konstatovala, že na základě dostupných studijních i klinických dat nejsou důvody k obavám z nových rizik užívání gliptinů pro pankreas.
„S jistou rezervou, pokud se týká průkazu kardiovaskulární bezpečnosti, což je ovšem společná výzva pro všechna nová antidiabetika, tedy inhibitory DPP ‑ 4 splňují moji představu o ideální léčbě DM2,“ uzavřel prof. Meier.
Prof. VILSBØLLOVÁ: HLASUJI PRO AGONISTY GLP‑1
„Kdo mě zná, ví že nerada prohrávám,“ uvedla svou argumentaci ve prospěch atomistů receptoru pro GLP‑1 coby optimálního léku druhé linie v kombinaci s metforminem prof. Vilsbøllová. Auditorium seznámila se svými prioritami: schopností individualizovat léčbu, setrvalým účinkem na snižování hyperglykemie, příznivým vlivem na tělesnou hmotnost, nízkým rizikem hypoglykemií, dobře zvladatelnými nežádoucími účinky a ovlivněním výskytu kardiovaskulárních příhod.
„Krátkodobě působící agonisté receptoru pro GLP‑1 posilují syntézu a sekreci inzulinu stejně jako proliferaci beta buněk, naopak snižují jejich apoptózu i sekreci glukagonu. Kromě toho prokazatelně zpomalují vyprázdnění žaludku,“ zdůraznila prof. Vilsbøllová.
Na základě rekapitulace publikovaných dat připomněla, že po přidání k metforminu redukují agonisté GLP‑1 koncentraci HbA1c glukózu nalačno o 0,6 – 1,5 mmol/ l (0,9 – 2,0 mmol/ l), tělesnou hmotnost o 2 – 4 kg (1,2 – 3 kg) a systolický krevní tlak o 2 – 9 mm Hg (1 – 4 mm Hg).
Účinek je navíc v čase setrvalý. Exenatid podávaný 1× týdně prokázal i po šesti letech sledování snížení koncentrace HbA1c o 1,62 % oproti výchozí hodnotě.
Čtyři studovaní agonisté receptoru pro GLP‑1 rovněž prokázali dlouhodobě nízké riziko vzniku hypoglykemie – od 0,03 do 0,34 pacienta/ rok oproti glimepiridu (0,86 pacienta/ rok) a inzulinu (0,9 pacienta/ rok).
Kritéria ideálního léku (kromě rovněž sporného KV efektu – na průkaz kardioprotektivity se mezi novými antidiabetiky stále čeká) tedy prof. Vilsbøllové agonisté receptoru pro GLP‑1 naplnily beze zbytku.
Tab. 1. Výhody a omezení nových antidiabetik (postřehy z klinické praxe T. Vilsbøllové). 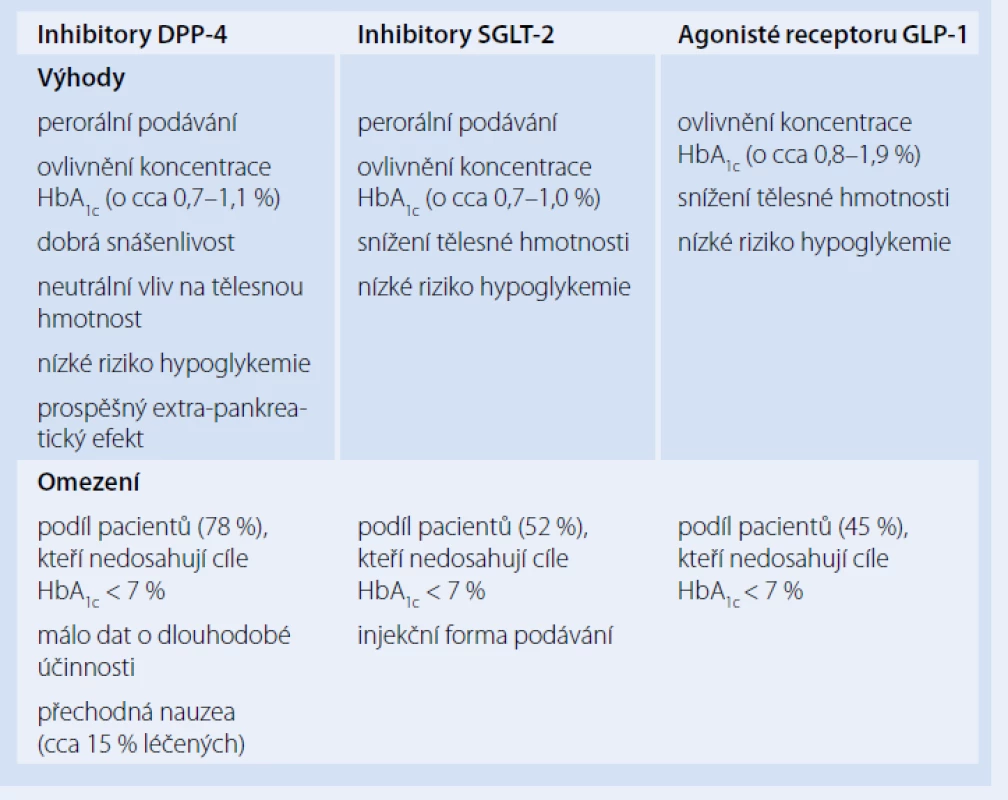
Prof. MATTHAEI: HLASUJI PRO GLIFLOZINY
„Inhibitory SGLT ‑ 2 mohou být volbou druhé linie pro všechny pacienty, u kterých neexistuje výslovná kontraindikace např. v podobě chronického selhání ledvin,“ je přesvědčen prof. Stephan Matthaei z Christliches Krankenhaus Quakenbrück, SRN. „Ideální profil léku snižujícího hyperglykemii pro mne znamená přesvědčivý antihyperglykemický účinek bez rizika hypoglykemie, příznivý vliv na hmotnost i krevní tlak, nízkou míru nežádoucích účinků a příznivý vliv na výskyt KV událostí,“ zdůraznil.
Připomněl dlouhodobá data z užívání kombinace dapagliflozinu s metforminem oproti glipizidu s metforminem – po 4 letech byla v prvním případě koncentrace HbA1c stále o 0,1 % nižší oproti výchozí hodnotě (u glipizidu o 0,2 % vyšší). Za stejné období byla pozorována hypoglykemie jen u 5,4 % pacientů s dapagliflozinem oproti 51,5 % s glipizidem.
Na konci čtyřletého období byl potvrzen setrvalý úbytek hmotnosti s dapagliflozinem o 3,65 kg oproti výchozí hodnotě – a protože ve skupině s glipizidem pacienti končili na 0,73 kg nad původní hmotností, činil celkový relativní přínos dapagliflozinu oproti glipizidu – 4,38 kg.
Vliv na tělesnou hmotnost je podle prof. Mathaeie společný a konzistentní u všech inhibitorů SGLT ‑ 2. Po dvou letech sledování ve studiích se jednalo o – 3,7 kg s dapagliflozinem (oproti +1,2 kg s glipizidem), – 3,6 kg s canagliflozinem (vs +1,7 kg s glimepiridem) a – 3,1 kg s empagliflozinem (vs +2,6 kg s glimepiridem).
„Pokud jde o nežádoucí účinky, vím, že existují obavy z genitálních infekcí,“ uvedl prof. Matthaei. Podle dostupných dat však jsou dobře zvladatelné, a pokud se vyskytují v předchozí anamnéze, je možno zvolit jinou vhodnou léčbu – a navíc jejich výskyt není nijak dramatický. Po dvou letech užívání byly zaznamenány ve 14,8 % s dapagliflozinem (oproti 2,9 % s glipizidem), 11,6 % s canagliflozinem 100 mg, resp. 12,4 % s canagliflozinem 300 mg (vs 2,3 % s glimepiridem) a 12 % s empagliflozinem (vs 2 % s glimepiridem).
A ještě jednou tytéž studie a nežádoucí účinky, tentokrát infekce močových cest. Po dvou letech 13,5 % s dapagliflozinem (oproti 9,1 % s lipizidem), 10,6 % s canagliflozinem 100 mg, resp. 9,7 % s canagliflozinem 300 mg (vs 6,8 % s glimepiridem) a 14 % s empagliflozinem (vs 13 % s glimepiridem). Podle prof. Matthaeie by dapagliflozin mohl být i prvním antidiabetikem s prokázanou kardioprotektivitou – to je úkolem randomizované, dvojitě zaslepené studie DECLARE ‑ Timi 58. Zahrne 17 150 pacientů s diabetem 2. typu a prokázaným KV onemocněním či s více KV rizikovými faktory. Budou randomizováni do dvou ramen k podávání dapagliflozinu 10 mg denně, nebo placeba, spolu se standardní antidiabetickou léčbou podle úvahy ošetřujícího lékaře.
Délka sledování by měla činit přibližně 4,5 roku, primární kompozitní cíl je složený z KV úmrtí, infarktu myokardu a ischemické CMP. Sekundárními cíli jsou hospitalizace pro chronické srdeční selhání, mortalita ze všech příčin a také změna hmotnosti. Studie byla zahájena v dubnu 2014, výsledky se očekávají v r. 2019, konstatoval prof. Matthaei – který tak jednoznačně preferoval glifloziny jako lék druhé volby do kombinace k metforminu.
Jeho názor byl natolik přesvědčivý, že ovlivnil i celé auditorium. Pokud si vzpomenete – nebo výše vyhledáte – , jak zněly odpovědi ohledně preferovaného léku druhé linie před odpoledními „obhajobami“ jednotlivých modalit, při opakovaném hlasování na závěr se preference výrazně změnily:
39 % – inhibitor SGLT ‑ 2,
37 % – inhibitory DPP ‑ 4,
21 % – agonisté receptoru pro GLP‑1,
1 % – sulfonylurea,
1 % – inzulin,
0 % – thiazolidindion.
Tab. 2. Která léčba bude za deset let užívána jako standard u většiny nemocných s DM2? (odpovědi účastníků sympozia) 
Off ‑ label úvaha na závěr
Jak by v budoucnu mohla nová antidiabetika ovlivnit terapii diabetu mellitu 1. typu, nad tím se zamyslel prof. Thomas Pieber z Universität Graz v Rakousku.
Připomněl, že léčba založená na substituci inzulinu je dnes základem terapie DM1 – zachraňuje životy, ale není kurativní. „Intenzifikovaná inzulinová terapie dokáže redukovat riziko dlouhodobých komplikací, ale významně zvyšuje výskyt hypoglykemických příhod. Jejím dobře zdokumentovaným nežádoucím účinkem je nárůst tělesné hmotnosti, jejíž kontrola je spolu s dobrou kontrolou hyperglykemie tou nejaktuálnější potřebou léčby DM1,“ konstatoval prof. Pieber. V budoucnu by měla být i terapie DM1 složena z více specifických přístupů. „Genetické predispozice i vlivy prostředí mají za následek specifickou autoimunitní odpověď ostrůvků. Nový přístup by tedy měl zahrnovat imunoterapii. Tu nespecifickou indukovanou CFA, anti‑CD3 mAb, HSC, MSC a exenatidem, i specifickou indukovanou inzulinem, GAD a PPI peptidy, dále produkci HSC, MSC a CD4+CD25 T buněk in vitro – a také samozřejmě náhradu samotných beta buněk,“ věří prof. Pieber.
Jak by v této indikaci mohli uspět agonisté receptou pro GLP‑1? „Z terapie DM2 je potvrzen jejich účinek na zvýšení sekrece inzulinu v závislosti na koncentraci sérové glukózy i na dosažení pocitu sytosti, naopak snižují sekreci glukagonu v závislosti na glukóze i riziko hypoglykemie, zpomalují motilitu gastrointestinálního traktu, snižují příjem energie, hodnotu lačné i postprandiální glykemie a také tělesnou hmotnost. Jejich potenciální benefit v terapii DM1 by tedy měl spočívat v redukci produkce jaterní glukózy prostřednictvím snížení koncentrace glukagonu, zpomalení vyprázdnění žaludku, snížení postprandiální hyperglykemie, redukci dávek inzulinu, udržení tělesné hmotnosti nebo jejím snížení a minimalizaci rizika hypoglykemie.“
Co mohou diabetikům 1. typu nabídnout inhibitory SGLT ‑ 2? „Kromě výhody perorálního podávání je to odstranění nadbytečné glukózy a kalorií v závislosti na vyšší koncentraci sérové glukózy, snížení inzulinové rezistence, krevního tlaku, tělesné hmotnosti i hodnoty lačné a postprandiální glykemie. To vše s velmi nízkým rizikem výskytu hypoglykemií. Co z toho by bylo možné s výhodou uplatnit i u diabetiků 1. typu? Určitě efekt omezení reabsorbce glukózy v tubulech, která je u DM1 v důsledku adaptace vyšší. Dále snížení postprandiální hyperglykemie, rizika hypoglykemie i dávky inzulinu a udržení tělesné hmotnosti nebo jejím snížení,“ je přesvědčen prof. Piber, který zároveň věří, že se ověření těchto hypotéz budou v dohledné budoucnosti věnovat i klinické studie.
Jan Kulhavý
šéfredaktor Zdravotnických novin
jan.kulhavy@ambitmedia.cz
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2014 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Statinová intolerance
- Co dělat při intoleranci statinů?
-
Všetky články tohto čísla
- Srdeční selhání a CHOPN – přehledový článek
- Diabetes mellitus a srdeční selhání
- Ledviny a srdeční selhání
- Léčba anémie a nedostatku železa z pohledu hematologa
- Léčba anémie a nedostatku železa u chronického srdečního selhání
- Léčba sideropenní anémie v gastroenterologii
- Léčba anémie z nedostatku železa z pohledu nefrologa
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Aerobní a specifický trénink nádechových svalů u pacientů s chronickým srdečním selháním – přehledový článek
- Profil nemocných s akutním srdečním selháním léčených v přednemocniční péči
- Ruptura aneuryzmatu nekoronárního Valsalvova sinu jako raritní příčina bolesti na hrudi – kazuistika
- Co nám přináší studie PARADIGM‑HF
- ESC 2014 Barcelona – kombinační léčba hypertenze
- Diagnostika a léčba osteoporózy
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Systémová sklerodermie
- Současné použití biologik v léčbě revmatoidní artritidy
- Nežádoucí účinky biologické léčby v revmatologii
- Stručný průvodce putováním od nové přes novější k nejnovější léčbě DM2
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba anémie a nedostatku železa z pohledu hematologa
- Antifosfolipidový syndrom – diagnostika, manifestace a léčba
- Nežádoucí účinky biologické léčby v revmatologii
- Systémová sklerodermie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



