-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Skórovací systémy u tromboembolické nemoci
Scoring systems for venous thromboembolic disease
Deep venous thrombosis and pulmonary embolism are severe clinical manifestations of venous thromboembolic disease affecting more than 1.5 million Europeans each year; one third of these patients die. The most disturbing fact is that 90% of these patients suffer from sudden embolism with no proven pre-existing source of pulmonary embolism. This is the main reason supporting the development of preventive, diagnostic and therapeutic methods for venous thromboembolic disease, including score systems and clinical algorithms for various groups of patients.
Keywords:
thromboembolic disease – deep venous thrombosis – pulmonary embolism – Padua prediction score – Caprini score – Wells Score – Wicki score – Geneva score – Kline algorithm – PESI – sPESI
Autori: J. Hlásenský 1; Z. Mihalová 1,2; J. Špinar 1,2; O. Ludka 1,2
Pôsobisko autorov: Interní kardiologická klinika LF MU a FN Brno 1; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 2
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(2): 126-130
Kategória: Kardiologická revue
Súhrn
Žilní trombóza společně s plicní embolií představují závažné klinické projevy tromboembolické nemoci, onemocnění, které přes veškerý dosažený pokrok stále zůstává významnou příčinou morbidity a mortality postižených pacientů, dle dat International Union of Angiology více než 1,5 milionu Evropanů ročně, z nichž jedna třetina představuje fatální případy. Závažnou okolností je skutečnost, že až u 90 % těchto případů jde o náhlé embolizační příhody bez předchozího průkazu existence zdroje plicní embolie, jimž by za optimálních podmínek, tedy uplatnění nejnovějších metod prevence, diagnostiky a léčby tromboembolické nemoci, šlo zabránit nebo alespoň výrazně snížit jejich počet. Tato skutečnost je důvodem pro vytváření různých doporučených postupů a konsenzů týkajících se žilního tromboembolizmu, zahrnujících tedy i skórovací systémy rizika tromboembolické nemoci.
Klíčová slova:
trombembolická nemoc – hluboká žilní trombóza – plicní embolie – Padovského skóre – Capriniho skóre – Rogersův skórovací sysém – Wellsovo skóre – Wickiho skóre – Geneva skóre – Klineho pravidlo – PESI – sPESISkórovací systémy při prevenci tromboembolické nemoci
Většina doporučení a skórovacích systémů tromboembolické nemoci v chirurgických a nechirurgických oborech vychází z kumulace klinických a laboratorních rizikových faktorů tromboembolické nemoci [1,2]. V chirurgických oborech je podle těchto [3] faktorů využíváno k určení stupně pooperačního rizika a intenzity profylaxe tromboembolické nemoci tzv. Capriniho skóre (tab. 1). To rozděluje pacienty s rizikem tromboembolické nemoci na skupiny podle rizika: velmi nízkého (< 0,5 % = 0 bodů), nízkého (cca 1,5 % = 1 – 2 body), středního (cca 3 % = 3 – 4 body) a vysokého (cca 6 % = nad 4 body). Capriniho skóre zahrnuje parametry jako věk, typ a trvání operace, obezita, anamnéza tromboembolické nemoci, trombofilní stavy, přítomnost centrálního žilního katetru, malignita a další faktory [4]. Obdobným, méně využívaným skórovacím systémem rizika tromboembolické nemoci u chirurgických nemocných je např. model Rogersův [5]. V prevenci tromboembolické nemoci u chirurgických pacientů je samozřejmě nutno přihlédnout i k riziku krvácení. To, hodnoceno z hlediska četnosti a závažnosti, do značné míry závisí na typu operace. Do skupiny pacientů s nejvyšším rizikem patři ti, kteří podstupují kardiochirurgii, kraniotomii, spinální chirurgii a operace pro traumatické poškození mozku a chirurgii páteře [6]. Rozhodnutí týkající se farmakologické tromboprofylaxe u chirurgických pacientů by mělo být provedeno po posouzení rizikových faktorů jak pro tromboembolickou nemoc, tak pro krvácení. Obecně platí, že u pacientů se středním a vysokým rizikem tromboembolické nemoci, s nanejvýš mírným rizikem krvácení, by měla být podávána farmakologická profylaxe. Pokud tito pacienti mají vysoké riziko krvácení, měli by dostávat mechanickou profylaxi, optimálně s intermitentní pneumatickou kompresí [7,8].
Tab. 1. Validovaný skórovací systém pooperačního rizika tromboembolické nemoci dle Capriniho [6]. ![Validovaný skórovací systém pooperačního rizika tromboembolické nemoci dle Capriniho [6].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/13638eb99e9fa1c6f4e59ac8ecc46945.png)
U interních pacientů je možné pro posouzení výše rizika a potřeby prevence použít Padovského skórovací systém (Padua prediction Score) (tab. 2). Tento zohledňuje všechny významné rizikové faktory tromboembolické nemoci, tedy jak ty vrozené, tak i ty aktuálně interním stavem podmíněné, tedy aktivní maligní onemocnění, pozitivní anamnézu tromboembolické nemoci, omezení mobility, známý trombofilní stav, nedávný úraz či operaci, věk nad 70 let, srdeční nebo respirační selhání, akutní infarkt myokardu či ischemickou cévní mozkovou příhodu, akutní infekce a/ nebo revmatologické onemocnění, obezitu a probíhající hormonální léčbu [9]. Vedle Padovského skóre, jehož spolehlivost byla ověřena v klinickém hodnocení, můžeme k rozhodnutí o způsobu vedení prevence tromboembolické nemoci u akutních interních nemocných s omezením hybnosti využít i modifikovaný algoritmus dle Cohena (tab. 3), jenž je v praxi využíván o něco méně často. Kromě již výše zmíněných faktorů zohledňuje i nefrotický syndrom, varixy a žilní insuficienci, nespecifické střevní záněty, dehydrataci a léčbu antipsychotiky [10]. Oba dva tyto skórovací systémy dělí pacienty na základě bodového hodnocení rizikových faktorů na skupiny s nízkým rizikem tromboembolické nemoci (< 3 body) a vysokým rizikem tromboembolické nemoci (≥ 3 body) [11,12]. Při nízkém riziku lze postupovat bez užití farmakoprofylaxe, tu lze zvážit případ od případu, jsou doporučovány metody nefarmakologické, tedy pravidelné cvičení dolních končetin, dostatečná hydratace, kompresivní antitrombotické punčochy s graduovaným tlakem nebo intermitentní pneumatické komprese [13,14]. Při vysokém riziku jsou doporučeny výše zmíněné způsoby nefarmakologické profylaxe s podáváním nízkomolekulárního heparinu 1× denně s.c. v profylaktické dávce (enoxaparin 4 000 IU, nadroparin 2 850 – 3 800 IU, dalteparin 5 000 IU, bemiparin 2 500 IU), nefrakcionovaný heparin 5 000 IU 2 – 3× denně nebo fondaparinux 2,5 mg s.c. 1× denně až do plné mobilizace [15]. Mezi kontraindikace antikoagulační terapie heparinem (nízkomolekulární nebo nefrakcionovaný) nebo fondaparinuxem patří heparinem indukovaná trombocytopenie (platí pro hepariny), hypersenzitivita na nízkomolekulární nebo nefrakcionovaný heparin či fondaparinux, krvácivý stav, aktivní vředová choroba nebo jiné organické poškození s rizikem krvácení, hemoragická cévní mozková příhoda, závažné jaterní onemocnění s koagulopatií (INR ≥ 1,5) a trombocytopenie (< 50 × 109 trombocytů/ l).
Tab. 2. Padovského skóre – predikce rizika tromboembolické nemoci u interních pacientů (riziko tromboembolické nemoci je vysoké při skóre ≥ 4). 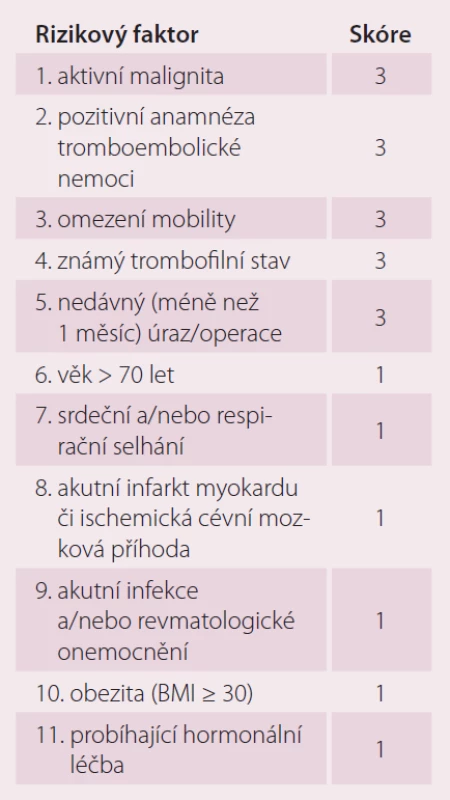
Tab. 3. Skóre rizikových faktorů tromboembolické nemoci u hospitalizovaných interních nemocných s omezenou hybností dle Cohena. 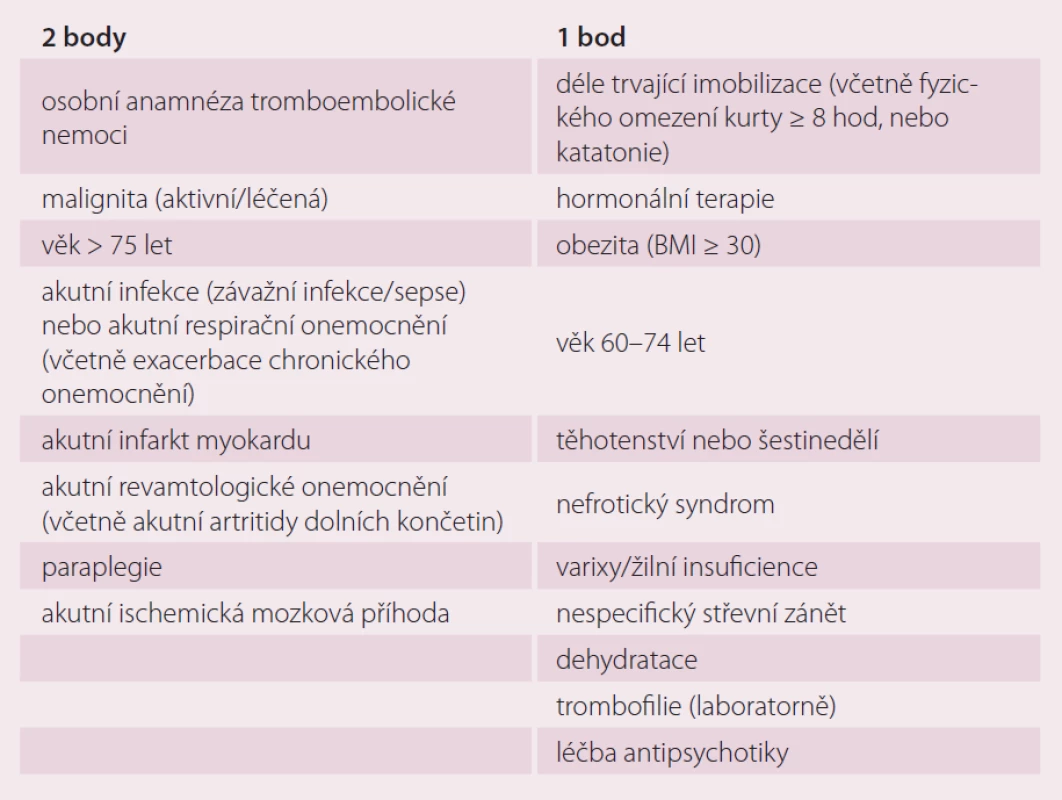
Skórovací systémy při diagnostice tromboembolické nemoci
Skórovacích systémů lze při diagnostice tromboembolické nemoci využít pouze k určení jisté míry pravděpodobnosti, neumožňují diagnostický závěr jen na základě samotného zjištění jejich zvýšených hodnot. V diagnostickém algoritmu hluboké žilní trombózy lze využít Wellsova klinická kritéria [16], jež využívají anamnestická data a klinické vyšetření (tab. 4). Prvním krokem v tomto algoritmu je odběr D‑dimerů, jenž při jeho negativitě rozdělí pacienty na skupinu, jež hlubokou žilní trombózu s vysokou pravděpodobností nemá, a při pozitivitě na skupinu, u níž nemůžeme hlubokou žilní trombózu vyloučit – můžeme pouze posoudit její pravděpodobnost na základě výše zmíněných kritérií – a je nutné doplnit duplexní sonografii, případně jiná zobrazovací vyšetření.
Tab. 4. Wellsova klinická kritéria pro diagnostiku hluboké žilní trombózy a jejich hodnocení. 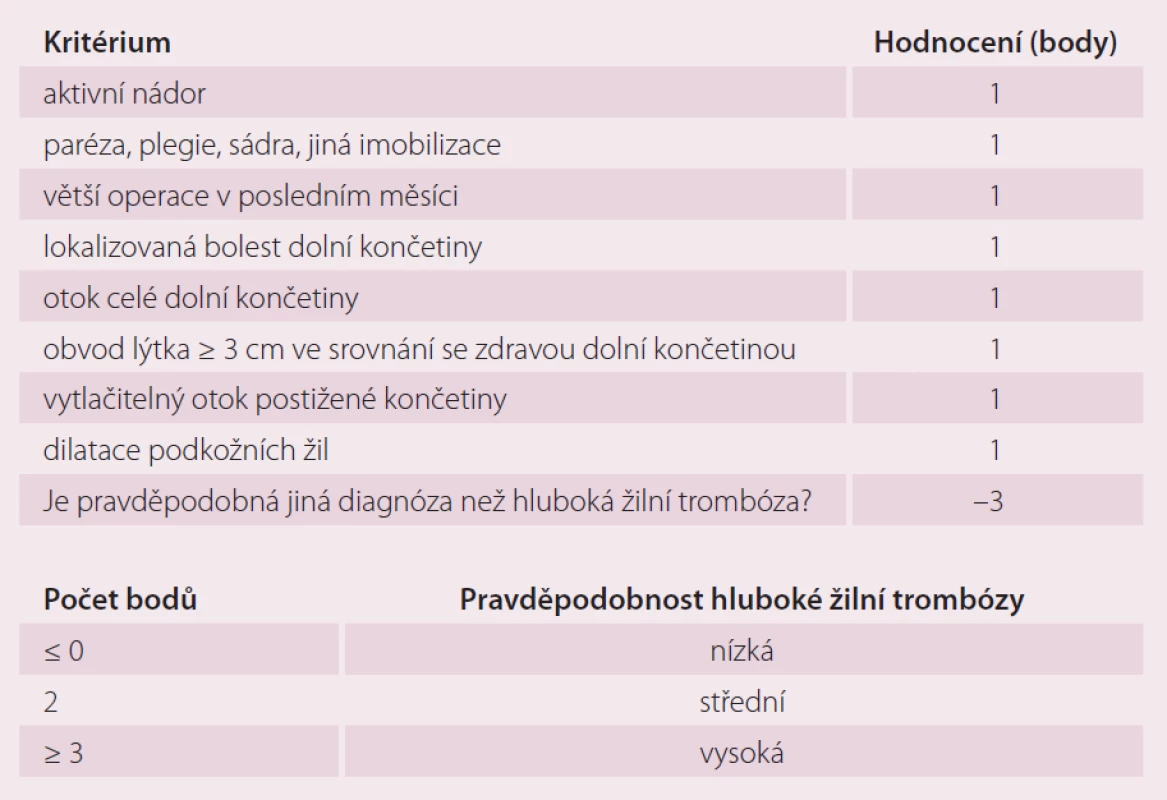
Pro určení pravděpodobnosti plicní embolie se nejčastěji využívá Wellsův skórovací systém, resp. jeho zjednodušená verze (tab. 5), jenž obdobně jako u predikce rizika hluboké žilní trombózy využívá k určení míry pravděpodobnosti anamnestická data a klinické vyšetření, méně často též Wickiho skórovací systém neboli Geneva skóre – i jeho zjednodušená verze (tab. 6), jenž vychází z praxe jednotek intenzivní péče a kromě anamnestických údajů a klinického vyšetření využívá též RTG snímek hrudníku a analýzu krevních plynů. Oba tyto skórovací systémy vykazují obdobnou predikční přesnost pravděpodobnosti plicní embolie. Samotný diagnostický postup je však třeba plánovat dle klinického stavu pacienta – jeho hemodynamické stability. Ta je dle Klineho pravidla dána při poměru tepové frekvence a systolického krevního tlaku < 1. U hemodynamicky stabilních pacientů s malou nebo střední klinickou pravděpodobností plicní embolie je vyšetřovací metodou první volby stanovení D‑dimerů. Negativní nález vylučuje plicní embolii, pozitivní nález je indikací ke spirálnímu CT plic. Pokud je CT vyšetření nedostupné, je diagnostickou metodou volby ventilačně‑perfuzní plicní scintigrafie. U hemodynamicky stabilních pacientů s podezřením na plicní embolii a ultrasonograficky potvrzenou hlubokou žilní trombózu lze bez dalšího vyšetřování zahájit antikoagulační léčbu. Žilní ultrazvuk a ECHO by měly předcházet ostatním zobrazovacím metodám při podezření na plicní embolii u těhotných žen a u pacientů s kontraindikací spirálního CT plic. U hemodynamicky nestabilních pacientů je diagnostickou metodou první volby spirální CT plic. Pokud není CT dostupné nebo pacient nemůže být transportován, je diagnostickou metodou volby ECHO u lůžka. Pro spolehlivé vyloučení plicní embolie je dostatečné spirální CT plic, které v této indikaci dnes nahrazuje ventilačně‑perfuzní plicní scintigrafii a plicní angiografii.
Tab. 5. Wellsův model pravděpodobnosti plicní embolie. 
Tab. 5 – 2. část. Zjednodušená verze Wellsova modelu dle ESC 2014 
Tab. 6. Klinická pravděpodobnost plicní embolie podle Wickiho skóre (Geneva score). 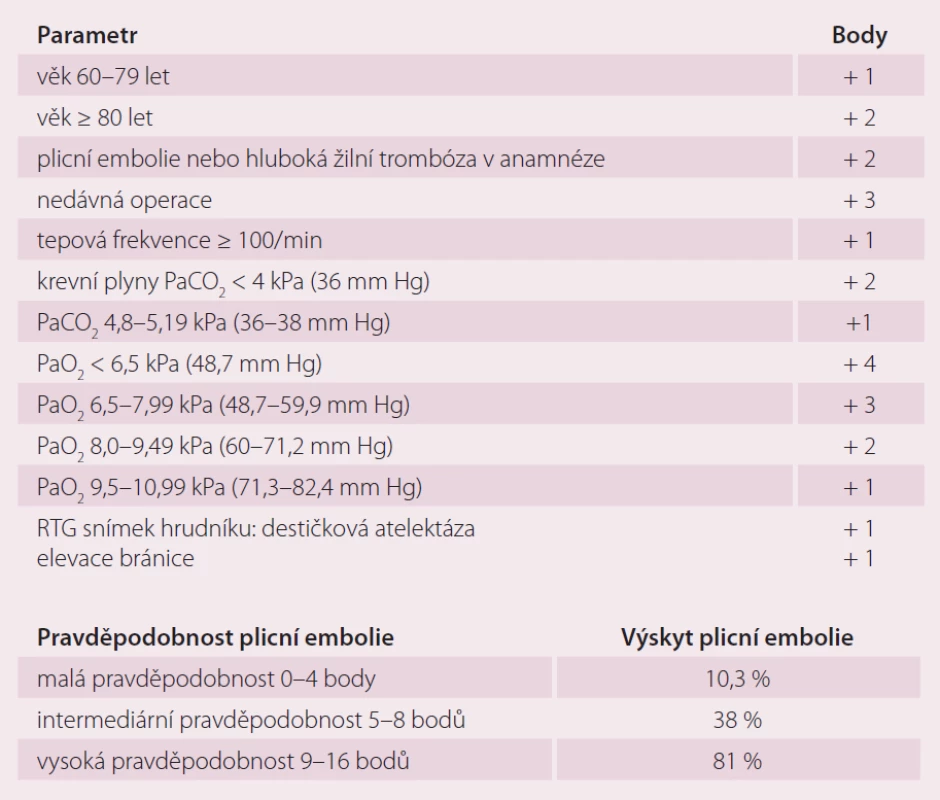
Tab. 6 – 2. část. Zjednodušená verze Geneva score dle ESC 2014 
Skórovací systémy pro určení rizika mortality u pacientů s plicní embolií
Pro určení rizika 30denní mortality u pacientů s plicní embolií se užívá tzv. Pulmonary Embolism Severity Index (PESI), resp. jeho zjednodušená forma simplified Pulmonary Embolism Severity Index (sPESI) (tab. 7), jež zahrnuje parametry, jako jsou věk a pohlaví nemocného, přidružená onemocnění, jako jsou onkologická malignita, srdeční selhání a chronická obstrukční plicní nemoc, a též klinické parametry jako tepová frekvence, krevní tlak, dechová frekvence, tělesná teplota, saturace krve kyslíkem a přítomnost poruchy vědomí [17].
Tab. 7. Pulmonary Embolism Severity Index (PESI) a jeho zjednodušená forma – simplified Pulmonary Embolism Severity Index (sPESI). 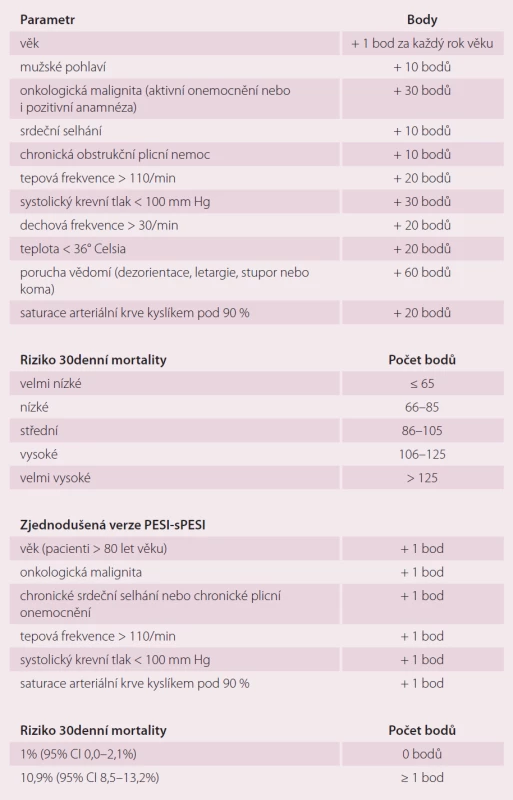
Nová klasifikace akutní plicní embolie dle ESC 2014 opírající se o riziko časné mortality dělí akutní plicní embolii do čtyř skupin rizika dle následujících rizikových parametrů:
Skupina s vysokým rizikem – pacienti v šoku nebo s hypotenzí, tato je definována jako systolický krevní tlak < 90 mmHg, nebo poklesem tohoto o ≥ 40 mmHg po dobu > 15 min, pokud není způsoben nově vzniklou arytmií, hypovolemií nebo sepsí. U těchto pacientů mohou být známky dysfunkce pravé komory cenné při neproveditelnosti spirální CT angiografie.
Skupina intermediárního‑ vysokého rizika; bez šoku nebo hypotenze, sPESI > 1, se známkami dysfunkce pravé komory a s pozitivními srdečními biomarkery.
Skupina intermediárního‑ nízkého rizika; bez šoku nebo hypotenze, klasifikována jako sPESI > 1 a k tomu s průkazem dysfunkce pravé komory nebo pozitivitou srdečních biomarkerů.
Skupina nízkého rizika – pacienti v této skupině jsou hemodynamicky stabilní a stanovení dysfunkce pravé komory a pozitivity srdečních biomarkerů není nutné.
U pacientů s vysokým rizikem plicní embolie se má co nejdříve zahájit intravenózní antikoagulační léčba použitím UFH a poté je indikována trombolytická léčba. Současné ESC guidelines doporučují u pacientů ve skupině intermediárního ‑ vysokého rizika zahájit antikoagulační léčbu a trombolytika podat jen pacientům, kteří se hemodynamicky destabilizují. Je však doporučeno pečlivé monitorování u pacientů s intermediárním ‑ vysokým rizikem, což dovolí časnou detekci hemodynamické dekompenzace a včasné zahájení záchranné reperfuzní léčby.
Závěr
Dosavadní domácí i mezinárodní zkušenosti a statistická data ukazuji, že přes veškerý dosažený pokrok stále zůstávají oblasti, kde nejsou doporučené postupy prevence tromboembolické nemoci uspokojivě uplatňovány. Jednou z těchto je mimo jiné i péče o pacienty s akutními interními onemocněními. Uplatnění metod účinné prevence tromboembolické nemoci, ale i metod její časné diagnostiky a léčby včetně užití skórovacích systémů, může vést k významné redukci výskytu žilního tromboembolizmu a jeho závažných dopadů v populaci.
Podpořeno Evropským regionálním fondem pro obnovu a rozvoj – Projekt FNUSA ‑ ICRC (No. CZ.1.05/ 1.1.00/ 02.0123) a projektem MZ ČR – RVO (FNBr, 65269705).
Doručeno do redakce: 7. 3. 2015
Přijato po recenzi: 15. 4. 2015
doc. MU Dr. Ondřej Ludka, Ph.D.
www.fnbrno.cz
oludka@fnbrno.cz
Zdroje
1. Widimský J, Malý J, Eliáš P et al. Doporučení diagnostiky, léčby a prevence plicní embolie, verze 2007. [online] Dostupné z: http:/ / www.kardio ‑ cz.cz/ resources/ upload/ data/ 128_22 - plicni_embolie2008.pdf.
2. Widimský J, Malý J et al. Akutní plicní embolie a žilní trombóza. 3. vyd. Praha: Triton 2011.
3. Hirmerová J, Karetová D, Malý R et al. Doporučený postup České angiologické společnosti ČLS JEP. Akutní žilní trombóza 2014: Současný stav prevence, diagnostiky a léčby. [online] Dostupné z: http:/ / www.angiology.cz/ Angiology/ media/ content/ Zilni_tromboza_doporuceni.pdf.
4. Wells PS, Hirsh J, Anderson DR et al. Accuracy of clinical assessment of deep ‑ vein thrombosis. Lancet 1995; 345 : 1326 – 1330.
5. Rogers MA, Levine DA, Blumberg N et al. Triggers of hospitalization for venous thromboembolism. Circulation 2012; 125 : 2092 – 2099. doi: 10.1161/ CIRCULATIONAHA.111.084467.
6. Caprini JA. Thrombosis risk assessment as a guide to quality patient care. Dis Mon 2005; 51 : 70 – 78.
7. Riedel M, Stanek V, Widimsky J et al. Long‑term follow‑up of patiens with pulmonary thromboembolism: late prognosis and evolution of hemodynamic and respirátory data. Chest 1982; 81 : 151 – 158.
8. Prevention and treatment of venous thromboembolism. International Consensus Statement. Int Angiol 2013; 3 : 111 – 260.
9. Malý J, Kessler P, Gumulec P et al. Trendy v profylaxi žilní tromboembolické nemoci. 2. vyd. Praha: Mladá fronta 2013.
10. Palareti G, Schellong S. Isolated distal deep vein thrombosis: chat we know and chat we are doing. J Thromb Haemost 2012; 10 : 11 – 19. doi: 10.1111/ j.1538 ‑ 7836.2011.04564.x.
11. O'Sullivan GJ, Semba CP, Bittner CA et al. Endovascular management of iliac vein compression (May ‑ Thurner) syndrome. J Vasc Interv Radiol 2000; 11 : 823 – 836.
12. Ocak G, Vossen CY, Verduijn M et al. Risk of venous thrombosis in patiens with major illnesses: results from the MEGA study. J Thromb Haemost 2013; 11 : 116 – 123. doi: 10.1111/ jth.12043.
13. National Institute for Health and Clinical Excellence. NICE Clinical Guideline 92. [online] Available from: https:/ / www.nice.org.uk/ guidance/ cg92.
14. Othieno R, Abu Affan M, Okpo E. Home versus in-patient treatment for deep vein thrombosis. Cochrane Database Syst Rev 2007; CD003076.
15. Nicolaides AN, Fareed J, Kakkar AK et al. Prevention and treatment of venous thromboembolism. International Consensus Statement. Int Angiol 2013; 32 : 111 – 260.
16. Eklof B, Perrin M, Delis KT et al. Updated terminology of chronic velus disorders: The VEIN-TERM transatlantik interdisciplinary konsensus document. J Vasc Surg 2009; 49 : 498 – 501. doi: 10.1016/ j.jvs.2008.09.014.
17. Casey ET, Murad MH, Zumaeta‑Garcia M et al. Treatment of acute iliofemoral deep vein thrombosis. J Vasc Surg 2012; 55 : 1463 – 1473. doi: 10.1016/ j.jvs.2011.12.082.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článek Náhlá srdeční smrtČlánek Akutní stavy v tyreologii
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2015 Číslo 2- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Skórovací systémy a predikce kardiovaskulárního rizika
- Náhlá srdeční smrt
- Skórovací systémy preventivní kardiologie
- Skórovací systémy u pacientů s akutním koronárním syndromem
- Skórovací systémy u fibrilace síní
- Skórovací systémy u tromboembolické nemoci
- Klinické klasifikace a skórovací systémy u srdečního selhání
- Role echokardiografie v hodnocení aortální stenózy a mitrální regurgitace
- Přímé versus nepřímé metody stanovení intenzity zatížení v kardiovaskulární rehabilitaci
- Skórovací systémy před kardiochirurgickou operací
- Nové léky pro akutní srdeční selhání
- Primární hyperaldosteronizmus – nejčastější forma sekundární hypertenze
- Cushingův syndrom a kardiovaskulární riziko
- Saturace jodem v České republice a ve světě – nedostatky a perspektivy
- Akutní stavy v tyreologii
- Diferenciální diagnostika hyponatremie
- Endokrinologie stárnutí – krátký přehled
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Klinické klasifikace a skórovací systémy u srdečního selhání
- Skórovací systémy u tromboembolické nemoci
- Diferenciální diagnostika hyponatremie
- Akutní stavy v tyreologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



